Method Article
마취 및 깨어 있는 행동하는 비인간 영장류 뇌에서 광유전학을 위한 AAV 벡터 주사
요약
현재 시행 된 바와 같이, 인간이 아닌 영장류의 광유전학은 바이러스 벡터를 뇌에 주입해야합니다. 최적의 주입 방법은 신뢰할 수 있어야 하며 많은 응용 분야에서 사후 조직학에서 쉽고 명확하게 식별되는 임의의 깊이의 개별 부위를 표적으로 삼을 수 있어야 합니다. 이러한 특성을 갖는 주입 방법이 제시된다.
초록
광유전학 기술은 신경과학 연구에 혁명을 일으켰으며 신경학적 유전자 치료에서도 동일한 작업을 수행할 준비가 되어 있습니다. 그러나 광유전학의 임상적 사용은 인간과의 신경학적 유사성 때문에 동물 모델, 이상적으로는 비인간 영장류(NHP)에서 안전성과 효능을 입증해야 합니다. 신경 과학 및 의학에 잠재적으로 유용한 후보 벡터의 수는 방대하며 이러한 벡터를 테스트하기위한 고 처리량 수단은 아직 존재하지 않습니다. 따라서, 사후 조직학을 통해 명확하게 확인할 수 있는 NHP 뇌에 바이러스 벡터를 공간적으로나 체적으로 정확하게 여러 번 주사하는 기술이 필요하다. 본원에 기재된 것은 이러한 방법이다. 주입 캐뉼러는 결합 된 폴리 테트라 플루오로 에틸렌과 스테인리스 스틸 튜브로 구성됩니다. 이 캐뉼러는 오토클레이브가 가능하고 일회용이며 최소 로딩량이 적기 때문에 값 비싸고 고농축 바이러스 벡터 용액을 주입하는 데 이상적입니다. 불활성의 적색 염색 미네랄 오일은 죽은 공간을 채우고 벡터 용액으로 눈에 보이는 반월판을 형성하여 주입 속도와 부피를 즉각적이고 정확하게 측정 할 수 있습니다. 오일은 캐뉼라의 뒤쪽에 적재되어 벡터와의 공동 주입 위험을 줄입니다. 캐뉼러는 10 분 안에로드 할 수 있으며 주사는 20 분 안에 할 수 있습니다. 이 절차는 깨어 있거나 마취 된 동물에게 주사하는 데 매우 적합합니다. 고품질 바이러스 벡터를 전달하는 데 사용되는 경우, 이 절차는 광유전 단백질의 강력한 발현을 생성하여 NHP에서 신경 활동 및 행동을 광학적으로 제어할 수 있습니다.
서문
비인간 영장류(NHP)의 광유전학은 일반적으로 바이러스 벡터를 뇌에 직접 주입하는 것을 포함합니다. 이 응용에 매우 적합한 벡터의 한 부류는 아데노-관련 바이러스(AAV)를 기반으로 한다. 이들 벡터는 단일 가닥 DNA 게놈을 둘러싸는 단백질 캡시드로 구성되며, 이 캡시드는 프로모터, 옵신 유전자 및 선택적으로 다른 단백질 코딩 및 유전자 조절 요소로 구성됩니다. 분자 클로닝의 발전은 새로운 벡터의 개발을 위해 이러한 구성 요소의 조작 및 조합을 촉진했습니다. 결과적으로, NHP 광유전학에 잠재적으로 유용한 AAV 벡터의 집합은 방대하고 빠르게 성장하고 있습니다.
현재, NHP 광유전학을 위한 AAV 벡터의 유용성은 생체 내 테스트가 필요합니다. 이 사실은 진보에 상당한 장벽입니다. 동물은 드물게 사용해야하며 단일 동물에서 여러 벡터를 테스트하려면 주사 부위가 신경 구조에 대해 신중하게 배치되고 바이러스 확산에 비해 잘 분리되어야합니다. 정확한 조직학적 평가를 위해서는 주사가 공간적으로나 체적으로 정확해야 합니다. 이전에 약리학 적 제제 1,2,3,4의 국소 전달에 사용 된 주사 기술은 이러한 주사를 만들기 위해 조정되고 단순화되었습니다. 이 주사 기술은 저렴하고 일회용, 살균 가능한 구성 요소를 사용하며 마취 또는 깨어있는 행동 원숭이에 사용할 수 있으며 모든 깊이의 다양한 뇌 영역을 표적으로 삼는 데 사용할 수 있습니다. 다음 프로토콜은 일회용 구성 요소를 제조하고 NHP 뇌에 주사하는 단계별 절차를 설명합니다. 이 기술의 장점과 단점에 대해 설명합니다.
프로토콜
모든 실험은 실험 동물의 관리 및 사용 가이드에 따라 수행되었으며 실험 동물 자원 연구소 및 국제 실험실 동물 관리 평가 및 인증 협회에서 권장하는 최소 요구 사항을 초과했습니다. 모든 절차는 워싱턴 대학의 동물 관리 및 사용위원회 (UW IACUC 프로토콜 # 4167-01)에 의해 평가되고 승인되었습니다. 5 마리의 건강한 원숭이 ( 마카카 물라타 2 마리, 마카카 네메 스트리나 3 마리, 수컷 4-11 세)가이 연구에 참여했습니다. 멸균 도구와 기술은 모든 수술 절차에 걸쳐 사용되었습니다.
1. 캐뉼러 만들기 (그림 1A)
- 각 부분의 준비
- 디스크 그라인더로 피하 주사 바늘 끝 (30G, 길이 13mm)을 무디게하십시오.
- 스테인리스 스틸 튜브(30G, 내경 = 0.16mm, 외경 = 0.31mm)를 대상 뇌 영역의 깊이에 맞는 길이로 자릅니다(25mm는 대뇌 피질의 등쪽 표면을 주입하는 데 적합함). 디스크 그라인더를 사용하여 절단 된 튜브의 한쪽 끝을 경사지고 다른 쪽 끝을 부드럽게합니다. 브로치로 튜브 내부를 디버링합니다.
- 폴리테트라플루오로에틸렌(PFTE) 튜브(내경 = 0.23mm ± 0.02mm, 벽 = 0.23mm ± 0.02mm, 1mm는 42nL± 7nL의 유체에 해당)를 로드할 벡터 용액의 양에 적합한 길이로 자릅니다(1μL의 벡터 용액은 24mm의 튜브를 차지함). 무딘 피하 주사 바늘을 삽입하여 PTFE 튜브의 양쪽 끝을 플레어합니다.
- 무딘 피하 주사 바늘을 PTFE 튜브의 한쪽 끝에 약 5mm 삽입합니다. 스테인리스 스틸 튜브의 비스듬한 끝을 다른 쪽 끝에 약 5mm 정도 삽입합니다(그림 1A).
- 사전 주입 테스트를 수행하십시오. 캐뉼라의 피하 주사 바늘 허브를 통해 여과 된 물을 주입하십시오. 팁에서 물이 비스듬한 스테인리스 스틸 튜브를 빠져나가고 양쪽 접합부에서 물이 새지 않는지 확인합니다.
2. 마취된 동물의 주사 절차
- 수술 준비
- 재료 표의 절차를 사용하여 수술 도구 및 용품을 소독하십시오.
- 필요한 경우 심부 뇌 구조를 표적으로 삼기 위해 머리 MRI를 찍습니다 (그림 2A).
- 수술 직전에 케타민 (10-15 mg / kg)으로 동물을 진정시키고 항생제 (세파 졸린)와 진통제 (서방성 부 프레 노르 핀 및 멜 록시 캄)를 근육 내 투여하십시오. 그런 다음 복재 또는 두부 정맥의 정맥 (IV) 카테터를 통해 propofol을 전달합니다.
- 동물을 삽관하고 이소 플루 란 가스로 전환하십시오. 안정적인 심박수, 혈압, 호흡수, 이완된 골격근, 눈꺼풀 또는 금단 반사의 부재로 적절한 마취를 확인하십시오.
- 동물의 머리를 면도하십시오. 건조를 방지하기 위해 각막에 인공 눈물 연고를 바르십시오.
- 주사 부위 준비
- 동물의 머리를 입체 프레임에 넣으십시오. 거즈 스폰지로 면도한 피부에 수술용 스크럽 용액을 바르고 부드러운 압력을 가하여 파편을 제거하고 이소프로필 알코올로 헹굽니다. 이 과정을 세 번 반복하십시오. 멸균 된 창공 커튼으로 동물을 덮으십시오. 피부를 절개하고 근육을 반사하십시오. 매니퓰레이터를 정위 팔에 놓고 목표 뇌 영역을 겨냥하도록 배치하고 멸균 된 펜으로 두개골의 개두술 위치를 표시합니다.
- 정위 조작기를 제거하고 개두술을 시행하십시오. 원하는 경우 경막을 절개합니다 (예 : 유황 랜드 마크를 시각화하기 위해). 매니퓰레이터를 스테레오택시 암으로 되돌립니다.
- 벡터 솔루션 로딩(그림 1C)
- 기포를 피하면서 P20 피펫터를 사용하여 벡터 용액을 멸균된 PCR 튜브로 부드럽게 옮깁니다.
- 경 사진 끝이 아래를 향하도록 캐뉼라를 수직 방향의 입체 고정 홀더에 부착하십시오. 1mL Luer-lock 주사기를 캐뉼라의 피하 주사 바늘 허브에 연결합니다.
- 캐뉼러의 경 사진 끝을 벡터 솔루션에 담그십시오.
알림: 주사기는 이미 부착되어 있어야합니다. 이 시점에서 부착하면 벡터 솔루션에 거품이 생깁니다. - 1ml 주사기로 부드러운 음압을 가하여 용액을 캐뉼라에 넣습니다. 용액과 공기 사이의 반월 상 연골을 시각적으로 추적하십시오.
- 벡터 용액이 로드되면 용액이 바늘 허브에 도달할 때까지 부드러운 음압을 계속합니다. 1mL 주사기를 제거하고 컬러 미네랄 오일을 피하 주사 바늘 허브에 주입합니다.
알림: 오일은 바늘 허브의 내벽을 따라 천천히 주입하여 벡터 용액으로 명확한 반월판을 형성하고 기포를 방지해야 합니다. - 피하 주사 바늘 허브를 3방향 Luer-lock 스톱콕의 두 개의 열린 포트 중 하나에 연결합니다.
알림: 피하 주사 바늘을 닫힌 포트에 부착하면 오일 뒤에 원치 않는 기압이 발생합니다. - 피하 주사 바늘 허브에 연결된 포트를 닫고 1mL 주사기에 공기를 채운 다음 다른 두 포트 중 하나에 부착합니다. 마지막으로 스톱 콕의 나머지 포트를 닫아 주사기를 캐뉼라에 연결합니다.
- 캐뉼라에 공기를 천천히 밀어 넣습니다. PTFE 튜브의 무딘 바늘 끝에 유색 오일이 나타나면 용액과 유색 오일 사이에 공기가 있는지 확인하십시오.
- 공기가 있으면 주사기에 음압을 가하여 유색 오일을 바늘 허브로 되돌립니다. 기포를 제거하고 경 사진 캐뉼라 팁에 벡터 용액 한 방울이 보일 때까지 양압을가하십시오.
- 1mL 주사기를 제거하여 오일 뒤의 원치 않는 공기 압력을 해제하고 스톱콕을 닫아 벡터가 중력에 의해 캐뉼라를 빠져나가는 것을 방지합니다.
- 플라스틱 자를 PTFE 튜브에 테이프로 붙여 주입 중 반월판의 움직임을 측정합니다(그림 1B, D, F).
- 표적 뇌 영역에 캐뉼러 삽입 (그림 1B)
- 캐뉼러를 정위 조작기에 부착하십시오.
- 펌프 튜브(Luer-lock 커넥터에서 종료됨)를 비멸균 보조자에서 외과의에게 수동으로 옮깁니다. 외과의 사는 멸균 슬리브의 벽을 통해 Luer-lock 커넥터를 잡고 두 번째 멸균 스톱 콕을 커넥터에 부착하고 슬리브를 단단히 테이프로 감은 다음 슬리브의 칼라를 떨어 뜨려 중력에 의해 튜브를 따라 연장되도록해야합니다.
- 캐뉼라 튜브에 부착 된 스톱 콕을 공기 펌프에 부착 된 스톱 콕에 연결하십시오. 공기 펌프를 저압으로 설정하고 전원을 켠 다음 오일이 캐뉼러를 통해 진행되고 캐뉼라 팁에 벡터 용액 한 방울이 보일 때까지 압력을 높입니다.
- PTFE 튜브의 플라스틱 눈금자 위치를 조정하여 주입 중 반월판의 움직임을 측정합니다.
- 정위 조작기로 캐뉼러를 아래로 내리고 팁이 표면에 도달하는 깊이(경막 또는 경막)를 기록합니다.
- 캐뉼러를 트랙을 따라 주입 할 가장 깊은 부위로 운전하십시오. 표면이 딤플됩니다. 표면 피질을 주입하는 경우 캐뉼러가 표면을 관통했는지 육안으로 확인하고 가능한 경우 수술 현미경이나 확대경을 사용하십시오.
- 조직 압박으로 인한 잘못된 표적화를 최소화하려면 캐뉼러를 천천히(1mm/분), 빠르게(0.5mm/s) 바닥에서 1-5분 기다리거나 가장 깊은 주사 부위를 500μm 초과한 다음 수축합니다.
- 주사
- 0.5 μL의 벡터 용액을 전기 공기 펌프로 10-30 초에 걸쳐 주입합니다. 착색된 오일과 PTFE 튜브의 벡터 용액 사이의 메니스커스를 추적하여 주입 흐름을 확인합니다.
- 1분 동안 기다렸다가 캐뉼러를 트랙을 따라 다음 주사 부위로 집어넣습니다.
- 최종 주입 후 벡터 유출을 피하기 위해 캐뉼러를 10분 동안 그대로 두십시오.
- 캐뉼러를 집어 넣고 생물학적 위험 용기에 버리십시오.
- 선택적으로, 사후 주입 부위의 식별을 용이하게 하기 위해 벡터 주입 부위 근처에 소량(≤1μL)의 형광 마이크로비드를 주입합니다.
- 다른 위치에 있는 다른 벡터 용액에 대해 원하는 대로 이 절차를 반복합니다(그림 2B).
- 수술 종결
- 경막, 근육 및 피부를 봉합하십시오.
- 스테레오택시 프레임에서 원숭이를 제거하고 모든 모니터 케이블을 제거합니다.
- 원숭이를 이소 플루 란 마취에서 제거하고 삼키는 반사가 돌아온 후 발관하십시오.
- 수술 후 치료 (멜 록시 캄 3-5 일 및 세팔 렉신 7-10 일)를 제공하십시오. 동물이 안정적으로 똑바로 앉은 자세를 유지할 수있을 때까지 적어도 10 분마다 한 번씩 동물을 모니터링하십시오.
3. 깨어 있는 행동을 하는 동물을 위한 수술 및 AAV 벡터 주입(그림 1D)
참고 :이 기술의 변형은 아래에 설명 된대로 깨어 있고 행동하는 원숭이의 뇌에 주사하는 데 사용할 수 있습니다.
- 녹음과 동시 주입
- 주입 부위에서 전기적 활동을 기록하려면 캐뉼라 외부를 에폭시(바닥 ~15mm)와 폴리이미드 튜브(남은 길이)로 코팅합니다. 에폭시를 긁어 팁의 금속을 드러냅니다(Injectrode, 그림 1F)2. 또는 캐뉼러와 별도의 세포외 전극을 이중 배럴 가이드 튜브에 나란히 삽입합니다(이중 배럴 가이드 튜브, 그림 1E).
- 표적 뇌 영역에 캐뉼라 삽입.
- 원숭이를 실험 부스에 놓고 머리의 움직임을 제한하고 표준 기술을 사용하여 두개골 장착 기록 챔버를 청소하십시오.
- 가이드 튜브를 마이크로 드라이브에 고정합니다. 주사 캐뉼러를 가이드 튜브에 삽입합니다.
- 팁이 가이드 튜브에서 튀어 나올 때까지 캐뉼러를 전진시킵니다.
- 스톱 콕을 전기 공기 펌프에 연결하십시오. 적절한 시스템 기능을 확인하려면 공기 펌프를 사용하여 팁에서 벡터 용액 한 방울을 밀어내고 오일 벡터 용액 메니스커스의 움직임을 확인합니다.
- 캐뉼러를 가이드 튜브로 ~5mm 빼내어 튜브를 뇌에 삽입하는 동안 손상되지 않도록 보호합니다. 가이드 튜브를 뇌에 삽입하십시오.
- 마이크로 드라이브를 사용하여 주입 할 부위로 캐뉼러를 구동하십시오. 전기 기록(그림 2C) 또는 자극으로 표적 부위를 식별합니다.
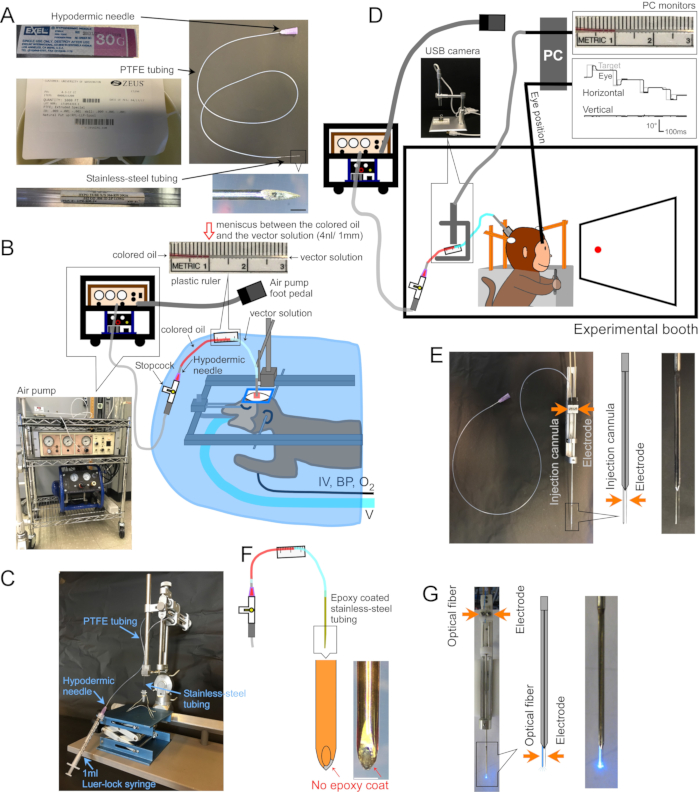
그림 1: 수술 및 기구 설정 . (A) 주사 캐뉼라. 캐뉼러의 각 부분이 표시됩니다. 오른쪽 하단에 삽입 : 캐뉼라 팁의 확대 사진, 스케일 바 : 500 μm. (B) 마취 된 원숭이를위한 수술 설정. 원숭이는 외과 용 드레이프 아래의 정위 프레임에 배치됩니다. 인공 호흡기 (V), 정맥 주사 라인 (IV), 혈압 모니터 (BP) 및 산소 포화도 모니터 (O2)가 원숭이에 연결됩니다. 주입 캐뉼러는 정위 미세 조작기를 사용하여 표적 영역에 삽입됩니다. 벡터 용액은 공기 압축기 (왼쪽 하단 삽입, 파란색)에 연결된 전기 공기 펌프 (왼쪽 하단 삽입, 갈색)에 의해 주입됩니다. 플라스틱 눈금자(상단 삽입물)를 PTFE 튜브에 테이프로 붙여 주입 중 유색 오일(상단 삽입, 빨간색)과 벡터 용액(상단 삽입, 투명) 사이의 메니스커스 움직임을 측정합니다. (C) 벡터 용액을 캐뉼라에로드하도록 설정합니다. (D) 실험 부스에서 벡터 용액을 주입하는 동안 원숭이. 동물의 머리는 3 개의 안정화 포스트에 의해 제자리에 고정되고 눈 위치는 공막 검색 코일 시스템에 의해 기록됩니다. 주입 캐뉼러는 마이크로 전극 홀더/드라이버를 사용하여 목표 깊이까지 유지되고 구동됩니다. 주입은 USB 카메라 (삽입 사진)를 통해 착색 된 오일과 벡터 용액 사이의 메 니스 커스를 모니터링함으로써 제어됩니다. (E) 이중 배럴 가이드 튜브 주입. 이중 배럴 가이드 튜브 홀더/드라이버는 주입 캐뉼러와 마이크로 전극을 고정합니다(삽입 참조). (F) 인젝트로드. 에폭시 코트를 긁어 노출된 캐뉼라 끝의 금속은 뉴런에 전기적으로 접근할 수 있도록 합니다(삽입, 스케일 바: 500μm). (G) 레이저 자극 설정. 이중 배럴 가이드 튜브 홀더/드라이버는 광섬유와 마이크로 전극을 모두 고정합니다(삽입 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
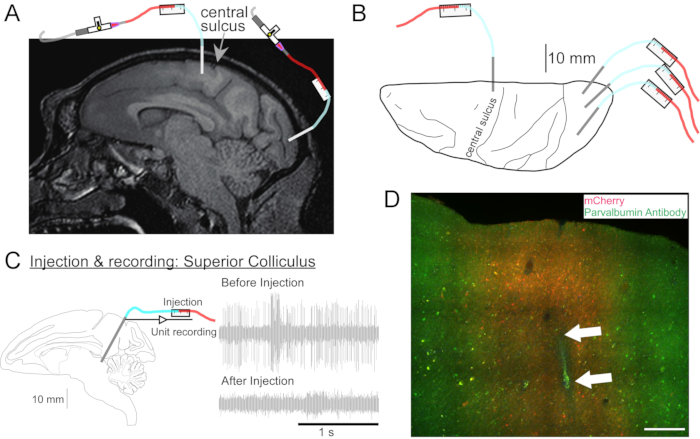
그림 2: AAV 주사 부위의 다이어그램. (A) 마카카 네메스트리나의 일차 운동 피질과 일차 시각 피질의 주사 부위를 보여주는 뇌 MR 이미지의 시상 부분. (B) 해당 아틀라스 플레이트의 등쪽 표면에서 중앙 고랑 (일차 운동 피질) 및 일차 시각 피질에 대한 캐뉼러 배치를 보여줍니다. (C) 상급 콜리큘러스에 주입하여 단위 기록. 주입 전에 격리된 장치(오른쪽 위)가 주입 후(오른쪽 아래) 사라졌습니다. (D) 사출 트랙 (흰색 화살표). 스케일 바: 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 조직학을 위한 뇌 조직 처리
- 주입 후 6-8 주를 기다려 전이 유전자 발현을 최대화하십시오.
참고: 최적의 지속 기간은 실험에 사용된 정확한 바이러스 벡터에 따라 다릅니다. - 형질 도입 효율과 선택성을 평가하기 위해 기존의 조직학적 기술을 사용하여 뇌를 처리합니다 5,6,7.
결과
여기에 기술된 외과적 주사 방법을 사용하여 NHP 뇌로의 생체 내 입체택시 주입에 의한 전이유전자 발현을 입증하기 위해, 별개의 뉴런 유형 8,9에서 수퍼 노란색 형광 단백질-2(SYFP2)의 발현을 유도하는 인핸서를 함유하는 2개의 벡터를 선택하였다. 바이러스 벡터를 PHP.eB 캡시드10에 패키징하고, 요오드 원심분리에 의해 정제한 다음, qPCR에 의해 측정된 바와 같이 높은 역가(>1E13 바이러스 게놈/mL)로 농축시켰다. 0.5 μL의 부피가 피질을 통해 10 개의 트랙을 따라 10 개의 깊이에 각각 주입되어 총 주입 부피가 5 μL / 트랙입니다. 그림 3A-C는 PVALB 서브클래스 특이적 AAV 벡터 CN2045를 성인 남성 마카카 네메스트리나의 일차 시각 피질에 주사한 지 113일 후 항-GFP 면역염색을 통한 SYFP2 발현을 보여줍니다. SYFP2 전이유전자는 피질 깊이에 걸쳐 흩어져 있는 수많은 비피라미드 뉴런에서 강력하게 검출되며, 대부분의 SYFP2 발현 뉴런은 PVALB7에 대해서도 면역반응성이었다. 도 3D는 L5 뉴런 서브클래스 특이적 AAV 벡터 CN2251의 주사 후 64일 후에 일차 운동 피질에서의 천연 SYFP2 발현을 보여준다. SYFP2 표지 뉴런은 모두 층 5로 제한된 체세포와 특징적인 두꺼운 정점 수상 돌기를 가진 명확한 피라미드 형태를 가지고 있습니다. 이러한 데이터는 AAV 벡터를 표적으로 하는 세포형 정위 주사에 의해 NHP 뇌의 신피질 뉴런의 일부 집단에서 전이유전자 발현의 정확한 제어를 명확하게 보여줍니다.
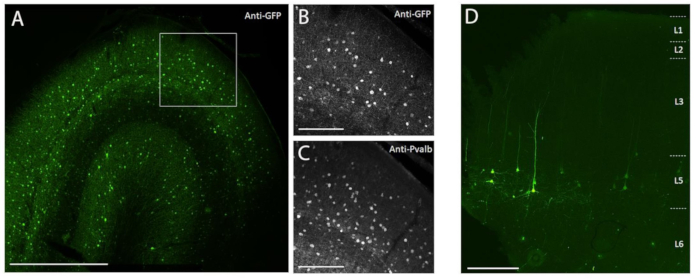
그림 3: NHP 뇌에 주입된 AAV 벡터에 의해 매개되는 세포 유형 특이적 SYFP2 발현의 예. (A) PVALB 서브클래스 특이적 AAV 벡터의 주입 후 113일 후에 원숭이 일차 시각 피질로부터의 고정된 절편의 에피형광 현미경 사진. 스케일 바: 1 mm. (ᄃ,씨) A에 표시된 박스형 영역의 고배율 이미지. (B) 안티 GFP 신호. (C) 안티 PVALB 신호. 스케일 바: 250 μm. (D) 층 5 종뇌 외 하위 클래스 특이적 AAV 벡터의 주입 후 64일 후에 원숭이 일차 운동 피질의 고정 섹션에서 네이티브 SYFP2 형광의 에피형광 현미경 사진. 스케일 바: 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
신경 생리 학적 및 행동 적 광유전 학적 조작에 대한이 주입 기술의 유용성을 입증하기 위해 각각 다른 원숭이 (Macaca mulatta)에 대해 세 가지 실험이 수행되었습니다. 첫 번째 실험(그림 4A-D)에서, 채널로돕신-2 전이유전자(AAV1-hSyn1-ChR2-mCherry)를 운반하는 AAV 벡터를 좌측 상콜리큘러스(SC)에 주입하였다. 벡터는 총 12 μL에 대해 19 깊이에서 250 μm마다 주입되었다. 두 번째 실험(그림 4E-G)에서, 3μL의 AAV1-hSyn-ArchT-EYFP 용액을 NRTP(nrtp)의 망상핵에 주입하였다. 세 번째 실험(그림 4H-K)에서는 24μL의 AAV9-L7-ChR2-mCherry 용액을 소뇌 피질(6)에 주입했습니다. 각 주사 후 6-8 주 후에 광섬유와 텅스텐 전극을 이중 배럴 가이드 튜브를 통해 뇌에 삽입했습니다 (그림 1G).
도 4B는 청색광(450 nm)에 대한 SC 뉴런의 반응을 나타낸다. 40mW에서 연속 조명(1.2초)은 일련의 연속 활동 전위를 생성했습니다(그림 4B, 상단). 1ms 지속 시간의 광 펄스는 40mW에서 활동 전위를 불러일으키지 못했지만(그림 4B, 중간) 2.7± 0.6ms의 대기 시간으로 테스트된 유일한 다른 전력 수준인 160mW에서 안정적으로 활동 전위를 불러일으켰습니다(그림 4B, 하단). 펄스 트레인(160mW, 주파수: 300Hz, 듀티 사이클: 15%, 지속 시간: 300ms)은 평균 대기 시간 97± 32ms, 평균 진폭 10.4°, 평균 각도 47°(위쪽 및 오른쪽; 그림 4C).
SC11,12의 임계 이하 전기 자극을 사용하여 단속 이득을 수정 한 연구와 일치하여, 15 °, 18 ° 및 20 ° 왼쪽 및 아래쪽 (225 °) 단속 후 SC의 광학 자극은 점차 단속 이득을 감소 시켰습니다 (그림 4D). 이러한 이득 감소는 적응 전 이득(검은색 원)으로 돌아가기 위해 ~250번의 시도(녹색 원)가 필요했으며, 이는 장기 가소성의 기초를 확인했습니다.
두 번째 실험 (그림 4E)에서, NRTP에서 소뇌 피질 (소엽 VIc 및 VII)의 안구 운동 vermis (OMV)로의 이끼 낀 섬유 투영이 광학적으로 억제되었다. 도 4F는 OMV(삽입물)에서 형광 표지된 이끼 섬유 및 로제트를 나타낸다. 황색 레이저 광 (589 nm)은 광섬유를 통해 OMV에 전달되었고, 근처의 텅스텐 전극은 Purkinje 세포 활동을 기록하기 위해 사용되었다. 그림 4G는 NRTP 투영의 광유전학적 불활성화 전(회색)과 후(주황색)의 간단한 스파이크 활동을 보여줍니다(그림 4G, 상단). 비활성화되기 전에 Purkinje 셀은 12° 우측 단속 단속 현상에 대해 이중 버스트 패턴을 나타냈습니다(그림 4G, 중간, 회색). 비활성화하는 동안 발사 속도가 감소하고 버스트 일시 중지 패턴으로 변경되었습니다(그림 4G, 중간, 주황색). 이 두 반응 패턴을 비교하면 Purkinje 세포에 입력된 이끼 낀 섬유가 두 번째 버스트를 구동하여 단속 감속 단계에 영향을 미친다는 것을 알 수 있습니다(그림 4G, 중간, 녹색). 우측 단속 단속의 가변성은 광유전학적 불활성화 동안 감소되었으며, 이는 단속 지표의 시험 간 가변성 중 일부가 이끼 낀 섬유에 의해 전달되는 신호의 가변성 때문이라는 생각과 일치합니다(그림 4G, 하단, 주황색).
세 번째 실험(도 4H)에서, OMV의 푸르킨제 세포는 광유전학적으로 자극되었다(도 4I). 짧은 광 펄스 (1.5-ms 펄스, 65 mW, 50 Hz)의 트레인은 분리 된 Purkinje 세포의 단순 스파이크 활동을 증가 시켰습니다 (그림 4J, 상단). 개별 1.5ms 광 펄스는 자주 >1 단순 스파이크를 유발했습니다(그림 4J, 하단). 단속 단속 (10-ms 광 펄스, 60mW) 동안 발생하도록 시간이 지정된 광유전 학적 단순 스파이크 활성화는 단속 진폭 증가 (그림 4K)를 통해 안구 운동 파열 발생기에서 Purkinje 세포의 억제 역할을 확인합니다.
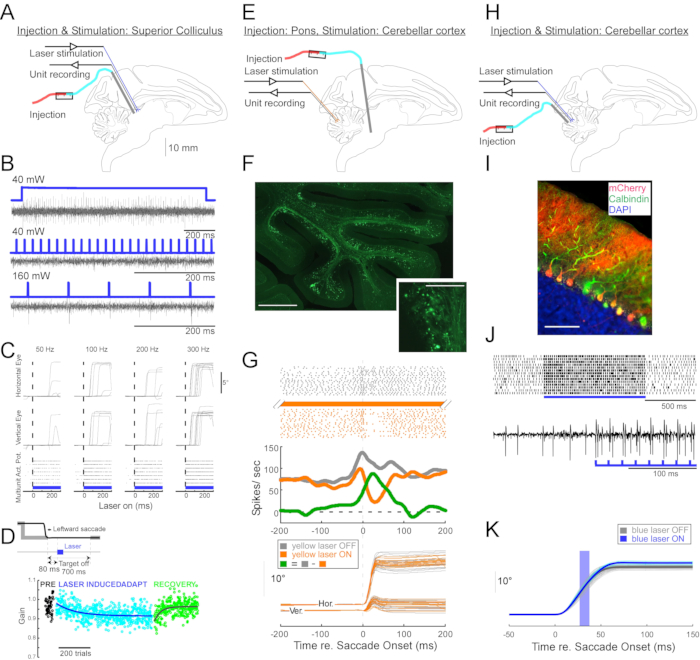
그림 4: 깨어 있는 원숭이에서 수행된 세 가지 광유전학 실험 요약. (A-D) 실험 1, 범뉴런 여기: 바이러스 주입, 레이저 자극 및 단위 기록은 우수한 콜리큘러스(A)에서 수행하였다. (B) 레이저 자극에 의해 유발되는 대표적인 단위 활동. (C), 안구 운동의 수평 (상단) 및 수직 (중간) 구성 요소 및 레이저 자극에 의해 유발되는 단위 활동의 래스터 플롯 (하단). (D) 레이저 자극에 의해 유도 된 단속 적응의 대표 세션. 자극(100개의 0.5-ms 레이저 펄스)은 각 단속(inset) 후에 80-ms로 전달되었다. 단속 이득(단속 진폭 / 목표 진폭)은 시행 전반에 걸쳐 점진적으로 감소했습니다. (예) 실험 2, 경로별 억제: 바이러스 벡터를 망상 핵 테그멘티폰티스에 주입하고, 레이저 자극 및 단위 기록을 안구 운동 만점(E)에 실시하였다. (F) 표지 된 이끼 섬유 (스케일 바 : 1mm)와 로제트 (삽입, 스케일 바 : 100μm)를 보여주는 안구 운동 vermis의 조직 학적 섹션. (G) Purkinje 세포 활동 (상단 : 래스터, 중간 : 평균 발사 속도) 및 레이저 자극 유무에 관계없이 시각 유도 단속 (하단)의 궤적. 회색: 시험에서 레이저 꺼짐, 주황색: 시험에 레이저, 녹색: 회색과 주황색의 차이. (H-K) 실험 3에서는 세포 유형별 활성화: 바이러스 주입, 레이저 자극 및 단위 기록을 안구 운동 버미스(H)에서 진행하였다. (i) 표지된 푸르킨제 세포를 보여주는 안구 운동 베르미스의 조직학적 절편. 스케일 바: 100 μm. (J) 레이저 자극에 의해 유발되는 Purkinje 세포의 단순 스파이크 활동. 위: 14번의 시도에서 나온 래스터 플롯. 하단: 단일 대표 시험의 전압 추적. (K) 레이저 자극이 있거나없는 시각 유도 단속의 궤적. 단속 중 10ms 광 펄스는 단속 진폭을 증가 시켰습니다. 레이저 시험에서 개별 단속 궤적(청록색)과 평균(파란색). 레이저 오프 시험에서 개별 단속 궤적 (밝은 회색)과 평균 (어두운 회색). 광 파장은 실험 1 및 3에서 450nm이었고 실험 2에서 589nm였습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
NHP 광유전학의 발전으로 정확하고 신뢰할 수 있는 두개내 주사 방법이 필요하게 되었습니다. 이 보고서에 설명 된 방법의 장점은 저렴하고 살균 가능하고 일회용 구성 요소를 사용하며 모든 깊이의 다양한 뇌 영역을 표적으로 삼을 수 있다는 것입니다. 또한 공기 밸브를 제어할 수 있는 속도로 분사 속도와 부피를 제어할 수 있습니다. 공기 압력을 일시적으로 증가시켜 막힘을 제거한 다음 지속적인 압력으로 인해 생성되는 후속 과다 주입을 방지하기 위해 빠르게 줄일 수 있습니다. 일회용 구성 요소는 주사 부위 간의 교차 오염 위험을 줄입니다.
이 주입 프로토콜의 중요한 단계에는 고품질 캐뉼라를 구성하고, 기포를 도입하지 않고 로드하고, 서로 너무 가깝지 않은 주입 부위를 선택하는 것이 포함됩니다. ≥1cm 간격으로 주사하는 것은 일반적으로 겹치지 않는 영역을 형질도입하지만 이 휴리스틱은 바이러스 혈청형, 역가, 프로모터, 부피, 표적 및 검출 방법에 따라 달라집니다. 직접 연결되지 않은 주사 부위를 선택하면 축삭을 따라 옵신 트래피킹으로 인해 발생할 수 있는 잠재적인 혼란과 역행 형질도입에 대한 일부 AAV 혈청형의 성향을 피할 수 있습니다.
이 방법은 마취 및 정위 프레임(그림 3) 또는 경고 및 헤드 고정(그림 4)에서 NHP를 주입하는 데 사용할 수 있습니다. 전자는 주사가 정위 좌표를 표적으로 할 수 있다는 장점이 있으며 급성 durotomy를 통해 캐뉼라 침투를 시각적으로 확인할 수 있습니다 (만성 개두술을 통해 깨어있는 원숭이의 경막을 절개하면 감염 위험이 높아집니다). 후자의 접근법은 생존 수술 횟수와 동물에 대한 스트레스를 줄이고, 행동 중 전기 생리 학적 기록과 호환되며, 주입 후 실험을 위해 광섬유를 삽입하는 데 사용되는 것과 동일한 좌표 프레임 및 계측기를 사용하는 장점이 있습니다. 깨어있는 원숭이의 주사 기술은 인공 경막13,14,15를 통해 주사함으로써 더욱 향상 될 수 있습니다. 이것은 주사 부위의 직접 시각화와 성공적인 형질 도입을 나타내는 조직 형광의 추가적인 이점을 부여합니다.
몇몇의 다른 AAV 주입 기술이 NHP에 사용되었다. 최근에, AAV 벡터를 큰 NHP 피질 영역(16)에 균일하게 전달하기 위해 다중-채널 주입 장치가 개발되었다. 유사한 결과가 대류-강화 전달17,18을 사용하여 얻어질 수 있다. 이러한 방법은 형질 도입 확산을 최대화하는 것을 목표로하며, 이는 중요한 목표이지만 우리 방법이 달성하고자하는 공간 정밀도와는 구별됩니다.
또 다른 대안은 한쪽 끝의 날카로운 팁에 비스듬히 기울어지고 다른쪽 5,6의 해밀턴 주사기에 부착된 붕규산 튜브를 통해 AAV 벡터를 주입하는 것입니다. 이 방법은 이 문서에 설명된 방법과 공통점이 많습니다. 바이러스 벡터는 튜빙 길이에 유지되고, 바이러스 뒤의 튜빙 공간은 염색된 오일로 채워지고, 벡터의 흐름은 오일-벡터 메니스커스의 움직임을 통해 모니터링됩니다. 이 대체 기술은 장비와 준비가 덜 필요하지만 음압에 의해 경 사진 팁을 통해 붕규산 튜브로 오일을 흡입하고 이후에 동일한 경로를 통해 벡터를로드해야합니다. 이것은 필연적으로 뇌에 전달되는 미량의 기름을 초래합니다. 또한 우리의 경험에 따르면 붕규산 튜브는 경사가 있어도 경막을 관통하기 위해 ~350μm의 직경을 가져야 하므로 이 백서에 설명된 더 얇은 금속 캐뉼라보다 더 큰 기계적 손상을 일으킵니다(그림 2D). 30G 튜빙은 임계 좌굴 하중이 1-10cm 길이에도 불구하고 경막 침투를 매개할 만큼 충분히 높고, PTFE 튜빙에 단단히 맞고, 거의 막히지 않기 때문에 사용되었습니다. 33G 튜빙은 더 쉽게 막히고 구부러지며 PTFE 튜빙과 결합하기가 더 어렵습니다. 36G 튜빙은 NHP 경막을 관통하기에 충분히 뻣뻣하지 않습니다.
또 다른 대안적인 주입 기술은 공기 펌프의 출력을 벡터-로딩된, 당김-유리 피펫(19)의 후면에 결합시키는 것이다. 벡터는 펌프의 직접적이고 간헐적인 공기 압력에 의해 피펫 팁에서 강제로 나오므로 오일이 필요하지 않습니다. 위에서 설명한 단일 튜브 방법과 유사하게 메 니스 커스와 캐뉼라 팁 사이에 재료 접합부가 없기 때문에 누출 위험이 줄어 듭니다. 그러나 유리 피펫의 날카로운 테이퍼와 섬세한 팁은 NHP 경막을 관통하거나 깊은 구조물을 표적으로 삼는 것을 방지합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 WaNPRC / ITHS P51OD010425 (JTT), 국립 보건원 (NIH) 보조금 EY023277 (YK의 경우 R01), EY030441 (GH의 경우 R01), MH114126 (RF1에서 JTT, 보아즈 레비, 에드 레인), MH120095 (JTT 및 GH의 경우 UG3), EY028902 (RS의 경우 R01), NIH 보조금 OD010425 (WaNPRC의 경우 P51) 및 워싱턴 대학교 로열티 연구 기금 A148416. 저자는 조직학의 Yasmine El-Shamayleh와 Victoria Omstead, 바이러스 벡터 클로닝의 Refugio Martinez, NHP 뇌 조직 처리에 대한 도움을 준 John Mich에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Equipment: Stereotaxic set | |||
| Item | |||
| Allen keys | BONDHUS | 10936 | STERRAD |
| Cannula holder | KOPF | 1770 | STERRAD |
| Carrier (manipulator) | KOPF | 1404 | STERRAD |
| Carrier platform | KOPF | 1430 | NA |
| Carrier stand | KOPF | 1449 | STERRAD |
| Eye, ear, mouth bars | KOPF | 1430 | NA |
| Stereotaxic base | KOPF | 1210 | NA |
| Equipment: Cannula | |||
| Item | |||
| 1 mL Luer-lock syringes | BD | 309628 | NA (sterilized package) |
| Cannulas* | (homemade - see below) | NA | steam (autoclave) |
| Colored oil** | (homemade - see below) | NA | NA |
| Elevator (for tube rack) | Cole-Parmer | UX-08057-10 | STERRAD |
| Filter tip | Genesee Scientific | 23-404 | NA (sterilized package) |
| Fluorescent microbeads | Lumafluor | R170 | NA |
| P20 pipetman | Gilson | FA10003M | NA |
| PCR tubes | Olympus Plastics | 22-161 | STERRAD |
| Stopcock | Cole-Parmer | 3060004 | STERRAD |
| Tube rack | homemade | NA | STERRAD |
| Vector solution | (homemade) | NA | NA |
| Equipment: Electric air pump set | |||
| Item | |||
| Electric air pump | World Precision Instruments | PV830 | NA |
| Foot pedal | World Precision Instruments | 3260 | NA |
| Tube cover | EZ Drape | A400-1000 | NA (sterilized package) |
| Equipment: General surgery tools | |||
| Item | |||
| Beaker | MEDLINE | azlon | STERRAD |
| Burrs | STRYKER | 277-10-235 | STERRAD |
| Double pronged tissue pick | Fine Science Tools | 18067-11 | STERRAD |
| Drapes | MEDLINE | DYNJP3004 | NA (sterilized package) |
| Dressing forceps | Miltex | 6-118 | STERRAD |
| Drill | STRYKER | Q9R-5400 | NA |
| Drill bits | STRYKER | 277-82-87 | STERRAD |
| Gauze | MEDLINE | NON26334 | NA (sterilized package) |
| Hemostatic mosquito forceps | Miltex | 7-2, 7-4 | STERRAD |
| Light handles | SKYTRON | Stellar XL | STERRAD |
| Needle hodler | Miltex | 8-2 | STERRAD |
| Periosteal elevator | Miltex | 18-1968 | STERRAD |
| Rongeurs | Miltex | 17-4800 | STERRAD |
| Saline | BAXTER | 2F7122 | STERRAD |
| Scalpel | Bard-Parker | 372610 | STERRAD |
| Scissors | Miltex | 5-12, 5-114 | STERRAD |
| Senn retractors | Miltex | 28065 | STERRAD |
| Sterile gloves | MEDLINE | Triumph Micro | NA (sterilized package) |
| Suction | medela | 200-4869 | NA |
| Suction tip | MEDLINE | DYNDFR12S | NA (sterilized package) |
| Suction tube | COVIDEN | 8888301614 | NA (sterilized package) |
| Surgical gowns | MEDLINE | DYNJP2002S | NA (sterilized package) |
| Surgical pens & ruler | MEDLINE | DYNJSM03 | NA (sterilized package) |
| Suture | COVIDEN | SL-635 | NA (sterilized package) |
| Tissue forceps | Miltex | 6-114 | STERRAD |
| Towel clamps | Miltex | 7-504 | STERRAD |
| Wood swabs | MEDLINE | MDS202095 | NA (sterilized package) |
| Equipment: *cannulas | |||
| Item | |||
| Hypodermic needle | EXELINT INTERNATIONAL | 26437 | NA (sterilized package) |
| Stainless steel tube | K-TUBE | K30R | NA |
| PTFE tube | ZEUS | 216200 | NA |
| Equipment: **colored oil | |||
| Item | |||
| Liquid Candle Dye Concentrate | PremiumCraft | Red/Pink | NA |
| Mineral oil | Vi-Jon | S0883 | NA |
| STERRAD: low-temperature hydrogen peroxide gas plasma |
참고문헌
- Kojima, Y., Robinson, F. R., Soetedjo, R. Cerebellar fastigial nucleus influence on ipsilateral abducens activity during saccades. Journal of Neurophysiology. 111 (8), 1553-1563 (2014).
- Kojima, Y., Soetedjo, R. Elimination of the error signal in the superior colliculus impairs saccade motor learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8987-8995 (2018).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effects of GABA agonist and antagonist injections into the oculomotor vermis on horizontal saccades. Brain Research. 1366, 93-100 (2010).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effect of inactivation and disinhibition of the oculomotor vermis on saccade adaptation. Brain Research. 1401, 30-39 (2011).
- De, A., El-Shamayleh, Y., Horwitz, G. D. Fast and reversible neural inactivation in macaque cortex by optogenetic stimulation of GABAergic neurons. eLife. 9, 52658(2020).
- El-Shamayleh, Y., Kojima, Y., Soetedjo, R., Horwitz, G. D. Selective optogenetic control of Purkinje cells in monkey cerebellum. Neuron. 95 (1), 51-62 (2017).
- Mich, J. K., et al. Functional enhancer elements drive subclass-selective expression from mouse to primate neocortex. Cell Reports. 34 (13), 108754(2021).
- Graybuck, L. T., et al. Enhancer viruses for combinatorial cell subclass-specific labeling. Neuron. (21), 00159(2020).
- Michel, J., Benninger, D., Dietz, V., van Hedel, H. J. Obstacle stepping in patients with Parkinson's disease. Complexity does influence performance. Journal of Neurology. 256 (3), 457-463 (2009).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Kaku, Y., Yoshida, K., Iwamoto, Y. Learning signals from the superior colliculus for adaptation of saccadic eye movements in the monkey. Journal of Neuroscience. 29 (16), 5266-5275 (2009).
- Soetedjo, R., Fuchs, A. F., Kojima, Y. Subthreshold activation of the superior colliculus drives saccade motor learning. Journal of Neuroscience. 29 (48), 15213-15222 (2009).
- Kleinbart, J. E., et al. A modular implant system for multimodal recording and manipulation of the primate brain. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual International Conference. 2018, 3362-3365 (2018).
- Arieli, A., Grinvald, A., Slovin, H. Dural substitute for long-term imaging of cortical activity in behaving monkeys and its clinical implications. Journal of Neuroscience Methods. 114 (2), 119-133 (2002).
- Ruiz, O., et al. Optogenetics through windows on the brain in the nonhuman primate. Journal of Neurophysiology. 110 (6), 1455-1467 (2013).
- Fredericks, J. M., et al. Methods for mechanical delivery of viral vectors into rhesus monkey brain. Journal of Neuroscience Methods. 339, 108730(2020).
- Bankiewicz, K. S., et al. Convection-enhanced delivery of AAV vector in parkinsonian monkeys; in vivo detection of gene expression and restoration of dopaminergic function using pro-drug approach. Experimental Neurology. 164 (1), 2-14 (2000).
- Yazdan-Shahmorad, A., et al. Widespread optogenetic expression in macaque cortex obtained with MR-guided, convection enhanced delivery (CED) of AAV vector to the thalamus. Journal of Neuroscience Methods. 293, 347-358 (2018).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유