Method Article
Iniezioni di vettori AAV per l'optogenetica in cervello di primati non umani anestetizzati e svegli
In questo articolo
Riepilogo
Come attualmente implementato, l'optogenetica nei primati non umani richiede l'iniezione di vettori virali nel cervello. Un metodo di iniezione ottimale dovrebbe essere affidabile e, per molte applicazioni, in grado di colpire singoli siti di profondità arbitraria che sono prontamente e inequivocabilmente identificati nell'istologia postmortem. Viene presentato un metodo di iniezione con queste proprietà.
Abstract
Le tecniche optogenetiche hanno rivoluzionato la ricerca neuroscientifica e sono pronte a fare lo stesso per la terapia genica neurologica. L'uso clinico dell'optogenetica, tuttavia, richiede che la sicurezza e l'efficacia siano dimostrate in modelli animali, idealmente nei primati non umani (NHP), a causa della loro somiglianza neurologica con gli esseri umani. Il numero di vettori candidati che sono potenzialmente utili per le neuroscienze e la medicina è vasto e non esiste ancora alcun mezzo ad alto rendimento per testare questi vettori. Pertanto, vi è la necessità di tecniche per effettuare iniezioni multiple spazialmente e volumetricamente accurate di vettori virali nel cervello NHP che possono essere identificate in modo inequivocabile attraverso l'istologia postmortem. Qui descritto è un tale metodo. Le cannule di iniezione sono costruite con tubi accoppiati in politetrafluoroetilene e acciaio inossidabile. Queste cannule sono autoclavabili, monouso e hanno bassi volumi di carico minimi, che le rendono ideali per l'iniezione di costose soluzioni di vettori virali altamente concentrati. Un olio minerale inerte tinto di rosso riempie lo spazio morto e forma un menisco visibile con la soluzione vettore, consentendo una misurazione istantanea e accurata delle velocità e dei volumi di iniezione. L'olio viene caricato nella parte posteriore della cannula, riducendo il rischio di co-iniezione con il vettore. Le cannule possono essere caricate in 10 minuti e le iniezioni possono essere fatte in 20 minuti. Questa procedura è adatta per iniezioni in animali svegli o anestetizzati. Se utilizzata per fornire vettori virali di alta qualità, questa procedura può produrre una robusta espressione di proteine optogenetiche, consentendo il controllo ottico dell'attività neurale e del comportamento nei NHP.
Introduzione
L'optogenetica nei primati non umani (NHP) comporta tipicamente l'iniezione di vettore virale direttamente nel cervello. Una classe di vettori che è adatta per questa applicazione è basata sul virus adeno-associato (AAV). Questi vettori consistono in un capside proteico che circonda un genoma di DNA a singolo filamento che, a sua volta, consiste in un promotore, un gene opsina e, facoltativamente, altri elementi codificanti proteine e regolatori genici. I progressi nella clonazione molecolare hanno facilitato la manipolazione e la combinazione di questi componenti per lo sviluppo di nuovi vettori. Di conseguenza, la collezione di vettori AAV potenzialmente utili per l'optogenetica NHP è ampia e in rapida crescita.
Allo stato attuale, l'utilità di un vettore AAV per l'optogenetica NHP richiede test in vivo. Questo fatto è un ostacolo sostanziale al progresso. Gli animali devono essere usati con parsimonia e testare più vettori in un singolo animale richiede che i siti di iniezione siano posizionati giudiziosamente rispetto all'architettura neurale e ben separati rispetto alla diffusione virale. Una valutazione istologica accurata richiede che le iniezioni siano spazialmente e volumetricamente accurate. Una tecnica di iniezione precedentemente utilizzata per la somministrazione focale di agenti farmacologici 1,2,3,4 è stata adattata e semplificata per effettuare tali iniezioni. Questa tecnica di iniezione è poco costosa, utilizza componenti monouso e sterilizzabili, può essere utilizzata in scimmie anestetizzate o sveglie e può essere utilizzata per colpire diverse aree cerebrali di qualsiasi profondità. Il seguente protocollo descrive le procedure passo-passo per fabbricare i componenti monouso e fare iniezioni nel cervello NHP. Vengono discussi i vantaggi e gli svantaggi della tecnica.
Protocollo
Tutti gli esperimenti sono stati eseguiti in conformità con la Guida per la cura e l'uso degli animali da laboratorio e hanno superato i requisiti minimi raccomandati dall'Institute of Laboratory Animal Resources e dall'Association for Assessment and Accreditation of Laboratory Animal Care International. Tutte le procedure sono state valutate e approvate dall'Animal Care and Use Committee dell'Università di Washington (protocollo UW IACUC #4167-01). Cinque macachi sani (2 Macaca mulatta, 3 Macaca nemestrina; maschio. 4-11 anni) hanno partecipato a questo studio. Strumenti e tecniche sterili sono stati utilizzati in tutte le procedure chirurgiche.
1. Fare una cannula (Figura 1A)
- Preparazione di ogni parte
- Smussare la punta di un ago ipodermico (30 G, lunghezza 13 mm) con una smerigliatrice a disco.
- Tagliare un tubo di acciaio inossidabile (30 G, diametro interno = 0,16 mm, diametro esterno = 0,31 mm) ad una lunghezza adattata alla profondità dell'area cerebrale bersaglio (25 mm è adatto per iniettare la superficie dorsale della corteccia cerebrale). Con una smerigliatrice a disco, smussare un'estremità del tubo tagliato e lisciare l'altra. Sbavare l'interno del tubo con una spilla.
- Tagliare il tubo in politetrafluoroetilene (PFTE) (diametro interno = 0,23 mm ± 0,02 mm, parete = 0,23 mm ± 0,02 mm, 1 mm corrisponde a 42 nL ± 7 nL di fluido) ad una lunghezza appropriata per la quantità di soluzione vettoriale da caricare (1 μL di soluzione vettoriale occupa 24 mm di tubo). Flare entrambe le estremità del tubo PTFE mediante l'inserimento dell'ago ipodermico smussato.
- Inserire l'ago ipodermico smussato di circa 5 mm in un'estremità del tubo di PTFE. Inserire l'estremità non smussata del tubo di acciaio inossidabile di circa 5 mm nell'altra estremità (figura 1A).
- Eseguire test pre-iniezione. Iniettare acqua filtrata attraverso il mozzo dell'ago ipodermico della cannula. Verificare che l'acqua esca dal tubo di acciaio inossidabile smussato dalla punta e che l'acqua non fuoriesca da nessuna delle due giunzioni.
2. Procedura di iniezione per animali anestetizzati
- Preparazione chirurgica
- Sterilizzare gli strumenti chirurgici e le forniture utilizzando le procedure nella tabella dei materiali.
- Se necessario, eseguire una risonanza magnetica alla testa per indirizzare le strutture cerebrali profonde (Figura 2A).
- Immediatamente prima dell'intervento, sedare gli animali con ketamina (10-15 mg/kg) e somministrare antibiotici (cefazolina) e analgesici (buprenorfina e meloxicam a rilascio prolungato) per via intramuscolare. Quindi, somministrare propofol tramite catetere endovenoso (IV) nelle vene safena o cefalica.
- Intubare l'animale e trasformarlo in gas isoflurano. Confermare la corretta anestesizzazione mediante frequenza cardiaca stabile, pressione sanguigna, frequenza respiratoria, muscoli scheletrici rilassati e assenza di riflessi palpebrali o di astinenza.
- Radere la testa dell'animale. Applicare un unguento lacrimale artificiale alle cornee per prevenire l'essiccazione.
- Preparazione dell'area di iniezione
- Posiziona la testa dell'animale nella cornice stereotassica. Applicare la soluzione chirurgica di scrub sulla pelle rasata con spugne di garza, applicare una leggera pressione per rilasciare eventuali detriti e risciacquare con alcool isopropilico. Ripeti questo processo tre volte. Coprire l'animale con un drappo sterile fenestrato. Incidi la pelle e rifletti il muscolo. Posizionare il manipolatore sul braccio stereotassico, posizionarlo per mirare all'area cerebrale bersaglio e contrassegnare la posizione della craniotomia sul cranio con una penna sterilizzata.
- Rimuovere il manipolatore stereotassico ed eseguire la craniotomia. Incidere la dura se lo si desidera (ad esempio, per visualizzare punti di riferimento solcali). Riportare il manipolatore sul braccio stereotassico.
- Caricamento della soluzione vettoriale (Figura 1C)
- Trasferire delicatamente la soluzione vettoriale in un tubo PCR sterilizzato con un pipettore P20, evitando bolle.
- Attaccare una cannula, con la punta smussata rivolta verso il basso, a un supporto stereotassico orientato verticalmente. Collegare una siringa Luer-lock da 1 mL al mozzo dell'ago ipodermico della cannula.
- Immergere la punta smussata della cannula nella soluzione vettoriale.
NOTA: la siringa deve essere già collegata; Attaccandolo a questo punto introdurrebbe bolle nella soluzione vettoriale. - Caricare la soluzione nella cannula applicando una leggera pressione negativa con la siringa da 1 ml. Traccia visivamente il menisco tra la soluzione e l'aria.
- Una volta caricata la soluzione vettoriale, continuare la leggera pressione negativa fino a quando la soluzione raggiunge il mozzo dell'ago. Rimuovere la siringa da 1 mL e iniettare l'olio minerale colorato nel mozzo dell'ago ipodermico.
NOTA: L'olio deve essere iniettato lentamente lungo la parete interna del mozzo dell'ago per formare un menisco trasparente con la soluzione vettoriale e per evitare bolle d'aria. - Collegare il mozzo dell'ago ipodermico a una delle due porte aperte di un rubinetto Luer-lock a 3 vie.
NOTA: Attaccare l'ago ipodermico alla porta chiusa introdurrà una pressione dell'aria indesiderata dietro l'olio. - Chiudere la porta collegata al mozzo dell'ago ipodermico, riempire una siringa da 1 mL con aria e collegarla a una delle altre due porte. Infine, chiudere la porta rimanente del rubinetto di arresto per collegare la siringa alla cannula.
- Spingere lentamente l'aria nella cannula. Una volta che l'olio colorato appare sulla punta dell'ago smussato nel tubo in PTFE, controllare l'aria tra la soluzione e l'olio colorato.
- Se è presente aria, applicare una pressione negativa alla siringa per riportare l'olio colorato nel mozzo dell'ago. Rimuovere la bolla e applicare una pressione positiva fino a quando una goccia di soluzione vettoriale è visibile sulla punta della cannula smussata.
- Rimuovere la siringa da 1 mL per rilasciare la pressione dell'aria indesiderata dietro l'olio e chiudere il rubinetto di arresto per evitare che il vettore esca dalla cannula per gravità.
- Fissare un righello di plastica al tubo in PTFE per misurare il movimento del menisco durante l'iniezione (Figura 1B,D,F).
- Inserimento della cannula nell'area cerebrale bersaglio (Figura 1B)
- Fissare la cannula al manipolatore stereotassico.
- Trasferire manualmente il tubo della pompa (che termina con un connettore Luer-lock) dall'assistente non sterile al chirurgo. Il chirurgo deve afferrare il connettore Luer-lock attraverso la parete di un manicotto sterile, fissare un secondo rubinetto sterile al connettore, fissare saldamente il manicotto attorno ad esso e quindi far cadere il colletto del manicotto, permettendogli di estendersi lungo il tubo per gravità.
- Collegare il rubinetto di arresto collegato al tubo della cannula al rubinetto di arresto collegato alla pompa dell'aria. Impostare la pompa dell'aria a bassa pressione, accenderla e aumentare la pressione fino a quando l'olio avanza attraverso la cannula e una goccia di soluzione vettoriale è visibile sulla punta della cannula.
- Regolare la posizione del righello di plastica sul tubo in PTFE per misurare il movimento del menisco durante l'iniezione.
- Guidare la cannula verso il basso con il manipolatore stereotassico e registrare la profondità alla quale la punta raggiunge la superficie (dura o pia madre).
- Guidare la cannula nel punto più profondo da iniettare lungo la pista. La superficie si attenuerà. Se si inietta corteccia superficiale, confermare visivamente che la cannula è penetrata nella superficie, con un microscopio chirurgico o lenti d'ingrandimento, se disponibili.
- Per ridurre al minimo il mistargeting dovuto alla compressione tissutale, guidare la cannula lentamente (1 mm/min), rapidamente (0,5 mm/s) con un'attesa di 1-5 minuti nella parte inferiore, oppure superare il sito di iniezione più profondo di 500 μm e quindi ritrarsi.
- Iniezione
- Iniettare 0,5 μL della soluzione vettoriale con la pompa pneumatica elettrica oltre 10-30 s. Confermare il flusso di iniezione tracciando il menisco tra l'olio colorato e la soluzione vettoriale nel tubo di PTFE.
- Attendere 1 minuto e ritrarre la cannula nel sito di iniezione successivo lungo il binario.
- Dopo l'iniezione finale, lasciare la cannula in posizione per 10 minuti per evitare effluenti vettoriali.
- Ritrarre la cannula e gettarla in un contenitore per oggetti taglienti a rischio biologico.
- Facoltativamente, iniettare una piccola quantità (≤1 μL) di microsfere fluorescenti vicino al sito di iniezione del vettore per facilitare l'identificazione del sito di iniezione post mortem.
- Ripetere questa procedura come desiderato per le altre soluzioni vettoriali in altre posizioni (Figura 2B).
- Chiusura dell'intervento chirurgico
- Sutura la dura, il muscolo e la pelle.
- Rimuovere la scimmia dal telaio stereotassico e rimuovere tutti i cavi del monitor.
- Rimuovere la scimmia dall'anestesia con isoflurano ed estubare dopo il ritorno del riflesso di deglutizione.
- Fornire un trattamento post-chirurgico (3-5 giorni di meloxicam e 7-10 giorni di cefalexina). Monitorare l'animale almeno una volta ogni 10 minuti fino a quando non è in grado di mantenere una posizione seduta eretta stabile.
3. Chirurgia e iniezione di vettori AAV per animali che si comportano svegli (Figura 1D)
NOTA: Una variante della tecnica può essere utilizzata per fare iniezioni nel cervello di scimmie sveglie e comportanti, come descritto di seguito.
- Iniezione simultanea con registrazione
- Per registrare l'attività elettrica nel sito di iniezione, rivestire l'esterno della cannula con resina epossidica (inferiore ~ 15 mm) e tubi in poliimmide (lunghezza rimanente). Rivelare il metallo sulla punta raschiando la resina epossidica da esso (Injectrode, Figura 1F)2. In alternativa, inserire la cannula e un elettrodo extracellulare separato, fianco a fianco, in un tubo guida a doppio cilindro (tubo guida a doppio barile, Figura 1E).
- Inserimento della cannula nell'area cerebrale bersaglio.
- Posizionare la scimmia nella cabina sperimentale, limitare il movimento della testa e pulire la camera di registrazione montata sul cranio usando tecniche standard.
- Fissare un tubo guida al microdrive. Inserire la cannula di iniezione nel tubo di guida.
- Far avanzare la cannula fino a quando la punta sporge dal tubo guida.
- Collegare il rubinetto di arresto alla pompa dell'aria elettrica. Per confermare il corretto funzionamento del sistema, spingere una goccia di soluzione vettoriale dalla punta utilizzando la pompa dell'aria e confermare il movimento del menisco della soluzione vettoriale dell'olio.
- Prelevare la cannula ~ 5 mm nel tubo guida per proteggerlo da danni durante l'inserimento del tubo nel cervello. Inserire il tubo guida nel cervello.
- Guidare la cannula nel sito da iniettare utilizzando il microdrive. Identificare il sito target mediante registrazione elettrica (Figura 2C) o stimolazione.
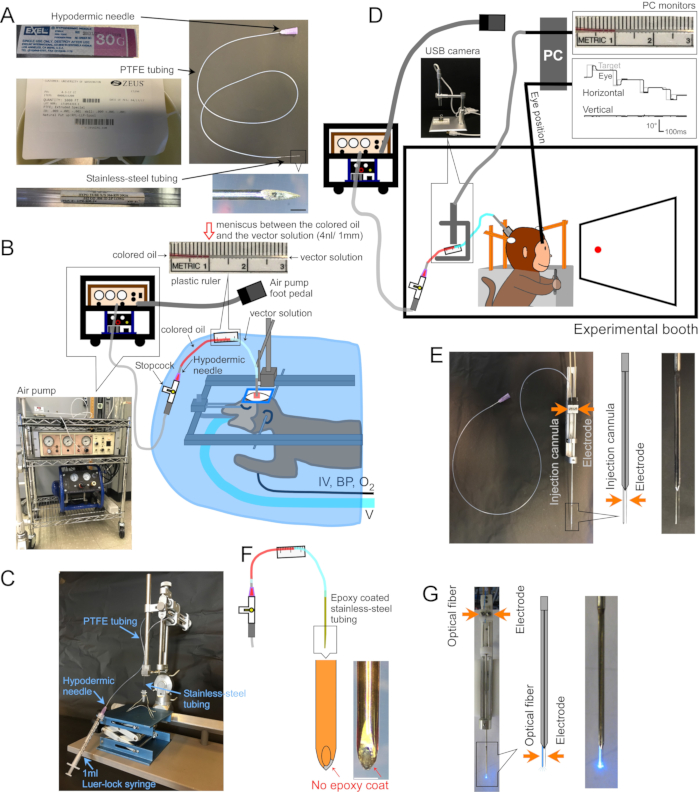
Figura 1: Configurazione dell'intervento chirurgico e dell'apparato. (A) Cannula per iniezione. Ogni parte della cannula è indicata. Inserto in basso a destra: immagine ingrandita della punta della cannula, barra della scala: 500 μm. (B) Impostazione chirurgica per scimmie anestetizzate. La scimmia è posta in una cornice stereotassica sotto un drappo chirurgico. Il ventilatore (V), la linea endovenosa (IV), il monitor della pressione sanguigna (BP) e il monitor della saturazione di ossigeno (O2) sono collegati alla scimmia. La cannula di iniezione viene inserita nell'area target utilizzando un micromanipolatore stereotassico. La soluzione vettoriale viene iniettata da una pompa d'aria elettrica (inserto in basso a sinistra, marrone) accoppiata a un compressore d'aria (inserto in basso a sinistra, blu). Un righello di plastica (inserto superiore) viene fissato al tubo in PTFE per misurare il movimento del menisco tra olio colorato (inserto superiore, rosso) e soluzione vettoriale (inserto superiore, trasparente) durante l'iniezione. (C) Impostazione per caricare la soluzione vettoriale nella cannula. (D) Una scimmia durante un'iniezione di soluzione vettoriale in una cabina sperimentale. La testa dell'animale è tenuta in posizione da tre pali di stabilizzazione e la posizione degli occhi è registrata da un sistema di bobine di ricerca sclerale. La cannula di iniezione viene tenuta e guidata alla profondità target utilizzando un supporto/driver per microelettrodi. L'iniezione viene controllata monitorando il menisco tra l'olio colorato e la soluzione vettoriale attraverso una telecamera USB (immagine inserita). (E) Iniezione del tubo guida a doppio barile. Un portatubo guida a doppio cilindro/driver contiene una cannula di iniezione e un microelettrodo (vedere riquadro). f) iniettore. Il metallo sulla punta della cannula, esposto raschiando il rivestimento epossidico, fornisce accesso elettrico ai neuroni (inserto, barra della scala: 500 μm). (G) Configurazione della stimolazione laser. Un portatubo guida a doppio barilotto contiene sia una fibra ottica che un microelettrodo (vedi riquadro). Fare clic qui per visualizzare una versione ingrandita di questa figura.
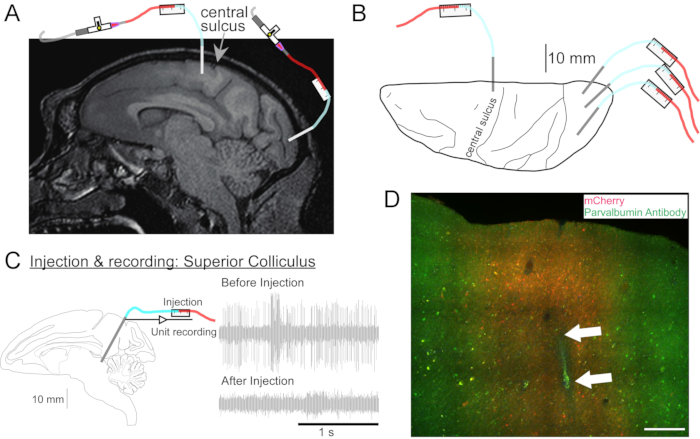
Figura 2: Diagramma dei siti di iniezione di AAV. (A) Sezione sagittale dell'immagine RM cerebrale che mostra i siti di iniezione nella corteccia motoria primaria e nella corteccia visiva primaria di una Macaca nemestrina. (B) Vista dalla superficie dorsale sulla corrispondente lastra Atlas che mostra il posizionamento della cannula rispetto al solco centrale (corteccia motoria primaria) e alla corteccia visiva primaria. (C) Registrazione unitaria mediante iniettore nel collicolo superiore. Un'unità che era stata isolata prima dell'iniezione (in alto a destra) è scomparsa dopo l'iniezione (in basso a destra). (D) Pista di iniezione (frecce bianche). Barra scala: 500 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Elaborazione del tessuto cerebrale per istologia
- Attendere 6-8 settimane dopo l'iniezione per massimizzare l'espressione del transgene.
NOTA: La durata ottimale dipende dall'esatto vettore virale utilizzato nell'esperimento. - Elaborare il cervello utilizzando tecniche istologiche convenzionali per valutare l'efficienza e la selettività della trasduzione 5,6,7.
Risultati
Per dimostrare l'espressione del transgene mediante iniezione stereotassica in vivo nel cervello NHP utilizzando il metodo di iniezione chirurgica qui descritto, sono stati selezionati due vettori che contenevano potenziatori che guidano l'espressione della proteina fluorescente super gialla-2 (SYFP2) in tipi neuronali distinti 8,9. I vettori virali sono stati confezionati nel capside10 di PHP.eB, purificati mediante centrifugazione dello iodixanolo e quindi concentrati a titolo elevato (genomi virali >1E13 / ml) misurati mediante qPCR. Un volume di 0,5 μL è stato iniettato a ciascuna delle dieci profondità lungo dieci tracce attraverso la corteccia per un volume totale di iniezione di 5 μL/traccia. La Figura 3A-C mostra l'espressione di SYFP2 tramite immunocolorazione anti-GFP 113 giorni dopo l'iniezione del vettore AAV specifico della sottoclasse PVALB, CN2045, nella corteccia visiva primaria di un maschio adulto di Macaca nemestrina. Il transgene SYFP2 è stato rilevato in modo robusto in numerosi neuroni non piramidali sparsi nella profondità corticale e la maggior parte dei neuroni che esprimono SYFP2 erano anche immunoreattivi per PVALB7. La Figura 3D mostra l'espressione nativa di SYFP2 nella corteccia motoria primaria 64 giorni dopo l'iniezione del vettore AAV specifico della sottoclasse di neuroni L5, CN2251. I neuroni marcati con SYFP2 hanno tutti una chiara morfologia piramidale con somata limitata allo strato 5 e caratteristici dendriti apicali spessi. Questi dati dimostrano inequivocabilmente un controllo preciso dell'espressione transgenica in popolazioni selezionate di neuroni neocorticali nel cervello NHP mediante iniezione stereotassica di vettori AAV mirati di tipo cellulare.
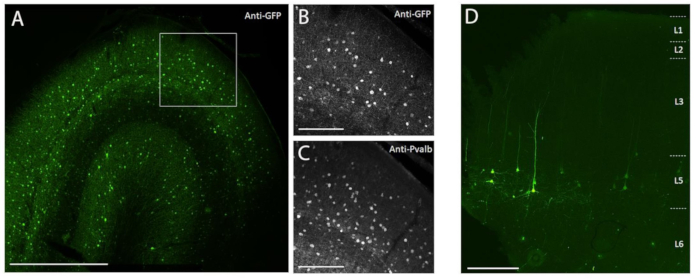
Figura 3: Esempio di espressione di SYFP2 specifica del tipo di cellula mediata da vettori AAV iniettati nel cervello NHP . (A) Fotomicrografia di epifluorescenza di una sezione fissa della corteccia visiva primaria del macaco 113 giorni dopo l'iniezione di un vettore AAV specifico della sottoclasse PVALB. Barra scala: 1 mm. (B,C) Immagine di ingrandimento più elevata della regione riposta mostrata in A. (B) Segnale anti-GFP. (C) Segnale anti-PVALB. Barre della scala: 250 μm. (D) Fotomicrografia dell'epifluorescenza della fluorescenza nativa di SYFP2 in una sezione fissa dalla corteccia motoria primaria del macaco 64 giorni dopo l'iniezione di un vettore AAV extratelencefalico specifico della sottoclasse 5 di livello 5. Barra scala: 500 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Per dimostrare l'utilità di questa tecnica di iniezione per manipolazioni optogenetiche neurofisiologiche e comportamentali, sono stati eseguiti tre esperimenti, ciascuno su una scimmia diversa (Macaca mulatta). Nel primo esperimento (Figura 4A-D), i vettori AAV portatori del transgene channelrhodopsin-2 (AAV1-hSyn1-ChR2-mCherry) sono stati iniettati nel collicolo superiore sinistro (SC). Il vettore è stato iniettato ogni 250 μm a 19 profondità per un totale di 12 μL. Nel secondo esperimento (Figura 4E-G), 3 μL di soluzione AAV1-hSyn-ArchT-EYFP sono stati iniettati nel nucleo reticularis tegmenti pontis (NRTP). Nel terzo esperimento (Figura 4H-K), 24 μL di soluzione AAV9-L7-ChR2-mCherry sono stati iniettati nella corteccia cerebellare 6. Da sei a otto settimane dopo ogni iniezione, una fibra ottica e un elettrodo di tungsteno sono stati inseriti nel cervello tramite un tubo guida a doppio cilindro (Figura 1G).
La Figura 4B mostra la risposta di un neurone SC alla luce blu (450 nm). La luce continua (1,2 s) a 40 mW ha prodotto una serie di potenziali d'azione consecutivi (Figura 4B, in alto). Gli impulsi luminosi della durata di 1 ms non sono riusciti a evocare potenziali d'azione a 40 mW (Figura 4B, al centro) ma hanno evocato potenziali d'azione in modo affidabile a 160 mW, l'unico altro livello di potenza testato, con una latenza di 2,7 ± 0,6 ms (Figura 4B, in basso). Un treno di impulsi (160 mW, frequenza: 300 Hz, duty cycle: 15%, durata: 300 ms) evocava saccadi coerentemente con una latenza media di 97 ± 32 ms, un'ampiezza media di 10,4° e un angolo medio di 47° (verso l'alto e verso destra; Figura 4C).
Coerentemente con gli studi che hanno modificato il guadagno di saccade utilizzando la stimolazione elettrica sottosoglia dell'SC11,12, la stimolazione ottica della SC dopo 15°, 18° e 20° saccadi a sinistra e verso il basso (225°) ha gradualmente ridotto il guadagno di saccade (Figura 4D). Questa diminuzione del guadagno ha richiesto ~ 250 prove (cerchi verdi) per tornare al guadagno pre-adattamento (cerchi neri), confermando la sua base nella plasticità a lungo termine.
Nel secondo esperimento (Figura 4E), la proiezione di fibre muschiose dal NRTP al verme oculomotore (OMV) della corteccia cerebellare (lobuli VIc e VII) è stata soppressa otticamente. La figura 4F mostra fibre muschiose e rosette marcate con fluorescenza nell'OMV (riquadro). La luce laser gialla (589 nm) è stata erogata all'OMV tramite fibra ottica e un elettrodo di tungsteno nelle vicinanze è stato utilizzato per registrare l'attività delle celle di Purkinje. La Figura 4G mostra una semplice attività di picco prima (grigia) e dopo (arancione) l'inattivazione optogenetica delle proiezioni NRTP (Figura 4G, in alto). Prima dell'inattivazione, la cellula di Purkinje mostrava un modello a doppia raffica per saccadi di 12° verso destra (Figura 4G, al centro, in grigio). Durante l'inattivazione, la velocità di sparo è diminuita e cambiata in un modello burst-pause (Figura 4G, al centro, arancione). Il confronto di questi due modelli di risposta suggerisce che l'ingresso di fibre muschiose alle cellule di Purkinje influenza la fase di decelerazione della saccade guidando la seconda raffica (Figura 4G, al centro, in verde). La variabilità delle saccadi verso destra è stata ridotta durante l'inattivazione optogenetica, coerentemente con l'idea che parte della variabilità da prova a prova nelle metriche di saccade è dovuta alla variabilità dei segnali trasportati dalle fibre muschiose (Figura 4G, in basso, arancione).
Nel terzo esperimento (Figura 4H), le cellule di Purkinje dell'OMV sono state stimolate optogeneticamente (Figura 4I). Un treno di brevi impulsi luminosi (impulsi di 1,5 ms, 65 mW, 50 Hz) ha aumentato la semplice attività di picco di una cella di Purkinje isolata (Figura 4J, in alto). I singoli impulsi luminosi di 1,5 ms evocavano frequentemente un picco semplice di >1 (Figura 4J, in basso). L'attivazione del picco semplice optogenetico, programmata per verificarsi durante una saccade (impulso luminoso di 10 ms, 60 mW), ha aumentato l'ampiezza della saccade (Figura 4K), confermando il ruolo disinibitorio delle cellule di Purkinje sul generatore di burst oculomotore.
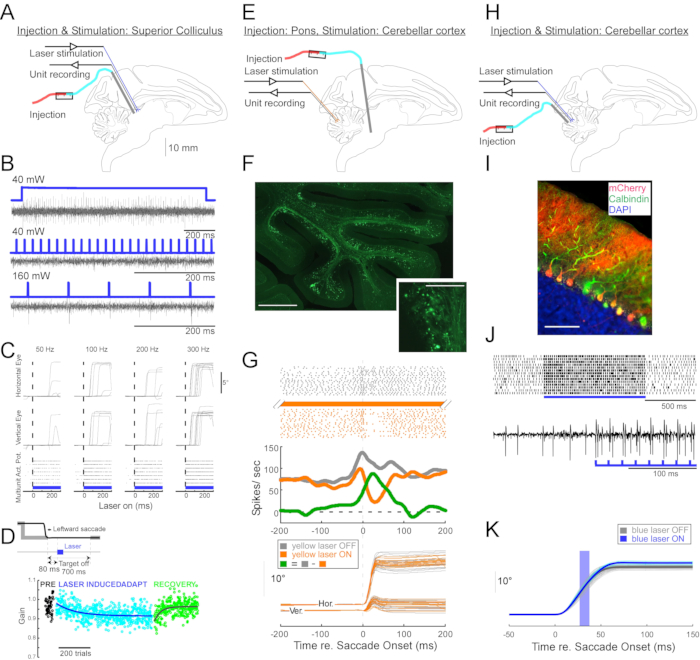
Figura 4: Riassunto di tre esperimenti optogenetici eseguiti in scimmie sveglie. (A-D) Esperimento 1, eccitazione pan-neuronale: iniezione virale, stimolazione laser e registrazione unitaria sono stati condotti nel collicolo superiore (A). (B) Attività unitaria rappresentativa evocata dalla stimolazione laser. (C), componenti orizzontali (in alto) e verticali (al centro) dei movimenti oculari e grafico raster dell'attività unitaria (in basso) evocato dalla stimolazione laser. (D) Una sessione rappresentativa di adattamento della saccade indotta dalla stimolazione laser. La stimolazione (100 impulsi laser da 0,5 ms) è stata erogata 80 ms dopo ogni sacca. Il guadagno di saccade (ampiezza saccade / ampiezza target) è diminuito gradualmente nel corso delle prove. (E-G) Esperimento 2, inibizione pathway-specific: un vettore virale è stato iniettato nel nucleo reticularis tegmenti pontis, e la stimolazione laser e la registrazione dell'unità sono state condotte nel verme oculomotore (E). (F) Sezione istologica del verme oculomotore che mostra fibre muschiose marcate (barra della scala: 1 mm) e le loro rosette (riquadro, barra della scala: 100 μm). (G) Attività cellulare di Purkinje (in alto: raster, al centro: velocità di sparo media) e traiettorie di saccadi guidate visivamente (in basso) con e senza stimolazione laser. Grigio: laser off trials, arancione: laser on trials, verde: differenza tra grigio e arancione. (H-K) Esperimento 3, attivazione specifica del tipo di cellula: iniezione virale, stimolazione laser e registrazione dell'unità sono stati condotti nel verme oculomotore (H). (I) Sezione istologica del verme oculomotore che mostra cellule di Purkinje marcate. Barra della scala: 100 μm. (J) Semplice attività spike di una cellula di Purkinje evocata dalla stimolazione laser. In alto: trama raster da 14 prove. In basso: traccia di tensione da una singola prova rappresentativa. (K) Traiettorie di saccadi a guida visiva con e senza stimolazione laser. Un impulso luminoso di 10 ms durante le saccadi aumentava le ampiezze della saccade. Traiettorie di saccade individuali (ciano) e loro media (blu) nelle prove laser-on. Traiettorie di saccade individuali (grigio chiaro) e loro media (grigio scuro) nelle prove laser-off. La lunghezza d'onda della luce era di 450 nm negli esperimenti 1 e 3 ed era di 589 nm nell'esperimento 2. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
I progressi nell'optogenetica NHP hanno creato la necessità di metodi di iniezione intracranica accurati e affidabili. I vantaggi del metodo descritto in questo rapporto sono che è economico, utilizza componenti sterilizzabili e usa e getta e ha la capacità di colpire diverse aree cerebrali di qualsiasi profondità. Consente inoltre di controllare la velocità e il volume di iniezione in virtù della velocità con cui la valvola dell'aria può essere controllata. La pressione dell'aria può essere aumentata transitoriamente per rimuovere un intasamento e quindi ridotta rapidamente per evitare la successiva sovrainiezione che sarebbe prodotta da una pressione sostenuta. I componenti monouso riducono il rischio di contaminazione incrociata tra i siti di iniezione.
I passaggi critici di questo protocollo di iniezione includono la costruzione di cannule di alta qualità, il loro caricamento senza introdurre bolle e la selezione di siti di iniezione non troppo vicini tra loro. Le iniezioni a ≥1 cm di distanza di solito trasducono regioni non sovrapposte, ma questa euristica dipende dal sierotipo virale, dal titolo, dal promotore, dal volume, dal bersaglio e dal metodo di rilevazione. La selezione di siti di iniezione che non sono direttamente collegati evita potenziali confusioni prodotti dal traffico di opsina lungo gli assoni e la propensione di alcuni sierotipi AAV alla trasduzione retrograda.
Il metodo può essere utilizzato per iniettare NHP mentre è anestetizzato e in un frame stereotassico (Figura 3) o vigile e fissato alla testa (Figura 4). Il primo ha il vantaggio di consentire di indirizzare le iniezioni in coordinate stereotassiche e consente la conferma visiva della penetrazione della cannula attraverso una durotomia acuta (incidendo la dura in una scimmia sveglia, attraverso una craniotomia cronica, aumenta il rischio di infezione). Quest'ultimo approccio ha il vantaggio di ridurre il numero di interventi chirurgici di sopravvivenza e quindi lo stress per l'animale, essendo compatibile con le registrazioni elettrofisiologiche durante il comportamento, e utilizzando lo stesso quadro di coordinate e strumentazione utilizzato per inserire le fibre ottiche per gli esperimenti post-iniezione. La tecnica di iniezione nelle scimmie sveglie potrebbe essere ulteriormente migliorata effettuando iniezioni attraverso dura artificiale13,14,15. Ciò conferirebbe gli ulteriori vantaggi della visualizzazione diretta dei siti di iniezione e della fluorescenza tissutale che indica una trasduzione riuscita.
Diverse altre tecniche di iniezione di AAV sono state utilizzate negli NHP. Recentemente, è stato sviluppato un dispositivo di iniezione multicanale per fornire vettori AAV uniformemente a grandi regioni corticali NHP16. Risultati simili possono essere ottenuti utilizzando l'erogazione potenziata dalla convezione17,18. Questi metodi mirano a massimizzare la diffusione della trasduzione, che è un obiettivo importante ma distinto dalla precisione spaziale che il nostro metodo mira a raggiungere.
Un altro metodo alternativo è quello di iniettare vettori AAV attraverso tubi borosilicati che vengono smussati a una punta affilata su un'estremità e attaccati a una siringa di Hamilton sull'altra 5,6. Questo metodo ha molto in comune con il metodo descritto in questo documento. Il vettore virale è tenuto in una lunghezza di tubo, lo spazio nel tubo dietro il virus è riempito con olio colorato e il flusso del vettore viene monitorato tramite il movimento del menisco del vettore dell'olio. Questa tecnica alternativa richiede meno attrezzature e preparazione, ma richiede l'estrazione di olio nel tubo borosilicato attraverso la punta smussata mediante pressione negativa e il caricamento successivo del vettore attraverso lo stesso percorso. Ciò si traduce inevitabilmente in tracce di olio consegnato al cervello. Inoltre, nella nostra esperienza, il tubo in borosilicato deve avere un diametro di ~ 350 μm per penetrare la dura anche quando smussato e quindi causa danni meccanici maggiori rispetto alla cannula metallica più sottile descritta in questo documento (Figura 2D). È stato utilizzato un tubo da 30 G perché il suo carico di instabilità critico è abbastanza elevato da mediare la penetrazione della dura nonostante una lunghezza di 1-10 cm, perché si adatta perfettamente al tubo in PTFE e perché raramente si ostruisce. Il tubo da 33 G si intasa e si piega più facilmente ed è più difficile da accoppiare con il tubo in PTFE. I tubi da 36 G non sono sufficientemente rigidi per penetrare la dura madre NHP.
Un'altra tecnica di iniezione alternativa consiste nell'accoppiare l'uscita della pompa dell'aria a una parte posteriore di una pipetta in vetro tirato caricata vettoriale19. Il vettore viene forzato dalla punta della pipetta dalla pressione diretta e intermittente dell'aria dalla pompa, eliminando la necessità di olio. Analogamente al metodo a tubo singolo spiegato sopra, la mancanza di giunzioni materiali tra il menisco e la punta della cannula riduce il rischio di perdite. Tuttavia, la conicità affilata e le punte delicate delle pipette di vetro impediscono loro di penetrare la dura NHP o di colpire le strutture profonde.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato supportato da WaNPRC / ITHS P51OD010425 (JTT), National Institute of Health (NIH) sovvenzioni EY023277 (R01 per YK), EY030441 (R01 per GH), MH114126 (RF1 a JTT, Boaz Levi, Ed Lein), MH120095 (UG3 per JTT e GH), EY028902 (R01 per RS), e reso possibile dalle sovvenzioni NIH OD010425 (P51 per WaNPRC) e University of Washington Royalty Research Fund A148416. Gli autori desiderano ringraziare Yasmine El-Shamayleh e Victoria Omstead per l'istologia, Refugio Martinez per la clonazione dei vettori virali e John Mich per l'assistenza nell'elaborazione del tessuto cerebrale NHP.
Materiali
| Name | Company | Catalog Number | Comments |
| Equipment: Stereotaxic set | |||
| Item | |||
| Allen keys | BONDHUS | 10936 | STERRAD |
| Cannula holder | KOPF | 1770 | STERRAD |
| Carrier (manipulator) | KOPF | 1404 | STERRAD |
| Carrier platform | KOPF | 1430 | NA |
| Carrier stand | KOPF | 1449 | STERRAD |
| Eye, ear, mouth bars | KOPF | 1430 | NA |
| Stereotaxic base | KOPF | 1210 | NA |
| Equipment: Cannula | |||
| Item | |||
| 1 mL Luer-lock syringes | BD | 309628 | NA (sterilized package) |
| Cannulas* | (homemade - see below) | NA | steam (autoclave) |
| Colored oil** | (homemade - see below) | NA | NA |
| Elevator (for tube rack) | Cole-Parmer | UX-08057-10 | STERRAD |
| Filter tip | Genesee Scientific | 23-404 | NA (sterilized package) |
| Fluorescent microbeads | Lumafluor | R170 | NA |
| P20 pipetman | Gilson | FA10003M | NA |
| PCR tubes | Olympus Plastics | 22-161 | STERRAD |
| Stopcock | Cole-Parmer | 3060004 | STERRAD |
| Tube rack | homemade | NA | STERRAD |
| Vector solution | (homemade) | NA | NA |
| Equipment: Electric air pump set | |||
| Item | |||
| Electric air pump | World Precision Instruments | PV830 | NA |
| Foot pedal | World Precision Instruments | 3260 | NA |
| Tube cover | EZ Drape | A400-1000 | NA (sterilized package) |
| Equipment: General surgery tools | |||
| Item | |||
| Beaker | MEDLINE | azlon | STERRAD |
| Burrs | STRYKER | 277-10-235 | STERRAD |
| Double pronged tissue pick | Fine Science Tools | 18067-11 | STERRAD |
| Drapes | MEDLINE | DYNJP3004 | NA (sterilized package) |
| Dressing forceps | Miltex | 6-118 | STERRAD |
| Drill | STRYKER | Q9R-5400 | NA |
| Drill bits | STRYKER | 277-82-87 | STERRAD |
| Gauze | MEDLINE | NON26334 | NA (sterilized package) |
| Hemostatic mosquito forceps | Miltex | 7-2, 7-4 | STERRAD |
| Light handles | SKYTRON | Stellar XL | STERRAD |
| Needle hodler | Miltex | 8-2 | STERRAD |
| Periosteal elevator | Miltex | 18-1968 | STERRAD |
| Rongeurs | Miltex | 17-4800 | STERRAD |
| Saline | BAXTER | 2F7122 | STERRAD |
| Scalpel | Bard-Parker | 372610 | STERRAD |
| Scissors | Miltex | 5-12, 5-114 | STERRAD |
| Senn retractors | Miltex | 28065 | STERRAD |
| Sterile gloves | MEDLINE | Triumph Micro | NA (sterilized package) |
| Suction | medela | 200-4869 | NA |
| Suction tip | MEDLINE | DYNDFR12S | NA (sterilized package) |
| Suction tube | COVIDEN | 8888301614 | NA (sterilized package) |
| Surgical gowns | MEDLINE | DYNJP2002S | NA (sterilized package) |
| Surgical pens & ruler | MEDLINE | DYNJSM03 | NA (sterilized package) |
| Suture | COVIDEN | SL-635 | NA (sterilized package) |
| Tissue forceps | Miltex | 6-114 | STERRAD |
| Towel clamps | Miltex | 7-504 | STERRAD |
| Wood swabs | MEDLINE | MDS202095 | NA (sterilized package) |
| Equipment: *cannulas | |||
| Item | |||
| Hypodermic needle | EXELINT INTERNATIONAL | 26437 | NA (sterilized package) |
| Stainless steel tube | K-TUBE | K30R | NA |
| PTFE tube | ZEUS | 216200 | NA |
| Equipment: **colored oil | |||
| Item | |||
| Liquid Candle Dye Concentrate | PremiumCraft | Red/Pink | NA |
| Mineral oil | Vi-Jon | S0883 | NA |
| STERRAD: low-temperature hydrogen peroxide gas plasma |
Riferimenti
- Kojima, Y., Robinson, F. R., Soetedjo, R. Cerebellar fastigial nucleus influence on ipsilateral abducens activity during saccades. Journal of Neurophysiology. 111 (8), 1553-1563 (2014).
- Kojima, Y., Soetedjo, R. Elimination of the error signal in the superior colliculus impairs saccade motor learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8987-8995 (2018).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effects of GABA agonist and antagonist injections into the oculomotor vermis on horizontal saccades. Brain Research. 1366, 93-100 (2010).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effect of inactivation and disinhibition of the oculomotor vermis on saccade adaptation. Brain Research. 1401, 30-39 (2011).
- De, A., El-Shamayleh, Y., Horwitz, G. D. Fast and reversible neural inactivation in macaque cortex by optogenetic stimulation of GABAergic neurons. eLife. 9, 52658(2020).
- El-Shamayleh, Y., Kojima, Y., Soetedjo, R., Horwitz, G. D. Selective optogenetic control of Purkinje cells in monkey cerebellum. Neuron. 95 (1), 51-62 (2017).
- Mich, J. K., et al. Functional enhancer elements drive subclass-selective expression from mouse to primate neocortex. Cell Reports. 34 (13), 108754(2021).
- Graybuck, L. T., et al. Enhancer viruses for combinatorial cell subclass-specific labeling. Neuron. (21), 00159(2020).
- Michel, J., Benninger, D., Dietz, V., van Hedel, H. J. Obstacle stepping in patients with Parkinson's disease. Complexity does influence performance. Journal of Neurology. 256 (3), 457-463 (2009).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Kaku, Y., Yoshida, K., Iwamoto, Y. Learning signals from the superior colliculus for adaptation of saccadic eye movements in the monkey. Journal of Neuroscience. 29 (16), 5266-5275 (2009).
- Soetedjo, R., Fuchs, A. F., Kojima, Y. Subthreshold activation of the superior colliculus drives saccade motor learning. Journal of Neuroscience. 29 (48), 15213-15222 (2009).
- Kleinbart, J. E., et al. A modular implant system for multimodal recording and manipulation of the primate brain. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual International Conference. 2018, 3362-3365 (2018).
- Arieli, A., Grinvald, A., Slovin, H. Dural substitute for long-term imaging of cortical activity in behaving monkeys and its clinical implications. Journal of Neuroscience Methods. 114 (2), 119-133 (2002).
- Ruiz, O., et al. Optogenetics through windows on the brain in the nonhuman primate. Journal of Neurophysiology. 110 (6), 1455-1467 (2013).
- Fredericks, J. M., et al. Methods for mechanical delivery of viral vectors into rhesus monkey brain. Journal of Neuroscience Methods. 339, 108730(2020).
- Bankiewicz, K. S., et al. Convection-enhanced delivery of AAV vector in parkinsonian monkeys; in vivo detection of gene expression and restoration of dopaminergic function using pro-drug approach. Experimental Neurology. 164 (1), 2-14 (2000).
- Yazdan-Shahmorad, A., et al. Widespread optogenetic expression in macaque cortex obtained with MR-guided, convection enhanced delivery (CED) of AAV vector to the thalamus. Journal of Neuroscience Methods. 293, 347-358 (2018).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon