Method Article
Anestezi Uygulanmış ve İnsan Dışı Primat Beyne Uyanan Optogenetik için AAV Vektörlerinin Enjeksiyonları
Bu Makalede
Özet
Şu anda uygulandığı gibi, insan olmayan primatlarda optogenetik, viral vektörlerin beyne enjekte edilmesini gerektirir. Optimal bir enjeksiyon yöntemi güvenilir olmalı ve birçok uygulama için, postmortem histolojide kolayca ve açık bir şekilde tanımlanan keyfi derinlikteki bireysel bölgeleri hedefleyebilmelidir. Bu özelliklere sahip bir enjeksiyon yöntemi sunulmaktadır.
Özet
Optogenetik teknikler sinirbilim araştırmalarında devrim yarattı ve nörolojik gen terapisi için de aynısını yapmaya hazır. Bununla birlikte, optogenetiğin klinik kullanımı, insanlara nörolojik benzerlikleri nedeniyle, ideal olarak insan olmayan primatlarda (NHP'ler) hayvan modellerinde güvenlik ve etkinliğin gösterilmesini gerektirir. Nörobilim ve tıp için potansiyel olarak yararlı olan aday vektörlerin sayısı çok fazladır ve bu vektörleri test etmek için henüz yüksek verimli bir araç mevcut değildir. Bu nedenle, viral vektörlerin NHP beynine çoklu mekansal ve hacimsel olarak doğru enjeksiyonlarını yapmak için tekniklere ihtiyaç vardır, bu da postmortem histoloji ile açık bir şekilde tanımlanabilir. Burada açıklanan böyle bir yöntemdir. Enjeksiyon kanülleri, birleştirilmiş politetrafloroetilen ve paslanmaz çelik borulardan yapılmıştır. Bu kanüller otoklavlanabilir, tek kullanımlıktır ve düşük minimum yükleme hacimlerine sahiptir, bu da onları pahalı, yüksek konsantrasyonlu viral vektör çözeltilerinin enjeksiyonu için ideal kılar. Hareketsiz, kırmızı boyalı bir mineral yağ, ölü alanı doldurur ve vektör çözeltisi ile görünür bir menisküs oluşturarak enjeksiyon hızlarının ve hacimlerinin anlık ve doğru bir şekilde ölçülmesini sağlar. Yağ, kanülün arkasına yüklenir ve vektörle birlikte enjeksiyon riskini azaltır. Kanüller 10 dakikada yüklenebilir ve enjeksiyonlar 20 dakikada yapılabilir. Bu prosedür uyanık veya anestezi uygulanmış hayvanlara enjeksiyonlar için çok uygundur. Yüksek kaliteli viral vektörler sunmak için kullanıldığında, bu prosedür optogenetik proteinlerin sağlam ekspresyonunu üretebilir ve NHP'lerde nöral aktivite ve davranışın optik kontrolüne izin verebilir.
Giriş
İnsan olmayan primatlarda (NHP'ler) optogenetik tipik olarak viral vektörün doğrudan beyne enjekte edilmesini içerir. Bu uygulama için çok uygun olan bir vektör sınıfı, adeno ile ilişkili virüse (AAV) dayanmaktadır. Bu vektörler, tek sarmallı bir DNA genomunu çevreleyen bir protein kapsidinden oluşur ve bu da bir promotör, bir opsin geni ve isteğe bağlı olarak diğer protein kodlayıcı ve gen düzenleyici elementlerden oluşur. Moleküler klonlamadaki ilerlemeler, yeni vektörlerin geliştirilmesi için bu bileşenlerin manipülasyonunu ve kombinasyonunu kolaylaştırmıştır. Sonuç olarak, NHP optogenetiği için potansiyel olarak yararlı olan AAV vektörlerinin toplanması büyüktür ve hızla büyümektedir.
Şu anda, NHP optogenetiği için bir AAV vektörünün yararı, in vivo test etmeyi gerektirmektedir. Bu gerçek, ilerlemenin önünde önemli bir engeldir. Hayvanlar idareli kullanılmalıdır ve tek bir hayvanda birden fazla vektörün test edilmesi, enjeksiyon bölgelerinin nöral mimariye göre makul bir şekilde konumlandırılmasını ve viral yayılmaya göre iyi ayrılmasını gerektirir. Doğru histolojik değerlendirme, enjeksiyonların mekansal ve hacimsel olarak doğru olmasını gerektirir. Daha önce farmakolojik ajanların fokal olarak verilmesi için kullanılan bir enjeksiyon tekniği 1,2,3,4, bu tür enjeksiyonları yapmak için uyarlanmış ve basitleştirilmiştir. Bu enjeksiyon tekniği ucuzdur, tek kullanımlık, sterilize edilebilir bileşenler kullanır, anestezi uygulanmış veya uyanık davranan maymunlarda kullanılabilir ve herhangi bir derinlikteki çeşitli beyin bölgelerini hedeflemek için kullanılabilir. Aşağıdaki protokol, tek kullanımlık bileşenlerin üretilmesi ve NHP beyninde enjeksiyon yapılması için adım adım prosedürleri açıklamaktadır. Tekniğin avantajları ve dezavantajları tartışılmaktadır.
Protokol
Tüm deneyler, Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak gerçekleştirilmiş ve Laboratuvar Hayvanları Kaynakları Enstitüsü ve Uluslararası Laboratuvar Hayvanları Bakımı Değerlendirme ve Akreditasyon Derneği tarafından önerilen asgari gereklilikleri aşmıştır. Tüm prosedürler Washington Üniversitesi Hayvan Bakım ve Kullanım Komitesi tarafından değerlendirilmiş ve onaylanmıştır (UW IACUC protokolü #4167-01). Bu çalışmaya beş sağlıklı makak (2 Macaca mulatta, 3 Macaca nemestrina; erkek. 4-11 yaş) katılmıştır. Tüm cerrahi işlemlerde steril aletler ve teknikler kullanıldı.
1. Kanül yapmak (Şekil 1A)
- Her parçanın hazırlanması
- Bir disk öğütücü ile hipodermik bir iğnenin ucunu (30 G, 13 mm uzunlukta) köreltin.
- Paslanmaz çelik bir tüpü (30 G, iç çap = 0,16 mm, dış çap = 0,31 mm) hedef beyin bölgesinin derinliğine göre uyarlanmış bir uzunluğa kesin (25 mm, serebral korteksin dorsal yüzeyini enjekte etmek için çok uygundur). Bir disk taşlama makinesi ile, kesme borusunun bir ucunu eğimlendirin ve diğerini pürüzsüzleştirin. Tüpün içini bir broş ile çapak alın.
- Politetrafloroetilen (PFTE) boruyu (iç çap = 0,23 mm ± 0,02 mm, duvar = 0,23 mm ± 0,02 mm, 1 mm 42 nL'ye karşılık gelir ± 7 nL sıvı) yüklenecek vektör çözeltisi miktarına uygun bir uzunluğa kadar kesin (1 μL vektör çözeltisi 24 mm boru kaplar). PTFE tüpünün her iki ucunu da körelmiş hipodermik iğnenin yerleştirilmesiyle parlayın.
- Körelmiş hipodermik iğneyi PTFE tüpünün bir ucuna yaklaşık 5 mm yerleştirin. Paslanmaz çelik borunun eğimsiz ucunu diğer uca yaklaşık 5 mm yerleştirin (Şekil 1A).
- Enjeksiyon öncesi test yapın. Filtrelenmiş suyu kanülün hipodermik iğne göbeğinden enjekte edin. Suyun eğimli paslanmaz çelik borudan uçtan çıktığını ve suyun her iki bağlantıdan da sızmadığını doğrulayın.
2. Anestezi uygulanan hayvanlar için enjeksiyon prosedürü
- Ameliyat hazırlığı
- Malzeme Tablosundaki prosedürleri kullanarak cerrahi aletleri ve malzemeleri sterilize edin.
- Gerekirse, derin beyin yapılarını hedeflemek için bir kafa MRG'si çekin (Şekil 2A).
- Ameliyattan hemen önce, hayvanları ketamin (10-15 mg / kg) ile sakinleştirin ve kas içinden antibiyotik (sefazolin) ve analjezikler (sürekli salınımlı buprenorfin ve meloksikam) uygulayın. Daha sonra, propofol safen veya sefalik damarlarda intravenöz (IV) kateter yoluyla verilir.
- Hayvanı entübe edin ve izofluran gazına geçirin. Stabil kalp atış hızı, kan basıncı, solunum hızı, gevşemiş iskelet kasları ve palpebral veya yoksunluk reflekslerinin yokluğu ile uygun anesteziyi onaylayın.
- Hayvanın kafasını tıraş edin. Kurumayı önlemek için kornealara yapay gözyaşı merhemi uygulayın.
- Enjeksiyon alanı hazırlama
- Hayvanın kafasını stereotaksik çerçeveye yerleştirin. Gazlı bez süngerlerle tıraş edilmiş cilde cerrahi ovma çözeltisi uygulayın, herhangi bir döküntüyü serbest bırakmak için hafif basınç uygulayın ve izopropil alkol ile durulayın. Bu işlemi üç kez tekrarlayın. Hayvanı steril bir federe örtü ile örtün. Cildi kesin ve kası yansıtın. Manipülatörü stereotaksik kola yerleştirin, hedef beyin bölgesini hedefleyecek şekilde konumlandırın ve kafatasındaki kraniyotomi pozisyonunu sterilize edilmiş bir kalemle işaretleyin.
- Stereotaksik manipülatörü çıkarın ve kraniyotomi yapın. İstenirse durayı kesin (örneğin, sulcal yer işaretlerini görselleştirmek için). Manipülatörü stereotaksik kola geri döndürün.
- Vektör çözeltisi yükleme (Şekil 1C)
- Vektör çözeltisini, kabarcıkları önleyerek P20 pipetörlü sterilize edilmiş bir PCR tüpüne yavaşça aktarın.
- Eğimli ucu aşağı bakacak şekilde dikey olarak yönlendirilmiş bir stereotaksik tutucuya bir kanül takın. Kanülün hipodermik iğne göbeğine 1 mL Luer-lock şırıngasını bağlayın.
- Kanülün eğimli ucunu vektör çözeltisine batırın.
NOT: Şırınga zaten takılı olmalıdır; Bu noktada eklenmesi, vektör çözeltisine kabarcıklar sokacaktır. - 1 ml'lik şırınga ile hafif negatif basınç uygulayarak çözeltiyi kanüle yükleyin. Çözelti ve hava arasındaki menisküsü görsel olarak izleyin.
- Vektör çözeltisi yüklendikten sonra, çözelti iğne göbeğine ulaşana kadar nazik negatif basınca devam edin. 1 mL şırıngayı çıkarın ve renkli mineral yağı hipodermik iğne göbeğinin içine enjekte edin.
NOT: Vektör çözeltisi ile net kesilmiş bir menisküs oluşturmak ve hava kabarcıklarını önlemek için yağ, iğne göbeğinin iç duvarı boyunca yavaşça enjekte edilmelidir. - Hipodermik iğne göbeğini, 3 yönlü Luer kilitli bir stopcock'un iki açık bağlantı noktasından birine takın.
NOT: Hipodermik iğnenin kapalı porta takılması, yağın arkasında istenmeyen hava basıncına neden olacaktır. - Hipodermik iğne göbeğine bağlı portu kapatın, 1 mL'lik bir şırıngayı hava ile doldurun ve diğer iki porttan birine takın. Son olarak, şırıngayı kanüle bağlamak için stopcock'un kalan portunu kapatın.
- Havayı yavaşça kanüle itin. Renkli yağ, PTFE borusundaki künt iğnenin ucunda göründüğünde, çözelti ile renkli yağ arasındaki havayı kontrol edin.
- Hava varsa, renkli yağı iğne göbeğine, geri döndürmek için şırıngaya negatif basınç uygulayın. Balonu çıkarın ve eğimli kanül ucunda bir damla vektör çözeltisi görünene kadar pozitif basınç uygulayın.
- Yağın arkasındaki istenmeyen hava basıncını serbest bırakmak için 1 mL şırıngayı çıkarın ve vektörün kanülden yerçekimi ile çıkmasını önlemek için durdurma horozunu kapatın.
- Enjeksiyon sırasında menisküsün hareketini ölçmek için PTFE borusuna plastik bir cetvel bantlayın (Şekil 1B, D, F).
- Hedef beyin bölgesine kanül yerleştirilmesi (Şekil 1B)
- Kanülü stereotaksik manipülatöre yapıştırın.
- Pompa borusunu (Luer kilitli bir konektörde sona eren) steril olmayan asistandan cerraha manuel olarak aktarın. Cerrah, Luer-lock konektörünü steril bir manşonun duvarından kavramalı, konektöre ikinci bir steril stopcock yapıştırmalı, manşonu sıkıca etrafına bantlamalı ve ardından manşonun yakasını düşürerek tüp boyunca yerçekimi ile uzanmasına izin vermelidir.
- Kanül borusuna bağlı stopcock'u hava pompasına bağlı stopcock'a bağlayın. Hava pompasını düşük basınca ayarlayın, açın ve yağ kanülden ilerleyene ve kanül ucunda bir vektör çözeltisi damlası görünene kadar basıncı artırın.
- Enjeksiyon sırasında menisküsün hareketini ölçmek için PTFE boru üzerindeki plastik cetvel konumunu ayarlayın.
- Kanülü stereotaksik manipülatör ile aşağı doğru sürün ve ucun yüzeye ulaştığı derinliği kaydedin (dura veya pia mater).
- Kanülü pist boyunca enjekte edilecek en derin bölgeye sürün. Yüzey çukurlaşacak. Yüzey korteksi enjekte ediliyorsa, kanülün yüzeye nüfuz ettiğini, cerrahi bir mikroskop veya varsa büyüteç ile görsel olarak onaylayın.
- Doku sıkışması nedeniyle yanlış hedeflemeyi en aza indirmek için, kanülü yavaşça (1 mm / dak), hızlı bir şekilde (0,5 mm / s) altta 1-5 dakika bekletin veya en derin enjeksiyon bölgesini 500 μm ile aşın ve ardından geri çekin.
- Enjeksiyon
- Vektör çözeltisinin 0,5 μL'sini elektrikli hava pompası ile 10-30 s'nin üzerinde enjekte edin. Renkli yağ ile PTFE tüpündeki vektör çözeltisi arasındaki menisküsü izleyerek enjeksiyon akışını onaylayın.
- 1 dakika bekleyin ve kanülü iz boyunca bir sonraki enjeksiyon bölgesine geri çekin.
- Son enjeksiyondan sonra, vektör efflux'ü önlemek için kanülü 10 dakika yerinde bırakın.
- Kanülü geri çekin ve biyolojik tehlike keskinliği kabına atın.
- İsteğe bağlı olarak, ölüm sonrası enjeksiyon bölgesinin tanımlanmasını kolaylaştırmak için vektör enjeksiyon bölgesinin yakınında az miktarda (≤1 μL) floresan mikroboncuk enjekte edin.
- Bu yordamı diğer konumlardaki diğer vektör çözümleri için istediğiniz gibi tekrarlayın (Şekil 2B).
- Ameliyat kapanışı
- Dura, kas ve cildi dikiştirin.
- Maymunu stereotaksik çerçeveden çıkarın ve tüm monitör kablolarını çıkarın.
- Maymunu izofluran anestezisinden çıkarın ve yutma refleksinin geri dönüşünü takiben ekstübe edin.
- Ameliyat sonrası tedavi sağlayın (3-5 gün meloksikam ve 7-10 gün sefaleksin). Sabit bir dik oturma pozisyonunu koruyana kadar hayvanı en az her 10 dakikada bir izleyin.
3. Uyanık davranan hayvanlar için cerrahi ve AAV vektör enjeksiyonu (Şekil 1D)
NOT: Tekniğin bir çeşidi, aşağıda açıklandığı gibi, uyanık, davranan maymunların beyinlerine enjeksiyon yapmak için kullanılabilir.
- Kayıt ile eşzamanlı enjeksiyon
- Enjeksiyon bölgesindeki elektriksel aktiviteyi kaydetmek için, kanülün dışını epoksi (alt ~ 15 mm) ve poliimid boru (kalan uzunluk) ile kaplayın. Epoksiyi kazıyarak uçtaki metali ortaya çıkarın (Enjektrode, Şekil 1F)2. Alternatif olarak, kanülü ve ayrı bir hücre dışı elektrotu yan yana, çift namlulu bir kılavuz tüpe yerleştirin (Çift namlulu kılavuz tüp, Şekil 1E).
- Hedef beyin bölgesine kanül yerleştirilmesi.
- Maymunu deney kabinine yerleştirin, başın hareketini kısıtlayın ve standart teknikler kullanarak kafatasına monte edilmiş kayıt odasını temizleyin.
- Mikro sürücüye bir kılavuz tüp sabitleyin. Enjeksiyon kanülünü kılavuz tüpe yerleştirin.
- Kanülü, uç kılavuz tüpten çıkıntı yapana kadar ilerletin.
- Stopcock'u elektrikli hava pompasına bağlayın. Doğru sistem fonksiyonunu doğrulamak için, hava pompasını kullanarak uçtan bir damla vektör çözeltisi itin ve yağ vektör çözeltisi menisküsünün hareketini onaylayın.
- Beyne tüp yerleştirilmesi sırasında hasardan korumak için kanülü ~ 5 mm kılavuz tüpe çekin. Kılavuz tüpü beyne yerleştirin.
- Kanülü mikrosürücüyü kullanarak enjekte edilecek bölgeye sürün. Hedef bölgeyi elektriksel kayıt (Şekil 2C) veya stimülasyon ile tanımlayın.
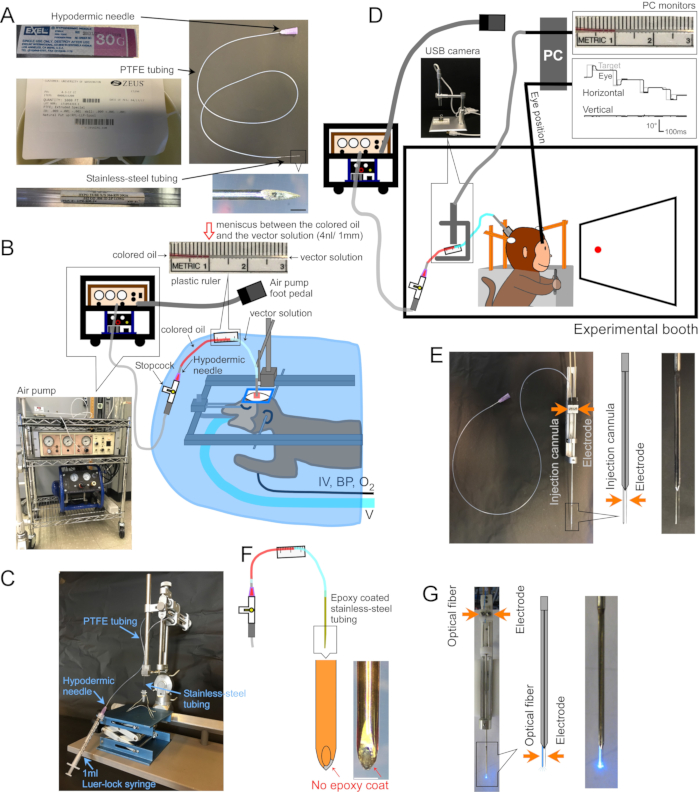
Resim 1: Ameliyat ve aparat kurulumu . (A) Enjeksiyon kanülü. Kanülün her bir kısmı belirtilmiştir. Sağ alttaki girinti: kanül ucunun büyütülmüş resmi, ölçek çubuğu: 500 μm. (B) Anestezi uygulanmış maymunlar için ameliyat kurulumu. Maymun, cerrahi bir örtünün altında stereotaksik bir çerçeveye yerleştirilir. Ventilatör (V), intravenöz hat (IV), kan basıncı monitörü (BP) ve oksijen doygunluk monitörü (O2) maymuna bağlanır. Enjeksiyon kanülü, stereotaksik bir mikromanipülatör kullanılarak hedef bölgeye yerleştirilir. Vektör çözeltisi, bir hava kompresörüne (sol alt giriş, mavi) bağlı bir elektrikli hava pompası (sol alt giriş, kahverengi) tarafından enjekte edilir. Enjeksiyon sırasında menisküsün renkli yağ (üst giriş, kırmızı) ve vektör çözeltisi (üst giriş, berrak) arasındaki hareketini ölçmek için PTFE borusuna plastik bir cetvel (üst giriş) bantlanır. (C) Vektör çözeltisini kanüle yüklemek için kurulum. (D) Bir deney kabininde vektör çözeltisinin enjeksiyonu sırasında bir maymun. Hayvanın başı üç stabilizasyon direği tarafından yerinde tutulur ve göz pozisyonu bir skleral arama bobini sistemi tarafından kaydedilir. Enjeksiyon kanülü tutulur ve bir mikro elektrot tutucu / sürücüsü kullanılarak hedef derinliğe sürülür. Enjeksiyon, renkli yağ ile vektör çözeltisi arasındaki menisküsün bir USB kamera aracılığıyla izlenmesiyle kontrol edilir (iç resim). (E) Çift namlulu kılavuz tüp enjeksiyonu. Çift namlulu kılavuz tüp tutucu/sürücü bir enjeksiyon kanülü ve bir mikro-elektrot tutar (bkz. (F) Enjektrod. Kanülün ucundaki metal, epoksi katın kazınmasıyla açığa çıkar, nöronlara elektriksel erişim sağlar (giriş, ölçek çubuğu: 500 μm). (G) Lazer stimülasyon kurulumu. Çift namlulu kılavuz tüp tutucu/sürücü hem optik fiber hem de mikro elektrot tutar (bkz. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
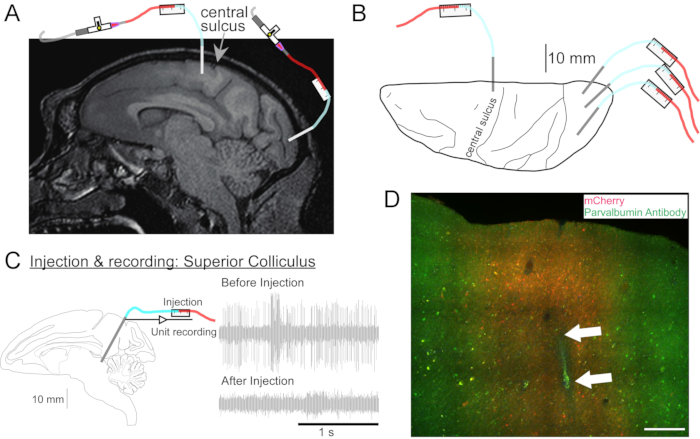
Şekil 2: AAV enjeksiyon bölgelerinin diyagramı . (A) Macaca nemestrina'nın primer motor korteksi ve primer görsel korteksindeki enjeksiyon bölgelerini gösteren beyin MR görüntüsünün Sagital bölümü. (B) Karşılık gelen Atlas plakasındaki dorsal yüzeyden, merkezi sulkus (birincil motor korteks) ve birincil görsel kortekse göre kanül yerleşimini gösteren görünüm. (C) Superior kollikulusa enjekte edilerek birim kaydı. Enjeksiyondan önce izole edilen bir ünite (sağ üst) enjeksiyondan sonra (sağ alt) kayboldu. (D) Enjeksiyon izi (beyaz oklar). Ölçek çubuğu: 500 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Histoloji için beyin dokusu işleme
- Transgen ekspresyonunu en üst düzeye çıkarmak için enjeksiyondan 6-8 hafta sonra bekleyin.
NOT: En uygun süre, deneyde kullanılan tam viral vektöre bağlıdır. - Transdüksiyon verimliliğini ve seçiciliği değerlendirmek için geleneksel histolojik teknikleri kullanarak beyni işleyin 5,6,7.
Sonuçlar
Burada açıklanan cerrahi enjeksiyon yöntemini kullanarak NHP beynine in vivo stereotaksik enjeksiyon yoluyla transgen ekspresyonunu göstermek için, farklı nöronal tip 8,9'da süper sarı floresan protein-2'nin (SYFP2) ekspresyonunu yönlendiren arttırıcıları içeren iki vektör seçildi. Viral vektörler PHP.eB kapsid10'da paketlendi, iyodiksantal santrifüjleme ile saflaştırıldı ve daha sonra qPCR ile ölçüldüğü gibi yüksek titreye (>1E13 viral genomlar / mL) konsantre edildi. Toplam 5 μL / iz enjeksiyon hacmi için korteks boyunca on iz boyunca on derinliğin her birine 0.5 μL'lik bir hacim enjekte edildi. Şekil 3A-C, PVALB alt sınıfına özgü AAV vektörü CN2045'in yetişkin bir erkek Macaca nemestrina'nın birincil görsel korteksine enjeksiyonundan 113 gün sonra anti-GFP immün boyama yoluyla SYFP2 ekspresyonunu göstermektedir. SYFP2 transgeni, kortikal derinliğe dağılmış çok sayıda piramidal olmayan nöronda sağlam bir şekilde tespit edilir ve çoğu SYFP2 eksprese eden nöronlar da PVALB7 için immünoreaktiftir. Şekil 3D, L5 nöron alt sınıfına özgü AAV vektörü CN2251'in enjeksiyonundan 64 gün sonra birincil motor korteksteki doğal SYFP2 ekspresyonunu göstermektedir. SYFP2 etiketli nöronların hepsi, katman 5 ve karakteristik kalın apikal dendritlerle sınırlı somata ile açık piramidal morfolojiye sahiptir. Bu veriler, NHP beynindeki neokortikal nöronların seçilmiş popülasyonlarında, AAV vektörlerini hedefleyen hücre tipi stereotaksik enjeksiyon yoluyla transgen ekspresyonunun kesin kontrolünü açıkça göstermektedir.
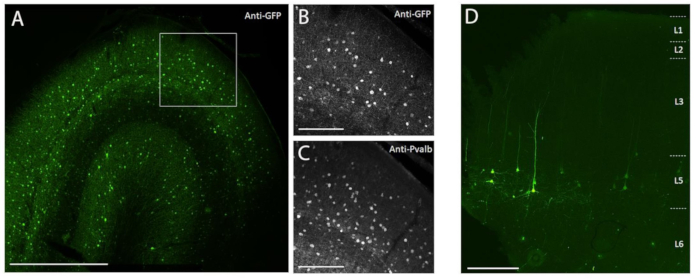
Şekil 3: NHP beynine enjekte edilen AAV vektörlerinin aracılık ettiği hücre tipine özgü SYFP2 ekspresyonu örneği . (A) PVALB alt sınıfına özgü bir AAV vektörünün enjeksiyonundan 113 gün sonra makak birincil görsel korteksten sabit bir bölümün epifloresan fotomikrografisi. Ölçek çubuğu: 1 mm. (B,C) A ile gösterilen kutulu bölgenin daha yüksek büyütme görüntüsü. (B) Anti-GFP sinyali. (C) Anti-PVALB sinyali. Ölçek çubukları: 250 μm. (D) Tabaka 5 ekstratelensefalik alt sınıfa özgü AAV vektörünün enjeksiyonundan 64 gün sonra makak primer motor korteksten sabit bir kesitte doğal SYFP2 floresansının epifloresan fotomikrografisi. Ölçek çubuğu: 500 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bu enjeksiyon tekniğinin nörofizyolojik ve davranışsal optogenetik manipülasyonlar için faydasını göstermek için, her biri farklı bir maymun (Macaca mulatta) üzerinde üç deney yapıldı. İlk deneyde (Şekil 4A-D), kanalrodopsin-2 transgenini (AAV1-hSyn1-ChR2-mCherry) taşıyan AAV vektörleri sol superior kollikulusa (SC) enjekte edildi. Vektör, toplam 12 μL için 19 derinlikte her 250 μm'de bir enjekte edildi. İkinci deneyde (Şekil 4E-G), nükleus reticularis tegmenti pontis'e (NRTP) 3 μL AAV1-hSyn-ArchT-EYFP çözeltisi enjekte edildi. Üçüncü deneyde (Şekil 4H-K), serebellar korteks6'ya 24 μL AAV9-L7-ChR2-mCherry çözeltisi enjekte edildi. Her enjeksiyondan altı ila sekiz hafta sonra, bir optik fiber ve bir tungsten elektrodu, çift namlulu bir kılavuz tüp aracılığıyla beyne yerleştirildi (Şekil 1G).
Şekil 4B, bir SC nöronunun mavi ışığa (450 nm) tepkisini göstermektedir. 40 mW'daki sürekli ışık (1,2 sn) bir dizi ardışık aksiyon potansiyeli üretti (Şekil 4B, üstte). 1-ms süreli ışık darbeleri 40 mW'ta aksiyon potansiyellerini uyandıramadı (Şekil 4B, orta) ancak 2,7 ± 0,6 ms gecikme süresiyle test edilen diğer tek güç seviyesi olan 160 mW'da aksiyon potansiyellerini güvenilir bir şekilde uyandırdı (Şekil 4B, alt). Bir darbe treni (160 mW, frekans: 300 Hz, görev döngüsü: %15, süre: 300-ms), ortalama 97 ± 32 ms gecikme, ortalama 10.4° genlik ve ortalama 47° açı (yukarı ve sağa; Şekil 4C).
SC11,12'nin eşik altı elektriksel stimülasyonunu kullanarak sakkad kazancını modifiye eden çalışmalarla tutarlı olarak, SC'nin 15 °, 18 ° ve 20 ° sol ve aşağı doğru (225 °) sonra optik stimülasyonu sakkad kazancını kademeli olarak azaltmıştır (Şekil 4D). Kazançtaki bu azalma, adaptasyon öncesi kazanca (siyah daireler) geri dönmek için ~ 250 deneme (yeşil daireler) gerektirdi ve uzun vadeli plastisitedeki temelini doğruladı.
İkinci deneyde (Şekil 4E), NRTP'den serebellar korteksin okülomotor vermisine (OMV) (lobüller VIc ve VII) yosunlu lif projeksiyonu optik olarak bastırıldı. Şekil 4F, OMV'deki (iç kısım) floresan etiketli yosunlu lifleri ve rozetleri göstermektedir. Sarı lazer ışığı (589 nm) optik fiber aracılığıyla OMV'ye iletildi ve Purkinje hücre aktivitesini kaydetmek için yakındaki bir tungsten elektrodu kullanıldı. Şekil 4G, NRTP projeksiyonlarının (gri) ve sonra (turuncu) optogenetik inaktivasyonundan önce (gri) ve sonra basit ani aktivite göstermektedir (Şekil 4G, üstte). İnaktivasyondan önce, Purkinje hücresi 12 ° sağa doğru sakkadlar için çift patlama paterni sergiledi (Şekil 4G, orta, gri). Etkisiz hale getirme sırasında, atış hızı azaldı ve bir patlama-duraklama düzenine dönüştü (Şekil 4G, orta, turuncu). Bu iki tepki paterninin karşılaştırılması, Purkinje hücrelerine yosunlu lif girişinin ikinci patlamayı sürerek sakkad yavaşlama fazını etkilediğini göstermektedir (Şekil 4G, orta, yeşil). Sağa doğru sakkadların değişkenliği, optogenetik inaktivasyon sırasında, sakkad metriklerindeki denemeden denemeye değişkenliğin bir kısmının yosunlu lifler tarafından taşınan sinyallerdeki değişkenlikten kaynaklandığı fikriyle tutarlı olarak azaltılmıştır (Şekil 4G, alt, turuncu).
Üçüncü deneyde (Şekil 4H), OMV'nin Purkinje hücreleri optogenetik olarak uyarıldı (Şekil 4I). Kısa ışık darbelerinden oluşan bir tren (1.5-ms darbeler, 65 mW, 50 Hz), izole bir Purkinje hücresinin basit ani yükselme aktivitesini arttırdı (Şekil 4J, üstte). Bireysel 1,5 ms'lik ışık darbeleri sıklıkla >1 basit bir ani yükselme uyandırdı (Şekil 4J, altta). Bir sakkad (10-ms ışık darbesi, 60 mW) sırasında meydana gelecek şekilde zamanlanmış optogenetik basit spike aktivasyonu, artan sakkad genliği (Şekil 4K), Purkinje hücrelerinin okülomotor patlama jeneratörü üzerindeki inhibitör rolünü doğrulamaktadır.
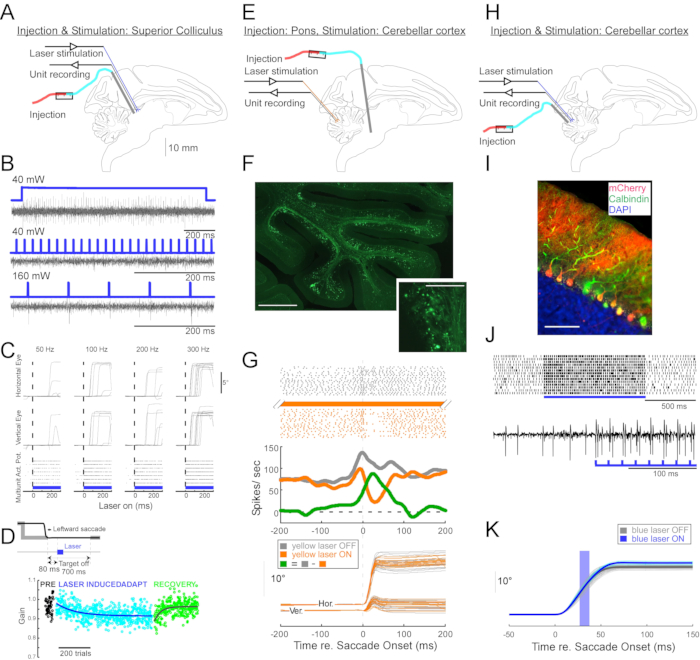
Şekil 4: Uyanık maymunlarda yapılan üç optogenetik deneyin özeti. (A-D) Deney 1, pan-nöronal uyarım: viral enjeksiyon, lazer stimülasyonu ve ünite kaydı superior colliculus'ta (A) gerçekleştirildi. (B) Lazer stimülasyonu ile uyarılan temsili birim aktivitesi. (C), Göz hareketlerinin yatay (üst) ve dikey (orta) bileşenleri ve lazer stimülasyonu ile uyarılan birim aktivitenin (alt) raster grafiği. (D) Lazer stimülasyonu ile indüklenen sakkad adaptasyonunun temsili bir oturumu. Stimülasyon (100 0.5-ms lazer darbesi) her sakkaddan (giriş) sonra 80-ms verildi. Sakkad kazancı (sakkad genliği / hedef genliği) denemeler boyunca kademeli olarak azalmıştır. (E-G) Deney 2, yola özgü inhibisyon: çekirdek reticularis tegmenti pontis'e viral bir vektör enjekte edildi ve okülomotor vermiste (E) lazer stimülasyonu ve birim kaydı yapıldı. (F) Okülomotor vermisin etiketli yosunlu lifleri (ölçek çubuğu: 1 mm) ve rozetlerini (giriş, ölçek çubuğu: 100 μm) gösteren histolojik kesiti. (G) Purkinje hücre aktivitesi (üst: raster, orta: ortalama ateşleme hızı) ve lazer stimülasyonlu ve lazer stimülasyonsuz görsel olarak yönlendirilmiş sakkadların (altta) yörüngeleri. Gri: denemelerde lazer, turuncu: denemelerde lazer, yeşil: gri ve turuncu arasındaki fark. (H-K) Deney 3, hücre tipine özgü aktivasyon: viral enjeksiyon, lazer stimülasyonu ve birim kaydı okülomotor vermiste (H) gerçekleştirildi. (I) Okülomotor vermisin etiketli Purkinje hücrelerini gösteren histolojik kesiti. Ölçek çubuğu: 100 μm. (J) Lazer stimülasyonu ile uyarılan bir Purkinje hücresinin basit başak aktivitesi. Üst: 14 denemeden raster arsa. Alt: Tek bir temsili denemeden voltaj izleme. (K) Lazer stimülasyonlu ve lazer stimülasyonsuz görsel olarak yönlendirilmiş sakkadların yörüngeleri. Sakatlar sırasında 10 ms'lik bir ışık darbesi sakkad genliklerini arttırdı. Lazerle yapılan denemelerde bireysel sakkad yörüngeleri (camgöbeği) ve ortalamaları (mavi). Lazerle kapatma denemelerinde bireysel sakkad yörüngeleri (açık gri) ve ortalamaları (koyu gri). Işık dalga boyu Deney 1 ve 3'te 450 nm ve Deney 2'de 589 nm idi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
NHP optogenetiğindeki ilerlemeler, doğru, güvenilir intrakraniyal enjeksiyon yöntemlerine ihtiyaç duymuştur. Bu raporda açıklanan yöntemin avantajları, ucuz olması, sterilize edilebilir ve tek kullanımlık bileşenler kullanması ve herhangi bir derinlikteki çeşitli beyin alanlarını hedefleme yeteneğine sahip olmasıdır. Ayrıca, hava valfinin kontrol edilebildiği hız sayesinde enjeksiyon hızının ve hacminin kontrol edilmesini sağlar. Hava basıncı, bir tıkanıklığı gidermek için geçici olarak arttırılabilir ve daha sonra sürekli basınç tarafından üretilecek daha sonra aşırı enjeksiyondan kaçınmak için hızlı bir şekilde azaltılabilir. Tek kullanımlık bileşenler, enjeksiyon bölgeleri arasında çapraz kontaminasyon riskini azaltır.
Bu enjeksiyon protokolündeki kritik adımlar, yüksek kaliteli kanüller inşa etmeyi, kabarcıkları sokmadan yüklemeyi ve birbirine çok yakın olmayan enjeksiyon bölgelerini seçmeyi içerir. 1 cm ≥ enjeksiyonlar genellikle örtüşmeyen bölgeleri dönüştürür, ancak bu sezgisel yöntem viral serotip, titre, promotör, hacim, hedef ve tespit yöntemine bağlıdır. Doğrudan bağlı olmayan enjeksiyon bölgelerinin seçilmesi, aksonlar boyunca opsin kaçakçılığının ve bazı AAV serotiplerinin retrograd transdüksiyon eğiliminin yarattığı potansiyel karışıklıkları önler.
Yöntem, anestezi altındayken ve stereotaksik bir çerçevede (Şekil 3) veya uyarı ve kafa sabitken (Şekil 4) NHP'leri enjekte etmek için kullanılabilir. Birincisi, enjeksiyonların stereotaksik koordinatlarda hedeflenmesine izin verme avantajına sahiptir ve akut bir durotomi yoluyla kanül penetrasyonunun görsel olarak doğrulanmasına izin verir (uyanık bir maymunda dura'yı kesmek, kronik bir kraniyotomi yoluyla, enfeksiyon riskini artırır). İkinci yaklaşım, hayatta kalma ameliyatlarının sayısını ve dolayısıyla hayvana olan stresi azaltma, davranış sırasında elektrofizyolojik kayıtlarla uyumlu olma ve enjeksiyon sonrası deneyler için optik fiberler eklemek için kullanılan aynı koordinat çerçevesini ve enstrümantasyonunu kullanma avantajlarına sahiptir. Uyanık maymunlarda enjeksiyon tekniği, yapay dura13,14,15 yoluyla enjeksiyon yapılarak daha da geliştirilebilir. Bu, enjeksiyon bölgelerinin ve başarılı transdüksiyonu gösteren doku floresansının doğrudan görselleştirilmesinin ek avantajlarını sağlayacaktır.
Son zamanlarda, AAV vektörlerini büyük NHP kortikal bölgelerine eşit olarak iletmek için çok kanallı bir enjeksiyon cihazı geliştirilmiştir16. Benzer sonuçlar konveksiyonla güçlendirilmiş teslimat17,18 kullanılarak elde edilebilir. Bu yöntemler, önemli bir hedef olan ancak yöntemimizin ulaşmayı amaçladığı mekansal hassasiyetten farklı olan iletim yayılımını en üst düzeye çıkarmayı amaçlamaktadır.
Başka bir alternatif yöntem, AAV vektörlerini, bir ucunda keskin bir uca eğimli ve diğer 5,6'da bir Hamilton şırıngasına tutturulmuş borosilikat borudan enjekte etmektir. Bu yöntemin, bu makalede açıklanan yöntemle birçok ortak noktası vardır. Viral vektör bir boru uzunluğunda tutulur, virüsün arkasındaki borudaki boşluk boyalı yağ ile doldurulur ve vektörün akışı yağ vektörü menisküsün hareketi ile izlenir. Bu alternatif teknik daha az ekipman ve hazırlık gerektirir, ancak eğimli uçtan borosilikat boruya negatif basınçla yağ çekilmesini ve vektörün daha sonra aynı yoldan yüklenmesini gerektirir. Bu kaçınılmaz olarak beyne verilen yağ izleriyle sonuçlanır. Ek olarak, deneyimlerimize göre, borosilikat boru, eğimli olduğunda bile duraya nüfuz etmek için ~ 350 μm çapa sahip olmalıdır ve bu nedenle bu makalede açıklanan daha ince metal kanülden daha büyük mekanik hasara neden olur (Şekil 2D). 30 G boru kullanılmıştır, çünkü kritik burkulma yükü 1-10 cm uzunluğa rağmen dura penetrasyonuna aracılık edecek kadar yüksektir, çünkü PTFE borusuna sıkıca oturur ve nadiren tıkanır. 33 G boru tıkanır ve daha kolay bükülür ve PTFE boru ile eşleşmesi daha zordur. 36 G boru, NHP dura mater'e nüfuz etmek için yeterince sert değildir.
Başka bir alternatif enjeksiyon tekniği, hava pompasının çıkışını vektör yüklü, çekilmiş cam pipet19'un arkasına bağlamaktır. Vektör, pompadan gelen doğrudan, aralıklı hava basıncı ile pipet ucundan zorlanır ve yağ ihtiyacını ortadan kaldırır. Yukarıda açıklanan tek tüp yöntemine benzer şekilde, menisküs ve kanül ucu arasında herhangi bir maddi bağlantı bulunmaması, sızıntı riskini azaltır. Bununla birlikte, cam pipetlerin keskin konik ve hassas uçları, NHP dura'ya nüfuz etmelerini veya derin yapıları hedeflemelerini önler.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma WaNPRC / ITHS P51OD010425 (JTT), Ulusal Sağlık Enstitüsü (NIH) EY023277 (YK için R01), EY030441 (GH için R01), MH114126 (RF1'den JTT'ye, Boaz Levi, Ed Lein'e), MH120095 (JTT ve GH için UG3), EY028902 (RS için R01) tarafından desteklenmiş ve NIH hibeleri OD010425 (WaNPRC için P51) ve Washington Üniversitesi Telif Hakkı Araştırma Fonu A148416 tarafından mümkün kılınmıştır. Yazarlar, histoloji için Yasmine El-Shamayleh ve Victoria Omstead'e, viral vektör klonlaması için Refugio Martinez'e ve NHP beyin dokusu işleme konusunda yardım için John Mich'e teşekkür etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment: Stereotaxic set | |||
| Item | |||
| Allen keys | BONDHUS | 10936 | STERRAD |
| Cannula holder | KOPF | 1770 | STERRAD |
| Carrier (manipulator) | KOPF | 1404 | STERRAD |
| Carrier platform | KOPF | 1430 | NA |
| Carrier stand | KOPF | 1449 | STERRAD |
| Eye, ear, mouth bars | KOPF | 1430 | NA |
| Stereotaxic base | KOPF | 1210 | NA |
| Equipment: Cannula | |||
| Item | |||
| 1 mL Luer-lock syringes | BD | 309628 | NA (sterilized package) |
| Cannulas* | (homemade - see below) | NA | steam (autoclave) |
| Colored oil** | (homemade - see below) | NA | NA |
| Elevator (for tube rack) | Cole-Parmer | UX-08057-10 | STERRAD |
| Filter tip | Genesee Scientific | 23-404 | NA (sterilized package) |
| Fluorescent microbeads | Lumafluor | R170 | NA |
| P20 pipetman | Gilson | FA10003M | NA |
| PCR tubes | Olympus Plastics | 22-161 | STERRAD |
| Stopcock | Cole-Parmer | 3060004 | STERRAD |
| Tube rack | homemade | NA | STERRAD |
| Vector solution | (homemade) | NA | NA |
| Equipment: Electric air pump set | |||
| Item | |||
| Electric air pump | World Precision Instruments | PV830 | NA |
| Foot pedal | World Precision Instruments | 3260 | NA |
| Tube cover | EZ Drape | A400-1000 | NA (sterilized package) |
| Equipment: General surgery tools | |||
| Item | |||
| Beaker | MEDLINE | azlon | STERRAD |
| Burrs | STRYKER | 277-10-235 | STERRAD |
| Double pronged tissue pick | Fine Science Tools | 18067-11 | STERRAD |
| Drapes | MEDLINE | DYNJP3004 | NA (sterilized package) |
| Dressing forceps | Miltex | 6-118 | STERRAD |
| Drill | STRYKER | Q9R-5400 | NA |
| Drill bits | STRYKER | 277-82-87 | STERRAD |
| Gauze | MEDLINE | NON26334 | NA (sterilized package) |
| Hemostatic mosquito forceps | Miltex | 7-2, 7-4 | STERRAD |
| Light handles | SKYTRON | Stellar XL | STERRAD |
| Needle hodler | Miltex | 8-2 | STERRAD |
| Periosteal elevator | Miltex | 18-1968 | STERRAD |
| Rongeurs | Miltex | 17-4800 | STERRAD |
| Saline | BAXTER | 2F7122 | STERRAD |
| Scalpel | Bard-Parker | 372610 | STERRAD |
| Scissors | Miltex | 5-12, 5-114 | STERRAD |
| Senn retractors | Miltex | 28065 | STERRAD |
| Sterile gloves | MEDLINE | Triumph Micro | NA (sterilized package) |
| Suction | medela | 200-4869 | NA |
| Suction tip | MEDLINE | DYNDFR12S | NA (sterilized package) |
| Suction tube | COVIDEN | 8888301614 | NA (sterilized package) |
| Surgical gowns | MEDLINE | DYNJP2002S | NA (sterilized package) |
| Surgical pens & ruler | MEDLINE | DYNJSM03 | NA (sterilized package) |
| Suture | COVIDEN | SL-635 | NA (sterilized package) |
| Tissue forceps | Miltex | 6-114 | STERRAD |
| Towel clamps | Miltex | 7-504 | STERRAD |
| Wood swabs | MEDLINE | MDS202095 | NA (sterilized package) |
| Equipment: *cannulas | |||
| Item | |||
| Hypodermic needle | EXELINT INTERNATIONAL | 26437 | NA (sterilized package) |
| Stainless steel tube | K-TUBE | K30R | NA |
| PTFE tube | ZEUS | 216200 | NA |
| Equipment: **colored oil | |||
| Item | |||
| Liquid Candle Dye Concentrate | PremiumCraft | Red/Pink | NA |
| Mineral oil | Vi-Jon | S0883 | NA |
| STERRAD: low-temperature hydrogen peroxide gas plasma |
Referanslar
- Kojima, Y., Robinson, F. R., Soetedjo, R. Cerebellar fastigial nucleus influence on ipsilateral abducens activity during saccades. Journal of Neurophysiology. 111 (8), 1553-1563 (2014).
- Kojima, Y., Soetedjo, R. Elimination of the error signal in the superior colliculus impairs saccade motor learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8987-8995 (2018).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effects of GABA agonist and antagonist injections into the oculomotor vermis on horizontal saccades. Brain Research. 1366, 93-100 (2010).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effect of inactivation and disinhibition of the oculomotor vermis on saccade adaptation. Brain Research. 1401, 30-39 (2011).
- De, A., El-Shamayleh, Y., Horwitz, G. D. Fast and reversible neural inactivation in macaque cortex by optogenetic stimulation of GABAergic neurons. eLife. 9, 52658(2020).
- El-Shamayleh, Y., Kojima, Y., Soetedjo, R., Horwitz, G. D. Selective optogenetic control of Purkinje cells in monkey cerebellum. Neuron. 95 (1), 51-62 (2017).
- Mich, J. K., et al. Functional enhancer elements drive subclass-selective expression from mouse to primate neocortex. Cell Reports. 34 (13), 108754(2021).
- Graybuck, L. T., et al. Enhancer viruses for combinatorial cell subclass-specific labeling. Neuron. (21), 00159(2020).
- Michel, J., Benninger, D., Dietz, V., van Hedel, H. J. Obstacle stepping in patients with Parkinson's disease. Complexity does influence performance. Journal of Neurology. 256 (3), 457-463 (2009).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Kaku, Y., Yoshida, K., Iwamoto, Y. Learning signals from the superior colliculus for adaptation of saccadic eye movements in the monkey. Journal of Neuroscience. 29 (16), 5266-5275 (2009).
- Soetedjo, R., Fuchs, A. F., Kojima, Y. Subthreshold activation of the superior colliculus drives saccade motor learning. Journal of Neuroscience. 29 (48), 15213-15222 (2009).
- Kleinbart, J. E., et al. A modular implant system for multimodal recording and manipulation of the primate brain. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual International Conference. 2018, 3362-3365 (2018).
- Arieli, A., Grinvald, A., Slovin, H. Dural substitute for long-term imaging of cortical activity in behaving monkeys and its clinical implications. Journal of Neuroscience Methods. 114 (2), 119-133 (2002).
- Ruiz, O., et al. Optogenetics through windows on the brain in the nonhuman primate. Journal of Neurophysiology. 110 (6), 1455-1467 (2013).
- Fredericks, J. M., et al. Methods for mechanical delivery of viral vectors into rhesus monkey brain. Journal of Neuroscience Methods. 339, 108730(2020).
- Bankiewicz, K. S., et al. Convection-enhanced delivery of AAV vector in parkinsonian monkeys; in vivo detection of gene expression and restoration of dopaminergic function using pro-drug approach. Experimental Neurology. 164 (1), 2-14 (2000).
- Yazdan-Shahmorad, A., et al. Widespread optogenetic expression in macaque cortex obtained with MR-guided, convection enhanced delivery (CED) of AAV vector to the thalamus. Journal of Neuroscience Methods. 293, 347-358 (2018).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır