Method Article
在麻醉和清醒行为的非人灵长类动物大脑中注射用于光遗传学的AAV载体
摘要
正如目前所实施的那样,非人灵长类动物的光遗传学需要将病毒载体注射到大脑中。最佳注射方法应该是可靠的,并且对于许多应用,能够靶向任意深度的单个位点,这些位点在尸检组织学中很容易明确地识别出来。提出了一种具有这些特性的注射方法。
摘要
光遗传学技术已经彻底改变了神经科学研究,并准备为神经基因治疗做同样的事情。然而,光遗传学的临床应用要求在动物模型中证明安全性和有效性,最好是在非人灵长类动物(NHP)中,因为它们与人类的神经学相似。对神经科学和医学可能有用的候选载体数量庞大,目前还没有高通量方法来测试这些载体。因此,需要一种技术来将病毒载体多次在空间和体积上准确的注射到NHP大脑中,这些载体可以通过死后组织学明确识别。这里描述的是这样的方法。注射插管由耦合的聚四氟乙烯和不锈钢管制成。这些插管可高压灭菌、一次性使用,并且具有低最小负载体积,使其成为注射昂贵、高度浓缩的病毒载体溶液的理想选择。惰性红色矿物油填充死区,并与载体溶液形成可见的弯月面,从而可以瞬时准确地测量注射速率和体积。油被装载到套管的后部,降低了与载体共同注射的风险。插管可以在10分钟内加载,注射可以在20分钟内进行。该程序非常适合注射到清醒或麻醉的动物中。当用于递送高质量的病毒载体时,该程序可以产生光遗传蛋白的稳健表达,从而可以对非人灵长类中的神经活动和行为进行光学控制。
引言
非人灵长类动物(NHP)的光遗传学通常涉及将病毒载体直接注射到大脑中。一类非常适合此应用的载体是基于腺相关病毒(AAV)。这些载体由围绕单链DNA基因组的蛋白质衣壳组成,而单链DNA基因组又由启动子,视蛋白基因以及其他可选的蛋白质编码和基因调控元件组成。分子克隆的进步促进了这些组分的操纵和组合,以开发新的载体。因此,对NHP光遗传学可能有用的AAV载体的收集量很大,并且增长迅速。
目前,AAV载体在NHP光遗传学中的实用性需要在体内进行测试。这一事实是取得进展的实质性障碍。必须谨慎使用动物,在单个动物中测试多种载体要求注射部位相对于神经结构进行明智的定位,并且相对于病毒传播进行良好的分离。准确的组织学评估要求注射在空间和体积上准确。以前用于局部输送药剂1,2,3,4的注射技术被调整和简化为进行这种注射。这种注射技术价格低廉,使用一次性、可消毒的组件,可用于麻醉或清醒行为的猴子,并可用于靶向任何深度的不同大脑区域。以下协议描述了制造一次性组件和在 NHP 大脑中进行注射的分步程序。讨论了该技术的优缺点。
研究方案
所有实验均按照《实验动物护理和使用指南》进行,并超过了实验动物资源研究所和国际实验动物护理评估和认证协会建议的最低要求。所有程序均由华盛顿大学动物护理和使用委员会评估和批准(UW IACUC协议#4167-01)。五只健康的猕猴(2只 猕猴,3只 猕猴;雄性,4-11岁)参加了这项研究。所有外科手术都使用无菌器械和技术。
1. 制作套管(图 1A)
- 每个部分的准备
- 用圆盘研磨机钝化皮下注射针头(30 G,13 mm长)的尖端。
- 将一根不锈钢管(30 G,内径 = 0.16 mm,外径 = 0.31 mm)切割成适合目标大脑区域深度的长度(25 mm 非常适合注射大脑皮层的背表面)。用圆盘研磨机将切割管的一端倾斜并平滑另一端。用拉刀对管子内部进行毛刺。
- 将聚四氟乙烯 (PFTE) 管(内径 = 0.23 mm ± 0.02 mm,壁 = 0.23 mm ± 0.02 mm,1 mm 对应于 42 nL ± 7 nL 流体)切割成适合要加载的载体溶液量的长度(1 μL 载体溶液占用 24 mm 管)。通过插入钝的皮下注射针头来激活PTFE管的两端。
- 将钝的皮下注射针头插入PTFE管的一端约5毫米。将不锈钢管的未斜面端插入另一端约5 mm(图1A)。
- 执行注射前测试。通过套管的皮下注射针轮注入过滤水。确认水从尖端流出斜面不锈钢管,并且水不会从任一连接处泄漏。
2. 麻醉动物注射程序
- 手术准备
- 使用 材料表中的程序对手术器械和用品进行消毒。
- 如果需要,进行头部MRI以针对深部脑结构(图2A)。
- 手术前立即用氯胺酮(10-15mg / kg)镇静动物,并肌内注射抗生素(头孢唑林)和镇痛药(缓释丁丙诺啡和美洛昔康)。然后,通过静脉注射 (IV) 导管在隐静脉或头静脉中输送丙泊酚。
- 插管动物并将其转变为异氟醚气体。通过稳定的心率、血压、呼吸频率、骨骼肌松弛以及无睑反射或戒断反射来确认适当的麻醉。
- 剃掉动物的头。在角膜上涂抹人工泪膏以防止干燥。
- 注射区准备
- 将动物的头部放在立体定位框架中。用纱布海绵将手术磨砂液涂抹在剃光的皮肤上,轻轻按压以释放任何碎屑,然后用异丙醇冲洗。重复此过程三次。用无菌开窗窗帘覆盖动物。切开皮肤并反射肌肉。将机械手放在立体定位臂上,将其定位以瞄准目标大脑区域,并用无菌笔在颅骨上标记开颅位置。
- 取下立体定位操纵器并进行开颅手术。如果需要,切开硬脑膜(例如,可视化脑沟标志)。将机械手返回到立体定位臂。
- 载体溶液加载(图1C)
- 用P20移液器将载体溶液轻轻转移到灭菌的PCR管中,避免气泡。
- 将套管连接到垂直方向的立体定位支架上,斜面尖端朝下。将 1 mL 鲁尔锁注射器连接到套管的皮下注射针轮毂。
- 将套管的斜尖浸入矢量溶液中。
注意:注射器应该已经连接;此时连接它会将气泡引入矢量溶液中。 - 用1ml注射器施加温和的负压,将溶液装入套管中。直观地跟踪溶液和空气之间的弯月面。
- 加载矢量溶液后,继续温和的负压,直到溶液到达针轮毂。取出 1 mL 注射器并将有色矿物油注入皮下注射针轮毂。
注意:应沿针毂内壁缓慢注入油,以与矢量溶液形成清晰的弯月面,并避免气泡。 - 将皮下注射针轮毂连接到 3 向鲁尔锁旋塞阀的两个开放端口之一。
注意:将皮下注射针头连接到关闭的端口会在油后面引入不需要的气压。 - 关闭连接到皮下注射针头集线器的端口,用空气填充 1 mL 注射器,并将其连接到其他两个端口之一。最后,关闭旋塞阀的剩余端口,将注射器连接到套管。
- 慢慢地将空气推入套管。一旦有色油出现在PTFE管中的钝针尖端,请检查溶液和有色油之间的空气。
- 如果存在空气,则对注射器施加负压,将彩色油返回到针轮毂中。去除气泡并施加正压,直到在斜面套管尖端可见一滴矢量溶液。
- 取下 1 mL 注射器以释放油后面不需要的气压,并关闭旋塞阀以防止载体因重力而离开套管。
- 将塑料尺子粘在PTFE管上,以测量注射过程中弯月面的运动(图1B,D,F)。
- 套管插入目标大脑区域(图1B)
- 将套管固定在立体定位操纵器上。
- 手动将泵管(终止于鲁尔锁连接器)从非无菌助手转移到外科医生。外科医生应通过无菌套管的壁抓住鲁尔锁接头,将第二个无菌旋塞阀固定在连接器上,将套管紧紧地粘在其周围,然后放下套筒的衣领,使其在重力作用下沿管子延伸。
- 将连接到套管的旋塞阀连接到连接到气泵的旋塞阀。将气泵设置为低压,将其打开并增加压力,直到油通过套管并在套管尖端可见一滴矢量溶液。
- 调整PTFE管上的塑料尺位置,以测量注射过程中弯月面的运动。
- 用立体定位操纵器向下驱动套管,并记录尖端到达表面(硬脑膜或软脑膜)的深度。
- 将套管驱动到最深的部位,沿着轨道注射。表面会凹陷。如果注射表面皮层,请用手术显微镜或放大镜(如果有)目视确认套管已穿透表面。
- 为了尽量减少由于组织压迫引起的误靶,缓慢(1 mm / min),快速(0.5 mm / s)驱动套管,在底部等待1-5分钟,或超过最深的注射部位500μm然后缩回。
- 注射
- 用电动气泵在 10-30 秒内注入 0.5 μL 载体溶液。通过跟踪有色油和PTFE管中的载体溶液之间的弯月面来确认注射流量。
- 等待1分钟,然后将套管缩回轨道上的下一个注射部位。
- 最后一次注射后,将套管留在原位10分钟,以避免向量外排。
- 收回套管并将其丢弃在生物危害锐器容器中。
- 可选地,在载体注射部位附近注入少量(≤1μL)荧光微珠,以方便尸检后识别注射部位。
- 根据需要对其他位置的其他矢量溶液重复此过程(图2B)。
- 手术结束
- 缝合硬脑膜、肌肉和皮肤。
- 从立体定位框架中取出猴子并卸下所有显示器电缆。
- 将猴子从异氟烷麻醉中取出,并在吞咽反射恢复后拔管。
- 提供术后治疗(美洛昔康3-5天和头孢氨苄7-10天)。每 10 分钟至少监测一次动物,直到它能够保持稳定的直立坐姿。
3.清醒行为动物的手术和AAV载体注射(图1D)
注意:该技术的一种变体可用于将注射到清醒的行为猴子的大脑中,如下所述。
- 同时注射和记录
- 为了记录注射部位的电活动,请在套管的外部涂上环氧树脂(底部~15毫米)和聚酰亚胺管(剩余长度)。通过从尖端刮下环氧树脂来露出尖端的金属(注射, 图1F)2。或者,将套管和单独的细胞外电极并排插入双管导管(双管导管, 图1E)。
- 套管插入目标大脑区域。
- 将猴子放在实验室中,限制头部的移动,并使用标准技术清洁安装在颅骨上的记录室。
- 将导管固定到微型驱动器上。将注射套管插入导管。
- 推进套管,直到尖端从导管突出。
- 将旋塞阀连接到电动气泵。要确认系统功能正常,请使用气泵从尖端推一滴载体溶液,并确认油载体溶液弯月面的移动。
- 将套管~5毫米撤回导管中,以保护其在管插入大脑期间免受损坏。将导管插入大脑。
- 使用微型驱动器将套管驱动到要注射的部位。通过电记录(图2C)或刺激确定目标部位。
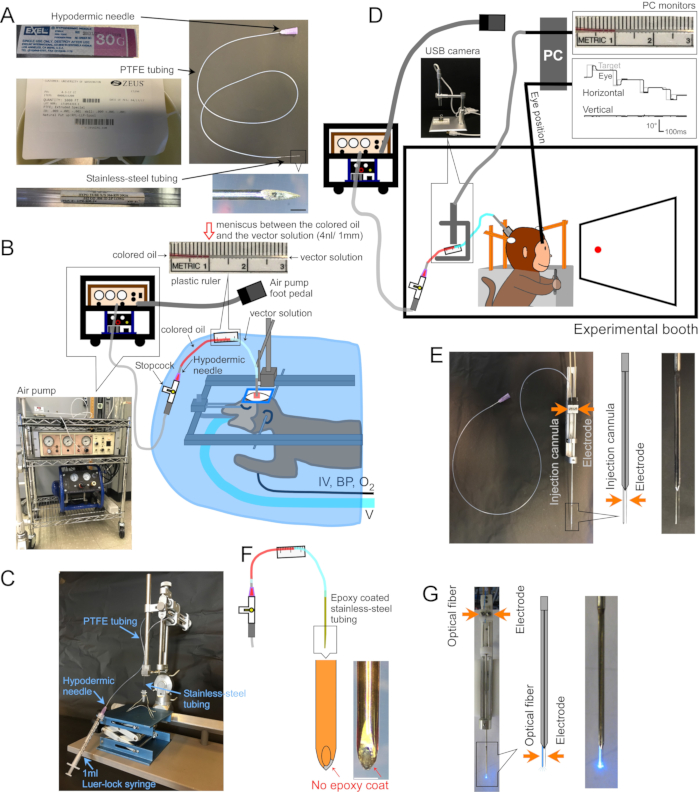
图1:手术和器械的设置 。 (A)注射套管。指示套管的每个部分。右下角插图:套管尖端的放大图片,比例尺:500 μm。 (B)麻醉猴的手术设置。将猴子放置在手术单下的立体定位框架中。呼吸机(V),静脉输液管(IV),血压监测仪(BP)和氧饱和度监测仪(O2)连接到猴子。使用立体定位显微操纵器将注射套管插入目标区域。矢量溶液由电动气泵(左下插图,棕色)与空气压缩机(左下插图,蓝色)耦合注入。将塑料尺(顶部插图)粘在PTFE管上,以测量注射过程中有色油(顶部插图,红色)和矢量溶液(顶部插图,透明)之间的弯月面运动。(C)设置以将矢量溶液加载到套管中。(D)一只猴子在实验室注射载体溶液。动物的头部由三个稳定柱固定到位,眼睛位置由巩膜搜索线圈系统记录。使用微电极支架/驱动器保持注射套管并将其驱动到目标深度。通过USB相机(插图)监测有色油和载体溶液之间的弯月面来控制注射。(五)双筒导管喷射。双桶导管支架/驱动器固定注射套管和微电极(见插图)。(F) 注射。通过刮擦环氧涂层暴露在套管尖端的金属为神经元提供电通道(插图,比例尺:500 μm)。(G) 激光刺激设置。双筒导管支架/驱动器同时容纳光纤和微电极(见插图)。 请点击此处查看此图的大图。
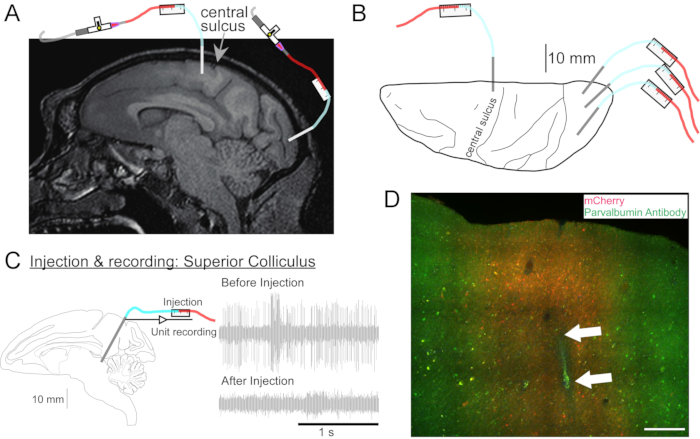
图2:AAV注射部位图 。 (A)脑MR图像的矢状部分,显示 猕猴的主要运动皮层和初级视觉皮层中的注射部位。(B)从相应Atlas板上的背表面查看,显示套管相对于中央沟(初级运动皮层)和初级视觉皮层的位置。(C)在上丘注射的单元记录。注射前分离的单元(右上)在注射后消失(右下)。(D) 注射轨道(白色箭头)。比例尺:500 μm。 请点击此处查看此图的大图。
4. 用于组织学的脑组织处理
- 注射后等待6-8周,以最大限度地提高转基因表达。
注意:最佳持续时间取决于实验中使用的确切病毒载体。 - 使用常规组织学技术处理大脑以评估转导效率和选择性5,6,7。
结果
为了证明使用此处描述的手术注射方法将体内立体定向注射到NHP脑中的转基因表达,选择了两种载体,其中含有驱动不同神经元类型8,9中超黄色荧光蛋白-2(SYFP2)表达的增强子。将病毒载体包装在PHP.eB衣壳10中,通过碘沙醇离心纯化,然后浓缩至高滴度(>1E13病毒基因组/ mL),通过qPCR测量。通过皮层沿十个轨道在十个深度中的每一个进样0.5 μL的体积,总进样体积为5 μL/轨道。图3A-C显示了将PVALB亚类特异性AAV载体CN2045注射到成年雄性玛卡卡犬的初级视觉皮层113天后,通过抗GFP免疫染色通过抗GFP免疫染色表达SYFP2。SYFP2转基因在分散在皮质深度的许多非锥体神经元中得到有力检测,大多数表达SYFP2的神经元也对PVALB7具有免疫反应性。图3D显示了注射L5神经元亚类特异性AAV载体CN225164天后初级运动皮层中的天然SYFP2表达。SYFP2标记的神经元都具有清晰的锥体形态,体细胞仅限于第5层和特征性的厚顶端树突。这些数据明确地证明了通过立体定位注射靶向AAV载体的细胞类型,精确控制了NHP大脑中选定的新皮质神经元群体中的转基因表达。
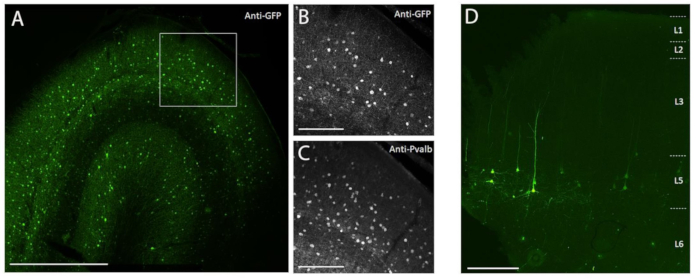
图 3:由注射到 NHP 大脑中的 AAV 载体介导的细胞类型特异性 SYFP2 表达示例 。 (A) 注射 PVALB 亚类特异性 AAV 载体后 113 天猕猴初级视觉皮层固定切片的落射荧光显微照片。比例尺:1毫米。 (乙,丙)以 A所示的盒装区域的更高放大倍率图像。(B)抗GFP信号。(C)抗PVALB信号。比例尺:250 μm。 (D) 注射第 5 层脑外亚类特异性 AAV 载体 64 天后,猕猴初级运动皮层固定切片中天然 SYFP2 荧光的落射荧光显微照片。比例尺:500 μm。 请点击此处查看此图的大图。
为了证明这种注射技术在神经生理学和行为光遗传学操作中的实用性,进行了三个实验,每个实验在不同的猴子(Macaca mulatta)上进行。在第一个实验(图4A-D)中,将携带通道视紫红质-2转基因(AAV1-hSyn1-ChR2-mCherry)的AAV载体注射到左上丘(SC)中。每250μm在19个深度进样载体,总共12μL。在第二个实验(图 4E-G)中,将 3 μL AAV1-hSyn-ArchT-EYFP 溶液注入桥状网状核 (NRTP)。在第三个实验(图 4H-K)中,将 24 μL AAV9-L7-ChR2-mCherry 溶液注射到小脑皮层 6。每次注射后六到八周,通过双管导管将光纤和钨电极插入大脑(图1G)。
图4B显示了SC神经元对蓝光(450nm)的响应。40 mW 下的常亮光 (1.2 s) 产生一系列连续动作电位(图 4B,顶部)。持续时间为 1 ms 的光脉冲在 40 mW 时无法唤起动作电位(图 4B,中),但在 160 mW 时确实可靠地唤起动作电位,这是测试的唯一其他功率电平,延迟为 2.7 ± 0.6 ms(图 4B,底部)。脉冲序列(160 mW,频率:300 Hz,占空比:15%,持续时间:300 ms)始终诱发扫视,平均潜伏期为 97 ± 32 毫秒,平均振幅为 10.4°,平均角度为 47°(向上和向右;图 4C)。
与使用 SC11,12 的亚阈值电刺激来改变扫视增益的研究一致,在 15°、18° 和 20° 左右和向下 (225°) 扫视后对 SC 进行光学刺激会逐渐降低扫视增益(图 4D)。这种增益的降低需要~250次试验(绿色圆圈)才能恢复到适应前的增益(黑色圆圈),证实了其长期可塑性的基础。
在第二个实验(图4E)中,从NRTP到小脑皮层(小叶VIc和VII)的动眼神经蚓(OMV)的苔藓纤维投影被光学抑制。图4F显示了OMV中荧光标记的苔藓纤维和玫瑰花结(插图)。黄色激光(589nm)通过光纤传递到OMV,附近的钨电极用于记录浦肯野细胞活性。图4G显示了NRTP投影的光遗传失活之前(灰色)和之后(橙色)的简单尖峰活性(图4G,顶部)。在失活之前,浦肯野细胞表现出12°向右扫视的双爆发模式(图4G,中间,灰色)。在失活期间,放电速率降低并变为突发暂停模式(图4G,中间,橙色)。比较这两种反应模式表明,浦肯野细胞的苔藓纤维输入通过驱动第二次爆发来影响扫视减速阶段(图4G,中间,绿色)。在光遗传学失活期间,向右扫视的变异性降低,这与扫视指标的一些试验间变异性是由于苔藓纤维携带的信号的变异性的观点一致(图4G,底部,橙色)。
在第三个实验(图4H)中,OMV的浦肯野细胞受到光遗传学刺激(图4I)。一系列短光脉冲(1.5 ms脉冲,65 mW,50 Hz)增加了分离的浦肯野电池的简单尖峰活性(图4J,顶部)。单个 1.5 ms 光脉冲经常引起 >1 个简单尖峰(图 4J,底部)。光遗传学简单尖峰激活,定时发生在扫视期间(10 ms光脉冲,60 mW),扫视幅度增加(图4K),证实了浦肯野细胞对动眼膜发生器的抑制作用。
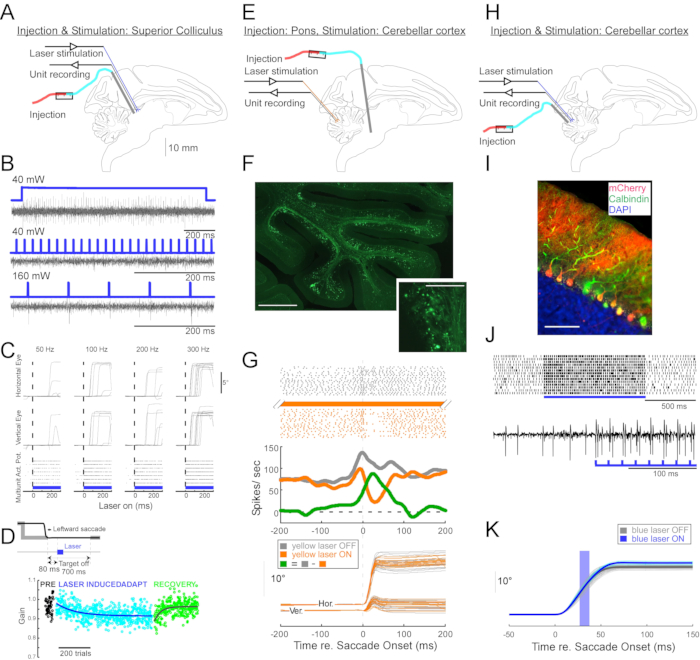
图4:在清醒的猴子中进行的三个光遗传学实验的摘要。 (A-D)实验1,泛神经元兴奋:病毒注射,激光刺激和单位记录在上丘中进行(A)。(B)激光刺激引起的代表性单位活动。(C),激光刺激引起的眼球运动的水平(顶部)和垂直(中间)分量和单位活动(底部)的光栅图。(D)激光刺激诱导的扫视适应的代表性会议。每次扫视后80毫秒(插图)进行刺激(100 0.5 ms激光脉冲)。扫视增益(扫视幅度/目标幅度)在试验中逐渐下降。(E-G)实验2,通路特异性抑制:将病毒载体注射到桥状网状核中,并在动眼神经蚓(E)中进行激光刺激和单元记录。(F) 动眼神经蚓部的组织学切片显示标记的苔藓纤维(比例尺:1 毫米)及其玫瑰花结(插图,比例尺:100 μm)。(G)浦肯野细胞活性(顶部:光栅,中:平均发射速率)和有和没有激光刺激的视觉引导扫视轨迹(底部)。灰色:激光关闭试验,橙色:激光试验,绿色:灰色和橙色之间的差异。(香港)实验3,细胞类型特异性激活:在动眼神经蚓部(H)中进行病毒注射,激光刺激和单位记录。(I)动眼神经蚓部的组织学切片显示标记的浦肯野细胞。比例尺:100 μm。 (J)激光刺激引起的浦肯野细胞的简单尖峰活性。上图:来自 14 次试验的光栅图。下图:来自单个代表性试验的电压迹线。(K) 有和没有激光刺激的视觉引导扫视轨迹。扫视期间的 10 ms 光脉冲会增加扫视幅度。激光试验中的单个扫视轨迹(青色)及其平均值(蓝色)。单个扫视轨迹(浅灰色)及其平均(深灰色)在激光关闭试验中。实验1和3的光波长为450 nm,实验2中的光波长为589 nm。请点击此处查看此图的大图。
讨论
非人灵长类光遗传学的进步产生了对准确、可靠的颅内注射方法的需求。本报告中描述的方法的优点是它价格低廉,使用可消毒和一次性组件,并且能够针对任何深度的不同大脑区域。它还允许通过控制空气阀的速度来控制注射速度和体积。气压可以暂时增加以清除堵塞,然后迅速降低,以避免随后由持续压力产生的过度注射。一次性组件可降低注射部位之间交叉污染的风险。
该注射方案中的关键步骤包括构建高质量的套管,在不引入气泡的情况下加载它们,以及选择不太靠近的注射部位。间隔≥1 cm的注射通常转导非重叠区域,但这种启发式方法取决于病毒血清型、滴度、启动子、体积、靶标和检测方法。选择不直接连接的注射部位可避免视蛋白沿轴突运输产生的潜在混杂以及某些AAV血清型的逆行转导倾向。
该方法可用于在麻醉和立体定位框架中注射非人灵长类(图3)或警报和头部固定(图4)。前者的优点是允许在立体定位坐标中靶向注射,并且它允许通过急性硬膜切开术目视确认套管穿透(通过慢性开颅术切开清醒的猴子的硬脑膜,增加感染的风险)。后一种方法的优点是减少了生存手术的次数,从而减少了对动物的压力,与行为过程中的电生理记录兼容,并且使用相同的坐标系和仪器插入光纤进行注射后实验。清醒猴的注射技术可以通过人工硬脑膜13,14,15进行注射来进一步改进。这将赋予直接可视化注射部位和指示成功转导的组织荧光的额外优势。
最近,开发了一种多通道注射装置,将AAV载体均匀地输送到大的NHP皮质区域16。使用对流增强输送可以获得类似的结果17,18。这些方法旨在最大化转导扩散,这是一个重要的目标,但与我们的方法旨在实现的空间精度不同。
另一种替代方法是通过硼硅酸盐管注入AAV载体,该管在一端斜向尖锐的尖端,并在另一端连接到汉密尔顿注射器上5,6。该方法与本文中描述的方法有很多共同之处。病毒载体保持在一段管子中,病毒后面的管子中的空间充满染色油,并通过油载体弯月面的运动监测载体的流动。这种替代技术需要较少的设备和准备,但它需要通过负压通过斜面尖端将油吸入硼硅酸盐管中,然后通过相同的路线加载载体。这不可避免地导致微量的油输送到大脑。此外,根据我们的经验,硼硅酸盐管的直径必须为 ~350 μm,即使在斜面时也能穿透硬脑膜,因此比本文中描述的更细的金属套管会造成更大的机械损伤(图 2D)。之所以使用30 G管,是因为尽管长度为1-10厘米,但其临界屈曲载荷足以介导硬脑膜穿透,因为它与PTFE管紧密配合,并且很少被阻塞。33 G 卡套管更容易堵塞和弯曲,并且更难与 PTFE 管配合。36 G 管的刚度不足以穿透 NHP 硬脑膜。
另一种替代注射技术是将气泵的输出与矢量加载的拉式玻璃移液器19的背面配合。通过泵的直接间歇气压将载体从移液器吸头中挤出,无需油。与上面解释的单管方法类似,弯月面和套管尖端之间没有任何材料连接,降低了泄漏的风险。然而,玻璃移液器的尖锐锥度和精致的尖端可防止它们穿透NHP硬脑膜或瞄准深层结构。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了WaNPRC / ITHS P51OD010425(JTT),美国国立卫生研究院(NIH)拨款EY023277(R01为YK),EY030441(R01为GH),MH114126(RF1至JTT,Boaz Levi,Ed Lein),MH120095(UG3为JTT和GH),EY028902(R01为RS)的支持,并由NIH拨款OD010425(P51为WaNPRC)和华盛顿大学版税研究基金A148416。作者要感谢Yasmine El-Shamayleh和Victoria Omstead的组织学,Refugio Martinez的病毒载体克隆以及John Mich在NHP脑组织处理方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Equipment: Stereotaxic set | |||
| Item | |||
| Allen keys | BONDHUS | 10936 | STERRAD |
| Cannula holder | KOPF | 1770 | STERRAD |
| Carrier (manipulator) | KOPF | 1404 | STERRAD |
| Carrier platform | KOPF | 1430 | NA |
| Carrier stand | KOPF | 1449 | STERRAD |
| Eye, ear, mouth bars | KOPF | 1430 | NA |
| Stereotaxic base | KOPF | 1210 | NA |
| Equipment: Cannula | |||
| Item | |||
| 1 mL Luer-lock syringes | BD | 309628 | NA (sterilized package) |
| Cannulas* | (homemade - see below) | NA | steam (autoclave) |
| Colored oil** | (homemade - see below) | NA | NA |
| Elevator (for tube rack) | Cole-Parmer | UX-08057-10 | STERRAD |
| Filter tip | Genesee Scientific | 23-404 | NA (sterilized package) |
| Fluorescent microbeads | Lumafluor | R170 | NA |
| P20 pipetman | Gilson | FA10003M | NA |
| PCR tubes | Olympus Plastics | 22-161 | STERRAD |
| Stopcock | Cole-Parmer | 3060004 | STERRAD |
| Tube rack | homemade | NA | STERRAD |
| Vector solution | (homemade) | NA | NA |
| Equipment: Electric air pump set | |||
| Item | |||
| Electric air pump | World Precision Instruments | PV830 | NA |
| Foot pedal | World Precision Instruments | 3260 | NA |
| Tube cover | EZ Drape | A400-1000 | NA (sterilized package) |
| Equipment: General surgery tools | |||
| Item | |||
| Beaker | MEDLINE | azlon | STERRAD |
| Burrs | STRYKER | 277-10-235 | STERRAD |
| Double pronged tissue pick | Fine Science Tools | 18067-11 | STERRAD |
| Drapes | MEDLINE | DYNJP3004 | NA (sterilized package) |
| Dressing forceps | Miltex | 6-118 | STERRAD |
| Drill | STRYKER | Q9R-5400 | NA |
| Drill bits | STRYKER | 277-82-87 | STERRAD |
| Gauze | MEDLINE | NON26334 | NA (sterilized package) |
| Hemostatic mosquito forceps | Miltex | 7-2, 7-4 | STERRAD |
| Light handles | SKYTRON | Stellar XL | STERRAD |
| Needle hodler | Miltex | 8-2 | STERRAD |
| Periosteal elevator | Miltex | 18-1968 | STERRAD |
| Rongeurs | Miltex | 17-4800 | STERRAD |
| Saline | BAXTER | 2F7122 | STERRAD |
| Scalpel | Bard-Parker | 372610 | STERRAD |
| Scissors | Miltex | 5-12, 5-114 | STERRAD |
| Senn retractors | Miltex | 28065 | STERRAD |
| Sterile gloves | MEDLINE | Triumph Micro | NA (sterilized package) |
| Suction | medela | 200-4869 | NA |
| Suction tip | MEDLINE | DYNDFR12S | NA (sterilized package) |
| Suction tube | COVIDEN | 8888301614 | NA (sterilized package) |
| Surgical gowns | MEDLINE | DYNJP2002S | NA (sterilized package) |
| Surgical pens & ruler | MEDLINE | DYNJSM03 | NA (sterilized package) |
| Suture | COVIDEN | SL-635 | NA (sterilized package) |
| Tissue forceps | Miltex | 6-114 | STERRAD |
| Towel clamps | Miltex | 7-504 | STERRAD |
| Wood swabs | MEDLINE | MDS202095 | NA (sterilized package) |
| Equipment: *cannulas | |||
| Item | |||
| Hypodermic needle | EXELINT INTERNATIONAL | 26437 | NA (sterilized package) |
| Stainless steel tube | K-TUBE | K30R | NA |
| PTFE tube | ZEUS | 216200 | NA |
| Equipment: **colored oil | |||
| Item | |||
| Liquid Candle Dye Concentrate | PremiumCraft | Red/Pink | NA |
| Mineral oil | Vi-Jon | S0883 | NA |
| STERRAD: low-temperature hydrogen peroxide gas plasma |
参考文献
- Kojima, Y., Robinson, F. R., Soetedjo, R. Cerebellar fastigial nucleus influence on ipsilateral abducens activity during saccades. Journal of Neurophysiology. 111 (8), 1553-1563 (2014).
- Kojima, Y., Soetedjo, R. Elimination of the error signal in the superior colliculus impairs saccade motor learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8987-8995 (2018).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effects of GABA agonist and antagonist injections into the oculomotor vermis on horizontal saccades. Brain Research. 1366, 93-100 (2010).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effect of inactivation and disinhibition of the oculomotor vermis on saccade adaptation. Brain Research. 1401, 30-39 (2011).
- De, A., El-Shamayleh, Y., Horwitz, G. D. Fast and reversible neural inactivation in macaque cortex by optogenetic stimulation of GABAergic neurons. eLife. 9, 52658 (2020).
- El-Shamayleh, Y., Kojima, Y., Soetedjo, R., Horwitz, G. D. Selective optogenetic control of Purkinje cells in monkey cerebellum. Neuron. 95 (1), 51-62 (2017).
- Mich, J. K., et al. Functional enhancer elements drive subclass-selective expression from mouse to primate neocortex. Cell Reports. 34 (13), 108754 (2021).
- Graybuck, L. T., et al. Enhancer viruses for combinatorial cell subclass-specific labeling. Neuron. (21), 00159 (2020).
- Michel, J., Benninger, D., Dietz, V., van Hedel, H. J. Obstacle stepping in patients with Parkinson's disease. Complexity does influence performance. Journal of Neurology. 256 (3), 457-463 (2009).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Kaku, Y., Yoshida, K., Iwamoto, Y. Learning signals from the superior colliculus for adaptation of saccadic eye movements in the monkey. Journal of Neuroscience. 29 (16), 5266-5275 (2009).
- Soetedjo, R., Fuchs, A. F., Kojima, Y. Subthreshold activation of the superior colliculus drives saccade motor learning. Journal of Neuroscience. 29 (48), 15213-15222 (2009).
- Kleinbart, J. E., et al. A modular implant system for multimodal recording and manipulation of the primate brain. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual International Conference. 2018, 3362-3365 (2018).
- Arieli, A., Grinvald, A., Slovin, H. Dural substitute for long-term imaging of cortical activity in behaving monkeys and its clinical implications. Journal of Neuroscience Methods. 114 (2), 119-133 (2002).
- Ruiz, O., et al. Optogenetics through windows on the brain in the nonhuman primate. Journal of Neurophysiology. 110 (6), 1455-1467 (2013).
- Fredericks, J. M., et al. Methods for mechanical delivery of viral vectors into rhesus monkey brain. Journal of Neuroscience Methods. 339, 108730 (2020).
- Bankiewicz, K. S., et al. Convection-enhanced delivery of AAV vector in parkinsonian monkeys; in vivo detection of gene expression and restoration of dopaminergic function using pro-drug approach. Experimental Neurology. 164 (1), 2-14 (2000).
- Yazdan-Shahmorad, A., et al. Widespread optogenetic expression in macaque cortex obtained with MR-guided, convection enhanced delivery (CED) of AAV vector to the thalamus. Journal of Neuroscience Methods. 293, 347-358 (2018).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。