Method Article
Injections de vecteurs AAV pour l’optogénétique dans le cerveau de primates non humains anesthésiés et éveillés
Dans cet article
Résumé
Telle qu’elle est actuellement mise en œuvre, l’optogénétique chez les primates non humains nécessite l’injection de vecteurs viraux dans le cerveau. Une méthode d’injection optimale doit être fiable et, pour de nombreuses applications, capable de cibler des sites individuels de profondeur arbitraire qui sont facilement et sans ambiguïté identifiés en histologie post-mortem. Une méthode d’injection avec ces propriétés est présentée.
Résumé
Les techniques optogénétiques ont révolutionné la recherche en neurosciences et sont sur le point de faire de même pour la thérapie génique neurologique. L’utilisation clinique de l’optogénétique exige toutefois que l’innocuité et l’efficacité soient démontrées dans des modèles animaux, idéalement chez des primates non humains (PSN), en raison de leur similitude neurologique avec les humains. Le nombre de vecteurs candidats potentiellement utiles pour les neurosciences et la médecine est vaste, et il n’existe pas encore de moyen à haut débit pour tester ces vecteurs. Il existe donc un besoin de techniques pour effectuer de multiples injections spatialement et volumétriquement précises de vecteurs viraux dans le cerveau des PSN qui peuvent être identifiées sans ambiguïté par histologie post-mortem. La présente méthode est décrite ici. Les canules d’injection sont construites à partir de tubes couplés en polytétrafluoroéthylène et en acier inoxydable. Ces canules sont autoclavables, jetables et ont de faibles volumes de charge minimale, ce qui les rend idéales pour l’injection de solutions de vecteurs viraux coûteuses et hautement concentrées. Une huile minérale inerte teinte en rouge remplit l’espace mort et forme un ménisque visible avec la solution vectorielle, permettant une mesure instantanée et précise des taux et des volumes d’injection. L’huile est chargée à l’arrière de la canule, ce qui réduit le risque de co-injection avec le vecteur. Les canules peuvent être chargées en 10 minutes et les injections en 20 minutes. Cette procédure est bien adaptée aux injections chez les animaux éveillés ou anesthésiés. Lorsqu’elle est utilisée pour administrer des vecteurs viraux de haute qualité, cette procédure peut produire une expression robuste des protéines optogénétiques, permettant un contrôle optique de l’activité neuronale et du comportement chez les PSN.
Introduction
L’optogénétique chez les primates non humains (PNH) implique généralement l’injection de vecteur viral directement dans le cerveau. Une classe de vecteurs bien adaptée à cette application est basée sur le virus adéno-associé (AAV). Ces vecteurs sont constitués d’une capside protéique entourant un génome d’ADN simple brin qui, à son tour, se compose d’un promoteur, d’un gène d’opsine et, éventuellement, d’autres éléments codant pour les protéines et de régulation des gènes. Les progrès du clonage moléculaire ont facilité la manipulation et la combinaison de ces composants pour le développement de nouveaux vecteurs. Par conséquent, la collection de vecteurs AAV potentiellement utiles pour l’optogénétique des PSN est importante et augmente rapidement.
À l’heure actuelle, l’utilité d’un vecteur AAV pour l’optogénétique des PSN nécessite des essais in vivo. Ce fait constitue un obstacle important au progrès. Les animaux doivent être utilisés avec parcimonie, et l’essai de plusieurs vecteurs chez un seul animal nécessite que les sites d’injection soient positionnés judicieusement par rapport à l’architecture neuronale et bien séparés par rapport à la propagation virale. Une évaluation histologique précise nécessite que les injections soient spatialement et volumétriquement précises. Une technique d’injection précédemment utilisée pour l’administration focale d’agents pharmacologiques 1,2,3,4 a été adaptée et simplifiée pour effectuer de telles injections. Cette technique d’injection est peu coûteuse, utilise des composants jetables et stérilisables, peut être utilisée chez des singes anesthésiés ou éveillés et peut être utilisée pour cibler diverses zones du cerveau de n’importe quelle profondeur. Le protocole suivant décrit les procédures étape par étape pour fabriquer les composants jetables et faire des injections dans le cerveau du PSN. Les avantages et les inconvénients de la technique sont discutés.
Protocole
Toutes les expériences ont été réalisées conformément au Guide pour le soin et l’utilisation des animaux de laboratoire et dépassaient les exigences minimales recommandées par l’Institute of Laboratory Animal Resources et l’Association for Assessment and Accreditation of Laboratory Animal Care International. Toutes les procédures ont été évaluées et approuvées par le Comité de soin et d’utilisation des animaux de l’Université de Washington (protocole UW IACUC #4167-01). Cinq macaques en bonne santé (2 Macaca mulatta, 3 Macaca nemestrina; mâle. 4-11 ans) ont participé à cette étude. Des instruments et des techniques stériles ont été utilisés tout au long de toutes les interventions chirurgicales.
1. Fabrication d’une canule (figure 1A)
- Préparation de chaque partie
- Émoussez la pointe d’une aiguille hypodermique (30 G, 13 mm de longueur) avec une meuleuse à disque.
- Découpez un tube en acier inoxydable (30 G, diamètre intérieur = 0,16 mm, diamètre extérieur = 0,31 mm) à une longueur adaptée à la profondeur de la zone cérébrale cible (25 mm est bien adapté pour injecter la surface dorsale du cortex cérébral). À l’aide d’une meuleuse à disque, biseauter une extrémité du tube coupé et lisser l’autre. Ébavure l’intérieur du tube avec une broche.
- Couper le tube en polytétrafluoroéthylène (PFTE) (diamètre intérieur = 0,23 mm ± 0,02 mm, paroi = 0,23 mm ± 0,02 mm, 1 mm correspond à 42 nL ± 7 nL de fluide) à une longueur appropriée à la quantité de solution vectorielle à charger (1 μL de solution vectorielle occupe 24 mm de tube). Évaser les deux extrémités du tube PTFE par insertion de l’aiguille hypodermique émoussée.
- Insérez l’aiguille hypodermique émoussée d’environ 5 mm dans une extrémité du tube en PTFE. Insérer l’extrémité non biseautée du tube en acier inoxydable à environ 5 mm dans l’autre extrémité (figure 1A).
- Effectuer des tests pré-injection. Injectez de l’eau filtrée à travers le moyeu hypodermique de l’aiguille de la canule. Confirmer que l’eau sort du tube en acier inoxydable biseauté de la pointe et que l’eau ne fuit pas de l’une ou l’autre jonction.
2. Procédure d’injection pour les animaux anesthésiés
- Préparation à la chirurgie
- Stériliser les instruments et les fournitures chirurgicales en suivant les procédures décrites dans le tableau des matériaux.
- Si nécessaire, passez une IRM de la tête pour cibler les structures cérébrales profondes (Figure 2A).
- Immédiatement avant la chirurgie, endormir les animaux avec de la kétamine (10-15 mg / kg) et administrer des antibiotiques (céfazoline) et des analgésiques (buprénorphine à libération prolongée et méloxicam) par voie intramusculaire. Ensuite, administrer le propofol via un cathéter intraveineux (IV) dans les veines saphènes ou céphaliques.
- Intuber l’animal et le transformer en gaz isoflurane. Confirmer une anesthésie adéquate par une fréquence cardiaque stable, une pression artérielle, une fréquence respiratoire, des muscles squelettiques détendus et l’absence de réflexes palpébraux ou de retrait.
- Rasez la tête de l’animal. Appliquez une pommade lacrymale artificielle sur les cornées pour éviter le dessèchement.
- Préparation de la zone d’injection
- Placez la tête de l’animal dans le cadre stéréotaxique. Appliquez une solution de gommage chirurgical sur la peau rasée avec des éponges de gaze, appliquez une légère pression pour libérer les débris et rincez avec de l’alcool isopropylique. Répétez ce processus trois fois. Couvrir l’animal d’un champ fenêtré stérile. Inciser la peau et réfléchir le muscle. Placez le manipulateur sur le bras stéréotaxique, positionnez-le pour viser la zone cérébrale cible et marquez la position de la craniotomie sur le crâne avec un stylo stérilisé.
- Retirez le manipulateur stéréotaxique et effectuez la craniotomie. Inciser la dure-mère si désiré (par exemple, pour visualiser les repères sulcaux). Retournez le manipulateur au bras stéréotaxique.
- Chargement de la solution vectorielle (Figure 1C)
- Transférer doucement la solution vectorielle dans un tube de PCR stérilisé avec un pipetor P20, en évitant les bulles.
- Fixez une canule, avec la pointe biseautée vers le bas, à un support stéréotaxique orienté verticalement. Connectez une seringue Luer-lock de 1 ml au moyeu hypodermique de la canule.
- Immerger l’extrémité biseautée de la canule dans la solution vectorielle.
REMARQUE: La seringue doit déjà être fixée; L’attacher à ce stade introduirait des bulles dans la solution vectorielle. - Charger la solution dans la canule en appliquant une légère pression négative avec la seringue de 1 ml. Suivez visuellement le ménisque entre la solution et l’air.
- Une fois la solution vectorielle chargée, continuez la légère pression négative jusqu’à ce que la solution atteigne le moyeu de l’aiguille. Retirez la seringue de 1 mL et injectez l’huile minérale colorée dans le moyeu de l’aiguille hypodermique.
REMARQUE: L’huile doit être injectée lentement le long de la paroi interne du moyeu de l’aiguille pour former un ménisque net avec la solution vectorielle et pour éviter les bulles d’air. - Fixez le moyeu d’aiguille hypodermique à l’un des deux orifices ouverts d’un robinet d’arrêt à verrouillage Luer à 3 voies.
REMARQUE: La fixation de l’aiguille hypodermique à l’orifice fermé introduira une pression d’air indésirable derrière l’huile. - Fermez l’orifice connecté au moyeu de l’aiguille hypodermique, remplissez une seringue de 1 ml d’air et fixez-la à l’un des deux autres orifices. Enfin, fermez l’orifice restant du robinet d’arrêt pour connecter la seringue à la canule.
- Poussez lentement l’air dans la canule. Une fois que l’huile colorée apparaît à l’extrémité de l’aiguille émoussée dans le tube en PTFE, vérifiez la présence d’air entre la solution et l’huile colorée.
- Si de l’air est présent, appliquez une pression négative sur la seringue pour renvoyer l’huile colorée dans le moyeu de l’aiguille. Retirer la bulle et appliquer une pression positive jusqu’à ce qu’une goutte de solution vectorielle soit visible à l’extrémité de la canule biseautée.
- Retirez la seringue de 1 mL pour libérer la pression d’air indésirable derrière l’huile et fermez le robinet d’arrêt pour empêcher le vecteur de sortir de la canule par gravité.
- Collez une règle en plastique sur la tubulure en PTFE pour mesurer le mouvement du ménisque pendant l’injection (figure 1B,D,F).
- Insertion de canules dans la zone cérébrale cible (Figure 1B)
- Fixez la canule au manipulateur stéréotaxique.
- Transférez manuellement le tube de la pompe (qui se termine par un connecteur Luer-lock) de l’assistant non stérile au chirurgien. Le chirurgien doit saisir le connecteur Luer-lock à travers la paroi d’un manchon stérile, fixer un deuxième robinet d’arrêt stérile sur le connecteur, coller fermement le manchon autour de celui-ci, puis laisser tomber le collier du manchon, lui permettant de s’étendre le long du tube par gravité.
- Connectez le robinet d’arrêt fixé au tube de la canule au robinet d’arrêt fixé à la pompe à air. Réglez la pompe à air à basse pression, allumez-la et augmentez la pression jusqu’à ce que l’huile avance à travers la canule et qu’une goutte de solution vectorielle soit visible à l’extrémité de la canule.
- Ajustez la position de la règle en plastique sur le tube en PTFE pour mesurer le mouvement du ménisque pendant l’injection.
- Enfoncez la canule vers le bas avec le manipulateur stéréotaxique et notez la profondeur à laquelle la pointe atteint la surface (dure-mère ou pie-mère).
- Conduire la canule au site le plus profond pour être injectée le long de la piste. La surface va capitonner. Si vous injectez du cortex superficiel, confirmez visuellement que la canule a pénétré la surface, à l’aide d’un microscope chirurgical ou de loupes grossissantes, le cas échéant.
- Pour minimiser les erreurs de ciblage dues à la compression tissulaire, enfoncez la canule lentement (1 mm/min), rapidement (0,5 mm/s) avec une attente de 1 à 5 minutes au fond, ou dépassez le site d’injection le plus profond de 500 μm, puis rétractez-vous.
- Injection
- Injecter 0,5 μL de la solution vectorielle avec la pompe à air électrique pendant 10-30 s. Confirmer le débit d’injection en suivant le ménisque entre l’huile colorée et la solution vectorielle dans le tube PTFE.
- Attendez 1 min et rétractez la canule au site d’injection suivant le long de la piste.
- Après l’injection finale, laissez la canule en place pendant 10 minutes pour éviter l’effusion vectorielle.
- Rétracter la canule et la jeter dans un contenant pour objets tranchants présentant un risque biologique.
- Éventuellement, injecter une petite quantité (≤1 μL) de microbilles fluorescentes près du site d’injection vectorielle pour faciliter l’identification post mortem du site d’injection.
- Répétez cette procédure si désiré pour les autres solutions vectorielles à d’autres endroits (Figure 2B).
- Fermeture de la chirurgie
- Suturer la dure-mère, le muscle et la peau.
- Retirez le singe du cadre stéréotaxique et retirez tous les câbles du moniteur.
- Retirer le singe de l’anesthésie à l’isoflurane et l’extuber après le retour du réflexe de déglutition.
- Fournir un traitement post-chirurgical (3-5 jours de méloxicam et 7-10 jours de céphalexine). Surveillez l’animal au moins une fois toutes les 10 minutes jusqu’à ce qu’il soit capable de maintenir une position assise stable.
3. Chirurgie et injection de vecteurs AAV pour les animaux éveillés (Figure 1D)
REMARQUE: Une variante de la technique peut être utilisée pour faire des injections dans le cerveau de singes éveillés et au comportement, comme décrit ci-dessous.
- Injection simultanée avec enregistrement
- Pour enregistrer l’activité électrique au site d’injection, enduisez l’extérieur de la canule d’époxy (fond ~15 mm) et de tubes en polyimide (longueur restante). Révéler le métal à l’extrémité en grattant l’époxy (Injectrode, Figure 1F)2. Vous pouvez également insérer la canule et une électrode extracellulaire séparée, côte à côte, dans un tube guide à double corps (tube guide à double barillet, figure 1E).
- Insertion de canules dans la zone cérébrale cible.
- Placez le singe dans la cabine expérimentale, limitez le mouvement de la tête et nettoyez la chambre d’enregistrement montée sur le crâne en utilisant des techniques standard.
- Fixez un tube de guidage au microdrive. Insérez la canule d’injection dans le tube de guidage.
- Avancer la canule jusqu’à ce que l’extrémité dépasse du tube de guidage.
- Raccordez le robinet d’arrêt à la pompe à air électrique. Pour confirmer le bon fonctionnement du système, poussez une goutte de solution vectorielle de la pointe à l’aide de la pompe à air et confirmez le mouvement du ménisque de la solution de vecteur huile.
- Retirer la canule ~5 mm dans le tube de guidage pour la protéger des dommages lors de l’insertion du tube dans le cerveau. Insérez le tube de guidage dans le cerveau.
- Conduisez la canule sur le site à injecter à l’aide du microdrive. Identifier le site cible par enregistrement électrique (figure 2C) ou par stimulation.
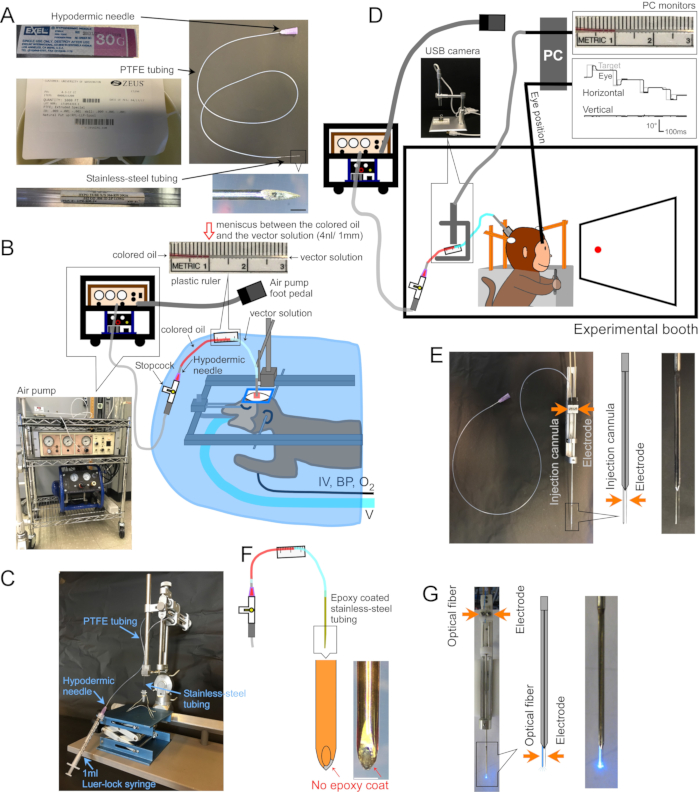
Figure 1 : Installation de la chirurgie et de l’appareil. (A) Canule d’injection. Chaque partie de la canule est indiquée. Encart en bas à droite : image agrandie de la pointe de la canule, barre d’échelle : 500 μm. (B) Installation chirurgicale pour singes anesthésiés. Le singe est placé dans un cadre stéréotaxique sous un champ chirurgical. Le ventilateur (V), la ligne intraveineuse (IV), le tensiomètre (PA) et le moniteur de saturation en oxygène (O2) sont connectés au singe. La canule d’injection est insérée dans la zone cible à l’aide d’un micromanipulateur stéréotaxique. La solution vectorielle est injectée par une pompe à air électrique (encart en bas à gauche, marron) couplée à un compresseur d’air (encart en bas à gauche, bleu). Une règle en plastique (encart supérieur) est collée sur le tube en PTFE pour mesurer le mouvement du ménisque entre l’huile colorée (encart supérieur, rouge) et la solution vectorielle (encart supérieur, transparent) pendant l’injection. (C) Configuration pour charger la solution vectorielle dans la canule. (D) Un singe lors d’une injection de solution vectorielle dans une cabine expérimentale. La tête de l’animal est maintenue en place par trois poteaux de stabilisation, et la position des yeux est enregistrée par un système de bobine de recherche sclérale. La canule d’injection est maintenue et entraînée à la profondeur cible à l’aide d’un porte-électrode/pilote de micro-électrode. L’injection est contrôlée en surveillant le ménisque entre l’huile colorée et la solution vectorielle à l’aide d’une caméra USB (image en médaillon). E) Injection de tube de guidage à double baril. Un porte-tube de guidage/haut-parleur à double corps contient une canule d’injection et une micro-électrode (voir encadré). f) Injectrode. Le métal à l’extrémité de la canule, exposé par grattage de la couche époxy, fournit un accès électrique aux neurones (encart : barre d’échelle : 500 μm). (G) Configuration de la stimulation laser. Un porte-tube de guidage à double barillet contient à la fois une fibre optique et une micro-électrode (voir encadré). Veuillez cliquer ici pour voir une version agrandie de cette figure.
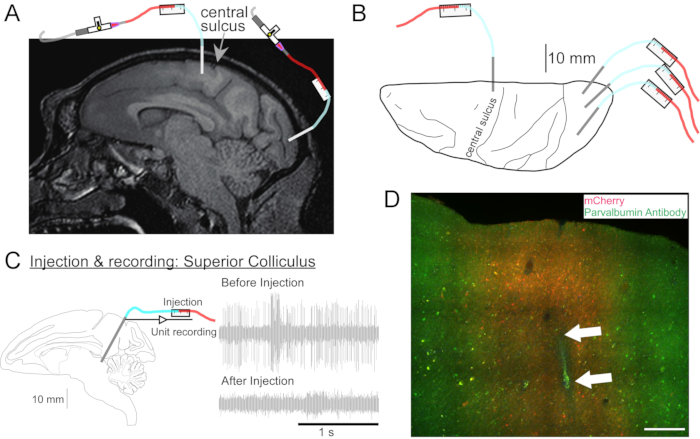
Figure 2 : Schéma des sites d’injection d’AAV. (A) Coupe sagittale de l’image IRM cérébrale montrant les sites d’injection dans le cortex moteur primaire et le cortex visuel primaire d’un Macaca nemestrina. (B) Vue de la surface dorsale sur la plaque Atlas correspondante montrant la position de la canule par rapport au sillon central (cortex moteur primaire) et au cortex visuel primaire. (C) Enregistrement unitaire par injectrode dans le colliculus supérieur. Une unité isolée avant l’injection (en haut à droite) a disparu après l’injection (en bas à droite). (D) Piste d’injection (flèches blanches). Barre d’échelle: 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Traitement des tissus cérébraux pour l’histologie
- Attendre 6 à 8 semaines après l’injection pour maximiser l’expression des transgènes.
REMARQUE: La durée optimale dépend du vecteur viral exact utilisé dans l’expérience. - Traiter le cerveau en utilisant des techniques histologiques conventionnelles pour évaluer l’efficacité et la sélectivitéde la transduction 5,6,7.
Résultats
Pour démontrer l’expression transgénique par injection stéréotaxique in vivo dans le cerveau du PSN à l’aide de la méthode d’injection chirurgicale décrite ici, deux vecteurs contenant des amplificateurs entraînant l’expression de la protéine fluorescente super jaune 2 (SYFP2) dans des types neuronaux distincts 8,9 ont été sélectionnés. Les vecteurs viraux ont été emballés dans la capside10 de PHP.eB, purifiés par centrifugation de l’iodixanol, puis concentrés à un titre élevé (génomes viraux >1E13/mL) mesuré par qPCR. Un volume de 0,5 μL a été injecté à chacune des dix profondeurs le long de dix pistes à travers le cortex pour un volume total d’injection de 5 μL/piste. La figure 3A-C montre l’expression de SYFP2 par immunomarquage anti-GFP 113 jours après l’injection du vecteur AAV spécifique de la sous-classe PVALB, CN2045, dans le cortex visuel primaire d’un Macaca nemestrina, mâle adulte. Le transgène SYFP2 est détecté de manière robuste dans de nombreux neurones non pyramidaux dispersés à travers la profondeur corticale, et la plupart des neurones exprimant SYFP2 étaient également immunoréactifs pour PVALB7. La figure 3D montre l’expression native de SYFP2 dans le cortex moteur primaire 64 jours après l’injection du vecteur AAV spécifique de la sous-classe du neurone L5, CN2251. Les neurones marqués SYFP2 ont tous une morphologie pyramidale claire avec somata limité à la couche 5 et des dendrites apicales épaisses caractéristiques. Ces données démontrent sans ambiguïté un contrôle précis de l’expression transgénique dans certaines populations de neurones néocorticaux dans le cerveau du PNH par injection stéréotaxique de vecteurs AAV ciblant des types cellulaires.
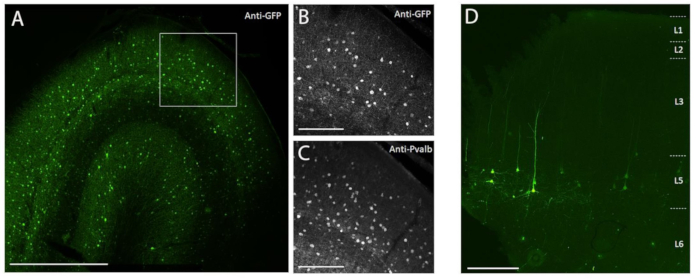
Figure 3 : Exemple d’expression de SYFP2 spécifique au type cellulaire médiée par des vecteurs AAV injectés dans le cerveau des PSN. (A) Photomicrographie par épifluorescence d’une coupe fixe du cortex visuel primaire du macaque 113 jours après l’injection d’un vecteur AAV spécifique à la sous-classe PVALB. Barre d’échelle: 1 mm. (B,C) Image à plus fort agrandissement de la région encadrée affichée en A. (B) Signal anti-GFP. (C) Signal anti-PVALB. Barres d’échelle : 250 μm. (D) Photomicrographie par épifluorescence de la fluorescence native SYFP2 dans une coupe fixe du cortex moteur primaire du macaque 64 jours après l’injection d’un vecteur AAV extratélencéphalique de couche 5 spécifique à la sous-classe. Barre d’échelle: 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour démontrer l’utilité de cette technique d’injection pour les manipulations optogénétiques neurophysiologiques et comportementales, trois expériences ont été réalisées, chacune sur un singe différent (Macaca mulatta). Dans la première expérience (Figure 4A-D), des vecteurs AAV porteurs du transgène channelrhodopsin-2 (AAV1-hSyn1-ChR2-mCherry) ont été injectés dans le colliculus supérieur gauche (SC). Le vecteur a été injecté tous les 250 μm à 19 profondeurs pour un total de 12 μL. Dans la deuxième expérience (Figure 4E-G), 3 μL de solution AAV1-hSyn-ArchT-EYFP ont été injectés dans le noyau réticulaire tegmenti pontis (NRTP). Dans la troisième expérience (Figure 4H-K), 24 μL de solution AAV9-L7-ChR2-mCherry ont été injectés dans le cortex cérébelleux 6. Six à huit semaines après chaque injection, une fibre optique et une électrode de tungstène ont été insérées dans le cerveau via un tube guide à double corps (Figure 1G).
La figure 4B montre la réponse d’un neurone SC à la lumière bleue (450 nm). La lumière continue (1,2 s) à 40 mW a produit une série de potentiels d’action consécutifs (figure 4B, en haut). Les impulsions lumineuses d’une durée de 1 ms n’ont pas réussi à évoquer des potentiels d’action à 40 mW (Figure 4B, au milieu), mais ont évoqué des potentiels d’action de manière fiable à 160 mW, le seul autre niveau de puissance testé, avec une latence de 2,7 ± 0,6 ms (Figure 4B, en bas). Un train d’impulsions (160 mW, fréquence : 300 Hz, rapport cyclique : 15 %, durée : 300 ms) évoquait des saccades de manière constante avec une latence moyenne de 97 ± 32 ms, une amplitude moyenne de 10,4° et un angle moyen de 47° (vers le haut et vers la droite ; Figure 4C).
Conformément aux études qui ont modifié le gain de saccade en utilisant une stimulation électrique inférieure au seuil du SC11,12, la stimulation optique du SC après 15°, 18° et 20° saccades gauche et descendante (225°) a progressivement réduit le gain de saccade (Figure 4D). Cette diminution du gain a nécessité ~250 essais (cercles verts) pour revenir au gain d’avant adaptation (cercles noirs), confirmant sa base dans la plasticité à long terme.
Dans la deuxième expérience (Figure 4E), la projection de fibres moussues du NRTP vers le vermis oculomoteur (OMV) du cortex cérébelleux (lobules VIc et VII) a été optiquement supprimée. La figure 4F montre des fibres moussues marquées par fluorescence et des rosettes dans l’OMV (encadré). La lumière laser jaune (589 nm) a été délivrée à l’OMV via une fibre optique, et une électrode de tungstène à proximité a été utilisée pour enregistrer l’activité des cellules de Purkinje. La figure 4G montre l’activité simple des pics avant (gris) et après (orange) l’inactivation optogénétique des projections NRTP (Figure 4G, en haut). Avant l’inactivation, la cellule de Purkinje présentait un motif de double éclatement pour des saccades de 12° vers la droite (Figure 4G, milieu, gris). Pendant l’inactivation, la cadence de tir a diminué et est passée à un schéma rafale-pause (figure 4G, milieu, orange). La comparaison de ces deux modèles de réponse suggère que l’apport de fibres moussues aux cellules de Purkinje influence la phase de décélération de la saccade en entraînant le deuxième sursaut (Figure 4G, milieu, vert). La variabilité des saccades droites a été réduite pendant l’inactivation optogénétique, conformément à l’idée qu’une partie de la variabilité d’un essai à l’autre dans les mesures de saccade est due à la variabilité des signaux véhiculés par les fibres moussues (Figure 4G, en bas, orange).
Dans la troisième expérience (Figure 4H), les cellules de Purkinje de l’OMV ont été stimulées optogénétiquement (Figure 4I). Un train d’impulsions lumineuses courtes (impulsions de 1,5 ms, 65 mW, 50 Hz) a augmenté l’activité de pointe simple d’une cellule de Purkinje isolée (Figure 4J, en haut). Des impulsions lumineuses individuelles de 1,5 ms évoquaient fréquemment >1 pic simple (figure 4J, en bas). Activation optogénétique simple du pic, programmée pour se produire lors d’une saccade (impulsion lumineuse de 10 ms, 60 mW), augmentation de l’amplitude de la saccade (Figure 4K), confirmant le rôle désinhibiteur des cellules de Purkinje sur le générateur de rafales oculomoteurs.
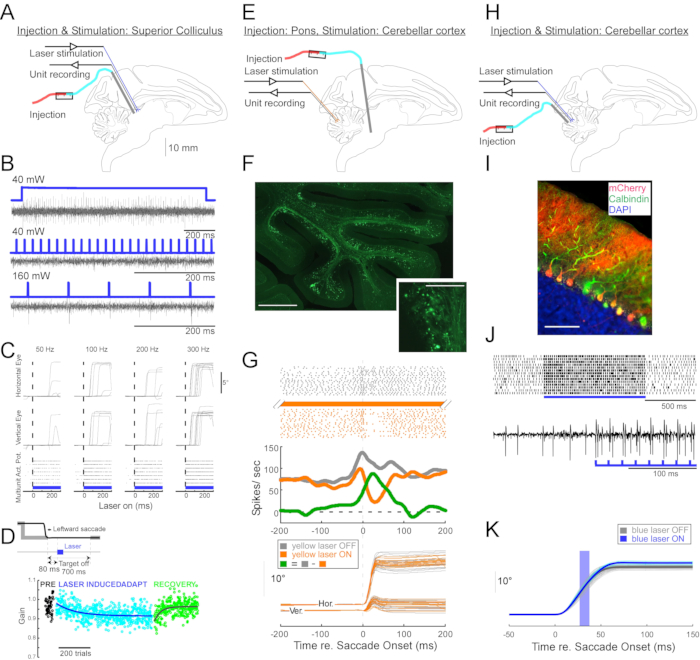
Figure 4 : Résumé de trois expériences optogénétiques réalisées sur des singes éveillés. (A-D) Expérience 1, excitation panneuronale : injection virale, stimulation laser et enregistrement unitaire ont été menées dans le colliculus supérieur (A). (B) Activité unitaire représentative évoquée par la stimulation laser. (C), composantes horizontales (en haut) et verticales (au milieu) des mouvements oculaires et tracé matriciel de l’activité unitaire (en bas) évoquée par la stimulation laser. (D) Une séance représentative d’adaptation de la saccade induite par stimulation laser. La stimulation (100 impulsions laser de 0,5 ms) a été délivrée 80 ms après chaque saccade (encart de jeu). Le gain de saccade (amplitude de la saccade / amplitude cible) a diminué progressivement dans les essais. (E-G) Expérience 2, inhibition spécifique à la voie : un vecteur viral a été injecté dans le nucleus reticularis tegmenti pontis, et une stimulation laser et un enregistrement unitaire ont été réalisés dans le vermis oculomoteur (E). (F) Coupe histologique du vermis oculomoteur montrant les fibres moussues marquées (barre d’échelle: 1 mm) et leurs rosettes (encadré, barre d’échelle: 100 μm). (G) Activité des cellules de Purkinje (en haut : raster, au milieu : taux de tir moyen) et trajectoires des saccades visuellement guidées (en bas) avec et sans stimulation laser. Gris : laser off trials, orange : laser on trials, vert : différence entre le gris et l’orange. (H-K) L’expérience 3, activation spécifique au type cellulaire: injection virale, stimulation laser et enregistrement unitaire ont été menées dans le vermis oculomoteur (H). (I) Coupe histologique du vermis oculomoteur montrant des cellules de Purkinje marquées. Barre d’échelle : 100 μm. (J) Activité de pointe simple d’une cellule de Purkinje évoquée par stimulation laser. En haut : tracé matriciel de 14 essais. En bas : trace de tension à partir d’un seul essai représentatif. (K) Trajectoires de saccades visuellement guidées avec et sans stimulation laser. Une impulsion lumineuse de 10 ms pendant les saccades a augmenté les amplitudes de saccade. Trajectoires individuelles de saccades (cyan) et leur moyenne (bleu) sur les essais laser. Trajectoires individuelles de saccades (gris clair) et leur moyenne (gris foncé) sur les essais laser-off. La longueur d’onde lumineuse était de 450 nm dans les expériences 1 et 3 et de 589 nm dans l’expérience 2. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les progrès de l’optogénétique des PSN ont créé un besoin de méthodes d’injection intracrâniennes précises et fiables. Les avantages de la méthode décrite dans ce rapport sont qu’elle est peu coûteuse, utilise des composants stérilisables et jetables, et a la capacité de cibler diverses zones du cerveau de n’importe quelle profondeur. Il permet également de contrôler la vitesse et le volume d’injection en raison de la vitesse à laquelle la soupape d’air peut être contrôlée. La pression de l’air peut être augmentée transitoirement pour déloger un bouchon, puis réduite rapidement pour éviter une surinjection ultérieure qui serait produite par une pression soutenue. Les composants jetables réduisent le risque de contamination croisée entre les sites d’injection.
Les étapes critiques de ce protocole d’injection comprennent la construction de canules de haute qualité, leur chargement sans introduction de bulles et la sélection de sites d’injection qui ne sont pas trop proches les uns des autres. Les injections espacées de ≥1 cm transduisent généralement des régions qui ne se chevauchent pas, mais cette heuristique dépend du sérotype, du titre, du promoteur, du volume, de la cible et de la méthode de détection du virus. La sélection de sites d’injection qui ne sont pas directement connectés permet d’éviter les confusions potentielles produites par le trafic d’opsine le long des axones et la propension de certains sérotypes AAV à la transduction rétrograde.
La méthode peut être utilisée pour injecter des PSN pendant l’anesthésie et dans un cadre stéréotaxique (figure 3) ou en alerte et tête fixe (figure 4). La première a l’avantage de permettre de cibler les injections en coordonnées stéréotaxiques, et elle permet une confirmation visuelle de la pénétration de la canule par une durotomie aiguë (inciser la dure-mère chez un singe éveillé, par une craniotomie chronique, augmente le risque d’infection). Cette dernière approche présente l’avantage de réduire le nombre de chirurgies de survie et donc le stress de l’animal, d’être compatible avec les enregistrements électrophysiologiques pendant le comportement, et d’utiliser le même cadre de coordonnées et la même instrumentation utilisés pour insérer des fibres optiques pour les expériences post-injection. La technique d’injection chez les singes éveillés pourrait être encore améliorée en faisant des injections à travers la dure-mère artificielle13,14,15. Cela conférerait les avantages supplémentaires de la visualisation directe des sites d’injection et de la fluorescence tissulaire qui indique une transduction réussie.
Plusieurs autres techniques d’injection d’AAV ont été utilisées dans les PSN. Récemment, un dispositif d’injection multicanal a été mis au point pour administrer uniformément des vecteurs AAV aux grandes régions corticales des PSN16. Des résultats similaires peuvent être obtenus en utilisant la livraison améliorée par convection17,18. Ces méthodes visent à maximiser la propagation de la transduction, ce qui est un objectif important mais distinct de la précision spatiale que notre méthode vise à atteindre.
Une autre méthode consiste à injecter des vecteurs AAV à travers un tube borosilicaté qui est biseauté à une pointe tranchante à une extrémité et attaché à une seringue Hamilton à l’autre 5,6. Cette méthode a beaucoup en commun avec la méthode décrite dans cet article. Le vecteur viral est maintenu dans une longueur de tube, l’espace dans le tube derrière le virus est rempli d’huile teintée et le flux du vecteur est surveillé via le mouvement du ménisque vecteur huileux. Cette technique alternative nécessite moins d’équipement et de préparation, mais elle nécessite d’aspirer de l’huile dans le tube borosilicaté à travers la pointe biseautée par pression négative et de charger le vecteur par la même voie par la suite. Il en résulte inévitablement des traces d’huile délivrées au cerveau. De plus, selon notre expérience, le tube en borosilicate doit avoir un diamètre de ~350 μm pour pénétrer dans la dure-mère même lorsqu’il est biseauté et cause donc des dommages mécaniques plus importants que la canule métallique plus mince décrite dans cet article (Figure 2D). Un tube de 30 G a été utilisé parce que sa charge de flambement critique est suffisamment élevée pour faciliter la pénétration de la dure-mère malgré une longueur de 1 à 10 cm, parce qu’il s’adapte étroitement au tube en PTFE et parce qu’il est rarement obstrué. Le tube de 33 G se bouche et se plie plus facilement et est plus difficile à accoupler avec le tube en PTFE. Les tubes de 36 G ne sont pas suffisamment rigides pour pénétrer dans la dure-mère des PSN.
Une autre technique d’injection alternative consiste à coupler la sortie de la pompe à air à l’arrière d’une pipette en verre tiré à chargement vectoriel19. Le vecteur est forcé de la pointe de la pipette par la pression d’air directe et intermittente de la pompe, éliminant ainsi le besoin d’huile. Semblable à la méthode monotube expliquée ci-dessus, l’absence de jonctions matérielles entre le ménisque et l’extrémité de la canule réduit le risque de fuites. Cependant, la conicité tranchante et les extrémités délicates des pipettes en verre les empêchent de pénétrer dans la dure-mère des PSN ou de cibler les structures profondes.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été soutenue par WaNPRC / ITHS P51OD010425 (JTT), National Institute of Health (NIH) subventions EY023277 (R01 pour YK), EY030441 (R01 pour GH), MH114126 (RF1 à JTT, Boaz Levi, Ed Lein), MH120095 (UG3 pour JTT et GH), EY028902 (R01 pour RS), et rendue possible par les subventions NIH OD010425 (P51 pour WaNPRC) et University of Washington Royalty Research Fund A148416. Les auteurs tiennent à remercier Yasmine El-Shamayleh et Victoria Omstead pour l’histologie, Refugio Martinez pour le clonage de vecteurs viraux et John Mich pour son aide au traitement des tissus cérébraux des PSN.
matériels
| Name | Company | Catalog Number | Comments |
| Equipment: Stereotaxic set | |||
| Item | |||
| Allen keys | BONDHUS | 10936 | STERRAD |
| Cannula holder | KOPF | 1770 | STERRAD |
| Carrier (manipulator) | KOPF | 1404 | STERRAD |
| Carrier platform | KOPF | 1430 | NA |
| Carrier stand | KOPF | 1449 | STERRAD |
| Eye, ear, mouth bars | KOPF | 1430 | NA |
| Stereotaxic base | KOPF | 1210 | NA |
| Equipment: Cannula | |||
| Item | |||
| 1 mL Luer-lock syringes | BD | 309628 | NA (sterilized package) |
| Cannulas* | (homemade - see below) | NA | steam (autoclave) |
| Colored oil** | (homemade - see below) | NA | NA |
| Elevator (for tube rack) | Cole-Parmer | UX-08057-10 | STERRAD |
| Filter tip | Genesee Scientific | 23-404 | NA (sterilized package) |
| Fluorescent microbeads | Lumafluor | R170 | NA |
| P20 pipetman | Gilson | FA10003M | NA |
| PCR tubes | Olympus Plastics | 22-161 | STERRAD |
| Stopcock | Cole-Parmer | 3060004 | STERRAD |
| Tube rack | homemade | NA | STERRAD |
| Vector solution | (homemade) | NA | NA |
| Equipment: Electric air pump set | |||
| Item | |||
| Electric air pump | World Precision Instruments | PV830 | NA |
| Foot pedal | World Precision Instruments | 3260 | NA |
| Tube cover | EZ Drape | A400-1000 | NA (sterilized package) |
| Equipment: General surgery tools | |||
| Item | |||
| Beaker | MEDLINE | azlon | STERRAD |
| Burrs | STRYKER | 277-10-235 | STERRAD |
| Double pronged tissue pick | Fine Science Tools | 18067-11 | STERRAD |
| Drapes | MEDLINE | DYNJP3004 | NA (sterilized package) |
| Dressing forceps | Miltex | 6-118 | STERRAD |
| Drill | STRYKER | Q9R-5400 | NA |
| Drill bits | STRYKER | 277-82-87 | STERRAD |
| Gauze | MEDLINE | NON26334 | NA (sterilized package) |
| Hemostatic mosquito forceps | Miltex | 7-2, 7-4 | STERRAD |
| Light handles | SKYTRON | Stellar XL | STERRAD |
| Needle hodler | Miltex | 8-2 | STERRAD |
| Periosteal elevator | Miltex | 18-1968 | STERRAD |
| Rongeurs | Miltex | 17-4800 | STERRAD |
| Saline | BAXTER | 2F7122 | STERRAD |
| Scalpel | Bard-Parker | 372610 | STERRAD |
| Scissors | Miltex | 5-12, 5-114 | STERRAD |
| Senn retractors | Miltex | 28065 | STERRAD |
| Sterile gloves | MEDLINE | Triumph Micro | NA (sterilized package) |
| Suction | medela | 200-4869 | NA |
| Suction tip | MEDLINE | DYNDFR12S | NA (sterilized package) |
| Suction tube | COVIDEN | 8888301614 | NA (sterilized package) |
| Surgical gowns | MEDLINE | DYNJP2002S | NA (sterilized package) |
| Surgical pens & ruler | MEDLINE | DYNJSM03 | NA (sterilized package) |
| Suture | COVIDEN | SL-635 | NA (sterilized package) |
| Tissue forceps | Miltex | 6-114 | STERRAD |
| Towel clamps | Miltex | 7-504 | STERRAD |
| Wood swabs | MEDLINE | MDS202095 | NA (sterilized package) |
| Equipment: *cannulas | |||
| Item | |||
| Hypodermic needle | EXELINT INTERNATIONAL | 26437 | NA (sterilized package) |
| Stainless steel tube | K-TUBE | K30R | NA |
| PTFE tube | ZEUS | 216200 | NA |
| Equipment: **colored oil | |||
| Item | |||
| Liquid Candle Dye Concentrate | PremiumCraft | Red/Pink | NA |
| Mineral oil | Vi-Jon | S0883 | NA |
| STERRAD: low-temperature hydrogen peroxide gas plasma |
Références
- Kojima, Y., Robinson, F. R., Soetedjo, R. Cerebellar fastigial nucleus influence on ipsilateral abducens activity during saccades. Journal of Neurophysiology. 111 (8), 1553-1563 (2014).
- Kojima, Y., Soetedjo, R. Elimination of the error signal in the superior colliculus impairs saccade motor learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8987-8995 (2018).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effects of GABA agonist and antagonist injections into the oculomotor vermis on horizontal saccades. Brain Research. 1366, 93-100 (2010).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effect of inactivation and disinhibition of the oculomotor vermis on saccade adaptation. Brain Research. 1401, 30-39 (2011).
- De, A., El-Shamayleh, Y., Horwitz, G. D. Fast and reversible neural inactivation in macaque cortex by optogenetic stimulation of GABAergic neurons. eLife. 9, 52658 (2020).
- El-Shamayleh, Y., Kojima, Y., Soetedjo, R., Horwitz, G. D. Selective optogenetic control of Purkinje cells in monkey cerebellum. Neuron. 95 (1), 51-62 (2017).
- Mich, J. K., et al. Functional enhancer elements drive subclass-selective expression from mouse to primate neocortex. Cell Reports. 34 (13), 108754 (2021).
- Graybuck, L. T., et al. Enhancer viruses for combinatorial cell subclass-specific labeling. Neuron. (21), 00159 (2020).
- Michel, J., Benninger, D., Dietz, V., van Hedel, H. J. Obstacle stepping in patients with Parkinson's disease. Complexity does influence performance. Journal of Neurology. 256 (3), 457-463 (2009).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Kaku, Y., Yoshida, K., Iwamoto, Y. Learning signals from the superior colliculus for adaptation of saccadic eye movements in the monkey. Journal of Neuroscience. 29 (16), 5266-5275 (2009).
- Soetedjo, R., Fuchs, A. F., Kojima, Y. Subthreshold activation of the superior colliculus drives saccade motor learning. Journal of Neuroscience. 29 (48), 15213-15222 (2009).
- Kleinbart, J. E., et al. A modular implant system for multimodal recording and manipulation of the primate brain. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual International Conference. 2018, 3362-3365 (2018).
- Arieli, A., Grinvald, A., Slovin, H. Dural substitute for long-term imaging of cortical activity in behaving monkeys and its clinical implications. Journal of Neuroscience Methods. 114 (2), 119-133 (2002).
- Ruiz, O., et al. Optogenetics through windows on the brain in the nonhuman primate. Journal of Neurophysiology. 110 (6), 1455-1467 (2013).
- Fredericks, J. M., et al. Methods for mechanical delivery of viral vectors into rhesus monkey brain. Journal of Neuroscience Methods. 339, 108730 (2020).
- Bankiewicz, K. S., et al. Convection-enhanced delivery of AAV vector in parkinsonian monkeys; in vivo detection of gene expression and restoration of dopaminergic function using pro-drug approach. Experimental Neurology. 164 (1), 2-14 (2000).
- Yazdan-Shahmorad, A., et al. Widespread optogenetic expression in macaque cortex obtained with MR-guided, convection enhanced delivery (CED) of AAV vector to the thalamus. Journal of Neuroscience Methods. 293, 347-358 (2018).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon