Method Article
Inyecciones de vectores AAV para optogenética en cerebro de primates no humanos anestesiados y despiertos
En este artículo
Resumen
Tal como se implementa actualmente, la optogenética en primates no humanos requiere la inyección de vectores virales en el cerebro. Un método de inyección óptimo debe ser confiable y, para muchas aplicaciones, capaz de dirigirse a sitios individuales de profundidad arbitraria que se identifican de manera fácil e inequívoca en la histología postmortem. Se presenta un método de inyección con estas propiedades.
Resumen
Las técnicas optogenéticas han revolucionado la investigación en neurociencia y están preparadas para hacer lo mismo con la terapia génica neurológica. El uso clínico de la optogenética, sin embargo, requiere que la seguridad y la eficacia se demuestren en modelos animales, idealmente en primates no humanos (NHP), debido a su similitud neurológica con los humanos. El número de vectores candidatos que son potencialmente útiles para la neurociencia y la medicina es enorme, y todavía no existe ningún medio de alto rendimiento para probar estos vectores. Por lo tanto, existe la necesidad de técnicas para realizar múltiples inyecciones espacial y volumétricamente precisas de vectores virales en el cerebro NHP que puedan identificarse inequívocamente a través de la histología postmortem. Aquí se describe un método de este tipo. Las cánulas de inyección están construidas a partir de tubos acoplados de politetrafluoroetileno y acero inoxidable. Estas cánulas son esterilizables en autoclave, desechables y tienen bajos volúmenes de carga mínima, lo que las hace ideales para la inyección de soluciones de vectores virales costosas y altamente concentradas. Un aceite mineral inerte teñido de rojo llena el espacio muerto y forma un menisco visible con la solución vectorial, lo que permite una medición instantánea y precisa de las tasas y volúmenes de inyección. El aceite se carga en la parte posterior de la cánula, lo que reduce el riesgo de coinyección con el vector. Las cánulas se pueden cargar en 10 minutos y las inyecciones se pueden hacer en 20 minutos. Este procedimiento es muy adecuado para inyecciones en animales despiertos o anestesiados. Cuando se utiliza para administrar vectores virales de alta calidad, este procedimiento puede producir una expresión robusta de proteínas optogenéticas, lo que permite el control óptico de la actividad neuronal y el comportamiento en los NHP.
Introducción
La optogenética en primates no humanos (NHP) generalmente implica la inyección de vector viral directamente en el cerebro. Una clase de vectores que es muy adecuado para esta aplicación se basa en el virus adenoasociado (AAV). Estos vectores consisten en una cápside proteica que rodea un genoma de ADN monocatenario que, a su vez, consiste en un promotor, un gen de opsina y, opcionalmente, otros elementos codificadores y reguladores de genes. Los avances en la clonación molecular han facilitado la manipulación y combinación de estos componentes para el desarrollo de nuevos vectores. En consecuencia, la colección de vectores AAV que es potencialmente útil para la optogenética NHP es grande y está creciendo rápidamente.
En la actualidad, la utilidad de un vector AAV para la optogenética NHP requiere pruebas in vivo. Este hecho es una barrera sustancial para el progreso. Los animales deben usarse con moderación, y probar múltiples vectores en un solo animal requiere que los sitios de inyección se coloquen juiciosamente en relación con la arquitectura neuronal y bien separados en relación con la propagación viral. La evaluación histológica precisa requiere que las inyecciones sean espacial y volumétricamente precisas. Una técnica de inyección previamente utilizada para la administración focal de agentes farmacológicos 1,2,3,4 fue adaptada y simplificada para realizar tales inyecciones. Esta técnica de inyección es económica, utiliza componentes desechables y esterilizables, se puede usar en monos anestesiados o despiertos, y se puede usar para atacar diversas áreas del cerebro de cualquier profundidad. El siguiente protocolo describe los procedimientos paso a paso para fabricar los componentes desechables y hacer inyecciones en el cerebro NHP. Se discuten las ventajas y desventajas de la técnica.
Protocolo
Todos los experimentos se realizaron de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio y superaron los requisitos mínimos recomendados por el Instituto de Recursos para Animales de Laboratorio y la Asociación Internacional para la Evaluación y Acreditación del Cuidado de Animales de Laboratorio. Todos los procedimientos fueron evaluados y aprobados por el Comité de Cuidado y Uso de Animales de la Universidad de Washington (protocolo UW IACUC # 4167-01). Cinco macacos sanos (2 Macaca mulatta, 3 Macaca nemestrina; macho. 4-11 años) participaron en este estudio. Se utilizaron instrumentos y técnicas estériles en todos los procedimientos quirúrgicos.
1. Hacer una cánula (Figura 1A)
- Preparación de cada parte
- Romar la punta de una aguja hipodérmica (30 G, 13 mm de longitud) con una amoladora de disco.
- Corte un tubo de acero inoxidable (30 G, diámetro interior = 0,16 mm, diámetro exterior = 0,31 mm) a una longitud adaptada a la profundidad del área cerebral objetivo (25 mm es muy adecuado para inyectar la superficie dorsal de la corteza cerebral). Con una amoladora de disco, biselar un extremo del tubo cortado y alisar el otro. Desbarbar el interior del tubo con una brocha.
- Corte el tubo de politetrafluoroetileno (PFTE) (diámetro interior = 0,23 mm ± 0,02 mm, pared = 0,23 mm ± 0,02 mm, 1 mm corresponde a 42 nL ± 7 nL de fluido) a una longitud apropiada para la cantidad de solución vectorial a cargar (1 μL de solución vectorial ocupa 24 mm de tubo). Ensartar ambos extremos del tubo de PTFE mediante la inserción de la aguja hipodérmica roma.
- Inserte la aguja hipodérmica roma aproximadamente 5 mm en un extremo del tubo de PTFE. Inserte el extremo no biselado del tubo de acero inoxidable aproximadamente 5 mm en el otro extremo (Figura 1A).
- Realice pruebas previas a la inyección. Inyecte agua filtrada a través del eje de la aguja hipodérmica de la cánula. Confirme que el agua sale del tubo de acero inoxidable biselado desde la punta y que el agua no se escapa de ninguna de las uniones.
2. Procedimiento de inyección para animales anestesiados
- Preparación quirúrgica
- Esterilice los instrumentos y suministros quirúrgicos utilizando los procedimientos de la Tabla de materiales.
- Si es necesario, tome una resonancia magnética de la cabeza para apuntar a las estructuras cerebrales profundas (Figura 2A).
- Inmediatamente antes de la cirugía, sedar a los animales con ketamina (10-15 mg/kg) y administrar antibióticos (cefazolina) y analgésicos (buprenorfina de liberación sostenida y meloxicam) por vía intramuscular. Luego, administre propofol a través de un catéter intravenoso (IV) en las venas safenas o cefálicas.
- Intubar al animal y hacer la transición a gas isoflurano. Confirme la anestesia adecuada mediante la frecuencia cardíaca estable, la presión arterial, la frecuencia respiratoria, los músculos esqueléticos relajados y la ausencia de reflejos palpebrales o de abstinencia.
- Afeitar la cabeza del animal. Aplique ungüento lagrimal artificial a las córneas para evitar que se sequen.
- Preparación del área de inyección
- Coloque la cabeza del animal en el marco estereotáxico. Aplique la solución de exfoliante quirúrgico sobre la piel afeitada con esponjas de gasa, aplique una presión suave para liberar cualquier residuo y enjuague con alcohol isopropílico. Repita este proceso tres veces. Cubra al animal con una cortina fenestrada estéril. Incide la piel y refleja el músculo. Coloque el manipulador en el brazo estereotáxico, colóquelo para apuntar al área del cerebro objetivo y marque la posición de la craneotomía en el cráneo con un bolígrafo esterilizado.
- Retire el manipulador estereotáxico y realice la craneotomía. Incise la duramadre si lo desea (por ejemplo, para visualizar puntos de referencia sulcales). Devuelva el manipulador al brazo estereotáxico.
- Carga de solución vectorial (Figura 1C)
- Transfiera suavemente la solución vectorial a un tubo de PCR esterilizado con un pipete P20, evitando burbujas.
- Fije una cánula, con la punta biselada hacia abajo, a un soporte estereotáxico orientado verticalmente. Conecte una jeringa Luer-lock de 1 ml al cubo de agujas hipodérmicas de la cánula.
- Sumerja la punta biselada de la cánula en la solución vectorial.
NOTA: La jeringa ya debe estar conectada; Adjuntarlo en este punto introduciría burbujas en la solución vectorial. - Cargue la solución en la cánula aplicando una presión negativa suave con la jeringa de 1 ml. Rastree visualmente el menisco entre la solución y el aire.
- Una vez que se haya cargado la solución vectorial, continúe la presión negativa suave hasta que la solución llegue al cubo de la aguja. Retire la jeringa de 1 ml e inyecte el aceite mineral coloreado en el cubo de la aguja hipodérmica.
NOTA: El aceite debe inyectarse lentamente a lo largo de la pared interior del cubo de la aguja para formar un menisco transparente con la solución vectorial y evitar burbujas de aire. - Acople el cubo de aguja hipodérmico a uno de los dos puertos abiertos de una llave de paso Luer-lock de 3 vías.
NOTA: Colocar la aguja hipodérmica en el puerto cerrado introducirá una presión de aire no deseada detrás del aceite. - Cierre el puerto conectado al cubo de agujas hipodérmicas, llene una jeringa de 1 ml con aire y conéctela a cualquiera de los otros dos puertos. Finalmente, cierre el puerto restante de la llave de paso para conectar la jeringa a la cánula.
- Empuje lentamente el aire hacia la cánula. Una vez que el aceite coloreado aparezca en la punta de la aguja roma en el tubo de PTFE, verifique si hay aire entre la solución y el aceite coloreado.
- Si hay aire presente, aplique presión negativa a la jeringa para devolver el aceite coloreado al cubo de la aguja. Retire la burbuja y aplique presión positiva hasta que una gota de solución vectorial sea visible en la punta de la cánula biselada.
- Retire la jeringa de 1 ml para liberar la presión de aire no deseada detrás del aceite y cierre la llave de paso para evitar que el vector salga de la cánula por gravedad.
- Pegue una regla de plástico al tubo de PTFE para medir el movimiento del menisco durante la inyección (Figura 1B, D, F).
- Inserción de la cánula en el área del cerebro objetivo (Figura 1B)
- Fije la cánula al manipulador estereotáxico.
- Transfiera manualmente el tubo de la bomba (que termina en un conector Luer-lock) del asistente no estéril al cirujano. El cirujano debe agarrar el conector Luer-lock a través de la pared de una manga estéril, fijar una segunda llave de paso estéril al conector, pegar la manga firmemente alrededor de ella y luego dejar caer el cuello de la manga, permitiendo que se extienda a lo largo del tubo por gravedad.
- Conecte la llave de paso conectada al tubo de la cánula a la llave de paso conectada a la bomba de aire. Ajuste la bomba de aire a baja presión, enciéndala y aumente la presión hasta que el aceite avance a través de la cánula y una gota de solución vectorial sea visible en la punta de la cánula.
- Ajuste la posición de la regla de plástico en el tubo de PTFE para medir el movimiento del menisco durante la inyección.
- Empuje la cánula hacia abajo con el manipulador estereotáxico y registre la profundidad a la que la punta llega a la superficie (duramadre o piamadre).
- Conduzca la cánula al sitio más profundo para inyectarla a lo largo de la pista. La superficie se atenuará. Si inyecta la corteza superficial, confirme visualmente que la cánula ha penetrado en la superficie, con un microscopio quirúrgico o lupas de aumento si están disponibles.
- Para minimizar la orientación errónea debido a la compresión del tejido, introduzca la cánula lentamente (1 mm / min), rápidamente (0.5 mm / s) con una espera de 1-5 minutos en la parte inferior, o sobrepase el sitio de inyección más profundo en 500 μm y luego retraiga.
- Inyección
- Inyecte 0,5 μL de la solución vectorial con la bomba de aire eléctrica durante 10-30 s. Confirme el flujo de inyección siguiendo el menisco entre el aceite coloreado y la solución vectorial en el tubo de PTFE.
- Espere 1 minuto y retraiga la cánula al siguiente sitio de inyección a lo largo de la pista.
- Después de la inyección final, deje la cánula en su lugar durante 10 minutos para evitar el flujo vectorial.
- Retraiga la cánula y deséchela en un recipiente para objetos punzantes de riesgo biológico.
- Opcionalmente, inyecte una pequeña cantidad (≤1 μL) de microperlas fluorescentes cerca del sitio de inyección del vector para facilitar la identificación del sitio de inyección post mortem.
- Repita este procedimiento como desee para las otras soluciones vectoriales en otras ubicaciones (Figura 2B).
- Cierre de la cirugía
- Suturar la duramadre, el músculo y la piel.
- Retire el mono del marco estereotáxico y retire todos los cables del monitor.
- Retire al mono de la anestesia con isoflurano y extube después del retorno del reflejo de deglución.
- Proporcionar tratamiento postquirúrgico (3-5 días de meloxicam y 7-10 días de cefalexina). Controle al animal al menos una vez cada 10 minutos hasta que sea capaz de mantener una posición estable y erguida.
3. Cirugía e inyección del vector AAV para animales despiertos que se comportan (Figura 1D)
NOTA: Se puede usar una variante de la técnica para hacer inyecciones en los cerebros de monos despiertos que se comportan, como se describe a continuación.
- Inyección simultánea con grabación
- Para registrar la actividad eléctrica en el lugar de la inyección, cubra el exterior de la cánula con epoxi (fondo ~ 15 mm) y tubo de poliimida (longitud restante). Revele el metal en la punta raspando el epoxi de él (Injectrode, Figura 1F)2. Alternativamente, inserte la cánula y un electrodo extracelular separado, uno al lado del otro, en un tubo guía de doble barril (tubo guía de doble barril, Figura 1E).
- Inserción de cánula en el área del cerebro objetivo.
- Coloque al mono en la cabina experimental, restrinja el movimiento de la cabeza y limpie la cámara de grabación montada en el cráneo utilizando técnicas estándar.
- Asegure un tubo guía al microdrive. Inserte la cánula de inyección en el tubo guía.
- Avance la cánula hasta que la punta sobresalga del tubo guía.
- Conecte la llave de paso a la bomba de aire eléctrica. Para confirmar el funcionamiento correcto del sistema, empuje una gota de solución vectorial desde la punta con la bomba de aire y confirme el movimiento del menisco de la solución vectorial de aceite.
- Extraiga la cánula ~ 5 mm en el tubo guía para protegerlo del daño durante la inserción del tubo en el cerebro. Inserte el tubo guía en el cerebro.
- Conduzca la cánula al sitio para inyectarla usando el microdrive. Identifique el sitio objetivo mediante grabación eléctrica (Figura 2C) o estimulación.
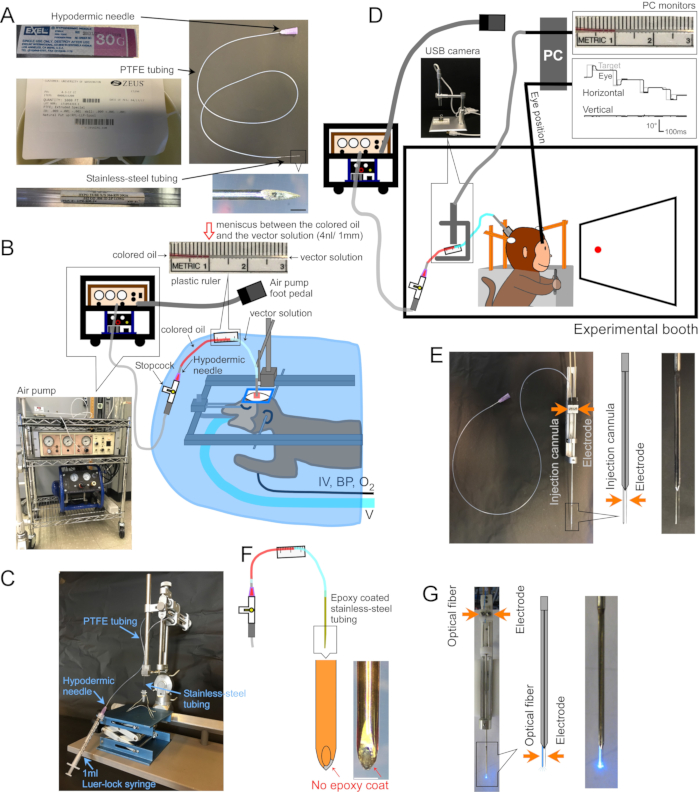
Figura 1: Configuración de la cirugía y el aparato . (A) Cánula de inyección. Se indica cada parte de la cánula. Recuadro en la parte inferior derecha: imagen ampliada de la punta de la cánula, barra de escala: 500 μm. (B) Configuración de la cirugía para monos anestesiados. El mono se coloca en un marco estereotáxico debajo de una cortina quirúrgica. El ventilador (V), la vía intravenosa (IV), el monitor de presión arterial (PA) y el monitor de saturación de oxígeno (O2) están conectados al mono. La cánula de inyección se inserta en el área objetivo utilizando un micromanipulador estereotáxico. La solución vectorial se inyecta mediante una bomba de aire eléctrica (recuadro inferior izquierdo, marrón) acoplada a un compresor de aire (recuadro inferior izquierdo, azul). Una regla de plástico (recuadro superior) se pega con cinta adhesiva al tubo de PTFE para medir el movimiento del menisco entre el aceite coloreado (recuadro superior, rojo) y la solución vectorial (recuadro superior, transparente) durante la inyección. (C) Configuración para cargar la solución vectorial en la cánula. (D) Un mono durante una inyección de solución vectorial en una cabina experimental. La cabeza del animal se mantiene en su lugar mediante tres postes de estabilización, y la posición de los ojos se registra mediante un sistema de bobina de búsqueda escleral. La cánula de inyección se sujeta y se conduce a la profundidad objetivo utilizando un soporte / controlador de microelectrodos. La inyección se controla monitoreando el menisco entre el aceite coloreado y la solución vectorial a través de una cámara USB (imagen insertada). (E) Inyección de tubo guía de doble barril. Un portaconductos/atornillador de tubo guía de doble cañón sostiene una cánula de inyección y un microelectrodo (ver recuadro). f) Inyección. El metal en la punta de la cánula, expuesto al raspar la capa epoxi, proporciona acceso eléctrico a las neuronas (recuadro, barra de escala: 500 μm). (G) Configuración de la estimulación láser. Un portatubos guía de doble barril / controlador contiene una fibra óptica y un microelectrodo (consulte el recuadro). Haga clic aquí para ver una versión más grande de esta figura.
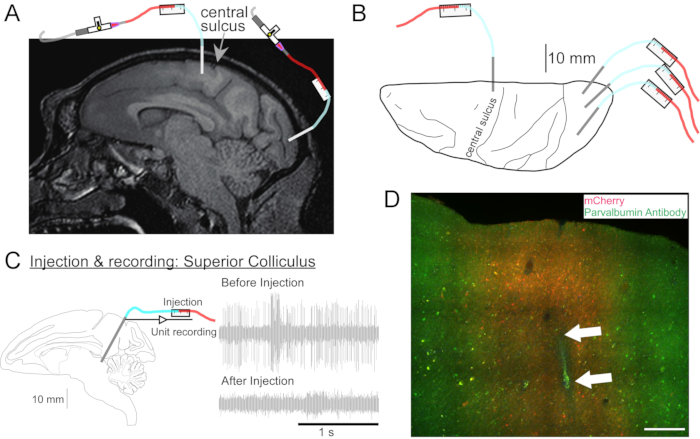
Figura 2: Diagrama de los sitios de inyección de AAV. (A) Sección sagital de la imagen de RM cerebral que muestra los sitios de inyección en la corteza motora primaria y la corteza visual primaria de una Macaca nemestrina. (B) Vista desde la superficie dorsal en la placa Atlas correspondiente que muestra la colocación de la cánula en relación con el surco central (corteza motora primaria) y la corteza visual primaria. (C) Registro unitario por inyección en el colículo superior. Una unidad que se aisló antes de la inyección (parte superior derecha) desapareció después de la inyección (parte inferior derecha). (D) Pista de inyección (flechas blancas). Barra de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
4. Procesamiento del tejido cerebral para histología
- Espere de 6 a 8 semanas después de la inyección para maximizar la expresión transgénica.
NOTA: La duración óptima depende del vector viral exacto utilizado en el experimento. - Procesar el cerebro utilizando técnicas histológicas convencionales para evaluar la eficiencia y selectividad de la transducción 5,6,7.
Resultados
Para demostrar la expresión transgénica mediante inyección estereotáxica in vivo en el cerebro NHP utilizando el método de inyección quirúrgica descrito aquí, se seleccionaron dos vectores que contenían potenciadores que impulsan la expresión de la proteína fluorescente súper amarilla-2 (SYFP2) en distintos tipos neuronales 8,9. Los vectores virales se empaquetaron en la cápside10 de PHP.eB, se purificaron mediante centrifugación con yododinanol y luego se concentraron a un título alto (genomas virales de >1E13 / ml) medidos por qPCR. Se inyectó un volumen de 0,5 μL a cada una de las diez profundidades a lo largo de diez pistas a través de la corteza para un volumen total de inyección de 5 μL / pista. La Figura 3A-C muestra la expresión de SYFP2 a través de inmunotinción anti-GFP 113 días después de la inyección del vector AAV específico de la subclase PVALB, CN2045, en la corteza visual primaria de un macho adulto Macaca nemestrina. El transgén SYFP2 se detecta robustamente en numerosas neuronas no piramidales dispersas por la profundidad cortical, y la mayoría de las neuronas que expresan SYFP2 también fueron inmunorreactivas para PVALB7. La figura 3D muestra la expresión nativa de SYFP2 en la corteza motora primaria 64 días después de la inyección del vector AAV específico de la subclase de neuronas L5, CN2251. Todas las neuronas marcadas con SYFP2 tienen una morfología piramidal clara con somata restringida a la capa 5 y dendritas apicales gruesas características. Estos datos demuestran inequívocamente el control preciso de la expresión transgénica en poblaciones seleccionadas de neuronas neocorticales en el cerebro NHP mediante la inyección estereotáxica de vectores AAV dirigidos a tipo celular.
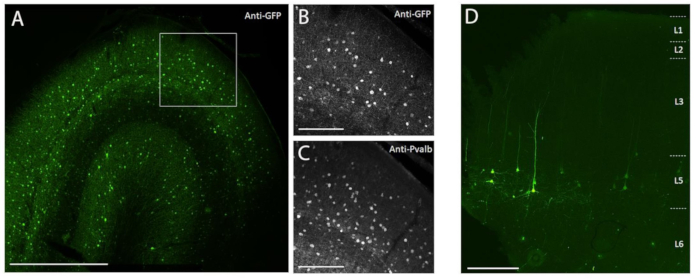
Figura 3: Ejemplo de expresión de SYFP2 específica del tipo celular mediada por vectores AAV inyectados en el cerebro NHP . (A) Fotomicrografía de epifluorescencia de una sección fija de la corteza visual primaria del macaco 113 días después de la inyección de un vector AAV específico de la subclase PVALB. Barra de escala: 1 mm. (B,C) Imagen de mayor aumento de la región en caja que se muestra en A. (B) Señal anti-GFP. (C) Señal anti-PVALB. Barras de escala: 250 μm. (D) Microcrografía de epifluorescencia de fluorescencia nativa de SYFP2 en una sección fija de la corteza motora primaria del macaco 64 días después de la inyección de un vector AAV específico de subclase extratelencefálica de capa 5. Barra de escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
Para demostrar la utilidad de esta técnica de inyección para manipulaciones neurofisiológicas y optogenéticas conductuales, se realizaron tres experimentos, cada uno en un mono diferente (Macaca mulatta). En el primer experimento (Figura 4A-D), se inyectaron vectores AAV portadores del transgén canalrodopsina-2 (AAV1-hSyn1-ChR2-mCherry) en el colículo superior izquierdo (SC). El vector se inyectó cada 250 μm a 19 profundidades para un total de 12 μL. En el segundo experimento (Figura 4E-G), se inyectaron 3 μL de solución AAV1-hSyn-ArchT-EYFP en el núcleo reticularis tegmenti pontis (NRTP). En el tercer experimento (Figura 4H-K), se inyectaron 24 μL de solución AAV9-L7-ChR2-mCherry en la corteza cerebelosa 6. De seis a ocho semanas después de cada inyección, se insertaron una fibra óptica y un electrodo de tungsteno en el cerebro a través de un tubo guía de doble barril (Figura 1G).
La figura 4B muestra la respuesta de una neurona SC a la luz azul (450 nm). La luz continua (1,2 s) a 40 mW produjo una serie de potenciales de acción consecutivos (Figura 4B, arriba). Los pulsos de luz de 1 ms de duración no evocaron potenciales de acción a 40 mW (Figura 4B, centro), pero sí evocaron potenciales de acción de manera confiable a 160 mW, el único otro nivel de potencia probado, con una latencia de 2.7 ± 0.6 ms (Figura 4B, abajo). Un tren de pulsos (160 mW, frecuencia: 300 Hz, ciclo de trabajo: 15%, duración: 300 ms) evocó sacadas consistentemente con una latencia promedio de 97 ± 32 ms, una amplitud media de 10.4° y un ángulo medio de 47° (hacia arriba y hacia la derecha; Figura 4C).
De acuerdo con los estudios que modificaron la ganancia de sacada utilizando estimulación eléctrica subumbral de las sacadas SC11,12, la estimulación óptica de la SC después de 15°, 18° y 20° hacia la izquierda y hacia abajo (225°) redujo gradualmente la ganancia de sacada (Figura 4D). Esta disminución en la ganancia requirió ~ 250 ensayos (círculos verdes) para volver a la ganancia previa a la adaptación (círculos negros), confirmando su base en la plasticidad a largo plazo.
En el segundo experimento (Figura 4E), la proyección de fibra musgosa desde la NRTP al vermis oculomotor (OMV) de la corteza cerebelosa (lóbulos VIc y VII) se suprimió ópticamente. La Figura 4F muestra fibras musgosas y rosetas marcadas con fluorescencia en el OMV (recuadro). La luz láser amarilla (589 nm) se entregó al OMV a través de fibra óptica, y se utilizó un electrodo de tungsteno cercano para registrar la actividad celular de Purkinje. La Figura 4G muestra la actividad de picos simples antes (gris) y después (naranja) de la inactivación optogenética de las proyecciones de NRTP (Figura 4G, arriba). Antes de la inactivación, la célula de Purkinje exhibió un patrón de doble ráfaga para sacadas de 12° hacia la derecha (Figura 4G, medio, gris). Durante la inactivación, la velocidad de disparo disminuyó y cambió a un patrón de ráfaga-pausa (Figura 4G, medio, naranja). La comparación de estos dos patrones de respuesta sugiere que la entrada de fibra musgosa a las células de Purkinje influye en la fase de desaceleración de la sacádica al impulsar la segunda ráfaga (Figura 4G, medio, verde). La variabilidad de las sacadas hacia la derecha se redujo durante la inactivación optogenética, de acuerdo con la idea de que parte de la variabilidad de ensayo a ensayo en las métricas de sacádicas se debe a la variabilidad en las señales transportadas por las fibras musgosas (Figura 4G, abajo, naranja).
En el tercer experimento (Figura 4H), las células de Purkinje del OMV fueron estimuladas optogenéticamente (Figura 4I). Un tren de pulsos de luz cortos (pulsos de 1,5 ms, 65 mW, 50 Hz) aumentó la actividad de pico simple de una célula aislada de Purkinje (Figura 4J, arriba). Los pulsos de luz individuales de 1,5 ms con frecuencia evocaban >1 pico simple (Figura 4J, abajo). Activación de espigas simples optogenéticas, programada para ocurrir durante una sacada (pulso de luz de 10 ms, 60 mW), aumento de la amplitud de la sacada (Figura 4K), lo que confirma el papel desinhibidor de las células de Purkinje en el generador de ráfagas oculomotoras.
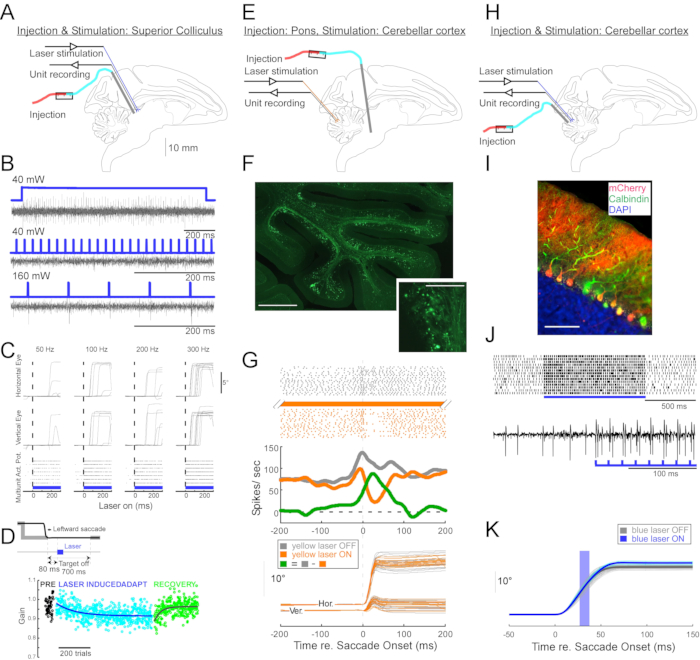
Figura 4: Resumen de tres experimentos optogenéticos realizados en monos despiertos. (A-D) Experimento 1, excitación panneuronal: inyección viral, estimulación láser y registro de unidades se realizaron en el colículo superior (A). (B) Actividad representativa de la unidad evocada por la estimulación láser. (C), componentes horizontales (arriba) y verticales (medio) de los movimientos oculares y diagrama ráster de la actividad unitaria (abajo) evocados por la estimulación láser. (D) Una sesión representativa de adaptación de sacádicas inducida por estimulación láser. La estimulación (100 pulsos de láser de 0,5 ms) se administró 80 ms después de cada sacada (recuadro). La ganancia de sacádica (amplitud de sacádica / amplitud objetivo) disminuyó gradualmente a lo largo de los ensayos. (E-G) Experimento 2, inhibición específica de la vía: se inyectó un vector viral en el núcleo reticularis tegmenti pontis, y se realizó estimulación láser y registro de unidades en el vermis oculomotor (E). (F) Sección histológica del vermis oculomotor que muestra fibras musgosas marcadas (barra de escala: 1 mm) y sus rosetas (recuadro, barra de escamas: 100 μm). (G) Actividad celular de Purkinje (arriba: ráster, medio: velocidad de disparo promedio) y trayectorias de sacadas guiadas visualmente (abajo) con y sin estimulación láser. Gris: láser apagado ensayos, naranja: láser en ensayos, verde: diferencia entre gris y naranja. (H-K) Experimento 3, activación específica del tipo celular: inyección viral, estimulación láser y registro de unidades se realizaron en el vermis oculomotor (H). (I) Sección histológica del vermis oculomotor mostrando células de Purkinje marcadas. Barra de escala: 100 μm. (J) Actividad de pico simple de una célula de Purkinje evocada por estimulación láser. Arriba: diagrama ráster de 14 ensayos. Abajo: traza de voltaje de una sola prueba representativa. (K) Trayectorias de sacadas guiadas visualmente con y sin estimulación láser. Un pulso de luz de 10 ms durante las sacadas aumentó las amplitudes de las sacadas. Trayectorias de sacádica individuales (cian) y su promedio (azul) en ensayos con láser. Trayectorias de sacádica individuales (gris claro) y su promedio (gris oscuro) en ensayos sin láser. La longitud de onda de la luz fue de 450 nm en los experimentos 1 y 3 y fue de 589 nm en el experimento 2. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los avances en la optogenética de NHP han creado la necesidad de métodos de inyección intracraneal precisos y confiables. Las ventajas del método descrito en este informe son que es barato, utiliza componentes esterilizables y desechables, y tiene la capacidad de dirigirse a diversas áreas del cerebro de cualquier profundidad. También permite controlar la velocidad y el volumen de inyección en virtud de la velocidad con la que se puede controlar la válvula de aire. La presión del aire puede aumentarse transitoriamente para desalojar una obstrucción y luego reducirse rápidamente para evitar la sobreinyección posterior que se produciría por la presión sostenida. Los componentes desechables reducen el riesgo de contaminación cruzada entre los sitios de inyección.
Los pasos críticos en este protocolo de inyección incluyen la construcción de cánulas de alta calidad, cargarlas sin introducir burbujas y seleccionar sitios de inyección que no estén demasiado juntos. Las inyecciones a ≥1 cm de distancia generalmente transducen regiones no superpuestas, pero esta heurística depende del serotipo viral, título, promotor, volumen, objetivo y método de detección. La selección de sitios de inyección que no están directamente conectados evita posibles confusiones producidas por el tráfico de opsinas a lo largo de los axones y la propensión de algunos serotipos AAV a la transducción retrógrada.
El método se puede utilizar para inyectar NHP mientras está anestesiado y en un marco estereotáxico (Figura 3) o alerta y cabeza fija (Figura 4). El primero tiene la ventaja de permitir que las inyecciones se dirijan en coordenadas estereotáxicas, y permite la confirmación visual de la penetración de la cánula a través de una durotomía aguda (incidir la duramadre en un mono despierto, a través de una craneotomía crónica, eleva el riesgo de infección). Este último enfoque tiene las ventajas de reducir el número de cirugías de supervivencia y, por lo tanto, el estrés para el animal, siendo compatible con los registros electrofisiológicos durante el comportamiento, y utilizando el mismo marco de coordenadas e instrumentación utilizada para insertar fibras ópticas para experimentos posteriores a la inyección. La técnica de inyección en monos despiertos podría mejorarse aún más haciendo inyecciones a través de duramadre artificial13,14,15. Esto conferiría las ventajas adicionales de la visualización directa de los sitios de inyección y la fluorescencia tisular que indica una transducción exitosa.
Varias otras técnicas de inyección de AAV se han utilizado en NHP. Recientemente, se desarrolló un dispositivo de inyección multicanal para administrar vectores AAV de manera uniforme a grandes regiones corticales de NHP16. Se pueden obtener resultados similares utilizando la administración mejorada por convección17,18. Estos métodos tienen como objetivo maximizar la propagación de la transducción, que es un objetivo importante pero que es distinto de la precisión espacial que nuestro método pretende lograr.
Otro método alternativo es inyectar vectores AAV a través de tubos de borosilicato que se biselan a una punta afilada en un extremo y se unen a una jeringa de Hamilton en el otro 5,6. Este método tiene mucho en común con el método descrito en este artículo. El vector viral se mantiene en una longitud de tubo, el espacio en el tubo detrás del virus se llena con aceite teñido y el flujo del vector se monitorea a través del movimiento del menisco vector de aceite. Esta técnica alternativa requiere menos equipo y preparación, pero requiere extraer aceite en el tubo de borosilicato a través de la punta biselada por presión negativa y cargar el vector por la misma ruta posteriormente. Esto inevitablemente resulta en rastros de aceite entregados al cerebro. Además, en nuestra experiencia, el tubo de borosilicato debe tener un diámetro de ~ 350 μm para penetrar la duramadre incluso cuando está biselado y, por lo tanto, causa un mayor daño mecánico que la cánula metálica más delgada descrita en este documento (Figura 2D). Se utilizó un tubo de 30 G porque su carga crítica de pandeo es lo suficientemente alta como para mediar la penetración de la duramadre a pesar de una longitud de 1-10 cm, porque se ajusta firmemente al tubo de PTFE y porque rara vez se obstruye. El tubo de 33 G se obstruye y se dobla más fácilmente y es más difícil de acoplar con el tubo de PTFE. El tubo de 36 G no es lo suficientemente rígido como para penetrar la duramadre NHP.
Otra técnica de inyección alternativa es acoplar la salida de la bomba de aire a la parte posterior de una pipeta de vidrio tirado cargada con vectores19. El vector es forzado desde la punta de la pipeta por la presión de aire directa e intermitente de la bomba, eliminando la necesidad de aceite. Similar al método de un solo tubo explicado anteriormente, la falta de uniones de material entre el menisco y la punta de la cánula reduce el riesgo de fugas. Sin embargo, la afición cónica y las delicadas puntas de las pipetas de vidrio evitan que penetren en la duradura NHP o se dirijan a estructuras profundas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado por WaNPRC / ITHS P51OD010425 (JTT), subvenciones del Instituto Nacional de Salud (NIH) EY023277 (R01 para YK), EY030441 (R01 para GH), MH114126 (RF1 a JTT, Boaz Levi, Ed Lein), MH120095 (UG3 para JTT y GH), EY028902 (R01 para RS), y fue posible gracias a las subvenciones de NIH OD010425 (P51 para WaNPRC) y el Fondo de Investigación de Regalías de la Universidad de Washington A148416. Los autores desean agradecer a Yasmine El-Shamayleh y Victoria Omstead por la histología, a Refugio Martínez por la clonación de vectores virales y a John Mich por su ayuda con el procesamiento del tejido cerebral NHP.
Materiales
| Name | Company | Catalog Number | Comments |
| Equipment: Stereotaxic set | |||
| Item | |||
| Allen keys | BONDHUS | 10936 | STERRAD |
| Cannula holder | KOPF | 1770 | STERRAD |
| Carrier (manipulator) | KOPF | 1404 | STERRAD |
| Carrier platform | KOPF | 1430 | NA |
| Carrier stand | KOPF | 1449 | STERRAD |
| Eye, ear, mouth bars | KOPF | 1430 | NA |
| Stereotaxic base | KOPF | 1210 | NA |
| Equipment: Cannula | |||
| Item | |||
| 1 mL Luer-lock syringes | BD | 309628 | NA (sterilized package) |
| Cannulas* | (homemade - see below) | NA | steam (autoclave) |
| Colored oil** | (homemade - see below) | NA | NA |
| Elevator (for tube rack) | Cole-Parmer | UX-08057-10 | STERRAD |
| Filter tip | Genesee Scientific | 23-404 | NA (sterilized package) |
| Fluorescent microbeads | Lumafluor | R170 | NA |
| P20 pipetman | Gilson | FA10003M | NA |
| PCR tubes | Olympus Plastics | 22-161 | STERRAD |
| Stopcock | Cole-Parmer | 3060004 | STERRAD |
| Tube rack | homemade | NA | STERRAD |
| Vector solution | (homemade) | NA | NA |
| Equipment: Electric air pump set | |||
| Item | |||
| Electric air pump | World Precision Instruments | PV830 | NA |
| Foot pedal | World Precision Instruments | 3260 | NA |
| Tube cover | EZ Drape | A400-1000 | NA (sterilized package) |
| Equipment: General surgery tools | |||
| Item | |||
| Beaker | MEDLINE | azlon | STERRAD |
| Burrs | STRYKER | 277-10-235 | STERRAD |
| Double pronged tissue pick | Fine Science Tools | 18067-11 | STERRAD |
| Drapes | MEDLINE | DYNJP3004 | NA (sterilized package) |
| Dressing forceps | Miltex | 6-118 | STERRAD |
| Drill | STRYKER | Q9R-5400 | NA |
| Drill bits | STRYKER | 277-82-87 | STERRAD |
| Gauze | MEDLINE | NON26334 | NA (sterilized package) |
| Hemostatic mosquito forceps | Miltex | 7-2, 7-4 | STERRAD |
| Light handles | SKYTRON | Stellar XL | STERRAD |
| Needle hodler | Miltex | 8-2 | STERRAD |
| Periosteal elevator | Miltex | 18-1968 | STERRAD |
| Rongeurs | Miltex | 17-4800 | STERRAD |
| Saline | BAXTER | 2F7122 | STERRAD |
| Scalpel | Bard-Parker | 372610 | STERRAD |
| Scissors | Miltex | 5-12, 5-114 | STERRAD |
| Senn retractors | Miltex | 28065 | STERRAD |
| Sterile gloves | MEDLINE | Triumph Micro | NA (sterilized package) |
| Suction | medela | 200-4869 | NA |
| Suction tip | MEDLINE | DYNDFR12S | NA (sterilized package) |
| Suction tube | COVIDEN | 8888301614 | NA (sterilized package) |
| Surgical gowns | MEDLINE | DYNJP2002S | NA (sterilized package) |
| Surgical pens & ruler | MEDLINE | DYNJSM03 | NA (sterilized package) |
| Suture | COVIDEN | SL-635 | NA (sterilized package) |
| Tissue forceps | Miltex | 6-114 | STERRAD |
| Towel clamps | Miltex | 7-504 | STERRAD |
| Wood swabs | MEDLINE | MDS202095 | NA (sterilized package) |
| Equipment: *cannulas | |||
| Item | |||
| Hypodermic needle | EXELINT INTERNATIONAL | 26437 | NA (sterilized package) |
| Stainless steel tube | K-TUBE | K30R | NA |
| PTFE tube | ZEUS | 216200 | NA |
| Equipment: **colored oil | |||
| Item | |||
| Liquid Candle Dye Concentrate | PremiumCraft | Red/Pink | NA |
| Mineral oil | Vi-Jon | S0883 | NA |
| STERRAD: low-temperature hydrogen peroxide gas plasma |
Referencias
- Kojima, Y., Robinson, F. R., Soetedjo, R. Cerebellar fastigial nucleus influence on ipsilateral abducens activity during saccades. Journal of Neurophysiology. 111 (8), 1553-1563 (2014).
- Kojima, Y., Soetedjo, R. Elimination of the error signal in the superior colliculus impairs saccade motor learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8987-8995 (2018).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effects of GABA agonist and antagonist injections into the oculomotor vermis on horizontal saccades. Brain Research. 1366, 93-100 (2010).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effect of inactivation and disinhibition of the oculomotor vermis on saccade adaptation. Brain Research. 1401, 30-39 (2011).
- De, A., El-Shamayleh, Y., Horwitz, G. D. Fast and reversible neural inactivation in macaque cortex by optogenetic stimulation of GABAergic neurons. eLife. 9, 52658(2020).
- El-Shamayleh, Y., Kojima, Y., Soetedjo, R., Horwitz, G. D. Selective optogenetic control of Purkinje cells in monkey cerebellum. Neuron. 95 (1), 51-62 (2017).
- Mich, J. K., et al. Functional enhancer elements drive subclass-selective expression from mouse to primate neocortex. Cell Reports. 34 (13), 108754(2021).
- Graybuck, L. T., et al. Enhancer viruses for combinatorial cell subclass-specific labeling. Neuron. (21), 00159(2020).
- Michel, J., Benninger, D., Dietz, V., van Hedel, H. J. Obstacle stepping in patients with Parkinson's disease. Complexity does influence performance. Journal of Neurology. 256 (3), 457-463 (2009).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Kaku, Y., Yoshida, K., Iwamoto, Y. Learning signals from the superior colliculus for adaptation of saccadic eye movements in the monkey. Journal of Neuroscience. 29 (16), 5266-5275 (2009).
- Soetedjo, R., Fuchs, A. F., Kojima, Y. Subthreshold activation of the superior colliculus drives saccade motor learning. Journal of Neuroscience. 29 (48), 15213-15222 (2009).
- Kleinbart, J. E., et al. A modular implant system for multimodal recording and manipulation of the primate brain. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual International Conference. 2018, 3362-3365 (2018).
- Arieli, A., Grinvald, A., Slovin, H. Dural substitute for long-term imaging of cortical activity in behaving monkeys and its clinical implications. Journal of Neuroscience Methods. 114 (2), 119-133 (2002).
- Ruiz, O., et al. Optogenetics through windows on the brain in the nonhuman primate. Journal of Neurophysiology. 110 (6), 1455-1467 (2013).
- Fredericks, J. M., et al. Methods for mechanical delivery of viral vectors into rhesus monkey brain. Journal of Neuroscience Methods. 339, 108730(2020).
- Bankiewicz, K. S., et al. Convection-enhanced delivery of AAV vector in parkinsonian monkeys; in vivo detection of gene expression and restoration of dopaminergic function using pro-drug approach. Experimental Neurology. 164 (1), 2-14 (2000).
- Yazdan-Shahmorad, A., et al. Widespread optogenetic expression in macaque cortex obtained with MR-guided, convection enhanced delivery (CED) of AAV vector to the thalamus. Journal of Neuroscience Methods. 293, 347-358 (2018).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados