A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنتاج ناقلات الفيروسات المرتبطة أدينو في مداخن الخلايا للدراسات ما قبل السريرية في نماذج حيوانية كبيرة
In This Article
Summary
هنا نقدم إجراء مفصلا لإنتاج واسع النطاق من ناقلات AAV من الدرجة البحثية باستخدام خلايا HEK 293 الملتصقة المزروعة في أكوام الخلايا وتنقية الكروماتوغرافيا التقارب. ينتج هذا البروتوكول باستمرار >1 × 1013 جينوم/مل متجه، مما يوفر كميات متجهة مناسبة للدراسات الحيوانية الكبيرة.
Abstract
تعد ناقلات الفيروسات المرتبطة بالأدينو من بين ناقلات العلاج الجيني الأكثر تقدما سريريا، مع اعتماد ثلاثة علاجات جينية AAV للبشر. التقدم السريري للتطبيقات الجديدة لAV ينطوي على الانتقال من نماذج الحيوانات الصغيرة، مثل الفئران، إلى نماذج حيوانية أكبر، بما في ذلك ال كلاب، والأغنام، والرئيسيات غير البشرية. أحد القيود المفروضة على إعطاء AAV للحيوانات الكبيرة هو شرط كميات كبيرة من فيروس التيتر العالي. في حين أن ثقافة الخلايا المعلقة هي طريقة قابلة للتطوير لإنتاج ناقلات AAV ، إلا أن القليل من مختبرات الأبحاث لديها المعدات (مثل المفاعلات الحيوية) أو تعرف كيفية إنتاج AAV بهذه الطريقة. وعلاوة على ذلك، فإن عوارض AAV غالبا ما تكون أقل بكثير عند إنتاجها في خلايا HEK 293 المعلقة مقارنة بخلايا HEK293 الملتصقة. وصف هنا هو وسيلة لإنتاج كميات كبيرة من AAV عالية titer باستخدام مداخن الخلية. كما يتم وصف بروتوكول مفصل لتكتيرينغ AAV وكذلك أساليب التحقق من صحة نقاء ناقلات. وأخيرا، يتم تقديم النتائج التمثيلية للتعبير المتحول بوساطة AAV في نموذج الأغنام. هذا البروتوكول الأمثل لإنتاج واسع النطاق من ناقلات AAV في الخلايا الملتصقة سيمكن مختبرات البيولوجيا الجزيئية من التقدم في اختبار علاجات AAV الجديدة في نماذج حيوانية أكبر.
Introduction
العلاج الجيني باستخدام ناقلات الفيروس المرتبطة أدينو (AAV) قد خطت خطوات كبيرة على مدى العقود الثلاثة الماضية1,2. أظهرت التحسينات في مجموعة متنوعة من الأمراض الوراثية، بما في ذلك العمى الخلقي، والهيموفيليا، وأمراض الجهاز العصبي العضلي الهيكلي والمركزي، جلبت العلاج الجيني AAV إلى طليعة البحوث السريرية3،4. في عام 2012، وافقت وكالة الأدوية الأوروبية (EMA) على غليبيرا، وهو ناقل AAV1 يعبر عن ليباز البروتين الدهني (LPL) لعلاج نقص LPL، مما يجعله أول تصريح تسويقي لعلاج العلاج الجيني في أوروبا أو الولايات المتحدة5. ومنذ ذلك الحين، حصل علاجان جينيان إضافيان من AAV، Luxturna6 و Zolgensma7،على موافقة إدارة الأغذية والعقاقير، ومن المتوقع أن يتوسع السوق بسرعة على مدى السنوات ال 5 المقبلة مع ما يصل إلى 10-20 العلاجات الجينية المتوقعة بحلول عام 20258. تشير البيانات السريرية المتاحة إلى أن العلاج الجيني AAV هو طريقة آمنة وجيدة التحمل وفعالة مما يجعله واحدا من أكثر ناقلات الفيروس الواعدة ، مع أكثر من 244 تجربة سريرية شملت AAV مسجلة مع ClinicalTrials.gov. الاهتمام المتزايد في التطبيقات السريرية التي تنطوي على ناقلات AAV يتطلب أساليب إنتاج قوية وقابلة للتطوير لتسهيل تقييم العلاجات AAV في النماذج الحيوانية الكبيرة، لأن هذا هو خطوة حاسمة في خط أنابيب9الترجمة .
لإنتاج ناقلات AAV ، فإن المتطلبات الرئيسية هما جينوم AAV و capsid. الجينوم من النوع البري (wt) - AAV هو الحمض النووي واحد تقطعت بهم السبل التي هي ما يقرب من 4.7 كيلو بايت في طول10. يضم جينوم wt-AAV تكرارات طرفية مقلوبة (ITRs) موجودة في طرفي الجينوم ، وهي مهمة للتغليف ، وجينات الممثل والغطاء 11. تتم إزالة الجينات مندوب وسقف، اللازمة لتكرار الجينوم، وتجميع capsid الفيروسية، وتغليف الجينوم في capsid الفيروسية، من الجينوم الفيروسية وتقدم في ترانس لإنتاج ناقلات AAV12. إن إزالة هذه الجينات من الجينوم الفيروسي يوفر مجالا للمتحولات العلاجية وجميع العناصر التنظيمية اللازمة، بما في ذلك المروج وإشارة تعدد الإرسال. تبقى ITRs في الجينوم ناقلات لضمان تكرار الجينوم السليم والتغليف الفيروسي13،14. لتحسين حركية التعبير المتحول ، يمكن هندسة جينوم ناقلات AAV ليكون متكاملا ذاتيا ، مما يخفف من الحاجة إلى التحويل من تحويل الحمض النووي أحادية التقطعت بهم السبل إلى تحويل الحمض النووي المزدوج أثناء تكرار جينوم AAV ، ولكنه يقلل من قدرة الترميز إلى ~ 2.4 kb15.
وراء تصميم الجينوم AAV، اختيار النمط المصلي capsid يحدد الأنسجة والخلايا تروبية من ناقلات AAV في الجسم الحي2. بالإضافة إلى التروبية الأنسجة، وقد ثبت مختلف الأنماط المصلية AAV لعرض مختلف الحركية التعبير الجيني16. على سبيل المثال، صنفت الزنكاريللي وآخرون17 أنماطا مصلية مختلفة للAV إلى أنماط مصلية منخفضة التعبير (AAV2 و3 و4 و5) وأنماط مصلية متوسطة التعبير (AAV1 و6 و8) وأنماط مصلية عالية التعبير (AAV7 و9). كما صنفوا الأنماط المصلية للAV إلى تعبير بطيء الظهور (AAV2 و3 و4 و5) أو تعبير سريع الظهور (AAV1 و6 و7 و8 و9). هذه التروبينات المتباينة وحركية التعبير الجيني ترجع إلى اختلافات الأحماض الأمينية في البروتينات الكابسيد، وتشكيلات البروتين capsid، والتفاعلات مع مستقبلات الخلايا المضيفة / المستقبلات المشتركة18. بعض capsids AAV لها خصائص مفيدة إضافية مثل القدرة على عبور حاجز الدم في الدماغ بعد الإدارة داخل الأوعية الدموية (AAV9) أو يقيمون في خلايا العضلات التي تعيش منذ فترة طويلة للتعبير عن المتحولين دائم (AAV6, 6.2FF, 8, و 9)19,20.
تهدف هذه الورقة إلى تفصيل طريقة فعالة من حيث التكلفة لإنتاج ناقلات AAV عالية النقاء وعالية التأرت والبحث لاستخدامها في نماذج الحيوانات الكبيرة قبل السريرية. يتم إنتاج AAV باستخدام هذا البروتوكول باستخدام ثنائي البلازميد transfection في الكلى الجنينية البشرية (HEK) 293 الخلايا التي تزرع في مداخن الخلايا. وعلاوة على ذلك، تصف الدراسة بروتوكول لتنقية الكروماتوغرافيا تقارب كبريتات الهيبارين، والتي يمكن استخدامها للأنماط المصلية AAV التي تحتوي على نطاقات ربط الهيبارين، بما في ذلك AAV2، 3، 6، 6.2FF، 13، ودي جي21،22.
وهناك عدد من أنظمة التعبئة والتغليف المتاحة لإنتاج ناقلات AAV. من بين هذه ، فإن استخدام نظامين مشتركين في العدوى ، حيث يتم احتواء جينات Rep و Cap وجينات مساعد الإعلان (E1A و E1B55K و E2A و E4orf6 و VA RNA) داخل بلازميد واحد (pHelper) ، له بعض المزايا العملية على طريقة العدوى الشائعة ثلاثية البلازميد (الثلاثية) ، بما في ذلك انخفاض تكلفة إنتاج البلازميد23،24 . يجب أن يحيط ب PLASMID الجينوم AAV التي تحتوي على كاسيت التعبير transgene (pTransgene) ، من قبل ITRs ، ويجب ألا يتجاوز ~ 4.7 كيلوبايت في الطول. يمكن أن يتأثر تيتر الناقل والنقاء بالمتحول بسبب الآثار السامة للخلايا المحتملة أثناء العدوى. ويرد وصف لتقييم نقاء ناقلات الأمراض في هذه المسألة. تم تقييم ناقلات المنتجة باستخدام هذه الطريقة، والتي تسفر عن 1 ×10 13 vg/mL لكل منهما، في الفئران، الهامستر، والنماذج الحيوانية ovine.
الجدول 1: تكوين الحلول المطلوبة. المعلومات الضرورية، بما في ذلك النسب المئوية والأحجام، للمكونات اللازمة لمختلف الحلول في جميع أنحاء البروتوكول. الرجاء الضغط هنا لتحميل هذا الجدول.
Protocol
1. مزدوجة plasmid transfection خلايا HEK293 في مداخن الخلية
- إذابة قارورة التبريد من خلايا HEK293 في حمام حبة تعيين في 37 درجة مئوية.
ملاحظة: DMEM كاملة قبل الحارة إلى 37 درجة مئوية في حين أن الخلايا تذوب لضمان درجة الحرارة الباردة لا صدمة الخلايا عند الطلاء. تأكد من أن الخلايا لديها عدد مرور منخفض ، أقل من 20 بشكل مثالي ، لضمان النمو الأمثل وكفاءة العدوى. تأكد من أن الخلايا معتمدة لتكون خالية من الميكوبلازما. - نقل محتويات قارورة التبريد دروبوايز في أنبوب مخروطي 15 مل تحتوي على 10 مل من DMEM كاملة قبل الحارة والطرد المركزي الخلايا في 500 × ز لمدة 5 دقائق.
- يستنشق وسائل الإعلام، ومن ثم إعادة إنفاق خلايا HEK293 في 20 مل من DMEM كاملة قبل الحارة. زرع الخلايا في لوحة 15 سم واحتضان في 37 درجة مئوية، مع 5٪ CO2.
- تقسيم الخلايا من لوحة واحدة 15 سم إلى ثلاثة لزرع في غرفة ثقافة الخلية.
- مرة واحدة هي الخلايا التقاء 80٪، يستنشق وسائل الإعلام وغسل بلطف لوحة مع 3 مل من برنامج تلفزيوني لعدم تعطيل monolayer. ثم يستنشق برنامج تلفزيوني وإضافة 3 مل من التريبسين.
- احتضان لمدة 2 دقيقة في 37 درجة مئوية حتى الخلايا رفع من لوحة، ومن ثم تحييد التريبسين بإضافة 7 مل من DMEM كاملة إلى لوحة.
- جمع جميع وسائل الإعلام والخلايا في أنبوب 15 مل والكريه الخلايا عن طريق الطرد المركزي في 500 × ز لمدة 5 دقائق.
- يستنشق الناموست من أنبوب 15 مل وإعادة إنفاق بيليه الخلية في 3 مل من DMEM كاملة. إضافة 1 مل لكل لوحة 15 سم تحتوي على 20 مل من DMEM كاملة; صخرة بلطف لوحات لتوزيع الخلايا بالتساوي، واحتضان في 37 درجة مئوية، مع 5٪ CO2.
- مرة واحدة في الخلايا هي التقاء 80٪، كرر الخطوتين 1.4.1 و 1.4.2. جمع supernatant في أنابيب مخروطية 50 مل، وعكس بلطف أنبوب لضمان الخلايا متجانسة.
- تحديد كثافة الخلية عن طريق خلط 10 ميكرولتر من عينات الخلايا مع 10 ميكرولتر من أزرق تريبان وإضافة الخليط إلى شريحة عد الخلايا للتحليل في عداد الخلية.
- مزيج 1 لتر من DMEM كاملة قبل الحارة مع تعليق الخلية اللازمة لزرع غرفة ثقافة الخلية (مساحة سطح 6360 سم2) مع 1 × 104 خلايا / سم2. صب خليط الخلية في غرفة ثقافة الخلية وتدوير بلطف لتوزيع الخلايا بالتساوي عبر كل طبقة أحادية (الشكل 1) واحتضان في 37 درجة مئوية، مع 5٪ CO2.
- بالإضافة إلى غرفة ثقافة الخلية، لوحة لوحة 15 سم مع 1 × 104 خلايا / سم2 كمرجع للالتقاء.
- بعد ~ 65 ساعة حضانة ، والتحقق من لوحة مرجعية للالتقاء المثالي ~ 80 ٪ - 90 ٪ التقاء.
ملاحظة: DMEM كاملة قبل الحارة لإضافة إلى غرفة ثقافة الخلية في 37 درجة مئوية.
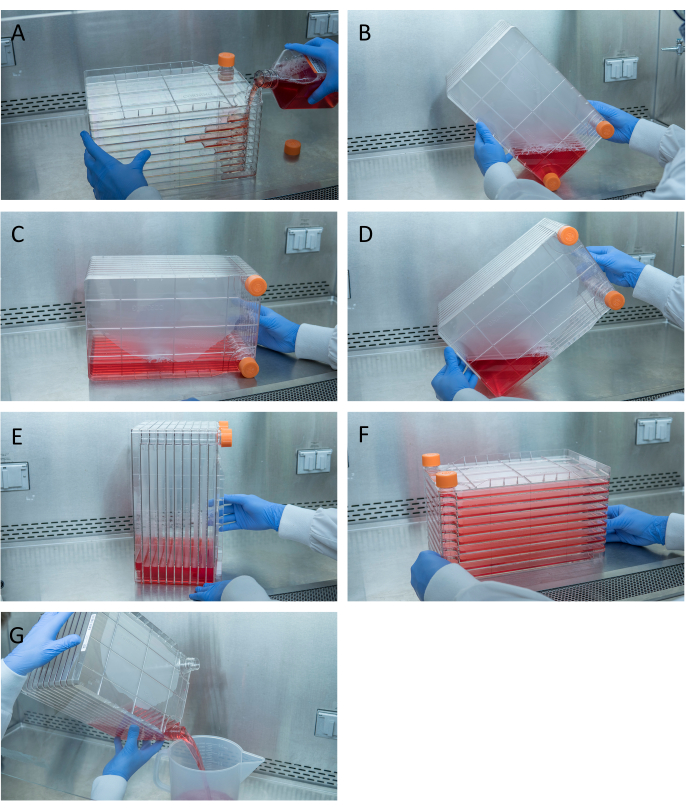
الشكل 1: المناورة من كومة الخلية للبذر الخلية وtransfection. لتكديس الخلايا البذر، ابدأ بإزالة واحدة من قبعات تنفيس وصب في 1 لتر من DMEM كاملة قبل الحارة مع الكمية اللازمة من خلايا HEK293 (A). توزيع الخلايا والوسائط بالتساوي عن طريق تشديد كل من قبعات تنفيس وجلب جميع وسائل الإعلام إلى زاوية المكدس الخلية مع واحدة من قبعات تنفيس ووضعها في تلك الزاوية (ب)، وضع كومة الخلية على جانبها (C)، ومن ثم بدوره كومة الخلية 90 ° (D) بحيث منافذ تنفيس هي أعلى (هاء). خفض بلطف كومة الخلية إلى وضعها الأفقي العادي وضمان تغطية جميع الغرف من كومة الخلية تماما في وسائل الإعلام (F). عند التحويل، فك كل من قبعات تنفيس وتصب ببطء من وسائل الإعلام القديمة في حاوية النفايات العقيمة النفايات لتدفق حتى لا يزعج monolayer من الخلايا (G). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- إعداد البولي إيثيلينيمين (PEI) / خليط الحمض النووي بنسبة تركيز 3:1 (ث / ث).
- إعداد خليط الحمض النووي في أنبوب مخروطي 50 مل عن طريق إضافة 475 ميكروغرام من pTrangene و 1425 ميكروغرام من pHelper إلى 40 مل من المتوسطة منخفضة المصل لخلق نسبة 3:1 من pHelper:pTrangene.
ملاحظة: يمكن العثور على آلة حاسبة خليط PEI/DNA باستخدام الجدول 2. - أضف 5.7 مل من جزيرة الأمير إدوارد (1 غرام/لتر) إلى متوسط المصل المنخفض وخليط الحمض النووي بشكل إسقاطي. ثم دوامة لفترة وجيزة واحتضان لمدة 10 دقيقة في درجة حرارة الغرفة.
ملاحظة: كما PEI / الحمض النووي تحتضن في درجة حرارة الغرفة، وسوف تصبح غائمة قليلا.
- إعداد خليط الحمض النووي في أنبوب مخروطي 50 مل عن طريق إضافة 475 ميكروغرام من pTrangene و 1425 ميكروغرام من pHelper إلى 40 مل من المتوسطة منخفضة المصل لخلق نسبة 3:1 من pHelper:pTrangene.
- بعد 8 دقائق من حضانة PEI / DNA ، قم بإزالة الوسائط من غرفة ثقافة الخلية.
ملاحظة: تأكد من تخفيف كل من القبعات البرتقالية للحفاظ على تدفق سلس من وسائل الإعلام لتجنب إزاحة الخلايا. - إضافة PEI / DNA إلى 1 لتر من DMEM كاملة قبل الحارة، وتصب ببطء الخليط في ميناء غرفة ثقافة الخلية. توزيع السائل بالتساوي على جميع الصفوف (الشكل 1) واحتضان لمدة 72 ساعة في 37 درجة مئوية، مع 5٪ CO2.
2 حصاد AAV وتحلل كيميائي للخلايا HEK293 المصابة
- هز غرفة ثقافة الخلية بقوة لطرد الخلايا حتى تظهر الوسائط غائمة من الخلايا المنزوعة وتتدفق إلى أربعة أنابيب طرد مركزي سعة 500 مل.
- طرد مركزي الأنابيب في 18،000 × ز لمدة 30 دقيقة في 4 درجة مئوية لبيليه الخلايا. صب supernatant أوضح في 1 L البولي ايثيلين تيريفثالات كوبوليستر (PETG) زجاجة.
ملاحظة: إذا لم يكن لدى الشخص إمكانية الوصول إلى جهاز طرد مركزي عالي السرعة، فإن جهاز الطرد المركزي يبلغ 12,000 × ز لمدة 40 دقيقة. قد لا تكون الخلايا الكريات صلبة بهذه السرعة وستنزلق على أنها تتدفق فائقة. - إعادة تشغيل الكريات الخلية في أنابيب الطرد المركزي 500 مل مع 50 مل من العازلة تحلل واحتضان لمدة 60 دقيقة في 37 درجة مئوية.
- طاردة مركزية الأنابيب في 18،000 × ز لمدة 30 دقيقة، ومن ثم نقل supernatant في نفس زجاجة 1 L PETG. تجاهل حطام الخلية بيليه.
ملاحظة: تنقية الفائقة الموضحة فورا وتخزينها في 4 درجة مئوية لمدة تصل إلى 72 ساعة. للتخزين على المدى الطويل، تخزين في -80 درجة مئوية. لا تخزن عند -20 درجة مئوية.
3 AAV ناقلات تنقية باستخدام الكروماتوغرافيا تقارب الهيبارين
- إزالة lysate الخام من -80 درجة مئوية وترك عند 4 °C بين عشية وضحاها لذوبان الجليد. وبمجرد إذابة الذوبان، استخدم فلتر 0.22 ميكرومتر لتصفية lysate الخام.
- لتمرير المكثف الطرد المركزي، إضافة 4 مل من العازلة قبل المعالجة مرشح إلى مكثف الطرد المركزي لكل عمود سيبهاروز الهيبارين المستخدمة. Passivate المكثف الطرد المركزي في درجة حرارة الغرفة لمدة 2-8 ساعة. إعداد التخميل مباشرة قبل خطوات التنقية.
- إعداد الأنابيب والمضخة (الشكل 2).
- وضع الأنابيب في مضخة التجسيم وتشغيل 20 مل من 1 M NaOH. بعد ذلك، تشغيل 50 مل من المياه الجزيئية الصف، ومن ثم تشغيل 50 مل من DMEM القاعدية.
- إرفاق 5 مل هيبارين سيبهاروز العمود إلى أنابيب وتشغيل 25 مل من DMEM القاعدية لإزالة المواد الحافظة.
- تشغيل 0.2 ميكرومتر من lysate الخام المصفاة من خلال العمود بمعدل تدفق 1-2 قطرات / ثانية.

الشكل 2: إعداد مضخة التجذيف لتنقية AAV. تشغيل أنابيب من lysate الخام، من خلال مضخة التمعج، وإلى عمود مصفوفة الهيبارين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: تأكد من عدم إدخال فقاعات أو السماح للعمود بالجفاف، لأن هذا سيعرض العمود للخطر ويمنع نطق AAV. تجاهل العمود إذا كان يعمل الجافة واستخدام عمود جديد لبقية lysate الخام.
- تحميل كافة lysate crude على عمود الهيبارين واستخدام الحلول التالية لغسل العمود.
- غسل باستخدام 50 مل من حلول الملح المتوازن هانك 1x (HBSS) دون ملغ2 + وكا2 +.
- غسل باستخدام 15 مل من 0.5 ٪ N-Lauroylsarcosine في HBSS دون ملغ2+ وكا2+.
- غسل باستخدام 50 مل من HBSS دون ملغ2 + وكا2 +.
- غسل باستخدام 50 مل من HBSS مع ملغ2 + وكا2 +
- غسل باستخدام 50 مل من 200 م م NaCl / HBSS مع Mg2 + وكا2 +.
- Elute 5 × 5 مل (25 مل المجموع) مع 300 mM من NaCl / HBSS مع ملغ2 + وكا2 + وتسمية elutions كما E1 - E5 (كل elution هو من 5 مل).
- تركيز الفيروس باستخدام جهاز طرد مركزي
- قم بتدفير المكثف الطردي الذي يحتوي على العازلة قبل المعالجة عند 900 × ز لمدة دقيقتين. تجاهل التدفق من خلال.
- غسل فلتر المكثف الطرد المركزي مع 4 مل من HBSS مع ملغ2 + وكا2 + والطرد المركزي في 1000 × ز لمدة 2 دقيقة؛ تجاهل التدفق من خلال.
- أضف elution E2 إلى جهاز الطرد المركزي المكثف. تدور في 1000 × ز لمدة 5 دقائق وتجاهل تدفق من خلال.
- الانتهاء من إضافة E2 ثم إضافة E3 إلى مركز الطرد المركزي وتدور في 1000 × ز لمدة 5 دقائق حتى الفيروس المركز هو ما يقرب من 1 مل.
ملاحظة: تجنب الطرد المركزي المتجه بحيث تكون وحدة التخزين أقل من مستوى عامل التصفية. لا تركز E1 أو E4 أو E5 في مركز الطرد المركزي ، لأنها تحتوي على القليل جدا من النواقل أو لا تحتوي على ملوثات. - إزالة الفيروس المركز من المكثف الطرد المركزي باستخدام طرف P200 المصفاة ووضعه في أنبوب الطرد المركزي 1.5 مل معقمة.
- شطف المكثف الطرد المركزي مع 200 ميكرولتر من HBSS مع ملغ2 + وكا2 + لطرد أي AAV المتبقية من المرشح. ماصة صعودا وهبوطا بقوة عدة مرات (ل~ 30 ق) لطرد أي فيروس انضمت إلى الغشاء ومكان في أنبوب الطرد المركزي 1.5 مل مع ما تبقى من الفيروس. خلط أنبوب جيدا.
- Aliquot 5 ميكرولتر لاستخراج الحمض النووي وتخزين ناقلات تنقية في -80 درجة مئوية.
- اغسل العمود باستخدام 25 مل من 2 M NaCl. علاوة على ذلك، استخدم 25 مل من 0.1٪ تريتون X-100، قبل تسخينها إلى 37 درجة مئوية لغسل العمود. بعد ذلك، اغسل العمود باستخدام 50 مل من dH2O المعقم، ثم اغسله باستخدام 25 مل من الإيثانول بنسبة 20٪.
- تأكد من تشبع غشاء العمود بالكامل في الإيثانول بنسبة 20٪، لأن هذا هو محلول التخزين. ختم العمود مع المقابس المقدمة وتخزينها في 4 درجة مئوية.
- تخزين الأنابيب في 1 M NaOH.
ملاحظة: إذا تم تنظيفها بشكل صحيح، يمكن إعادة استخدام أعمدة سيبهاروز الهيبارين حتى خمس مرات.
4 استخراج الحمض النووي الجينومي AAV
- إعداد مزيج رد الفعل المذكورة في الجدول 3 في أنبوب PCR لعلاج DNase.
| مكون | حجم |
| ناقل AAV منقى | 5 ميكرولتر |
| 10x المخزن المؤقت DNase | 2 ميكرولتر |
| DNase | 1 ميكرولتر |
| ddH2O | 12 ميكرولتر |
| المجلد النهائي | 20 ميكرولتر |
الجدول 3: تركيبة مزيج العلاج الرئيسي DNase. المكونات والأحجام الموصى بها اللازمة لعلاج DNase من ناقلات AAV الفيروسية أثناء استخراج الحمض النووي.
- دوامة أنبوب PCR لخلط ونبض أنبوب PCR لتدور أسفل المحتويات.
- باستخدام دراجة حرارية، واحتضن في 37 درجة مئوية لمدة 20 دقيقة تليها 75 درجة مئوية لمدة 15 دقيقة لتسخين تعطيل DNase.
- إضافة 5 ميكرولتر من بروتيناز K.
- باستخدام دراجة حرارية، واحتضان في 50 درجة مئوية لمدة 60 دقيقة ومن ثم في 95 درجة مئوية لمدة 30 دقيقة لتسخين بروتيناز K.
- استخدم مجموعة تنظيف الحمض النووي لإزالة الملوثات المحتملة.
ملاحظة: تم تنفيذ هذه الخطوة باستخدام مجموعة تنظيف الدم والأنسجة المتاحة تجاريا(جدول المواد).- إضافة 200 ميكرولتر من العازلة AL (الدم والأنسجة تنظيف عدة، جدول المواد)إلى أنبوب PCR التي تحتوي على ناقلات DNase / Proteinase K المعالجة.
- دوامة أنبوب PCR واحتضان في 56 درجة مئوية لمدة 10 دقيقة في دراجة حرارية.
- ماصة السائل من أنبوب PCR في عمود تدور عقيمة يجلس في أنبوب جمع.
- إضافة 200 ميكرولتر من الإيثانول 100٪ إلى العمود وتخلط جيدا عن طريق الدوامة.
- جهاز الطرد المركزي في 6000 س غ لمدة دقيقة واحدة وتجاهل تدفق من خلال.
- إضافة 500 ميكرولتر من AW1 العازلة (الدم والأنسجة تنظيف عدة، جدول المواد)إلى العمود تدور.
- جهاز الطرد المركزي في 6000 س غ لمدة دقيقة واحدة وتجاهل تدفق من خلال.
- إضافة 500 ميكرولتر من العازلة AW2 (الدم والأنسجة تنظيف عدة، جدول المواد)إلى العمود تدور.
- جهاز الطرد المركزي في 15،000 × ز لمدة 3 دقائق والتخلص من تدفق من خلال.
- ضع عمود الدوران في أنبوب طرد مركزي معقم سعة 1.5 مل وأضف 200 ميكرولتر من العازلة AE (طقم تنظيف الدم والأنسجة ، جدول المواد) مباشرة إلى غشاء العمود الدوراني.
- احتضان في درجة حرارة الغرفة لمدة 1 دقيقة.
- جهاز طرد مركزي على 6000 x gلمدة دقيقة واحدة ل elute الحمض النووي.
- تخزين الحمض النووي في -20 درجة مئوية.
5 المعايرة من الجينوم ناقلات AAV باستخدام تفاعل سلسلة البوليميراز الكمي وفيروس سيميان 40 (SV40) التحقيق
ملاحظة: قم بإجراء جميع أعمال qPCR في غطاء محرك السيارة PCR باستخدام نصائح ماصة تمت تصفيتها لتجنب تلوث الحمض النووي الخارجي. إذا لم ترميز الجينوم AAV تسلسل بوليا SV40، استخدم مسبار ضد ITR وصفها في مكان آخر25. تأكد من أن الحمض النووي البلازميد المحدد كمعيار يحتوي على تسلسل SV40 polyA.
- إعداد معيار المخزون
- تمييع معيار الحمض النووي للمخزون (pTransgene plasmid الذي يحتوي على تسلسل بولي أ SV40) إلى تركيز نهائي قدره 10 ميكروغرام / ميكرولتر وتخزينه عند -20 درجة مئوية في 6 ميكرولتر من الاقتباسات.
- تحديد عدد النسخ الموجودة في معيار الحمض النووي plasmid باستخدام آلة حاسبة على الانترنت التالية26.
ملاحظة: استخدم حمضا نوويا بلازما يستخدم للمعيار الذي ينتجه بائع تجاري لضمان الجودة والتركيز الصحيح. إعداد كمية كبيرة من المعايير (على سبيل المثال، 10 مل) لإجراء دراسات انتقالية عند الانتقال إلى معيار تم إعداده حديثا.
- إعداد مزيج الكاشف التالي المذكور في الجدول 4 لكل من العينات والمعيار في أنبوب الطرد المركزي 1.5 مل.
ملاحظة: تحضير الإفراط كافية من المزيج الرئيسي. انظر الجدول 5 للاطلاع على تسلسلات التمهيدي/المسبار.
| مكون | حجم |
| مزيج qPCR الرئيسي العالمي (2X) | 10 ميكرولتر |
| المياه الصف الجزيئي | 4.5 ميكرولتر |
| 40x SV40 التمهيدي بوليA / التحقيق | 0.5 ميكرولتر |
| المجلد النهائي | 15 ميكرولتر |
الجدول 4: مزيج qPCR الرئيسي ل AAV المعايرة. المكونات والأحجام الموصى بها المطلوبة لqPCR من الحمض النووي المستخرج من ناقلات الفيروس AAV.
| مكون | تسلسل |
| التمهيدي الأمامي | 5'-أكغاتاغاكاتاكاكااتاتاكا-3' |
| التمهيدي العكسي | 5'-CCاغاكاتاغاتاكاتاغاغاغات-3' |
| مجس | /56-فام/أغكاتت/زين/تيتكاتغكاتكاتشتغغغتغتغغتغتك/3IABkFQ |
الجدول 5: تسلسلات التمهيدي ضد تسلسل الحمض النووي ل SV40 polyA. تسلسلات من التمهيديات والتحقيق المستخدمة لqPCR المعايرة، والتي تربط إلى مناطق محددة من ناقلات الفيروسية AAV التي تحتوي على تسلسل بوليا SV40.
- Pipette سيد خلط صعودا وهبوطا لخلط.
- إعداد لوحة التخفيف.
- استخدم لوحة واضحة من 96 بئرا لإعداد المخففات القياسية والعينة ، وإضافة 45 ميكرولتر من الماء الجزيئي إلى كل بئر في كل عمود آخر بدءا من العمود 1 (الأعمدة 1 و 3 و 5 و 7 و 9 و 11).
- إضافة 5 ميكرولتر من المعيار إلى A1 جيدا وماصة لخلط.
- استخدام تلميح ماصة تصفية جديدة لخلق تخفيف 1/10 من A1 جيدا إلى B1.
- استمر في سلسلة من التخفيفات ذات 10 أضعاف أسفل العمود حتى الوصول إلى G1.
- لا تقم بإضافة إلى H1، لأن هذا سيكون بمثابة عنصر تحكم سلبي.
- تطبيق العينة الأولى (S1) بإضافته إلى A3 جيدا، وتشكيل تخفيف 1/10. ماصة هذا الخليط ونقل 5 ميكرولترتو جيدا B3. تجاهل تلميح ماصة بعد هذا النقل.
- مع طرف ماصة جديدة، مزيج الحل في B3 جيدا وتشكيل تخفيف 1/100. نقل 5 μLof هذا الخليط إلى C3 جيدا وتجاهل تلميح بعد نقل.
- مع طرف ماصة جديدة، ماصة صعودا وهبوطا الحل في C3 جيدا لجعل تخفيف 1/1000. تجاهل الطرف.
- استمر في تخفيف العينات دون إضافة أي عينات إلى الأعمدة 2 أو 4 أو 6 أو 8 أو 10 أو 12.
- بمجرد أن يتم تخفيف جميع العينات، اخلط المحتويات في آبار العمود 1، ثم قم بنقل 20 ميكرولتر إلى العمود 2.
- كرر هذا للأعمدة 3 و 5 و 7 و 9 و 11 لإنشاء نسخ متماثلة من كل معيار و عينة التخفيف. راجع الشكل 3 لتخطيط اللوحة.
ملاحظة: عند اتباع إعداد لوحة في الشكل 3، عينات مخففة في الصفين G و H سيكون فقط 1/10 و 1/100 التخفيفات.
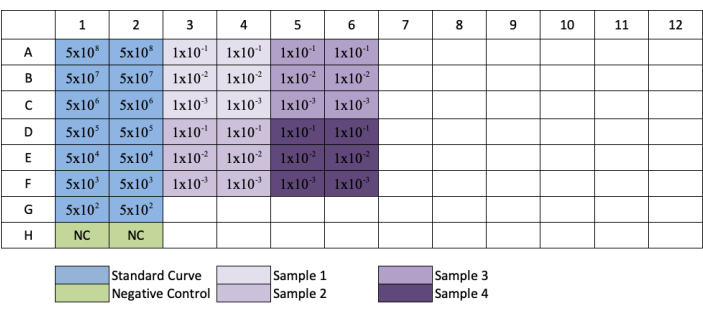
الشكل 3: تخطيط لوحة لqPCR AAV المعايرة. يشير اللون الأزرق إلى موضع التخفيف التسلسلي للمعيار؛ الأخضر يشير إلى موضع السيطرة السلبية؛ الأرجواني يشير إلى وضع التخفيف من العينات. تتم إضافة كل معيار أو سالب أو عينة في النسخ المتماثل. وقد أضيف مثال لتركيز المعيار لإظهار سلسلة التخفيف من المعيار، وأضيفت إلى الآبار الخاصة بهم موضع تخفيف العينة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- المعايرة بواسطة SV40 متعددة الأسلحة القائمة على qPCR
- إضافة 15 ميكرولتر من مزيج QPCR الرئيسي إلى كل بئر من لوحة qPCR أبيض شبه ملتف 96 جيدا.
- نقل 5 ميكرولتر من كل عينة من لوحة واضحة 96 جيدا إلى الأبيض شبه التفاف 96 لوحة qPCR جيدا.
- استخدام ماصة متعددة القنوات لضمان خلط كافية من مزيج QPCR الرئيسي وعينة.
- ختم لوحة مع فيلم الختم والطرد المركزي لوحة qPCR في 1500 × ز لمدة 30 s.
- تشغيل رد فعل qPCR على لوحة المستندة إلى اللوحة في الوقت الحقيقي PCR التضخيم والكشف عن الصك، وذلك باستخدام الشروط المقترحة في الجدول 6.
| قسم | دورات | الوقت | درجة الحرارة | وصف |
| ما قبل الحضانة | 1x | 5 دقائق | 95 درجة مئوية | إشباع الحمض النووي. |
| التضخيم | 38x | 15 ق | 95 درجة مئوية | تضخيم الحمض النووي. يمكن تعديل الإعدادات إذا كنت تستخدم التمهيديات البديلة بدرجات حرارة تمي مختلفة. |
| 60 ق | 60 درجة مئوية | |||
| تبريد | 1x | 60 ق | 40 درجة مئوية | تبريد اللوحة. نهاية الشوط. |
الجدول 6: بروتوكول Thermocycler لإجراء عملية التحلل المائي لكمية التحلل القائم على qPCR. الموصى بها بروتوكول thermocycler لاستخدام التحقيق القائم على qPCR المعايرة من الحمض النووي المستخرج ناقلات AAV المنقى.
ملاحظة: للحصول على ورقة عمل المعايرة AAV qPCR راجع الجدول 7.
- تحليل البيانات لتحديد أرقام نسخ الجينوم AAV.
- تعبئة خلايا بيانات جدول البيانات(الجدول 7A)مع قيم التركيز التي تم الحصول عليها من تشغيل qPCR لكل من المخففات القياسية والعينة.
- استخدام قيم التركيز من الجدول 7A لإنتاج منحنى قياسي(الجدول 7B).
ملاحظة: سيتم عرض المنحنى القياسي كلوغاريتم طبيعي (y = ln (x) + b) مع كفاءة R2. يجب أن يكون للمنحنى القياسي كفاءة قريبة من 100٪ وR2 قريبة من 1.0 (≥0.99). - ملء كفاءة المنحدر عن طريق ملء هذه الآلة الحاسبة على الانترنت27.
ملاحظة: كفاءة بين 90٪-110٪ مقبول. إذا كانت كفاءة qPCR خارج هذا النطاق، إعادة تشغيل qPCR. - استخدام قيم التركيز من الجدول 7A إلى متوسط التخفيفات من كل عينة وتحديد الانحراف المعياري لكل عينة (الجدول 7C).
ملاحظة: استبعاد التخفيفات من العينات التي هي أكثر من انحراف معياري واحد بعيدا عن متوسط مخففات العينة. - باستخدام متوسط تركيز كل تخفيف، تتكاثر بعامل التخفيف، ثم تقسيم على خمسة للحصول على الجينوم ناقلات (vg)/μL من كل عينة (الجدول 7C).
- حساب vg/mL من كل عينة بضرب متوسط تركيزات كل عينة في 80000 (الجدول 7C).
- متوسط vg/ مل من كل تخفيف لإنتاج vg/ مل النهائي من كل عينة (الجدول 7C).
ملاحظة: يجب على المستخدم تقسيم متوسط تركيز كل تخفيف على عامل خمسة لحساب 5 ميكرولتر محملة في كل بئر لتشغيل qPCR لإنتاج التركيز في vg/μL. ويمثل عامل 000 80 عامل الانتقال من متوسط قيمة تركيز كل عينة إلى vg/mL. أولا، يجب ضرب متوسط قيمة تركيز كل عينة في 2 لحساب الجينوم واحد تقطعت بهم السبل، كما مجموعة التمهيدي التحقيق فقط يحدد كميا إيجابية الشعور، واحد تقطعت بهم السبل الحمض النووي (ssDNA)، والجينوم AAV موجود في نسبة 1:1 تقريبا بين الموجبة والسلبية ssDNA25،28. يجب ضرب متوسط قيمة تركيز كل عينة x40 لمراعاة تخفيف العينة من 5 ميكرولتر من المتجه المنقى (القسم 4.1) إلى 200 ميكرولتر من الحمض النووي المستخرج (القسم 4.6.12). وأخيرا، يجب ضرب متوسط قيمة تركيز كل عينة x1000 لتحويلها من vg/μL إلى vg/mL.
6 تقييم جودة النواقل ونقاوتها
- مراقبة الجودة - بلوت الغربية
- إعداد هلام صفحة SDS 12٪.
- أداء البولي أكريلاميد هلام الكهربائي.
ملاحظة: تحميل 6 × 1010 vg من العينات لكل بئر. - نقل البروتينات إلى غشاء ثنائي فلوريد البولي فينيلدين (PVDF).
- حجب غشاء PVDF
- إزالة الغشاء من جهاز نقل وشطف في 0.1٪ PBST لإزالة الأكريلاميد فضفاضة.
- ضع الغشاء في محلول الحجب لمدة ساعة واحدة على الأقل في درجة حرارة الغرفة أو بين عشية وضحاها عند 4 درجات مئوية.
ملاحظة: يمكن استكمال العازلة حجب مع مصل الماعز 2٪.
- حضانة مع الأجسام المضادة الأولية
- Decant العازلة حجب وإضافة الأجسام المضادة الأولية ، وهو مضاد للماوس AAV الأجسام المضادة أحادية النسيلة في تخفيف 1:200.
- حضانة بين عشية وضحاها في 4 °C.
- decant الأجسام المضادة الأساسية وغسل خمس مرات مع 0.1٪ PBST لمدة 5 دقائق في درجة حرارة الغرفة مع التحريض.
- حضانة مع الأجسام المضادة الثانوية
- decant محلول الغسيل وإضافة HRP الأجسام المضادة الثانوية المقترنة، المخفف في 1:7500 في العازلة حجب، واحتضان لمدة 1 ساعة في درجة حرارة الغرفة مع التحريض.
- Decant الأجسام المضادة الثانوية وغسل خمس مرات مع 0.1٪ PBST لمدة 5 دقائق في درجة حرارة الغرفة مع التحريض.
- إجراء غسل النهائي مع برنامج تلفزيوني في درجة حرارة الغرفة مع التحريض.
- الكشف عن البروتينات باستخدام الركيزة المحسنة chemiluminescent (ECL).
- صورة هلام لتصور البروتينات الفيروسية (VP1، VP2، و VP3 الوحدات الفرعية)(الشكل 4).

الشكل 4: لطخة الغربية تظهر البروتينات كابسيد AAV. حارة A; سلم ميغاواط، لين ب؛ AAV6.2FF-hIgG01, حارة C; AAV6.2FF-hIgG02, لين D; AAV6.2FF-hIgG03، ولين E؛ AAV6.2FF-hIgG04. 6 × 1010 vg من كل AAV6.2FF-hIgG تم تحميلها في الممرات الخاصة بهم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- التحكم في النقاء - SDS PAGE وكوماسي ستين
- إعداد هلام SDS-PAGE وعينات كما هو موضح من الخطوة 6.1.1 و 6.1.2.
- إصلاح هلام في حل تحديد لمدة 1 ساعة أو بين عشية وضحاها مع التحريض لطيف. تغيير حل الإصلاح مرة واحدة خلال الساعة الأولى.
- وصمة عار الجل في محلول تلطيخ لمدة 2-4 ساعة مع التحريض لطيف.
- ديستان الجل مع حل إزالة التين. تجديد محلول إزالة التلطيخ عدة مرات حتى يتم إزالة اللون بالكامل من خلفية الجل (4-24 ساعة).
- تخزين هلام destained في حل التخزين.
- صورة هلام لتصور جميع البروتينات الملطخة محلول تلطيخ Coomassie.
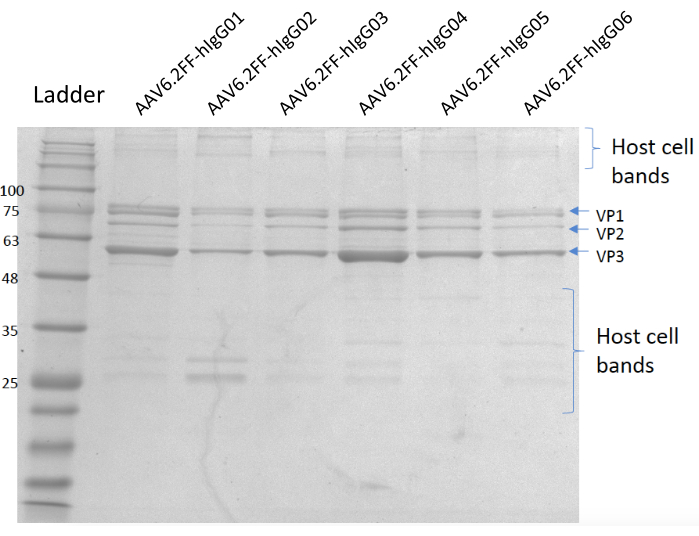
الشكل 5: كوماسي الملطخة هلام. حارة A; سلم ميغاواط، لين ب؛ AAV6.2FF-hIgG01, حارة C; AAV6.2FF-hIgG02, لين D; AAV6.2FF-hIgG03, لين E; AAV6.2FF-hIgG04, لين F; AAV6.2FF-hIgG05، ولين G؛ AAV6.2FF-hIgG06. 6 × 1010 vg من كل AAV6.2FF-hIgG تم تحميلها في الممرات الخاصة بهم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- اختبار التحكم البديل في النقاء - HEK293 الكشف عن بروتين الخلية المضيفة ELISA
- قم بإجراء الكشف عن بروتين الخلية المضيفة HEK293 عبر ELISA وفقا لتعليمات الشركة المصنعة.
ملاحظة: استخدم المخففات من 5 × 10-2 و 1 × 10-3 لعينات rAAV المنقى. بمجرد إضافة TMB إلى البئر ، احتضن بعيدا عن الضوء. لا يمكن استخدام الانحدار الخطي لتحليل النتائج. - إجراء تحليل من نقطة إلى نقطة، أو خط مكعب، أو طريقة تناسب لوجستية من أربع معلمات لاستيفاء تركيزات المجهولات والتكاثر بعامل التخفيف لتحديد تركيز العينة الأصلي.
- قم بإجراء الكشف عن بروتين الخلية المضيفة HEK293 عبر ELISA وفقا لتعليمات الشركة المصنعة.
النتائج
الترجمة من نماذج القوارض الصغيرة إلى نماذج حيوانية أكبر والتطبيق السريري في نهاية المطاف يمثل تحديا كبيرا بسبب كمية كبيرة من AAV المطلوبة لتحويل الحيوانات الكبيرة وتحقيق الآثار العلاجية. لمقارنة كفاءة نقل AAV6.2FF capsid المصممة بشكل عقلاني ، أظهرت سابقا زيادة 101 مرة في كفاءة النقل في خلايا عضلة ...
Discussion
يستخدم إنتاج ناقلات AAV المؤتلفة (rAAV) الموصوفة في هذه الورقة المواد والكواشف والمعدات الشائعة الموجودة في غالبية مختبرات ومرافق أبحاث البيولوجيا الجزيئية. تسمح هذه الورقة لإنتاج عالية الجودة في المختبر وفي الصف في الجسم الحي rAAV من قبل القارئ. وقبل كل شيء، فإن هذا البروتوكول لإنتا...
Disclosures
سارة ك. ووتون هو مخترع على براءة اختراع الولايات المتحدة US10806802B2 لAFF6.2FF capsid.
Acknowledgements
وكانت أميرة د. أرغي، وبرينا أ. ي. ستيفنز، وسيلفيا ب. توماس، وجاكوب ج. إ. ييتس من الحاصلين على رواتب طلاب كلية أونتاريو البيطرية، فضلا عن منح الدراسات العليا في أونتاريو. كانت أميرة د. أرغي متلقية الحصول على كلية ميتاك لتسريع الطلاب. تم تمويل هذا العمل من قبل منحة مشروع المعاهد الكندية للبحوث الصحية (#66009) ومنحة مشاريع البحوث الصحية التعاونية (NSERC) (#433339) ل SKW.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore Sigma | S2GPU05RE | |
| 0.25% Trypsin | Fisher Scientific | SM2001C | |
| 1-Butanol | Thermo Fisher Scientific | A399-4 | CAUTION. Use under a laminar flow hood. Wear gloves |
| 10 chamber cellstack | Corning | 3271 | |
| 1L PETG bottle | Thermo Fisher Scientific | 2019-1000 | |
| 30% Acrylamide/Bis Solution | Bio-Rad | 1610158 | |
| 96-well skirted plate | FroggaBio | FS-96 | |
| Adhesive plate seals | Thermo Fisher Scientific | 08-408-240 | |
| Ammonium persulfate (APS) | Bio-Rad | 161-0700 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Blood and Tissue Clean up Kit | Qiagen | 69506 | Use for DNA clean up in section 4.6 of protocol |
| Bromophenol blue | Fisher Scientific | B392-5 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Cell Culture Dishes | Greiner bio-one | 7000232 | 15 cm plates |
| Culture Conical Tube | Thermo Fisher Scientific | 339650 | 15 mL conical tube |
| Culture Conical Tube | Fisher Scientific | 14955240 | 50 mL conical tube |
| Dulbecco's Modified Eagle Medium (DMEM) with 1000 mg/L D-glucose, L-glutamine | Cytiva Life Sciences | SH30022.01 | |
| ECL Western Blotting Substrate | Thermo Fisher Scientific | 32209 | |
| Ethanol | Greenfield | P016EA95 | Dilute ethyl alcohol(95% vol) to 20% for section 3.7.4 and 70% for section 6.1.1.1 |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | SH30396.03 | |
| Glacial acetic acid | Fisher Scientific | A38-500 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Glycerol | Fisher Scientific | BP229-1 | |
| Glycine | Fisher Scientific | BP381-500 | |
| HBSS with Mg2+ and Ca2+ | Thermo Fisher Scientific | SH302268.02 | |
| HBSS without Mg2+ and Ca2+ | Thermo Fisher Scientific | SH30588.02 | |
| HEK293 cells | American Tissue Culture Collection | CRL-1573 | Upon receipt, thaw the cells and culture as described in manufacturer’s protocol. Once cells have been minimally passaged and are growing well, freeze a subfraction for future in aliquots and store in liquid nitrogen. Always use cells below passage number 30. Once cultured cells have been passaged more than 30 times, it is recommended to restart a culture from the stored aliquots |
| HEK293 host cell protein ELISA kit | Cygnus Technologies | F650S | Follow manufacturer’s instructions |
| Heparin sulfate column | Cytiva Life Sciences | 17040703 | |
| Kimwipe | Thermo Fisher Scientific | KC34120 | |
| L-glutamine (200 mM) | Thermo Fisher Scientific | SH30034.02 | |
| Large Volume Centrifuge Tube Support Cushion | Corning | CLS431124 | Support cushion must be used with large volume centrifuge tubes uless the centrifuge rotor has the approriate V-bottom cushions |
| Large Volume Centrifuge Tubes | Corning | CLS431123-6EA | 500 mL centrifuge tubes |
| MgCl2 | Thermo Fisher Scientific | 7791-18-6 | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | 1.5 mL microcentrifuge tube, sterilize prior to use |
| Molecular Grade Water | Cytiva Life Sciences | SH30538.03 | |
| N-Lauroylsarcosine sodium salt | Sigma Aldrich | L5125 | CAUTION. Wear gloves |
| NaCl | Thermo Fisher Scientific | BP35810 | |
| Optimem, reduced serum medium | Thermo Fisher Scientific | 31985070 | |
| Pasteur pipets | Fisher Scientific | 13-678-20D | Sterilize prior to use |
| PBS (10x) | Thermo Fisher Scientific | 70011044 | Dilute to 1x for use on cells |
| Penicillin-Streptomycin Solution | Cytiva Life Sciences | SV30010 | |
| pHelper plasmid | De novo design or obtained from plasmid repository | NA | |
| Pipet basin | Thermo Fisher Scientific | 13-681-502 | Purchase sterile pipet basins |
| Polyethylene glycol tert-octylphenyl ether (Triton X-100) | Thermo Fisher Scientific | 9002-93-1 | CAUTION. Wear gloves |
| Polyethylenimine (PEI) | Polyscience | 24765-1 | Follow manufacturer’s instructions to produce a 1L solution. 0.22μm filter and store at 4°C |
| Polypropylene semi-skirted PCR Plate | FroggaBio | WS-96 | |
| Polysorbate 20 (Tween 20) | Thermo Fisher Scientific | BP337-100 | CAUTION. Wear gloves |
| polyvinylidene difluoride (PVDF) membrane | Cytiva Life Sciences | 10600023 | Use forceps to manipulate. Wear gloves. |
| Primary antibody | Progen | 65158 | |
| Protein Ladder | FroggaBio | PM008-0500 | |
| Proteinase K | Thermo Fisher Scientific | AM2546 | |
| pTrangene plasmid | De novo design or obtained from plasmid repository | NA | Must contain SV40 polyA in genome to be compatible with AAV titration in section 5.0 |
| Pump tubing | Cole-Parmer | RK-96440-14 | Optimize length of tubing and containment of virus in fractions E1-E5 |
| RQ1 Dnase 10 Reaction Buffer | Promega | M6101 | Use at 10x concentration in protocol from section 4.0 |
| RQ1 Rnase-free Dnase | Promega | M6101 | |
| Sample dilutent | Cygnus Technologies | I700 | Must be purchased separately for use with HEK293 host cell protein ELISA kit |
| Secondary antibody, HRP | Thermo Fisher Scientific | G-21040 | |
| Skim milk powder | Oxoid | LP0033B | |
| Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 28312 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | SS266-4 | |
| SV40 polyA primer probe | IDT | Use sequence in Table X for quote from IDT for synthesis | |
| Tetramethylethylenediamine (TEMED) | Thermo Fisher Scientific | 15524010 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypan blue | Bio-Rad | 1450021 | |
| Ultra-Filter | Millipore Sigma | UFC810024 | Ultra-4 Centrifugal 10K device must be used, as it has a 10000 molecular weight cutoff |
| Universal Nuclease for cell lysis | Thermo Fisher Scientific | 88702 | |
| Universal qPCR master mix | NEB | M3003L | |
| Whatman Paper | Millipore Sigma | WHA1001325 | |
| β-mercaptoethanol | Fisher Scientific | 21985023 | CAUTION. Use under a laminar flow hood. Wear gloves |
| CAUTION: Refer to the Materials Table for guidelines on the use of dangerous chemicals. |
References
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: A golden anniversary of discovery, research, and gene therapy success-a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Nathwani, A. C., et al. Long-term safety and efficacy of factor IX gene therapy in hemophilia B. The New England Journal of Medicine. 371 (21), 1994-2004 (2014).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Ylä-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (10), 1831-1832 (2012).
- FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-novel-gene-therapy-treat-patients-rare-form-inherited-vision-loss (2020)
- FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease (2020)
- Statement from FDA Commissioner Scott Gottlieb, MD and Peter Marks, MD Ph.D., Director of the Center for Biologics Evaluation and Research on new policies to advance development of safe and effective cell and gene therapies. FDA Available from: https://www.fda.gov/news-events/press-announcements/statement-fda-commissioner-scott-gottlieb-md-and-peter-marks-md-phd-director-center-biologics (2020)
- Asokan, A., Schaffer, D. V., Samulski, R. J. The AAV vector toolkit: poised at the clinical crossroads. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (4), 699-708 (2012).
- Rose, J. A., Hoggan, M. D., Shatkin, A. J. Nucleic acid from an adeno-associated virus: chemical and physical studies. Proceedings of the National Academy of Sciences of the United States of America. 56 (1), 86-92 (1966).
- Lusby, E., Fife, K. H., Berns, K. I. Nucleotide sequence of the inverted terminal repetition in adeno-associated virus DNA. Journal of Virology. 34 (2), 402-409 (1980).
- Masat, E., Pavani, G., Mingozzi, F. Humoral immunity to AAV vectors in gene therapy: challenges and potential solutions. Discovery Medicine. 15 (85), 379-389 (2013).
- Ling, C. Enhanced Transgene Expression from Recombinant Single-Stranded D-Sequence-Substituted Adeno-Associated Virus Vectors in Human Cell Lines In Vitro and in Murine Hepatocytes In Vivo. Journal of Virology. 89 (2), 952-961 (2014).
- Cathomen, T., Stracker, T. H., Gilbert, L. B., Weitzman, M. D. A genetic screen identifies a cellular regulator of adeno-associated virus. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 14991-14996 (2001).
- McCarty, D. M. Self-complementary AAV vectors; advances and applications. Molecular Therapy. 16 (10), 1648-1656 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of aav serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PLOS One. 8 (9), 76310 (2013).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Pillay, S., et al. Adeno-associated virus (AAV) serotypes have distinctive interactions with domains of the cellular AAV receptor. Journal of Virology. 91 (18), (2017).
- Merkel, S. F. Trafficking of adeno-associated virus vectors across a model of the blood-brain barrier; a comparative study of transcytosis and transduction using primary human brain endothelial cells. Journal of Neurochemistry. 140 (2), 216-230 (2017).
- van Lieshout, L. P., et al. A novel triple-mutant AAV6 capsid induces rapid and potent transgene expression in the muscle and respiratory tract of mice. Molecular Therapy. Methods & Clinical Development. 9, 323-329 (2018).
- Wu, Z., Asokan, A., Grieger, J. C., Govindasamy, L., Agbandje-McKenna, M., Samulski, R. J. single amino acid changes can influence titer, heparin binding, and tissue tropism in different adeno-associated virus serotypes. Journal of Virology. 80 (22), 11393-11397 (2006).
- Liu, J., Moon, Y. -. A. Simple purification of adeno-associated virus-DJ for liver-specific gene expression. Yonsei Medical Journal. 57 (3), 790-794 (2016).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adeno-associated virus vectors. Human Gene Therapy. 9 (18), 2745-2760 (1998).
- Kimura, T., et al. Production of adeno-associated virus vectors for in vitro and in vivo applications. Scientific Reports. 9 (1), 13601 (2019).
- Aurnhammer, C., et al. Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences. Human Gene Therapy Methods. 23 (1), 18-28 (2012).
- . Paramyxoviridae: The viruses and their replication. Fields Virology Available from: https://www.scholars.northwestern.edu/en/publications/paramyxoviridae-the-viruses-and-their-replication (1996)
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Kaludov, N., Brown, K. E., Walters, R. W., Zabner, J., Chiorini, J. A. Adeno-associated virus serotype 4 (AAV4) and AAV5 Both require sialic acid binding for hemagglutination and efficient transduction but differ in sialic acid linkage specificity. Journal of Virology. 75 (15), 6884-6893 (2001).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Human Gene Therapy Methods. 26 (6), 228-242 (2015).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Frontiers in Microbiology. 10, 1570 (2019).
- Backovic, A., et al. Capsid protein expression and adeno-associated virus like particles assembly in Saccharomyces cerevisiae. Microbial Cell Factories. 11, 124 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved