A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור וקטורים הקשורים אדנו וירוס בערימות תאים למחקרים פרה קליניים במודלים בעלי חיים גדולים
In This Article
Summary
כאן אנו מספקים הליך מפורט לייצור בקנה מידה גדול של וקטורים AAV ברמה מחקרית באמצעות תאי HEK 293 דבקים הגדלים בערימות תאים וטיהור כרומטוגרפיה של זיקה. פרוטוקול זה מניב באופן עקבי >1 x 1013 גנומים וקטוריים /mL, ומספק כמויות וקטוריות המתאימות למחקרים גדולים בבעלי חיים.
Abstract
וקטורים הקשורים לווירוסים הקשורים לאדנו (AAV) הם בין וקטורי הטיפול הגנטי המתקדמים ביותר מבחינה קלינית, עם שלושה טיפולים גנטיים AAV שאושרו לבני אדם. קידום קליני של יישומים חדשניים עבור AAV כרוך במעבר ממודלים קטנים של בעלי חיים, כגון עכברים, למודלים בעלי חיים גדולים יותר, כולל כלבים, כבשים ופרימטים לא אנושיים. אחת המגבלות של מתן AAV לבעלי חיים גדולים יותר היא הדרישה לכמויות גדולות של וירוס טיטר גבוה. בעוד שתרבית תאי ההשעיה היא שיטה מדרגית לייצור וקטור AAV, מעבדות מחקר מעטות יש את הציוד (למשל, bioreactors) או יודע איך לייצר AAV באופן זה. יתר על כן, TITERS AAV הם לעתים קרובות נמוך באופן משמעותי כאשר מיוצרים השעיה HEK 293 תאים לעומת תאי HEK293 דבק. המתואר כאן היא שיטה לייצור כמויות גדולות של AAV titer גבוהה באמצעות ערימות תאים. פרוטוקול מפורט עבור titering AAV, כמו גם שיטות לאימות טוהר וקטור מתוארים גם. לבסוף, מוצגות תוצאות מייצגות של ביטוי טרנסג'ן בתיווך AAV במודל כבשים. פרוטוקול ממוטב זה לייצור בקנה מידה גדול של וקטורים AAV בתאים חסידים יאפשר מעבדות ביולוגיה מולקולרית לקדם את הבדיקה של טיפולים AAV החדש שלהם במודלים בעלי חיים גדולים יותר.
Introduction
טיפול גנטי המשתמש בווקטורים הקשורים לווירוסים הקשורים לאדנו (AAV) עשה צעדים עצומים בשלושת העשורים האחרונים1,2. שיפורים שהפגינו במגוון רחב של מחלות גנטיות, כולל עיוורון מולד, המופיליה ומחלות של מערכת העצבים השלד והמרכז, הביאו את הטיפול הגנטי AAV לחזית המחקר הקליני3,4. בשנת 2012, סוכנות התרופות האירופית (EMA) אישרה את Glybera, וקטור AAV1 המבטא ליפופרוטאין ליפאז (LPL) לטיפול במחסור ב- LPL, מה שהופך אותו לאישור השיווק הראשון לטיפול גנטי באירופה או בארצות הברית5. מאז, שני טיפולים גנטיים נוספים של AAV, Luxturna6 ו- Zolgensma 7 ,קיבלואת אישור ה-FDA, והשוק צפוי להתרחב במהירות במהלך 5 השנים הקרובות עם עד 10-20 טיפולים גנטיים הצפויים עד 20258. נתונים קליניים זמינים מצביעים על כך שטיפול גנטי AAV הוא מודל בטוח, נסבל היטב ויעיל, מה שהופך אותו לאחד הווקטורים הנגיפיים המבטיחים ביותר, עם מעל 244 ניסויים קליניים מעורבים AAV רשום עם ClinicalTrials.gov. העניין הגובר ביישומים קליניים המערבים וקטורים AAV דורש שיטות ייצור חזקות ומדרגיות כדי להקל על הערכת טיפולים AAV במודלים בעלי חיים גדולים, שכן זהו צעד קריטי בצינור התרגומי9.
עבור ייצור וקטור AAV, שתי הדרישות העיקריות הן הגנום AAV ואת capsid. הגנום של סוג בר (wt)-AAV הוא DNA חד גדילי כי הוא כ 4.7 kbאורך 10. הגנום wt-AAV כולל חזרות מסוף הפוכות (ITRs) שנמצאות בשני קצות הגנום, החשובות לאריזה, ואת הגנים של הנציג והכובע 11. הגנים נציג וכובע, הדרושים לשכפול הגנום, הרכבה של קפסיד ויראלי, אנקפסולציה של הגנום לתוך קפסיד ויראלי, מוסרים מן הגנום הנגיפי מסופקים טרנס לייצור וקטור AAV12. הסרת גנים אלה מהגנום הנגיפי מספקת מקום לטרנסגנים טיפוליים ולכל האלמנטים הרגולטוריים הדרושים, כולל המקדם ואות הפוליה. ה- ITRs נשארים בגנום הווקטורי כדי להבטיח שכפול גנום תקין ו אנקפסולציה ויראלית13,14. כדי לשפר את הקינטיקה של ביטוי טרנסג'ן, ניתן להנדס גנומים וקטוריים של AAV להיות משלימים את עצמם, מה שמפחית את הצורך בהמרה ממרת דנ"א חד-גדילית לדו-גדילית במהלך שכפול הגנום של AAV, אך מפחית את יכולת הקידוד ל- ~ 2.4 kb15.
מעבר לעיצוב הגנום של AAV, בחירת הסרוטיפ קבסידי קובעת את הרקמה ואת tropism התא של וקטור AAV ב vivo2. בנוסף לטרופיזם רקמה, סרוטיפים שונים של AAV הוכחו כמציגים קינטיקה שונה של ביטויגנים 16. לדוגמה, זינצרליואח' 17 סיווגו סרוטיפים שונים של AAV לסרוטיפים בעלי הבעה נמוכה (AAV2, 3, 4, 5), סרוטיפים מתונים (AAV1, 6, 8) וסרוטיפים בעלי ביטוי גבוה (AAV7 ו-9). הם גם סיווגו סרוטיפים של AAV לביטוי פתיחה איטית (AAV2, 3, 4, 5) או ביטוי פתיחה מהירה (AAV1, 6, 7, 8 ו-9). טרופיזם מפוצלים אלה וביטוי גנים קינטיקה נובעים וריאציות חומצת אמינו חלבונים קפסיד, תצורות חלבון capsid, ואינטראקציות עם קולטני תא מארח / קולטנים משותפים18. כמה capsids AAV יש מאפיינים מועילים נוספים כגון היכולת לחצות את מחסום הדם - מוח בעקבות ניהול תוך כלי דם (AAV9) או מתגוררים בתאי שריר חיים ארוכים עבור ביטוי transgene עמיד (AAV6, 6.2FF, 8, ו 9)19,20.
מאמר זה נועד לפרט שיטה חסכונית לייצור וקטורים AAV באיכות גבוהה, בעלי טוהר גבוה, ברמת מחקר לשימוש במודלים פרה-אקליניים של בעלי חיים גדולים. ייצור AAV באמצעות פרוטוקול זה מושגת באמצעות transfection כפול פלסמיד לתוך כליות עובריות אנושיות דבקות (HEK)293 תאים הגדלים בערימות תאים. יתר על כן, המחקר מתאר פרוטוקול עבור טיהור כרומטוגרפיה זיקה הפרין גופרתי, אשר יכול לשמש עבור סרוטיפים AAV המכילים תחומים מחייב הפרין, כולל AAV2, 3, 6, 6.2FF, 13, ו DJ21,22.
מספר מערכות אריזה זמינות לייצור וקטורים AAV. בין אלה, השימוש במערכות שיתוף פעולה דו-פלסמיד, שבהן הגנים Rep ו- Cap וגנים מסייעים עד (E1A, E1B55K, E2A, E4orf6 ו- VA RNA) כלולים בתוך פלסמיד אחד (pHelper), יש כמה יתרונות מעשיים על פני שיטת טרנספקטציה נפוצה של שלושה פלסמיד (משולש), כולל עלות מופחתת לייצור plasmid23,24 . גנום AAV plasmid המכיל את קלטת הביטוי transgene (pTransgene), חייב להיות מוקף על ידי ITRs, ואסור לחרוג ~ 4.7 kb אורך. טיטר וקטור וטוהר יכול להיות מושפע טרנסג'ן בשל השפעות ציטוטוקסיות פוטנציאליות במהלך transfection. הערכה של טוהר וקטור מתוארת כאן. וקטורים המיוצרים בשיטה זו, אשר מניבים 1 x 1013 vg / mL עבור כל אחד, הוערך בעכברים, אוגרים, מודלים בעלי חיים הביצית.
טבלה 1: הרכב הפתרונות הנדרשים. מידע הכרחי, כולל אחוזים ואמצעי אחסון, של רכיבים הדרושים לפתרונות שונים לאורך הפרוטוקול. נא לחץ כאן כדי להוריד טבלה זו.
Protocol
1. טרנספלציה כפולה של תאי HEK293 בערימות תאים
- להפשיר קריו-ביון של תאי HEK293 באמבט חרוזים להגדיר ב 37 °C (50 °F).
הערה: DMEM מלא מראש עד 37 °C (7 °F) בעוד תאים מפשירים כדי להבטיח את הטמפרטורה הקרה לא לזעזע תאים בעת ציפוי. ודא שלתאים יש מספר מעבר נמוך, באופן אידיאלי פחות מ-20, כדי להבטיח צמיחה אופטימלית ויעילות טרנס-זיהום. ודא שהתאים מאושרים להיות ללא מיקופלסמה. - העבר את התוכן של טיפת הקפאה-vial לתוך צינור חרוט 15 מ"ל המכיל 10 מ"ל של DMEM מלא מחומם מראש צנטריפוגה התאים ב 500 x גרם במשך 5 דקות.
- שאפו את המדיה, ולאחר מכן resuspened תאי HEK293 ב 20 מ"ל של DMEM מלא התחמם מראש. זרע את התאים בצלחת 15 ס"מ ודגורה ב 37 °C (5%, עם 5% CO2.
- לפצל את התאים מצלחת אחת 15 ס"מ לשלושה עבור זריעה בתא תרבית התא.
- לאחר התאים הם 80% מפגש, לשאוף את התקשורת בעדינות לשטוף את הצלחת עם 3 מ"ל של PBS לא לשבש את monolayer. לאחר מכן, לשאוף PBS ולהוסיף 3 מ"ל של טריפסין.
- דגירה במשך 2 דקות ב 37 °C עד התאים להרים מן הצלחת, ולאחר מכן לנטרל טריפסין על ידי הוספת 7 מ"ל של DMEM מלא לצלחת.
- לאסוף את כל המדיה והתאים לתוך צינור 15 מ"ל גלולה את התאים על ידי centrifuging ב 500 x g במשך 5 דקות.
- שאפו את supernatant מצינור 15 מ"ל ו resuspend גלולה התא ב 3 מ"ל של DMEM מלא. הוסף 1 מ"ל לכל צלחת 15 ס"מ המכילה 20 מ"ל של DMEM מלא; בעדינות לטלטל את הצלחות כדי להפיץ את התאים באופן שווה, ודגורה ב 37 °C (5%, עם 5% CO2.
- לאחר התאים הם 80% מפגש, לחזור על שלבים 1.4.1 ו 1.4.2. לאסוף את supernatant ב 50 mL צינורות חרוטיים, בעדינות הפוך את הצינור כדי להבטיח את התאים הומוגניים.
- לקבוע את צפיפות התא על ידי ערבוב 10 μL של דגימות של תאים עם 10 μL של כחול טריפן והוספת התערובת שקופית ספירת תאים לניתוח בדלפק התא.
- ערבבו 1 ליטר של DMEM מלא מחומם מראש עם השעיית התא הדרושה כדי לזרוע את תא תרבית התא (שטח פנים של 6360 ס"מ2) עם 1 x 104 תאים / ס"מ2. יוצקים את תערובת התאים לתא תרבית התאים ומסובבים בעדינות כדי לפזר באופן שווה את התאים על פני כל מונו-שכבתית(איור 1)ודגרה ב-37 מעלות צלזיוס, עם 5% CO2.
- בנוסף לתא תרבית התא, צלחת 15 ס"מ עם 1 x 104 תאים / ס"מ2 כהפניה למפגש.
- לאחר דגירה ~ 65 שעות, לבדוק את לוח ההתייחסות למפגש - אידיאלי ~ 80%-90% confluent.
הערה: DMEM מלא מראש להוספת תא תרבית התא ב 37 °C (50 °F).
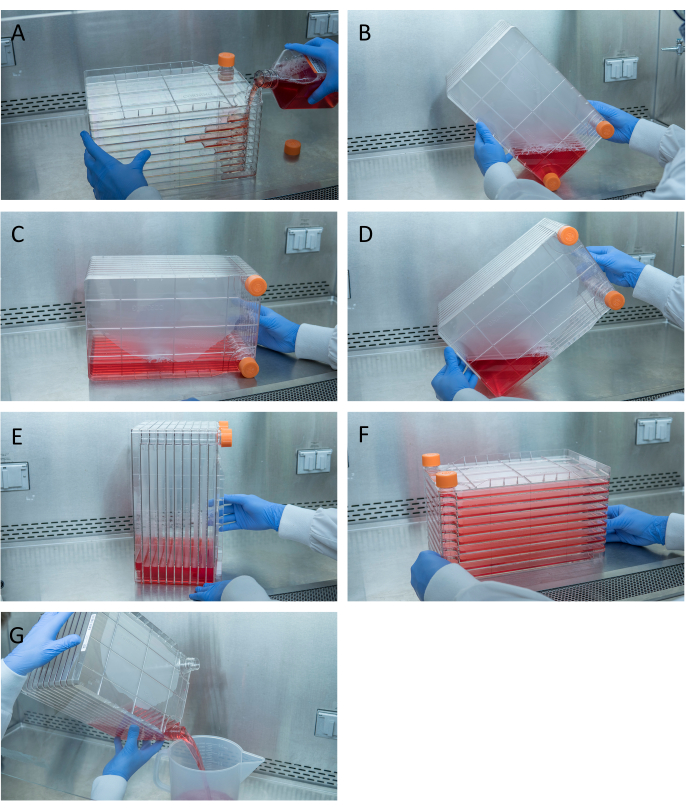
איור 1: תמרון של מחסנית תאים לזריעת תאים ולהצלה. עבור ערימת תאים זריעה, להתחיל על ידי הסרת אחד כובעי האוורור ושפוך 1 ליטר של DMEM מלא מחומם מראש עם הכמות הדרושה של תאי HEK293 (A). פזר באופן שווה תאים ומדיה על-ידי הידוק שני כובעי האוורור והבא את כל המדיה לפינה של מחסנית התאים עם אחד מכובעי האוורור והצבתו בפינה זו (B), מקם את מחסנית התאים בצד שלה (C) ולאחר מכן סובב את מחסנית התאים ב- 90° (D) כך שיציאות האוורור למעלה (E). הוריד בעדינות את מחסנית התאים למיקומה האופקי הרגיל והבטח שכל התאים של מחסנית התאים מכוסים לחלוטין במדיה (F). בעת ביצוע ההדבקה, פתחו את שני כובעי האוורור ושפכו לאט לאט את המדיה הישנה לתוך מיכל פסולת סטרילי לזרימה אפילו לא להפריע למונו-שכבתית של התאים (G). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הכן תערובת פוליאתילנית (PEI)/DNA ביחס ריכוז של 3:1 (w/w).
- הכן את תערובת ה- DNA בצינור חרוטי 50 מ"ל על ידי הוספת 475 מיקרוגרם של pTrangene ו 1425 מיקרוגרם של pHelper ל 40 מ"ל של מדיום בסרום מופחת כדי ליצור יחס 3:1 של pHelper:pTrangene.
הערה: ניתן למצוא את מחשבון תערובת PEI / DNA באמצעות טבלה 2. - הוסיפו 5.7 מ"ל של PEI (1 גרם/ליטר) למדיום בסרום מופחת ותערובת הדנ"א טיפה. לאחר מכן, מערבולת בקצרה ודגרה במשך 10 דקות בטמפרטורת החדר.
הערה: כאשר PEI / DNA מדגירה בטמפרטורת החדר, יהיה מעונן מעט.
- הכן את תערובת ה- DNA בצינור חרוטי 50 מ"ל על ידי הוספת 475 מיקרוגרם של pTrangene ו 1425 מיקרוגרם של pHelper ל 40 מ"ל של מדיום בסרום מופחת כדי ליצור יחס 3:1 של pHelper:pTrangene.
- לאחר 8 דקות של דגירה PEI / DNA, להסיר את המדיה מתא תרבית התא.
הערה: יש להקפיד לשחרר את שני כובעי הכתומים כדי לשמור על זרימה חלקה של מדיה כדי למנוע פירוק תאים. - הוסיפו PEI/DNA ל-1 ליטר של DMEM שלם שהתחמם מראש, ושפכו לאט לאט את התערובת ליציאת התאים. פזורו את הנוזל באופן שווה לכל השורות(איור 1)ודגרו במשך 72 שעות ב-37 °C (5%), עם 5% CO2.
2 קציר AAV ותסיסה כימית של תאי HEK293 שהודבקו
- לנער את תא תרבית התא במרץ כדי לסלק את התאים עד התקשורת נראית מעוננת מתאים מנותקים לשפוך לתוך ארבעה צינורות צנטריפוגה 500 מ"ל.
- צנטריפוגות הצינורות ב 18,000 x g במשך 30 דקות ב 4 °C (70 °F) כדי כדורי התאים. יוצקים את supernatant המובהק לתוך 1 L פוליאתילן טרפתלט copolyester (PETG) בקבוק.
הערה: אם אין גישה לצנטריפוגה במהירות גבוהה, צנטריפוגה ב 12,000 x g במשך 40 דקות. התאים כדורית לא יכול להיות מוצק במהירות זו יהיה להחליק כמו לשפוך החוצה supernatant. - resuspend כדורי התא ב 500 mL צינורות צנטריפוגה עם 50 מ"ל של חוצץ תמוגה ודגרה במשך 60 דקות ב 37 °C (57 °F).
- צנטריפוגות הצינורות ב 18,000 x g במשך 30 דקות, ולאחר מכן להעביר את supernatant לאותו בקבוק PETG 1 L. השלך את פסולת התאים המנוצלים.
הערה: לטהר את supernatant המובהק מיד ולאחסן ב 4 °C (72 °F) עד 72 שעות. לאחסון לטווח ארוך יותר, יש לאחסן ב- -80 °C (70 °F). אין לאחסן ב--20 מעלות צלזיוס.
3 AAV וקטור טיהור באמצעות כרומטוגרפיה של זיקה הפרין
- הסר את ליסאט גולמי מ -80 °C (50 °F) ולהשאיר בשעה 4 °C (50 °F) לילה כדי להפשיר. לאחר הפשרה, השתמש במסנן 0.22 מיקרומטר כדי לסנן את ה- lysate הגולמי.
- כדי להעביר את רכז הצנטריפוגלי, להוסיף 4 מ"ל של חיץ טרום טיפול מסנן לרכז צנטריפוגלי עבור כל עמוד ספרוז הפרין בשימוש. יש להעביר את הרכז הצנטריפוגלי בטמפרטורת החדר למשך 2-8 שעות. הגדר פסיבים מיד לפני שלב הטיהור.
- הגדירו את הצינורות ואת המשאבה(איור 2).
- מניחים את הצינורות במשאבה פריסטלטית ולהפעיל 20 מ"ל של 1 M NaOH. לאחר מכן, להפעיל 50 מ"ל של מים מולקולריים כיתה, ולאחר מכן להפעיל 50 מ"ל של DMEM בזאלי.
- צרף עמודת ספרון הפרין 5 מ"ל לצינורות והפעל 25 מ"ל של DMEM בזאלי כדי להסיר את החומר המשמר.
- הפעל 0.2 μM של ליסייט גולמי מסונן דרך העמודה בקצב זרימה של 1-2 טיפות/s.

איור 2: הגדירו משאבה פרייסטלית לטיהור AAV. הפעל את הצינורות מן lysate הגולמי, דרך המשאבה peristaltic, ולתוך עמוד מטריצת הפרין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
הערה: הקפד לא להציג בועות או לאפשר לעמודה להתייבש, שכן זה יסכן את העמודה וימנע את ההבעה של AAV. השלך את העמודה אם היא מתייבשת והשתמש בעמודה חדשה למשך שארית ה- lysate הגולמי.
- טען את כל lysate הגולמי על עמוד הפרין ולהשתמש בפתרונות הבאים כדי לשטוף את העמודה.
- לשטוף באמצעות 50 מ"ל של 1x האנק פתרונות מלח מאוזנים (HBSS) ללא Mg2 + ו Ca2 +.
- לשטוף באמצעות 15 מ"ל של 0.5 % N-Lauroylsarcosine ב HBSS ללא Mg2 + ו Ca2 +.
- לשטוף באמצעות 50 מ"ל של HBSS ללא Mg2 + ו Ca2 +.
- לשטוף באמצעות 50 מ"ל של HBSS עם Mg2+ ו Ca2 +
- לשטוף באמצעות 50 מ"ל של 200 mM NaCl / HBSS עם Mg2 + ו Ca2 +.
- אלוט 5 x 5 מ"ל (25 מ"ל סה"כ) עם 300 מ"מ של NaCl /HBSS עם Mg2+ ו- Ca2+ ולתייג את האלוטות כ- E1-E5 (כל אלוטציה היא של 5 מ"ל).
- ריכוז הנגיף באמצעות רכז צנטריפוגלי
- סובבו את הרכז הצנטריפוגלי המכיל את המאגר לפני הטיפול ב-900 x g למשך 2 דקות. זרוק את הזרימה דרך.
- לשטוף את מסנן רכז צנטריפוגלי עם 4 מ"ל של HBSS עם Mg2+ ו Ca2 + וצנטריפוגה ב 1000 x גרם במשך 2 דקות; זרוק את הזרימה דרך.
- מוסיפים את ה-E2 לרכז הצנטריפוגלי. ספין ב 1000 x g במשך 5 דקות ולהשליך את הזרימה דרך.
- לסיים להוסיף E2 ולאחר מכן להוסיף E3 לרכז צנטריפוגלי להסתובב ב 1000 x g במשך 5 דקות עד הווירוס המרוכז הוא כ 1 מ"ל.
הערה: הימנעו משימוש בווקטור כך שהנפח יהיה מתחת לרמת המסנן. אין לרכז את E1, E4 או E5 ברכז הצנטריפוגלי, שכן הם מכילים מעט מאוד עד ללא וקטור ומכילים מזהמים. - הסר את הווירוס המרוכז מן רכז צנטריפוגלי באמצעות קצה מסונן p200 ומניחים אותו לתוך צינור צנטריפוגה סטרילי 1.5 מ"ל.
- יש לשטוף את הרכז הצנטריפוגלי עם 200 מיקרו-אל של HBSS עם Mg2+ ו-Ca2+ כדי להעיף את כל ה-AAV הנותר מהמסנן. פיפטה למעלה ולמטה במרץ מספר פעמים (עבור ~ 30 s) כדי להעביר כל וירוס דבק בממברנה ולהניח את צינור צנטריפוגה 1.5 מ"ל עם שארית הנגיף. מערבבים היטב את הצינור.
- Aliquot 5 μL עבור עקירות DNA ולאחסן את הווקטור המטוהר ב -80 °C (50 °F).
- לשטוף את העמודה באמצעות 25 מ"ל של 2 M NaCl. יתר על כן, השתמש 25 מ"ל של 0.1% Triton X-100, מחומם מראש ל 37 °C (7 °F) לשטוף את העמודה. לאחר מכן, לשטוף את העמודה באמצעות 50 מ"ל של סטרילי dH2O, ולאחר מכן לשטוף באמצעות 25 מ"ל של 20% אתנול.
- ודא קרום העמודה רוויה לחלוטין 20% אתנול, כמו זה פתרון האחסון. חתום את העמודה עם תקעים שסופקו ולאחסן ב 4 °C (7 °F).
- אחסן את הצינורות ב 1 M NaOH.
הערה: אם מנקים כראוי, עמודות ספרון הפרין ניתן להשתמש מחדש עד חמש פעמים.
4 מיצוי דנ"א גנומי AAV
- הכן את תערובת התגובה המוזכרת בטבלה 3 בצינור PCR לטיפול DNase.
| רכיב | נפח |
| וקטור AAV מטוהר | 5 μL |
| מאגר DNase 10x | 2 μL |
| DNase | 1 μL |
| ddH2O | 12 μL |
| אמצעי אחסון סופי | 20 μL |
טבלה 3: נוסחת תערובת מאסטר לטיפול DNase. רכיבים ונפחים מומלצים הנדרשים לטיפול DNase של וקטורים ויראליים AAV במהלך מיצוי DNA.
- מערבולת צינור PCR לערבב ולפעום את צינור PCR לסובב את התוכן.
- באמצעות תרמוציקלר, דגירה ב 37 °C (55 °F) במשך 20 דקות ואחריו 75 °C (75 °F) במשך 15 דקות כדי לחמם את DNase.
- יש להוסיף 5 מיקרו-אל של פרוטאינאז קיי.
- באמצעות תרמוציקלר, דגירה ב 50 °C (50 °F) במשך 60 דקות ולאחר מכן ב 95 °C (30 °F) במשך 30 דקות כדי לחמם את Proteinase K.
- השתמש בערכת ניקוי DNA כדי להסיר מזהמים פוטנציאליים.
הערה: שלב זה בוצע באמצעות ערכת ניקוי דם ורקמות זמינה מסחרית(טבלת החומרים).- הוסף 200 μL של חיץ AL (ערכת ניקוי דם ורקמות, טבלת חומרים) לצינור PCR המכיל את הווקטור המטופל DNase / Proteinase K.
- מערבולת צינור PCR ודגרה ב 56 °C (56 °F) במשך 10 דקות תרמוציקלר.
- Pipette את הנוזל מצינור PCR לתוך עמוד ספין סטרילי יושב בצינור אוסף.
- הוסף 200 μL של 100% אתנול לעמוד ולערבב ביסודיות על ידי מערבולת.
- צנטריפוגה ב 6,000 x g במשך 1 דקות ולהשליך את הזרימה דרך.
- הוסף 500 μL של חוצץ AW1 (ערכת ניקוי דם ורקמות, טבלת חומרים) לעמודת הסיבוב.
- צנטריפוגה ב 6,000 x g במשך 1 דקות ולהשליך את הזרימה דרך.
- הוסף 500 μL של חוצץ AW2 (ערכת ניקוי דם ורקמות, טבלת חומרים) לעמודת הסיבוב.
- צנטריפוגה ב 15,000 x g במשך 3 דקות ולהשליך את הזרימה דרך.
- מניחים את עמוד הספין לתוך צינור צנטריפוגה סטרילי 1.5 מ"ל ולהוסיף 200 μL של AE חיץ (ערכת ניקוי דם ורקמות, שולחן חומרים) ישירות לקרום עמוד ספין.
- דגירה בטמפרטורת החדר למשך דקה אחת.
- צנטריפוגה ב 6,000 x gבמשך 1 דקות כדי לחמוק מהדנ"א.
- לאחסן את ה- DNA ב - -20 °C (50 °F).
5 טיטרציה של גנומים וקטוריים AAV באמצעות תגובת שרשרת פולימראז כמותית ווירוס Simian 40 (SV40) בדיקה
הערה: בצע את כל עבודת qPCR במכסה המנוע של PCR באמצעות טיפים מסוננים של פיפטה כדי למנוע זיהום DNA חיצוני. אם הגנום AAV אינו מקודד רצף פוליה SV40, השתמש בבדיקה נגד ITR המתואר במקום אחר25. ודא שהדנ"א הפלסמי שנבחר כסטנדרט מכיל רצף פוליה SV40.
- הכנת תקן מלאי
- לדלל את תקן ה- DNA plasmid המלאי (pTransgene plasmid המכיל רצף פוליה SV40) לריכוז סופי של 10 מיקרוגרם / μL ולאחסן ב -20 °C ב 6 aliquots μL.
- קבע את מספר העותק הנמצא בתקן ה- DNA של פלסמיד באמצעות המחשבון המקוון הבא26.
הערה: השתמש בדנ"א פלסמי המשמש לתקן המיוצר על ידי ספק מסחרי כדי להבטיח איכות וריכוז נכון. הכן כמות גדולה של תקן (למשל, 10 מ"ל) כדי לערוך מחקרי גישור בעת מעבר לתקן שהוכן לאחרונה.
- הכן את תערובת הריאגנט הבאה המוזכרת בטבלה 4 הן עבור הדגימות והן עבור התקן בצינור צנטריפוגה 1.5 מ"ל.
הערה: הכן עודף מספיק של תערובת מאסטר. ראה טבלה 5 עבור רצפי פריימר /בדיקה.
| רכיב | נפח |
| תערובת אב אוניברסלית של qPCR (פי 2) | 10 μL |
| מים ברמה מולקולרית | 4.5 μL |
| 40x SV40 פוליה פריימר/בדיקה | 0.5 μL |
| אמצעי אחסון סופי | 15 μL |
טבלה 4: תערובת תבנית בסיס של qPCR עבור טיטרציה של AAV. רכיבים ונפחים מומלצים הנדרשים ל- qPCR של DNA שחולצו מווקטורים ויראליים של AAV.
| רכיב | רצף |
| פריימר קדמי | 5'-אגקטאגקטקאקאאטקאה-3' |
| פריימר הפוך | 5'-CCAGACATGATAAGATACATTGATGAGTT-3' |
| בדיקה | /56-FAM/AGCATTTTT/Zen/TTCACTGCATTCTAGTTGTGGTTTGTC/3IABKFQ |
טבלה 5: רצפי פריימר נגד רצף ה- DNA של הפוליה SV40. רצפים של פריימרים וגשוש המשמשים titration qPCR, אשר נקשרים לאזורים ספציפיים של וקטורים ויראליים AAV המכילים את רצף הפוליA SV40.
- פיפטה, התבנית הראשית, מערבבת מעלה ומטה כדי לערבב.
- תסדר את לוח הדילול.
- השתמש בצלחת ברורה של 96 באר כדי להכין דילול סטנדרטי ודגם, הוסף 45 μL של מים ברמה מולקולרית לכל באר בכל עמודה אחרת החל בעמודה 1 (עמודות 1, 3, 5, 7, 9 ו- 11).
- הוסף 5 μL של התקן כדי גם A1 ו pipette לערבב.
- השתמש בקצה פיפטה מסונן חדש כדי ליצור דילול של 1/10 מבאר A1 ל- B1.
- המשך סדרה של דילול פי 10 במורד העמודה עד להגעה ל- G1.
- אל תוסיף ל- H1, שכן פעולה זו תפעל כשליטה שלילית.
- החל את המדגם הראשון (S1) על ידי הוספתו ל- A3, ויוצר דילול 1/10. Pipette תערובת זו ולהעביר 5 μLto היטב B3. יש להשליך את טיפ הפיפטה לאחר העברה זו.
- עם טיפ פיפטה חדש, מערבבים את התמיסה היטב B3 ויוצרים דילול 1/100. מעבירים 5 μLof תערובת זו היטב C3 ולהשליך את הקצה לאחר ההעברה.
- עם טיפ פיפטה חדש, פיפטה למעלה ולמטה הפתרון היטב C3 כדי להפוך דילול 1/1000. זרוק את הקצה.
- המשך לדלל דוגמאות מבלי להוסיף דוגמאות לעמודות 2, 4, 6, 8, 10 או 12.
- לאחר כל הדגימות מדוללות, מערבבים את התוכן בבארות של עמודה 1 ולאחר מכן מעבירים 20 μL לעמודה 2.
- חזור על פעולה זו עבור עמודות 3, 5, 7, 9 ו- 11 כדי ליצור שכפולים של כל דילול סטנדרטי ודגם. עיין באיור 3 לפריסת לוחית רישוי.
הערה: בעת הגדרת הלוח הבא באיור 3, דגימות מדוללות בשורות G ו- H יהיו רק 1/10 ו- 1/100 דילול.
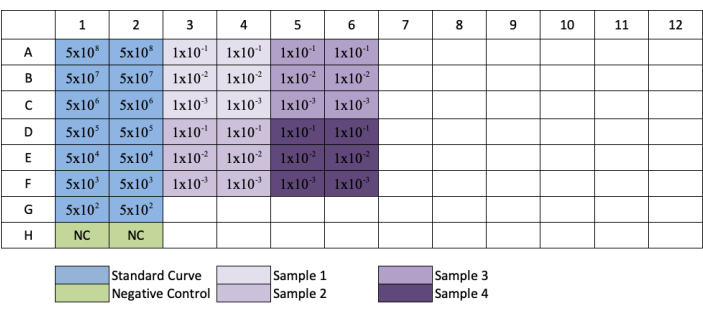
איור 3: פריסת לוחית עבור titration AAV qPCR. כחול מציין את מיקום הדילול הטורי של התקן; ירוק מציין את המיקום של הפקד השלילי; סגול מציין את המיקום של דילול הדגימות. כל דוגמה סטנדרטית, שלילית או מדגם מתווספת לשכפול. דוגמה לריכוז התקן נוספה כדי להציג את סדרת הדילול של התקן, ומיקום דילול מדגם נוספו לבארות שלהם בהתאמה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- טיטרציה על ידי SV40 פוליה מבוסס זיהוי qPCR
- הוסף 15 μL של תערובת מאסטר qPCR לכל באר של צלחת qPCR 96-חצאית לבן.
- העבר 5 μL של כל מדגם מן צלחת ברור 96-well לצלחת 96 חצא לבן חצאי היטב qPCR.
- השתמש בצינור רב-ערוצי כדי להבטיח ערבוב הולם של התערובת והדגימה הראשית של qPCR.
- לאטום את הצלחת עם סרט איטום צנטריפוגה צלחת qPCR ב 1500 x g עבור 30 s.
- הפעל את תגובת qPCR במכשיר הגברה וזיהוי PCR מבוסס לוחית בזמן אמת, תוך שימוש בתנאים המוצעים בטבלה 6.
| במקטע | מחזורים | זמן | טמפרטורה | תיאור |
| לפני הדגירה | 1x | 5 דקות | 95 °C (75 °F) | דנ"א. |
| הגברה | 38x | 15 s | 95 °C (75 °F) | הגברה של דנ"א. ניתן לשנות את ההגדרות אם משתמשים בפריימרים חלופיים עם טמפרטורות חישול שונות. |
| שנות ה-60 | 60 °C (70 °F) | |||
| קירור | 1x | שנות ה-60 | 40 °C (70 °F) | צלחת קירור. סוף הריצה. |
טבלה 6: פרוטוקול תרמוציקלר עבור titration qPCR מבוסס בדיקה הידרוליזה. פרוטוקול תרמוציקלר מומלץ לשימוש titration qPCR מבוסס בדיקה של DNA שחולצו וקטורים AAV מטוהרים.
הערה: עבור גליון עבודה של titration AAV של qPCR ראה טבלה 7.
- ניתוח נתונים כדי לקבוע מספרי העתקת גנום AAV.
- מלא את תאי הנתונים של הגיליון האלקטרוני (טבלה 7A) בערכי הריכוז המתקבלים מהפעלת qPCR הן עבור דילול רגיל והן עבור דילול מדגם.
- השתמש בערכי ריכוז מטבלה 7A כדי ליצור עקומה סטנדרטית (טבלה 7B).
הערה: העקומה הסטנדרטית תוצג כלוגריתם טבעי (y = ln(x) + b) יחד עם יעילות R2. לעקומה סטנדרטית חייבת להיות יעילות הקרובה ל- 100 % ו- R2 קרוב ל- 1.0 (≥0.99). - מלא את יעילות השיפוע על ידי מילוי מחשבון מקוון זה27.
הערה: יעילות בין 90%-110% מקובלת. אם היעילות של qPCR נמצאת מחוץ לטווח זה, הפעל מחדש את ה- qPCR. - השתמש בערכי ריכוז מטבלה 7A כדי לממוצע את הדילול של כל מדגם ולקבוע את סטיית התקן של כל מדגם (טבלה 7C).
הערה: אל תכלול דילול מדגימות הנמצאות במרחק של יותר מסטיית תקן אחת מהממוצע של דילול המדגם. - באמצעות הריכוז הממוצע של כל דילול, להכפיל על ידי גורם דילול, ולאחר מכן לחלק בחמש כדי לקבל את הגנומים וקטור (vg)/μL של כל מדגם (טבלה 7C).
- חשב את vg/mL של כל מדגם על ידי הכפלת הממוצע של ריכוזי כל מדגם ב-80,000 (טבלה 7C).
- ממוצע vg / mL של כל דילול כדי לייצר את vg הסופי / mL של כל מדגם (טבלה 7C).
הערה: המשתמש חייב לחלק את הריכוז הממוצע של כל דילול על ידי גורם חמש כדי להסביר את 5 μL טעון לתוך כל באר עבור ריצת qPCR כדי לייצר את הריכוז vg / μL. הגורם של 80,000 חשבונות עבור המעבר מערך הריכוז הממוצע של כל דגימות ל- vg / mL. ראשית, יש להכפיל את ממוצע ערך הריכוז של כל דגימה ב- 2 כדי להסביר את הגנום החד-גדילי, שכן ערכת בדיקת הפריימר מכמתת רק את ה- DNA החיובי-חושי, החד-גדילי (ssDNA), וגנום AAV קיים ביחס משוער של 1:1 בין ssDNA חיובי לתחושה שלילית25,28. יש להכפיל את ממוצע ערך הריכוז של כל דגימה x40 כדי להסביר את דילול הדגימה מ- 5 μL של וקטור מטוהר (סעיף 4.1) ל- 200 μL של DNA שחולץ (סעיף 4.6.12). לבסוף, הממוצע של ערך הריכוז של כל מדגם חייב להיות מוכפל x1000 כדי להמיר מ vg / μL ל vg / mL.
6 הערכה של איכות וקטור וטוהר
- בקרת איכות - כתם מערבי
- הכן ג'ל SDS PAGE 12%.
- בצע אלקטרופורזה ג'ל polyacrylamide.
הערה: לטעון 6 x 1010 vg של דגימות לבאר. - העבר את החלבונים לקרום פוליווינילידן דיפלואוריד (PVDF).
- חסימת קרום PVDF
- הסר את הממברנה ממנגנון ההעברה ולשטוף 0.1% PBST כדי להסיר אקרילאמיד רופף.
- מניחים את הממברנה בחסימת פתרון לפחות 1 שעה בטמפרטורת החדר או לילה ב 4 °C (70 °F).
הערה: ניתן להשלים עוד יותר את חסימת המאגר עם סרום עזים של 2%.
- דגירה עם נוגדן ראשוני
- פירוק מאגר החסימה והוסף את הנוגדן העיקרי, נוגדן חד שבטי נגד עכבר AAV בדילול של 1:200.
- דגירה לילה ב 4 °C (5 °F).
- יש לנקות את הנוגדן העיקרי ולשטוף חמש פעמים עם 0.1% PBST למשך 5 דקות בטמפרטורת החדר עם תסיסה.
- דגירה עם נוגדן משני
- נקו את תמסת הכביסה והוסיפו נוגדן משני מצומד של HRP, מדולל ב-1:7500 בחסימת חוצץ, ודגרה במשך שעה אחת בטמפרטורת החדר בתסיסה.
- הדק את הנוגדן המשני לשטוף חמש פעמים עם 0.1% PBST במשך 5 דקות בטמפרטורת החדר עם עצבנות.
- בצע שטיפה סופית עם PBS בטמפרטורת החדר עם עצבנות.
- לזהות את החלבונים באמצעות מצע כימותרפיה משופרת (ECL).
- דמיינו את הג'ל כדי לדמיין את החלבונים הנגיפיים (VP1, VP2 ו-VP3) (איור 4).

איור 4: כתם מערבי המציג חלבונים קבסיד AAV. נתיב א'; סולם MW, ליין B; AAV6.2FF-hIgG01, ליין C; AAV6.2FF-hIgG02, ליין D; AAV6.2FF-hIgG03, וליין E; AAV6.2FF-hIgG04. 6 x 1010 vg של כל AAV6.2FF-hIgG הועמסו לנתיבים שלהם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- בקרת טוהר - דף SDS וכתם קומאסי
- הכן ג'ל SDS-PAGE ודוגמאות כמתואר מהשלב 6.1.1 ו- 6.1.2.
- תקן את הג'ל בתיקון פתרון במשך שעה אחת או לילה עם עצבנות עדינה. שנה את פתרון התיקון פעם אחת במהלך השעה הראשונה.
- מכתימים את הג'ל בתמיסת כתמים למשך 2-4 שעות בתסיסה עדינה.
- תמנע את הג'ל עם פתרון תיעה. לחדש את הפתרון destaining מספר פעמים עד הרקע של הג'ל הוא destained לחלוטין (4-24 שעות).
- אחסן את הג'ל המוכתם בפתרון אחסון.
- דמיינו את הג'ל כדי לדמיין את כל החלבונים המוכתמים בתמיסת כתמי קומאסי.
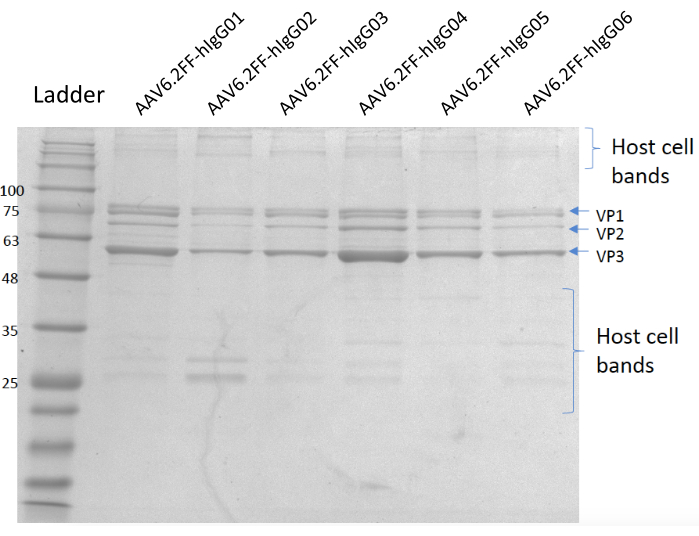
איור 5: ג'ל מוכתם בקומה. נתיב א'; סולם MW, ליין B; AAV6.2FF-hIgG01, ליין C; AAV6.2FF-hIgG02, ליין D; AAV6.2FF-hIgG03, ליין E; AAV6.2FF-hIgG04, ליין F; AAV6.2FF-hIgG05, וליין G; AAV6.2FF-hIgG06. 6 x 1010 vg של כל AAV6.2FF-hIgG הועמסו לנתיבים שלהם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- בקרת טוהר חלופית - זיהוי חלבון תאי מארח HEK293 ELISA
- בצע את זיהוי חלבון התא המארח HEK293 באמצעות ELISA בהתאם להוראות היצרן.
הערה: השתמש בדילול של 5 x 10-2 ו- 1 x 10-3 עבור דגימות rAAV מטוהרות. לאחר TMB מתווסף לבאר, דגירה הרחק מהאור. אין אפשרות להשתמש ברגרסיה ליניארית כדי לנתח את התוצאות. - בצע ניתוח מנקודה לנקודה, spline מעוקב, או שיטת התאמה לוגיסטית ארבעה פרמטרים כדי interpolate ריכוזים של לא ידועים ולהכפיל על ידי גורם הדילול כדי לקבוע את ריכוז המדגם המקורי.
- בצע את זיהוי חלבון התא המארח HEK293 באמצעות ELISA בהתאם להוראות היצרן.
תוצאות
תרגום ממודלים מכרסמים קטנים למודלים בעלי חיים גדולים יותר ובסופו של דבר יישום קליני מהווה אתגר משמעותי בשל הכמות הגדולה של AAV הנדרשת כדי transduce בעלי חיים גדולים יותר ולהשיג השפעות טיפוליות. כדי להשוות את יעילות התמסורת של AAV6.2FF capsid שתוכנן באופן רציונלי, הפגין בעבר עלייה של פי 101 ביעילות התמר?...
Discussion
הייצור של וקטורים AAV רקומביננטיים (rAAV) המתוארים במאמר זה משתמש בחומרים נפוצים, ריאגנטים, וציוד שנמצא ברוב המעבדות והמתקנים למחקר ביולוגיה מולקולרית. מאמר זה מאפשר ייצור באיכות גבוהה במבחנה וב-in vivo כיתה rAAV על ידי הקורא. מעל לכל, פרוטוקול זה לייצור rAAV, בהשוואה לפרוטוקולים מייגעים יו...
Disclosures
שרה ק. ווטון היא ממציאה על פטנט אמריקאי US10806802B2 עבור AAV6.2FF capsid.
Acknowledgements
אמירה ד. ראג'י, ברנה א. י. סטיבנס, סילביה פ. תומאס וג'ייקוב ג'י אי ייטס היו מקבלים מלגות סטודנטים לסטודנטים וטרינריים באונטריו וכן מלגות בוגרים של אונטריו. אמירה ד. ראג'י קיבלה תואר שני בסטודנטית מואצת. עבודה זו מומנה על ידי מענק הפרויקט של המכונים הקנדיים לחקר הבריאות (CIHR) (#66009) ומענק לחקר הבריאות השיתופי (NSERC שותף) (#433339) ל- SKW.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore Sigma | S2GPU05RE | |
| 0.25% Trypsin | Fisher Scientific | SM2001C | |
| 1-Butanol | Thermo Fisher Scientific | A399-4 | CAUTION. Use under a laminar flow hood. Wear gloves |
| 10 chamber cellstack | Corning | 3271 | |
| 1L PETG bottle | Thermo Fisher Scientific | 2019-1000 | |
| 30% Acrylamide/Bis Solution | Bio-Rad | 1610158 | |
| 96-well skirted plate | FroggaBio | FS-96 | |
| Adhesive plate seals | Thermo Fisher Scientific | 08-408-240 | |
| Ammonium persulfate (APS) | Bio-Rad | 161-0700 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Blood and Tissue Clean up Kit | Qiagen | 69506 | Use for DNA clean up in section 4.6 of protocol |
| Bromophenol blue | Fisher Scientific | B392-5 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Cell Culture Dishes | Greiner bio-one | 7000232 | 15 cm plates |
| Culture Conical Tube | Thermo Fisher Scientific | 339650 | 15 mL conical tube |
| Culture Conical Tube | Fisher Scientific | 14955240 | 50 mL conical tube |
| Dulbecco's Modified Eagle Medium (DMEM) with 1000 mg/L D-glucose, L-glutamine | Cytiva Life Sciences | SH30022.01 | |
| ECL Western Blotting Substrate | Thermo Fisher Scientific | 32209 | |
| Ethanol | Greenfield | P016EA95 | Dilute ethyl alcohol(95% vol) to 20% for section 3.7.4 and 70% for section 6.1.1.1 |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | SH30396.03 | |
| Glacial acetic acid | Fisher Scientific | A38-500 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Glycerol | Fisher Scientific | BP229-1 | |
| Glycine | Fisher Scientific | BP381-500 | |
| HBSS with Mg2+ and Ca2+ | Thermo Fisher Scientific | SH302268.02 | |
| HBSS without Mg2+ and Ca2+ | Thermo Fisher Scientific | SH30588.02 | |
| HEK293 cells | American Tissue Culture Collection | CRL-1573 | Upon receipt, thaw the cells and culture as described in manufacturer’s protocol. Once cells have been minimally passaged and are growing well, freeze a subfraction for future in aliquots and store in liquid nitrogen. Always use cells below passage number 30. Once cultured cells have been passaged more than 30 times, it is recommended to restart a culture from the stored aliquots |
| HEK293 host cell protein ELISA kit | Cygnus Technologies | F650S | Follow manufacturer’s instructions |
| Heparin sulfate column | Cytiva Life Sciences | 17040703 | |
| Kimwipe | Thermo Fisher Scientific | KC34120 | |
| L-glutamine (200 mM) | Thermo Fisher Scientific | SH30034.02 | |
| Large Volume Centrifuge Tube Support Cushion | Corning | CLS431124 | Support cushion must be used with large volume centrifuge tubes uless the centrifuge rotor has the approriate V-bottom cushions |
| Large Volume Centrifuge Tubes | Corning | CLS431123-6EA | 500 mL centrifuge tubes |
| MgCl2 | Thermo Fisher Scientific | 7791-18-6 | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | 1.5 mL microcentrifuge tube, sterilize prior to use |
| Molecular Grade Water | Cytiva Life Sciences | SH30538.03 | |
| N-Lauroylsarcosine sodium salt | Sigma Aldrich | L5125 | CAUTION. Wear gloves |
| NaCl | Thermo Fisher Scientific | BP35810 | |
| Optimem, reduced serum medium | Thermo Fisher Scientific | 31985070 | |
| Pasteur pipets | Fisher Scientific | 13-678-20D | Sterilize prior to use |
| PBS (10x) | Thermo Fisher Scientific | 70011044 | Dilute to 1x for use on cells |
| Penicillin-Streptomycin Solution | Cytiva Life Sciences | SV30010 | |
| pHelper plasmid | De novo design or obtained from plasmid repository | NA | |
| Pipet basin | Thermo Fisher Scientific | 13-681-502 | Purchase sterile pipet basins |
| Polyethylene glycol tert-octylphenyl ether (Triton X-100) | Thermo Fisher Scientific | 9002-93-1 | CAUTION. Wear gloves |
| Polyethylenimine (PEI) | Polyscience | 24765-1 | Follow manufacturer’s instructions to produce a 1L solution. 0.22μm filter and store at 4°C |
| Polypropylene semi-skirted PCR Plate | FroggaBio | WS-96 | |
| Polysorbate 20 (Tween 20) | Thermo Fisher Scientific | BP337-100 | CAUTION. Wear gloves |
| polyvinylidene difluoride (PVDF) membrane | Cytiva Life Sciences | 10600023 | Use forceps to manipulate. Wear gloves. |
| Primary antibody | Progen | 65158 | |
| Protein Ladder | FroggaBio | PM008-0500 | |
| Proteinase K | Thermo Fisher Scientific | AM2546 | |
| pTrangene plasmid | De novo design or obtained from plasmid repository | NA | Must contain SV40 polyA in genome to be compatible with AAV titration in section 5.0 |
| Pump tubing | Cole-Parmer | RK-96440-14 | Optimize length of tubing and containment of virus in fractions E1-E5 |
| RQ1 Dnase 10 Reaction Buffer | Promega | M6101 | Use at 10x concentration in protocol from section 4.0 |
| RQ1 Rnase-free Dnase | Promega | M6101 | |
| Sample dilutent | Cygnus Technologies | I700 | Must be purchased separately for use with HEK293 host cell protein ELISA kit |
| Secondary antibody, HRP | Thermo Fisher Scientific | G-21040 | |
| Skim milk powder | Oxoid | LP0033B | |
| Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 28312 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | SS266-4 | |
| SV40 polyA primer probe | IDT | Use sequence in Table X for quote from IDT for synthesis | |
| Tetramethylethylenediamine (TEMED) | Thermo Fisher Scientific | 15524010 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypan blue | Bio-Rad | 1450021 | |
| Ultra-Filter | Millipore Sigma | UFC810024 | Ultra-4 Centrifugal 10K device must be used, as it has a 10000 molecular weight cutoff |
| Universal Nuclease for cell lysis | Thermo Fisher Scientific | 88702 | |
| Universal qPCR master mix | NEB | M3003L | |
| Whatman Paper | Millipore Sigma | WHA1001325 | |
| β-mercaptoethanol | Fisher Scientific | 21985023 | CAUTION. Use under a laminar flow hood. Wear gloves |
| CAUTION: Refer to the Materials Table for guidelines on the use of dangerous chemicals. |
References
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: A golden anniversary of discovery, research, and gene therapy success-a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Nathwani, A. C., et al. Long-term safety and efficacy of factor IX gene therapy in hemophilia B. The New England Journal of Medicine. 371 (21), 1994-2004 (2014).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Ylä-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (10), 1831-1832 (2012).
- FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-novel-gene-therapy-treat-patients-rare-form-inherited-vision-loss (2020)
- FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease (2020)
- Statement from FDA Commissioner Scott Gottlieb, MD and Peter Marks, MD Ph.D., Director of the Center for Biologics Evaluation and Research on new policies to advance development of safe and effective cell and gene therapies. FDA Available from: https://www.fda.gov/news-events/press-announcements/statement-fda-commissioner-scott-gottlieb-md-and-peter-marks-md-phd-director-center-biologics (2020)
- Asokan, A., Schaffer, D. V., Samulski, R. J. The AAV vector toolkit: poised at the clinical crossroads. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (4), 699-708 (2012).
- Rose, J. A., Hoggan, M. D., Shatkin, A. J. Nucleic acid from an adeno-associated virus: chemical and physical studies. Proceedings of the National Academy of Sciences of the United States of America. 56 (1), 86-92 (1966).
- Lusby, E., Fife, K. H., Berns, K. I. Nucleotide sequence of the inverted terminal repetition in adeno-associated virus DNA. Journal of Virology. 34 (2), 402-409 (1980).
- Masat, E., Pavani, G., Mingozzi, F. Humoral immunity to AAV vectors in gene therapy: challenges and potential solutions. Discovery Medicine. 15 (85), 379-389 (2013).
- Ling, C. Enhanced Transgene Expression from Recombinant Single-Stranded D-Sequence-Substituted Adeno-Associated Virus Vectors in Human Cell Lines In Vitro and in Murine Hepatocytes In Vivo. Journal of Virology. 89 (2), 952-961 (2014).
- Cathomen, T., Stracker, T. H., Gilbert, L. B., Weitzman, M. D. A genetic screen identifies a cellular regulator of adeno-associated virus. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 14991-14996 (2001).
- McCarty, D. M. Self-complementary AAV vectors; advances and applications. Molecular Therapy. 16 (10), 1648-1656 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of aav serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PLOS One. 8 (9), 76310 (2013).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Pillay, S., et al. Adeno-associated virus (AAV) serotypes have distinctive interactions with domains of the cellular AAV receptor. Journal of Virology. 91 (18), (2017).
- Merkel, S. F. Trafficking of adeno-associated virus vectors across a model of the blood-brain barrier; a comparative study of transcytosis and transduction using primary human brain endothelial cells. Journal of Neurochemistry. 140 (2), 216-230 (2017).
- van Lieshout, L. P., et al. A novel triple-mutant AAV6 capsid induces rapid and potent transgene expression in the muscle and respiratory tract of mice. Molecular Therapy. Methods & Clinical Development. 9, 323-329 (2018).
- Wu, Z., Asokan, A., Grieger, J. C., Govindasamy, L., Agbandje-McKenna, M., Samulski, R. J. single amino acid changes can influence titer, heparin binding, and tissue tropism in different adeno-associated virus serotypes. Journal of Virology. 80 (22), 11393-11397 (2006).
- Liu, J., Moon, Y. -. A. Simple purification of adeno-associated virus-DJ for liver-specific gene expression. Yonsei Medical Journal. 57 (3), 790-794 (2016).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adeno-associated virus vectors. Human Gene Therapy. 9 (18), 2745-2760 (1998).
- Kimura, T., et al. Production of adeno-associated virus vectors for in vitro and in vivo applications. Scientific Reports. 9 (1), 13601 (2019).
- Aurnhammer, C., et al. Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences. Human Gene Therapy Methods. 23 (1), 18-28 (2012).
- . Paramyxoviridae: The viruses and their replication. Fields Virology Available from: https://www.scholars.northwestern.edu/en/publications/paramyxoviridae-the-viruses-and-their-replication (1996)
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Kaludov, N., Brown, K. E., Walters, R. W., Zabner, J., Chiorini, J. A. Adeno-associated virus serotype 4 (AAV4) and AAV5 Both require sialic acid binding for hemagglutination and efficient transduction but differ in sialic acid linkage specificity. Journal of Virology. 75 (15), 6884-6893 (2001).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Human Gene Therapy Methods. 26 (6), 228-242 (2015).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Frontiers in Microbiology. 10, 1570 (2019).
- Backovic, A., et al. Capsid protein expression and adeno-associated virus like particles assembly in Saccharomyces cerevisiae. Microbial Cell Factories. 11, 124 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved