需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在细胞堆中生产腺相关病毒载体,用于大型动物模型的临床前研究
摘要
在这里,我们提供了使用在细胞堆叠中生长的贴壁HEK 293细胞和亲和色谱纯化大规模生产研究级AAV载体的详细程序。该方案始终如一地产生>1 x 1013 个载体基因组/ mL,提供适合大型动物研究的载体量。
摘要
腺相关病毒(AAV)载体是临床上最先进的基因治疗载体之一,有三种AAV基因疗法被批准用于人类。AAV新应用的临床进展涉及从小动物模型(如小鼠)过渡到较大的动物模型,包括狗,绵羊和非人类灵长类动物。对大型动物施用AAV的局限性之一是需要大量高滴度病毒。虽然悬浮细胞培养是AAV载体生产的可扩展方法,但很少有研究实验室拥有设备(例如,生物反应器)或知道如何以这种方式生产AAV。此外,与贴壁HEK293细胞相比,在悬浮HEK 293细胞中产生AAV滴度通常显着降低。这里描述的是一种使用细胞堆栈生产大量高滴度AAV的方法。还描述了用于滴定AAV的详细方案以及验证载体纯度的方法。最后,介绍了AAV介导的转基因表达在绵羊模型中的代表性结果。这种用于在贴壁细胞中大规模生产AAV载体的优化方案将使分子生物学实验室能够在更大的动物模型中推进其新型AAV疗法的测试。
引言
利用腺相关病毒(AAV)载体的基因治疗在过去三十年中取得了巨大的进步1,2。在各种遗传疾病(包括先天性失明,血友病以及肌肉骨骼和中枢神经系统疾病)中表现出的改善,使AAV基因治疗成为临床研究的前沿3,4。2012年,欧洲药品管理局(EMA)批准了Glybera,一种表达脂蛋白脂肪酶(LPL)的AAV1载体,用于治疗LPL缺乏症,使其成为欧洲或美国基因治疗的首个上市授权5。从那时起,另外两种AAV基因疗法Luxturna6和Zolgensma7已获得FDA批准,预计到2025年,市场将迅速扩大,预计到2025年将有多达10-20种基因疗法8。现有的临床数据表明,AAV基因治疗是一种安全、耐受性良好且有效的方法,使其成为最有前途的病毒载体之一,超过244项涉及AAV的临床试验已 ClinicalTrials.gov 注册。对涉及AAV载体的临床应用的兴趣日益增加,需要强大且可扩展的生产方法来促进大型动物模型中AAV疗法的评估,因为这是转化管道中的关键步骤9。
对于AAV载体生产,两个主要要求是AAV基因组和衣壳。野生型(wt)-AAV的基因组是单链DNA,长度约为4.7 kb10。wt-AAV基因组包括在基因组两端发现的倒置末端重复序列(ITR),这对包装很重要,并且rep和cap基因11。基因组复制,病毒衣壳组装以及将基因组封装到病毒衣壳中所必需的rep和cap基因从病毒基因组中移除并以反式形式提供用于AAV载体生产12。从病毒基因组中去除这些基因为治疗性转基因和所有必要的调节元件(包括启动子和polyA信号)提供了空间。ITR保留在载体基因组中,以确保适当的基因组复制和病毒封装13,14。为了改善转基因表达的动力学,可以将AAV载体基因组设计为自互补,这减轻了AAV基因组复制期间从单链DNA转换到双链DNA转换的需求,但将编码能力降低到〜2.4 kb15。
除了AAV基因组设计之外,衣壳血清型选择还决定了体内AAV载体2的组织和细胞向性。除了组织向性外,不同的AAV血清型已被证明可以显示不同的基因表达动力学16。例如,Zincarelli等人17将不同的AAV血清型分为低表达血清型(AAV2,3,4,5),中等表达血清型(AAV1,6,8)和高表达血清型(AAV7和9)。他们还将AAV血清型分为慢发表达(AAV2,3,4,5)或快速发作表达(AAV1,6,7,8和9)。这些不同的趋向性和基因表达动力学是由于衣壳蛋白中的氨基酸变异,衣壳蛋白的形成以及与宿主细胞受体/共受体的相互作用18。一些AAV衣壳具有额外的有益特征,例如在血管内给药(AAV9)后穿过血脑屏障的能力或驻留在长寿的肌肉细胞中以持久转基因表达(AAV6,6.2FF,8和9)19,20。
本文旨在详细介绍一种生产高纯度、高滴度、研究级AAV载体的具有成本效益的方法,用于临床前大型动物模型。使用该协议生产AAV是使用双质粒转染到在细胞堆叠中生长的贴壁人胚胎肾(HEK)293细胞来实现的。此外,该研究描述了硫酸肝素亲和色谱纯化的方案,可用于含有肝素结合结构域的AAV血清型,包括AAV2,3,6,6.2FF,13和DJ21,22。
许多包装系统可用于生产AAV载体。其中,使用双质粒共转染系统,其中Rep和Cap基因以及Ad辅助基因(E1A,E1B55K,E2A,E4orf6和VA RNA)包含在一个质粒(pHelper)中,与常见的三质粒(三重)转染方法相比具有一些实际优势,包括降低质粒生产成本23,24.含有转基因表达盒(pTransgene)的AAV基因组质粒必须由ITR两侧放置,并且长度不得超过约4.7 kb。由于转染过程中潜在的细胞毒性作用,载体滴度和纯度可能受到转基因的影响。本文描述了载体纯度的评估。在小鼠,仓鼠和绵羊动物模型中评估使用该方法生产的载体,每个载体产生1 x10 13 vg / mL。
表1:所需溶液的组成。整个协议中各种解决方案所需组件的必要信息,包括百分比和体积。 请点击此处下载此表格。
研究方案
1. 细胞堆中HEK293细胞的双质粒转染
- 在设置为37°C的珠浴中解冻HEK293细胞的冷冻小瓶。
注意:在电芯解冻时将完整的DMEM预热至37°C,以确保电镀时冷温不会冲击电芯。确保细胞具有较低的传代数,理想情况下小于20,以确保最佳生长和转染效率。确保细胞被认证为无支原体。 - 将冷冻小瓶的内容物滴入含有10 mL预热完全DMEM的15 mL锥形管中,并以500×g离心细胞5分钟。
- 吸出培养基,然后将HEK293细胞重悬于20 mL预热的完全DMEM中。将细胞接种在15厘米的板中,并在37°C下孵育,其中5%CO2。
- 将细胞从一个15厘米的板中分成三个,以便在细胞培养室中接种。
- 一旦细胞汇合80%,吸出培养基并用3mL PBS轻轻洗涤板,以免破坏单层。然后,抽吸PBS并加入3 mL胰蛋白酶。
- 在37°C下孵育2分钟,直到细胞从板中抬起,然后通过向板中加入7mL完整的DMEM来中和胰蛋白酶。
- 将所有培养基和细胞收集到15mL管中,并通过以500×g离心5分钟来沉淀细胞。
- 从15mL管中吸出上清液,并将细胞沉淀重悬于3mL完全DMEM中。向含有20毫升完整DMEM的每个15厘米板中加入1毫升;轻轻摇动板以均匀分布细胞,并在37°C下孵育,CO为5%2。
- 一旦细胞汇合80%,重复步骤1.4.1和1.4.2。将上清液收集在50mL锥形管中,并轻轻倒置管以确保细胞均匀。
- 通过将10μL细胞样品与10μL台盼蓝混合并将混合物加入细胞计数载玻片中以在细胞计数器中进行分析来确定细胞密度。
- 将1L预热的完整DMEM与所需的细胞悬浮液混合,以接种1 x 104个细胞/ cm2的细胞(表面积为6360 cm2)。将细胞混合物倒入细胞培养室并轻轻旋转以将细胞均匀分布在每个单层上(图1),并在37°C下孵育,CO为5%2。
- 除细胞培养室外,还用1 x 104 个细胞/ cm2 的15cm板作为汇合的参考。
- 孵育约65小时后,检查参比板的汇合度 - 理想情况下约为80%-90%汇合。
注意:预热完整的DMEM,用于在37°C下加入细胞培养室。
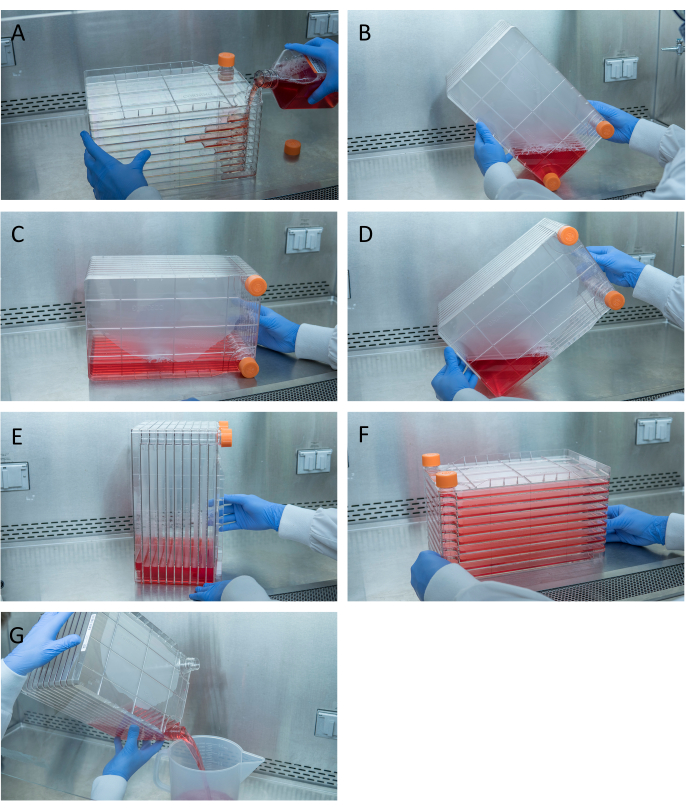
图1:细胞堆的操纵,用于细胞接种和转染。对于接种细胞堆栈,首先取下其中一个通风盖,然后倒入1升预热的完整DMEM,并加入所需数量的HEK293电池(A)。通过拧紧两个通风口盖均匀分布细胞和培养基,并将所有介质带到具有其中一个通风盖的细胞堆的角落并将其放置在该角(B)中,将细胞堆叠放在其侧面(C),然后将电池堆旋转90°(D),使通风口向上(E)。轻轻地将细胞堆降低到其正常的水平位置,并确保细胞堆叠的所有腔室都完全被介质(F)覆盖。转染时,拧下两个通风口盖,然后缓慢地将旧培养基倒入废物无菌废物容器中,以使流动均匀,以免干扰细胞的单层(G)。请点击此处查看此图的放大版本。
- 以3:1(w/ w)的浓度比制备聚乙烯亚胺(PEI)/DNA混合物。
- 通过将475μgpTrangene和1425μgpHelper加入40mL还原血清培养基中,在50mL锥形管中制备DNA混合物,以产生3:1比例的pHelper:pTrangene。
注:PEI/DNA混合计算器可使用 表2找到。 - 滴加5.7 mL PEI(1g / L)到还原血清培养基和DNA混合物中。然后,短暂涡旋并在室温下孵育10分钟。
注意:当PEI / DNA在室温下孵育时,它会变得略微浑浊。
- 通过将475μgpTrangene和1425μgpHelper加入40mL还原血清培养基中,在50mL锥形管中制备DNA混合物,以产生3:1比例的pHelper:pTrangene。
- PEI / DNA孵育8分钟后,从细胞培养室中取出培养基。
注意:确保松开两个橙色盖子,以保持培养基的顺畅流动,以避免细胞脱落。 - 将PEI / DNA加入1L预热的完整DMEM中,并将混合物缓慢倒入细胞培养室端口。将液体均匀地分布到所有行(图1),并在37°C下孵育72小时,CO为2。
2 收获转染HEK293细胞的AAV和化学裂解
- 用力摇动细胞培养室以移走细胞,直到培养基从移出的细胞中变浑浊,然后倒入四个500 mL离心管中。
- 在4°C下以18,000×g离心管30分钟以沉淀细胞。将澄清的上清液倒入1L聚对苯二甲酸乙二醇酯共聚酯(PETG)瓶中。
注意:如果无法使用高速离心机,请以12,000×g离心40分钟。 在这个速度下,沉淀的细胞可能不是固体,并且会随着倒出的上清液而滑动。 - 将细胞沉淀重悬于500mL离心管中,加入50mL裂解缓冲液,并在37°C下孵育60分钟。
- 将管以18,000×g离心30分钟,然后将上清液转移到相同的1 L PETG瓶中。丢弃颗粒状细胞碎片。
注意:立即纯化澄清的上清液,并在4°C下储存长达72小时。对于长期储存,储存在-80°C。 不要储存在-20°C。
3 AAV载体纯化使用肝素亲和色谱
- 从-80°C除去粗裂解物,并在4°C下过夜解冻。解冻后,使用0.22μM过滤器过滤粗裂解物。
- 要钝化离心浓缩器,对于所使用的每个肝素琼脂糖柱,向离心浓缩器中加入4mL过滤预处理缓冲液。在室温下钝化离心浓缩器2-8小时。在纯化步骤之前立即设置钝化。
- 设置管道和泵(图2)。
- 将管道置于蠕动泵中,运行 20 mL 1 M NaOH。接下来,运行50 mL分子级水,然后运行50 mL基础DMEM。
- 将 5 mL 肝素琼脂糖柱连接到导管上,并运行 25 mL 基础 DMEM 以除去防腐剂。
- 以1-2滴/秒的流速在色谱柱中运行0.2μM过滤的粗裂解物。

图2:为AAV纯化蠕动泵设置。 将管道从粗裂解物中流出,通过蠕动泵,进入肝素基质柱。 请点击此处查看此图的放大版本。
注意:确保不要引入气泡或让色谱柱干涸,因为这会损害色谱柱并防止AAV洗脱。如果色谱柱干涸,则丢弃色谱柱,并对剩余的粗裂解物使用新色谱柱。
- 将所有粗裂解物加载到肝素柱上,并使用以下溶液洗涤柱。
- 使用 50 mL 不含 Mg2+ 和 Ca2+的 1x Hank's 平衡盐溶液 (HBSS) 洗涤。
- 使用15毫升0.5%N-月桂酰肌氨酸在HBSS中洗涤,不含Mg2 +和Ca2 +。
- 使用50毫升不含镁2 +和钙2+的HBSS洗涤。
- 使用 50 mL HBSS 与 Mg2+和 Ca2+洗涤
- 使用50毫升200 mM NaCl / HBSS与Mg2 +和Ca2 +洗涤。
- 洗脱 5 x 5 mL(总共 25 mL),加入 300 mM NaCl/HBSS,Mg2+ 和 Ca2+, 并将洗脱物标记为 E1-E5(每次洗脱为 5 mL)。
- 使用离心浓缩器浓缩病毒
- 将含有预处理缓冲液的离心浓缩器以900×g旋转2分钟。 丢弃流出。
- 用4 mL HBSS与Mg2 +和Ca 2+洗涤离心浓缩器过滤器,并以1000×g离心2分钟; 丢弃流出。
- 将洗脱液E2加入离心浓缩器中。以1000 x g 旋转 5 分钟,丢弃流出物。
- 完成加入E2,然后将E3加入离心浓缩器中,以1000×g旋转5分钟,直到浓缩的病毒约为1mL。
注意:避免离心载体,使体积低于过滤器的水平。不要在离心浓缩器中浓缩E1,E4或E5,因为它们含有很少或没有载体并且含有污染物。 - 使用p200过滤的尖端从离心浓缩器中取出浓缩的病毒,并将其放入无菌的1.5mL离心管中。
- 用200μLHBSS冲洗离心浓缩器,其中Mg2 + 和Ca2 + 以从过滤器中除去任何剩余的AAV。多次用力上下移液(约30秒)以移走粘附在膜上的任何病毒,并将剩余的病毒置于1.5mL离心管中。将管子混合均匀。
- 等分试样5μL用于DNA提取,并将纯化的载体储存在-80°C。
- 使用25 mL的2 M NaCl洗涤色谱柱。此外,使用25毫升0.1%Triton X-100,预热至37°C洗涤色谱柱。接下来,使用50mL无菌dH2O洗涤色谱柱,然后使用25mL 20%乙醇洗涤。
- 确保柱膜在20%乙醇中完全饱和,因为这是储存溶液。用提供的塞子密封色谱柱,并储存在4°C。
- 将管子存放在 1 M NaOH 中。
注意:如果清洁得当,肝素琼脂糖柱可以重复使用多达五次。
4 AAV 基因组 DNA 提取
- 在PCR管中制备 表3 中提到的反应混合物以进行DNA酶处理。
| 元件 | 卷 |
| 纯化的 AAV 载体 | 5 μL |
| 10x 脱氧核酸酶缓冲液 | 2 μL |
| 脱氧核糖核酸酶 | 1 μL |
| ddH2O | 12 μL |
| 最终卷 | 20 μL |
表3:脱氧核糖核酸酶处理预混液配方。 DNA提取期间DNase处理AAV病毒载体所需的推荐成分和体积。
- 涡旋PCR管以混合和脉冲PCR管以旋转内容物。
- 使用热循环器,在37°C下孵育20分钟,然后在75°C下孵育15分钟以加热灭活DNA酶。
- 加入5μL蛋白酶K。
- 使用热循环器,在50°C下孵育60分钟,然后在95°C下孵育30分钟以加热灭活蛋白酶K。
- 使用DNA净化试剂盒去除潜在的污染物。
注意:此步骤是使用市售的血液和组织清洁试剂盒(材料表)进行的。- 将200μLAL缓冲液(血液和组织清洁试剂盒, 材料表)加入含有DNA酶/蛋白酶K处理载体的PCR管中。
- 涡旋PCR管并在热循环仪中在56°C下孵育10分钟。
- 将液体从PCR管移入位于收集管中的无菌旋转柱中。
- 向色谱柱中加入200μL100%乙醇,并通过涡旋彻底混合。
- 以6,000×g离心1分钟,丢弃流经。
- 将500μL缓冲液AW1(血液和组织清洁试剂盒, 材料表)加入离心柱中。
- 以6,000×g离心1分钟,丢弃流经。
- 将500μL缓冲液AW2(血液和组织清洁试剂盒, 材料表)加入离心柱中。
- 以15,000×g离心3分钟,丢弃流经。
- 将离心柱放入无菌的1.5mL离心管中,并将200μL缓冲液AE(血液和组织清洁试剂盒, 材料表)直接加入离心柱膜中。
- 在室温下孵育1分钟。
- 以6,000×g离心1分钟以洗脱DNA。
- 将DNA储存在-20°C。
5 使用定量聚合酶链反应和猿猴病毒 40 (SV40) 探针滴定 AAV 载体基因组
注:使用过滤的移液器吸头在PCR抽油烟机中执行所有qPCR工作,以避免外部DNA污染。如果AAV基因组不编码SV40 polyA序列,请使用探针来对抗其他地方描述的ITR 25。确保选择作为标准品的质粒DNA含有SV40多A序列。
- 浆料标准品制备
- 将储备质粒DNA标准品(含有SV40 polyA序列的p转基因质粒)稀释至10μg/ μL的最终浓度,并在-20°C下储存在6μL等分试样中。
- 使用以下在线计算器26确定质粒DNA标准品中存在的拷贝数。
注:使用商业供应商生产的用于标准品的质粒DNA,以确保质量和正确的浓度。准备大量标准品(例如,10 mL),以便在过渡到新制备的标准品时进行桥接研究。
- 在1.5mL离心管中为样品和标准品制备 表4 中提到的以下试剂混合物。
注意:准备足够的预混液超量。引物/探针序列见表5。
| 元件 | 卷 |
| 通用 qPCR 预混液 (2X) | 10 μL |
| 分子级水 | 4.5 μL |
| 40x SV40 多晶硅底漆/探头 | 0.5 μL |
| 最终卷 | 15 μL |
表4:用于AAV滴定的qPCR预混液。从AAV病毒载体中提取的DNA的qPCR所需的推荐成分和体积。
| 元件 | 序列 |
| 正向底漆 | 5'-AGCAATAGCATCACAAATTTCACAA-3' |
| 反向底漆 | 5'-CCAGACATGATAAGATACATTGAGTT-3' |
| 探针 | /56-FAM/AGCATTTTT/Zen/TTCACTGCATTAGTTGTGGTTTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGTGT |
表5:针对SV40多A DNA序列的引物序列。 用于 qPCR 滴定的引物和探针的序列,它们与含有 SV40 polyA 序列的 AAV 病毒载体的特定区域结合。
- 上下移取预混液进行混合。
- 设置稀释板。
- 使用透明的96孔板制备标准品和样品稀释液,从柱1(柱1,3,5,7,9和11)开始,在每隔一个色谱柱中向每个孔中加入45μL分子级水。
- 将5μL标准品加入孔A1中,移液器混合。
- 使用新的过滤移液器吸头,从孔A1到B1产生1/10的稀释度。
- 继续沿着色谱柱进行一系列10倍的稀释,直到达到G1。
- 不要添加到H1,因为这将作为阴性对照。
- 通过将第一个样品(S1)添加到孔A3中,形成1/10稀释液,将其施加。移取该混合物并将5μL转移到孔B3中。转移后丢弃移液器吸头。
- 使用新的移液器吸头,将溶液在孔B3中混合并形成1/100稀释液。将5μLof该混合物转移到孔C3中,并在转移后丢弃尖端。
- 使用新的移液器吸头,在C3孔中上下移取溶液以产生1/1000稀释液。丢弃吸头。
- 继续稀释样品,不向柱2、4、6、8、10或12添加任何样品。
- 稀释所有样品后,将内容物混合在1柱的孔中,然后将20μL转移到柱2中。
- 对色谱柱 3、5、7、9 和 11 重复此操作,以创建每个标准品和样品稀释的重复项。有关板布局,请参阅图 3。
注:当遵循 图3中的板设置时,在G行和H行中稀释的样品将只有1/10和1/100稀释。
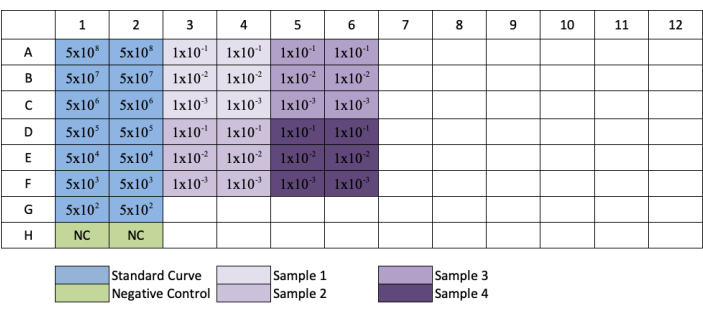
图3:qPCR AAV滴定的板布局。 蓝色表示标准品的连续稀释位置;绿色表示阴性对照的位置;紫色表示样品稀释的位置。每个标准品、阴性或样品均以重复方式添加。添加了标准品浓度的示例以显示标准的稀释系列,并将样品稀释液的位置添加到其各自的孔中。 请点击此处查看此图的放大版本。
- 通过基于 SV40 多聚A 检测的 qPCR 进行滴定
- 向白半裙边96孔qPCR板的每个孔中加入15μL qPCR预混液。
- 将5μL每个样品从透明的96孔板转移到白色半裙边96孔qPCR板。
- 使用多通道移液器确保qPCR预混液和样品充分混合。
- 用密封膜密封板,并将qPCR板以1500×g离心30秒。
- 在基于板的实时荧光定量PCR扩增和检测仪器上运行qPCR反应,使用 表6中的建议条件。
| 部分 | 周期 | 时间 | 温度 | 描述 |
| 预孵化 | 1 倍 | 5 分 | 95 °C | DNA变性。 |
| 放大 | 38 倍 | 15 秒 | 95 °C | DNA的扩增。如果使用具有不同退火温度的替代引物,则可以修改设置。 |
| 60 秒 | 60 °C | |||
| 冷却 | 1 倍 | 60 秒 | 40 °C | 板冷却。运行结束。 |
表6:基于水解探针的qPCR滴定的热循环仪方案。 推荐的热循环仪方案用于使用基于探针的qPCR滴定提取的DNA纯化的AAV载体。
注:对于qPCR AAV滴定工作表,请参见表7。
- 数据分析以确定AAV基因组拷贝数。
- 在电子表格数据单元(表7A)中填写从qPCR运行中获得的标准液和样品稀释液的浓度值。
- 使用表7A中的浓度值生成标准曲线(表7B)。
注:标准曲线将与 R2效率一起显示为自然对数(y = a ln(x) + b)。标准曲线的效率必须接近 100%,R2必须接近 1.0 (≥0.99)。 - 通过填写此在线计算器27来填充斜率效率。
注意:90%-110%之间的效率是可以接受的。如果 qPCR 的效率超出此范围,请重新运行 qPCR。 - 使用表7A中的浓度值来平均每个样品的稀释度并确定每个样品的标准偏差(表7C)。
注:排除与样品稀释平均值相差超过一个标准差的样品中的稀释液。 - 使用每次稀释的平均浓度,乘以稀释因子,然后除以5得到每个样品的载体基因组(vg)/ μL(表7C)。
- 通过将每个样品浓度的平均值乘以80,000来计算每个样品的vg / mL(表7C)。
- 平均每次稀释的vg / mL以产生每个样品的最终vg / mL(表7C)。
注意:用户必须将每种稀释液的平均浓度除以因子5,以解释每个孔中加载的5μL,用于qPCR运行以产生vg / μL的浓度。80,000的系数解释了从每个样品的平均浓度值到vg/mL的过渡。首先,每个样品浓度值的平均值必须乘以2才能解释单链基因组,因为引物探针集仅量化正感单链DNA(ssDNA),并且AAV基因组以阳性和负义ssDNA25,28之间的近似1:1比例存在。每个样品的浓度值的平均值必须乘以x40,以考虑样品稀释度从5μL纯化载体(第4.1节)到200μL提取的DNA(第4.6.12节)。最后,每个样品浓度值的平均值必须乘以x1000才能从vg/μL转换为vg/mL。
6 载体质量和纯度的评估
- 质量控制 - 蛋白质印迹
- 准备12%SDS PAGE凝胶。
- 进行聚丙烯酰胺凝胶电泳。
注意:每孔加载6 x10 10 vg样品。 - 将蛋白质转移到聚偏二氟乙烯(PVDF)膜上。
- 阻隔光伏自闭膜
- 从转印装置中取出膜,用0.1%PBST冲洗以除去松散的丙烯酰胺。
- 将膜置于封闭溶液中,在室温下或4°C下过夜至少1小时。
注意:封闭缓冲液可进一步补充2%山羊血清。
- 与一抗一抗一起孵育
- 倾析封闭缓冲液并加入一抗,抗AAV小鼠单克隆抗体以1:200稀释。
- 在4°C下孵育过夜。
- 倾析一抗,并在室温下搅拌用0.1%PBST洗涤5次5分钟。
- 与二抗一起孵育
- 倾析洗涤液并加入HRP偶联二抗,在封闭缓冲液中以1:7500稀释,并在室温下搅拌孵育1小时。
- 倾析二抗,并在室温下搅拌用0.1%PBST洗涤5次5分钟。
- 在室温下搅拌用PBS进行最终洗涤。
- 使用增强型化学发光(ECL)底物检测蛋白质。
- 对凝胶进行成像以可视化病毒蛋白(VP1,VP2和VP3亚基)(图4)。

图4:显示AAV衣壳蛋白的蛋白质印迹。 巷 A;MW梯子,B巷;AAV6.2FF-hIgG01, C巷;AAV6.2FF-hIgG02, D巷;AAV6.2FF-hIgG03和Lane E;AAV6.2FF-hIgG04. 6 x10 10 vg的每个AAV6.2FF-hIgG被加载到各自的通道中。 请点击此处查看此图的放大版本。
- 纯度控制 - SDS PAGE 和考马斯染色
- 按照步骤6.1.1和6.1.2中所述制备SDS-PAGE凝胶和样品。
- 将凝胶固定在固定溶液中1小时或过夜,轻轻搅拌。在第一个小时内更改一次固定解决方案。
- 在染色溶液中染色凝胶2-4小时,轻轻搅拌。
- 用脱色溶液脱色凝胶。多次补充脱色溶液,直到凝胶的背景完全脱色(4-24小时)。
- 将去污的凝胶储存在储存溶液中。
- 对凝胶进行成像,以可视化由考马斯染色溶液染色的所有蛋白质。
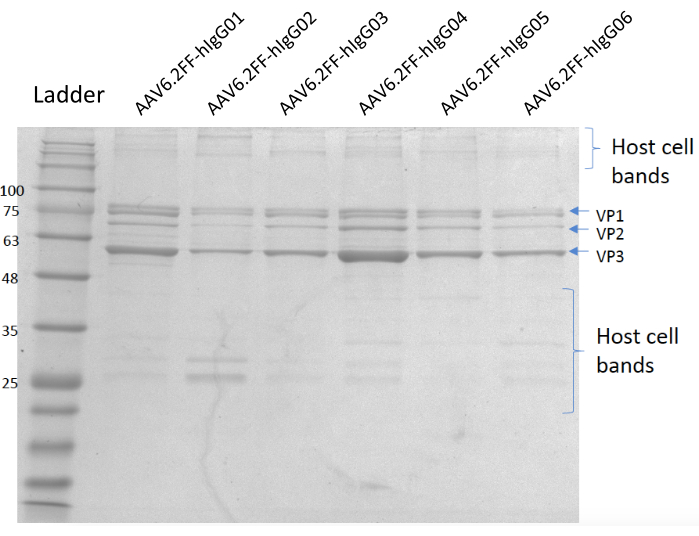
图5:考马斯染色的凝胶。 巷 A;MW梯子,B巷;AAV6.2FF-hIgG01, C巷;AAV6.2FF-hIgG02, D巷;AAV6.2FF-hIgG03, 巷 E;AAV6.2FF-hIgG04, F巷;AAV6.2FF-hIgG05和Lane G;AAV6.2FF-hIgG06. 6 x10 10 VG 的每个 AAV6.2FF-hIgG 被加载到各自的通道中。 请点击此处查看此图的放大版本。
- 替代纯度控制检测法 - HEK293 宿主细胞蛋白检测 ELISA
- 根据制造商的说明,通过ELISA执行HEK293宿主细胞蛋白检测。
注意:对于纯化的rAAV样品,使用5 x 10-2 和1 x10 -3 的稀释液。一旦TMB被添加到孔中,就远离光线进行孵育。线性回归不能用于分析结果。 - 执行点对点分析、立方样条或四参数逻辑拟合方法,以插值未知物的浓度并乘以稀释因子以确定原始样品浓度。
- 根据制造商的说明,通过ELISA执行HEK293宿主细胞蛋白检测。
结果
从小型啮齿动物模型到大型动物模型的转换以及最终的临床应用提出了重大挑战,因为需要大量的AAV来转导大型动物并达到治疗效果。为了比较合理设计的AAV6.2FF衣壳的转导效率,先前证明与AAV63相比,小鼠肌细胞的转导效率提高了101倍,小鼠,仓鼠和羔羊都给予AAV6.2FF表达人单克隆抗体(hIgG)。AAV6.2FF-hIgG表达载体含有CASI启动子4、伍德查克肝炎病毒转录后调节...
讨论
本文中描述的重组AAV(rAAV)载体的生产使用大多数分子生物学研究实验室和设施中发现的常见材料,试剂和设备。该论文允许阅读器产生高质量的 体外 和 体内 级rAAV。最重要的是,与涉及氯化铯纯化的更繁琐的方案相比,这种用于rAAV生产的方案是有效的,并且避免了使用超速离心。一旦HEK293细胞被转染,纯化的AAV就可以在5个工作日内使用。
在rAAV生产和纯化?...
披露声明
Sarah K. Wootton是美国专利US10806802B2的发明人,用于AAV6.2FF衣壳。
致谢
Amira D. Rghei,Brenna A. Y. Stevens,Sylvia P. Thomas和Jacob G. E. Yates是安大略省兽医学院学生津贴以及安大略省研究生奖学金的获得者。Amira D. Rghei是Mitacs Accelerate Studentship的获得者。这项工作由加拿大卫生研究院(CIHR)项目赠款(#66009)和SKW的合作健康研究项目(NSERC合作)赠款(#433339)资助。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore Sigma | S2GPU05RE | |
| 0.25% Trypsin | Fisher Scientific | SM2001C | |
| 1-Butanol | Thermo Fisher Scientific | A399-4 | CAUTION. Use under a laminar flow hood. Wear gloves |
| 10 chamber cellstack | Corning | 3271 | |
| 1L PETG bottle | Thermo Fisher Scientific | 2019-1000 | |
| 30% Acrylamide/Bis Solution | Bio-Rad | 1610158 | |
| 96-well skirted plate | FroggaBio | FS-96 | |
| Adhesive plate seals | Thermo Fisher Scientific | 08-408-240 | |
| Ammonium persulfate (APS) | Bio-Rad | 161-0700 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Blood and Tissue Clean up Kit | Qiagen | 69506 | Use for DNA clean up in section 4.6 of protocol |
| Bromophenol blue | Fisher Scientific | B392-5 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Cell Culture Dishes | Greiner bio-one | 7000232 | 15 cm plates |
| Culture Conical Tube | Thermo Fisher Scientific | 339650 | 15 mL conical tube |
| Culture Conical Tube | Fisher Scientific | 14955240 | 50 mL conical tube |
| Dulbecco's Modified Eagle Medium (DMEM) with 1000 mg/L D-glucose, L-glutamine | Cytiva Life Sciences | SH30022.01 | |
| ECL Western Blotting Substrate | Thermo Fisher Scientific | 32209 | |
| Ethanol | Greenfield | P016EA95 | Dilute ethyl alcohol(95% vol) to 20% for section 3.7.4 and 70% for section 6.1.1.1 |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | SH30396.03 | |
| Glacial acetic acid | Fisher Scientific | A38-500 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Glycerol | Fisher Scientific | BP229-1 | |
| Glycine | Fisher Scientific | BP381-500 | |
| HBSS with Mg2+ and Ca2+ | Thermo Fisher Scientific | SH302268.02 | |
| HBSS without Mg2+ and Ca2+ | Thermo Fisher Scientific | SH30588.02 | |
| HEK293 cells | American Tissue Culture Collection | CRL-1573 | Upon receipt, thaw the cells and culture as described in manufacturer’s protocol. Once cells have been minimally passaged and are growing well, freeze a subfraction for future in aliquots and store in liquid nitrogen. Always use cells below passage number 30. Once cultured cells have been passaged more than 30 times, it is recommended to restart a culture from the stored aliquots |
| HEK293 host cell protein ELISA kit | Cygnus Technologies | F650S | Follow manufacturer’s instructions |
| Heparin sulfate column | Cytiva Life Sciences | 17040703 | |
| Kimwipe | Thermo Fisher Scientific | KC34120 | |
| L-glutamine (200 mM) | Thermo Fisher Scientific | SH30034.02 | |
| Large Volume Centrifuge Tube Support Cushion | Corning | CLS431124 | Support cushion must be used with large volume centrifuge tubes uless the centrifuge rotor has the approriate V-bottom cushions |
| Large Volume Centrifuge Tubes | Corning | CLS431123-6EA | 500 mL centrifuge tubes |
| MgCl2 | Thermo Fisher Scientific | 7791-18-6 | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | 1.5 mL microcentrifuge tube, sterilize prior to use |
| Molecular Grade Water | Cytiva Life Sciences | SH30538.03 | |
| N-Lauroylsarcosine sodium salt | Sigma Aldrich | L5125 | CAUTION. Wear gloves |
| NaCl | Thermo Fisher Scientific | BP35810 | |
| Optimem, reduced serum medium | Thermo Fisher Scientific | 31985070 | |
| Pasteur pipets | Fisher Scientific | 13-678-20D | Sterilize prior to use |
| PBS (10x) | Thermo Fisher Scientific | 70011044 | Dilute to 1x for use on cells |
| Penicillin-Streptomycin Solution | Cytiva Life Sciences | SV30010 | |
| pHelper plasmid | De novo design or obtained from plasmid repository | NA | |
| Pipet basin | Thermo Fisher Scientific | 13-681-502 | Purchase sterile pipet basins |
| Polyethylene glycol tert-octylphenyl ether (Triton X-100) | Thermo Fisher Scientific | 9002-93-1 | CAUTION. Wear gloves |
| Polyethylenimine (PEI) | Polyscience | 24765-1 | Follow manufacturer’s instructions to produce a 1L solution. 0.22μm filter and store at 4°C |
| Polypropylene semi-skirted PCR Plate | FroggaBio | WS-96 | |
| Polysorbate 20 (Tween 20) | Thermo Fisher Scientific | BP337-100 | CAUTION. Wear gloves |
| polyvinylidene difluoride (PVDF) membrane | Cytiva Life Sciences | 10600023 | Use forceps to manipulate. Wear gloves. |
| Primary antibody | Progen | 65158 | |
| Protein Ladder | FroggaBio | PM008-0500 | |
| Proteinase K | Thermo Fisher Scientific | AM2546 | |
| pTrangene plasmid | De novo design or obtained from plasmid repository | NA | Must contain SV40 polyA in genome to be compatible with AAV titration in section 5.0 |
| Pump tubing | Cole-Parmer | RK-96440-14 | Optimize length of tubing and containment of virus in fractions E1-E5 |
| RQ1 Dnase 10 Reaction Buffer | Promega | M6101 | Use at 10x concentration in protocol from section 4.0 |
| RQ1 Rnase-free Dnase | Promega | M6101 | |
| Sample dilutent | Cygnus Technologies | I700 | Must be purchased separately for use with HEK293 host cell protein ELISA kit |
| Secondary antibody, HRP | Thermo Fisher Scientific | G-21040 | |
| Skim milk powder | Oxoid | LP0033B | |
| Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 28312 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | SS266-4 | |
| SV40 polyA primer probe | IDT | Use sequence in Table X for quote from IDT for synthesis | |
| Tetramethylethylenediamine (TEMED) | Thermo Fisher Scientific | 15524010 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypan blue | Bio-Rad | 1450021 | |
| Ultra-Filter | Millipore Sigma | UFC810024 | Ultra-4 Centrifugal 10K device must be used, as it has a 10000 molecular weight cutoff |
| Universal Nuclease for cell lysis | Thermo Fisher Scientific | 88702 | |
| Universal qPCR master mix | NEB | M3003L | |
| Whatman Paper | Millipore Sigma | WHA1001325 | |
| β-mercaptoethanol | Fisher Scientific | 21985023 | CAUTION. Use under a laminar flow hood. Wear gloves |
| CAUTION: Refer to the Materials Table for guidelines on the use of dangerous chemicals. |
参考文献
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: A golden anniversary of discovery, research, and gene therapy success-a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Nathwani, A. C., et al. Long-term safety and efficacy of factor IX gene therapy in hemophilia B. The New England Journal of Medicine. 371 (21), 1994-2004 (2014).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Ylä-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (10), 1831-1832 (2012).
- FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-novel-gene-therapy-treat-patients-rare-form-inherited-vision-loss (2020)
- FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease (2020)
- Statement from FDA Commissioner Scott Gottlieb, MD and Peter Marks, MD Ph.D., Director of the Center for Biologics Evaluation and Research on new policies to advance development of safe and effective cell and gene therapies. FDA Available from: https://www.fda.gov/news-events/press-announcements/statement-fda-commissioner-scott-gottlieb-md-and-peter-marks-md-phd-director-center-biologics (2020)
- Asokan, A., Schaffer, D. V., Samulski, R. J. The AAV vector toolkit: poised at the clinical crossroads. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (4), 699-708 (2012).
- Rose, J. A., Hoggan, M. D., Shatkin, A. J. Nucleic acid from an adeno-associated virus: chemical and physical studies. Proceedings of the National Academy of Sciences of the United States of America. 56 (1), 86-92 (1966).
- Lusby, E., Fife, K. H., Berns, K. I. Nucleotide sequence of the inverted terminal repetition in adeno-associated virus DNA. Journal of Virology. 34 (2), 402-409 (1980).
- Masat, E., Pavani, G., Mingozzi, F. Humoral immunity to AAV vectors in gene therapy: challenges and potential solutions. Discovery Medicine. 15 (85), 379-389 (2013).
- Ling, C. Enhanced Transgene Expression from Recombinant Single-Stranded D-Sequence-Substituted Adeno-Associated Virus Vectors in Human Cell Lines In Vitro and in Murine Hepatocytes In Vivo. Journal of Virology. 89 (2), 952-961 (2014).
- Cathomen, T., Stracker, T. H., Gilbert, L. B., Weitzman, M. D. A genetic screen identifies a cellular regulator of adeno-associated virus. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 14991-14996 (2001).
- McCarty, D. M. Self-complementary AAV vectors; advances and applications. Molecular Therapy. 16 (10), 1648-1656 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of aav serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PLOS One. 8 (9), 76310 (2013).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Pillay, S., et al. Adeno-associated virus (AAV) serotypes have distinctive interactions with domains of the cellular AAV receptor. Journal of Virology. 91 (18), (2017).
- Merkel, S. F. Trafficking of adeno-associated virus vectors across a model of the blood-brain barrier; a comparative study of transcytosis and transduction using primary human brain endothelial cells. Journal of Neurochemistry. 140 (2), 216-230 (2017).
- van Lieshout, L. P., et al. A novel triple-mutant AAV6 capsid induces rapid and potent transgene expression in the muscle and respiratory tract of mice. Molecular Therapy. Methods & Clinical Development. 9, 323-329 (2018).
- Wu, Z., Asokan, A., Grieger, J. C., Govindasamy, L., Agbandje-McKenna, M., Samulski, R. J. single amino acid changes can influence titer, heparin binding, and tissue tropism in different adeno-associated virus serotypes. Journal of Virology. 80 (22), 11393-11397 (2006).
- Liu, J., Moon, Y. -. A. Simple purification of adeno-associated virus-DJ for liver-specific gene expression. Yonsei Medical Journal. 57 (3), 790-794 (2016).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adeno-associated virus vectors. Human Gene Therapy. 9 (18), 2745-2760 (1998).
- Kimura, T., et al. Production of adeno-associated virus vectors for in vitro and in vivo applications. Scientific Reports. 9 (1), 13601 (2019).
- Aurnhammer, C., et al. Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences. Human Gene Therapy Methods. 23 (1), 18-28 (2012).
- . Paramyxoviridae: The viruses and their replication. Fields Virology Available from: https://www.scholars.northwestern.edu/en/publications/paramyxoviridae-the-viruses-and-their-replication (1996)
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Kaludov, N., Brown, K. E., Walters, R. W., Zabner, J., Chiorini, J. A. Adeno-associated virus serotype 4 (AAV4) and AAV5 Both require sialic acid binding for hemagglutination and efficient transduction but differ in sialic acid linkage specificity. Journal of Virology. 75 (15), 6884-6893 (2001).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Human Gene Therapy Methods. 26 (6), 228-242 (2015).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Frontiers in Microbiology. 10, 1570 (2019).
- Backovic, A., et al. Capsid protein expression and adeno-associated virus like particles assembly in Saccharomyces cerevisiae. Microbial Cell Factories. 11, 124 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。