JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
대형 동물 모델의 전임상 연구를 위한 세포 스택에 있는 아데노 관련 바이러스 벡터의 생산
요약
여기서 는 세포 스택 및 친화성 크로마토그래피 정제에서 자란 부착 된 HEK 293 세포를 사용하여 연구 급 AAV 벡터의 대규모 생산을위한 상세한 절차를 제공합니다. 이 프로토콜은 지속적으로 >1 x10 13 벡터 게놈/mL을 산출하여 대규모 동물 연구에 적합한 벡터 양을 제공합니다.
초록
Adeno 관련 바이러스 (AAV) 벡터는 인간을 위해 승인된 3개의 AAV 유전자 치료와 함께 가장 임상적으로 진보된 유전자 치료 벡터 중 하나입니다. AAV에 대한 새로운 응용 프로그램의 임상 발전은 개, 양 및 비인간 영장류를 포함한 더 큰 동물 모델로 마우스와 같은 작은 동물 모델에서 전환하는 것을 포함합니다. 더 큰 동물에 AAV를 투여의 한계 중 하나는 하이 티터 바이러스의 대량에 대한 요구 사항입니다. 서스펜션 세포 배양은 AAV 벡터 생산을 위한 확장 가능한 방법이지만, 장비(예를 들어, 생물반응기)가 있거나 이러한 방식으로 AAV를 생산하는 방법을 아는 연구실이 거의 없습니다. 더욱이, AAV 티터는 부착된 HEK293 세포에 비해 현탁액 HEK 293 세포에서 생산될 때 현저히 낮습니다. 여기에 설명된 셀 스택을 사용하여 다량의 하이티터 AAV를 생산하는 방법이다. AAV를 적발하기 위한 자세한 프로토콜과 벡터 순도 유효성을 검사하는 방법도 설명되어 있습니다. 마지막으로, 양 모델에서 AAV 매개 된 유전자 발현의 대표적인 결과가 제시된다. 부착 된 세포에서 AAV 벡터의 대규모 생산을위한이 최적화 된 프로토콜은 분자 생물학 실험실이 더 큰 동물 모델에서 새로운 AAV 치료의 테스트를 진행할 수 있게합니다.
서문
아데노 관련 바이러스(AAV) 벡터를 이용한 유전자 치료는 지난 3년간1,2에걸쳐 큰 진전을 이루었다. 선천성 실명, 혈우병, 근골격계 및 중추 신경계의 질병을 포함한 다양한 유전질환의 개선을 입증하여 임상 연구3,4의최전선에 AAV 유전자 요법을 도입했다. 2012년, 유럽의약품청(EMA)은 LPL 결핍 의 치료를 위해 지단백질 리파아제(LPL)를 발현하는 AAV1 벡터인 글리베라를 승인하여 유럽 또는 미국에서 유전자 치료 치료를 위한 최초의 마케팅 승인을5. 그 이후, 2개의 추가 AAV 유전자 치료, Luxturna6 및 Zolgensma7는FDA 승인을 수신하고, 시장은 2025년까지 예상되는 10-20의 유전자 치료로 향후 5년 동안 빨리 확장될 것으로 예상됩니다8. 사용 가능한 임상 데이터는 AAV 유전자 치료가 안전하고 잘 용납되며 효과적인 양식으로 가장 유망한 바이러스 벡터 중 하나이며 AAV가 ClinicalTrials.gov 등록한 244개 이상의 임상 시험이 있음을 나타냅니다. AAV 벡터를 포함하는 임상 응용에 대한 관심이 증가함에 따라 대형 동물 모델에서 AAV 치료법의 평가를 용이하게 하기 위해 견고하고 확장 가능한 생산 방법이 필요하며, 이는 번역 파이프라인9에서중요한 단계이기 때문이다.
AAV 벡터 생산을 위해, 두 가지 주요 요구 사항은 AAV 게놈과 캡시드입니다. 야생형(wt)-AAV의 게놈은 길이10에서약 4.7kb인 단일 좌초 DNA이다. wt-AAV 게놈은 게놈의 양끝에서 발견되는 반전된 말단 반복(ItR)을 포함하며, 이는 포장에 중요하며, 담당자 및 캡 유전자(11). 게놈 복제, 바이러스 캡슐화, 바이러스 캡슐화에 필요한 렙 및 캡 유전자는 바이러스 게놈으로부터 제거되고 AAV 벡터생산(12)을위한 트랜스에서 제공된다. 바이러스 게놈에서 이러한 유전자의 제거는 프로모터 및 polyA 신호를 포함하여 치료 간유전자 및 모든 필요한 규제 요소에 대한 공간을 제공합니다. ItR은 적절한 게놈 복제 및 바이러스 캡슐화를 보장하기 위해 벡터 게놈에 남아있다 13,14. 유전자 발현의 역학을 개선하기 위해 AAV 벡터 게놈은 자체 보완적으로 설계되어 AAV 게놈 복제 시 단일 가닥에서 이중 가닥 DNA 변환으로 변환할 필요성을 완화하지만 코딩 용량을 ~2.4 kb15로감소시킨다.
AAV 게놈 설계를 넘어, 캡시드 혈청형 선택은 생체 내 AAV 벡터의 조직 및 세포 트트로피를 결정한다. 조직 트락피즘 이외에, 상이한 AAV 혈청형은 다른 유전자 발현운동학(16)을표시하는 것으로 나타났다. 예를 들어, Zincarelli외. 17 낮은 발현 혈청형 (AAV2, 3, 4, 5), 적당 한 발현 혈청형 (AAV1, 6, 8), 및 높은 발현 혈청형 (AAV7 및 9)으로 상이한 AAV 혈청형을 분류하였다. 또한 AAV 혈청형을 느린 발병 식(AAV2, 3, 4, 5) 또는 급속 발병 식(AAV1, 6, 7, 8 및 9)으로 분류하였다. 이러한 발산 열대성 및 유전자 발현 운동학은 캡시드 단백질의 아미노산 변이, 캡시드 단백질 형성 및 숙주 세포 수용체/공동 수용체와의 상호작용(18)에기인한다. 일부 AAV 캡시드는 내트라바스 내투여(AAV9)에 이어 혈액-뇌 장벽을 넘거나 내구성이 뛰어난 유전자 발현(AAV6, 6.2FF, 8, 및 9)19,20을위한 장수 근육 세포에 상주하는 능력과 같은 추가적인 유익한특성을갖는다.
이 논문은 전임상 대형 동물 모델에 사용하기 위한 고순도, 하이티터, 연구급 AAV 벡터를 생산하는 비용 효율적인 방법을 자세히 설명하는 것을 목표로 합니다. 이 프로토콜을 사용하여 AAV의 생산은 세포 스택에서 자란 부착 된 인간 배아 신장 (HEK)293 세포로 이중 플라스미드 형광을 사용하여 달성된다. 더욱이, 연구는 AAV2, 3, 6, 6.2FF, 13 및 DJ21,22를포함하여 헤파린 결합 도메인을 포함하는 AAV 혈청형에 사용될 수 있는 헤파린 황산염 친화성 크로마토그래피 정제를 위한프로토콜을기술한다.
AAV 벡터의 생산에 사용할 수 있는 여러 패키징 시스템이 있습니다. 이 중, Rep 및 Cap 유전자 및 Ad 도우미 유전자(E1A, E1B55K, E2A, E4orf6 및 VA RNA)가 하나의 플라스미드(pHelper) 내에 포함되는 2-플라스미드 공동 형질 전환 시스템의 사용은 일반적인 3플라스미드(triple) 트랜스포메이션에 비해 몇 가지 실질적인 장점이있으며,23개의플라미드 생산 법, 비용 절감(triple) 트랜스포메이션 에 비해 몇 가지 실질적인 장점이 있다. . 유전자 발현 카세트(pTransgene)를 함유하는 AAV 게놈 플라스미드는 ItR에 의해 측면에 있어야 하며 길이가 ~4.7kb를 초과해서는 안 됩니다. 벡터 티터 및 순도는 형질 전환 시 잠재적인 세포독성 효과로 인해 트랜스진에 의해 영향을 받을 수 있다. 벡터 순도의 평가는 본원에 기재된다. 이 방법을 사용하여 생성된 벡터는 각각 1x10 13 vg/mL을 산출하며, 마우스, 햄스터 및 소 동물 모델에서 평가하였다.
표 1: 필요한 솔루션의 구성. 프로토콜 전체의 다양한 솔루션에 필요한 구성 요소의 백분율 및 볼륨을 포함한 필요한 정보입니다. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
프로토콜
1. 세포 스택에 HEK293 세포의 이중 플라스미드 형질
- 37°C에서 설정된 구슬 목욕에서 HEK293 세포의 저온병을 해동한다.
참고: 세포가 해동하는 동안 37°C로 완전 DMEM을 완전히 따뜻하게 하여 도금시 세포에 충격이 되지 않도록 합니다. 최적의 성장과 트랜스페션 효율을 보장하기 위해 세포가 20개 미만의 낮은 통로 수를 확보하도록 보장합니다. 세포가 마이코플라즈마가 없는 것으로 인증되었는지 확인합니다. - 저온 유리병의 내용을 10mL의 사전 따뜻하게 된 완전한 DMEM을 포함하는 15 mL 원판 튜브로 옮기고 5 분 동안 500 x g의 세포원심분리를 전달합니다.
- 미디어를 흡인한 다음, 사전 따뜻하게 된 완전한 DMEM의 20 mL에서 HEK293 세포를 재중단합니다. 세포를 15cm 플레이트로 시드하고 37°C에서 배양하고 5% CO2를 구사합니다.
- 세포 배양실에서 파종하기 위해 15cm 플레이트에서 세포를 3개로 나눕다.
- 일단 세포가 80% 컨실릭되면, 미디어를 흡인하고 단층층을 방해하지 않도록 PBS3mL로 접시를 부드럽게 씻으십시오. 그런 다음 PBS를 흡인하고 트립신 3 mL를 추가합니다.
- 세포가 플레이트에서 들어올 때까지 37°C에서 2분 동안 배양한 다음, 플레이트에 완전한 DMEM 7mL을 추가하여 트립신을 중화시한다.
- 모든 미디어와 세포를 15mL 튜브로 수집하고 5 분 동안 500 x g에서 원심 분리하여 세포를 펠릿하십시오.
- 15mL 튜브에서 상류체를 흡인하고 완전한 DMEM의 3mL에서 세포 펠릿을 재보냅니다. 완전한 DMEM의 20 mL를 포함하는 각 15cm 접시에 1mL를 추가; 부드럽게 세포를 균등하게 분배하기 위해 판을 흔들고, 37 °C에서 배양하고 5 % CO2로배양한다.
- 일단 세포가 80% 수렴되면, 1.4.1 및 1.4.2단계를 반복합니다. 50mL 원추형 튜브에서 상체관을 수집하고 튜브를 부드럽게 반전하여 세포가 균일하게 변합니다.
- 10μL의 트라이팬 블루를 셀 샘플의 10 μL을 혼합하고 세포 카운터에서 분석을 위해 셀 카운팅 슬라이드에 혼합물을 추가하여 세포 밀도를 결정합니다.
- 1 x 104 셀/cm2와세포 배양 챔버 (6360 cm2의표면적)를 종자하는 데 필요한 셀 현탁액과 미리 따뜻하게 된 완전한 DMEM 1 L을 혼합하십시오. 세포 혼합물을 세포 배양챔버에 붓고 부드럽게 회전하여 각 단층(도1)에걸쳐 세포를 균등하게 분배하고 37°C에서 배양하고 5% CO2로 배양한다.
- 세포 배양 챔버 이외에, 1x 104 세포/cm2를 가진 15cm 플레이트를 결합을 위한 참고 자료로 플레이트한다.
- ~65-h 인큐베이션에 이어, 참조 플레이트를 이상적으로 ~80%-90% 컨할수 있는지 확인하십시오.
참고: 37°C에서 세포 배양챔버에 첨가하기 위한 사전 웜 완전 DMEM.
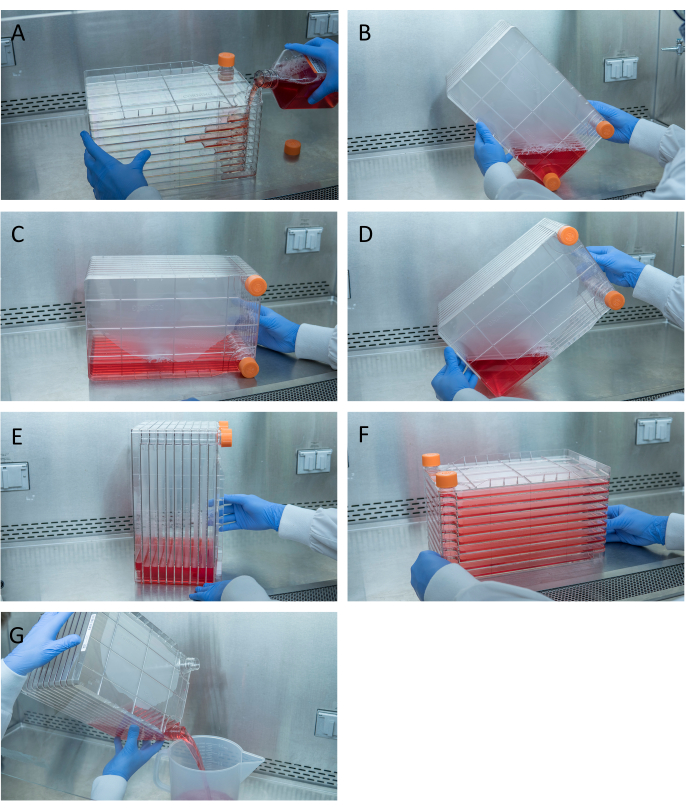
그림 1: 세포 종착 및 형질 에 대한 셀 스택의 기동. 파종 셀 스택의 경우, 통풍구 중 하나를 제거하고 HEK293 세포의 필요한 수량으로 미리 따뜻진 완전한DMEM의 1 L에 부어 서 시작하십시오(A). 벤트 캡을 모두 조이고 모든 미디어를 통풍구 캡으로 모서리에 가져와 서 그코너(B)에배치한 다음, 셀 스택을 그쪽(C)에놓고, 통풍구 포트가 위로되도록 셀 스택 90°(D)를 돌린다음 셀 스택을돌린다(E). 셀 스택을 정상 수평 위치로 부드럽게 낮추고 셀 스택의 모든 챔버가미디어(F)로완전히 덮여 있는지 확인합니다. 배분시, 통풍구를 모두 풀고 오래된 미디어를 천천히 폐기물 멸균 폐기물 용기에 부어 세포의단층(G)을방해하지 않도록 하는 흐름도 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 3:1(w/w)의 농도 비율로 폴리에틸렌네이민(PEI)/DNA 혼합물을 준비한다.
- pTrangene의 475 μg 및 1425 μg의 pHelper를 40 mL의 감소혈자 배지에 추가하여 50 mL 원추형 튜브에서 DNA 혼합물을 준비하여 pHelper:pTrangene의 3:1 비율을 생성합니다.
참고: PEI/DNA 혼합물 계산기는 표 2를사용하여 찾을 수 있다. - 감소된 혈청 배지및 DNA 혼합물에 PEI(1 g/L)의 5.7mL를 드롭방향으로 추가합니다. 그런 다음, 소용돌이를 잠깐 배양하고 실온에서 10 분 동안 배양합니다.
참고: PEI/DNA가 실온에서 배양되면서 약간 흐리게 됩니다.
- pTrangene의 475 μg 및 1425 μg의 pHelper를 40 mL의 감소혈자 배지에 추가하여 50 mL 원추형 튜브에서 DNA 혼합물을 준비하여 pHelper:pTrangene의 3:1 비율을 생성합니다.
- PEI/DNA 배양 8분 후 세포 배양실에서 미디어를 제거합니다.
참고: 세포의 파기를 피하기 위해 매끄러운 미디어 흐름을 유지하기 위해 두 주황색 캡을 모두 느슨하게 해야 합니다. - 미리 따뜻해지는 완전한 DMEM의 1 L에 PEI/DNA를 추가하고 천천히 세포 배양 챔버 포트에 혼합물을 붓습니다. 액체를 모든행(도 1)에고르게 분배하고 37°C에서 72h로 배양하고 5% CO2를사용합니다.
2 감염된 HEK293 세포의 AAV 및 화학 리시스 를 수확
- 세포 배양실을 힘차게 흔들어 서 세포가 빠진 세포에서 흐린 것처럼 보이고 4개의 500mL 원심분리기 튜브에 부어 넣을 때까지 세포를 빼냅니다.
- 4°C에서 30분 동안 18,000 x g의 튜브를 원심분리하여 세포를 펠릿합니다. 1 L 폴리에틸렌 테레프탈레이트 코폴리에스테르(PETG) 병에 정제된 상체를 붓습니다.
참고: 고속 원심분리기에 액세스할 수 없는 경우 원심분리기는 40분 동안 12,000 x g의 원심분리기를 제공합니다. 펠릿 세포는이 속도로 단단하지 않을 수 있으며 상체를 쏟아 붓는 것처럼 미끄러질 것입니다. - 500mL 원심분리기 튜브에서 셀 펠릿을 50mL의 리시스 버퍼로 재보중단하고 37°C에서 60분 동안 배양합니다.
- 30 분 동안 18,000 x g에서 튜브를 원심 분리 한 다음 동일한 1 L PETG 병으로 상퍼를 옮긴다. 펠렛 셀 파편을 버리십시오.
참고: 명확히 된 상체를 즉시 정화하고 최대 72 시간 동안 4 °C에 보관하십시오. 장기 보관을 위해 -80°C에 보관하십시오. -20 °C에 보관하지 마십시오.
3 헤파린 친화성 크로마토그래피를 사용하여 AAV 벡터 정제
- -80°C에서 원유 용액을 제거하고 해동하기 위해 하룻밤 사이에 4 °C로 둡니다. 해동되면 0.22 μM 필터를 사용하여 조잡한 용해를 필터링합니다.
- 원심 농축기를 전달하기 위해, 사용되는 각 헤파린 세파로즈 컬럼에 대해 원심 농축기에 4mL의 필터 전처리 버퍼를 추가한다. 2-8 시간 동안 실온에서 원심 농축기를 전달합니다. 정화 단계 바로 앞에 통과를 설정합니다.
- 튜브와 펌프를 설정(그림 2).
- 튜브를 연동 펌프에 놓고 1 M NaOH의 20mL를 실행합니다. 다음으로, 분자 등급 의 물 50 mL을 실행하고 기초 DMEM의 50 mL을 실행합니다.
- 튜브에 5mL 헤파린 세파로즈 컬럼을 부착하고 방부제를 제거하기 위해 25mL의 기초 DMEM을 실행합니다.
- 1-2 방울 /s의 유량으로 컬럼을 통해 여과 된 원유 의 0.2 μM을 실행합니다.

그림 2: AAV 정화를 위한 연동 펌프설정. 조잡한 lysate에서 튜브를 실행, 연동 펌프를 통해, 그리고 헤파린 매트릭스 컬럼으로. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
참고: 기둥이 손상되고 AAV의 용출을 방지하므로 거품을 도입하거나 컬럼이 건조하게 실행되지 않도록 하십시오. 컬럼이 건조하게 실행되면 열을 버리고 나머지 원유 용해에 새 열을 사용합니다.
- 모든 원유 용액을 헤파린 열에 로드하고 다음 솔루션을 사용하여 열을 세척합니다.
- Mg 2+ 및 Ca2+ 없이 행크의 균형 잡힌 소금 솔루션(HBSS)의 50mL를 사용하여세척하십시오.
- Mg2+ 및 Ca2+없이 HBSS에서 0.5 % N-Lauroylsarcosine의 15 mL을 사용하여 세척하십시오.
- Mg 2+ 및 Ca2+ 없이 HBSS 50mL를 사용하여세척하십시오.
- Mg2+ 및 Ca2+와 HBSS 50 mL를 사용하여 세척
- Mg2+와 Ca2+200 mM NaCl/HBSS의 50mL를 사용하여 세척하십시오.
- Elute 5 x 5 mL (25 mL 총) 와 300 MM 의 NaCl/ HBSS 와 Mg2+ 및 Ca2+ E1-E5로 elutions레이블 (각 용출은 5 mL).
- 원심 농축기를 사용하여 바이러스 집중
- 전처리 버퍼를 함유한 원심 농축기를 900 x g에서 2분 동안 회전합니다. 흐름을 삭제합니다.
- Mg2+ 및 Ca2+ 및 원심분리기를 2분 동안 1000 x g로 HBSS 4mL로 원심 농축필터를 세척하십시오. 흐름 스루를 삭제합니다.
- 원심 농축기에 용출 E2를 추가합니다. 1000 x g에서 5분 간 회전하고 흐름을 폐기하십시오.
- E2를 추가한 다음 원심 농축기에 E3를 추가한 다음 농축 바이러스가 약 1mL가 될 때까지 5분 동안 1000 x g에서 회전합니다.
참고: 볼륨이 필터 수준 이하일 수 있도록 벡터원심분리를 피하십시오. E1, E4 또는 E5를 원심 농축기에 집중하지 마십시오. - p200 여과 팁을 사용하여 원심 농축기에서 농축 된 바이러스를 제거하고 멸균 1.5 mL 원심 분리 튜브에 배치하십시오.
- Mg2+ 및 Ca2+를 사용하여 200 μL의 HBSS로 원심 농축기를 헹구어 필터에서 남은 AAV를 제거합니다. 파이펫은 바이러스의 나머지 부분과 함께 멤브레인에 부착된 바이러스를 빼내고 1.5mL 원심분리기 튜브에 배치하는 데 여러 번(~30초)을 격렬히 제거한다. 튜브를 잘 섞습니다.
- DNA 추출을 위한 Aliquot 5 μL및 정제된 벡터를 -80°C에 저장한다.
- 2M NaCl의 25mL를 사용하여 컬럼을 세척합니다. 또한, 0.1% 트리톤 X-100의 25mL를 사용하고, 37°C로 예열되어 컬럼을 세척한다. 다음으로, 50mL의 멸균 dH2O를 사용하여 컬럼을 세척한 다음 20% 에탄올의 25mL를 사용하여 세척한다.
- 이 스토리지 솔루션이기 때문에 컬럼 멤브레인이 20% 에탄올로 완전히 포화되었는지 확인합니다. 제공된 플러그로 컬럼을 밀봉하고 4°C에 보관하십시오.
- 튜브를 1 M NaOH에 보관하십시오.
참고: 제대로 청소하면 헤파린 세파로즈 열을 최대 5회 다시 사용할 수 있습니다.
4 AAV 게놈 DNA 추출
- DNase 치료를 위한 PCR 튜브에서 표 3에 언급된 반응 믹스를 준비한다.
| 구성 요소 | 음량 |
| 정제된 AAV 벡터 | 5 μL |
| 10x DNase 버퍼 | 2 μL |
| 드나스 | 1 μL |
| ddH2O | 12 μL |
| 최종 볼륨 | 20 μL |
표 3: DNase 트리트먼트 마스터 믹스 포뮬러. DNA 추출 중 AAV 바이러스 벡터의 DNase 치료에 필요한 권장 성분 및 볼륨.
- PCR 튜브를 소용돌이쳐 PCR 튜브를 혼합하고 펄스하여 내용물아래로 회전합니다.
- 열사이클러를 사용하여 37°C에서 20분 동안 인큐베이션한 다음 75°C에서 15분 동안 디나스를 가열합니다.
- 프로틴아제 K 5 μL을 추가합니다.
- 열사이클러를 사용하여 50°C에서 60분 동안 배양한 다음 95°C에서 30분 동안 배양하여 단백질을 가열합니다.
- DNA 정리 키트를 사용하여 잠재적인 오염 물질을 제거하십시오.
참고:이 단계는 시판되는 혈액 및 조직 정리키트(재료 표)를사용하여 수행하였다.- DNase/Proteinase K 처리 벡터를 포함하는 PCR 튜브에 AL 버퍼(혈액 및 조직 정리 키트, 재료 테이블)의200 μL을 추가합니다.
- PCR 튜브를 소용돌이시키고 56°C에서 56°C에서 열순환기에서 10분 동안 배양합니다.
- PCR 튜브의 액체를 수집 튜브에 앉아 멸균 스핀 컬럼으로 피펫합니다.
- 기둥에 100% 에탄올의 200 μL을 추가하고 소용돌이에 의해 철저하게 섞습니다.
- 원심분리기는 6,000 x g에서 1분 동안 흐르고 흐름을 버립니다.
- 스핀 컬럼에 완충 AW1(혈액 및 조직 정리 키트, 재료 테이블)의500 μL을 추가합니다.
- 원심분리기는 6,000 x g에서 1분 동안 흐르고 흐름을 버립니다.
- 스핀 컬럼에 완충 AW2(혈액 및 조직 정리 키트, 재료 테이블)의500 μL을 추가합니다.
- 원심분리기는 15,000 x g에서 3분 동안 흐르고 흐름을 버립니다.
- 스핀 컬럼을 멸균 1.5mL 원심분리기 튜브에 넣고 200 μL의 완충AE(혈액 및 조직 정리 키트, 재료 표)를스핀 컬럼 멤브레인에 직접 넣습니다.
- 실온에서 1분 동안 배양하십시오.
- DNA를 엘로우하기 위해 1 분 동안 6,000 x g의원심 분리기.
- DNA를 -20°C에 저장합니다.
5 정량 적 중합체 연쇄 반응 및 Simian 바이러스 40 (SV40) 프로브를 사용하여 AAV 벡터 게놈의 적정
참고: 외부 DNA 오염을 방지하기 위해 필터링된 파이펫 팁을 사용하여 PCR 후드에서 모든 qPCR 작업을 수행합니다. AAV 게놈이 SV40 폴리아 서열을 인코딩하지 않으면 다른 곳에서 설명된 ITR에 대한프로브를 25로사용한다. 표준으로 선택된 플라스미드 DNA에 SV40 폴리아 서열이 포함되어 있는지 확인합니다.
- 재고 표준 준비
- 10 μg/μL의 최종 농도로 주식 플라스미드 DNA 표준(SV40 폴리A 서열을 함유한 pTransgene plasmid)을 희석하고 6 μL 알리쿼트에서 -20°C에 저장합니다.
- 다음 온라인계산기(26)를사용하여 플라스미드 DNA 표준에 존재하는 카피 번호를 결정한다.
참고: 품질과 정확한 농도를 보장하기 위해 상용 공급업체가 생산한 표준에 사용되는 플라스미드 DNA를 사용합니다. 새로 준비된 표준으로 전환할 때 브리징 연구를 수행하기 위해 다량의 표준(예: 10mL)을 준비합니다.
- 1.5mL 원심분리기 튜브의 샘플과 표준 모두에 대해 표 4에 언급된 다음 시약 믹스를 준비한다.
참고 : 마스터 믹스의 충분한 오버런을 준비합니다. 프라이머/프로브 시퀀스의 표 5를 참조하십시오.
| 구성 요소 | 음량 |
| 유니버설 qPCR 마스터 믹스 (2X) | 10 μL |
| 분자 등급 물 | 4.5 μL |
| 40 x SV40 폴리A 프라이머 / 프로브 | 0.5 μL |
| 최종 볼륨 | 15 μL |
표 4: AAV 적정을 위한 qPCR 마스터 믹스. AAV 바이러스 벡터에서 추출된 DNA의 qPCR에 필요한 권장 성분 및 부체.
| 구성 요소 | 순서 |
| 포워드 프라이머 | 5'-AGCAA타그카타아타타카-3' |
| 역프라이머 | 5'-CCAGACATGATAAGATAATAATACATTGATGAGTT-3' |
| 탐침 | /56-FAM/AGCATTTTT/젠/TTCACTGCATTCTAGGTGTTTGTC/3IABkFQ |
표 5: SV40 폴리아 DNA 서열에 대한 프라이머 서열. SV40 폴리A 서열을 포함하는 AAV 바이러스 벡터의 특정 영역에 결합하는 qPCR 적정에 사용되는 프라이머 및 프로브의 서열.
- 마스터믹스를 위아래로 섞어 주시면 됩니다.
- 희석 판을 설정합니다.
- 명확한 96웰 플레이트를 사용하여 표준 및 시료 희석을 준비하고, 열 1(컬럼 1, 3, 5, 7, 9 및 11)으로 시작하는 다른 모든 컬럼에 각각 45 μL의 분자 등급 물을 추가합니다.
- 잘 A1과 파이펫에 표준의 5 μL을 추가하여 혼합합니다.
- 새 필터링된 파이펫 팁을 사용하여 잘 A1에서 B1까지 1/10 희석을 만듭니다.
- G1에 도달할 때까지 열 아래로 10배 의 희석을 계속합니다.
- 이는 음수 제어 역할을 하므로 H1에 추가하지 마십시오.
- 첫 번째 샘플(S1)을 잘 A3에 추가하여 1/10 희석을 형성하여 적용합니다. 파이펫이 혼합물과 5 μLto 잘 B3를 전송합니다. 이 전송 후 파이펫 팁을 폐기합니다.
- 새로운 파이펫 팁으로 솔루션을 B3에 잘 혼합하고 1/100 희석을 형성합니다. 5 μLof이 혼합물을 잘 C3로 옮기고 전달 후 팁을 버리십시오.
- 새로운 파이펫 팁으로, 파이펫은 잘 C3의 솔루션을 위아래로 1/1000 희석을 합니다. 팁을 삭제합니다.
- 컬럼 2, 4, 6, 8, 10 또는 12에 샘플을 추가하지 않고 샘플을 희석계속합니다.
- 모든 샘플이 희석되면 컬럼 1의 우물에서 내용을 혼합한 다음 20 μL을 20 μL로 컬럼 2로 옮습니다.
- 열 3, 5, 7, 9 및 11에 대해 이 것을 반복하여 각 표준 및 샘플 희석의 복제를 만듭니다. 플레이트 레이아웃의 그림 3을 참조하십시오.
참고: 도 3에서플레이트 설정을 따라 갈 때 G행과 H행으로 희석된 샘플은 1/10 및 1/100 희석만 합니다.
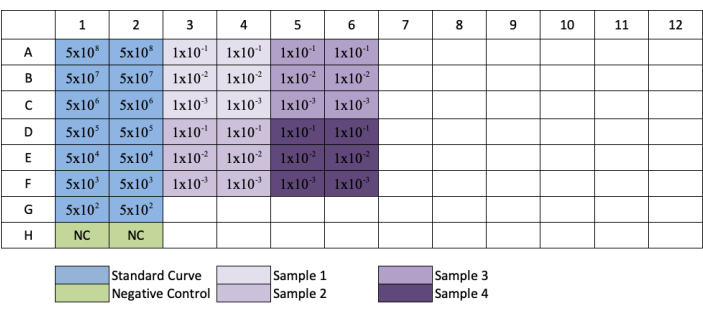
그림 3: qPCR AAV 적정판에 대한 플레이트 레이아웃. 파란색은 표준의 직렬 희석의 배치를 나타냅니다. 녹색은 음수 컨트롤의 배치를 나타냅니다. 보라색은 샘플의 희석의 배치를 나타냅니다. 각 표준, 음수 또는 샘플이 복제에 추가됩니다. 표준의 농도에 대한 예가 첨가되어 표준의 희석 계열을 나타내고, 시료 희석의 배치가 각각의 우물에 추가되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- SV40 폴리A 검출 기반 qPCR에 의한 적정
- 흰색 세미 스커트 96 웰 qPCR 플레이트의 각 웰에 qPCR 마스터 믹스 15 μL을 추가합니다.
- 투명 한 96 웰 플레이트에서 흰색-세미 스커트 96 웰 qPCR 플레이트에 각 샘플의 5 μL을 전송합니다.
- 멀티채널 파이펫을 사용하여 qPCR 마스터 믹스 및 시료를 적절히 혼합할 수 있습니다.
- 밀봉 필름으로 플레이트를 밀봉하고 qPCR 플레이트를 30초 동안 1500 x g로 원심분리합니다.
- 표 6에서제안된 조건을 사용하여 플레이트 기반 실시간 PCR 증폭 및 검출 기기에서 qPCR 반응을 실행한다.
| 절 | 사이클 | 시간 | 온도 | 묘사 |
| 배양 전 | 1x | 5분 | 95°C | DNA 변성. |
| 증폭 | 38x | 15 s | 95°C | DNA의 증폭. 온도가 다른 대체 프라이머를 사용하는 경우 설정을 수정할 수 있습니다. |
| 60 s | 60 °C | |||
| 냉각 | 1x | 60 s | 40°C | 플레이트 냉각. 실행 종료입니다. |
표 6: 가수분해 프로브 기반 qPCR 적정용 열순환기 프로토콜. 정제된 AAV 벡터를 추출한 DNA의 프로브 기반 qPCR 적정을 사용하기 위한 권장 열순환기 프로토콜.
참고: qPCR AAV 티티레이션 워크시트의 경우 표 7을참조하십시오.
- AAV 게놈 복사 번호를 결정하기 위한 데이터 분석.
- 표준 및 시료 희석모두에 대해 qPCR 실행에서 얻은 농도 값으로 스프레드시트 데이터셀(표 7A)을채우는 다.
- 표 7A의 농도 값을 사용하여 표준 곡선(표7B)을생성합니다.
참고: 표준 곡선은R2 효율과 함께 천연 로가릿(y = ln(x) + b)로표시됩니다. 표준 곡선은 100 %에 가까운 효율을 가져야하며 R2는 1.0 (≥0.99)에 가깝습니다. - 이 온라인 계산기(27)를작성하여 경사 효율을 채우기.
참고: 90%-110% 사이의 효율성은 허용됩니다. qPCR의 효율성이 이 범위를 벗어나면 qPCR을 다시 실행합니다. - 표 7A의 농도 값을 사용하여 각 샘플의 희석을 평균하고 각 샘플(표7C)의표준 편차를 결정합니다.
참고: 샘플 희석의 평균에서 두 개 이상의 표준 편차가 있는 샘플에서 희석을 제외합니다. - 각 희석의 평균 농도를 사용하여 희석 계수에 곱한 다음 5로 나누어 각 샘플의 벡터 게놈(vg)/μL(표7C)을얻습니다.
- 각 샘플의 평균을 80,000(표7C)에곱하여 각 시료의 vg/mL을 계산합니다.
- 각 희석의 VG/mL을 평균하여 각 샘플의 최종 Vg/mL(표7C)을생성한다.
참고: 사용자는 vg/μL의 농도를 생성하기 위해 qPCR 실행에 대해 각 웰에 로드된 5 μL을 고려하여 각 희석의 평균 농도를 5인으로 나누어야 합니다. 80,000의 계수는 각 샘플의 평균 농도 값에서 vg/mL로의 전환을 차지합니다. 첫째, 각 시료의 농도 값의 평균은 단일 가닥 게놈을 설명하기 위해 2로 곱되어야 하며, 프라이머 프로브 세트는 양성 감각, 단일 가닥 DNA(ssDNA)를 정량화하고, AAV 게놈은 양성 및 음수 sDNA25,28사이의 대략적인 1:1 비율로 존재한다. 각 시료의 농도 값의 평균은 5 μL의 정제 된 벡터 (섹션 4.1)에서 추출 된 DNA (섹션 4.6.12)의 200 μL에서 샘플 희석을 고려하기 위해 x40을 곱해야합니다. 마지막으로, 각 샘플의 농도 값의 평균은 vg/μL에서 vg/mL로 변환하려면 x1000을 곱해야 합니다.
6 벡터 품질 및 순도 평가
- 품질 관리 - 웨스턴 블롯
- 12% SDS PAGE 젤을 준비합니다.
- 폴리아크릴아미드 젤 전기포고를 수행합니다.
참고: 잘 조리된 샘플 6 x10 10 vg을 로드합니다. - 단백질을 폴리비닐리덴 디플루오라이드(PVDF) 막으로 이송한다.
- PVDF 멤브레인 차단
- 전달 장치에서 멤브레인을 제거하고 0.1% PBST로 헹구어 느슨한 아크릴아미드를 제거합니다.
- 멤브레인을 실온에서 1시간 이상 또는 하룻밤 동안 4°C의 블로킹 용액에 배치합니다.
참고: 블로킹 버퍼는 2% 염소 세럼으로 추가로 보완할 수 있습니다.
- 1차 항체를 가진 배양
- 차단 버퍼를 데칸트하고 1:200 희석에서 항 AAV 마우스 단일 클론 항체인 1차 항체를 첨가한다.
- 4 °C에서 하룻밤 동안 배양하십시오.
- 1 차적인 항체를 데칭하고 동요와 실온에서 5 분 동안 0.1 % PBST로 5 번 세척하십시오.
- 이차 항체를 가진 배양
- 세척 용액을 데킹하고 HRP 공액 이차 항체를 추가하여 1:7500에 희석하여 차단 버퍼에 넣고 동요가 있는 실온에서 1시간 동안 배양합니다.
- 이차 항체를 데칭하고 동요와 실온에서 5 분 동안 0.1 % PBST로 5 번 세척하십시오.
- 동요와 실온에서 PBS와 함께 최종 세척을 수행합니다.
- 향상된 화학 발광 (ECL) 기판을 사용하여 단백질을 감지합니다.
- 바이러스 성 단백질(VP1, VP2 및 VP3 하위 단위)을 시각화하는 겔을이미지(도 4).

그림 4: AAV 캡시드 단백질을 나타내는 서양 블롯. 레인 A; MW 사다리, 레인 B; AAV6.2FF-hIgG01, 레인 C; AAV6.2FF-hIgG02, 레인 D; AAV6.2FF-hIgG03 및 레인 E; AAV6.2FF-hIgG04. 각 AAV6.2FF-hIgG의 6 x10 10 vg이 각각의 차선에 로드되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 순도 제어 - SDS 페이지 및 쿠마시 스테인
- 6.1.1 및 6.1.2 단계에서 설명된 대로 SDS-PAGE 젤 및 샘플을 준비합니다.
- 젤을 고정용 액수에 1시간 또는 하룻밤 동안 부드럽게 교반하여 고정하십시오. 첫 번째 시간 동안 수정 솔루션을 한 번 변경합니다.
- 부드러운 교반으로 2-4 h염색 용액에 젤을 얼룩지게 합니다.
- 젤을 스테인딩 용액으로 데스테인. 젤의 배경이 완전히 비열 될 때까지 스테디닝 용액을 여러 번 보충하십시오 (4-24 h).
- 스테디드 젤을 저장 용액에 보관합니다.
- 쿠마시 염색 용액에 의해 염색 된 모든 단백질을 시각화하는 젤을 이미지.
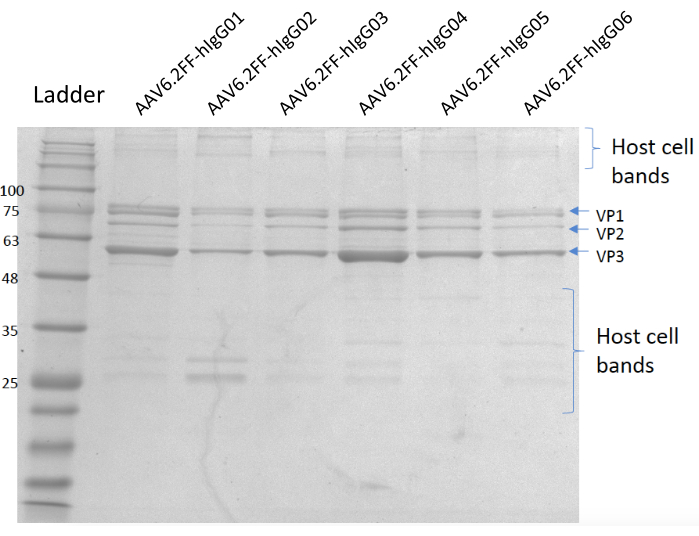
그림 5: 쿠마시 스테인드 젤. 레인 A; MW 사다리, 레인 B; AAV6.2FF-hIgG01, 레인 C; AAV6.2FF-hIgG02, 레인 D; AAV6.2FF-hIgG03, 레인 E; AAV6.2FF-hIgG04, 레인 F; AAV6.2FF-hIgG05 및 레인 G; AAV6.2FF-hIgG06. 각 AAV6.2FF-hIgG의 6 x10 10 vg이 각각의 차선에 로드되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 대체 순도 제어 분석 - HEK293 숙주 세포 단백질 검출 ELISA
- 제조업체의 지침에 따라 ELISA를 통해 HEK293 숙주 세포 단백질 검출을 수행합니다.
참고: 정제된 rAAV 샘플에 5 x 10-2 및 1 x10-3의 희석을 사용합니다. TMB가 우물에 추가되면 빛에서 멀리 배양하십시오. 선형 회귀를 사용하여 결과를 분석할 수 없습니다. - 포인트-포인트 분석, 입방 스프라인 또는 4파라미터 로지스틱 핏 방법을 수행하여 미지의 농도를 보간하고 희석 계수에 곱하여 원래 의 시료 농도를 결정한다.
- 제조업체의 지침에 따라 ELISA를 통해 HEK293 숙주 세포 단백질 검출을 수행합니다.
결과
작은 설치류 모델에서 더 큰 동물 모델로 의번역및 최종 임상 응용 프로그램은 더 큰 동물을 트랜스포유하고 치료 효과를 달성하는 데 필요한 많은 양의 AAV로 인해 중요한 과제를 제시합니다. 합리적으로 설계된 AAV6.2FF 캡시드의 트랜스듀션 효율을 비교하기 위해, 이전에는 AAV63,마우스, 햄스터 및 양에 비해 뮤린 근육 세포에서 의 연도 효율이 101배 증가하여 인간 단클론 항체(hIg...
토론
이 논문에 기재된 재조합 AAV(rAAV) 벡터의 생산은 분자 생물학 연구 실험실 및 시설의 대부분에서 발견되는 일반적인 재료, 시약 및 장비를 사용합니다. 이 논문은 높은 품질의 시험관 내 및 생체 내 등급 rAAV를 독자에 의해 생성 할 수 있습니다. 무엇보다도, rAAV 생산을 위한 이 프로토콜은 세슘 염화 정제와 관련된 보다 지루한 프로토콜에 비해 효율적이며 초원심분리의 사용을 방지한...
공개
사라 K. 우튼은 AAV6.2FF 캡시드에 대한 미국 특허 US10806802B2의 발명가입니다.
감사의 말
아미라 D. Rghei, 브레나 A. Y. 스티븐스, 실비아 P. 토마스, 제이콥 지 이 예이츠는 온타리오 수의대 학생 스티펜스와 온타리오 대학원 장학금을 받았다. 아미라 D. Rghei는 미탁스 가속 학생의 수혜자였다. 이 연구는 건강 연구를위한 캐나다 연구소 (CIHR) 프로젝트 보조금 (#66009)과 SKW에 공동 건강 연구 프로젝트 (NSERC 파트너) 보조금 (#433339)에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore Sigma | S2GPU05RE | |
| 0.25% Trypsin | Fisher Scientific | SM2001C | |
| 1-Butanol | Thermo Fisher Scientific | A399-4 | CAUTION. Use under a laminar flow hood. Wear gloves |
| 10 chamber cellstack | Corning | 3271 | |
| 1L PETG bottle | Thermo Fisher Scientific | 2019-1000 | |
| 30% Acrylamide/Bis Solution | Bio-Rad | 1610158 | |
| 96-well skirted plate | FroggaBio | FS-96 | |
| Adhesive plate seals | Thermo Fisher Scientific | 08-408-240 | |
| Ammonium persulfate (APS) | Bio-Rad | 161-0700 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Blood and Tissue Clean up Kit | Qiagen | 69506 | Use for DNA clean up in section 4.6 of protocol |
| Bromophenol blue | Fisher Scientific | B392-5 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Cell Culture Dishes | Greiner bio-one | 7000232 | 15 cm plates |
| Culture Conical Tube | Thermo Fisher Scientific | 339650 | 15 mL conical tube |
| Culture Conical Tube | Fisher Scientific | 14955240 | 50 mL conical tube |
| Dulbecco's Modified Eagle Medium (DMEM) with 1000 mg/L D-glucose, L-glutamine | Cytiva Life Sciences | SH30022.01 | |
| ECL Western Blotting Substrate | Thermo Fisher Scientific | 32209 | |
| Ethanol | Greenfield | P016EA95 | Dilute ethyl alcohol(95% vol) to 20% for section 3.7.4 and 70% for section 6.1.1.1 |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | SH30396.03 | |
| Glacial acetic acid | Fisher Scientific | A38-500 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Glycerol | Fisher Scientific | BP229-1 | |
| Glycine | Fisher Scientific | BP381-500 | |
| HBSS with Mg2+ and Ca2+ | Thermo Fisher Scientific | SH302268.02 | |
| HBSS without Mg2+ and Ca2+ | Thermo Fisher Scientific | SH30588.02 | |
| HEK293 cells | American Tissue Culture Collection | CRL-1573 | Upon receipt, thaw the cells and culture as described in manufacturer’s protocol. Once cells have been minimally passaged and are growing well, freeze a subfraction for future in aliquots and store in liquid nitrogen. Always use cells below passage number 30. Once cultured cells have been passaged more than 30 times, it is recommended to restart a culture from the stored aliquots |
| HEK293 host cell protein ELISA kit | Cygnus Technologies | F650S | Follow manufacturer’s instructions |
| Heparin sulfate column | Cytiva Life Sciences | 17040703 | |
| Kimwipe | Thermo Fisher Scientific | KC34120 | |
| L-glutamine (200 mM) | Thermo Fisher Scientific | SH30034.02 | |
| Large Volume Centrifuge Tube Support Cushion | Corning | CLS431124 | Support cushion must be used with large volume centrifuge tubes uless the centrifuge rotor has the approriate V-bottom cushions |
| Large Volume Centrifuge Tubes | Corning | CLS431123-6EA | 500 mL centrifuge tubes |
| MgCl2 | Thermo Fisher Scientific | 7791-18-6 | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | 1.5 mL microcentrifuge tube, sterilize prior to use |
| Molecular Grade Water | Cytiva Life Sciences | SH30538.03 | |
| N-Lauroylsarcosine sodium salt | Sigma Aldrich | L5125 | CAUTION. Wear gloves |
| NaCl | Thermo Fisher Scientific | BP35810 | |
| Optimem, reduced serum medium | Thermo Fisher Scientific | 31985070 | |
| Pasteur pipets | Fisher Scientific | 13-678-20D | Sterilize prior to use |
| PBS (10x) | Thermo Fisher Scientific | 70011044 | Dilute to 1x for use on cells |
| Penicillin-Streptomycin Solution | Cytiva Life Sciences | SV30010 | |
| pHelper plasmid | De novo design or obtained from plasmid repository | NA | |
| Pipet basin | Thermo Fisher Scientific | 13-681-502 | Purchase sterile pipet basins |
| Polyethylene glycol tert-octylphenyl ether (Triton X-100) | Thermo Fisher Scientific | 9002-93-1 | CAUTION. Wear gloves |
| Polyethylenimine (PEI) | Polyscience | 24765-1 | Follow manufacturer’s instructions to produce a 1L solution. 0.22μm filter and store at 4°C |
| Polypropylene semi-skirted PCR Plate | FroggaBio | WS-96 | |
| Polysorbate 20 (Tween 20) | Thermo Fisher Scientific | BP337-100 | CAUTION. Wear gloves |
| polyvinylidene difluoride (PVDF) membrane | Cytiva Life Sciences | 10600023 | Use forceps to manipulate. Wear gloves. |
| Primary antibody | Progen | 65158 | |
| Protein Ladder | FroggaBio | PM008-0500 | |
| Proteinase K | Thermo Fisher Scientific | AM2546 | |
| pTrangene plasmid | De novo design or obtained from plasmid repository | NA | Must contain SV40 polyA in genome to be compatible with AAV titration in section 5.0 |
| Pump tubing | Cole-Parmer | RK-96440-14 | Optimize length of tubing and containment of virus in fractions E1-E5 |
| RQ1 Dnase 10 Reaction Buffer | Promega | M6101 | Use at 10x concentration in protocol from section 4.0 |
| RQ1 Rnase-free Dnase | Promega | M6101 | |
| Sample dilutent | Cygnus Technologies | I700 | Must be purchased separately for use with HEK293 host cell protein ELISA kit |
| Secondary antibody, HRP | Thermo Fisher Scientific | G-21040 | |
| Skim milk powder | Oxoid | LP0033B | |
| Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 28312 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | SS266-4 | |
| SV40 polyA primer probe | IDT | Use sequence in Table X for quote from IDT for synthesis | |
| Tetramethylethylenediamine (TEMED) | Thermo Fisher Scientific | 15524010 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypan blue | Bio-Rad | 1450021 | |
| Ultra-Filter | Millipore Sigma | UFC810024 | Ultra-4 Centrifugal 10K device must be used, as it has a 10000 molecular weight cutoff |
| Universal Nuclease for cell lysis | Thermo Fisher Scientific | 88702 | |
| Universal qPCR master mix | NEB | M3003L | |
| Whatman Paper | Millipore Sigma | WHA1001325 | |
| β-mercaptoethanol | Fisher Scientific | 21985023 | CAUTION. Use under a laminar flow hood. Wear gloves |
| CAUTION: Refer to the Materials Table for guidelines on the use of dangerous chemicals. |
참고문헌
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: A golden anniversary of discovery, research, and gene therapy success-a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Nathwani, A. C., et al. Long-term safety and efficacy of factor IX gene therapy in hemophilia B. The New England Journal of Medicine. 371 (21), 1994-2004 (2014).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Ylä-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (10), 1831-1832 (2012).
- FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-novel-gene-therapy-treat-patients-rare-form-inherited-vision-loss (2020)
- FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease (2020)
- Statement from FDA Commissioner Scott Gottlieb, MD and Peter Marks, MD Ph.D., Director of the Center for Biologics Evaluation and Research on new policies to advance development of safe and effective cell and gene therapies. FDA Available from: https://www.fda.gov/news-events/press-announcements/statement-fda-commissioner-scott-gottlieb-md-and-peter-marks-md-phd-director-center-biologics (2020)
- Asokan, A., Schaffer, D. V., Samulski, R. J. The AAV vector toolkit: poised at the clinical crossroads. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (4), 699-708 (2012).
- Rose, J. A., Hoggan, M. D., Shatkin, A. J. Nucleic acid from an adeno-associated virus: chemical and physical studies. Proceedings of the National Academy of Sciences of the United States of America. 56 (1), 86-92 (1966).
- Lusby, E., Fife, K. H., Berns, K. I. Nucleotide sequence of the inverted terminal repetition in adeno-associated virus DNA. Journal of Virology. 34 (2), 402-409 (1980).
- Masat, E., Pavani, G., Mingozzi, F. Humoral immunity to AAV vectors in gene therapy: challenges and potential solutions. Discovery Medicine. 15 (85), 379-389 (2013).
- Ling, C. Enhanced Transgene Expression from Recombinant Single-Stranded D-Sequence-Substituted Adeno-Associated Virus Vectors in Human Cell Lines In Vitro and in Murine Hepatocytes In Vivo. Journal of Virology. 89 (2), 952-961 (2014).
- Cathomen, T., Stracker, T. H., Gilbert, L. B., Weitzman, M. D. A genetic screen identifies a cellular regulator of adeno-associated virus. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 14991-14996 (2001).
- McCarty, D. M. Self-complementary AAV vectors; advances and applications. Molecular Therapy. 16 (10), 1648-1656 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of aav serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PLOS One. 8 (9), 76310 (2013).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Pillay, S., et al. Adeno-associated virus (AAV) serotypes have distinctive interactions with domains of the cellular AAV receptor. Journal of Virology. 91 (18), (2017).
- Merkel, S. F. Trafficking of adeno-associated virus vectors across a model of the blood-brain barrier; a comparative study of transcytosis and transduction using primary human brain endothelial cells. Journal of Neurochemistry. 140 (2), 216-230 (2017).
- van Lieshout, L. P., et al. A novel triple-mutant AAV6 capsid induces rapid and potent transgene expression in the muscle and respiratory tract of mice. Molecular Therapy. Methods & Clinical Development. 9, 323-329 (2018).
- Wu, Z., Asokan, A., Grieger, J. C., Govindasamy, L., Agbandje-McKenna, M., Samulski, R. J. single amino acid changes can influence titer, heparin binding, and tissue tropism in different adeno-associated virus serotypes. Journal of Virology. 80 (22), 11393-11397 (2006).
- Liu, J., Moon, Y. -. A. Simple purification of adeno-associated virus-DJ for liver-specific gene expression. Yonsei Medical Journal. 57 (3), 790-794 (2016).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adeno-associated virus vectors. Human Gene Therapy. 9 (18), 2745-2760 (1998).
- Kimura, T., et al. Production of adeno-associated virus vectors for in vitro and in vivo applications. Scientific Reports. 9 (1), 13601 (2019).
- Aurnhammer, C., et al. Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences. Human Gene Therapy Methods. 23 (1), 18-28 (2012).
- . Paramyxoviridae: The viruses and their replication. Fields Virology Available from: https://www.scholars.northwestern.edu/en/publications/paramyxoviridae-the-viruses-and-their-replication (1996)
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Kaludov, N., Brown, K. E., Walters, R. W., Zabner, J., Chiorini, J. A. Adeno-associated virus serotype 4 (AAV4) and AAV5 Both require sialic acid binding for hemagglutination and efficient transduction but differ in sialic acid linkage specificity. Journal of Virology. 75 (15), 6884-6893 (2001).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Human Gene Therapy Methods. 26 (6), 228-242 (2015).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Frontiers in Microbiology. 10, 1570 (2019).
- Backovic, A., et al. Capsid protein expression and adeno-associated virus like particles assembly in Saccharomyces cerevisiae. Microbial Cell Factories. 11, 124 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유