Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Büyük Hayvan Modellerinde Preklinik Çalışmalar İçin Hücre Yığınlarında Adeno İlişkili Virüs Vektörlerinin Üretimi
Bu Makalede
Özet
Burada, hücre yığınlarında yetişen yapışan HEK 293 hücrelerini ve benzeşim kromatografisi saflaştırmayı kullanarak araştırma sınıfı AAV vektörlerinin büyük ölçekli üretimi için ayrıntılı bir prosedür sunuyoruz. Bu protokol sürekli olarak >1 x 1013 vektör genomları /mL verir ve büyük hayvan çalışmaları için uygun vektör miktarları sağlar.
Özet
Adeno ilişkili virüs (AAV) vektörleri, insanlar için onaylanmış üç AAV gen tedavisi ile klinik olarak en gelişmiş gen tedavisi vektörleri arasındadır. AAV için yeni uygulamaların klinik ilerlemesi, fareler gibi küçük hayvan modellerinden köpekler, koyunlar ve insan olmayan primatlar da dahil olmak üzere daha büyük hayvan modellerine geçişi içerir. AAV'yi daha büyük hayvanlara uygulamanın sınırlamalarından biri, büyük miktarlarda yüksek titre virüsü gereksinimidir. Süspansiyon hücre kültürü AAV vektör üretimi için ölçeklenebilir bir yöntem olsa da, çok az araştırma laboratuvarı ekipmana (örneğin biyoreaktörler) sahiptir veya bu şekilde AAV'nin nasıl üretileceği hakkında bilir. Ayrıca, AAV titreleri süspansiyon HEK 293 hücrelerinde üretildiğinde, yapışan HEK293 hücrelerine kıyasla genellikle önemli ölçüde daha düşüktür. Burada açıklanan hücre yığınları kullanarak yüksek titre AAV büyük miktarlarda üretmek için bir yöntemdir. AAV'yi titretmeye yönelik ayrıntılı bir protokol ve vektör saflığını doğrulama yöntemleri de açıklanmıştır. Son olarak, bir koyun modelinde AAV aracılı transgene ekspresyonunun temsili sonuçları sunulmuştur. AAV vektörlerinin yapışan hücrelerde büyük ölçekli üretimi için optimize edilmiş bu protokol, moleküler biyoloji laboratuvarlarının yeni AAV tedavilerinin daha büyük hayvan modellerinde test edilmesini ilerletmesini sağlayacaktır.
Giriş
Adeno ilişkili virüs (AAV) vektörlerini kullanan gen tedavisi son otuz yılda büyük adımlar attı1,2. Konjenital körlük, hemofili ve kas-iskelet sistemi ve merkezi sinir sistemi hastalıkları da dahil olmak üzere çeşitli genetik hastalıklarda ortaya konan gelişmeler, AAV gen tedavisini klinik araştırmalarda ön plana çıkarmıştır3,4. 2012 yılında, Avrupa İlaç Ajansı (EMA), LPL eksikliğinin tedavisi için lipoprotein lipazını (LPL) ifade eden bir AAV1 vektörü olan Glybera'yı onayladı ve avrupa veya Amerika BirleşikDevletleri'ndebir gen tedavisi tedavisi için ilk pazarlama izni 5 . O zamandan beri, iki ek AAV gen tedavisi, Luxturna6 ve Zolgensma7, FDA onayı aldı ve pazarın önümüzdeki 5 yıl içinde 20258'ekadar beklenen 10-20 gen tedavisi ile hızla genişlemesi bekleniyor. Mevcut klinik veriler, AAV gen tedavisinin güvenli, iyi tolere edilmiş ve etkili bir modalite olduğunu ve AAV'nin ClinicalTrials.gov kayıtlı 244'ün üzerinde klinik çalışma ile onu en umut verici viral vektörlerden biri haline getirdiğini göstermektedir. AAV vektörlerini içeren klinik uygulamalara artan ilgi, AAV tedavilerinin büyük hayvan modellerinde değerlendirilmesini kolaylaştırmak için sağlam ve ölçeklenebilir üretim yöntemleri gerektirir, çünkü bu çeviri boru hattında kritik bir adımdır9.
AAV vektör üretimi için iki temel gereklilik AAV genom ve kapsiddir. Vahşi tip (wt)-AAV'nin genomları, yaklaşık 4,7 kb uzunluğunda10olan tek iplikli DNA'dır. wt-AAV genom, ambalajlama için önemli olan genomun her iki ucunda bulunan ters terminal tekrarlarını (ITR'ler) ve rep ve cap genleriniiçerir 11. Genom replikasyonu, viral kapsid montajı ve genomun viral kapsid içine kapsüllenmesi için gerekli olan rep ve cap genleri viral genomdan çıkarılır ve AAV vektör üretimi için trans olarak sağlanır12. Bu genlerin viral genomdan çıkarılması, terapötik transgenlere ve promotör ve polyA sinyali de dahil olmak üzere gerekli tüm düzenleyici unsurlara yer sağlar. ITR'ler, uygun genom replikasyonu ve viral kapsülleme sağlamak için vektör genomunda kalır13,14. Transgene ekspresyonunun kinetiğini iyileştirmek için, AAV vektör genomları, AAV genom replikasyon sırasında tek iplikten çift iplikli DNA dönüşümüne dönüştürme ihtiyacını azaltan, ancak kodlama kapasitesini ~ 2.4 kb15'e düşüren kendi kendini tamamlayıcı olacak şekilde geliştirilebilir.
AAV genom tasarımının ötesinde, kapsid serotip seçimi AAV vektörün doku ve hücre tropizmini belirler in vivo2. Doku trompisine ek olarak, farklı AAV serotiplerinin farklı gen ekspresyasyonu kinetiği gösterdiği gösterilmiştir16. Örneğin, Zincarelli ve ark.17 farklı AAV serotiplerini düşük ekspresyon serotipleri (AAV2, 3, 4, 5), ılımlı ifade serotipleri (AAV1, 6, 8) ve yüksek ekspresyon serotipleri (AAV7 ve 9) olarak sınıflandırdı. Ayrıca AAV serotiplerini yavaş başlangıçlı ifade (AAV2, 3, 4, 5) veya hızlı başlangıçlı ifade (AAV1, 6, 7, 8 ve 9) olarak kategorize ettiler. Bu farklı tromizmler ve gen ekspresyasyonu kinetikleri kapsid proteinlerindeki amino asit varyasyonlarından, kapsid protein oluşumlarından ve konak hücre reseptörleri/ ko-reseptörleri ile etkileşimlerden kaynaklanmaktadır18. Bazı AAV kapsidleri, intravasküler uygulama (AAV9) sonrasında kan-beyin bariyerini geçme veya dayanıklı transgene ekspresyasyonu için uzun ömürlü kas hücrelerinde yaşama (AAV6, 6.2FF, 8 ve 9)19,20gibi ek faydalı özelliklere sahiptir.
Bu makale, klinik öncesi büyük hayvan modellerinde kullanılmak üzere yüksek saflıkta, yüksek titreli, araştırma sınıfı AAV vektörleri üretmek için uygun maliyetli bir yöntemi detaylandırmayı amaçlamaktadır. Bu protokol kullanılarak AAV üretimi, hücre yığınlarında yetişen yapışan insan embriyonik böbreği (HEK)293 hücreye çift plazmid transfeksiyon kullanılarak elde edilir. Ayrıca, çalışma, AAV2, 3, 6, 6.2FF, 13 ve DJ21,22 dahil olmak üzere heparin bağlayıcı alanlar içeren AAV serotipleri için kullanılabilen heparin sülfat benzeşim kromatografisi saflaştırma için bir protokol açıklanmaktadır.
AAV vektörlerinin üretimi için bir dizi paketleme sistemi mevcuttur. Bunlar arasında, iki plazmid eş transfeksiyon sistemlerinin kullanımı, Rep ve Cap genlerinin ve Reklam yardımcısı genlerinin (E1A, E1B55K, E2A, E4orf6 ve VA RNA) bir plazmid (pHelper) içinde bulunduğu, plazmid üretimi için azaltılmış maliyet de dahil olmak üzere ortak üç plazmid (üçlü) transfeksiyon yöntemine göre bazı pratik avantajlara sahiptir23,24 . Transgene ifade kasetini (pTransgene) içeren AAV genom plazmidi, ITR'ler tarafından kuşatılmalı ve uzunluğu ~4,7 kb'ı geçmemelidir. Vektör titresi ve saflık transeksiyon sırasında potansiyel sitotoksik etkiler nedeniyle transgeneden etkilenebilir. Vektör saflığının değerlendirilmesi burada açıklanmıştır. Her biri için 1 x 1013 vg/mL veren bu yöntem kullanılarak üretilen vektörler fare, hamster ve yumurta hayvan modellerinde değerlendirildi.
Tablo 1: Gerekli çözümlerin bileşimi. Protokol boyunca çeşitli çözümler için gereken bileşenlerin yüzdeleri ve hacimleri de dahil olmak üzere gerekli bilgiler. Bu Tabloyu indirmek için lütfen tıklayınız.
Protokol
1. Hücre yığınlarındaki HEK293 hücrelerinin çift plazmid transfeksiyon
- 37 °C'de ayarlanmış bir boncuk banyosunda hek293 hücrelerinin kriyo şişelerini çözün.
NOT: Soğuk sıcaklığın kaplama sırasında hücreleri şoklamamasını sağlamak için hücreler çözülürken, önceden ısınan komple DMEM ila 37 °C. Optimum büyüme ve transeksiyon verimliliği sağlamak için hücrelerin ideal olarak 20'den az düşük geçiş sayısına sahip olduğundan emin olun. Hücrelerin mikoplazma içermediğinin onaylı olduğundan emin olun. - Kriyo şişesinin içeriğini damla yönünde 10 mL önceden ısıtılmış komple DMEM içeren 15 mL konik bir tüpe aktarın ve hücreleri 5 dakika boyunca 500 x g'da santrifüjleyin.
- Ortamı aspire edin ve ardından HEK293 hücrelerini önceden ısıtılmış 20 mL'lik komple DMEM'de yeniden biriktirin. Hücreleri 15 cm'lik bir plakada tohumlayın ve% 5 CO 2 ile 37 ° C'de kuluçkayayatırın.
- Hücre kültürü odasında tohumlama için hücreleri bir 15 cm plakadan üçe bölün.
- Hücreler % 80 birleştiğinde, ortamı aspire edin ve monolayer'ı bozmamak için plakayı 3 mL PBS ile hafifçe yıkayın. Ardından, PBS'yi aspire edin ve 3 mL tripsin ekleyin.
- Hücreler plakadan kaldırınceye kadar 37 °C'de 2 dakika kuluçkaya yatırın ve plakaya 7 mL komple DMEM ekleyerek tripsin nötralize edin.
- Tüm ortamları ve hücreleri 15 mL'lik bir tüpte toplayın ve 5 dakika boyunca 500 x g'da santrifüj yaparak hücreleri peletlayın.
- Süpernatantı 15 mL tüpten epire edin ve hücre peletini 3 mL'lik komple DMEM'de yeniden süzülür. 20 mL komple DMEM içeren her 15 cm plakaya 1 mL ekleyin; hücreleri eşit olarak dağıtmak için plakaları hafifçe sallayın ve% 5 CO 2 ile 37 ° C'de kuluçkayayaslayın.
- Hücreler %80 birleştiğinde, 1.4.1 ve 1.4.2 adımlarını yineleyin. Süpernatantları 50 mL konik tüplerde toplayın ve hücrelerin homojen olduğundan emin olmak için tüpü hafifçe ters çevirin.
- Hücre örneklerinin 10 μL'lik kısmını 10 μL trippan mavisi ile karıştırarak ve karışımı hücre sayma slaydına ekleyerek hücre yoğunluğunu belirleyin.
- Hücre kültürü odasını (6360 cm2yüzey alanı) tohumlamak için gerekli hücre süspansiyonu ile 1 X 104 hücre/cm2ile 1 L önceden ısıtılmış komple DMEM karıştırın. Hücre karışımını hücre kültürü odasına dökün ve hücreleri her bir monolayer boyunca eşit olarak dağıtmak için hafifçe döndürün (Şekil 1) ve% 5 CO 2 ile 37 ° C'de kuluçkaya yatırın.
- Hücre kültürü odasına ek olarak, izdiah için referans olarak 1 x 104 hücre/cm2 ile 15 cm'lik bir plakayı plakalayın.
- ~65-h inkübasyonu takiben, referans plakasını konfluens-ideal olarak ~%80-%90 konfluent için kontrol edin.
NOT: 37 °C'de hücre kültürü odasına eklemek için önceden ısınan komple DMEM.
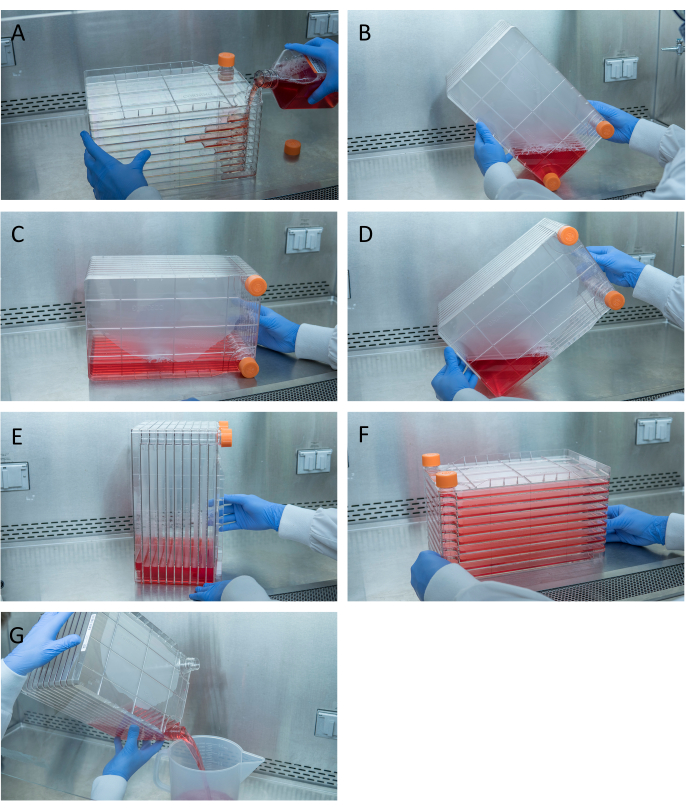
Şekil 1: Hücre tohumlama ve transfection için hücre yığınının manevrası. Hücre yığınının tohumlenmesi için, havalandırma kapaklarından birini çıkararak ve gerekli miktarda HEK293 hücresi (A) ile önceden ısıtılmış 1 L komple DMEM dökerek başlayın. Her iki havalandırma kapağını da sıkarak hücreleri ve medyayı eşit olarak dağıtın ve tüm ortamları havalandırma kapaklarından biriyle hücre yığınının köşesine getirin ve bu köşeye (B) yerleştirin, hücre yığınını yan (C) yerleştirin ve ardından hücre yığınını 90 ° (D) çevirin, böylece havalandırma bağlantı noktaları (E). Hücre yığınını yavaşça normal yatay konumuna dirilt ve hücre yığınının tüm odacıklarının tamamen ortamla(F)kaplı olduğundan emin olun. Transfecting yaparken, her iki havalandırma kapağını da sökün ve hücrelerin monolayerini(G)rahatsız etmemek için bile akış için eski medyayı yavaşça atık steril bir atık kabına dökün. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Polietilenimin (PEI)/DNA karışımını 3:1 (w/w) konsantrasyon oranında hazırlayın.
- 3:1 pHelper:pTrangene oranı oluşturmak için 40 mL'ye 475 μg pTrangene ve 1425 μg pHelper ekleyerek DNA karışımını 50 mL konik bir tüpte hazırlayın.
NOT: PEI/DNA karışımı hesap makinesi Tablo 2kullanılarak bulunabilir. - Azaltılmış serum ortamına ve DAMLA YÖNÜNDE DNA karışımına 5,7 mL PEI (1 g/L) ekleyin. Daha sonra, girdap kısa bir süre ve oda sıcaklığında 10 dakika kuluçkaya yaslanın.
NOT: PEI/DNA oda sıcaklığında kuluçkaya yatırarken, hafif bulutlu olacaktır.
- 3:1 pHelper:pTrangene oranı oluşturmak için 40 mL'ye 475 μg pTrangene ve 1425 μg pHelper ekleyerek DNA karışımını 50 mL konik bir tüpte hazırlayın.
- 8 dakikalık PEI/DNA inkübasyonundan sonra, medyayı hücre kültürü odasından çıkarın.
NOT: Hücrelerin yerinden olmasını önlemek için ortamın düzgün akışını sağlamak için her iki turuncu kapağı da gevşetmeyi unutmayın. - Önceden ısıtılmış 1 L komple DMEM'e PEI/DNA ekleyin ve karışımı yavaşça hücre kültürü odası bağlantı noktasına dökün. Sıvıyı tüm sıralara eşit olarak dağıtın (Şekil 1) ve % 5 CO 2 ile 37 ° C'de 72 saat kuluçkayayatırın.
2 Transkfected HEK293 hücrelerinin AAV ve kimyasal lizizinin toplanması
- Ortam yerinden çıkan hücrelerden bulutlu görünene kadar hücreleri yerinden çıkarmak için hücre kültür odasını kuvvetlice sallayın ve dört 500 mL santrifüj tüpüne dökün.
- Hücreleri peletmek için 4 °C'de 30 dakika boyunca tüpleri 18.000 x g'da santrifüj edin. Netleştirilmiş süpernatantı 1 L polietilen tereftalat kokart (PETG) şişesine dökün.
NOT: Yüksek hızlı bir santrifüje erişimi yoksa, 40 dakika boyunca 12.000 x g'da santrifüj. Peletlenmiş hücreler bu hızda katı olmayabilir ve süpernatant dökülürken kayar. - Hücre peletlerini 500 mL santrifüj tüplerinde 50 mL lizis tamponu ile yeniden satın ve 37 °C'de 60 dakika kuluçkaya yatırın.
- Tüpleri 30 dakika boyunca 18.000 x g'da santrifüj edin ve ardından süpernatantı aynı 1 L PETG şişesine aktarın. Peletlenmiş hücre kalıntılarını atın.
NOT: Netleştirilmiş süpernatantı hemen arındırın ve 4 °C'de 72 saate kadar saklayın. Daha uzun süreli depolama için -80 °C'de saklayın. -20 °C'de saklamayın.
3 Heparin benzeşim kromatografisi kullanılarak AAV Vektör saflaştırması
- Ham maddeyi -80 °C'den çıkarın ve erimek için gece boyunca 4 °C'de bırakın. Çözdükten sonra, ham lisatı filtrelemek için 0,22 μM filtre kullanın.
- Santrifüj konsantratörü devre dışı bırakmak için, kullanılan her heparin sepharose sütunu için bir santrifüj konsantratörüne 4 mL filtre ön işlem tamponu ekleyin. Santrifüj konsantratörü oda sıcaklığında 2-8 saat boyunca geçirin. Temizleme adımlarını atmadan hemen önce pasivasyonu ayarlayın.
- Boruyu ve pompayı ayarlayın (Şekil 2).
- Boruyu peristaltik bir pompaya yerleştirin ve 20 mL 1 M NaOH çalıştırın. Daha sonra, 50 mL moleküler dereceli su çalıştırın ve ardından 50 mL bazal DMEM çalıştırın.
- Boruya 5 mL heparin sepharose kolonu takın ve koruyucuyu çıkarmak için 25 mL bazal DMEM çalıştırın.
- Filtrelenmiş ham maddeden 0,2 μM'lik bir akış hızıyla sütundan 1-2 damla/sn hızla çalıştırın.

Şekil 2: AAV saflaştırması için peristaltik pompa için ayarlayın. Boruyu ham lisattan peristaltik pompadan ve heparin matris kolonuna çalıştırın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
NOT: Kabarcıkları tanıtmamaya veya sütunun kuru çalışmasına izin vermediğinden emin olun, çünkü bu sütunu tehlikeye atacak ve AAV'nin yayılmasını önleyecektir. Kuru çalışıyorsa sütunu atın ve ham lisatın geri kalanı için yeni bir sütun kullanın.
- Tüm ham lisatları heparin sütununa yükleyin ve sütunu yıkamak için aşağıdaki çözümleri kullanın.
- Mg2+ ve Ca 2+ olmadan 50 mL 1x Hank'in Dengeli Tuz Çözeltileri (HBSS) kullanarakyıkayın.
- Mg 2+ ve Ca2+olmadan HBSS'de 15 mL %0,5 N-Lauroylsarcosine kullanarak yıkayın.
- Mg 2+ veCa2+ olmadan 50 mL HBSS kullanarak yıkayın.
- Mg2+ ve Ca2+ ile 50 mL HBSS kullanarak yıkayın
- Mg2+ ve Ca 2+ ile 50 mL 200 mM NaCl / HBSS kullanarakyıkayın.
- Mg 2+ ve Ca 2+ ile 300 mM NaCl/HBSS ile 5 x5 mL (toplam25 mL) elute edin ve elutionları E1-E5 olarak etiketlenin (her elution 5 mL'dir).
- Santrifüj konsantratörü kullanarak virüsü konsantre etme
- Ön işlem tamponu içeren santrifüj konsantratörü 2 dakika boyunca 900 x g'da döndürün. Akışa geç.
- Santrifüj konsantratör filtresini Mg2+ ve Ca 2+ ile 4 mL HBSS ile yıkayın ve2 dakika boyunca 1000 x g'da santrifüj; akış atmasını atın.
- E2 elution'ı santrifüj konsantratörüne ekleyin. 5 dakika boyunca 1000 x g'da döndürün ve akışı atın.
- E2 eklemeyi bitirin ve ardından santrifüj konsantratörüne E3 ekleyin ve konsantre virüs yaklaşık 1 mL olana kadar 5 dakika boyunca 1000 x g'da döndürün.
NOT: Vektörü, ses düzeyi filtre düzeyinin altında olacak şekilde santrifüjlemekten kaçının. E1, E4 veya E5'i santrifüj konsantratöründe yoğunlaştırmayın, çünkü çok az vektör içerirler ve kirleticiler içerirler. - Konsantre virüsü p200 filtreli bir uç kullanarak santrifüj konsantratöründen çıkarın ve steril 1,5 mL santrifüj tüpüne yerleştirin.
- Kalan AAV'leri filtreden çıkarmak için santrifüj konsantratörü Mg 2+ ve Ca2+ ile200 μL HBSS ile durulayın. Pipet, zara yapıştığı herhangi bir virüsü yerinden çıkarmak ve virüsün geri kalanıyla birlikte 1,5 mL santrifüj tüpüne yerleştirmek için güçlü bir şekilde birden fazla kez (~30 s için) yukarı ve aşağı. Tüpü iyice karıştırın.
- DNA ekstraksiyonları için Aliquot 5 μL ve saflaştırılmış vektörü -80 °C'de saklayın.
- Sütunu 25 mL 2 M NaCl kullanarak yıkayın. Ayrıca, sütunu yıkamak için önceden 37 °C'ye ısıtılmış% 0,1 Triton X-100'ün 25 mL'sini kullanın. Daha sonra, kolonu 50 mL steril dH2O kullanarak yıkayın ve ardından% 20 etanol 25 mL kullanarak yıkayın.
- Sütun zarın% 20 etanolde tamamen doygun olduğundan emin olun, çünkü bu depolama çözümüdür. Sütunu sağlanan fişlerle kapatın ve 4 °C'de saklayın.
- Boruyu 1 M NaOH'da saklayın.
NOT: Düzgün temizlenirse, heparin sepharose sütunları beş kata kadar yeniden kullanılabilir.
4 AAV genomik DNA ekstraksiyonu
- Tablo 3'te belirtilen reaksiyon karışımını DNase tedavisi için bir PCR tüpünde hazırlayın.
| Parça | Hacim |
| Saflaştırılmış AAV vektörü | 5 μL |
| 10x DNase Arabelleği | 2 μL |
| DNase | 1 μL |
| ddH2O | 12 μL |
| Son Ses Düzeyi | 20 μL |
Tablo 3: DNase tedavi master mix formülü. DNA ekstraksiyonu sırasında AAV viral vektörlerinin DNaz tedavisi için önerilen bileşenler ve hacimler.
- İçeriği aşağı döndürmek için PCR tüpünü karıştırmak ve nabızlamak için PCR tüpünü girdaplayın.
- Bir termosikler kullanarak, 37 °C'de 20 dakika kuluçkaya yatırın ve ardından 15 dakika boyunca 75 °C'yi kullanarak DNase'yi ısıtarak etkisiz hale getirin.
- 5 μL Proteinaz K ekleyin.
- Bir termosikler kullanarak, Proteinaz K'yi ısıtmak için 60 dakika boyunca 50 ° C'de ve ardından 95 ° C'de 30 dakika kuluçkaya yatırın.
- Olası kirleticileri çıkarmak için DNA temizleme kiti kullanın.
NOT: Bu adım, piyasada bulunan bir kan ve doku temizleme kiti(Malzeme Masası)kullanılarak gerçekleştirildi.- DNase/Proteinaz K tedavi vektörünü içeren PCR tüpüne 200 μL AL tamponu (Kan ve doku temizleme kiti, Malzeme Masası)ekleyin.
- PCR tüpünü girdap edin ve bir termosikler içinde 10 dakika boyunca 56 °C'de kuluçkaya yatırın.
- PCR tüpündeki sıvıyı bir toplama tüpünde oturan steril bir spin sütununa pipetlayın.
- Sütuna 200 μL% 100 etanol ekleyin ve girdapla iyice karıştırın.
- 1 dakika boyunca 6.000 x g'da santrifüj ve akışı atın.
- Spin sütununa 500 μL tampon AW1 (Kan ve doku temizleme kiti, Malzeme Masası)ekleyin.
- 1 dakika boyunca 6.000 x g'da santrifüj ve akışı atın.
- Spin sütununa 500 μL tampon AW2 (Kan ve doku temizleme kiti, Malzeme Masası)ekleyin.
- 3 dakika boyunca 15.000 x g'da santrifüj ve akışı atın.
- Spin sütununu steril bir 1,5 mL santrifüj tüpüne yerleştirin ve doğrudan spin sütunu zarına 200 μL tampon AE (Kan ve doku temizleme kiti, Malzeme Masası)ekleyin.
- Oda sıcaklığında 1 dakika kuluçkaya yatır.
- DNA'yı vermek için 1 dakika boyunca 6.000 x g'dasantrifüj.
- DNA'yı -20 °C'de saklayın.
5 Nicel polimeraz zincir reaksiyonu ve Simian Virus 40 (SV40) probu kullanılarak AAV vektör genomlarının titrasyonu
NOT: Harici DNA kirlenmesini önlemek için filtrelenmiş pipet uçlarını kullanarak tüm qPCR çalışmalarını bir PCR davlumbazında gerçekleştirin. AAV genom bir SV40 polyA dizisini kodlamazsa, başka bir yerde açıklanan ITR'ye karşı bir prob kullanın25. Standart olarak seçilen plazmid DNA'sının SV40 polyA dizisi içerdiğinden emin olun.
- Stok standardı hazırlama
- Stok plazmid DNA standardını (SV40 poliA dizisi içeren pTransgene plazmid) 10 μg/μL'lik son konsantrasyona seyreltin ve 6 μL aliquots içinde -20 °C'de saklayın.
- Aşağıdaki çevrimiçi hesap makinesini kullanarak plazmid DNA standardında bulunan kopya numarasını belirleyin26.
NOT: Kaliteyi ve doğru konsantrasyonu sağlamak için ticari bir satıcı tarafından üretilen standart için kullanılan plazmid DNA kullanın. Yeni hazırlanmış bir standarda geçiş yaparken köprüleme çalışmaları yapmak için büyük miktarda standart (örneğin, 10 mL) hazırlayın.
- Tablo 4'te belirtilen aşağıdaki reaktif karışımını 1,5 mL santrifüj tüpünde hem numuneler hem de standart için hazırlayın.
NOT: Yeterli ana karışım fazlalık hazırlayın. Astar/prob dizileri için Tablo 5'e bakın.
| Parça | Hacim |
| Evrensel qPCR ana karışımı (2X) | 10 μL |
| Moleküler sınıf su | 4,5 μL |
| 40x SV40 polyA astar/prob | 0,5 μL |
| Son Ses Düzeyi | 15 μL |
Tablo 4: AAV titrasyon için qPCR ana karışımı. AAV viral vektörlerinden çıkarılan DNA'nın qPCR'si için önerilen bileşenler ve hacimler.
| Parça | Sıra |
| İleri astar | 5'-AGCAATAGCATCAAATTTCACAA-3' |
| Ters astar | 5'-CCAGACATGATAAGATACATTGATGAGTT-3' |
| Sonda | /56-FAM/AGCATTTTT/Zen/TTCACTGCATTCTAGTTGTGGTTTGTTTGTC/3IABkFQ |
Tablo 5: SV40 polyA DNA dizisine karşı astar dizileri. SV40 polyA dizisini içeren AAV viral vektörlerinin belirli alanlarına bağlanan qPCR titrasyon için kullanılan astarların ve probun dizileri.
- Pipet ana karıştırmak için yukarı ve aşağı karıştırın.
- Seyreltme plakasını kurun.
- Standart ve numune seyreltmeleri hazırlamak için net bir 96 kuyu plakası kullanın, sütun 1'den (sütun 1, 3, 5, 7, 9 ve 11) başlayarak diğer her sütuna 45 μL moleküler dereceli su ekleyin.
- Kuyu A1'e standardın 5 μL'sini ve karıştırmak için pipet ekleyin.
- Kuyu A1'den B1'e 1/10 seyreltme oluşturmak için yeni bir filtrelenmiş pipet ucu kullanın.
- G1'e ulaşana kadar sütundan aşağı doğru bir dizi 10 kat seyreltme devam edin.
- H1'e eklemeyin, çünkü bu negatif bir kontrol görevi görecektir.
- İlk numuneyi (S1) iyi bir A3'e ekleyerek uygulayın ve 1/10 seyreltme oluşturur. Pipet bu karışımı ve transfer 5 μLto kuyu B3. Bu aktarımdan sonra pipet ucunu atın.
- Yeni bir pipet ucu ile çözeltiyi iyice B3'te karıştırın ve 1/100 seyreltme oluşturur. 5 μBu karışımı iyi C3'e aktarın ve transferden sonra ucu atın.
- Yeni bir pipet ucu ile pipet, 1/1000 seyreltme yapmak için çözeltiyi iyi C3'te yukarı ve aşağı. Ucu atın.
- 2, 4, 6, 8, 10 veya 12 sütunlarına örnek eklemeden örnekleri seyreltmeye devam edin.
- Tüm numuneler seyreltildikten sonra, içeriği sütun 1 kuyularında karıştırın ve ardından 20 μL'yi sütun 2'ye aktarın.
- Her standart ve örnek seyreltmenin çoğaltmalarını oluşturmak için 3, 5, 7, 9 ve 11 sütunları için bunu yineleyin. Plaka düzeni için Şekil 3'e bakın.
NOT: Şekil 3'teplaka kurulumünü takip ederken, G ve H sıralarında seyreltilmiş numuneler sadece 1/10 ve 1/100 seyreltmelere sahip olacaktır.
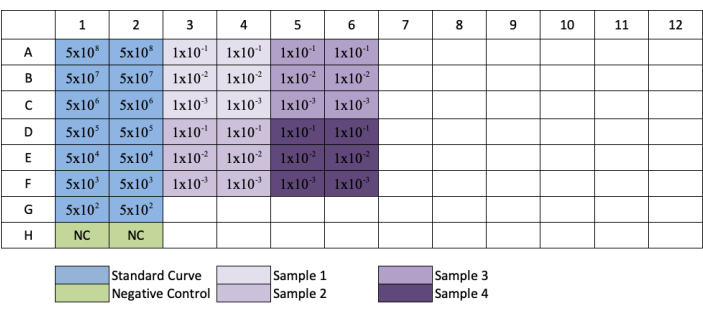
Şekil 3: qPCR AAV titrasyon için plaka düzeni. Mavi, standardın seri seyreltilmesinin yerleşimini gösterir; yeşil, negatif kontrolün yerleşimini gösterir; mor, numunelerin seyreltilmesinin yerleşimini gösterir. Her standart, negatif veya örnek replicate olarak eklenir. Standardın seyreltme serisini göstermek için standardın konsantrasyonu için bir örnek eklenmiştir ve numune seyreltmelerinin yerleştirilmesi ilgili kuyularına eklenmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- SV40 polyA algılama tabanlı qPCR ile titrasyon
- Beyaz yarı etekli 96 kuyulu qPCR plakanın her kuyusuna 15 μL qPCR ana karışımı ekleyin.
- Her numunenin 5 μL'sini şeffaf 96 kuyu plakasından beyaz yarı etekli 96 kuyu qPCR plakaya aktarın.
- qPCR ana karışımının ve örneğinin yeterli karıştırılmasını sağlamak için çok kanallı bir pipet kullanın.
- Plakayı bir sızdırmazlık filmi ile kapatın ve qPCR plakasını 30 s için 1500 x g'da santrifüjleyin.
- QPCR reaksiyonu plaka tabanlı gerçek zamanlı PCR amplifikasyon ve algılama cihazında, Tablo 6'daönerilen koşulları kullanarak çalıştırın.
| Bölüm | Döngü | Saat | Sıcaklık | Tarif |
| Ön kuluçka | 1x | 5 dk | 95 °C | DNA denatürasyonu. |
| Amplifikasyon | 38x | 15 sn | 95 °C | DNA'nın amplifikasyonu. Farklı tavlama sıcaklıklarına sahip alternatif astarlar kullanıyorsanız ayarlar değiştirilebilir. |
| 60 sn | 60 °C | |||
| Soğutma | 1x | 60 sn | 40 °C | Plaka Soğutma. Koşunun sonu. |
Tablo 6: Hidroliz prob bazlı qPCR titrasyon için termosikler protokolü. Saflaştırılmış AAV vektörlerinin çıkarılan DNA'nın prob bazlı qPCR titrasyonunun kullanımı için önerilen termosikler protokolü.
NOT: qPCR AAV titrasyon çalışma sayfası için bkz.
- AAV genom kopya numaralarını belirlemek için veri analizi.
- Elektronik tablo veri hücrelerini (Tablo 7A) hem standart hem de örnek seyreltmeler için qPCR çalıştırmasından elde edilen konsantrasyon değerleriyle doldurun.
- Standart bir eğri (Tablo 7B) üretmek için Tablo 7A'dan konsantrasyon değerlerini kullanın.
NOT: Standart eğri, R2 verimliliği ile birlikte doğal logaritma (y = a ln(x) + b) olarak gösterilecektir. Standart bir eğrinin %100'e yakın, R 2'nin ise1,0'a (≥0,99) yakın bir verimliliğe sahip olması gerekir. - Bu çevrimiçi hesap makinesini doldurarak eğim verimliliğini doldurun27.
NOT: %90-%110 arasında bir verimlilik kabul edilebilir. qPCR'nin verimliliği bu aralığın dışındaysa, qPCR'yi yeniden çalıştırın. - Her numunenin seyreltmelerini ortalamak ve her numunenin standart sapmasını belirlemek için Tablo 7A'dan konsantrasyon değerlerini kullanın (Tablo 7C).
NOT: Örnek seyreltmelerin ortalamasından birden fazla standart sapma olan numunelerden seyreltmeleri hariç tutun. - Her seyreltmenin ortalama konsantrasyonunu kullanarak, seyreltme faktörü ile çarpın ve ardından her numunenin vektör genomlarını (vg)/μL almak için beşe bölün (Tablo 7C).
- Her numunenin konsantrasyonlarının ortalamasını 80.000(Tablo 7C)ile çarparak her numunenin vg/mL'sini hesaplayın.
- Her numunenin son vg/mL'sini üretmek için her seyreltmenin vg/mL ortalamasını(Tablo 7C).
NOT: Kullanıcı, qPCR çalışmasının vg/μL'deki konsantrasyonu üretmesi için her kuyuya yüklenen 5 μL'yi hesaba katmak için her seyreltmenin ortalama konsantrasyonunu beş faktöre bölmelidir. Her numunenin ortalama konsantrasyon değerinden vg/mL'ye geçiş için 80.000 hesap faktörü. İlk olarak, astar-prob seti sadece pozitif duyusal, tek iplikli DNA'yı (ssDNA) ölçtğünden ve AAV genomu pozitif ve negatif duyu ssDNA25,28arasında yaklaşık 1:1 oranında bulunduğundan, tek iplikli genomları hesaba katmak için her örneğin konsantrasyon değerinin ortalaması 2 ile çarpılmalıdır. Numune seyreltmenin 5 μL saflaştırılmış vektörden (bölüm 4.1) 200 μL'ye (bölüm 4.6.12) hesaplanması için her numunenin konsantrasyon değerinin ortalaması x40 ile çarpılmalıdır. Son olarak, vg/μL'den vg/mL'ye dönüştürmek için her numunenin konsantrasyon değerinin ortalaması x1000 ile çarpılmalıdır.
6 Vektör kalitesi ve saflığının değerlendirilmesi
- Kalite Kontrol - Batı Blot
- %12 SDS PAGE jel hazırlayın.
- Poliakrilamid jel elektroforez gerçekleştirin.
NOT: Kuyu başına 6 x 1010 vg numune yükleyin. - Proteinleri polivinylidene difluoride (PVDF) membranına aktarın.
- PVDF membranlarını engelleme
- Membranı transfer cihazından çıkarın ve gevşek akrilamidi çıkarmak için% 0.1 PBST'de durulayın.
- Membranı oda sıcaklığında en az 1 saat veya gece boyunca 4 °C'de blokaj çözeltisine yerleştirin.
NOT: Blokaj tamponu% 2 keçi serumu ile daha da desteklenebilir.
- Primer antikor ile inkübasyon
- Blokaj tamponunu deklare edin ve 1:200 seyreltmede bir anti-AAV fare monoklonal antikoru olan birincil antikoru ekleyin.
- 4 °C'de gece boyunca kuluçkaya yaslanın.
- Birincil antikoru dekantasyona sokun ve oda sıcaklığında 5 dakika boyunca% 0.1 PBST ile beş kez ajitasyonla yıkayın.
- İkincil antikor ile inkübasyon
- Yıkama çözeltisini dekantasyona ekleyin ve hrp konjuge ikincil antikor ekleyin, blokaj tamponunda 1:7500'de seyreltilir ve ajitasyon ile oda sıcaklığında 1 saat kuluçkaya yaslanır.
- İkincil antikorun dekontunu haline haline alıp oda sıcaklığında 5 dakika boyunca %0,1 PBST ile beş kez ajitasyonla yıkayın.
- Ajitasyon ile oda sıcaklığında PBS ile son bir yıkama gerçekleştirin.
- Gelişmiş chemiluminescent (ECL) substrat kullanarak proteinleri tespit edin.
- Viral proteinleri (VP1, VP2 ve VP3 alt birimleri) görselleştirmek için jeli görüntüleyin (Şekil 4).

Şekil 4: AAV kapsid proteinlerini gösteren batı lekesi. A Şeridi; MW merdiven, Lane B; AAV6.2FF-hIgG01, C Şeridi; AAV6.2FF-hIgG02, Şerit D; AAV6.2FF-hIgG03 ve Lane E; AAV6.2FF-hIgG04. Her AAV6.2FF-hIgG'nin 6 x10 10 vg'si kendi şeritlerine yüklendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Saflık Kontrolü - SDS PAGE ve Coomassie Lekesi
- Adım 6.1.1 ve 6.1.2'den açıklandığı gibi SDS PAGE jel ve örnekleri hazırlayın.
- Jeli 1 saat veya bir gecede hafif ajitasyonla sabitleme çözeltisinde sabitle. Sabitleme çözümünü ilk saat içinde bir kez değiştirin.
- Jeli hafif ajitasyonla 2-4 saat boyama çözeltisinde lekelenin.
- Jeli bir destaining çözeltisi ile destain. Jelin arka planı tamamen çözülene kadar (4-24 saat) destaining çözeltisini birkaç kez yeniler.
- Destained jel bir depolama çözümünde saklayın.
- Coomassie boyama çözeltisi ile lekelenmiş tüm proteinleri görselleştirmek için jeli görüntüleyin.
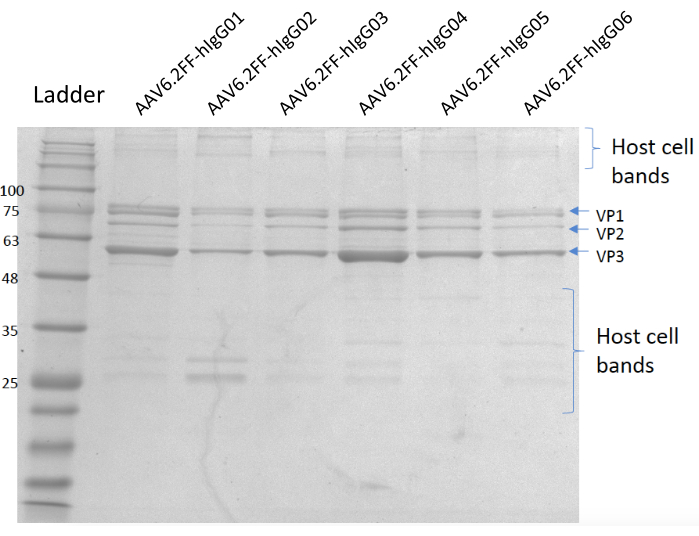
Şekil 5: Coomassie lekeli jel. A Şeridi; MW merdiven, Lane B; AAV6.2FF-hIgG01, C Şeridi; AAV6.2FF-hIgG02, Şerit D; AAV6.2FF-hIgG03, E Şeridi; AAV6.2FF-hIgG04, Şerit F; AAV6.2FF-hIgG05 ve Lane G; AAV6.2FF-hIgG06. Her AAV6.2FF-hIgG'nin 6 x10 10 vg'si kendi şeritlerine yüklendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Alternatif saflık kontrolü tahlil - HEK293 konak hücre proteini tespiti ELISA
- Hek293 ana hücre proteini algılamasını, üreticinin talimatlarına göre ELISA üzerinden gerçekleştirin.
NOT: Saflaştırılmış rAAV numuneleri için 5 x10 -2 ve 1 x10 -3 seyreltmeler kullanın. Kuyuya TMB eklendikten sonra ışıktan uzak durun. Doğrusal regresyon sonuçları çözümlemek için kullanılamaz. - Bilinmeyen konsantrasyonlarını enterpolasyonlamak ve orijinal numune konsantrasyonunu belirlemek için seyreltme faktörüyle çarpmak için noktadan noktaya analiz, kübik spline veya dört parametreli lojistik uyum yöntemi gerçekleştirin.
- Hek293 ana hücre proteini algılamasını, üreticinin talimatlarına göre ELISA üzerinden gerçekleştirin.
Sonuçlar
Küçük kemirgen modellerinden daha büyük hayvan modellerine ve nihai klinik uygulamaya çeviri, daha büyük hayvanları transdüze etmek ve terapötik etkiler elde etmek için gereken büyük miktarda AAV nedeniyle önemli bir zorluk ortaya sömektedir. Rasyonel olarak tasarlanmış AAV6.2FF kapsidinin transdüksiyon verimliliğini karşılaştırmak için, daha önce AAV63'ekıyasla murine kas hücrelerinde transdüksiyon verimliliğinde 101 kat artış gösterdi, fareler, hamsterlar ve kuzu...
Tartışmalar
Bu makalede açıklanan rekombinant AAV (rAAV) vektörlerinin üretimi, moleküler biyoloji araştırma laboratuvarlarının ve tesislerinin çoğunda bulunan ortak malzemeler, reaktifler ve ekipmanlar kullanmaktadır. Bu makale, okuyucu tarafından yüksek kaliteli in vitro ve in vivo sınıf rAAV üretilmesini sağlar. Her şeyden önce, rAAV üretimi için bu protokol, sezyum klorür saflaştırmayı içeren daha sıkıcı protokollere kıyasla verimlidir ve ultrasantrifüj kullanımını önler. HEK...
Açıklamalar
Sarah K. Wootton, AAV6.2FF kapsid için US10806802B2 abd patenti üzerinde bir mucittir.
Teşekkürler
Amira D. Rghei, Brenna A. Y. Stevens, Sylvia P. Thomas ve Jacob G. E. Yates, Ontario Veteriner Koleji Öğrenci Burslarının yanı sıra Ontario Lisansüstü Bursları'nın da sahibiydi. Amira D. Rghei, Mitacs Accelerate Studentship'in alıcısıydı. Bu çalışma Kanada Sağlık Araştırmaları Enstitüleri (CIHR) Proje Hibesi (#66009) ve SKW'ye İşbirlikçi Sağlık Araştırma Projeleri (NSERC ortaklı) hibesi (#433339) tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore Sigma | S2GPU05RE | |
| 0.25% Trypsin | Fisher Scientific | SM2001C | |
| 1-Butanol | Thermo Fisher Scientific | A399-4 | CAUTION. Use under a laminar flow hood. Wear gloves |
| 10 chamber cellstack | Corning | 3271 | |
| 1L PETG bottle | Thermo Fisher Scientific | 2019-1000 | |
| 30% Acrylamide/Bis Solution | Bio-Rad | 1610158 | |
| 96-well skirted plate | FroggaBio | FS-96 | |
| Adhesive plate seals | Thermo Fisher Scientific | 08-408-240 | |
| Ammonium persulfate (APS) | Bio-Rad | 161-0700 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Blood and Tissue Clean up Kit | Qiagen | 69506 | Use for DNA clean up in section 4.6 of protocol |
| Bromophenol blue | Fisher Scientific | B392-5 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Cell Culture Dishes | Greiner bio-one | 7000232 | 15 cm plates |
| Culture Conical Tube | Thermo Fisher Scientific | 339650 | 15 mL conical tube |
| Culture Conical Tube | Fisher Scientific | 14955240 | 50 mL conical tube |
| Dulbecco's Modified Eagle Medium (DMEM) with 1000 mg/L D-glucose, L-glutamine | Cytiva Life Sciences | SH30022.01 | |
| ECL Western Blotting Substrate | Thermo Fisher Scientific | 32209 | |
| Ethanol | Greenfield | P016EA95 | Dilute ethyl alcohol(95% vol) to 20% for section 3.7.4 and 70% for section 6.1.1.1 |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | SH30396.03 | |
| Glacial acetic acid | Fisher Scientific | A38-500 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Glycerol | Fisher Scientific | BP229-1 | |
| Glycine | Fisher Scientific | BP381-500 | |
| HBSS with Mg2+ and Ca2+ | Thermo Fisher Scientific | SH302268.02 | |
| HBSS without Mg2+ and Ca2+ | Thermo Fisher Scientific | SH30588.02 | |
| HEK293 cells | American Tissue Culture Collection | CRL-1573 | Upon receipt, thaw the cells and culture as described in manufacturer’s protocol. Once cells have been minimally passaged and are growing well, freeze a subfraction for future in aliquots and store in liquid nitrogen. Always use cells below passage number 30. Once cultured cells have been passaged more than 30 times, it is recommended to restart a culture from the stored aliquots |
| HEK293 host cell protein ELISA kit | Cygnus Technologies | F650S | Follow manufacturer’s instructions |
| Heparin sulfate column | Cytiva Life Sciences | 17040703 | |
| Kimwipe | Thermo Fisher Scientific | KC34120 | |
| L-glutamine (200 mM) | Thermo Fisher Scientific | SH30034.02 | |
| Large Volume Centrifuge Tube Support Cushion | Corning | CLS431124 | Support cushion must be used with large volume centrifuge tubes uless the centrifuge rotor has the approriate V-bottom cushions |
| Large Volume Centrifuge Tubes | Corning | CLS431123-6EA | 500 mL centrifuge tubes |
| MgCl2 | Thermo Fisher Scientific | 7791-18-6 | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | 1.5 mL microcentrifuge tube, sterilize prior to use |
| Molecular Grade Water | Cytiva Life Sciences | SH30538.03 | |
| N-Lauroylsarcosine sodium salt | Sigma Aldrich | L5125 | CAUTION. Wear gloves |
| NaCl | Thermo Fisher Scientific | BP35810 | |
| Optimem, reduced serum medium | Thermo Fisher Scientific | 31985070 | |
| Pasteur pipets | Fisher Scientific | 13-678-20D | Sterilize prior to use |
| PBS (10x) | Thermo Fisher Scientific | 70011044 | Dilute to 1x for use on cells |
| Penicillin-Streptomycin Solution | Cytiva Life Sciences | SV30010 | |
| pHelper plasmid | De novo design or obtained from plasmid repository | NA | |
| Pipet basin | Thermo Fisher Scientific | 13-681-502 | Purchase sterile pipet basins |
| Polyethylene glycol tert-octylphenyl ether (Triton X-100) | Thermo Fisher Scientific | 9002-93-1 | CAUTION. Wear gloves |
| Polyethylenimine (PEI) | Polyscience | 24765-1 | Follow manufacturer’s instructions to produce a 1L solution. 0.22μm filter and store at 4°C |
| Polypropylene semi-skirted PCR Plate | FroggaBio | WS-96 | |
| Polysorbate 20 (Tween 20) | Thermo Fisher Scientific | BP337-100 | CAUTION. Wear gloves |
| polyvinylidene difluoride (PVDF) membrane | Cytiva Life Sciences | 10600023 | Use forceps to manipulate. Wear gloves. |
| Primary antibody | Progen | 65158 | |
| Protein Ladder | FroggaBio | PM008-0500 | |
| Proteinase K | Thermo Fisher Scientific | AM2546 | |
| pTrangene plasmid | De novo design or obtained from plasmid repository | NA | Must contain SV40 polyA in genome to be compatible with AAV titration in section 5.0 |
| Pump tubing | Cole-Parmer | RK-96440-14 | Optimize length of tubing and containment of virus in fractions E1-E5 |
| RQ1 Dnase 10 Reaction Buffer | Promega | M6101 | Use at 10x concentration in protocol from section 4.0 |
| RQ1 Rnase-free Dnase | Promega | M6101 | |
| Sample dilutent | Cygnus Technologies | I700 | Must be purchased separately for use with HEK293 host cell protein ELISA kit |
| Secondary antibody, HRP | Thermo Fisher Scientific | G-21040 | |
| Skim milk powder | Oxoid | LP0033B | |
| Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 28312 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | SS266-4 | |
| SV40 polyA primer probe | IDT | Use sequence in Table X for quote from IDT for synthesis | |
| Tetramethylethylenediamine (TEMED) | Thermo Fisher Scientific | 15524010 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypan blue | Bio-Rad | 1450021 | |
| Ultra-Filter | Millipore Sigma | UFC810024 | Ultra-4 Centrifugal 10K device must be used, as it has a 10000 molecular weight cutoff |
| Universal Nuclease for cell lysis | Thermo Fisher Scientific | 88702 | |
| Universal qPCR master mix | NEB | M3003L | |
| Whatman Paper | Millipore Sigma | WHA1001325 | |
| β-mercaptoethanol | Fisher Scientific | 21985023 | CAUTION. Use under a laminar flow hood. Wear gloves |
| CAUTION: Refer to the Materials Table for guidelines on the use of dangerous chemicals. |
Referanslar
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: A golden anniversary of discovery, research, and gene therapy success-a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Nathwani, A. C., et al. Long-term safety and efficacy of factor IX gene therapy in hemophilia B. The New England Journal of Medicine. 371 (21), 1994-2004 (2014).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Ylä-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (10), 1831-1832 (2012).
- FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-novel-gene-therapy-treat-patients-rare-form-inherited-vision-loss (2020)
- FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease (2020)
- Statement from FDA Commissioner Scott Gottlieb, MD and Peter Marks, MD Ph.D., Director of the Center for Biologics Evaluation and Research on new policies to advance development of safe and effective cell and gene therapies. FDA Available from: https://www.fda.gov/news-events/press-announcements/statement-fda-commissioner-scott-gottlieb-md-and-peter-marks-md-phd-director-center-biologics (2020)
- Asokan, A., Schaffer, D. V., Samulski, R. J. The AAV vector toolkit: poised at the clinical crossroads. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (4), 699-708 (2012).
- Rose, J. A., Hoggan, M. D., Shatkin, A. J. Nucleic acid from an adeno-associated virus: chemical and physical studies. Proceedings of the National Academy of Sciences of the United States of America. 56 (1), 86-92 (1966).
- Lusby, E., Fife, K. H., Berns, K. I. Nucleotide sequence of the inverted terminal repetition in adeno-associated virus DNA. Journal of Virology. 34 (2), 402-409 (1980).
- Masat, E., Pavani, G., Mingozzi, F. Humoral immunity to AAV vectors in gene therapy: challenges and potential solutions. Discovery Medicine. 15 (85), 379-389 (2013).
- Ling, C. Enhanced Transgene Expression from Recombinant Single-Stranded D-Sequence-Substituted Adeno-Associated Virus Vectors in Human Cell Lines In Vitro and in Murine Hepatocytes In Vivo. Journal of Virology. 89 (2), 952-961 (2014).
- Cathomen, T., Stracker, T. H., Gilbert, L. B., Weitzman, M. D. A genetic screen identifies a cellular regulator of adeno-associated virus. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 14991-14996 (2001).
- McCarty, D. M. Self-complementary AAV vectors; advances and applications. Molecular Therapy. 16 (10), 1648-1656 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of aav serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PLOS One. 8 (9), 76310 (2013).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Pillay, S., et al. Adeno-associated virus (AAV) serotypes have distinctive interactions with domains of the cellular AAV receptor. Journal of Virology. 91 (18), (2017).
- Merkel, S. F. Trafficking of adeno-associated virus vectors across a model of the blood-brain barrier; a comparative study of transcytosis and transduction using primary human brain endothelial cells. Journal of Neurochemistry. 140 (2), 216-230 (2017).
- van Lieshout, L. P., et al. A novel triple-mutant AAV6 capsid induces rapid and potent transgene expression in the muscle and respiratory tract of mice. Molecular Therapy. Methods & Clinical Development. 9, 323-329 (2018).
- Wu, Z., Asokan, A., Grieger, J. C., Govindasamy, L., Agbandje-McKenna, M., Samulski, R. J. single amino acid changes can influence titer, heparin binding, and tissue tropism in different adeno-associated virus serotypes. Journal of Virology. 80 (22), 11393-11397 (2006).
- Liu, J., Moon, Y. -. A. Simple purification of adeno-associated virus-DJ for liver-specific gene expression. Yonsei Medical Journal. 57 (3), 790-794 (2016).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adeno-associated virus vectors. Human Gene Therapy. 9 (18), 2745-2760 (1998).
- Kimura, T., et al. Production of adeno-associated virus vectors for in vitro and in vivo applications. Scientific Reports. 9 (1), 13601 (2019).
- Aurnhammer, C., et al. Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences. Human Gene Therapy Methods. 23 (1), 18-28 (2012).
- . Paramyxoviridae: The viruses and their replication. Fields Virology Available from: https://www.scholars.northwestern.edu/en/publications/paramyxoviridae-the-viruses-and-their-replication (1996)
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Kaludov, N., Brown, K. E., Walters, R. W., Zabner, J., Chiorini, J. A. Adeno-associated virus serotype 4 (AAV4) and AAV5 Both require sialic acid binding for hemagglutination and efficient transduction but differ in sialic acid linkage specificity. Journal of Virology. 75 (15), 6884-6893 (2001).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Human Gene Therapy Methods. 26 (6), 228-242 (2015).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Frontiers in Microbiology. 10, 1570 (2019).
- Backovic, A., et al. Capsid protein expression and adeno-associated virus like particles assembly in Saccharomyces cerevisiae. Microbial Cell Factories. 11, 124 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır