Method Article
فحص الخصائص الهيكلية والديناميكية للهياكل النانوية دون الخلوية عن طريق التحليل الطيفي للتذبذب الزماني المكاني
In This Article
Summary
يتم تطبيق تحليل متوسط الإزاحة المربعة (iMSD) المشتق من التصوير على الماكروبينوسومات لتسليط الضوء على طبيعتها الجوهرية المتطورة زمنيا من حيث الخصائص الهيكلية والديناميكية. ثم تتم مقارنة Macropinosomes مع حبيبات إفراز الأنسولين (ISGs) كمرجع للهياكل دون الخلوية مع متوسط الخصائص الهيكلية / الديناميكية الثابتة زمنيا.
Abstract
يستخدم متوسط الإزاحة المربعة المشتق من التصوير (iMSD) لمعالجة الخصائص الهيكلية والديناميكية للهياكل النانوية دون الخلوية ، مثل الحويصلات المشاركة في الاتجار الداخلي / الإفرازي للمذابات والجزيئات الحيوية. يعتمد iMSD على التصوير القياسي بالفاصل الزمني ، وهو متوافق مع أي إعداد بصري ، ولا يحتاج إلى التركيز على كائنات فردية لاستخراج المسارات. من كل أثر iMSD ، يتم حساب ودمج ثلاثة أضعاف فريدة من متوسط المعلمات الهيكلية والديناميكية (أي الحجم والانتشار المحلي والمعامل الشاذ) لبناء "توقيع iMSD" للبنية النانوية قيد الدراسة.
تم إثبات فعالية هذا النهج هنا مع الحالة المثالية للماكروبينوسومات. تتطور هذه الحويصلات بمرور الوقت ، مما يغير متوسط حجمها وعددها وخصائصها الديناميكية التي تمر من المراحل المبكرة إلى المتأخرة من الاتجار داخل الخلايا. كعنصر تحكم ، يتم استخدام حبيبات إفراز الأنسولين (ISGs) كمرجع للهياكل دون الخلوية التي تعيش في حالة ثابتة يكون فيها متوسط الخصائص الهيكلية والديناميكية لجميع سكان الكائنات ثابتا في الوقت المناسب. يسلط تحليل iMSD الضوء على هذه الميزات الغريبة كميا ويمهد الطريق لتطبيقات مماثلة على المستوى دون الخلوي ، سواء في الحالات الفسيولوجية أو المرضية.
Introduction
تلعب الهياكل النانوية دون الخلوية (مثل الحويصلات الداخلية / الإفرازية والعضيات) دورا محوريا في تنظيم إشارات الخلايا1. يحدد الضبط السليم لخصائصها الهيكلية (مثل الحجم) و / أو الديناميكية (مثل الانتشار) كيفية استجابة الخلية للمحفزات الداخلية أو الخارجية2،3،4. بناء على هذه الأدلة ، ليس من المستغرب أن يتم العثور على تغييرات في هذه الخصائص في العديد من الحالات المرضية. وتشمل الأمثلة دور كثرة الخلايا الداخلية غير المنظمة في السرطان 2,3 ، والتغيرات الهيكلية والديناميكية الموجودة على مستوى ISGs في الخلايا β المعرضة لحالات مرض السكري من النوع2 5 ، وسوء تنظيم الخصائص الهيكلية والنقل الليزوزومية في حثل المادة البيضاء للخلايا الكروية أو داء الدهون galactosylceramide6 ، والاختلالات الوظيفية في المسار الداخلي الليزوزومي في الاضطرابات العصبية التنكسية (على سبيل المثال ، مرض الزهايمر)7.
في هذا السياق ، أثبت الباحثون مؤخرا أنه يمكن تحسين أداء طرق الفحص المجهري البصري القياسية من خلال ضبط دقة أخذ العينات المكانية والزمانية8 بشكل صحيح. وهذا بدوره قد يوفر مزيدا من التبصر في العمليات البيولوجية ذات الصلة. في الممارسة العملية ، أصبح ذلك ممكنا من خلال خوارزمية تحليل التقلبات الزمانية المكانية ، والتي تستخرج في وقت واحد متوسط الخصائص الهيكلية والديناميكية للأجسام المنتشرة مباشرة من المكدس القياسي لصور المجهر الضوئي دون أي حاجة إلى معرفة أولية حول الكائن البيولوجي ذي الأهمية واستخراج مسارات الجسم الواحد. يتم تضمين كل هذه المعلومات في إخراج واحد من الطريقة: تتبع iMSD9 (يتم إعطاء تفاصيل حول اشتقاق وتحليل تتبع iMSD في الملف التكميلي 1).
يتكون البروتوكول التجريبي الناتج من بضع خطوات. أولا ، يتم إجراء تصوير المنطقة ذات الاهتمام بدقة زمنية عالية. بعد ذلك ، يتم حساب متوسط وظائف الارتباط المكاني والزماني من كومة الصور. وأخيرا، من خلال التركيب الغاوسي لسلسلة دوال الارتباط، يتم الحصول على متوسط "قانون الانتشار" مباشرة من التصوير وتحليله للتعرف على وضع انتشار الكائن. وقد ثبتت بالفعل إمكانات هذه الطريقة لمجموعة متنوعة من الأجسام البيولوجية، بدءا من الجزيئات إلى الجسيمات النانوية وحتى العضيات/الهياكل تحت الخلوية بأكملها9،10،11،12،13،14،15.
تقدم هذه الورقة تقارير عن تطبيق iMSD على الماكروبينوسومات لتسليط الضوء على طبيعتها الجوهرية التي لا رجعة فيها والتي تتطور زمنيا من حيث متوسط خصائصها الهيكلية والديناميكية (أي على مستوى السكان بأكمله). علاوة على ذلك ، تتم مقارنة هذه الحويصلات الداخلية ب ISGs كمرجع للهياكل دون الخلوية في "حالة ثابتة" ، أي حالة يظل فيها متوسط الخصائص الهيكلية / الديناميكية لجميع سكان الحبيبات ثابتا في أي وقت من الأوقات. يحدد Macropinocytosis سلسلة من الأحداث التي بدأتها إعادة التنظيم الشامل (أو الكشكشة) لغشاء البلازما لتشكيل بنية خارجية ذات خلايا عمينية كبيرة يتم استيعابها بعد ذلك16. الماكروبينوسومات المشكلة في المراحل المبكرة تشبه إلى حد كبير البلعمة. في الوقت نفسه ، يمكن تمييزها عن الأشكال الأخرى من الحويصلات الداخلية بسبب حجمها الكبير المميز ، وعدم التجانس المورفولوجي ، ونقص هياكل معطف البروتين.
وكشفت الفحوص البيوكيميائية أنه عند الاستيعاب، يتم إثراء الماكروبينوسومات تدريجيا بعلامات البروتين لمسارات الخلايا الداخلية الأخرى، مما يشير بدوره إلى أن هوياتها تتغير باستمرار أثناء الاتجار17. باستخدام الأجسام المضادة ضد العلامات المعروفة للمسار الإندوسومي، ثبت أن الماكروبينوسومات تتبنى تدريجيا السمات الإندوسومية الكلاسيكية: فهي تتضاءل في الحجم، وتتطور إلى هياكل إندوسوماتيكية متأخرة (مثل الليزوسومات)، أو تفقد هويتها في نهاية المطاف عن طريق الاسترجاع بوساطة الغشاء لعلامات جزيئية محددة (على سبيل المثال، فرز الروابط)18،19 . السيناريو العام هو أن كل ماكروبينوسوم داخل الخلية يغير بشكل لا رجعة فيه هويته الهيكلية والديناميكية (وكذلك الجزيئية) أثناء الاتجار من غشاء البلازما إلى مصيره النهائي داخل الخلايا. ونتيجة لذلك ، فإن الخصائص الهيكلية / الديناميكية / الجزيئية لجميع سكان الماكروبينوسومات تتغير أيضا على طول نفس المسار الزمني. وبما أن طريقة iMSD حساسة في جوهرها لمتوسط خصائص جميع السكان من الأجسام المرصودة، فإنها تصور كميا "الطبيعة المتطورة" من خلال التحديد الكمي للمعلمات المتوسطة الرئيسية، أي الانتشار المحلي والمعامل الشاذ (الخصائص الديناميكية) ومتوسط حجم الماكروبينوسومات (الخاصية الهيكلية) في أي مرحلة من مراحل الاتجار بها داخل الخلايا.
وللمقارنة، أجريت قياسات مماثلة على هيكل مغلق داخل الخلايا معروف جيدا، وهو ISG، في نموذج للخلايا β. مثل الماكروبينوسومات ، فإن تنظيم الخصائص الهيكلية والديناميكية ل ISGs ، من نشأتها في شبكة Trans Golgi (TGN) إلى إفرازاتها في غشاء البلازما ، أمر محوري للتنفيذ السليم لوظيفة ISG20. ومع ذلك ، على عكس الماكروبينوسومات ، تعيش ISGs في "حالة ثابتة" ، حيث توجد في أي وقت جميع المراحل الوظيفية / الهيكلية / الجزيئية لعمر ISG في وقت واحد داخل الخلية ، ويتم تمثيل كل منها بمجموعة فرعية محددة من ISGs. وهذا يعني أنه على الرغم من أن كل حبيبة واحدة تتطور بشكل لا رجعة فيه من التخلق الحيوي إلى الإفراز ، فمن المتوقع أن يظل متوسط الخصائص الهيكلية / الديناميكية لجميع سكان الحبيبات ثابتا في أي نقطة زمنية (ما لم يتم تغيير ظروف الحالة الثابتة ، على سبيل المثال ، بواسطة محفزات خارجية مثل الجلوكوز والكوليسترول والسيتوكينات13). وهذا ما يؤكده تحليل iMSD.
Protocol
1. إعداد العينات
- قبل تجربة الفحص المجهري ، خلايا الزراعة الفرعية في أطباق مناسبة لتطبيقات الفحص المجهري.
- اغسل طبقا معالجا بالأنسجة بحجم 10 سم من خلايا HeLa أو INS 1E المتقاربة (β الشبيهة بالخلايا) مرتين باستخدام 0.01 M 1x PBS ، وأضف 1 مل من 0.05٪ من التربسين-EDTA (1x) ، وضعه في حاضنة 37 درجة مئوية ، رطبة ، 5٪ CO2 لمدة 5 دقائق.
- أعد تعليق الخلايا المنفصلة بإضافة 9 مل من وسط DMEM الكامل (لخلايا HeLa) أو RPMI 1640 (لخلايا INS-1E) ، وجمع 10 مل النهائي في أنابيب الطرد المركزي.
- البذور حوالي 2 × 105 خلايا في كل طبق 35 مم × 10 مم في حجم نهائي من 1 مل من الوسط. احتضان الخلايا لمدة 24 ساعة عند 37 درجة مئوية و 5٪ CO2.
- لتسمية الليزوسومات بالفلورسنت، استخدم LysoTracker Red DND-99.
- قم بتخفيف محلول المخزون في 1 مل من الوسط المسخن مسبقا إلى تركيز صبغة نهائي يبلغ 70 نانومتر.
- استبدل الوسط من الطبق بوسط طازج يحتوي على LysoTracker. احتضن الخلايا في وسط يحتوي على LysoTracker لمدة 20 دقيقة عند 37 درجة مئوية في جو 5٪ CO2 ، واغسلها مرتين بوسط طازج قبل التجربة.
- لتسمية الماكروبينوسومات بالفلورسنت ، استخدم 70-kDa fluorescein isothiocyanate-dextran. اغسل الخلايا المستزرعة ثلاث مرات بمحلول ملحي مخزن بالفوسفات 0.01 M 1x (PBS) ، واستبدله بوسط يحتوي على الدكستران (1 مجم / مل) ، واحتضنه عند 37 درجة مئوية لمدة 30 دقيقة. قبل الشروع في تجربة الفحص المجهري ، اغسل الخلايا ثلاث مرات بوسط طازج.
- لتسمية ISGs بالفلورسنت في خلايا INS-1E ، قم بنقل الخلايا باستخدام كاشف النقل (انظر جدول المواد) وبروتين الفلورسنت الأخضر المعزز بالببتيد C (EGFP) البلازميد13 وفقا لبروتوكول الشركة المصنعة ، واحتضنها عند 37 درجة مئوية لمدة 24 ساعة في جو 5٪ CO2 قبل التجربة.
2. الحصول على البيانات
- للسماح للمجهر بالتوازن عند درجة الحرارة والغلاف الجوي المطلوبين ، قم بتشغيل نظام التحكم في حاضنة المجهر قبل 2 ساعة على الأقل من التجربة.
ملاحظة: كل عملية استحواذ عبارة عن سلسلة بفاصل زمني. - احصل على الصور باستخدام مجهر بؤري مقلوب مجهز بهدف غمر الماء بفتحة عددية 60x و 1.2 (NA).
- استخدم ليزر الأرجون 488 نانومتر لإثارة EGFP (الخلايا المنقولة) والماكروبينوسومات التي تحمل علامة الفلوريسين. اجمع انبعاث التألق بين 500 و 600 نانومتر باستخدام كاشف أنبوب مضاعف ضوئي قياسي.
- استخدم ليزر HeNe 543 نانومتر لإثارة Lysotracker وجمع انبعاثاته الفلورية بين 555 و 655 نانومتر.
- اضبط قطر ثقب الكشف على حجم 1 متجدد الهواء. لكل عملية استحواذ، اجمع سلسلة من 1000 إطار متسلسل. اضبط وقت سكن البكسل على 2 μs / pixel لفترة زمنية تبلغ 129 مللي ثانية.
ملاحظة: يتكون كل إطار من 256 × 256 بكسل (16 بت/بكسل) ببعد مادي يبلغ 69 نانومتر/بكسل، وهو ما يعادل تقريبا مساحة 17 ميكرومتر × 17 ميكرومتر.
3. طحساب MSD
ملاحظة: لتنفيذ العملية الحسابية بشكل صحيح، استخدم برنامجا قادرا على الحساب الرقمي وبرمجة البرامج النصية. يجب أن يكون البرنامج النصي المحدد (أي لملف البرنامج النصي "iMSD.m"، راجع الملف الداعم 1) موجودا في نفس الدليل الذي يحتوي على سلسلة الصور المراد معالجتها. يجب حفظ كل صورة من السلسلة كملف ".tif" متميز.
- لتهيئة المعلمات الأساسية المستخدمة في عمليات الاستحواذ بشكل صحيح ، افتح iMSD.m باستخدام محرر نصوص البرنامج وقم بتعديل القسم الأول على النحو التالي.
- اضبط N كعدد الإطارات في السلسلة الزمنية (على سبيل المثال، 1000 في هذا البروتوكول).
- تعيين px_size: حجم البكسل، معبرا عنه بميكرومتر (على سبيل المثال، 0,069 في هذا البروتوكول).
- المجموعة f: الدقة الزمنية لكل إطار، معبرا عنها بالثواني (على سبيل المثال، 0,129 في هذا البروتوكول).
- تعيين عامل التصفية: إدخال ثنائي لتصحيح الخلفية، أو تعيين القيمة إلى "0" لمعالجة الصور الخام، أو تعيين القيمة إلى "1" لإجراء طرح الخلفية المستند إلى العتبة.
- مجموعة av_toll: عتبة تصحيح الخلفية؛ سيتم تعيين أي بكسل بكثافة أقل من هذه القيمة على أنه 0 إذا كان Filter=1.
- اضبط بت كعدد صحيح يحدد عينة الكثافة (على سبيل المثال، 8 بت، 16 بت).
- حفظ وتشغيل ملف البرنامج النصي iMSD.m تحريرها.
- تحقق من تنفيذ البرنامج النصي.
ملاحظة: يمكن التحقق من حالة معالجة الحساب في نافذة الأوامر; في حالة حدوث أي مشكلة قاتلة ، ستتم مقاطعة العملية ، وسيتم عرض رسالة تحذير لإظهار نوع الخطأ ورمز السطر ذي الصلة. وإلا، اتبع الخطوات 3.3.1-3.3.3.- قم باستيراد مكدس الصور واطرح الخلفية (إذا لزم الأمر).
- احسب دالة الارتباط الزماني المكاني G(ξ,η,τ) باستخدام طريقة فورييه.
- تناسب وظيفة الارتباط الزماني المكاني مع دالة غاوسية 2D.
ملاحظة: في نهاية العملية، سيتم عرض قيم المخرجات لإجراءات تركيب σ 2 (τ) في نافذة الأوامر: يتم الإبلاغ عن المتوسطات والخطأ والخير المقابل (R2) للتركيب.
- تحقق من الإخراج الرسومي.
ملاحظة: يظهر منحنى iMSD ومنحنيات التركيب المقابلة له في ثلاث لوحات منفصلة، لكل منها نوع مختلف من معادلة التركيب المستخدمة: الانتشار البراوني، أو الانتشار الشاذ، أو الانتشار المحصور. لكل منحنى، يتم الإبلاغ عن قيمة R2 في وسيلة إيضاح الرسم البياني. - تحقق من إخراج النص.
ملاحظة: في نهاية العملية، يتم إنشاء ملف ".xls" بنفس اسم ملف ".tif" الأصلي بفاصل زمني. تحتوي الورقة الأولى على قيم ξ و η و τ و σ2 محسوبة لكل تأخير زمني. يتم الإبلاغ عن معلمات الإدخال وقيم المخرجات المحسوبة الرئيسية في الورقة الثانية ، أي معامل الانتشار ، والمعامل الشاذ ، والمحور y σ20 اعتراض.
النتائج
يتم عرض سير العمل العام للطريقة في الشكل 1. وهو يلخص الخطوات الرئيسية المعروضة في قسم البروتوكول، من إعداد العينات (الشكل 1 ألف) إلى التصوير بفاصل زمني للهياكل النانوية داخل الخلايا (الشكل 1 باء)، وتحليل التذبذب لحساب سلسلة دوال الارتباط الزماني المكاني (الشكل 1 جيم)، والملائم لاشتقاق متوسط الخصائص الهيكلية/الديناميكية للكائن قيد الدراسة (الشكل 1 دال).
المعلمة الحرجة هي الدقة الزمنية المعتمدة لتصوير الكائن دون الخلوي محل الاهتمام. ستحدد هذه القيمة التجريبية العتبة الزمنية التي سيتم عندها قياس الحد الأدنى لمتوسط إزاحة الكائنات ذات الاهتمام. ومع ذلك ، فإن الشرط المفضل هو تعيين دقة زمنية للتصوير يظهر فيها الكائن محل الاهتمام "غير متحرك" داخل الإطار الملتقط ، أي أنه يعرض حجما مميزا ، في المتوسط ، لا يتشوه بسبب سرعة التصوير. هذا ممكن تقنيا إذا كان الكائن محل الاهتمام هو بنية تحت الخلية مغلقة بالغشاء أو عضية (كما في هذه الحالة). عادة ما تظهر الهياكل تحت الخلوية معاملات انتشار محلية (D ، μm2 / s ، انظر الجدول 1) أقل بعدة أوامر من حيث الحجم من تلك الموجودة في جزيئات مفردة معزولة في السيتوبلازم (على سبيل المثال ، GFP21). يمكن إجراء التحقق من الصحة عن طريق شل حركة العضية ذات الأهمية بشكل مصطنع (على سبيل المثال ، عن طريق التثبيت الكيميائي). في الواقع ، يمكن أن يكون هذا الشرط بمثابة مرجع لتحديد حجم العضية الفعلي في ظل الظروف التجريبية المستخدمة (على سبيل المثال ، الطول الموجي للإثارة ، حجم البكسل ، الهدف).
هنا ، على الرغم من استخدام الليزوسومات كعضيات اختبار لهذا الإجراء ، إلا أن النتائج صالحة بشكل مستقل عن البنية المستهدفة. ويبين الشكل 2 ألف صورة لليزوسوم ثابت (أي غير متحرك) إلى جانب عملية اقتناء أجريت على الخلايا الحية بدقة زمنية مناسبة (أي عادة ما تكون أقل من 100 مللي ثانية/إطار؛ على سبيل المثال، 65 مللي ثانية/إطار في المثال الوارد في الشكل 2 باء) وعملية اقتناء أجريت عمدا بدقة زمنية منخفضة جدا (على سبيل المثال، 10 ثانية/إطار في المثال الوارد في الشكل 2 جيم) ). لكل شرط ، يتم استخراج حجم الكائن المنتشر على النحو التالي: i) يتم اشتقاق ملف تعريف كثافة البقعة بواسطة أداة الخط في برنامج ImageJ ؛ ب) يتم رسم ملف تعريف الكثافة واستكماله بواسطة دالة غاوسية لحساب العرض الكامل عند نصف القيمة القصوى (FWHM) التي تستخدم بدورها كتقدير لقطر البقعة (الشكل 2D). وكما هو متوقع ومبين في مخطط الشكل 2 هاء، فإن الاقتناء بدقة زمنية عالية جدا (أي 65 مللي ثانية/إطار) ينتج عنه متوسط حجم للهيكل قريب من الحجم الذي تم الحصول عليه في العينة الثابتة، إما باستخدام الأداة القياسية الموصوفة أعلاه أو عن طريق استخراج اعتراض المحور y MSD i. بدلا من ذلك ، يؤدي الاستحواذ بسرعة بطيئة إلى زيادة في الحجم الظاهري للهيكل ، بسبب ديناميكيات البنية الطبيعية أثناء التصوير. في ظل الظروف التجريبية دون المستوى الأمثل ، لا تعكس المعلومات الهيكلية / الديناميكية المستخرجة بأمانة الخصائص الجوهرية للكائن قيد الدراسة.
بمجرد اختيار المعلمات التجريبية الرئيسية ، يمكن إنتاج مجموعات بيانات للهياكل داخل الخلايا المستهدفة. بالنسبة للماكروبينوسومات ، بعد 20 دقيقة من حضانة الخلايا مع 70 kDa dextrans ، تم الحصول على سلسلة زمنية من الهياكل داخل الخلايا المصنفة في نقاط زمنية مختلفة بعد العلاج ، من 30 دقيقة إلى حوالي 180 دقيقة. ومن المثير للاهتمام ، أنه تم الكشف عن تغيير تدريجي في الخصائص الهيكلية والديناميكية للماكروبينوسومات أثناء الاتجار (الشكل 3 ؛ يتم الإبلاغ عن توزيعات σ02 و Dm و α و N لل macropinosomes في المؤامرات على اليسار). وفي حين لم تكتشف تغيرات واضحة في الانتشار المحلي (Dm) للماكروبينوسومات أثناء الاتجار، فإن الحجم المميز (σ02) ونمط الحركة العام (α) يتطوران في الوقت المناسب.
وتجدر الإشارة بوجه خاص إلى أن انخفاضا في متوسط حجم الماكروبينوسومات لوحظ أثناء الاتجار بها (الشكل 3 ألف، إلى اليسار)، إلى جانب زيادة مصاحبة في الطبيعة الفرعية المنتشرة لحركتها (أي يشار إليها على أنها انخفاض في قيم α، الشكل 3 جيم، اللوحة اليسرى). بالإضافة إلى ذلك ، تم استخراج عدد الماكروبينوسومات من كل عملية استحواذ: النتائج ، المبلغ عنها في الشكل 3D ، اللوحة اليسرى ، تكشف بوضوح عن زيادة في عدد الماكروبينوسومات في الوقت المناسب. كل هذه النتائج تتفق بشكل جيد مع التوقعات لأن الماكروبينوسومات التي تحمل علامة ديكستران من المفترض أن تنشأ كحويصلات معزولة وكبيرة مغلقة بالغشاء في غشاء البلازما (والتي هي أيضا مختصة بالحركة على طول المكونات الهيكلية الخلوية) ولكن من المفترض أن تتواصل تدريجيا مع المسار داخل الليزوزومات المكون من مجموعة كبيرة من الهياكل الأصغر والمنتشرة بشكل عشوائي.
وكما هو متوقع أعلاه، فإن نتائج الماكروبينوسومات تتناقض مع القياسات المماثلة التي أجريت على ISGs (الشكل 3، العمود الأيمن). لا تظهر حبيبات الأنسولين اتجاها متطورا زمنيا للمعلمات الهيكلية / الديناميكية المشتقة من iMSD (ومتوسط عددها داخل الخلية) في نفس النافذة الزمنية التي لوحظت للماكروبينوسومات. علاوة على ذلك ، فإن القيم المميزة σ02 و Dm و α تختلف تماما عن قيم الليزوسومات ، التي تستخدم مرة أخرى كمرجع. تؤكد هذه النتيجة الفكرة ، كما هو متوقع أعلاه ، أن الحبيبات يتم فحصها في "حالة ثابتة" لا يتغير فيها ، في أي وقت ، متوسط الخصائص الهيكلية / الديناميكية لجميع سكان ISGs (أي أنها تظل ثابتة ، ما لم تتغير ظروف الحالة الثابتة ، على سبيل المثال ، بسبب المحفزات الخارجية).
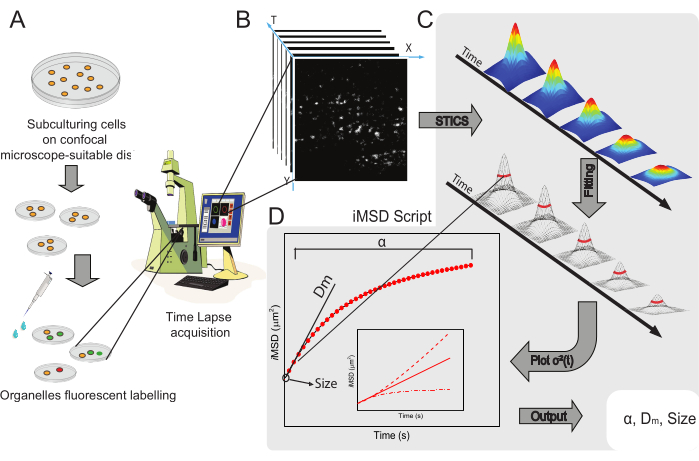
الشكل 1: سير العمل التجريبي . (أ) تم طلاء الخلايا على مدار 24 ساعة (48 ساعة لتجارب النقل) قبل إجراء تجارب متحدة البؤرة على أطباق الخلايا المناسبة للتطبيقات المجهرية. ثم عولجت الخلايا بشكل مناسب وفقا لطريقة وضع العلامات (انظر البروتوكول) لتلطيخ العضية السيتوبلازمية ذات الاهتمام. (ب) يتكون الاكتساب البؤري النموذجي من كومة من الصور (الفاصل الزمني) لجزء سيتوبلازمي من خلية حية، تصف التطور الزمني لديناميات العضيات المسماة. (ج) يتم تحليل فيلم الفاصل الزمني باستخدام نص Matlab المصنوع خصيصا ، أولا حساب دالة ارتباط الصورة الزمانية المكانية وتركيب Gaussian لرسم منحنيات iMSD (D) ومعلمات التركيب المستخرجة ذات الصلة التي تصف معلمات الديناميات الهيكلية للعضيات المصورة. الاختصارات: iMSD = متوسط الإزاحة المربعة المشتقة من التصوير. STICS = التحليل الطيفي لارتباط الصورة الزمانية المكانية; α = معامل الانتشار الشاذ; Dm = الانتشار المحلي; σ2 (τ) = التباين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
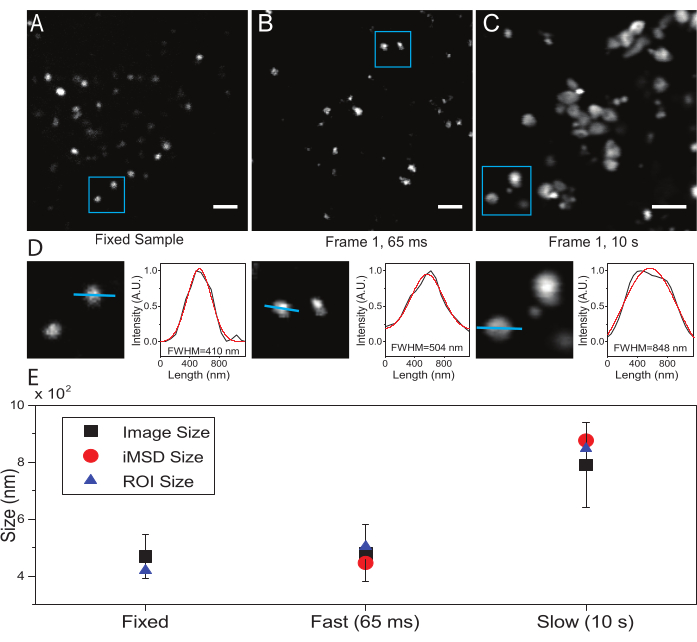
الشكل 2: المعلمات التجريبية المناسبة . (أ) صورة مثالية للليزوسومات الملطخة في عينة ثابتة. شريط المقياس = 2 ميكرومتر (B) الإطار الأول لمجموعة من الصور من الليزوسومات الملطخة في خلية حية ، تم الحصول عليها باستخدام المعلمات المناسبة. الدقة الزمنية: 65 مللي ثانية / إطار. شريط المقياس = 2 ميكرومتر (C) الإطار الأول من كومة من الصور من الليزوسومات الملطخة في خلية حية، التي تم الحصول عليها بسرعة منخفضة: تشوه مصطنع لحجم الليزوسوم الظاهر بسبب حركة العضية أثناء التصوير مرئي. الدقة الزمنية: 10 ثانية / إطار. شريط المقياس = 2 ميكرومتر (D) مثال على حساب الحجم للليزوسومات المصورة في عائد استثمار أزرق من (A) و (B) و (C). تم تزويد ملف تعريف الكثافة على طول الخط الأزرق بدالة Gaussian لاسترداد FWHM ، أي تقدير لحجم البقعة. يتم الإبلاغ عن قيم FWHM لكل تركيب. (ه) تمثيل بياني لقيم الحجم التي تم الحصول عليها عن طريق تحليل الصور الموصوف في اللوحة (D) لجميع الليزوسومات المصورة (المربع الأسود، والقيمة المتوسطة، والانحراف المعياري)، للليزوسومات المحاطة بعائد الاستثمار الأزرق (المثلث الأزرق)، والتي تم استرجاعها بواسطة تحليل iMSD (الدائرة الحمراء). هذا الرقم من 22. الاختصارات: عائد الاستثمار = منطقة الاهتمام; FWHM = العرض الكامل عند نصف الحد الأقصى ؛ iMSD = متوسط الإزاحة المربعة المشتقة من التصوير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
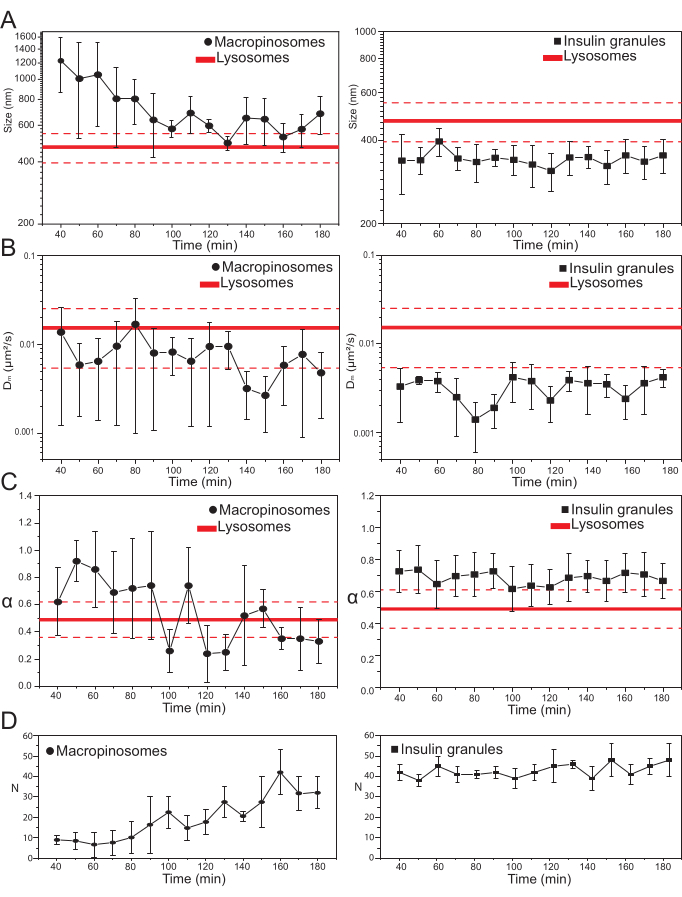
الشكل 3: التطور الزمني للعضيات المسماة . (أ) قطع من قيم الحجم المستخرجة من iMSD مقابل التقدم الزمني لعمليات الاستحواذ اللاحقة الممثلة كمتوسط للقيم المقاسة في عمليات الاستحواذ التي تتم في نافذة زمنية مدتها 10 دقائق. على اليسار ، الانخفاض التدريجي في متوسط حجم الماكروبينوسومات (الدوائر السوداء) وعلى اليمين ، الحجم الثابت زمنيا لحبيبات إفراز الأنسولين (المربعات السوداء) مقارنة بالليزوسومات ، ممثلة كمتوسط قيمة الحجم (خط أحمر أكثر سمكا) ± الانحراف المعياري (الخطوط الحمراء المتقطعة). (B) و (C) التقدم الزمني ل Dm و α معاملات الماكروبينوسومات (يسار) وحبيبات الأنسولين (يمين) المستخرجة بواسطة تحليل iMSD. (د) التطور الزمني لأعداد الماكروبينوسومات المسماة وحبيبات الأنسولين المقاسة في الإطار الأول من كل فيلم بفاصل زمني مكتسب. الاختصارات: iMSD = متوسط الإزاحة المربعة المشتقة من التصوير. α = معامل الانتشار الشاذ; Dm = الانتشار المحلي، N = العدد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| أورجانيل | وسمها | خط الخلية | الحجم (نانومتر) | Dm ( × 10-3 ميكرومتر2/ثانية) | α | N | الرقم المرجعي. | ||
| الإندوسوم المبكر (EE) | CellLight في وقت مبكر إندوسوم GFP | هيلا | 395±74 | 3.0±2.4 | 1.02±0.20 | 40 | 10 | ||
| الإندوسوم المتأخر (جنيه) | سيللايت في وقت متأخر إندوسوم GFP | هيلا | 693±102 | 15.4±10.6 | 0.57±0.16 | 58 | 10 | ||
| الليزوسوم (LY) | ليزوتراكر DND-99 | هيلا | 471±76 | 15.3±9.0 | 0.49±0.13 | 143 | 10, 14 | ||
| كافيولا (CAV) | كافولين-EGFP | هيلا | 405±49 | 3.1±1.8 | 1.00±0.22 | 15 | 10 | ||
| كلاثرين المغلفة Vescicle (CCV) | ترانسفيرين-أليكسا 488 | هيلا | 513±62 | 16.2±9.9 | 0.48±0.17 | 33 | 10 | ||
| حبيبات الأنسولين (IG) | C-الببتيد-EGFP | INS-1E | 335±56 | 3.0±1.7 | 0.70±0.14 | 107 | 11 | ||
| الماكروبينوسوم المبكر (EMCR) | فلوريسين ديكستران 70 كيلو دال | هيلا | 979±423 | 8.3±9 | 0.79±0.27 | 36 | 10 | ||
| ماكروبينوسوم متوسط (IMCR) | فلوريسين ديكستران 70 كيلو دال | هيلا | 702±180 | 13.7±19.9 | 0.60±0.38 | 29 | 10 | ||
| الماكروبينوسوم المتأخر (LMCR) | فلوريسين ديكستران 70 كيلو دال | هيلا | 592±127 | 5.8±4.7 | 0.39±0.21 | 21 | 10 | ||
الجدول 1: المعلمات الهيكلية والديناميكية المستخرجةمن MSD. يوضح الجدول قيم الحجم و Dm ومعامل α المقاسة للعضيات المختلفة ، مع تحديد استراتيجيات وضع العلامات ، وخط الخلية المستخدم ، وعدد عمليات الاستحواذ التي تم تحليلها. يتم الإبلاغ عن القيم كمتوسط ± الانحراف المعياري. الاختصارات: iMSD = متوسط الإزاحة المربعة المشتقة من التصوير. α = معامل الانتشار الشاذ; Dm = الانتشار المحلي ، N = العدد ؛ GFP = بروتين الفلورسنت الأخضر; EGFP = بروتين الفلورسنت الأخضر المحسن.
الملف التكميلي 1: تفاصيل حول اشتقاق وتحليل تتبع iMSD. يرجى النقر هنا لتنزيل هذا الملف.
دعم الملف 1: يرجى النقر هنا لتنزيل هذا الملف.
Discussion
خصائص ومزايا iMSD واضحة عند مقارنتها بالتقنيات المتاحة لاسترداد المعلومات المماثلة. للحصول على المعلومات الهيكلية ، فإن الخيار المفضل هو تحليل المجهر الإلكتروني للإرسال (TEM). بهذه الطريقة ، يمكن استرداد التفاصيل فوق الهيكلية بدقة جزيئية وحتى خارجها ، حتى بالنسبة للهياكل النانوية دون الخلوية. ومع ذلك ، يتم تحقيق الدقة المكانية الغريبة ل TEM على حساب المعلومات في البعد الزمني ، وهو أمر مهم هنا. وللتعويض عن ذلك، فإن التطورات الأخيرة في تقنيات تصوير الخلايا الحية ذات أهمية خاصة. وتشمل هذه العلامات الفلورية الجديدة مع زيادة الأداء (على سبيل المثال ، السطوع والاستقرار الضوئي) ، وإجراءات وضع العلامات المحسنة ، وأجهزة الكشف الأكثر حساسية. وبالإضافة إلى ذلك، تتوفر أدوات تحليلية لمعالجة كل من التحليل الهيكلي (على سبيل المثال، "الحجم" عن طريق التحليل القائم على الطور للتحليل الطيفي المحلي لارتباط الصورة، PLICS23، التجميع/قلة القلة بواسطة تحليل العدد والسطوع24) والديناميكية (على سبيل المثال، قانون الانتشار عن طريق تتبع الجسيمات المفردة، أي (SPT)25،26،27،28 ) المعلمات على المقياس تحت الخلوي. تتيح طريقة SPT الوصول المباشر إلى مسار الكائن و MSD الخاص به. ومع ذلك ، فإن العيب هو الحاجة إلى كثافة منخفضة للمسبار وتسميات ساطعة للغاية والعديد من مسارات الجسم الواحد التي يجب قياسها لتلبية المعايير الإحصائية. وفيما يتعلق بالاستبانة الزمنية للقياس، يمكن للمجسات غير العضوية والقابلة للتصوير الضوئي (مثل النقاط الكمومية أو الجسيمات النانوية المعدنية) أن تزيد من أداء SPT ولكن على حساب إجراءات الإنتاج ووضع العلامات المعقدة.
بالمقارنة مع هذه المعايير ، تظهر طريقة iMSD الموضحة هنا بعض المزايا الرئيسية. أولا ، يمكن استخدام هذا النهج بالاقتران مع علامات الفلورسنت الخافتة نسبيا ، مثل البروتينات الفلورية المشفرة وراثيا (على سبيل المثال ، التطبيق على ISGs). وبالتالي ، بالمقارنة مع SPT ، يتم تحقيق دقة زمنية أعلى (باستخدام نفس الملصق) بسبب انخفاض كمية الفوتونات المطلوبة8. ثانيا ، تقتصر طريقة iMSD فقط على الدقة الزمنية ولكن ليس الحيود . في الواقع ، على الرغم من الإعداد البصري المحدود للحيود المستخدم ، يمكن قياس متوسط الإزاحة الجزيئية حتى أقل من حد الحيود ، كما هو موضح بالفعل للتدفقات الجزيئية باستخدام STICS29. تعتمد الدقة الفعلية في قياس الإزاحة على مدى دقة (من حيث الإشارة إلى الضوضاء) التي يمكن قياس دالة الارتباط ، مما يفسر سبب عدم تقييدها بالحيود . وبالتالي ، يبدو من الواضح أن الحد الأدنى للإزاحة التي يمكن قياسها يعتمد على انتشار الكائن محل الاهتمام والدقة الزمنية لإعداد التصوير.
في هذا الصدد ، من المهم اعتبار أن التطبيق على الهياكل النانوية دون الخلوية ، مثل الماكروبينوسومات أو حبيبات الأنسولين ، باستخدام المجهر الضوئي بالليزر هو الأمثل: سرعة المسح المتاحة أعلى بكثير من ديناميكيات الكائن محل الاهتمام. في مثل هذه الحالة ، تكون حركة الكائنات أثناء الاستحواذ ضئيلة ، ويمكن تقريب دالة الارتباط بواسطة دالة Gaussian. وأخيرا، يمكن تطبيق نهج iMSD بسهولة على مجموعة واسعة من إعدادات الفحص المجهري البصري التجاري استنادا إلى المسح النقطي أو التصوير القائم على الكاميرا واسعة المجال، دون الحاجة إلى معايرة النظام (مطلوب فقط إذا كان من الضروري تحقيق تقدير دقيق لحجم الجسيمات). معلمة مهمة لطريقة العمل هي أخذ العينات المكانية المناسبة. كقاعدة عامة ، للوصول إلى تقارب مرض لخوارزمية التركيب ، يجب أن يكون الحد الأدنى لحجم المنطقة ذات الأهمية للتصوير أكبر ب 3 مرات على الأقل من الحد الأقصى لإزاحة الاهتمام.
في الختام ، لا تتطلب طريقة iMSD سوى مجهر مجهز للاكتساب السريع. يمكن وضع علامة على بنية الاهتمام لأي فلوروفور مشفر وراثيا أو عضوي ، مما يتيح التصوير متعدد القنوات. ومن المتوقع أن يستخدم التحليل عبر iMSD في المستقبل القريب لاختيار المجموعات الفرعية للهياكل النانوية دون الخلوية والكشف عن تفاعلاتها وانتشارها المشترك داخل الخلية، وهذا الأخير هو موضوع ساخن في الفيزياء الحيوية الخلوية. إذا فقدت أي تفاصيل عن طريق تحليل iMSD ، فإن هذا يرتبط بالتأكيد بالكمية الكبيرة من المعلومات الجزيئية داخل الهياكل النانوية الديناميكية تحت الخلوية. يتم حتما حساب متوسط هذه المعلومات أثناء القياس بسبب ضعف الدقة الزمنية. من الناحية النظرية ، ومع ذلك ، لا يوجد حد تقني بسبب إمكانية استرداد المعلومات الجزيئية ، شريطة أن يكون من الممكن تحقيق سرعات اكتساب كافية8. نظرا للتحسينات المستمرة في سرعة / حساسية الكاشف وتقنيات التصوير ، من المتوقع أن يتم استخراج المعلومات حول المقصورة تحت الخلوية بأكملها ومكوناتها الجزيئية من مجموعة بيانات واحدة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان.
Acknowledgements
تلقى هذا العمل تمويلا من مجلس البحوث الأوروبي (ERC) في إطار برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي (اتفاقية المنحة رقم 866127 ، مشروع CAPTUR3D).
Materials
| Name | Company | Catalog Number | Comments |
| 100x Penicillin-Streptomycin-Glutamine | Gibco | 10378-016 | Cell medium supplement |
| C-peptide-EGFP | Plasmid | ||
| DMEM High Glucose | Gibco | 31053028 | Cell medium (HeLa) |
| FBS | Gibco | 10082147 | Cell medium supplement |
| Fluorescein isothiocyanate-dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | Reagent |
| HeLa | ATCC | CCL-61 | Cell Line |
| Lipofectamine 2000 | TermoFisher | 11668019 | Trasfection reagent |
| Lysotracker Red DND-99 | Gibco | L7528 | Reagent |
| Matlab | MathWork | Software | |
| Microscope-suitable cell dishes | Willco | GWSt-3522 | Petri dishes |
| Olympus FV1000 | Olympus Japan | Confocal microscope | |
| RPMI 1640 | Gibco | 11835063 | Cell medium (INS-1E) |
References
- Murphy, J. E., Padilla, B. E., Hasdemir, B., Cottrell, G. S., Bunnett, N. W. Endosomes: a legitimate platform for the signaling train. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17615-17622 (2009).
- Mosesson, Y., Mills, G. B., Yarden, Y. Derailed endocytosis: an emerging feature of cancer. Nature Reviews Cancer. 8 (11), 835-850 (2008).
- Mellman, I., Yarden, Y. Endocytosis and cancer. Cold Spring Harbor Perspectives in Biology. 5 (12), 016949 (2013).
- Di Fiore, P. P. Endocytosis, signaling and cancer, much more than meets the eye. Preface. Molecular Oncology. 3 (4), 273-279 (2009).
- Bogan, J. S., Xu, Y., Hao, M. Cholesterol accumulation increases insulin granule size and impairs membrane trafficking. Traffic. 13 (11), 1466-1480 (2012).
- Ballabio, A., Gieselmann, V. Lysosomal disorders: From storage to cellular damage. Biochimica et Biophysica Acta. 1793 (4), 684-696 (2009).
- Hu, Y. -. B., Dammer, E. B., Ren, R. -. J., Wang, G. The endosomal-lysosomal system: from acidification and cargo sorting to neurodegeneration. Translational Neurodegeneration. 4, 18 (2015).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Spatiotemporal fluctuation analysis: a powerful tool for the future nanoscopy of molecular processes. Biophysical Journal. 111 (4), 679-685 (2016).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Fast spatiotemporal correlation spectroscopy to determine protein lateral diffusion laws in live cell membranes. Proceedings of the National Academy of Sciences of the United States of America. 110 (30), 12307-12312 (2013).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. From fast fluorescence imaging to molecular diffusion law on live cell membranes in a commercial microscope. Journal of Visualized Experiments: JoVE. (92), e51994 (2014).
- Digiacomo, L., et al. Dynamic fingerprinting of sub-cellular nanostructures by image mean square displacement analysis. Scientific Reports. 7 (1), 14836 (2017).
- Durso, W., et al. Lysosome dynamic properties during neuronal stem cell differentiation studied by spatiotemporal fluctuation spectroscopy and organelle tracking. International Journal of Molecular Sciences. 21 (9), 3397 (2020).
- Ferri, G., et al. Insulin secretory granules labelled with phogrin-fluorescent proteins show alterations in size, mobility and responsiveness to glucose stimulation in living β-cells. Scientific Reports. 9 (1), 2890 (2019).
- Durso, W., D'Autilia, F., Amodeo, R., Marchetti, L., Cardarelli, F. Probing labeling-induced lysosome alterations in living cells by imaging-derived mean squared displacement analysis. Biochemical and Biophysical Research Communications. 503 (4), 2704-2709 (2018).
- Digiacomo, L., Digman, M. A., Gratton, E., Caracciolo, G. Development of an image Mean Square Displacement (iMSD)-based method as a novel approach to study the intracellular trafficking of nanoparticles. Acta Biomaterialia. 42, 189-198 (2016).
- Swanson, J. A., Watts, C. Macropinocytosis. Trends in Cell Biology. 5 (11), 424-428 (1995).
- Jones, A. T. Macropinocytosis: searching for an endocytic identity and role in the uptake of cell penetrating peptides. Journal of Cellular and Molecular Medicine. 11 (4), 670-684 (2007).
- Falcone, S., et al. Macropinocytosis: regulated coordination of endocytic and exocytic membrane traffic events. Journal of Cell Science. 119, 4758-4769 (2006).
- Kerr, M. C., et al. Visualisation of macropinosome maturation by the recruitment of sorting nexins. Journal of Cell Science. 119, 3967-3980 (2006).
- Rorsman, P., Renstrom, E. Insulin granule dynamics in pancreatic beta cells. Diabetologia. 46 (8), 1029-1045 (2003).
- Di Rienzo, C., Piazza, V., Gratton, E., Beltram, F., Cardarelli, F. Probing short-range protein Brownian motion in the cytoplasm of living cells. Nature Communications. 5 (1), 5891 (2014).
- Ferri, G., et al. Time-lapse confocal imaging datasets to assess structural and dynamic properties of subcellular nanostructures. Scientific Data. 5 (1), 180191 (2018).
- Scipioni, L., Gratton, E., Diaspro, A., Lanzanò, L. Phasor analysis of local ICS detects heterogeneity in size and number of intracellular vesicles. Biophysical Journal. 111 (3), 619-629 (2016).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical Journal. 94 (6), 2320-2332 (2008).
- Li, C. H., Bai, L., Li, D. D., Xia, S., Xu, T. Dynamic tracking and mobility analysis of single GLUT4 storage vesicle in live 3T3-L1 cells. Cell Research. 14 (6), 480-486 (2004).
- Donovan, K. W., Bretscher, A. Tracking individual secretory vesicles during exocytosis reveals an ordered and regulated process. Journal of Cell Biology. 210 (2), 181-189 (2015).
- Westphal, V., et al. Video-rate far-field optical nanoscopy dissects synaptic vesicle movement. Science. 320 (5873), 246-249 (2008).
- Tabei, S. M. A., et al. Intracellular transport of insulin granules is a subordinated random walk. Proceedings of the National Academy of Sciences of the United States of America. 110 (13), 4911-4916 (2013).
- Hebert, B., Costantino, S., Wiseman, P. W. Spatiotemporal image correlation spectroscopy (STICS) theory, verification, and application to protein velocity mapping in living CHO cells. Biophysical Journal. 88 (5), 3601-3614 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved