Method Article
時空間変動分光法による細胞内ナノ構造のトラッキングの構造と動特性のプロービング
要約
イメージングによる二乗平均変位(iMSD)解析をマクロピノソームに適用し、構造的および動的特性の観点から、マクロピノソームの固有の時間進化的性質を強調します。次いで、マクロピノソームは、時間不変の平均構造的/動的特性を有する細胞下構造の基準として、インスリン分泌顆粒(ISG)と比較される。
要約
イメージング由来の二乗平均変位(iMSD)は、溶質および生体分子のエンド/エキソサイトーシス輸送に関与する小胞などの細胞内ナノ構造の構造的および動的特性に対処するために使用される。iMSDは、標準のタイムラプスイメージングに依存しており、あらゆる光学セットアップと互換性があり、軌道を抽出するために単一のオブジェクトにこだわる必要はありません。各iMSDトレースから、平均構造パラメータおよび動的パラメータ(すなわち、サイズ、局所拡散性、異常係数)の一意のトリプレットが計算され、組み合わされて、研究中のナノ構造の「iMSDシグネチャ」が構築される。
このアプローチの効力は、マクロピノソームの例示的な症例でここで証明される。これらの小胞は時間とともに進化し、細胞内トラフィッキングの初期段階から後期にかけて、その平均サイズ、数、および動的特性を変化させる。対照として、インスリン分泌顆粒(ISG)は、物体の全集団の平均構造的および動的特性が時間的に不変である静止状態で生きる細胞下構造の基準として使用される。iMSD分析は、これらの特異な特徴を定量的に強調し、生理学的および病理学的状態の両方で、細胞内レベルで同様の応用への道を開く。
概要
細胞内ナノ構造(例えば、エンドサイト/分泌小胞、細胞小器官)は、細胞シグナル伝達調節において極めて重要な役割を果たしている1。それらの構造的(例えば、サイズ)および/または動的(例えば、拡散性)特性の適切な同調は、細胞が内部または外部刺激にどのように応答するかを決定する2、3、4。この証拠に基づいて、これらの特性の変化が多くの病理学的状態において見出されることは驚くべきことではない。実施例は、癌における誤った調節エンドサイトーシスの役割2、3、2型糖尿病状態5に曝露されたβ細胞におけるISGのレベルで見出される構造的および動的変化、グロボイド細胞白質ジストロフィーまたはガラクトシルセラミドリピドーシス6におけるリソソーム構造および輸送特性の誤った調節、ならびに神経変性障害(例えば、アルツハイマー病)におけるエンドリソソーム経路における機能不全を包含する7。
この文脈で、研究者は最近、標準的な光学顕微鏡法の性能が空間的および時間的サンプリング分解能を適切に調整することによって強化できることを証明しました8。これは、今度は、関連性のある生物学的プロセスへのさらなる洞察を提供するかもしれない。実際には、これは時空間変動解析のアルゴリズムによって可能になり、目的の生物学的物体に関する予備的な知識や単一物体の軌道の抽出を必要とせずに、光学顕微鏡画像の標準スタックから直接拡散物体の平均構造的および動的特性を同時に抽出する。これらの情報はすべて、このメソッドの 1 つの出力 (iMSD トレース9) に囲まれています (iMSD トレースの導出と分析の詳細については、 補足ファイル 1 を参照してください)。
得られた実験プロトコールは、いくつかのステップからなる。まず、関心領域の撮像は、高い時間分解能で行われる。次に、平均空間時間相関関数が画像のスタックから計算されます。最後に、一連の相関関数のガウスフィッティングによって、平均「拡散法則」が画像から直接得られ、物体拡散モードを認識するために分析される。この方法の可能性は、分子からナノ粒子、さらには細胞内小器官/構造全体に至るまで、さまざまな生物学的物体についてすでに証明されています9、10、11、12、13、14、15。
本稿では、iMSDをマクロピノソームに適用し、マクロピノソームの内在的で不可逆的な時間進化の性質を、その平均的(すなわち、全集団レベルで)の構造的および動的特性の観点から強調することを報告している。さらに、これらのエンドサイトーシス小胞は、「静止状態」、すなわち顆粒の全集団の平均構造的/動的特性が任意の時点で一定に保たれる状態における細胞下構造の基準としてISGと比較される。マクロピノサイトーシスは、原形質膜の広範な再編成(またはフリル)によって開始され、外部マクロピノサイト構造を形成し、その後内在化される一連の事象を定義する16。形成された初期段階のマクロピノソームは、ファゴソームと非常によく似ている。同時に、それらは、その特徴的な大きなサイズ、形態学的不均一性、およびタンパク質コート構造の欠如のために、他の形態のエンドサイトーシス小胞と区別することができる。
生化学的アッセイにより、マクロピノソームはインターナリゼーション時に他のエンドサイトーシス経路のタンパク質マーカーで徐々に濃縮されることが明らかになり、そのアイデンティティがトラフィッキング中に継続的に変化していることが示唆された17。エンドソーム経路の既知のマーカーに対する抗体を用いて、マクロピノソームは古典的なエンドソームの特徴を徐々に採用することが実証された:それらはサイズが減少し、後期エンドサイト構造(例えば、リソソーム)に発達し、または最終的に特定の分子マーカーの膜媒介性検索(例えば、ネキシンの選別)を介して同一性を失う18,19。.全体的なシナリオは、細胞内のすべてのマクロピノソームが、原形質膜から最終的な細胞内運命へのトラフィッキング中に、その構造的および動的(ならびに分子的)同一性を不可逆的に変化させることである。その結果、マクロピノソームの全集団の構造的/動的/分子的特性も同じ時間的経路に沿って変化している。iMSD法は、観測された物体の集団全体の平均特性に本質的に敏感であるため、重要な平均パラメータ、すなわち局所拡散性および異常係数(動的特性)およびマクロピノソームの平均サイズ(構造特性)を細胞内輸送の任意の段階で定量化することによって、「進化する性質」を定量的に描写する。
比較のために、β細胞のモデルにおいて、周知の細胞内膜封入構造であるISGについて同様の測定を行った。マクロピノソームと同様に、トランスゴルジネットワーク(TGN)での起源から原形質膜でのエキソサイトーシスまで、ISGの構造的および動的特性の調節は、ISG機能20の適切な実行にとって極めて重要である。しかし、マクロピノソームとは異なり、ISGは、ISGの寿命のすべての機能的/構造的/分子的段階がいつでも細胞内に同時に存在し、それぞれがISGの特定の亜集団によって表される「静止状態」に生きる。これは、すべての顆粒が生合成から分泌まで不可逆的に進化するが、顆粒の全集団の平均構造的/動的特性は、(例えば、グルコース、コレステロール、サイトカインなどの外部刺激によって静止状態条件が変化しない限り)いつでも一定に保たれると予想されることを意味する13。これはiMSD分析により確認される。
プロトコル
1. サンプル調製
- 顕微鏡実験の前に、細胞を顕微鏡観察用途に適したディッシュ中で継代培養する。
- コンフルエントなHeLaまたはINS 1E(インスリノーマβ細胞様)細胞の10 cm組織培養処理皿を0.01 M 1x PBSで2回洗浄し、1 mLの0.05%トリプシン-EDTA(1x)を加え、37°C加湿した5%CO2 インキュベーターに5分間置く。
- 9 mLの完全DMEM(HeLa細胞の場合)またはRPMI 1640(INS−1E細胞の場合)培地を加えて剥離した細胞を再懸濁し、最後の10 mLを遠沈管に集めた。
- 各35 mm x 10 mmディッシュに約2個×105個の細胞を1mLの培地の最終容量で播種する。細胞を37°Cおよび5%CO2で24時間インキュベートする。
- リソソームを蛍光標識するには、LysoTracker Red DND-99を使用してください。
- 予備加温した培地1mLで原液を最終色素濃度70nMに希釈する。
- ディッシュの培地を新鮮なLysoTracker含有培地と交換する。細胞をLysoTracker含有培地中で5%CO2雰囲気中37°Cで20 分間インキュベートし、実験前に新鮮な培地で2回洗浄した。
- マクロピノソームを蛍光標識するには、70-kDaフルオレセインイソチオシアネート-デキストランを使用する。継代培養細胞を0.01 M 1xリン酸緩衝生理食塩水(PBS)で3回洗浄し、デキストラン含有培地(1 mg/mL)と交換し、37°Cで30分間インキュベートする。顕微鏡実験を進める前に、細胞を新鮮な培地で3回洗浄する。
- INS-1E細胞中のISGsを蛍光標識するには、製造者のプロトコールに従って、トランスフェクション試薬( 材料表を参照)およびC-ペプチド増強緑色蛍光タンパク質(EGFP)プラスミド13 を用いて細胞をトランスフェクトし、実験前に5%CO2雰囲気中で37°Cで24 時間インキュベートする。
2. データ取得
- 顕微鏡を所望の温度および雰囲気で平衡化させるには、実験の少なくとも2時間前に顕微鏡インキュベーター制御システムをオンにします。
メモ: 各集録はタイムラプスシリーズです。 - 60倍、1.2開口数(NA)水浸型対物レンズを搭載した倒立共焦点顕微鏡を使用して画像を取得します。
- EGFP(形質移入細胞)およびフルオレセイン標識マクロピノソームの励起には、488nmアルゴンレーザーを使用してください。標準的な光電子増倍管検出器を使用して、500 ~ 600 nm の蛍光発光を収集します。
- 543 nm の HeNe レーザーを使用して Lysotracker を励起し、555 ~ 655 nm の蛍光発光を収集します。
- 検出ピンホールの直径を 1 エアリーのサイズに設定します。集録ごとに、一連の 1000 個の連続フレームを収集します。ピクセル ドウェル時間を 2 μs/ピクセルに設定し、フレーム時間は 129 ミリ秒です。
注: 各フレームは 256 x 256 ピクセル (16 ビット/ピクセル) で構成され、物理寸法は 69 nm/ピクセルで、およそ 17 μm x 17 μm の面積に相当します。
3. iMSD 計算
メモ: 計算を正しく実行するには、数値計算とスクリプトプログラミングが可能なソフトウェアを使用してください。特定のスクリプト (つまり、'iMSD.m' スクリプト ファイルについては、 サポート ファイル 1 を参照) は、処理するイメージ シリーズを含む同じディレクトリに存在する必要があります。シリーズの各画像は、個別の「.tif」ファイルとして保存する必要があります。
- 集録に使用される器械パラメータを正しく初期化するには、ソフトウェアテキストエディタでiMSD.mを開き、最初のセクションを次のように変更します。
- 時系列のフレーム数として N を設定します (たとえば、このプロトコルでは 1000)。
- セット px_size:μmで表されるピクセルサイズ(例えば、このプロトコルでは0,069)。
- セット f:秒単位で表された各フレームの時間分解能(例えば、このプロトコルでは0,129)。
- フィルターの設定: 背景補正用のバイナリ入力、生の画像を処理するための値 '0' の設定、しきい値ベースの背景減算を実行するための値 '1' の設定。
- av_toll設定: バックグラウンド補正のしきい値。この値より低い強度のピクセルは、Filter=1 の場合、0 に設定されます。
- 強度サンプリングを決定する整数としてビットを設定する(例えば、8ビット、16 ビット )。
- 編集した iMSD.m スクリプト ファイルを保存して実行します。
- スクリプトの実行を確認します。
メモ: 計算処理の状態は、コマンドウィンドウで確認できます。致命的な問題が発生した場合、プロセスは中断され、エラーの種類と関連する行コードを示す警告メッセージが表示されます。それ以外の場合は、手順 3.3.1 ~ 3.3.3 を実行します。- 画像スタックをインポートし、背景を減算します(必要な場合)。
- フーリエ法を用いて時空間相関関数G(ξ,η,τ)を計算する。
- 時空間相関関数を 2D ガウス関数に当てはめます。
メモ: プロセスの最後に、σ2(τ) フィッティング手順の出力値がコマンドウィンドウに表示され、フィッティングの平均、誤差、および対応する良度 (R2) が報告されます。
- グラフィカルな出力を確認します。
メモ: iMSD 曲線と対応する継ぎ手曲線は 3 つのパネルに示されており、それぞれが異なるタイプの継ぎ手方程式 (ブラウン拡散、異常拡散、または閉じ込め拡散) に対して示されています。各曲線について、R2 値がグラフの凡例に報告されます。 - テキスト出力を確認します。
注:プロセスの最後に、元のタイムラプス「.xls」ファイルと同じ名前の「.tif」ファイルが作成されます。最初のシートには、時間遅延ごとに計算された ξ、η、τ、およびσ2 の値が含まれています。入力パラメータおよび主要な計算された出力値は、第2のシート、すなわち、拡散係数、異常係数、およびy軸σ20 切片に報告される。
結果
このメソッドの一般的なワークフローを図 1 に示します。サンプル調製(図1A)から細胞内ナノ構造のタイムラプスイメージング(図1B)、一連の時空間相関関数の計算のための変動分析(図1C)、および研究対象物体の平均構造的/動的特性の導出(図1D)まで、プロトコルセクションで提示された主なステップを要約します。
重要なパラメータは、対象となる細胞内物体を撮像するために採用される時間分解能である。この実験値は、対象オブジェクトの最小平均変位が測定される時間しきい値を設定します。しかしながら、好ましい条件は、対象の物体が撮像フレーム内で「不動」に見える撮像の時間分解能を設定すること、すなわち、平均して撮像速度のために変形しない特性サイズを表示することである。これは、目的の物体が膜に囲まれた細胞内構造または細胞小器官である場合(この場合のように)技術的に可能である。典型的には、細胞下構造は、細胞質内の単離された単一分子(例えばGFP21)のそれよりも数桁低い局所拡散係数(D、μm 2/s、表1参照)を示す。バリデーションは、目的のオルガネラを人為的に固定化することによって(例えば、化学的固定によって)行うことができる。実際、この条件は、使用される実験条件(例えば、励起波長、ピクセルサイズ、対物レンズ)の下での実際のオルガネラサイズを決定するための基準として役立つことができる。
ここでは、この手順の被検細胞小器官としてリソソームを用いたが、結果は標的構造とは無関係に有効である。図2Aは、固定(すなわち、不動)リソソームの画像と、生細胞に対して適切な時間分解能(すなわち、典型的には100ms/フレーム未満;例えば、図2Bの例では65ms/フレーム)で実施された取得および非常に低い時間分解能(例えば、図2Cの例では10秒/フレーム)で意図的に行われた取得を示す。 ).各条件について、拡散オブジェクトのサイズは次のように抽出されます:i)スポットの強度プロファイルは、ImageJソフトウェアのラインツールによって導出されます。ii)強度プロファイルをガウス関数によってプロットおよび補間して、半値全幅(FWHM)値を計算し、スポット直径の推定値として使用します(図2D)。予想通り、図2Eのプロットに示されているように、非常に高い時間分解能(すなわち、65ms/frame)での集録は、上記の標準ツールを使用するか、iMSD y軸切片を抽出することによって、固定サンプルで得られたものに近い構造の平均サイズを生成します。代わりに、低速での取得は、イメージング中の自然な構造ダイナミクスのために、構造の見かけのサイズの増加をもたらす。最適でない実験条件下では、抽出された構造的/動的情報は、研究対象の物体の本質的な特性を忠実に反映していない。
主要な実験パラメータが選択されると、標的細胞内構造のデータセットを作製することができる。マクロピノソームの場合、70kDaデキストレートとの細胞の20分間のインキュベーション後、標識された細胞内構造の時系列が、処理後の異なる時点で、30分から約180分まで取得された。興味深いことに、マクロピノソームの構造的および動的特性の漸進的な変化がトラフィッキング中に検出される(図3;マクロピノソームのσ02、Dm、α、およびNの分布が左側のプロットで報告されている)。トラフィッキング中にマクロピノソームの局所拡散性(Dm)の明らかな変化は検出されないが、特徴的なサイズ(σ02)と全体的な運動様式(α)の両方が時間とともに変化する。
特に注目すべきは、マクロピノソームの平均サイズの減少が、それらの運動の亜拡散性の性質の付随的な増加と共に、トラフィッキング中に観察される(すなわち、α値の減少として示される、 図3C、左パネル)。さらに、各取得からマクロピノソームの数を抽出した: 図3D、左パネルで報告された結果は、時間内のマクロピノソームの数の増加を明確に明らかにしている。デキストラン標識マクロピノソームは原形質膜(細胞骨格成分に沿った移動にも有能である)で単離された大きな膜密閉小胞として起源を持つと考えられているが、より小さくランダムに拡散する構造の大きな集団からなるエンドリソソーム経路と徐々に通信することになっているため、これらの結果はすべて期待とよく一致している。
上記で予想したように、マクロピノソームの結果は、ISGに対して行われた同様の測定とは対照的である(図3、右列)。インスリン顆粒は、マクロピノソームについて観察された同じ時間枠において、iMSD由来の構造的/力学パラメータ(および細胞内のそれらの平均数)の時間進化傾向を示さない。また、σ02、Dm、およびαの特性値は、リソソームの特性値とはかなり異なり、再度基準として用いた。この結果は、上記で予想したように、顆粒が、ISGの全集団の平均構造的/動的特性がいつでも変化しない(すなわち、静止状態条件が例えば外部刺激によって変化しない限り、それらは一定である)「静止状態」でプローブされるという考えを裏付ける。
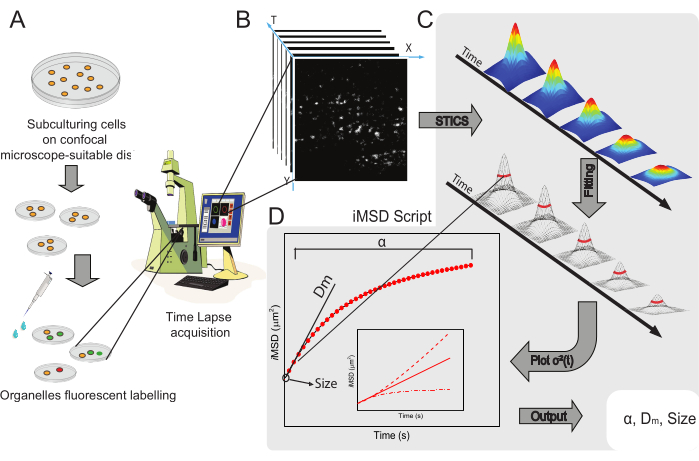
図1:実験ワークフロー 。(A)共焦点実験の前に、顕微鏡用途に適した細胞皿に細胞を24時間(トランスフェクション実験の場合は48時間)播種した。次いで、細胞を標識法(プロトコール参照)に従って適切に処理し、目的の細胞質オルガネラを染色する。(B)典型的な共焦点取得は、標識された細胞小器官のダイナミクスの時間進化を記述する、生細胞の細胞質部分の画像(タイムラプス)のスタックからなる。(C)タイムラプスムービーをカスタムメイドのMatlabスクリプトで解析し、まず時空間画像相関関数とガウスフィッティングを計算してiMSD曲線(D)および画像化された細胞小器官の構造ダイナミクスパラメータを記述する関連抽出フィッティングパラメータをプロットする。略語: iMSD = イメージングから派生した平均二乗変位;STICS = 時空間画像相関分光法;α = 異常な拡散係数;Dm = 局所拡散性;σ2(τ) = 分散。 この図の拡大版を表示するには、ここをクリックしてください。
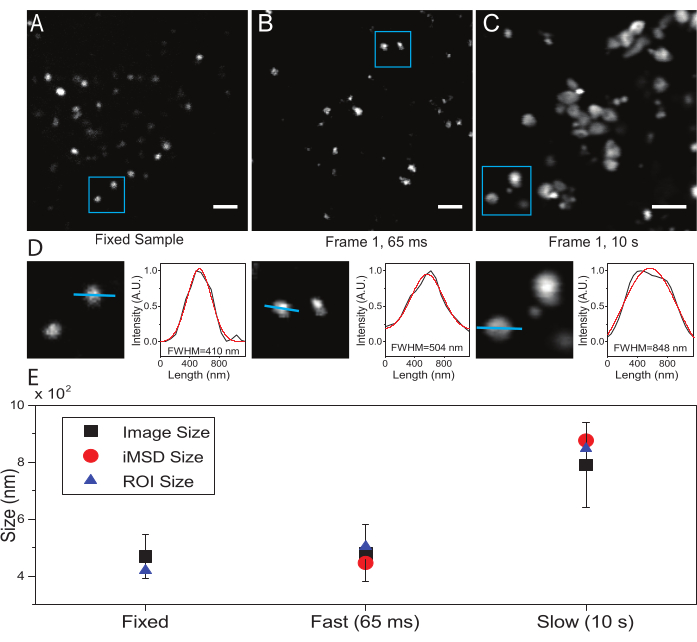
(A)固定サンプル中の染色されたリソソームの例示的な画像。(B)適切なパラメータで取得した生細胞内の染色されたリソソームの画像のスタックの最初のフレーム。時間分解能:65ミリ秒/フレーム。(C)低速で取得された生細胞内の染色されたリソソームの画像のスタックの最初のフレーム:イメージング中のオルガネラ運動による見かけのリソソームサイズのアーチファクト変形が見える。時間分解能:10秒/フレーム。(D)(A)、(B)、および(C)の青色ROIで画像化されたリソソームのサイズ計算の例。青い線に沿った強度プロファイルには、FWHMを取得するためのガウス関数、すなわちスポットサイズの推定値が取り付けられました。FWHM 値は継ぎ手ごとに報告されます。(e)パネル(D)に記載した画像解析により得られたサイズ値を、全ての画像化されたリソソーム(黒四角、平均値、標準偏差)について、青色のROI(青色の三角形)内に囲まれたリソソームについて、iMSD解析により検索した(赤丸)のグラフ表示。この数字は22からのものです。略語: ROI = 関心領域;FWHM = 半値全幅;iMSD = イメージングから派生した平均二乗変位。この図の拡大版を表示するには、ここをクリックしてください。
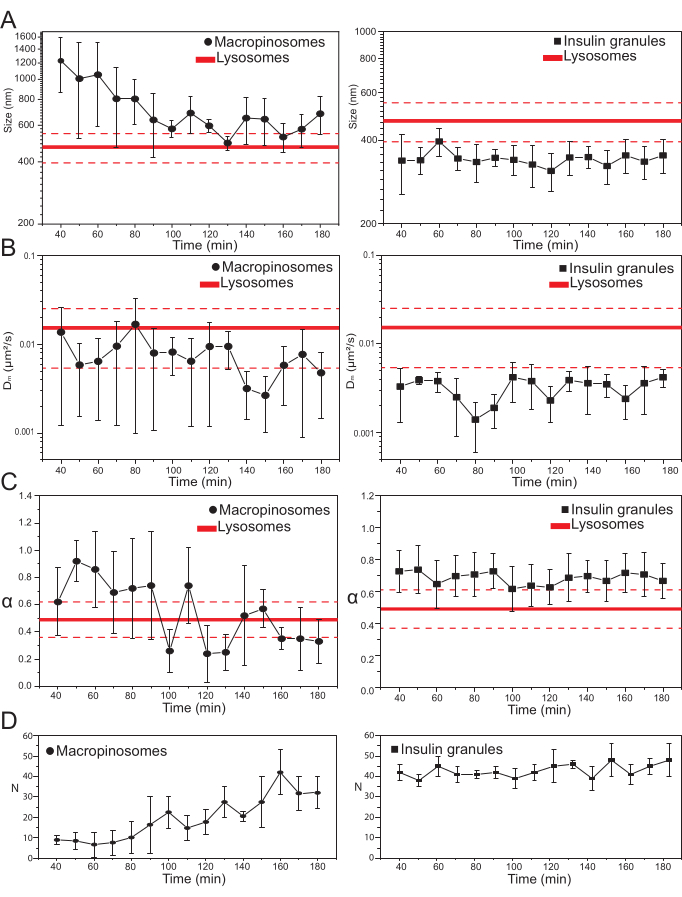
図3:標識された細胞小器官の時間的進化。 (A) iMSDで抽出されたサイズ値のプロットとその後の取得の時間進行は、10分の時間枠で実行された取得の測定値の平均として表されます。左側では、マクロピノソームの平均サイズ(黒丸)の漸進的な減少を、右側では、インスリン分泌顆粒の時間不変サイズ(黒四角)をリソソームと比較して、平均サイズ値(太い赤線)±標準偏差(破線の赤線)として表した。(B)及び(C)iMSD解析により抽出したマクロピノソーム(左)及びインスリン顆粒(右)のDm 及びα係数の時間経過。(d)取得した各タイムラプスムービーの第1フレームで測定した標識マクロピノソームおよびインスリン顆粒の数の時間進化。略語: iMSD = イメージングから派生した平均二乗変位;α = 異常な拡散係数;Dm = 局所拡散率、N = 数値。 この図の拡大版を表示するには、ここをクリックしてください。
| 細胞小器官 | ラベリング | 細胞株 | サイズ (nm) | Dm ( × 10-3 μm2/s) | α | N | 参照 | ||
| 初期エンドソーム(EE) | セルライト早期エンドソームGFP | ヘラ | 395±74 | 3.0±2.4 | 1.02±0.20 | 40 | 10 | ||
| 後期エンドソーム(LE) | セルライト後期エンドソームGFP | ヘラ | 693±102 | 15.4±10.6 | 0.57±0.16 | 58 | 10 | ||
| リソソーム (LY) | リソトラッカーDND-99 | ヘラ | 471±76 | 15.3±9.0 | 0.49±0.13 | 143 | 10, 14 | ||
| カベオラ (CAV) | カベオリン-EGFP | ヘラ | 405±49 | 3.1±1.8. | 1.00±0.22 | 15 | 10 | ||
| クラトリンコーティングベシクル(CCV) | トランスフェリン - アレクサ488 | ヘラ | 513±62 | 16.2±9.9 | 0.48±0.17 | 33 | 10 | ||
| インスリン顆粒(IG) | C-ペプチド-EGFP | インス-1E | 335±56 | 3.0±1.7 | 0.70±0.14 | 107 | 11 | ||
| 初期のマクロピノソーム(EMCR) | フルオレセイン-デキストラン 70 kDa | ヘラ | 979±423 | 8.3±9 | 0.79±0.27 | 36 | 10 | ||
| 中間マクロピノソーム(IMCR) | フルオレセイン-デキストラン 70 kDa | ヘラ | 702±180 | 13.7±19.9 | 0.60±0.38 | 29 | 10 | ||
| 後期マクロピノソーム(LMCR) | フルオレセイン-デキストラン 70 kDa | ヘラ | 592±127 | 5.8±4.7 | 0.39±0.21 | 21 | 10 | ||
表 1: 構造的および動的 iMSD 抽出パラメーター。 この表は、異なる細胞小器官について測定されたサイズ、Dm、およびα係数の値を示し、標識戦略、使用した細胞株、および分析された取得の数を指定します。値は平均±標準偏差として報告されます。略語: iMSD = イメージングから派生した平均二乗変位;α = 異常な拡散係数;Dm = 局所拡散率、N = 数値;GFP = 緑色蛍光タンパク質;EGFP=増強された緑色蛍光タンパク質。
補足ファイル 1: iMSD トレースの導出と分析の詳細。このファイルをダウンロードするには、ここをクリックしてください。
サポート ファイル 1: このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
iMSD の特性と利点は、類似の情報を取得するために使用できる手法と比較すると明らかです。構造情報の場合、好ましい選択は透過型電子顕微鏡(TEM)分析である。この方法により、細胞内ナノ構造であっても、分子分解能で、さらにはそれ以上の超微細構造の詳細を取得することができます。それにもかかわらず、TEMの特異な空間分解能は、時間的次元の情報を犠牲にして達成され、これはここで興味深い。これを補うために、生細胞イメージング技術における最近の進歩が特に注目されている。これらには、性能が向上した新しい蛍光マーカー(輝度や光安定性など)、最適化された標識手順、より高感度の検出器が含まれます。さらに、構造(例えば、局所画像相関分光法、PLICS 23、Number&Brightness分析24による凝集/オリゴマー化のフェーザーベースの分析による「サイズ」)および動的(例えば、単一粒子追跡による拡散法則、すなわち、(SPT)25、26、27、28の両方に対処するために、分析ツールが利用可能である。)パラメータを細胞内スケールで示す。SPT メソッドを使用すると、オブジェクトの軌道とその MSD に直接アクセスできます。しかしながら、欠点は、統計的基準を満たすために測定される低密度のプローブおよび非常に明るいラベルおよび多くの単一物体軌道の必要性である。測定の時間分解能に関して、無機の光受容性プローブ(例えば、量子ドットまたは金属ナノ粒子)は、SPT性能を増加させることができるが、複雑な製造および標識手順を犠牲にする。
これらの標準と比較して、ここで説明するiMSD法は、いくつかの重要な利点を示しています。第1に、このアプローチは、遺伝的にコードされた蛍光タンパク質などの比較的薄暗い蛍光タグ(例えば、ISGへの適用)と組み合わせて使用することができる。したがって、SPTと比較して、必要な光子の量が少ないため、より高い時間分解能が(同じラベルを使用して)達成される8。第2に、iMSD法は時間分解能によってのみ制限され、回折によって制限されるわけではない。実際、回折制限された光学セットアップが使用されているにもかかわらず、STICS29を使用して分子流についてすでに実証されているように、回折限界を下回っても平均分子変位を測定することができます。変位測定における実際の分解能は、相関関数を(信号対雑音の観点から)どれだけ正確に測定できるかによって異なり、回折によって制限されない理由を説明します。したがって、測定できる最小変位は、対象物体の拡散性および撮像セットアップの時間分解能に依存することは明らかであるように思われる。
これに関して、レーザー走査顕微鏡によるマクロピノソームまたはインスリン顆粒などの細胞内ナノ構造への適用が最適であることを考慮することが重要である:利用可能な走査速度は、目的の物体のダイナミクスよりも有意に高い。このような場合、取得中の物体の動きはごくわずかであり、相関関数はガウス関数によって近似することができる。最後に、iMSDアプローチは、ラスタースキャンまたは広視野カメラベースのイメージングに基づく幅広い商用光学顕微鏡セットアップに容易に適用でき、システムキャリブレーションは必要ありません(粒子サイズの正確な推定を達成する必要がある場合のみ必要です)。メソッドが機能するための重要なパラメーターは、適切な空間サンプリングです。一般的なルールとして、フィッティングアルゴリズムの満足のいく収束に達するためには、画像化のための関心領域の最小サイズは、関心の最大変位よりも少なくとも3倍大きくなければならない。
結論として、iMSD法は、迅速な取得のために装備された顕微鏡のみを必要とする。目的の構造は、遺伝的にコードされた任意の蛍光色素分子または有機蛍光色素分子にタグ付けできるため、マルチチャンネルイメージングが可能になります。クロスiMSD解析は、近い将来、細胞内ナノ構造の部分集団を選択し、細胞内での相互作用と共拡散を明らかにするために用いられることが想定されており、後者は細胞生物物理学においてホットな話題となっている。iMSD解析によって詳細が失われた場合、これは確かに動的細胞内ナノ構造内の大量の分子情報に関連しています。このような情報は、時間分解能が低いため、測定中に必然的に平均化されます。しかし、理論的には、十分な取得速度を達成できれば、分子情報を取り出す可能性による技術的限界はない8.検出器の速度/感度とイメージング技術の継続的な改善により、細胞内区画全体とその分子構成成分に関する情報が単一のデータセットから抽出されることが想定されています。
開示事項
著者は宣言する利益相反はありません。
謝辞
この研究は、欧州連合のHorizon 2020 Research and Innovation Programme(助成金契約No 866127、Project CAPTUR3D)の下で、欧州研究評議会(ERC)から資金提供を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 100x Penicillin-Streptomycin-Glutamine | Gibco | 10378-016 | Cell medium supplement |
| C-peptide-EGFP | Plasmid | ||
| DMEM High Glucose | Gibco | 31053028 | Cell medium (HeLa) |
| FBS | Gibco | 10082147 | Cell medium supplement |
| Fluorescein isothiocyanate-dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | Reagent |
| HeLa | ATCC | CCL-61 | Cell Line |
| Lipofectamine 2000 | TermoFisher | 11668019 | Trasfection reagent |
| Lysotracker Red DND-99 | Gibco | L7528 | Reagent |
| Matlab | MathWork | Software | |
| Microscope-suitable cell dishes | Willco | GWSt-3522 | Petri dishes |
| Olympus FV1000 | Olympus Japan | Confocal microscope | |
| RPMI 1640 | Gibco | 11835063 | Cell medium (INS-1E) |
参考文献
- Murphy, J. E., Padilla, B. E., Hasdemir, B., Cottrell, G. S., Bunnett, N. W. Endosomes: a legitimate platform for the signaling train. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17615-17622 (2009).
- Mosesson, Y., Mills, G. B., Yarden, Y. Derailed endocytosis: an emerging feature of cancer. Nature Reviews Cancer. 8 (11), 835-850 (2008).
- Mellman, I., Yarden, Y. Endocytosis and cancer. Cold Spring Harbor Perspectives in Biology. 5 (12), 016949 (2013).
- Di Fiore, P. P. Endocytosis, signaling and cancer, much more than meets the eye. Preface. Molecular Oncology. 3 (4), 273-279 (2009).
- Bogan, J. S., Xu, Y., Hao, M. Cholesterol accumulation increases insulin granule size and impairs membrane trafficking. Traffic. 13 (11), 1466-1480 (2012).
- Ballabio, A., Gieselmann, V. Lysosomal disorders: From storage to cellular damage. Biochimica et Biophysica Acta. 1793 (4), 684-696 (2009).
- Hu, Y. -. B., Dammer, E. B., Ren, R. -. J., Wang, G. The endosomal-lysosomal system: from acidification and cargo sorting to neurodegeneration. Translational Neurodegeneration. 4, 18 (2015).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Spatiotemporal fluctuation analysis: a powerful tool for the future nanoscopy of molecular processes. Biophysical Journal. 111 (4), 679-685 (2016).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Fast spatiotemporal correlation spectroscopy to determine protein lateral diffusion laws in live cell membranes. Proceedings of the National Academy of Sciences of the United States of America. 110 (30), 12307-12312 (2013).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. From fast fluorescence imaging to molecular diffusion law on live cell membranes in a commercial microscope. Journal of Visualized Experiments: JoVE. (92), e51994 (2014).
- Digiacomo, L., et al. Dynamic fingerprinting of sub-cellular nanostructures by image mean square displacement analysis. Scientific Reports. 7 (1), 14836 (2017).
- Durso, W., et al. Lysosome dynamic properties during neuronal stem cell differentiation studied by spatiotemporal fluctuation spectroscopy and organelle tracking. International Journal of Molecular Sciences. 21 (9), 3397 (2020).
- Ferri, G., et al. Insulin secretory granules labelled with phogrin-fluorescent proteins show alterations in size, mobility and responsiveness to glucose stimulation in living β-cells. Scientific Reports. 9 (1), 2890 (2019).
- Durso, W., D'Autilia, F., Amodeo, R., Marchetti, L., Cardarelli, F. Probing labeling-induced lysosome alterations in living cells by imaging-derived mean squared displacement analysis. Biochemical and Biophysical Research Communications. 503 (4), 2704-2709 (2018).
- Digiacomo, L., Digman, M. A., Gratton, E., Caracciolo, G. Development of an image Mean Square Displacement (iMSD)-based method as a novel approach to study the intracellular trafficking of nanoparticles. Acta Biomaterialia. 42, 189-198 (2016).
- Swanson, J. A., Watts, C. Macropinocytosis. Trends in Cell Biology. 5 (11), 424-428 (1995).
- Jones, A. T. Macropinocytosis: searching for an endocytic identity and role in the uptake of cell penetrating peptides. Journal of Cellular and Molecular Medicine. 11 (4), 670-684 (2007).
- Falcone, S., et al. Macropinocytosis: regulated coordination of endocytic and exocytic membrane traffic events. Journal of Cell Science. 119, 4758-4769 (2006).
- Kerr, M. C., et al. Visualisation of macropinosome maturation by the recruitment of sorting nexins. Journal of Cell Science. 119, 3967-3980 (2006).
- Rorsman, P., Renstrom, E. Insulin granule dynamics in pancreatic beta cells. Diabetologia. 46 (8), 1029-1045 (2003).
- Di Rienzo, C., Piazza, V., Gratton, E., Beltram, F., Cardarelli, F. Probing short-range protein Brownian motion in the cytoplasm of living cells. Nature Communications. 5 (1), 5891 (2014).
- Ferri, G., et al. Time-lapse confocal imaging datasets to assess structural and dynamic properties of subcellular nanostructures. Scientific Data. 5 (1), 180191 (2018).
- Scipioni, L., Gratton, E., Diaspro, A., Lanzanò, L. Phasor analysis of local ICS detects heterogeneity in size and number of intracellular vesicles. Biophysical Journal. 111 (3), 619-629 (2016).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical Journal. 94 (6), 2320-2332 (2008).
- Li, C. H., Bai, L., Li, D. D., Xia, S., Xu, T. Dynamic tracking and mobility analysis of single GLUT4 storage vesicle in live 3T3-L1 cells. Cell Research. 14 (6), 480-486 (2004).
- Donovan, K. W., Bretscher, A. Tracking individual secretory vesicles during exocytosis reveals an ordered and regulated process. Journal of Cell Biology. 210 (2), 181-189 (2015).
- Westphal, V., et al. Video-rate far-field optical nanoscopy dissects synaptic vesicle movement. Science. 320 (5873), 246-249 (2008).
- Tabei, S. M. A., et al. Intracellular transport of insulin granules is a subordinated random walk. Proceedings of the National Academy of Sciences of the United States of America. 110 (13), 4911-4916 (2013).
- Hebert, B., Costantino, S., Wiseman, P. W. Spatiotemporal image correlation spectroscopy (STICS) theory, verification, and application to protein velocity mapping in living CHO cells. Biophysical Journal. 88 (5), 3601-3614 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved