Method Article
基于时空波动光谱的运输亚细胞纳米结构的结构和动态性质
摘要
成像衍生的均方位移(iMSD)分析应用于大刺激小体,以突出它们在结构和动态特性方面的内在时间演化性质。然后将大孔蛋白酶体与胰岛素分泌颗粒(ISG)进行比较,作为具有时间不变平均结构/动态特性的亚细胞结构的参考。
摘要
成像衍生的均方位移(iMSD)用于解决亚细胞纳米结构的结构和动态特性,例如参与溶质和生物分子的内/胞外运输的囊泡。iMSD依赖于标准的延时成像,与任何光学设置兼容,并且不需要停留在单个物体上来提取轨迹。从每个iMSD迹线中,计算并组合平均结构和动态参数(即尺寸,局部扩散率,异常系数)的唯一三重态,以构建所研究的纳米结构的"iMSD特征"。
这种方法的有效性在这里用大孔蛋白酶体的示范案例证明了。这些囊泡随着时间的推移而进化,改变它们的平均大小,数量和动态特性,从细胞内运输的早期到晚期阶段。作为对照,胰岛素分泌颗粒(ISG)被用作生活在静止状态的亚细胞结构的参考,在这种状态下,整个物体群体的平均结构和动态特性在时间上是不变的。iMSD分析定量地突出了这些特殊特征,并为亚细胞水平的类似应用铺平了道路,无论是在生理还是病理状态下。
引言
亚细胞纳米结构(例如,内吞/分泌囊泡,细胞器)在细胞信号传导调节1中起关键作用。正确调整其结构(例如,大小)和/或动态(例如,扩散率)特征决定了细胞如何响应内部或外部刺激2,3,4。基于这些证据,在许多病理条件下发现这些特征的改变也就不足为奇了。例子包括失调的内吞作用在癌症中的作用2,3,暴露于2型糖尿病的β细胞5中ISG水平上发现的结构和动态改变,球状细胞白细胞白细胞营养不良或半乳糖基神经酰胺脂质病6中溶酶体结构和转运特性的错误调节,以及神经退行性疾病(例如阿尔茨海默病)中内溶酶体通路的功能失调7。
在这种情况下,研究人员最近证明,通过适当调整空间和时间采样分辨率8,可以提高标准光学显微镜方法的性能。反过来,这可以进一步了解相关的生物过程。在实践中,这是通过时空波动分析算法实现的,该算法同时直接从标准光学显微镜图像堆栈中提取扩散物体的平均结构和动态特性,而无需对感兴趣的生物物体进行任何初步了解并提取单个物体轨迹。所有这些信息都包含在该方法的单个输出中:iMSD迹线9 (有关iMSD迹线派生和分析的详细信息在 补充文件1中给出)。
由此产生的实验方案由几个步骤组成。首先,以高时间分辨率对感兴趣区域进行成像。然后,从图像堆栈中计算平均时空相关函数。最后,通过高斯拟合一系列相关函数,直接从成像中得到平均"扩散定律",并对其进行分析,以识别物体扩散模式。该方法的潜力已经被证明用于各种生物对象,从分子到纳米颗粒,甚至整个亚细胞器/结构9,10,11,12,13,14,15。
本文报告了iMSD在大蛋白酶体中的应用,以突出其平均(即在整个种群水平上)结构和动态特性的内在,不可逆的时间演化性质。此外,将这些内吞囊泡与ISG进行比较,作为处于"静止状态"的亚细胞结构的参考,即在整个颗粒群体的平均结构/动态特性在任何时间点保持恒定的状态。大毛细胞增多症定义了由质膜的广泛重组(或褶皱)引发的一系列事件,以形成外部大旋细胞结构,然后内化16。形成的早期巨噬细胞体与吞噬体非常相似。同时,它们可以与其他形式的内吞囊泡区分开来,因为它们具有特征性的大尺寸,形态异质性和缺乏蛋白质涂层结构。
生化测定显示,在内化后,巨蛋白酶体逐渐富集其他内吞途径的蛋白质标记物,反过来表明它们的身份在运输过程中不断变化17。使用针对内体途径已知标记物的抗体,证明大孔蛋白酶体逐渐采用经典的内体特征:它们减小,发展成晚期内吞结构(例如溶酶体),或者通过膜介导的特定分子标记物(例如,分选神经素)最终失去其身份18,19.总体情况是,细胞内的每个大蛋白酶体在从质膜运输到最终的细胞内命运的过程中都会不可逆地改变其结构和动态(以及分子)身份。因此,整个大孔蛋白酶体群体的结构/动力学/分子特性也沿着相同的时间路径发生变化。由于对整个被观察对象群体的平均特性具有内在敏感性,iMSD方法通过量化关键平均参数(即局部扩散率和异常系数(动态特性)以及大孔蛋白酶体(结构特性)在其细胞内运输的任何阶段的平均大小(结构特性)来定量地描述"进化性质"。
为了进行比较,在β细胞模型中对众所周知的细胞内膜封闭结构ISG进行了类似的测量。与巨噬细胞体一样,ISG结构和动态特性的调节,从它们在反式高尔基体网络(TGN)的产生到它们在质膜上的胞吐,对于ISG功能20的正确执行至关重要。然而,与巨蛋白酶体不同,ISG生活在"平稳状态"中,在任何时候,ISG寿命的所有功能/结构/分子阶段同时存在于细胞内,并且每个阶段都由特定的ISG亚群表示。这意味着,尽管每个颗粒都不可逆地从生物发生进化到分泌,但整个颗粒群体的平均结构/动态特性预计在任何时间点都保持不变(除非静止状态条件被改变,例如,通过葡萄糖,胆固醇和细胞因子等外部刺激13)。iMSD分析证实了这一点。
研究方案
1. 样品制备
- 在显微镜实验之前,培养皿中的细胞适合显微镜应用。
- 用0.01 M 1x PBS洗涤10cm组织培养处理的融合HeLa或INS 1E(胰岛素瘤β细胞样)细胞两次,加入1mL 0.05%胰蛋白酶- EDTA(1x),并将其置于37°C,加湿,5%CO2 培养箱中5分钟。
- 通过加入9mL完全DMEM(用于HeLa细胞)或RPMI 1640(用于INS-1E细胞)培养基来重悬分离的细胞,并将最后的10mL收集在离心管中。
- 在每个35mm x 10mm培养皿中接种约2×10个5个细胞,最终体积为1mL培养基。将细胞在37°C和5%CO 2下孵育24小时。
- 要荧光标记溶酶体,请使用LysoTracker Red DND-99。
- 将储备溶液在1mL预热培养基中稀释至最终染料浓度为70nM。
- 用新鲜的含有LysoTracker的培养基替换盘子中的培养基。将细胞在含有LysoTracker的培养基中在5%CO 2气氛中在37°C下孵育20 分钟,并在实验前用新鲜培养基洗涤两次。
- 为了荧光标记大孔小体,使用70-kDa荧光素异硫氰酸酯 - 葡聚糖。用0.01M 1x磷酸盐缓冲盐水(PBS)洗涤传代培养的细胞三次,用含葡聚糖的培养基(1mg / mL)替换,并在37°C下孵育30分钟。在进行显微镜实验之前,用新鲜培养基洗涤细胞三次。
- 为了在INS-1E细胞中以荧光标记ISG,根据制造商的方案,使用转染试剂(参见 材料表)和C肽增强绿色荧光蛋白(EGFP)质粒13 转染细胞,并在实验前在37°C下在5%CO 2气氛中孵育24 小时。
2. 数据采集
- 为了让显微镜在所需的温度和气氛下平衡,请在实验前至少2小时打开显微镜培养箱控制系统。
注意:每次采集都是一个延时序列。 - 使用配备60x,1.2数值孔径(NA)水浸物镜的倒置共聚焦显微镜采集图像。
- 使用488nm氩激光激发EGFP(转染细胞)和荧光素标记的大蛋白酶体。使用标准光电倍增管检测器收集500至600nm之间的荧光发射。
- 使用543 nm HeNe激光激发溶酶跟踪仪并收集其555至655 nm之间的荧光发射。
- 将检测针孔的直径设置为 1 Airy 的大小。对于每次采集,收集一系列 1000 个连续帧。将像素停留时间设置为 2 μs/像素,帧时间为 129 ms。
注意:每个帧由 256 x 256 像素(16 位/像素)组成,物理尺寸为 69 nm/像素,大约相当于 17 μm x 17 μm 的面积。
3. i默沙东计算
注意:要正确执行计算,请使用能够进行数值计算和脚本编程的软件。特定脚本(即,对于"iMSD.m"脚本文件,请参阅 支持文件 1)必须存在于包含要处理的映像系列的同一目录中。该系列的每个图像都必须另存为不同的".tif"文件。
- 要正确初始化用于采集的仪器参数,请使用软件文本编辑器打开iMSD.m并修改其第一部分,如下所示。
- 将 N 设置为时间序列中的帧数(例如,在此协议中为 1000)。
- 设置 px_size:像素大小,以μm表示(例如,在此协议中为0,069)。
- 设置 f:每帧的时间分辨率,以秒为单位表示(例如,在此协议中为0,129)。
- 设置 过滤器:用于背景校正的二进制输入,将值设置为"0"以处理原始图像,或将值设置为"1"以执行基于阈值的背景减法。
- 设置 av_toll:背景校正阈值;如果 Filter=1,则强度低于此值的任何像素都将设置为 0。
- 将 位 设置为确定强度采样的整数(例如,8 位、16 位)。
- 保存并运行编辑后的 iMSD.m 脚本文件。
- 检查脚本执行。
注意:可以在命令窗口检查计算处理状态;如果发生任何致命问题,该过程将被中断,并且将显示一条警告消息以显示错误类型和相关行代码。否则,请按照步骤 3.3.1-3.3.3。- 导入图像堆栈并减去背景(如果需要)。
- 使用傅里叶法计算时空相关函数 G(ξ,η,τ)。
- 将时空相关函数拟合为二维高斯函数。
注意:在过程结束时,σ2(τ) 拟合过程的输出值将显示在命令窗口中:报告拟合的平均值、误差和相应的优劣 (R2)。
- 检查图形输出。
注:iMSD 曲线和相应的拟合曲线显示在三个单独的面板中,每个面板对应使用的不同类型的拟合方程:布朗扩散、异常扩散或受限扩散。对于每条曲线,R2 值在图形图例中报告。 - 检查文本输出。
注意:在该过程结束时,将创建一个".xls"文件,其名称与原始延时".tif"文件的名称相同。第一个工作表包含为每个时间延迟计算的 ξ、η、τ 和 σ2 的值。输入参数和主计算输出值在第二张表中报告,即扩散系数、异常系数和y轴σ20 截距。
结果
该方法的一般工作流程如图 1 所示。它概述了方案部分提出的主要步骤,从样品制备(图1A)到细胞内纳米结构的延时成像(图1B),用于计算一系列时空相关函数的波动分析(图1C),以及用于推导所研究物体的平均结构/动力学特性的拟合(图1D)。
一个关键参数是用于对感兴趣的亚细胞物体进行成像的时间分辨率。该实验值将设置测量感兴趣对象的最小平均位移的时间阈值。然而,优选的条件是设置成像的时间分辨率,在该分辨率下,感兴趣的对象在捕获的帧内显得"不动",即,它显示的特征尺寸,平均而言,不会由于成像速度而变形。如果感兴趣的对象是膜封闭的亚细胞结构或细胞器(如本例所示),这在技术上是可能的。通常,亚细胞结构表现出局部扩散系数(D,μm2 / s,见 表1),比细胞质中分离的单分子(例如GFP21)低几个数量级。验证可以通过人工固定感兴趣的细胞器(例如,通过化学固定)来执行。实际上,该条件可以作为参考,以确定在所使用的实验条件下的实际细胞器尺寸(例如,激发波长,像素尺寸,物镜)。
在这里,尽管溶酶体被用作该手术的测试细胞器,但结果独立于靶结构是有效的。 图2A 显示了固定(即不动)溶酶体的图像,以及以适当的时间分辨率(即,通常低于100 ms /帧;例如, 图2B中的示例中的65 ms /帧)对活细胞进行的采集,以及以非常低的时间分辨率(例如, 图2C中的示例中的10 s /帧)故意进行的采集。).对于每种情况,扩散物体的大小提取如下:i)通过ImageJ软件中的线工具导出斑点的强度曲线;ii)强度曲线由高斯函数绘制和插值,以计算全宽度的半最大值(FWHM)值,该值又用作光斑直径的估计值(图2D)。正如 图2E所示,在非常高的时间分辨率(即65 ms/帧)下采集,通过使用上述标准工具或通过提取 iMSD y轴截距,可以产生接近固定样本中获得的结构的平均尺寸。相反,由于成像过程中的自然结构动力学,以慢速采集会导致结构表观尺寸的增加。在次优实验条件下,提取的结构/动态信息不能忠实地反映所研究对象的内在特性。
一旦选择了主要的实验参数,就可以为目标细胞内结构生成数据集。对于大孔蛋白酶体,在用70 kDa右旋糖孵育细胞20分钟后,在处理后的不同时间点获得标记的细胞内结构的时间序列,从30分钟到大约180分钟。有趣的是,在运输过程中检测到大孔细胞的结构和动态特性的逐渐变化(图3;在左侧的图中报告了大孔小体的σ0,Dm,α和N的分布)。虽然在运输过程中未检测到大孔蛋白酶体的局部扩散率(Dm)的明显变化,但特征大小(σ02)和整体运动模式(α)都会随着时间的推移而变化。
特别值得注意的是,在运输过程中观察到大孔细胞平均大小的减小(图3A,左),以及伴随其运动的微分性质的增加(即,表示为α值的减少, 图3C,左图)。此外,从每次采集中提取大孔细胞的数量: 结果在图3D左图中报告,清楚地显示大胰岛素体数量在时间上的增加。所有这些结果都与预期完全一致,因为葡聚糖标记的巨蛋白酶体应该起源于质膜上分离的大膜封闭囊泡(也能够沿着细胞骨架成分运动),但应该逐渐与由大量较小和随机扩散结构组成的内溶酶体途径相通。
如上所述,大孔蛋白酶体的结果与在ISG上进行的类似测量形成鲜明对比(图3,右栏)。胰岛素颗粒在观察到的巨蛋白酶体的同一时间窗口中,不显示iMSD衍生的结构/动态参数(以及它们在细胞内的平均数量)的时间演变趋势。此外,σ02,Dm和α的特征值与溶酶体的特征值有很大不同,再次用作参考。这一结果证实了这个想法,正如上面所预期的那样,颗粒在"静止状态"下被探测,在这种状态下,在任何时候,整个ISG群体的平均结构/动态特性保持不变(即,它们保持不变,除非静止状态条件发生变化,例如,由于外部刺激)。
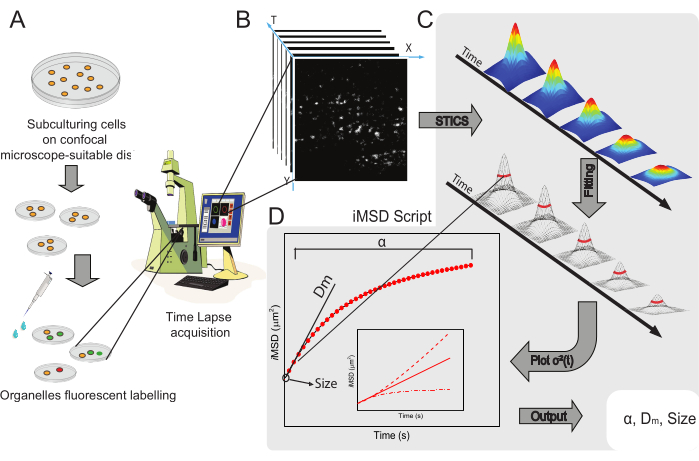
图1:实验工作流程。 (A)在共聚焦实验前24小时(转染实验为48小时)将细胞接种到适合显微镜应用的细胞培养皿上。然后根据标记方法(参见方案)对细胞进行适当的处理,以染色感兴趣的细胞质细胞器。(B)典型的共聚焦采集由活细胞细胞质部分的一堆图像(延时)组成,描述了标记细胞器动力学的时间进化。(C)使用定制的Matlab脚本分析延时短片,首先计算时空图像相关函数和高斯拟合,以绘制iMSD曲线(D)和相关提取的拟合参数,描述成像细胞器的结构动力学参数。缩写:iMSD = 成像派生的均方位移;STICS = 时空图像相关光谱;α = 异常扩散系数;Dm = 局部扩散率;σ2(τ) = 方差。 请点击此处查看此图的大图。
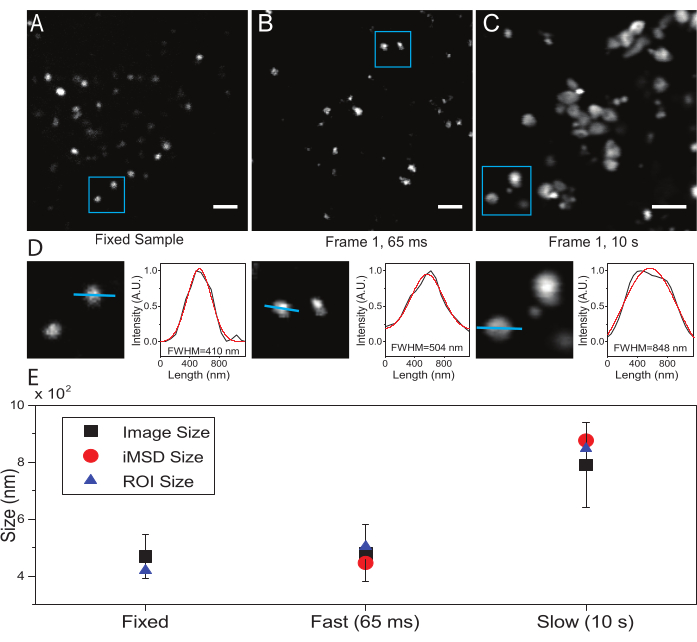
图2:适当的实验参数。 (A)固定样品中染色溶酶体的示例性图像。比例尺 = 2 μm. (B) 活细胞中染色溶酶体图像堆叠的第一帧,使用适当的参数获取。时间分辨率:65 毫秒/帧。(C)以低速获得的活细胞中染色溶酶体图像的第一帧:成像过程中由于细胞器运动而导致的表观溶酶体大小的伪像变形是可见的。时间分辨率:10 s/帧。比例尺 = 2 μm. (D) 在蓝色 ROI 为 (A)、(B) 和 (C) 中成像溶酶体的大小计算示例。沿蓝线的强度分布拟合了高斯函数以检索FWHM,即光斑大小的估计值。报告每个管接头的 FWHM 值。(E)通过面板(D)中描述的所有成像溶酶体(黑色正方形,平均值和标准偏差)的图像分析获得的大小值的图形表示,对于包含在蓝色ROI(蓝色三角形)内的溶酶体,并通过iMSD分析(红色圆圈)检索。这个数字来自 22。缩写:ROI = 感兴趣的区域;FWHM = 半最大值处的全宽;iMSD = 成像派生的均方位移。 请点击此处查看此图的大图。
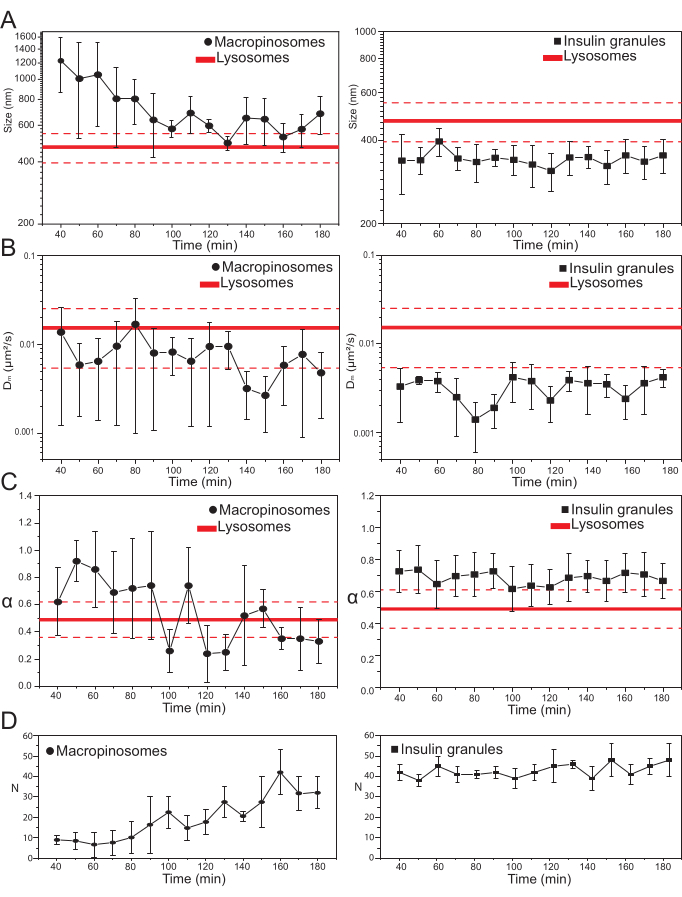
(A)iMSD提取的尺寸值与后续采集的时间进展的关系图表示为在10分钟时间窗口上进行的采集中测量值的平均值。在左边,大胰岛素样体(黑圆圈)的平均大小的逐渐减小,在右边,胰岛素分泌颗粒(黑色方块)的时间不变大小与溶酶体相比,表示为平均大小值(较粗的红线)±标准偏差(虚线红线)。(B)和(C)通过iMSD分析提取的大胰岛素样体(左)和胰岛素颗粒(右)的Dm和α系数的时间进展。(D)在每个获得的延时电影的第一帧中测量的标记大蛋白酶体和胰岛素颗粒数量的时间演变。缩写:iMSD = 成像派生的均方位移;α = 异常扩散系数;Dm = 局部扩散率,N = 数。请点击此处查看此图的大图。
| 细胞 | 标签 | 细胞系 | 尺寸(海里) | Dm ( × 10-3 μm2/s) | α | N | 裁判。 | ||
| 早期内体 (EE) | 细胞光早期内体GFP | 呵呵 | 395±74 | 3.0±2.4 | 1.02±0.20 | 40 | 10 | ||
| 晚期内体 | 细胞光晚期内体GFP | 呵呵 | 693±102 | 15.4±10.6 | 0.57±0.16 | 58 | 10 | ||
| 溶酶体 | 利索跟踪器 DND-99 | 呵呵 | 471±76 | 15.3±9.0 | 0.49±0.13 | 143 | 10, 14 | ||
| 卡沃拉 (CAV) | Caveolin-EGFP | 呵呵 | 405±49 | 3.1±1.8 | 1.00±0.22 | 15 | 10 | ||
| 克拉氏包被囊泡 (CCV) | 转铁蛋白-Alexa 488 | 呵呵 | 513±62 | 16.2±9.9 | 0.48±0.17 | 33 | 10 | ||
| 胰岛素颗粒 | C-肽-EGFP | INS-1E | 335±56 | 3.0±1.7 | 0.70±0.14 | 107 | 11 | ||
| 早期巨噬细胞体 | 荧光素-葡聚糖 70 kDa | 呵呵 | 979±423 | 8.3±9 | 0.79±0.27 | 36 | 10 | ||
| 中间巨噬细胞体 | 荧光素-葡聚糖 70 kDa | 呵呵 | 702±180 | 13.7±19.9 | 0.60±0.38 | 29 | 10 | ||
| 晚期巨蛋白酶体 | 荧光素-葡聚糖 70 kDa | 呵呵 | 592±127 | 5.8±4.7 | 0.39±0.21 | 21 | 10 | ||
表1:结构和动态 iMSD提取的参数。 该表显示了为不同细胞器测量的尺寸,Dm和α系数的值,指定了标记策略,使用的细胞系以及分析的采集数量。值报告为平均值±标准偏差。缩写:iMSD = 成像派生的均方位移;α = 异常扩散系数;Dm = 局部扩散率,N = 数;GFP = 绿色荧光蛋白;EGFP = 增强的绿色荧光蛋白。
补充文件 1:有关 iMSD 跟踪派生和分析的详细信息。请点击此处下载此文件。
支持文件1:请点击这里下载此文件。
讨论
与可用于检索类似信息的技术相比,iMSD的特性和优势是显而易见的。对于结构信息,首选是透射电子显微镜(TEM)分析。通过这种方法,可以检索分子分辨率甚至更高的超微结构细节,即使对于亚细胞纳米结构也是如此。然而,TEM的特殊空间分辨率是以牺牲时间维度中的信息为代价实现的,这在这里很有趣。为了弥补这一点,活细胞成像技术的最新进展特别令人感兴趣。这些包括具有更高性能(例如亮度和光稳定性)的新型荧光标记物,优化的标记程序以及更灵敏的检测器。此外,分析工具可用于解决结构(例如,通过基于相量的局部图像相关光谱分析的"大小",PLICS23,通过数和亮度分析24进行聚集/齐聚)和动态(例如,通过单粒子跟踪的扩散定律,即(SPT)25,26,27,28) 参数在亚细胞尺度上。SPT方法允许直接访问物体轨迹及其MSD。然而,缺点是需要低密度的探头和非常明亮的标签以及许多单一物体轨迹来测量以满足统计标准。关于测量的时间分辨率,无机的光稳定探针(例如,量子点或金属纳米颗粒)可以提高SPT性能,但以牺牲复杂的生产和标记程序为代价。
与这些标准相比,这里描述的iMSD方法显示出一些关键优势。首先,这种方法可以与相对暗淡的荧光标签结合使用,例如遗传编码的荧光蛋白(例如,应用于ISG)。因此,与SPT相比,由于所需的光子量较低,因此实现了更高的时间分辨率(使用相同的标签)。其次,iMSD方法仅受时间分辨率的限制,而不受衍射的限制。事实上,尽管使用了衍射极限光学设置,但即使低于衍射极限也可以测量平均分子位移,正如使用STICS29已经证明的分子流所示。位移测量的实际分辨率取决于测量相关函数的精度(就信噪比而言),从而解释了为什么它不受衍射的限制。因此,可以测量的最小位移显然取决于目标物体的扩散率和成像设置的时间分辨率。
在这方面,重要的是要考虑用激光扫描显微镜应用于亚细胞纳米结构,例如大孔蛋白酶体或胰岛素颗粒是最佳的:可用的扫描速度明显高于目标对象的动力学。在这种情况下,对象在采集过程中的运动可以忽略不计,相关函数可以近似于高斯函数。最后,iMSD方法可以很容易地应用于基于光栅扫描或基于宽视场相机成像的各种商业光学显微镜设置,无需系统校准(仅当需要实现颗粒尺寸的准确估计时才需要)。该方法工作的一个重要参数是适当的空间采样。作为一般规则,为了达到拟合算法的满意收敛,用于成像的感兴趣区域的最小尺寸应至少大于最大位移的3倍。
总之,iMSD方法只需要配备用于快速采集的显微镜。感兴趣的结构可以标记到任何遗传编码或有机荧光团,从而实现多通道成像。预计在不久的将来,交叉iMSD分析将用于选择亚细胞纳米结构的亚群,并揭示它们在细胞内的相互作用和共扩散,后者是细胞生物物理学的热门话题。如果iMSD分析丢失了任何细节,这肯定与动态亚细胞纳米结构中的大量分子信息有关。由于时间分辨率差,这些信息在测量过程中不可避免地被平均化。然而,从理论上讲,由于检索分子信息的可能性,不存在技术限制,前提是可以达到足够的采集速度8。由于检测器速度/灵敏度和成像技术的不断改进,预计有关整个亚细胞区室及其分子成分的信息将从单个数据集中提取。
披露声明
作者没有利益冲突需要声明。
致谢
这项工作已获得欧洲研究理事会(ERC)根据欧盟地平线2020研究与创新计划(赠款协议无866127,项目CAPTUR3D)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 100x Penicillin-Streptomycin-Glutamine | Gibco | 10378-016 | Cell medium supplement |
| C-peptide-EGFP | Plasmid | ||
| DMEM High Glucose | Gibco | 31053028 | Cell medium (HeLa) |
| FBS | Gibco | 10082147 | Cell medium supplement |
| Fluorescein isothiocyanate-dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | Reagent |
| HeLa | ATCC | CCL-61 | Cell Line |
| Lipofectamine 2000 | TermoFisher | 11668019 | Trasfection reagent |
| Lysotracker Red DND-99 | Gibco | L7528 | Reagent |
| Matlab | MathWork | Software | |
| Microscope-suitable cell dishes | Willco | GWSt-3522 | Petri dishes |
| Olympus FV1000 | Olympus Japan | Confocal microscope | |
| RPMI 1640 | Gibco | 11835063 | Cell medium (INS-1E) |
参考文献
- Murphy, J. E., Padilla, B. E., Hasdemir, B., Cottrell, G. S., Bunnett, N. W. Endosomes: a legitimate platform for the signaling train. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17615-17622 (2009).
- Mosesson, Y., Mills, G. B., Yarden, Y. Derailed endocytosis: an emerging feature of cancer. Nature Reviews Cancer. 8 (11), 835-850 (2008).
- Mellman, I., Yarden, Y. Endocytosis and cancer. Cold Spring Harbor Perspectives in Biology. 5 (12), 016949 (2013).
- Di Fiore, P. P. Endocytosis, signaling and cancer, much more than meets the eye. Preface. Molecular Oncology. 3 (4), 273-279 (2009).
- Bogan, J. S., Xu, Y., Hao, M. Cholesterol accumulation increases insulin granule size and impairs membrane trafficking. Traffic. 13 (11), 1466-1480 (2012).
- Ballabio, A., Gieselmann, V. Lysosomal disorders: From storage to cellular damage. Biochimica et Biophysica Acta. 1793 (4), 684-696 (2009).
- Hu, Y. -. B., Dammer, E. B., Ren, R. -. J., Wang, G. The endosomal-lysosomal system: from acidification and cargo sorting to neurodegeneration. Translational Neurodegeneration. 4, 18 (2015).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Spatiotemporal fluctuation analysis: a powerful tool for the future nanoscopy of molecular processes. Biophysical Journal. 111 (4), 679-685 (2016).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Fast spatiotemporal correlation spectroscopy to determine protein lateral diffusion laws in live cell membranes. Proceedings of the National Academy of Sciences of the United States of America. 110 (30), 12307-12312 (2013).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. From fast fluorescence imaging to molecular diffusion law on live cell membranes in a commercial microscope. Journal of Visualized Experiments: JoVE. (92), e51994 (2014).
- Digiacomo, L., et al. Dynamic fingerprinting of sub-cellular nanostructures by image mean square displacement analysis. Scientific Reports. 7 (1), 14836 (2017).
- Durso, W., et al. Lysosome dynamic properties during neuronal stem cell differentiation studied by spatiotemporal fluctuation spectroscopy and organelle tracking. International Journal of Molecular Sciences. 21 (9), 3397 (2020).
- Ferri, G., et al. Insulin secretory granules labelled with phogrin-fluorescent proteins show alterations in size, mobility and responsiveness to glucose stimulation in living β-cells. Scientific Reports. 9 (1), 2890 (2019).
- Durso, W., D'Autilia, F., Amodeo, R., Marchetti, L., Cardarelli, F. Probing labeling-induced lysosome alterations in living cells by imaging-derived mean squared displacement analysis. Biochemical and Biophysical Research Communications. 503 (4), 2704-2709 (2018).
- Digiacomo, L., Digman, M. A., Gratton, E., Caracciolo, G. Development of an image Mean Square Displacement (iMSD)-based method as a novel approach to study the intracellular trafficking of nanoparticles. Acta Biomaterialia. 42, 189-198 (2016).
- Swanson, J. A., Watts, C. Macropinocytosis. Trends in Cell Biology. 5 (11), 424-428 (1995).
- Jones, A. T. Macropinocytosis: searching for an endocytic identity and role in the uptake of cell penetrating peptides. Journal of Cellular and Molecular Medicine. 11 (4), 670-684 (2007).
- Falcone, S., et al. Macropinocytosis: regulated coordination of endocytic and exocytic membrane traffic events. Journal of Cell Science. 119, 4758-4769 (2006).
- Kerr, M. C., et al. Visualisation of macropinosome maturation by the recruitment of sorting nexins. Journal of Cell Science. 119, 3967-3980 (2006).
- Rorsman, P., Renstrom, E. Insulin granule dynamics in pancreatic beta cells. Diabetologia. 46 (8), 1029-1045 (2003).
- Di Rienzo, C., Piazza, V., Gratton, E., Beltram, F., Cardarelli, F. Probing short-range protein Brownian motion in the cytoplasm of living cells. Nature Communications. 5 (1), 5891 (2014).
- Ferri, G., et al. Time-lapse confocal imaging datasets to assess structural and dynamic properties of subcellular nanostructures. Scientific Data. 5 (1), 180191 (2018).
- Scipioni, L., Gratton, E., Diaspro, A., Lanzanò, L. Phasor analysis of local ICS detects heterogeneity in size and number of intracellular vesicles. Biophysical Journal. 111 (3), 619-629 (2016).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical Journal. 94 (6), 2320-2332 (2008).
- Li, C. H., Bai, L., Li, D. D., Xia, S., Xu, T. Dynamic tracking and mobility analysis of single GLUT4 storage vesicle in live 3T3-L1 cells. Cell Research. 14 (6), 480-486 (2004).
- Donovan, K. W., Bretscher, A. Tracking individual secretory vesicles during exocytosis reveals an ordered and regulated process. Journal of Cell Biology. 210 (2), 181-189 (2015).
- Westphal, V., et al. Video-rate far-field optical nanoscopy dissects synaptic vesicle movement. Science. 320 (5873), 246-249 (2008).
- Tabei, S. M. A., et al. Intracellular transport of insulin granules is a subordinated random walk. Proceedings of the National Academy of Sciences of the United States of America. 110 (13), 4911-4916 (2013).
- Hebert, B., Costantino, S., Wiseman, P. W. Spatiotemporal image correlation spectroscopy (STICS) theory, verification, and application to protein velocity mapping in living CHO cells. Biophysical Journal. 88 (5), 3601-3614 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。