Method Article
القياس الكمي للمنافسة بين البكتيريا باستخدام التصوير الفلوري أحادي الخلية
In This Article
Summary
تصف هذه المخطوطة طريقة لاستخدام المجهر الفلوري أحادي الخلية لتصور المنافسة البكتيرية في الزراعة المشتركة وتحديدها كميا.
Abstract
المنافسة بين البكتيريا يمكن أن تؤثر بشكل مباشر على بنية ووظيفة الميكروبيوم. يصف هذا العمل نهج المجهر الفلوري الذي يمكن استخدامه لتصور وقياس التفاعلات التنافسية بين السلالات البكتيرية المختلفة على مستوى الخلية الواحدة. يوفر البروتوكول الموصوف هنا أساليب للنهج المتقدمة في إعداد الشرائح على المجاهر المستقيمة والمقلوبة ، وتقنيات التصوير بالخلايا الحية والفاصل الزمني ، وتحليل الصور الكمية باستخدام برنامج فيجي مفتوح المصدر. يوضح النهج في هذه المخطوطة التحديد الكمي للتفاعلات التنافسية بين مجموعات Vibrio fischeri التكافلية من خلال قياس التغير في المساحة بمرور الوقت لسلالتين متفاعلتين تعبران عن بروتينات فلورية مختلفة من البلازميدات المستقرة. يتم وصف طرق بديلة لتحسين هذا البروتوكول في أنظمة النموذج البكتيري التي تتطلب ظروف نمو مختلفة. على الرغم من أن المقايسة الموصوفة هنا تستخدم الظروف الأمثل لV. fischeri، فإن هذا النهج قابل للاستنساخ للغاية ويمكن تكييفه بسهولة لدراسة المنافسة بين العزلات القابلة للتكرار من الميكروبيوم المتنوعة.
Introduction
توضح هذه المقالة طريقة لقياس المنافسة البكتيرية على مستوى الخلية الواحدة باستخدام المجهر الفلوري. غالبا ما يتشكل هيكل ووظيفة المجتمعات الميكروبية من خلال التفاعلات التنافسية بين الميكروبات ، وفي كثير من الحالات يتطلب توصيف هذه التفاعلات مراقبة السلالات البكتيرية المختلفة في التنبيب1و2و3و4و5و6و7و8 . تقليديا، يتم قياس المنافسة البكتيرية على مستوى السكان عن طريق عد وحدات تشكيل مستعمرة (CFUs) من المثبطات والسلالات المستهدفة قبل وبعد فترة التنبيب2،9. وتوزع آليات المنافسة الميكروبية على نطاق واسع بين البكتيريا وقد تعتمد على الانتشار أو الاتصال الخلوي لمنع الخلاياالمستهدفة10و11و12و13و14و15و16و17و18و19.
على الرغم من أن السلالات البكتيرية غالبا ما تلاحظ في عملية التكبيب على مستوى السكان، إلا أن هذه المخطوطة تحدد المقايسة للقياس الكمي للخلية الواحدة للمنافسة البكتيرية. وعلاوة على ذلك، يتضمن هذا العمل اقتراحات لتكييف البروتوكول للاستخدام مع الأنواع البكتيرية الأخرى. في حين يتم استخدام تقنيات محددة في هذه المقالة لدراسة المنافسة داخل المحددة التي تعتمد على الاتصال بين سلالات من البكتيريا التكافلية Vibrio fischeri20،21،22، يمكن تكييفها للمنافسة بين العديد من الكائنات الحية. توفر هذه المقالة إرشادات لإعداد الشرائح على المجاهر المستقيمة والمقلوبة على حد سواء، ويتم وصف جميع التحليلات باستخدام برنامج فيجي23 مفتوح المصدر بحيث يمكن استخدام الطريقة من قبل الباحثين الذين يمكنهم الوصول إلى أجهزة التصوير وبرامج التحليل المختلفة. ونظرا لأهمية دراسة المنافسة الميكروبية على مستوى السكان والخلايا الواحدة على حد سواء، فإن هذه الطريقة ستكون موردا قيما للباحثين لتحديد التفاعلات التنافسية، ولا سيما تلك التي لا تملك إمكانية الوصول إلى برامج التحليل الخاصة.
Protocol
1. تحسين السلالات البكتيرية
- اختر نوعين من السلالات البكتيرية لإجراء فحوصات المنافسة البكتيرية أحادية الخلية. هنا، يتم استخدام نوعين من V. fischeri: سلالة الهدف (ES11424)وسلالة مثبطة (MJ1125)التي من المعروف لقتل سلالة الهدف باستخدام نظام إفراز النوع السادس على الكروموسوم الثاني (T6SS2)1، وهو آلية القتل تعتمد على الاتصال.
- تحديد عناصر التحكم المناسبة للتجربة. في هذا المثال ، فإن السيطرة المناسبة هي احتضان كل من النوع البري وسلالات مثبطات T6SS متحولة مع السلالة المستهدفة لتحديد تأثير القتل بوساطة T6SS.
ملاحظة: يمكن أن تتضمن عناصر التحكم الإضافية سلالة مستهدفة تعبر عن جين (جينات) المناعة اللازمة لمنع القتل المعتمد على T6SS أو سلالة متحولة مثبطة تعبر عن نسخ من النوع البري للجينات المتحولة في ترانس لاستعادة نشاط T6SS1. - عندما يكون ذلك ممكنا، تحويل سلالات مع البلازميدات مستقرة ترميز الجينات لبروتينات الفلورسنت المختلفة (على سبيل المثال، GFP أو RFP) للتمييز بصريا أنواع سلالة على المجهر. هنا ، يتم وضع علامة على سلالة المثبط مع بلازميد GFP الترميز (pVSV102) ، ويتم وضع علامة على السلالة المستهدفة مع بلازميد dsRed الترميز (pVSV208)26.
ملاحظة: إذا لم يكن من الممكن استخدام البلازميدات المستقرة ، يمكن إدخال علامات الفلورسنت على الكروموسوم البكتيري للتصور27،28. - خلال فترة التحسين الأولية ، والثقافات صورة التخفي من السلالات الموسومة تحت كل من المرشحات الفلورية التي سيتم استخدامها خلال التجربة لضمان أن الخلايا مرئية فقط في القناة المقصودة. على سبيل المثال، تأكد من أن سلالة GFP المعلمة مرئية فقط في قناة FITC.
2. إعداد لوحة Agarose
- إعداد حل لوحة agarose عن طريق حل 2٪ agarose منخفضة الذوبان (ث / v) في mPBS. سخني المحلول لفترة وجيزة في الميكروويف والدوامة حتى يذوب الآغروز تماما. حافظ على هذا الحل دافئا بوضعه في حمام مائي 55 درجة مئوية حتى يصبح جاهزا للاستخدام. راجع قسم المناقشة لمزيد من المعلومات حول إعداد منصات الآغاروز.
ملاحظة: هنا، تم إعداد mPBS بإضافة 20 غرام/لتر NaCl إلى برنامج تلفزيوني قياسي 1x. - لف قطعة من شريط المختبر حول شريحة زجاجية خمس مرات. كرر هذه العملية مرة ثانية على نفس الشريحة بحيث تكون المسافة بين قطعتي الشريط أصغر قليلا من عرض غطاء(الشكل 1A). على سبيل المثال، إذا كان استخدام25 ملم 2 coverslips، ينبغي أن تكون متباعدة قطعة من الشريط ما يقرب من 20 ملم عن بعضها البعض.
ملاحظة: بينما يمكن تعديل عدد المرات التي يتم التفاف الشريط حول الشريحة لضبط سمك لوحة agarose، من المهم أن طبقات الشريط هي نفس الارتفاع على كلا الجانبين من الشريحة بحيث تظل لوحة agarose مسطحة. - Pipette حل agarose الدافئة بين قطعتين من الشريط وأعلى على الفور مع غطاء بحيث تقع على قطعة من الشريط. وهذا يضمن أن سطح لوحة الآغاروز لا يزال مسطحا. حجم الحل agarose pipetted في هذه الخطوة ينبغي أن يكون كافيا أن coverlip يجعل الاتصال مع السائل ويدفع بها أي فقاعات في حل agarose. لهذا الإعداد خاصة، 200 ميكرولتر من الآغاروز الدافئ كافية.
- دع لوحة الآغروز تتوطد في درجة حرارة الغرفة لمدة ساعة واحدة على الأقل قبل فحص التكنس. الخطوة 2.2 سوف تنتج لوحة agarose من حوالي 20 ملم2.
- قطع هذه وسادة agarose مع شفرة حلاقة إلى أربعة، 5 مم2 منصات لاستخدامها في التصوير.
ملاحظة: يمكن صنع منصات الآجروز قبل أسبوع واحد من التجربة وتخزينها عند درجة حرارة 4 درجات مئوية في صفيحة بيتري فارغة ومعقمة مختومة بالبارافيلم لمنع التجفيف.
3. إعداد سلالات للحضانة المشتركة
- خط من كل سلالة لاستخدامها في فحص التكون من -80 درجة مئوية الأسهم على لوحات أجار LBS تكملها المضادات الحيوية المناسبة واحتضان بين عشية وضحاها في 24°C. على سبيل المثال، يتم استخدام ثلاث سلالات: سلالة المثبط البرية، ونوع السادس إفراز نظام متحولة، وسلالة الهدف.
- في اليوم التالي، ابدأ الثقافات بين عشية وضحاها في التكرار البيولوجي عن طريق اختيار مستعمرتين من كل سلالة وإعادة تعليقها في LBS المتوسطة تكملها المضادات الحيوية المناسبة واحتضان بين عشية وضحاها في 24°C مع اهتزاز في 200 دورة في الدقيقة.
- في صباح اليوم التالي، كل ثقافة فرعية تكرار البيولوجية 1:1000 في المتوسط LBS الطازجة دون المضادات الحيوية واحتضان في 24 درجة مئوية مع اهتزاز لمدة 4-5 ساعة أو حتى تصل الخلايا إلى OD600 من ~ 1.5.
ملاحظة: توقيت الخطوات 3.1, 3.2, و 3.3 قد تحتاج إلى تحسين لأنواع البكتيريا المختلفة كما قد تختلف معدل نموها بشكل كبير. لهذا المقايسة، كانت الخلايا تهدف إلى أن تكون في مرحلة منتصف السجل في بداية فحص التكتن.
4. سلالات البكتيريا Coincubate
- بدءا من ثقافات منتصف السجل من الخطوة 3.3، قم بقياس وتسجيل الكثافة البصرية عند 600 نانومتر (OD600)لجميع العينات.
- تطبيع كل عينة إلى OD600 = 1.0، والذي يتوافق مع ما يقرب من 109 CFU / مل لفيشري V.، عن طريق تمييع الثقافة مع LBS المتوسطة.
- امزج بين السلالات المتنافسة بنسبة 1:1 استنادا إلى الحجم عن طريق إضافة 30 ميكرولتر من كل سلالة طبيعية إلى أنبوب 1.5 مل المسمى. دوامة ثقافة السلالة المختلطة لمدة 1-2 ق.
ملاحظة: في بعض الحالات، قد يكون من المناسب خلط الثقافات المشتركة في نسب مختلفة. على سبيل المثال، عندما تنمو سلالة واحدة أسرع بكثير من الأخرى، قد يكون من الضروري بدء الضغط المتزايد أبطأ في ميزة عددية من أجل مراقبة المنافسة. قد يكون التحسين مطلوبا أيضا إذا كان OD600 لا يتوافق مع CFU/mL مماثل لكلا السلالات. - كرر الخطوة 4.3 لكل تكرار بيولوجي وعلاج. وفي المثال المبين هنا، سيؤدي ذلك إلى ما مجموعه أربعة أنابيب مختلطة السلالة: تكراران بيولوجيان مع سلالة مثبطة من النوع البري ممزوجة بالسلالة المستهدفة واثنين من التكرارات البيولوجية مع سلالة متحولة من النوع السادس لنظام إفراز مختلطة مع السلالة المستهدفة.
- لضمان الخلايا المتنافسة كثيفة بما فيه الكفاية للقتل تعتمد على الاتصال في coincubation على لوحة أجار، وتركيز كل ثقافة مختلطة 3 أضعاف عن طريق الطرد المركزي الثقافة المختلطة في أنبوب الطرد المركزي 1.5 مل القياسية لمدة دقيقة واحدة في 21130 × ز،والتخلص من supernatant، وإعادة تعليق كل بيليه في 20 ميكرولتر LBS المتوسطة. كرر لكل عينة.
ملاحظة: بعض الخلايا البكتيرية حساسة للتلف عن طريق الطرد المركزي في rcf عالية; في مثل هذه الحالات يمكن طرد الثقافة المختلطة لمدة 3 دقائق عند 4600 × ز29. بالإضافة إلى ذلك، عند تحديد المنافسة المعتمدة على الاتصال، من المهم ضمان كثافة كافية للخلايا على الشريحة لمراقبة القتل. في هذه المقالة، كان العلاجات "مزدحمة"، حيث لوحظ القتل، ما يقرب من 10 خلايا/20 ميكرومتر2؛ راجع قسم المناقشة للحصول على مزيد من المعلومات.
5. إعداد الشرائح
- عند استخدام المجهر المستقيم، ضع لوحة أغروز2 5 مم على شريحة زجاجية قياسية مقاس 1 مم. بقعة 2 ميكرولتر من ثقافة مختلطة على لوحة agarose ووضع # 1.5 coverslip (25 ملم2)على الفور. راجع الشكل 1B للحصول على مثال.
- عند استخدام المجهر المقلوب، بقعة 2 ميكرولتر من ثقافة مختلطة على الجزء السفلي # 1.5 coverslip من طبق بيتري 35 ملم ووضع لوحة agarose ~ 5 ملم2 على بقعة التنبيب. ضع غطاء زجاجي دائري مقاس 12 مم فوق لوحة الآجروز. راجع الشكل 1C للحصول على مثال.
- كرر الخطوة 5.1 أو 5.2، اعتمادا على إعداد المجهر المستخدم، للثقافات المختلطة الثلاث المتبقية، مما أدى إلى أربع شرائح أو أطباق ليتم تصويرها.
- السماح الشرائح للجلوس على مقاعد البدلاء لمدة 5 دقائق تقريبا قبل الشروع في الخطوة 6. وهذا يسمح للخلايا بالاستقرار على وسادة أجار ويزيل الحركة أثناء عملية التصوير.
6. مسكوب مضان
- ابدأ بالتركيز على الخلايا التي تستخدم الضوء الأبيض (تباين المرحلة أو DIC) لتقليل آثار تبييض الصور. استنادا إلى متوسط حجم الخلية البكتيرية الواحدة، استخدم هدف زيت 60x أو 100x.
- ضبط وقت التعرض وإعدادات الاقتناء لكل قناة بحيث تكون الخلايا مرئية في القناة المناسبة مع الحد الأدنى من الكشف عن الخلفية.
ملاحظة: من المناسب استخدام أوقات تعرض مختلفة لقنوات مختلفة، ولكن ينبغي استخدام نفس وقت التعرض عبر جميع النسخ المتماثلة البيولوجية والعلاجات لقناة معينة. - لكل عينة، حدد خمسة حقول رؤية على الأقل (FOV) والحصول على صور في كل قناة مناسبة باستخدام إعدادات الامتلاك من الخطوة 6.2 (انظر الأمثلة في الشكل 2). حفظ نقاط XY من كل FOV بحيث يمكن تصوير FOV نفسه خلال النقطة الزمنية النهائية. تصوير نفس FOV في كل نقطة زمنية ضروري لتحديد نسبة المساحة التي تشغلها الخلايا المستهدفة أو المثبطة أثناء خطوات التحليل.
ملاحظة: في هذا المثال، يتم الكشف عن مضان GFP باستخدام مرشح مع الطول الموجي الإثارة من 467 -498 نانومتر ومرشح الانبعاثات من 513-556 نانومتر والأخضر زائفة اللون. يتم الكشف عن فلورسينس من dsRed باستخدام مرشح مع الطول الموجي الإثارة من 542 - 582 نانومتر ومرشح الانبعاثات من 603 - 678 نانومتر وهو أرجواني زائف اللون. - بعد 2 ساعة، كرر الخطوة 6.3 لكل عينة باستخدام نقاط XY المحفوظة سابقا(الشكل 2).
ملاحظة: قد يحتاج توقيت الصور اللاحقة إلى تحسينه للكائنات الحية ذات معدلات النمو المختلفة أو الآليات التنافسية.
7. تحليل الصور في فيجي
- تحميل وتثبيت برنامج معالجة الصور فيجي باستخدام التعليمات الموجودة هنا: https://imagej.net/Fiji/Downloads
- فتح فيجي واستيراد ملفات الصور للتحليل.
ملاحظة: في معظم الحالات . سيتم استخدام ملفات TIFF لتحليل الصور، على الرغم من أن بعض برامج الحصول على الصور سيتم تصديرها باستخدام أنواع الملفات المسجلة الملكية. يمكن لفيجي التعرف على معظم أنواع الملفات الخاصة ويمكن استيراد الصور وتحليلها على النحو التالي. - لكل صورة تم الحصول عليها في الخطوتين 6.3 و 6.4، قم بتحويل الصورة إلى تدرج رمادي، وافصل القنوات، وابدأ بالتقسيع (Ctrl + Shift + T) وإنشاء قناع ثنائي للصورة المعالجة مسبقا(الشكل 3A، B).
ملاحظة: هنا، يتم استخدام إعدادات thresholding الافتراضي في فيجي. في بعض الحالات، قد يكون من الضروري تغيير هذه الإعدادات، وفي هذه الحالة يجب استخدام نفس الإعدادات لجميع الصور في تلك التجربة. - تعيين مقياس على الصورة (تحليل | تعيين مقياس) باستخدام القيم المناسبة لإعداد المجهر23.
- تعيين القياسات (تحليل | تعيين القياسات) وحدد المنطقة.
ملاحظة: يمكن إضافة قياسات أخرى إذا كانت مناسبة للتجربة. مطلوب قياس ناحية الكائن فقط لتحليل المثال الموضح هنا. - تحليل الجسيمات (تحليل | تحليل الجسيمات) باستخدام الإعدادات الافتراضية (الشكل 3C). إذا كان هناك حطام في العينة، قد يكون من الضروري ضبط الحجم أو التعميم لتصفية الجسيمات غير الخلية. حدد إظهار | الخطوط العريضة بحيث يتضمن ناتج هذا التحليل مخططا مرقما لجميع الجسيمات التي تم تحليلها(الشكل 3D).
ملاحظة: مقارنة المخطط التفصيلي في الشكل 3D بالصورة الأولية مهم بشكل خاص في خطوة التحسين لضمان أن (1) يتم تحليل كافة الخلايا و (2) أن أي حطام يتم استبعاده من التحليل. - تصدير القياسات من الخطوة 7.4(الشكل 3E)إلى برنامج جدول بيانات لمزيد من التحليل والرسوم البيانية.
- كرر الخطوات 7.1 - 7.5 لجميع القنوات والصور التي تم الحصول عليها أثناء التجربة.
8. حساب نسبة المساحة المستهدفة الأولية مع مرور الوقت
- لكل مجال من مجالات الرؤية التي تم تحليلها في القسم 7، تأكد من أن الملف المصدر يحتوي على قياس منطقة فردية لكل جسيم تم تحليله. بدءا من قناة الفلورسينس الخاصة بالسلالة المستهدفة، احسب مساحة جسيمات المجموع لكل مجال رؤية على حدة. بالنسبة لمكرني بيولوجيين مع خمسة FOV لكل منهما ، يجب أن يؤدي هذا إلى عشرة مناطق مجموع لكل علاج في كل نقطة زمنية.
- حساب نسبة المساحة المستهدفة الأولية مع مرور الوقت لكل FOV باستخدام المعادلة التالية: (
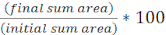 )
) - كرر هذا الحساب لجميع العلاجات ورسم بياني النسبة المئوية للمنطقة المستهدفة الأولية (نتيجة المعادلة من الخطوة 8.2) لكل علاج(الشكل 4A).
- تحديد ما إذا كانت هناك زيادة صافية في عدد السكان المستهدفين (مما يشير إلى النمو)، أو انخفاض صافي في عدد السكان المستهدفين (مما يشير إلى الوفاة)، أو عدم حدوث تغيير (مما يشير إلى عدم وجود نمو أو وفاة) لكل علاج.
ملاحظة: تشير النسبة المئوية للمنطقة المستهدفة الأولية التي تزيد قيمتها عن 100 إلى نمو مستهدف صافي، وتشير القيم الأقل من 100 إلى صافي الوفيات المستهدفة. وتشير النسبة المئوية للقيم المستهدفة الأولية التي لا تزال عند 100 إلى عدم حدوث تغير صاف في السكان المستهدفين. راجع المناقشة لإجراء تجارب المتابعة المقترحة.
9. حساب نسبة منطقة المثبطات الأولية مع مرور الوقت
- كرر الخطوات من 8.1 إلى 8.3، وهذه المرة باستخدام القياسات التي تم جمعها من قناة الفلورية لسلالة المثبط في القسم 7(الشكل 4B).
- تحديد ما إذا كانت هناك زيادة صافية في عدد السكان المثبطين (النمو)؛ انخفاض صافي في عدد المثبطات (الموت) ، أو أي تغيير لكل علاج. وتشير القيم التي تزيد عن 100 إلى نمو مثبطات صافية، وتشير القيم الأقل من 100 إلى صافي وفيات المثبطات.
النتائج
لتصور وقياس التفاعلات التنافسية بين البكتيريا على مستوى الخلية الواحدة ، تم تطوير بروتوكول وتحسينه لV. fischeri عن طريق تعديل لدينا راسخة على أساس CFU المقايسة1،2. يستخدم هذا الأسلوب GFP- وdsRed ترميز البلازميدات مستقرة للتمييز بصريا سلالات مختلفة من V. fischeri. ويمكن قياس النتائج التنافسية لهذه التفاعلات من خلال تحليل الصور المكتسبة من هذا المقايسة باستخدام برنامج فيجي المفتوح المصدر. وكمثال على ذلك، أجريت التجربة التالية باستخدام عزلات V. fischeri. سلالة مثبطة تؤوي البلازميد الذي يشفر GFP، وسلالة الهدف تؤوي البلازميد الذي يشفر dsRed. وبالنظر إلى أن T6SS2 المشفرة بواسطة المثبط هي آلية قتل تعتمد على الاتصال ، تم تضمين العلاجات حيث كانت الخلايا إما مزدحمة (اتصال عالي بالخلايا الخلوية) أو تفريق (اتصال منخفض بين الخلية والخلية) على شريحة لتسليط الضوء على تأثير الإعداد التجريبي على النتائج النهائية لهذا الفحص. وفي بيانات العينة، كانت السلالات المتنافسة مختلطة بنسبة 1:1 وتم احتضانها على منصة الآغاروز لمدة 2 ساعة، وتم التقاط الصور الأولية والنهائية (2 ساعة). وكعنصر تحكم، تم أيضا مكافحة سلالة متحولة T6SS2 مع السلالة المستهدفة في كل من الظروف المزدحمة والتفرقية. تم إعداد ثقافات كل سلالة و coincubated كما هو موضح أعلاه وتم إعداد الشرائح كما هو موضح في الشكل 1.
ويبين الشكل 2 صورا مجهرية مفلورة تمثيلية لكل علاج تجريبي بنفس مجال الرؤية المصورة عند نقطة زمنية أولية ونهائية. لكل علاج، إما مثبط من النوع البري أو سلالة متحولة T6SS إيواء بلازميد GFP الترميز تم خلط بنسبة 1:1 مع سلالة الهدف إيواء بلازميد dsRed الترميز. خلال فترة 2 ساعة coincubation مع هذا الإعداد التجريبي، قد تنمو خلايا V. فيشري تذهب من خلال 1-2 أقسام (الشكل 2؛ الأسهم الرمادية). في الشكل 2A، تم فرض الاتصال بين الخلية الخلية بين الهدف والمثبط عن طريق تركيز الثقافة المختلطة قبل اكتشاف على الشريحة. ويلاحظ أن خلايا مستهدفة متعددة تصبح مدورة و/ أو تختفي على مدار 2 ساعة، بما يتفق مع الخلايا المستهدفة التي يتم القضاء عليها بواسطة المثبط(الشكل 2؛ الأسهم البيضاء). راجع قسم المناقشة للحصول على مزيد من المعلومات حول تفسير التقريب أو lysing الخلايا الهدف. في الشكل 2B، تم رصد نفس coincubation على شريحة ، وهذه المرة دون تركيز الثقافة المختلطة بحيث ظلت الخلايا تتفرق وكان هناك اتصال ضئيل بين الضغوط على الشريحة. هنا، لا يلاحظ اختفاء أو تقريب الخلايا المستهدفة، مما يشير إلى أن السلالة المستهدفة لم تمنع في هذا العلاج. الشكل 2C والشكل 2D تظهر نفس العلاجات المزدحمة وتفريق المذكورة أعلاه، وهذه المرة باستخدام متحولة T6SS كما سلالة المانع. ولم تلاحظ الخلايا المستهدفة تختفي أو تدور عندما يتم تسبيبها بمتحول T6SS إما في ظروف مزدحمة أو تفريقية، مما يشير مرة أخرى إلى أن الهدف لم يكن مثبطا في أي من العلاجين.
ويبين الشكل 3 سير عمل تحليل فيجي المستخدم لقياس المنافسة في هذا البروتوكول. تم تحديد صورة تمثيلية من القناة المستهدفة(الشكل 3A)وتم إنشاء قناع ثنائي باستخدام إعدادات العتبة الافتراضية في فيجي(الشكل 3B). تم تعيين مقياس الصورة بشكل مناسب لإعداد المجهر هذا. تم تحليل الجسيمات باستخدام معلمة الحجم = 0 - اللانهاية ، معلمة التعميم = 0.00 - 1.00 ، وتم اختيار إظهار الخطوط العريضة (الشكل 3C). تظهر نتائج تحليل الجسيمات هذا كمخطط رقمي لكل جسيم(الشكل 3D)،وكجدول يحتوي على أعمدة لرقم الجسيم واسم الملف (التسمية) ومنطقة الجسيمات في μm2 (المنطقة)(الشكل 3E).
في الشكل 4، يتم رسم البيانات التي تم الحصول عليها من الشكل 3E وتحليلها. في الشكل 4A، يتم عرض نسبة المنطقة المستهدفة الأولية في النقطة الزمنية النهائية لكل علاج وفقا للخطوة 8.2. وإذا كانت النسبة المئوية للمنطقة المستهدفة الأولية أكبر من 100، فإن ذلك يمثل زيادة صافية في الهدف (أي النمو) ويلاحظ في الظروف التي لا يمنع فيها السكان المستهدفون بشكل كبير. ومع ذلك، إذا كانت النسبة المئوية للمنطقة المستهدفة الأولية أقل من 100، فإن هذه النتيجة تشير إلى انخفاض صافي في الهدف (أي الوفاة) ويلاحظ في الظروف التي يكون فيها السكان المستهدفون تثبيطا كبيرا. عندما تم مكافحة الهدف بمثبط من النوع البري في ظروف مزدحمة ، تظهر البيانات انخفاضا صافيا في المنطقة المستهدفة. وعلى النقيض من ذلك، عندما تم مكافحة الهدف إما بمثبط من النوع البري في ظروف التفرق أو متحول T6SS في ظروف مزدحمة أو تفريقية، تظهر البيانات زيادة صافية في المنطقة المستهدفة. كانت نسبة المنطقة المستهدفة الأولية عندما تم اختبار الهدف بمثبط من النوع البري في ظروف مزدحمة أقل من 100 وأقل بكثير من جميع العلاجات الأخرى وفقا ل ANOVA أحادي الاتجاه يليه اختبار المقارنات المتعددة ل Tukey عبر جميع العلاجات (p < 0.0001). تشير هذه البيانات إلى أن موت الخلية المستهدفة يعتمد على T6SS وظيفية في المثبط ويؤكد على أهمية الإعداد التجريبي الذي يسمح اتصال كاف الخلية الخلية، من أجل الكشف عن موت الخلية من آلية القتل تعتمد على الاتصال.
الشكل 4B يقدم النسبة المئوية لمنطقة المثبطات الأولية في النقطة الزمنية النهائية لكل علاج. في هذا المثال، لوحظ النمو الصافي لسلالة المثبط عبر جميع العلاجات. ومع ذلك ، كانت نسبة منطقة المانع الأولية أعلى بكثير عندما تم عمل مثبط من النوع البري مع الهدف في ظروف مزدحمة مقارنة بجميع العلاجات الأخرى وفقا ل ANOVA في اتجاه واحد يليه اختبار المقارنات المتعددة ل Tukey عبر جميع العلاجات (p < 0.0001). في البداية ، اعتبرنا أن الزيادة الصافية في منطقة المانع قد تكون مدفوعة بالزيادة في المساحة المتاحة للنمو مع القضاء على الخلايا المستهدفة. ومع ذلك ، لم تلاحظ هذه الزيادة نفسها في نمو المثبطات في العلاجات المتفرقة ، حيث كان للخلايا المثبطة مجال للنمو منذ بداية التكون المعدني. وبدلا من ذلك، يمكن أن تشير هذه النتيجة إلى أن المواد الغذائية المنبعثة من الخلايا المستهدفة تسمح بزيادة أكبر في عدد المثبطات. مجتمعة، تشير هذه النتائج إلى أن سلالة المثبط يقضي على الهدف بطريقة تعتمد على T6SS فقط عندما يتم فرض اتصال الخلية عالية من قبل الخلايا مزاحمة على الشريحة.
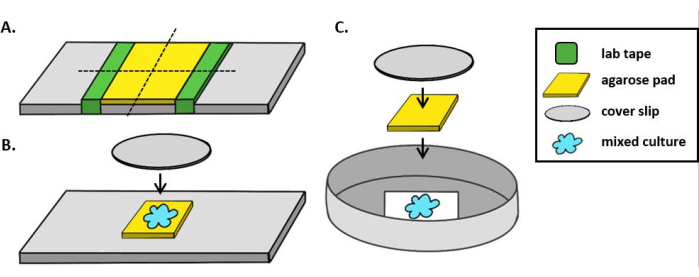
الشكل 1: إعداد لوحة Agarose وإعداد الشريحة لعدادات التكتن. (أ) الإعداد لصنع منصات agarose 2٪. يتم لف خمس طبقات من الشريط المعملي (الأخضر) حول زلة غطاء عند نقطتين تفصل بينهما حوالي 20 ملم. بعد ذلك ، يتم أنابيب 2٪ من الآغروز الدافئ في mPBS (الأصفر) بين قطع الشريط وتغطيته على الفور بزلة غطاء25 مم 2 ويسمح لترسيخ لمدة ساعة واحدة على الأقل في درجة حرارة الغرفة. استخدام شفرة حلاقة لقطع لوحة agarose إلى ~ 5 ملم2 قطعة واستخدام ملاقط لنقل لوحة إلى شريحة جديدة للتصوير. (ب) عند التصوير على المجهر تستقيم، ضع 5 مم2 agarose لوحة مباشرة على الشريحة، واتبع الثقافة المختلطة (الأزرق) و12 مم دائرية # 1.5 زلة الغطاء. (ج)عند التصوير على المجهر المقلوب، بقعة الثقافة المختلطة مباشرة على الغطاء الزجاجي # 1.5 زلة أسفل طبق بيتري 35 ملم، ووضع لوحة agarose على رأس الثقافة تليها زلة غطاء دائري 12 ملم الثانية لتسطيح لوحة agarose. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
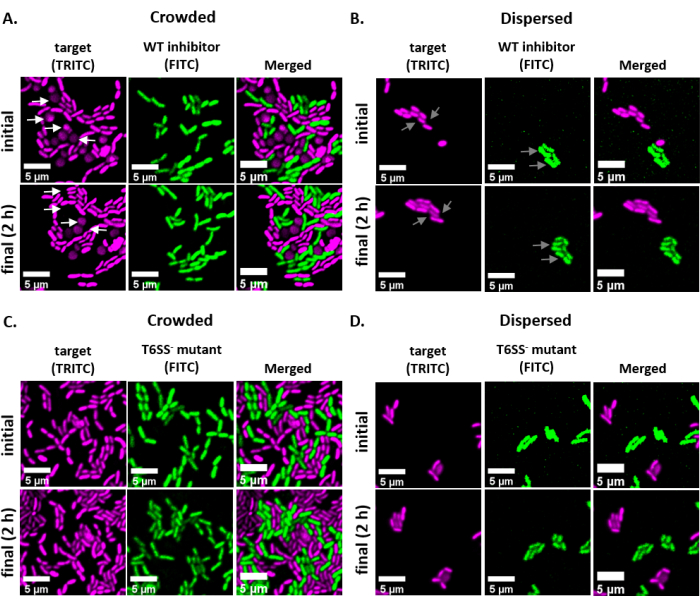
الشكل 2:صور الفاصل الزمني لبقع التكتنف في ظروف مزدحمة أو تفريق. (A)صور تمثيلية في النقاط الزمنية الأولية والأخيرة حيث تركزت ثقافة مختلطة من الهدف ومثبط البرية من نوع 3x قبل اكتشاف على الشريحة لفرض الاتصال الخلية الخلية بين السلالات. تشير الأسهم البيضاء في قناة TRITC إلى أمثلة للخلايا المستهدفة التي تدور أو تهريج طوال فترة التجربة. (ب) صور تمثيلية حيث تم رصد ثقافة مختلطة من الهدف والمانع البرية من دون التركيز بحيث يتم تفريق الخلايا وهناك الحد الأدنى من الاتصال بين الخلية الخلية بين السلالات. تشير الأسهم الرمادية في قنوات FITC وTRITC إلى أمثلة لتقسيم الخلايا طوال مسار التجربة. (ج) صور تمثيلية حيث كانت الثقافة المختلطة للهدف و T6SS- متحولة تتركز 3x قبل اكتشاف على الشريحة لفرض الاتصال الخلية الخلية بين السلالات. (د) صور تمثيلية حيث تم رصد ثقافة مختلطة من الهدف و T6SS- متحولة دون التركيز بحيث يتم تفريق الخلايا وهناك الحد الأدنى من الاتصال الخلية الخلية بين السلالات. أشرطة المقياس = 5 ميكرومتر وهي متسقة عبر جميع الصور؛ قناة TRITC هو أرجواني زائف اللون، قناة FITC هو أخضر زائف اللون. تم تنفيذ Deconvolution على جميع الصور؛ تم طرح الخلفية ، والسطوع / التباين تعديلها بشكل موحد عبر جميع الصور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
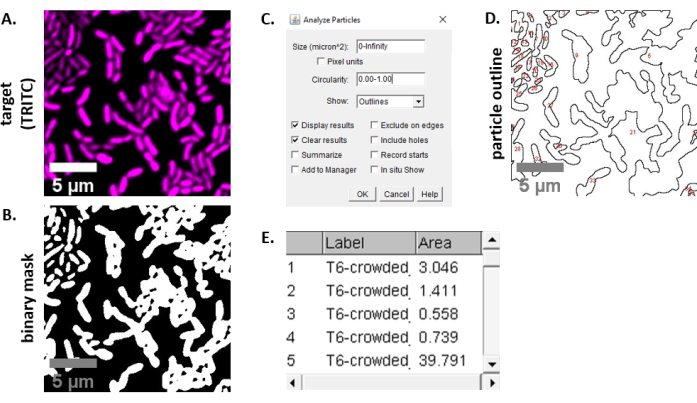
الشكل 3: سير عمل تحليل فيجي. (أ) صورة تمثيلية للتحليل. يتكرر سير العمل هذا لكلا القناتين عبر كافة مجالات العرض والعينات. أشرطة المقياس = 5 ميكرومتر وهي متسقة عبر جميع الصور؛ قناة TRITC هو أرجواني زائف اللون، قناة FITC هو أخضر زائف اللون. (B) قناع ثنائي تم إنشاؤه بواسطة عتبة الصورة باستخدام الإعدادات الافتراضية في فيجي. (ج)مثال على إعدادات تحليل الجسيمات المستخدمة في هذه المخطوطة. نطاق الحجم = 0 - ما لا نهاية μm2; دائري = 0.00 - 1.00; إظهار = المخططات التفصيلية. (د) مخطط الجسيمات التي تم إنشاؤها كخرج تحليل الجسيمات في (C). يجب مقارنة مخطط الجسيمات في(D)بالصورة الأصلية (A) لضمان التقاط جميع الخلايا في تحليل الجسيمات. (ه) جدول النتائج التي تم إنشاؤها على أنها ناتج من تحليل الجسيمات في (C). رقم الكائن (العمود 1) يتوافق مع الجسيمات الفردية (خلية واحدة أو أكثر) المبينة والمسميات باللون الأحمر في لوحة(D). التسمية = اسم ملف الصورة التي تم تحليلها؛ المساحة = إجمالي مساحة الجسيمات في μm2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
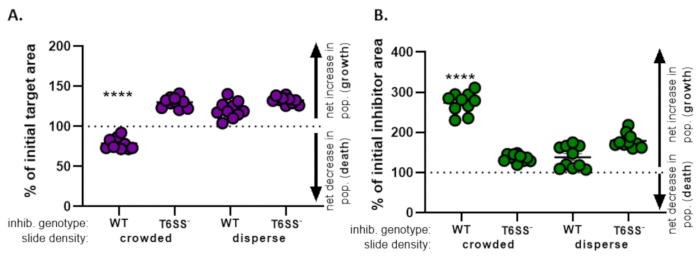
الشكل 4:عينة من البيانات لتقييم ما إذا كان يتم منع السلالة المستهدفة. النسبة المئوية للمنطقة الأولية في النقاط الزمنية النهائية للسلالة المستهدفة(A)وسلالة المانع(B)،في كثافات الخلايا الأولية المختلفة. تشير كثافة الشرائح إما إلى كثافة خلايا البداية المزدحمة (ملامسة الخلية العالية بين السلالات)، أو إلى تشتت أكثر (اتصال منخفض بالخلايا بين السلالات) كما هو موضح في الشكل 2. النمط الجيني المثبط يشير إلى أن إما البرية من نوع أو متحولة T6SS (T6SS-) تم coincubated سلالة مع سلالة الهدف. تشير النجمات إلى اختلاف كبير في النسبة المئوية للتغيير مقارنة بجميع العلاجات (ANOVA أحادية الاتجاه تليها اختبارات المقارنات المتعددة التي أجراها توكي مقارنة جميع العلاجات؛ (p < 0.0001). يشير خط متقطع إلى عدم وجود تغيير صافي في منطقة الضغط بين نقطة التوقيت الأولية والنهائية؛ (أ) يشير التغير في النسبة المئوية > 100 إلى زيادة صافية (أي النمو) ويشير التغير في المائة < 100 إلى انخفاض صافي (أي موت الخلايا). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يوفر البروتوكول المذكور أعلاه أداة قوية لتحديد المنافسة بين البكتيريا ووصفها على مستوى الخلية الواحدة. هذا المقايسة، التي تم تطويرها عن طريق تعديل لدينا اختبار المنافسة المستندة إلى CFU على لوحات أجار1،2،سمح لتصور المنافسة خلية واحدة بين V. فيشري يعزل ويتم توفير اقتراحات لتحسين طريقة لمجموعة واسعة من النظم والتجهيزات المجهرية. على الرغم من أن الطريقة الموصوفة هنا تم تحسينها لsymbiont V. fischeriالجهاز الخفيف ، يمكن تعديلها بسهولة لاستيعاب العديد من الميكروبات المتنوعة والطائفية. من المهم ملاحظة أنه يمكن تنظيم الآليات التنافسية من خلال أي عدد من المتغيرات البيئية، بما في ذلك درجة الحرارة والملوحة واللزوجة30و31و32و33و34. وقد أكد العمل السابق أن V. fischeri تتنافس باستخدام نظام إفراز النوع السادس المعتمد على الاتصال الذي ينشط على الأسطح30، مما يجعل الظروف الموصوفة في هذا الفحص مناسبة لدراسة المنافسة بين سلالات المثال. من المهم أيضا النظر في الكثافة الأولية للخلايا على الشريحة عند تحديد المنافسة البكتيرية. وبالنظر إلى أن الاتصال بين الخلايا المستهدفة والمانع غالبا ما يكون مطلوبا لحدوث القتل، ينبغي أن تتركز الثقافة المختلطة بحيث يتم تعظيم الاتصال بين الخلية والخلية وتبقى الخلايا في مستوى واحد على الشريحة. وينبغي زراعة ثقافات الخلايا إلى كثافة بصرية مماثلة (مرحلة منتصف السجل) ومن ثم تركيزها لفرض الاتصال بدلا من مجرد زراعة الثقافات إلى كثافة بصرية أعلى بسبب التغيرات الفسيولوجية للخلايا في مراحل النمو المختلفة. وفي نظم أخرى، قد تحتاج الظروف الثقافية والإعداد التجريبي إلى تعديل لضمان أن الآلية التنافسية نشطة ويمكن اكتشافها في حالة التكون المعدني.
توفر منصات الآغاروز المستخدمة في هذا الفحص العديد من الفوائد: فهي توفر الاستقرار بحيث لا تتحرك الخلايا بحرية ، وتمنع الثقافة من الجفاف على مدار التجربة. بالإضافة إلى ذلك ، إذا كانت الحث الكيميائية ، مثل isopropyl -β-D-thiogalactoside (IPTG) ، مطلوبة للتجربة ، فيمكن إضافتها بسهولة إلى محلول الآغاروز. ومع ذلك، من المهم أن نلاحظ أن إعداد الآغاروز من المرجح أن تحتاج إلى تعديل لأنظمة مختلفة. في المثال المذكور أعلاه، تم إعداد لوحة الآغاروز عن طريق حل 2٪ agarose (ث / v) إلى 20 psu mPBS، وهي الملوحة القياسية المستخدمة في متوسط نمو V. fischeri. وعلاوة على ذلك، قد يحتاج مصدر الكربون في بعض الحالات إلى إضافته إلى منصة الآغاروز لكي تنمو الخلايا وتتنافس على تجارب أطول. في مثل هذه الحالة، يمكن استبدال mPBS في منصات الآجاروز مع أي وسيلة النمو، على الرغم من أن المواد الغذائية في المتوسط النمو قد تأتي مع مقايضة من مضان الخلفية إضافية.
بدون برامج تحليل الصور الخاصة ، يمكن أن يكون من الصعب جدا الحصول على عدد الخلايا الفردية عندما يكون الاتصال بالخلايا عالية ، وهو ما نطلبه كما نظهر هنا لمراقبة القتل المعتمد على الاتصال. وقد صمم هذا المقايسة لتوفير طريقة بديلة للقياس الكمي لا تعتمد على عدد الخلايا الفردية. بدلا من ذلك، يتم استخدام المساحة الكلية للخلية لكل قناة مضان لتحديد مدى القتل بين السلالات المنقوطة. لأن هذا الأسلوب يعتمد على ناحية بدلا من عدد الخلايا الفردية، إعدادات العتبة الافتراضية عادة ما تكون كافية للخطوط العريضة لمنطقة الخلية الإجمالية. يمكن التحقق من دقة العتبة بقسمة إجمالي مساحة الكائن لحقل عرض تمثيلي على متوسط حجم الخلية للكائن الحي النموذجي ومقارنة رقم الخلية المقدر هذا بعدد خلايا يدوي لنفس الصورة.
في التكبيبات بين مثبط واحد وهدف واحد (غير قاتل) سلالة، ومن المتوقع النمو الصافي للمثبط. وكما رأينا في الشكل 4،قد يكون نمو المثبطات أعلى بكثير في العلاجات التي يلاحظ فيها القتل، مقارنة بالعلاجات التي لا يلاحظ فيها القتل، ربما لأن العناصر الغذائية التي تطلقها الخلايا المستهدفة تسمح لسلالة المثبط بالنمو بسرعة أكبر. في المثال المبين هنا، لوحظ صافي وفيات المستهدفين لأن المنافسة بوساطة T6SS تؤدي إلى تحلل الخلية المستهدفة حيث يتم القضاء على الهدف جسديا. ومع ذلك، من المهم ملاحظة أن الآليات التنافسية لا تؤدي جميعها إلى القضاء المادي على الخلايا المستهدفة. إذا كان الهدف عاجزا بسبب سم يسبب تثبيط النمو ، فقد يؤدي البروتوكول المبين هنا إلى بقاء السكان المستهدفين المرئيين مستقرين بمرور الوقت حيث لم تعد الخلايا المستهدفة تنمو ولكنها لا تنمو أيضا. في مثل هذه الحالة ، سيكون من المناسب مقارنة نتائج هذا الفحص مع اختبارات المتابعة لاستدامة الخلية المستهدفة ، مثل الطلاء لوحدات تشكيل المستعمرة (CFUs) أو عن طريق إجراء فحوصات حية ميتة عن طريق تلطيخ مع يوديد البروبيديوم أو SYTOX الأخضر35،36.
بالمقارنة مع المقايسات coincubation التي تعتمد على التهم CFU، وهذا المقايسة يجعل من الممكن لمراقبة وقياس الهيكل المكاني للمنافسة بين السلالات وتتبع التغيرات في مورفولوجيا الخلية المستهدفة مع مرور الوقت. على سبيل المثال، من المعروف أن الخلايا المثبطة التي تقتل باستخدام T6SS لترميز البروتينات LysM المجال الذي يحط من جدار الخلية المستهدفة، مما أدى إلى تقريب الخلية الأولية ومن ثم تحلل13،والتي لاحظناها في المثال المبين في الشكل 2A. وعلاوة على ذلك، يمكن استخدام هذا البروتوكول لتتبع المنافسة بدقة عالية على مدى جداول زمنية قصيرة جدا. في المثال المبين هنا، لوحظ انخفاض كبير في المنطقة المستهدفة بعد ساعتين فقط عندما تكون الخلايا مزدحمة ويتم فرض الاتصال بين الخلية الخلية بين السلالات(الشكل 4). كما يمكن إجراء تحليل الصورة الموصوف هنا باستخدام المجهر البؤري، مما يجعل من الممكن دراسة المنافسة البكتيرية في الجسم الحي أو في الأغشية الحيوية المعقدة، دون تعطيل التوزيع المكاني للسلالات المتحللة.
وباختصار، يهدف الفحص الموصوف هنا إلى توفير نهج سهل الوصول إليه وتعديله لتصور وقياس المنافسة البكتيرية على مستوى الخلية الواحدة باستخدام المجهر الفلوري. يمكن تطبيق هذه الطريقة على عزل البكتيريا المتنوعة ويمكن استخدامها لتصور المنافسة البكتيرية حتى في البيئات المعقدة مثل داخل مصفوفة المضيف أو بيو فيلم.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم A.N.S من قبل منحة NIGMS R35 GM137886 وتم دعم S.N.S من قبل برنامج زمالة الدراسات العليا في علوم الدفاع الوطني والهندسة.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Fisher | 05-408-129 | |
| 10 uL single channel pipette | |||
| 1000 uL single channel pipette | |||
| 20 uL single channel pipette | |||
| 200 uL single channel pipette | |||
| Agarose | Fisher | BP165-25 | Low melting agarose |
| Calculator | |||
| Cellvis 35 mm Dish | Fisher | NC0409658 | #1.5 cover glass bottom |
| Chloramphenicol | Sigma | C0378 | stock (20 mg/mL in Ethanol); final concentration in media (2 μg /mL LBS) |
| DAPI Nucleic Acid Stain | Fisher | EN62248 | optional (if not using stable plasmids) |
| FIJI image analysis sofware | ImageJ | https://imagej.net/Fiji/Downloads | open-source software |
| Fisherbrand Cover Glasses: Circles | Fisher | 12-545-81P | #1.5 cover glass; 12 mm diameter |
| Kanamycin Sulfate | Fisher | BP906-5 | stock (100 mg/mL in water, filter sterilize); final concentration in media (1 μg/mL LBS) |
| Lens Cleaning Tissue Paper | Fisher | S24530 | |
| Parafilm | Fisher | 13-374-12 | |
| Petri Plates | Fisher | FB0875713 | sterile with lid |
| Razor Blades | Fisher | S65921 | |
| Semi-micro Cuvettes | VWR | 97000-586 | |
| Spectrophotometer | |||
| SYBR Green Nucleic Acid Stain | Fisher | S7563 | optional (if not using stable plasmids) |
| Thermo Scientific Gold Seal Plain Microscope Slides | Fisher | 12-518-100B | |
| Thermo Scientific Richard-Allan Scientific Cover Glass | Fisher | 22-050-235 | #1.5 cover glass, 25 mm2 |
| Type F Immersion Oil | Fisher | NC0297589 | |
| Upright or inverted fluorescence microscope with camera and imaging software | Images in this article were acquired on a Nikon TI-2 inverted fluorescent microscope outfitted with an ORCA-Fusion Digital CMOS camera using NIS-Elements software. | ||
| Vortex | |||
| Water bath | Used to keep agarose warm prior to pipetting | ||
| LBS media | |||
| 1M Tris Buffer (pH ~7.5) | 50 mL 1 M stock buffer (62 mL HCl, 938 mL DI water, 121 g Trizma Base) | ||
| Agar Technical | Fisher | DF0812-17-9 | 15 g (Add only for plates) |
| DI water | 950 mL | ||
| Sodium Chloride | Fisher | S640-3 | 20 g |
| Tryptone | Fisher | BP97265 | 10 g |
| Yeast Extract | Fisher | BP9727-2 | 5 g |
| mPBS (marine PBS) | Phosphate buffered saline with marine salts added; used for making agarose pad | ||
| 10X PBS | Fisher | ICN1960454 | |
| Instant Ocean Sea Salt | Instant Ocean | SS1-160P | Adjust concentration to appropriate salinity; 20 psu used here |
| Sterile Vacuum Filter Units | Fisher | SCGVU01RE | Used to filter-sterilize mPBS |
| Vacuum pump | Used to filter-sterilize mPBS |
References
- Speare, L., et al. Bacterial symbionts use a type VI secretion system to eliminate competitors in their natural host. Proceedings of the National Academy of Sciences. 115 (36), 8528-8537 (2018).
- Speare, L., Septer, A. N. Coincubation assay for quantifying competitive interactions between Vibrio fischeri isolates. Journal of Visualized Experiments. (149), e59759(2019).
- Frost, I., et al. Cooperation, competition and antibiotic resistance in bacterial colonies. The ISME journal. 12 (6), 1582-1593 (2018).
- Stubbendieck, R. M., Vargas-Bautista, C., Straight, P. D. Bacterial communities: interactions to scale. Frontiers in Microbiology. 7, 1234(2016).
- Souza, D. P., et al. Bacterial killing via a type IV secretion system. Nature Communications. 6 (1), 1-9 (2015).
- Anderson, M. C., Vonaesch, P., Saffarian, A., Marteyn, B. S., Sansonetti, P. J. Shigella sonnei encodes a functional T6SS used for interbacterial competition and niche occupancy. Cell Host and Microbe. 21 (6), 769-776 (2017).
- Basler, M., Ho, B., Mekalanos, J. Tit-for-tat: Type VI secretion system counterattack during bacterial cell-cell interactions. Cell. 152 (4), 884-894 (2013).
- Guillemette, R., Ushijima, B., Jalan, M., Häse, C. C., Azam, F. Insight into the resilience and susceptibility of marine bacteria to T6SS attack by Vibrio cholerae and Vibrio coralliilyticus. PloS One. 15 (1), 0227864(2020).
- Hachani, A., Lossi, N. S., Filloux, A. A visual assay to monitor T6SS-mediated bacterial competition. Journal of Visualized Experiments. (73), e50103(2013).
- Hibbing, M. E., Fuqua, C., Parsek, M. R., Peterson, S. B. Bacterial competition: surviving and thriving in the microbial jungle. Nature Reviews Microbiology. 8 (1), 15-25 (2010).
- Ruhe, Z. C., Low, D. A., Hayes, C. S. Bacterial contact-dependent growth inhibition. Trends in Microbiology. 21 (5), 230-237 (2013).
- Wood, D. W., Pierson, L. S. The phzI gene of Pseudomonas aureofaciens 30-84 is responsible for the production of a diffusible signal required for phenazine antibiotic production. Gene. 168 (1), 49-53 (1996).
- Smith, W. P., et al. The evolution of the type VI secretion system as a disintegration weapon. PLoS Biology. 18 (5), 3000720(2020).
- Chen, L., Zou, Y., She, P., Wu, Y. Composition, function, and regulation of T6SS in Pseudomonas aeruginosa. Microbiological Research. 172, 19-25 (2015).
- Sana, T. G., Lugo, K. A., Monack, D. M. T6SS: The bacterial "fight club" in the host gut. PLoS Pathogens. 13 (6), 1006325(2017).
- Basler, M. Type VI secretion system: secretion by a contractile nanomachine. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1679), 20150021(2015).
- Joshi, A., et al. Rules of engagement: the type VI secretion system in Vibrio cholerae. Trends in Microbiology. 25 (4), 267-279 (2017).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nature Reviews Microbiology. 14 (9), 589-600 (2016).
- Stubbendieck, R. M., Straight, P. D. Multifaceted interfaces of bacterial competition. Journal of Bacteriology. 198 (16), 2145-2155 (2016).
- Septer, A. N. The Vibrio-squid symbiosis as a model for studying interbacterial competition. Msystems. 4 (3), (2019).
- Tischler, A. H., Hodge-Hanson, K. M., Visick, K. L. Vibrio fischeri-squid symbiosis. eLS. , 1-9 (2019).
- Mandel, M. J., Dunn, A. K. Impact and influence of the natural Vibrio-squid symbiosis in understanding bacterial-animal interactions. Frontiers in Microbiology. 7, 1982(2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Boettcher, K., Ruby, E. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna Scolopes. Journal of Bacteriology. 172 (7), 3701-3706 (1990).
- Doino, J. A., McFall-Ngai, M. J. A transient exposure to symbiosis-competent bacteria induces light organ morphogenesis in the host squid. The Biological Bulletin. 189 (3), 347-355 (1995).
- Dunn, A. K., Millikan, D. S., Adin, D. M., Bose, J. L., Stabb, E. V. New rfp-and pES213-derived tools for analyzing symbiotic Vibrio fischeri reveal patterns of infection and lux expression in situ. Applied and Environmental Microbiology. 72 (1), 802-810 (2006).
- Lambertsen, L., Sternberg, C., Molin, S. Mini-Tn7 transposons for site-specific tagging of bacteria with fluorescent proteins. Environmental Microbiology. 6 (7), 726-732 (2004).
- Koch, B., Jensen, L. E., Nybroe, O. A panel of Tn7-based vectors for insertion of the gfp marker gene or for delivery of cloned DNA into Gram-negative bacteria at a neutral chromosomal site. Journal of Microbiological Methods. 45 (3), 187-195 (2001).
- Peterson, B. W., Sharma, P. K., Van Der Mei, H. C., Busscher, H. J. Bacterial cell surface damage due to centrifugal compaction. Applied and Environmental Microbiology. 78 (1), 120-125 (2012).
- Speare, L., Smith, S., Salvato, F., Kleiner, M., Septer, A. N. Environmental viscosity modulates interbacterial killing during habitat transition. MBio. 11 (1), (2020).
- Salomon, D., Gonzalez, H., Updegraff, B. L., Orth, K. Vibrio parahaemolyticus type VI secretion system 1 is activated in marine conditions to target bacteria, and is differentially regulated from system 2. PloS One. 8 (4), 61086(2013).
- Sana, T. G., et al. Salmonella Typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut. Proceedings of the National Academy of Sciences. 113 (34), 5044-5051 (2016).
- Bachmann, V., et al. Bile salts modulate the mucin-activated type VI secretion system of pandemic Vibrio cholerae. PLoS Neglected Tropical Diseases. 9 (8), 0004031(2015).
- Ishikawa, T., et al. Pathoadaptive conditional regulation of the type VI secretion system in Vibrio cholerae O1 strains. Infection and Immunity. 80 (2), 575-584 (2012).
- Johnson, M. B., Criss, A. K. Fluorescence microscopy methods for determining the viability of bacteria in association with mammalian cells. Journal of Visualized Experiments. (79), e50729(2013).
- Stiefel, P., Schmidt-Emrich, S., Maniura-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. 15 (1), 36(2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved