Method Article
단세포 형광 화상 진찰을 사용하여 세균 간 경쟁의 정량화
요약
이 원고는 단일 세포 형광 현미경 검사를 사용하여 공동 문화에서 세균 경쟁을 시각화하고 정량화하는 방법을 설명합니다.
초록
세균 간 경쟁은 미생물군유전체의 구조와 기능에 직접적인 영향을 미칠 수 있습니다. 이 작품은 단일 세포 수준에서 다른 세균성 긴장 사이의 경쟁 상호 작용을 시각화하고 정량화하는 데 사용할 수있는 형광 현미경 접근법을 설명합니다. 여기서 설명된 프로토콜은 수직 및 반전된 상피성 현미경, 라이브 셀 및 시간 경과 이미징 기술, 오픈 소스 소프트웨어 FIJI를 이용한 정량적 이미지 분석에 대한 슬라이드 준비에 대한 고급 접근법을 위한 방법을 제공한다. 이 원고의 접근법은 안정된 플라스미드에서 다른 형광 단백질을 표현하는 두 개의 주화 된 균주에 대한 시간이 지남에 따라 지역의 변화를 측정하여 공생 Vibrio fischeri 인구 사이의 경쟁 상호 작용의 정량화를 설명합니다. 다른 성장 조건을 필요로 하는 세균 형 모델 시스템에서이 프로토콜을 최적화하기 위한 대체 방법이 설명되어 있습니다. 여기에 설명된 분석법은 V. fischeri에최적화된 조건을 사용하지만, 이 접근법은 매우 재현가능하며 다양한 미생물군유전체에서 컬처 가능한 분리체 간의 경쟁에 쉽게 적응할 수 있습니다.
서문
이 문서는 형광 현미경 검사를 사용하여 단세포 수준에서 세균 경쟁을 정량화하는 방법을 설명합니다. 미생물 공동체의 구조와 기능은 종종 미생물 간의 경쟁적 상호 작용에 의해 형성되며, 이러한 상호 작용을 특징짓는 많은 경우 코인큐베이션1,2,3,4,5,6,7,8에서 다른 세균균균을 관찰해야합니다. . 전통적으로, 세균경쟁은 코인큐베이션 기간2,9전후의 억제제 및 표적 균주의 식민지 형성 단위(CFU)를 계산하여 인구 수준에서 정량화된다. 미생물 경쟁을 위한 메커니즘은 박테리아 간에 광범위하게 분포되어 있으며 표적 세포10,11,12,13,14,15,16,17,18,19를억제하기 위해 확산 또는 세포 접촉에 의존할 수 있다.
세균성 균주는 인구 수준에서 coincubation에서 수시로 관찰됩니다, 이 원고는 세균 성 경쟁의 단세포 정량화를 위한 분석서를 설명합니다. 또한, 이 작업에는 다른 세균 종과 함께 사용하기 위한 프로토콜을 조정하기 위한 제안이 포함되어 있습니다. 이 문서의 특정 기술은 공생 세균 비브리오 피셔리20,21,22의균주 사이의 접촉 의존성 특이적 경쟁을 연구하는 데 사용되지만, 많은 유기체 간의 경쟁에 적응할 수 있다. 이 문서에서는 수직 및 반전 된 현미경 모두에 슬라이드 설정에 대한 지침을 제공하고, 모든 분석은 다른 이미징 설정 및 분석 프로그램에 액세스 할 수있는 연구원에 의해 사용할 수 있도록 오픈 소스 소프트웨어 FIJI23을 사용하여 설명된다. 인구와 단일 세포 수준에서 미생물 경쟁을 연구하는 것의 중요성을 감안할 때,이 방법은 경쟁력있는 상호 작용을 정량화하는 연구원, 특히 독점 분석 소프트웨어에 액세스 할 수없는 사람들을위한 귀중한 자원이 될 것입니다.
프로토콜
1. 세균균의 최적화
- 단세포 세균성 경쟁 세균성 연세 약에 대한 두 개의 세균성 균주를 선택하십시오. 여기서, V. fischeri의 2개의 변종은 사용되는: 표적 균주(ES11424)및 억제제 균주(MJ1125)는염색체 II(T6SS2)1에대한 형 VI 분비 시스템을 사용하여 표적 균주를 죽이는 것으로 알려져 있으며, 이는 접촉 의존적 살인 기전이다.
- 실험에 적합한 컨트롤을 결정합니다. 이 예에서, 적절한 제어는 T6SS 매개 살인의 효과를 정량화하기 위해 대상 균주와 야생형 및 T6SS 돌연변이 억제제 균주를 모두 배양하는 것이다.
참고: 추가 대조군은 T6SS 활동1을복원하기 위해 트랜스에서 돌연변이 유전자의 야생 형 사본을 발현하는 T6SS 의존적 살인 또는 억제제 돌연변이 균주를 방지하기 위해 필요한 면역 유전자(들)를 발현하는 표적 균주를 포함할 수 있다. - 가능하면, 현미경에 변형 유형을 시각적으로 구별하기 위해 다른 형광 단백질 (예를 들어, GFP 또는 RFP)에 대한 유전자를 코딩 안정적인 플라스미드균으로 균주를 변환합니다. 여기서, 억제제 균주는 GFP-인코딩 플라스미드(pVSV102)로 태그되고, 표적 균주는 dsRed-인코딩 플라스미드(pVSV208)26으로태그된다.
참고: 안정적인 플라스미드를 사용할 수 없는 경우, 형광 태그는시각화(27,28)를위해 세균 염색체에 도입될 수 있다. - 초기 최적화 기간 동안, 실험 중에 사용될 각 형광 필터 하에서 태그된 균주의 이미지 복제 배양은 세포가 의도한 채널에서만 볼 수 있도록 합니다. 예를 들어 GFP 태그가 지정된 스트레인이 FITC 채널에만 표시되는지 확인합니다.
2. 아가로즈 패드 준비
- mPBS에 2% 저용 아가로즈(w/v)를 용해시켜 아가로즈 패드 용액을 준비한다. 아가로즈가 완전히 용해될 때까지 전자레인지와 소용돌이에서 용액을 간략하게 가열합니다. 이 솔루션을 사용할 준비가 될 때까지 55°C 수조에 배치하여 따뜻하게 유지하십시오. 아가로즈 패드 준비에 대한 자세한 내용은 토론 섹션을 참조하십시오.
참고 : 여기에, mPBS는 표준 1 x PBS에 20 g / L NaCl을 추가하여 제조되었다. - 유리 슬라이드 주위에 실험실 테이프 조각을 5 번 감쌉니다. 이 과정을 동일한 슬라이드에서 두 번째로 반복하여 두 조각의 테이프 사이의 거리가 커버슬립(그림1A)의너비보다 약간 작아지않도록 합니다. 예를 들어 25mm2 커버립을 사용하는 경우 테이프 조각은 약 20mm 간격으로 간격을 두어야 합니다.
참고: 테이프를 슬라이드 주위에 감싸는 횟수는 아가로즈 패드의 두께를 조정하도록 수정할 수 있지만, 아가로즈 패드가 평평하게 유지되도록 슬라이드양쪽에 테이프 층이 동일한 높이인 것이 중요합니다. - 파이펫 따뜻한 아가로즈 용액은 테이프 두 조각 사이에 즉시 커버슬립을 얹어 테이프 조각에 놓습니다. 이렇게 하면 아가로즈 패드의 표면이 평평하게 유지됩니다. 이 단계에서 파이프처리된 아가로즈 용액의 부피는 커버슬립이 액체와 접촉하고 아가로즈 용액의 거품을 밀어내는 것으로 충분해야 합니다. 이 특정 설정의 경우 따뜻한 아가로즈 200 μL이 충분합니다.
- 아가로즈 패드가 동전 배양 분석 전에 적어도 1 시간 동안 실온에서 고형화시키십시오. 2.2 단계는 약 20mm2의아가로즈 패드를 생성합니다.
- 이 아가로즈 패드를 면도날로 4개, 5mm2 패드로 잘라 이미징에 사용됩니다.
참고: 아가로즈 패드는 실험 1주일 전까지 만기가도 되며 건조를 방지하기 위해 파라필름으로 밀봉된 빈 멸균 페트리 플레이트에 4°C로 보관할 수 있습니다.
3. 공동 배양을위한 균주를 준비
- -80°C 의 주로부터 -80°C의 주로부터 적절한 항생제로 보충된 LBS 천판에 각 균주를 줄이며 24°C에서 하룻밤 동안 배양한다. 이 예에서는 야생형 억제제 균주, VI 분비 시스템 돌연변이체 및 표적 균주 등 3가지 균주가 사용된다.
- 다음 날, 각 균주에서 두 개의 식민지를 따기와 적절한 항생제로 보충 LBS 배지에서 그들을 다시 중단하여 생물학적 중복에서 하룻밤 문화를 시작하고 200 rpm에서 흔들어 와 24 ° C에서 하룻밤 배양.
- 다음 날 아침, 각 생물학적 하위 배양은 항생제 없이 신선한 LBS 배지로 1:1000을 복제하고 24°C에서 4-5h 또는 세포가 OD600에 도달할 때까지 배양합니다.
참고: 3.1, 3.2 및 3.3 단계의 타이밍은 성장률이 크게 다를 수 있으므로 다른 세균 종에 최적화되어야 할 수 있습니다. 이 분석의 경우, 세포는 코인큐배션 분석의 시작 시 중간 로그 단계에 있는 것을 목표로 하였다.
4. 코인큐어 세균균
- 3.3단계에서 의 중간 로그 배양으로 시작하여 모든 샘플에 대해 600nm(OD600)에서광학 밀도를 측정하고 기록합니다.
- 각 샘플을 LBS 배지로 희석하여 V. fischeri에대한 약 109 CFU/mL에 해당하는 OD600 = 1.0으로 정규화한다.
- 각 정규화된 균주 30μL을 라벨이 붙은 1.5mL 튜브에 추가하여 부피를 기준으로 두 개의 경쟁 균주를 1:1 비율로 혼합합니다. 1-2s에 대한 혼합 변형 배양을 소용돌이.
참고: 경우에 따라 서로 다른 비율로 공동 문화를 혼합하는 것이 적절할 수 있습니다. 예를 들어, 하나의 균주가 다른 균주보다 훨씬 빠르게 증가할 때, 경쟁을 관찰하기 위해 수치 적 이점으로 느린 성장 균주를 시작해야 할 수도 있다. OD600이 두 균주에 대해 유사한 CFU/mL에 해당하지 않는 경우에도 최적화가 필요할 수 있습니다. - 각 생물학적 복제 및 치료에 대해 4.3 단계를 반복하십시오. 여기에 나타난 예에서, 이것은 총 4개의 혼합 균주 관을 초래할 것이다: 표적 균주와 혼합된 야생형 억제제 균주와 2개의 생물학적 복제및 표적 균주와 혼합된 형 VI 분비 시스템 돌연변이 균주와 함께 2개의 생물학적 복제.
- 경쟁 세포가 한천 패드의 코인큐베이션에서 접촉 의존적 살인을 위해 충분히 조밀하도록 하기 위해, 각 혼합 배양을 표준 1.5mL 원심분리튜브에서 21,130 x g에서1분 동안 원심분리하여 각 혼합 배양을 3배, 초판을 버리고, 20 μL LBS 배지의 각 펠릿을 재연한다. 각 샘플에 대해 반복합니다.
참고: 일부 세균 세포는 높은 rcf에서 원심분리에 의한 손상에 민감합니다. 이러한 경우 혼합 배양은 4600 x g29에서3분 동안 원심분리될 수 있다. 또한 접촉 에 의존하는 경쟁을 정량화할 때 슬라이드에서 충분한 세포 밀도를 보장하여 살인을 관찰하는 것이 중요합니다. 이 기사에서, "붐비는" 처리는, 살인이 관찰되는 곳에, 대략 10 개의 세포/20 μm2가있었습니다; 자세한 내용은 토론 섹션을 참조하십시오.
5. 슬라이드 설정
- 직립 현미경을 사용하는 경우 표준 1mm 유리 슬라이드에 ~ 5mm2 아가로즈 패드를 놓습니다. 혼합 배양의 2 μL을 아가로즈 패드에 놓고 #1.5 커버슬립(25mm2)을그 자리에 놓습니다. 예를 들어 그림 1B를 참조하십시오.
- 반전 된 현미경을 사용하는 경우, 35mm 페트리 접시의 #1.5 커버 슬립 바닥에 혼합 배양2 μL을 발견하고 동전 배양 지점에 ~ 5mm2 아가로즈 패드를 놓습니다. 아가로즈 패드 위에 12mm 원형 유리 커버슬립을 놓습니다. 예를 들어 그림 1C를 참조하십시오.
- 반복 단계 5.1 또는 5.2, 사용되는 현미경 설정에 따라, 나머지 세 가지 혼합 배양에 대한, 네 개의 슬라이드 또는 접시를 이미지하게.
- 슬라이드가 6단계로 진행되기 전에 약 5분 동안 벤치탑에 앉을 수 있도록 허용합니다. 이를 통해 세포는 한천 패드에 정착할 수 있으며 이미징 프로세스 중 의 움직임을 제거합니다.
6. 형광 현미경 검사법
- 백광(위상 대비 또는 DIC)을 사용하여 세포에 초점을 맞추어 사진 표백 효과를 최소화합니다. 단일 세균 세포의 평균 크기에 따라 60x 또는 100x 오일 목표를 사용합니다.
- 각 채널의 노출 시간 및 획득 설정을 조정하여 배경 감지를 최소화하면서 적절한 채널에 셀을 볼 수 있도록 합니다.
참고: 다른 채널에 대해 서로 다른 노출 시간을 사용하는 것이 적절하지만, 주어진 채널에 대해 모든 생물학적 복제 및 치료에 대해 동일한 노출 시간을 사용해야 합니다. - 각 샘플에 대해 최소 5개의 보기 필드(FOV)를 선택하고 6.2단계의 획득 설정을 사용하여 각 적절한 채널에서 이미지를 수집합니다(그림 2의예 참조). 각 FOV에서 XY 점을 저장하여 최종 시점 동안 동일한 FOV를 이미지화할 수 있습니다. 각 시점에서 동일한 FOV를 이미징하는 것은 분석 단계 동안 표적 또는 억제제 세포에 의해 점유된 영역의 비율을 결정하는 데 필요하다.
참고: 이 예에서 GFP의 형광은 467-498 nm의 흥분 파장을 가진 필터를 사용하여 검출되고 513 -556 nm의 방출 필터를 사용하며 거짓 색 녹색입니다. dsRed의 형광은 542 -582 nm의 발산 파장을 가진 필터를 사용하여 검출되고 603 - 678 nm의 방출 필터를 가지고 있으며 거짓 색 마젠타입니다. - 2시간 후, 이전에 저장된 XY점(도 2)을사용하여 각 샘플에 대해 6.3단계를 반복한다.
참고: 후속 이미지의 타이밍은 다른 성장률 또는 경쟁 메커니즘을 가진 유기체에 최적화되어야 할 수 있습니다.
7. 피지의 이미지 분석
- 여기에 있는 지침을 사용하여 FIJI 이미지 처리 소프트웨어를 다운로드하고 설치하십시오: https://imagej.net/Fiji/Downloads
- 분석을 위해 FIJI를 열고 이미지 파일을 가져옵니다.
참고: 대부분의 경우 . TIFF 파일은 이미지 분석에 사용되지만 일부 이미지 수집 소프트웨어는 독점 파일 형식을 사용하여 내보낼 것입니다. FIJI는 대부분의 독점 파일 유형을 인식할 수 있으며 이미지는 다음과 같이 가져오고 분석할 수 있습니다. - 6.3 및 6.4 단계에서 획득한 각 이미지에 대해 이미지를 회색으로 변환하고 채널을 분리하고 임계값(Ctrl + Shift + T)으로 시작하여 미리 처리된 이미지의 이진 마스크를만듭니다(그림 3A,B).
참고: 여기, 피지의 기본 임계값 설정이 사용 됩니다. 경우에 따라 이러한 설정을 변경해야 할 수 있으며, 이 경우 해당 실험의 모든 이미지에 동일한 설정을 사용해야 합니다. - 이미지의 크기설정(분석 | 설정 배율)현미경설정(23)에적합한 값을 사용하여 .
- 측정설정(| 분석 측정을 설정하고 영역을 선택합니다.
참고: 실험에 적합한 경우 다른 측정값을 추가할 수 있습니다. 여기에 표시된 예제 분석에는 개체 영역 측정만 필요합니다. - 입자분석(분석 | 기본 설정을 사용하여 파티클 을 분석합니다(그림3C). 시료에 이물질이 있는 경우 비세포 입자를 필터링하기 위해 크기 또는 원형을 조정해야 할 수도 있습니다. | 표시 선택 이 분석의 출력이 분석된 모든 입자의 번호가 매겨진 윤곽선을 포함하도록 하는 윤곽선(그림3D).
참고: 도 3D의 윤곽선을 초기 이미지와 비교하는 것은 최적화 단계에서 특히 중요하며(1) 모든 세포가 분석되고 있는지, (2) 모든 파편이 분석에서 제외되는지 확인한다. - 추가 분석 및 그래프를 위해 7.4단계(그림 3E)에서스프레드시트 소프트웨어로 측정을 내보냅니다.
- 실험 중에 획득한 모든 채널및 이미지에 대해 7.1 - 7.5 단계를 반복합니다.
8. 시간이 지남에 따라 초기 목표 영역의 백분율 계산
- 섹션 7에서 분석된 각 시야에 대해 내보낸 파일에 분석된 각 파티클에 대한 개별 영역 측정값이 포함되어 있는지 확인합니다. 대상 스트레인의 형광 채널부터 각 개별 시야에 대한 합계 입자 영역을 계산합니다. 각각 5개의 FOV를 가진 2개의 생물학 복제를 위해, 이것은 각 시점에서 처리 당 10개의 합계 영역 귀착되어야 합니다.
- 다음 방정식을 사용하여 각 FOV에 대한 시간이 지남에 따라 초기 대상 영역의 백분율을
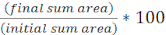 계산합니다.
계산합니다. - 모든 치료에 대해 이 계산을 반복하고 각 처리에 대해 초기 표적 영역의 백분율(8.2단계에서 방정식의 결과)을그래프로 반복한다(그림 4A).
- 대상 인구의 순 증가(성장을 나타내는), 목표 인구의 순 감소(사망 표시) 또는 각 치료에 대한 변화 없음(성장 또는 사망 없음)이 있는지 여부를 결정합니다.
참고: 값이 100을 초과하는 초기 대상 영역의 백분율은 순 목표 증가를 나타내며, 값이 100보다 낮음은 순 목표 사망을 나타냅니다. 100에 남아 있는 초기 대상 값의 백분율은 대상 모집단의 순 변동을 나타내지 않습니다. 제안된 후속 실험에 대한 토론을 참조하십시오.
9. 시간이 지남에 따라 초기 억제제 영역의 백분율 계산
- 반복 단계 8.1 받는 자 8.3, 이번에는 제7항(도 4B)에서억제제 변형의 형광 채널로부터 수집된 측정을 이용하여.
- 억제제 인구에 있는 순 증가가 있었는지 결정합니다 (성장); 억제제 인구의 순 감소 (죽음), 또는 각 치료에 대한 변화가 없습니다. 값이 100보다 큰 값은 순 억제제 성장을 나타내며, 값이 100보다 낮을수록 순 억제제 사망을 나타냅니다.
결과
단일 세포 수준에서 박테리아 간의 경쟁 적 상호 작용을 시각화하고 정량화하기 위해, 프로토콜은 잘 확립 된 CFU 기반 분석1,2를수정하여 V. fischeri에 대한 개발 및 최적화되었다. 이 방법은 GFP-및 dsRed-인코딩 안정플라스미드를 사용하여 V. fischeri의다른 균주를 시각적으로 구별합니다. 이러한 상호 작용의 경쟁 결과는 오픈 소스 소프트웨어 FIJI를 사용하여이 분석에서 얻은 이미지를 분석하여 정량화 할 수 있습니다. 예를 들어, V. 피셔리 분리를 사용하여 다음과 같은 실험을 수행하였다. 억제제 균주는 GFP를 인코딩하는 플라스미드를 품고 있었고, 표적 균주는 dsRed를 인코딩하는 플라스미드를 수용했습니다. 억제제에 의해 인코딩된 T6SS2가 접촉 의존적 살상 메커니즘임을 감안할 때, 세포가 혼잡한 곳(높은 세포 세포 접촉) 또는 분산(low cell-cell contact)이 이 분석의 최종 결과에 대한 실험 설정의 영향을 강조하기 위해 치료가 포함되었다. 샘플 데이터에서, 경쟁 균주는 1:1 비율로 혼합되고 2h에 대한 아가로즈 패드에 배양되었고, 초기 및 최종 (2 h) 이미지를 모두 촬영하였다. 대조군으로서, T6SS2 돌연변이 균주는 또한 혼잡하고 분산된 조건에서 표적 균주로 주조하였다. 상기와 같이 각 균주의 배양이 제조되고 주조되었고, 슬라이드는 도 1에도시된 바와 같이 제조되었다.
도 2는 초기 및 최종 시점에서 이미지화된 동일한 시야를 가진 각 실험 치료의 대표적인 형광 현미경 이미지를 나타낸다. 각 치료에 대해, GFP-인코딩 플라스미드를 품고 있는 야생형 억제제 또는 T6SS 돌연변이 균주들은 dsRed-인코딩 플라스미드를 품고 있는 표적 균주와 1:1 비율로 혼합하였다. 이 실험용 설정으로 2h 코인큐베이션 기간 동안, 성장하는 V. fischeri 세포는 1-2 분할(도2;회색 화살표)을통과할 수 있다. 도 2A에서,세포-세포 접촉은 슬라이드에 포지킹하기 전에 혼합 배양을 집중시킴으로써 표적과 억제제 사이에서 강제로 강제되었다. 다중 표적 세포는 2h의 과정을 통해 반올림 및/또는 사라지는 것으로 관찰되며, 억제제에 의해 제거되는 표적 세포와일치한다(도 2; 백색 화살표). 반올림 또는 용해 대상 셀 해석에 대한 자세한 내용은 토론 섹션을 참조하십시오. 도 2B에서,동일한 코인큐베이션이 슬라이드상에 발견되었으며, 이번에는 혼합 배양을 집중하지 않고 세포가 분산되어 슬라이드에 균주 사이에 최소한의 접촉이 있었다. 여기서, 표적 세포가 사라지지 않거나 둥근 것으로 관찰되지 않으며, 이는 표적 균주가 이 치료법에서 억제되지 않았다는 것을 시사한다. 도 2C 및 도 2D는 전술한 것과 동일한 혼잡및 분산 처리를 나타내며, 이번에는 억제제 균주와 같은 T6SS 돌연변이를 이용하여 한다. 표적 세포는 혼잡하거나 분산된 조건에서 T6SS 돌연변이제로 주조할 때 사라지지 않거나 둥근 것으로 관찰되지 않았으며, 다시 한 번 표적이 어느 치료에서도 억제되지 않았다는 것을 시사한다.
그림 3은 이 프로토콜에서 경쟁을 정량화하는 데 사용되는 FIJI 분석 워크플로우를 보여 주어 있다. 대상 채널의 대표 이미지가 선택되었다(그림3A)및 이진 마스크는 FIJI(그림3B)의기본 임계값 설정을 사용하여 만들어졌다. 이 현미경 설정에 대해 이미지 스케일이 적절하게 설정되었습니다. 입자는 크기 매개변수 = 0-무한대, 원형 매개변수 = 0.00 - 1.00을 사용하여 분석되었으며, 윤곽선 표시가 선택되었다(그림3C). 이러한 입자 분석의 결과는 각입자(도 3D)의번호가 매겨진 윤곽선과 입자 번호, 파일 이름(label) 및 μm 2(area)의 입자 영역(그림3E)에대한 열이 있는 테이블로 도시된다.
도 4에서도 3E로부터 얻은 데이터는 그래프화 및 분석된다. 도 4A에서,최종 시점에서 초기 표적 영역의 백분율은 8.2 단계에 따라 각 치료에 대해 제시된다. 초기 목표 영역의 백분율이 100보다 큰 경우, 이는 목표(즉, 성장)의 순 증가를 나타내며 대상 인구가 현저히 억제되지 않는 조건에서 관찰됩니다. 그러나, 초기 표적 영역의 백분율이 100보다 낮은 경우, 이 결과는 목표(즉, 사망)의 순 감소를 나타내며 표적 인구가 현저히 억제되는 조건에서 관찰된다. 대상이 혼잡한 조건에서 야생형 억제제로 주조되었을 때, 데이터는 대상 영역의 순 감소를 보여줍니다. 대조적으로, 대상이 분산 조건에서 야생형 억제제 또는 혼잡하거나 분산된 조건에서 T6SS 돌연변이체로 주조되었을 때, 데이터는 대상 영역의 순 증가를 보여준다. 대상이 혼잡한 조건에서 야생형 억제제로 주조되었을 때 초기 표적 영역의 백분율은 100 미만이었고 모든치료법(p < 0.0001)에걸쳐 투키의 다중 비교 테스트가 뒤따랐습니다. 이러한 데이터는 표적 세포 사멸이 억제제에서 기능성 T6SS에 의존한다는 것을 나타내며 접촉 의존적 살상 메커니즘에서 세포 사멸을 검출하기 위해 충분한 세포 세포 접촉을 허용하는 실험 적 설정의 중요성을 강조한다.
도 4B는 각 치료에 대한 최종 시점에서 초기 억제제 영역의 백분율을 제시한다. 이 예에서, 억제제 균주의 순 성장은 모든 치료 전반에 걸쳐 관찰되었다. 그러나, 초기 억제제 영역의 백분율은 모든 처리에 걸쳐 투키의 다중 비교 시험(p < 0.0001)에따라 단방향 ANOVA에 따라 다른 모든 처리에 비해 혼잡한 조건에서 표적으로 주조될 때 상당히 높았습니다(p < 0.0001). 처음에, 우리는 억제제 영역의 순 증가가 표적 세포가 제거됨에 따라 성장하는 사용 가능한 공간의 증가에 의해 구동 될 수 있다고 생각했다. 그러나, 억제제 성장에 있는 이 같은 증가는 억제제 세포가 coincubation의 시작부터 성장할 여지가 있던 분산 처리에서 관찰되지 않았습니다. 대안적으로, 이 결과는 용액 표적 세포에서 풀어 놓인 양분이 억제제 집단에 있는 더 중대한 증가를 허용한다는 것을 건의할 수 있었습니다. 종합하면, 이러한 결과는 억제제 균주가 높은 세포-세포 접촉이 슬라이드에 세포를 혼잡하게 하는 경우에만 T6SS에 의존하는 방식으로 표적을 제거한다는 것을 시사한다.
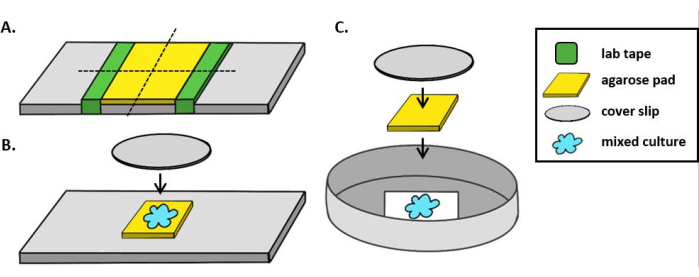
그림 1: 아가로즈 패드 준비 및 슬라이드 설정은 코인큐베이션 을 위한 것입니다.(A)2% 아가로즈 패드 를 만들기 위한 설정. 5층의 실험실 테이프(녹색)는 약 20mm 간격으로 2개의 지점에서 커버 슬립을 감싸고 있습니다. 다음으로, mPBS(노란색)에서 따뜻한 2% 아가로즈가 테이프 조각 사이에 파이프를 바르고 즉시 25mm2 커버 슬립으로 덮여 실온에서 1시간 이상 고화할 수 있습니다. 면도날을 사용하여 아가로즈 패드를 ~5mm2개로 자르고 핀셋을 사용하여 패드를 이미징을 위한 새로운 슬라이드로 옮겨넣습니다. (B)직립 현미경으로 이미징할 때 5mm2 아가로즈 패드를 슬라이드에 직접 배치하고 혼합 배양(파란색)과 12mm 원형 #1.5 커버 슬립을 따랐다. (C)반전 된 현미경으로 이미징 할 때, 35mm 페트리 접시의 #1.5 유리 커버 슬립 바닥에 직접 혼합 배양을 발견하고, 아가로즈 패드를 평평하게하기 위해 두 번째 12mm 원형 커버 슬립을 다음 배양 위에 아가로즈 패드를 놓습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
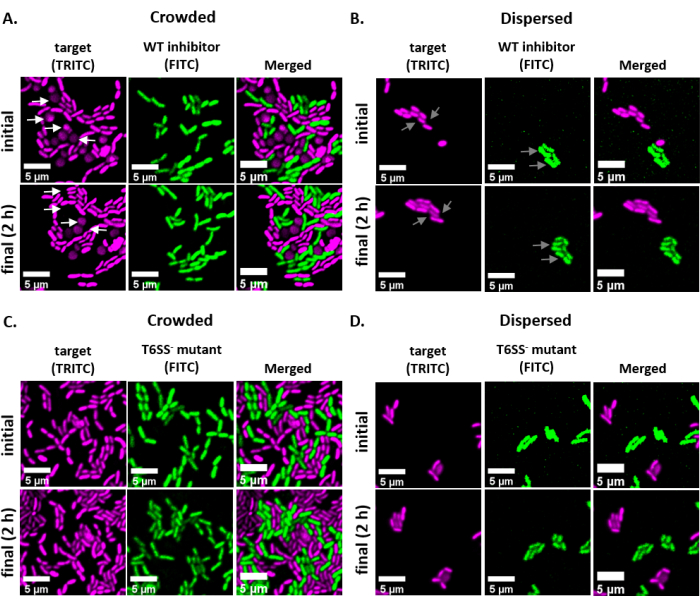
도 2: 혼혈 부위의 시간 경과 이미지로 혼잡하거나 분산되는 조건에서. (A)표적과 야생형 억제제의 혼합배양이 슬라이드에서 포지엄하기 전에 3배 집중된 초기 및 최종 시점에서 대표적인 이미지가 균주 들 사이의 세포 접촉을 강제로 하였다. TRITC 채널의 흰색 화살표는 실험 과정 전반에 걸쳐 둥글거나 lyse하는 표적 세포의 예를 나타냅니다. (B)표적과 야생형 억제제의 혼합배양이 집중없이 발견되어 세포가 분산되고 균주 들 사이의 세포 접촉이 최소화된 대표적인 이미지. FITC 및 TRITC 채널의 회색 화살표는 실험 과정 전반에 걸쳐 세포 분열의 예를 나타냅니다. (C)표적과 T6SS의 혼합 배양-돌연변이가 슬라이드에서 포지팅하기 전에 3배 집중되어 균주 들 사이의 세포 접촉을 강제로 하였다. (D)표적과 T6SS의 혼합 배양-돌연변이가 집중하지 않고 발견되어 세포가 분산되고 균주 들 사이의 세포 접촉이 최소화되는 대표적인 이미지. 스케일 바 = 5 μm 이며 모든 이미지에 걸쳐 일관 된; TRITC 채널은 거짓 색 의 마젠타, FITC 채널은 거짓 색 녹색입니다. deconvolution은 모든 이미지에서 수행되었다; 배경이 차감되었고 밝기/대비가 모든 이미지에서 균일하게 조정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
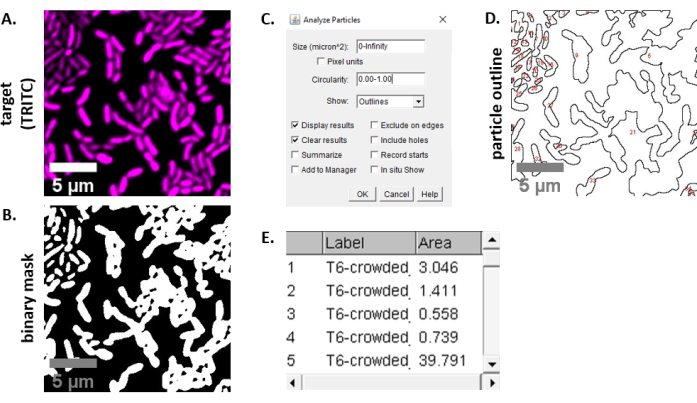
그림 3: 피지 분석 워크플로우. (A)분석을 위한 대표적인 이미지. 이 워크플로는 모든 보기 및 샘플 필드에 걸쳐 두 채널모두에 대해 반복됩니다. 스케일 바 = 5 μm 이며 모든 이미지에 걸쳐 일관 된; TRITC 채널은 거짓 색 의 마젠타, FITC 채널은 거짓 색 녹색입니다. (B)피지의 기본 설정을 사용하여 이미지를 임계값으로 표시하여 생성된 바이너리 마스크입니다. (C)이 원고에 사용되는 입자 분석을 위한 설정의 예입니다. 크기 범위 = 0 - 무한대 μm2; 순환 = 0.00 - 1.00; 표시 = 윤곽선. (D)입자 분석의 출력으로 생성된 입자 윤곽선(C). 입자 윤곽선은(D)의모든 세포가 입자 분석에서 캡처되었는지 확인하기 위해 원본 이미지(A)와 비교되어야 합니다. (E)(C)에서입자 분석에서 출력으로 만든 결과 테이블. 개체 번호(열 1)는패널(D)에서빨간색으로 윤곽을 매기고 레이블이 지정된 개별 입자(하나 이상의 셀)에 해당합니다. 레이블 = 분석된 이미지의 파일 이름; 면적 = μm2의총 입자 면적. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
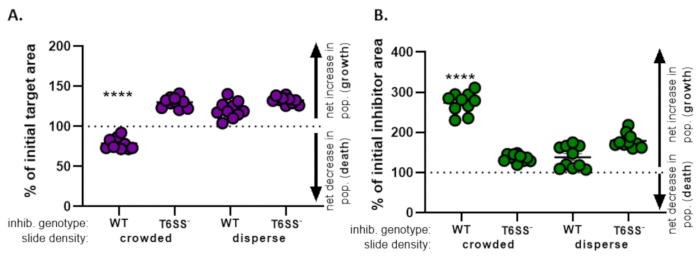
그림 4: 표적 균주가 억제되는지 여부를 평가하기 위한 샘플 데이터. 상이한 초기 세포 밀도에서 표적균주(A)및 억제제 균주(B)에 대한 최종 시점에서 초기 영역의 백분율. 슬라이드 밀도는 도 2에설명된 바와 같이 혼잡한 시작 세포 밀도(균주 간의 세포 접촉이 높음) 또는 더 분산(균주 간의 낮은 세포 접촉)을 나타낸다. 억제제 유전자형은 야생형 또는 T6SS 돌연변이(T6SS-)균주가 표적 균주와 함께 주조되었다는 것을 나타낸다. 별표는 모든 처리를 비교하는 % 변경에 있는 중요한 다름을 나타냅니다 (편도 ANOVA는 모든 처리를 비교하는 Tukey의 다중 비교 시험 뒤에; (p< 0.0001). 대시 선은 초기 및 최종 시간 점 사이의 변형 영역의 순 변화를 나타내지 않습니다. 100> % 변화는 순 증가(즉, 성장) 및 %변화가 100< 순 감소(즉, 세포 사멸)를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
전술한 프로토콜은 단일 세포 수준에서 세균 간 경쟁을 정량화하고 특성화하기 위한 강력한 도구를 제공합니다. 이 분석법은 한천판1,2에대한 CFU 기반 경쟁 분석법을 수정하여 개발되었으며, V. fischeri 격리 및 제안 간의 단일 세포 경쟁의 시각화를 허용하여 광범위한 시스템 및 현미경 설정에 대한 방법을 최적화할 수 있습니다. 여기에 설명된 방법은 광기관 공생 V. fischeri에최적화되었지만, 많은 다양하고 컬처 가능한 미생물을 수용하기 위해 쉽게 수정할 수 있다. 경쟁 메커니즘은 온도, 염도 및점도(30,31,32,33,34)를포함한 임의의 환경 변수에 의해 조절될 수 있다는 점에 유의해야 한다. 이전 연구는 V. fischeri가 표면(30)에서활성화되는 접촉 의존형 VI 분비 시스템을 사용하여 경쟁한다는 것을 확인하여, 본예 균주 간의 경쟁을 연구하기에 적합한 이 분석서에 설명된 조건을 만드는 것으로 확인되었습니다. 세균 경쟁을 정량화할 때 슬라이드에 있는 세포의 초기 밀도를 고려하는 것이 중요합니다. 표적과 억제제 세포 사이의 접촉이 종종 발생하도록 죽이는 데 요구된다는 점을 감안할 때, 세포 접촉이 최대화되고 세포가 슬라이드에 단일 평면에 남아 있도록 혼합 배양은 집중되어야한다. 세포 배양은 유사한 광학 밀도(중간 로그 상)로 성장한 다음, 다른 성장 단계에서 세포의 생리적 변화로 인해 단순히 배양을 더 높은 광학 밀도로 성장시키기 보다는 접촉을 강제하기 위해 농축되어야 한다. 다른 시스템에서는, 배양 조건 및 실험 용 설정은 경쟁 메커니즘이 활성화되고 코인큐베이션 조건에서 검출될 수 있도록 수정해야 할 수 있다.
이 분석서에 사용된 아가로즈 패드는 몇 가지 이점을 제공합니다: 세포가 자유롭게 움직이지 않도록 안정화를 제공하고, 실험 과정에서 배양이 건조되는 것을 방지합니다. 또한, 이소프로필-β-D-티오갈라콘토스사이드(IPTG)와 같은 화학 유도제가 실험에 필요한 경우, 아가로즈 용액에 쉽게 첨가할 수 있다. 그러나 아가로즈 준비는 다른 시스템에 맞게 조정되어야 할 가능성이 높다는 점에 유의해야 합니다. 전술한 예에서, 아가로즈 패드는 V. 피셔리 성장 배지에 사용되는 표준 염분인 20 psu mPBS로 2% 아가로즈(w/v)를 용해시킴으로써 제조하였다. 더욱이, 어떤 경우에는 세포가 성장하고 더 긴 실험을 통해 경쟁하기 위해 아가로즈 패드에 탄소 원을 추가해야 할 수도 있다. 이러한 경우, 아가로즈 패드내의 mPBS는 성장 배지의 영양소가 추가적인 배경 형광의 절충과 함께 올 수 있지만, 임의의 성장 매체로 대체될 수 있다.
독점적인 이미지 분석 소프트웨어가 없으면 셀-셀 접촉이 높을 때 개별 셀 수를 얻는 것이 매우 어려울 수 있으며, 여기서 보여 주듯이 접촉에 의존하는 살인을 관찰해야 합니다. 이 분석법은 개별 세포 수에 의존하지 않는 정량화를 위한 대체 방법을 제공하도록 설계되었습니다. 대신, 각 형광 채널에 대한 총 세포 영역은 주조 균주 사이의 살인 의 정도를 정량화하는 데 사용됩니다. 이 메서드는 개별 셀 수가 아닌 영역에 의존하기 때문에 기본 임계값 설정은 일반적으로 전체 셀 영역을 요약하기에 충분합니다. 임계값의 정확도는 모델 유기체에 대한 평균 세포 크기로 대표적인 시야에 대한 총 개체 영역을 분할하고 이 추정된 셀 수를 동일한 이미지에 대한 수동 셀 수와 비교하여 확인할 수 있다.
하나의 억제제와 하나의 표적 (비 킬러) 균주 사이의 동전 큐브에서, 억제제의 순 성장이 예측된다. 도 4에서볼 수 있듯이, 억제제 성장은 살인이 관찰되는 치료법에서 상당히 높을 수 있으며, 살인이 관찰되지 않는 치료법과 비교하여, 아마도 표적 세포를 리스하여 방출되는 영양소가 억제제 균주가 더 빨리 성장할 수 있기 때문일 수 있습니다. 여기에 나타난 예에서, T6SS-중재 경쟁은 대상이 물리적으로 제거되는 표적 세포 용해의 결과이기 때문에 순 표적 죽음이 관찰된다. 그러나 모든 경쟁 메커니즘이 대상 셀의 물리적 제거를 초래하는 것은 아닙니다. 대상이 성장 억제를 일으키는 독소에 의해 무능력한 경우, 여기에 설명된 프로토콜은 대상 세포가 더 이상 성장하지 않고 또한 lyse하지 않기 때문에 시간이 지남에 따라 안정적으로 남아있는 가시 대상 집단을 초래할 수 있습니다. 이러한 경우, 이 분석의 결과를 콜로니 성형 유닛(CFU)에 대한 도금과 같은 표적 세포 생존가능성에 대한 후속 검사와 비교하거나, 프로피듐 요오드 또는 SYTOX그린(35,36)으로염색하여 살아있는 분석서를 수행하는 것이 적절할 것이다.
CFU 카운트에 의존하는 코인큐레이션 분석서와 비교하여, 이 분석은 시간이 지남에 따라 균주와 표적 세포 형태학의 변화의 변형을 관찰하고 정량화할 수 있게 합니다. 예를 들어, T6SS를 사용하여 죽이는 억제제 세포는 표적 세포벽을 저하시키는 LysM-도메인 단백질을 인코딩하는 것으로 알려져 있으며, 그 결과 초기 세포 반올림 및리시스(13)가발생하며, 이는 도 2A에도시된 예에서 관찰된 것이다. 또한 이 프로토콜은 매우 짧은 시간 스케일에 걸쳐 고해상도로 경쟁을 추적하는 데 사용할 수 있습니다. 여기에 나타난 예에서, 세포가 혼잡하고 세포 세포 접촉이 균주 들 사이에서 강제되는 경우 2 시간 후에 표적 영역의 현저한 감소가 관찰된다(도4). 여기에 설명된 이미지 분석은 또한 공초점 현미경 검사를 사용하여 수행될 수 있었습니다, 이는 동전 배양 긴장의 공간 분포를 방해하지 않고, 생체 내 또는 복잡한 생물막에서 세균성 경쟁을 공부할 수 있게 할 것입니다.
요약하자면, 여기에 설명된 분석법은 형광 현미경을 사용하여 단일 세포 수준에서 세균 경쟁을 시각화하고 정량화하기 위한 접근가능하고 쉽게 수정된 접근법을 제공하는 것을 목표로 한다. 이 방법은 다양한 세균 분리에 적용될 수 있으며 숙주 또는 생물막 매트릭스 내와 같은 복잡한 환경에서도 세균 경쟁을 시각화하는 데 사용할 수 있다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
A.N.S는 NIGMS 보조금 R35 GM137886의 지원을 받았으며 S.N.S는 국방 과학 및 공학 대학원 펠로우십 프로그램의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Fisher | 05-408-129 | |
| 10 uL single channel pipette | |||
| 1000 uL single channel pipette | |||
| 20 uL single channel pipette | |||
| 200 uL single channel pipette | |||
| Agarose | Fisher | BP165-25 | Low melting agarose |
| Calculator | |||
| Cellvis 35 mm Dish | Fisher | NC0409658 | #1.5 cover glass bottom |
| Chloramphenicol | Sigma | C0378 | stock (20 mg/mL in Ethanol); final concentration in media (2 μg /mL LBS) |
| DAPI Nucleic Acid Stain | Fisher | EN62248 | optional (if not using stable plasmids) |
| FIJI image analysis sofware | ImageJ | https://imagej.net/Fiji/Downloads | open-source software |
| Fisherbrand Cover Glasses: Circles | Fisher | 12-545-81P | #1.5 cover glass; 12 mm diameter |
| Kanamycin Sulfate | Fisher | BP906-5 | stock (100 mg/mL in water, filter sterilize); final concentration in media (1 μg/mL LBS) |
| Lens Cleaning Tissue Paper | Fisher | S24530 | |
| Parafilm | Fisher | 13-374-12 | |
| Petri Plates | Fisher | FB0875713 | sterile with lid |
| Razor Blades | Fisher | S65921 | |
| Semi-micro Cuvettes | VWR | 97000-586 | |
| Spectrophotometer | |||
| SYBR Green Nucleic Acid Stain | Fisher | S7563 | optional (if not using stable plasmids) |
| Thermo Scientific Gold Seal Plain Microscope Slides | Fisher | 12-518-100B | |
| Thermo Scientific Richard-Allan Scientific Cover Glass | Fisher | 22-050-235 | #1.5 cover glass, 25 mm2 |
| Type F Immersion Oil | Fisher | NC0297589 | |
| Upright or inverted fluorescence microscope with camera and imaging software | Images in this article were acquired on a Nikon TI-2 inverted fluorescent microscope outfitted with an ORCA-Fusion Digital CMOS camera using NIS-Elements software. | ||
| Vortex | |||
| Water bath | Used to keep agarose warm prior to pipetting | ||
| LBS media | |||
| 1M Tris Buffer (pH ~7.5) | 50 mL 1 M stock buffer (62 mL HCl, 938 mL DI water, 121 g Trizma Base) | ||
| Agar Technical | Fisher | DF0812-17-9 | 15 g (Add only for plates) |
| DI water | 950 mL | ||
| Sodium Chloride | Fisher | S640-3 | 20 g |
| Tryptone | Fisher | BP97265 | 10 g |
| Yeast Extract | Fisher | BP9727-2 | 5 g |
| mPBS (marine PBS) | Phosphate buffered saline with marine salts added; used for making agarose pad | ||
| 10X PBS | Fisher | ICN1960454 | |
| Instant Ocean Sea Salt | Instant Ocean | SS1-160P | Adjust concentration to appropriate salinity; 20 psu used here |
| Sterile Vacuum Filter Units | Fisher | SCGVU01RE | Used to filter-sterilize mPBS |
| Vacuum pump | Used to filter-sterilize mPBS |
참고문헌
- Speare, L., et al. Bacterial symbionts use a type VI secretion system to eliminate competitors in their natural host. Proceedings of the National Academy of Sciences. 115 (36), 8528-8537 (2018).
- Speare, L., Septer, A. N. Coincubation assay for quantifying competitive interactions between Vibrio fischeri isolates. Journal of Visualized Experiments. (149), e59759 (2019).
- Frost, I., et al. Cooperation, competition and antibiotic resistance in bacterial colonies. The ISME journal. 12 (6), 1582-1593 (2018).
- Stubbendieck, R. M., Vargas-Bautista, C., Straight, P. D. Bacterial communities: interactions to scale. Frontiers in Microbiology. 7, 1234 (2016).
- Souza, D. P., et al. Bacterial killing via a type IV secretion system. Nature Communications. 6 (1), 1-9 (2015).
- Anderson, M. C., Vonaesch, P., Saffarian, A., Marteyn, B. S., Sansonetti, P. J. Shigella sonnei encodes a functional T6SS used for interbacterial competition and niche occupancy. Cell Host and Microbe. 21 (6), 769-776 (2017).
- Basler, M., Ho, B., Mekalanos, J. Tit-for-tat: Type VI secretion system counterattack during bacterial cell-cell interactions. Cell. 152 (4), 884-894 (2013).
- Guillemette, R., Ushijima, B., Jalan, M., Häse, C. C., Azam, F. Insight into the resilience and susceptibility of marine bacteria to T6SS attack by Vibrio cholerae and Vibrio coralliilyticus. PloS One. 15 (1), 0227864 (2020).
- Hachani, A., Lossi, N. S., Filloux, A. A visual assay to monitor T6SS-mediated bacterial competition. Journal of Visualized Experiments. (73), e50103 (2013).
- Hibbing, M. E., Fuqua, C., Parsek, M. R., Peterson, S. B. Bacterial competition: surviving and thriving in the microbial jungle. Nature Reviews Microbiology. 8 (1), 15-25 (2010).
- Ruhe, Z. C., Low, D. A., Hayes, C. S. Bacterial contact-dependent growth inhibition. Trends in Microbiology. 21 (5), 230-237 (2013).
- Wood, D. W., Pierson, L. S. The phzI gene of Pseudomonas aureofaciens 30-84 is responsible for the production of a diffusible signal required for phenazine antibiotic production. Gene. 168 (1), 49-53 (1996).
- Smith, W. P., et al. The evolution of the type VI secretion system as a disintegration weapon. PLoS Biology. 18 (5), 3000720 (2020).
- Chen, L., Zou, Y., She, P., Wu, Y. Composition, function, and regulation of T6SS in Pseudomonas aeruginosa. Microbiological Research. 172, 19-25 (2015).
- Sana, T. G., Lugo, K. A., Monack, D. M. T6SS: The bacterial "fight club" in the host gut. PLoS Pathogens. 13 (6), 1006325 (2017).
- Basler, M. Type VI secretion system: secretion by a contractile nanomachine. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1679), 20150021 (2015).
- Joshi, A., et al. Rules of engagement: the type VI secretion system in Vibrio cholerae. Trends in Microbiology. 25 (4), 267-279 (2017).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nature Reviews Microbiology. 14 (9), 589-600 (2016).
- Stubbendieck, R. M., Straight, P. D. Multifaceted interfaces of bacterial competition. Journal of Bacteriology. 198 (16), 2145-2155 (2016).
- Septer, A. N. The Vibrio-squid symbiosis as a model for studying interbacterial competition. Msystems. 4 (3), (2019).
- Tischler, A. H., Hodge-Hanson, K. M., Visick, K. L. Vibrio fischeri-squid symbiosis. eLS. , 1-9 (2019).
- Mandel, M. J., Dunn, A. K. Impact and influence of the natural Vibrio-squid symbiosis in understanding bacterial-animal interactions. Frontiers in Microbiology. 7, 1982 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Boettcher, K., Ruby, E. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna Scolopes. Journal of Bacteriology. 172 (7), 3701-3706 (1990).
- Doino, J. A., McFall-Ngai, M. J. A transient exposure to symbiosis-competent bacteria induces light organ morphogenesis in the host squid. The Biological Bulletin. 189 (3), 347-355 (1995).
- Dunn, A. K., Millikan, D. S., Adin, D. M., Bose, J. L., Stabb, E. V. New rfp-and pES213-derived tools for analyzing symbiotic Vibrio fischeri reveal patterns of infection and lux expression in situ. Applied and Environmental Microbiology. 72 (1), 802-810 (2006).
- Lambertsen, L., Sternberg, C., Molin, S. Mini-Tn7 transposons for site-specific tagging of bacteria with fluorescent proteins. Environmental Microbiology. 6 (7), 726-732 (2004).
- Koch, B., Jensen, L. E., Nybroe, O. A panel of Tn7-based vectors for insertion of the gfp marker gene or for delivery of cloned DNA into Gram-negative bacteria at a neutral chromosomal site. Journal of Microbiological Methods. 45 (3), 187-195 (2001).
- Peterson, B. W., Sharma, P. K., Van Der Mei, H. C., Busscher, H. J. Bacterial cell surface damage due to centrifugal compaction. Applied and Environmental Microbiology. 78 (1), 120-125 (2012).
- Speare, L., Smith, S., Salvato, F., Kleiner, M., Septer, A. N. Environmental viscosity modulates interbacterial killing during habitat transition. MBio. 11 (1), (2020).
- Salomon, D., Gonzalez, H., Updegraff, B. L., Orth, K. Vibrio parahaemolyticus type VI secretion system 1 is activated in marine conditions to target bacteria, and is differentially regulated from system 2. PloS One. 8 (4), 61086 (2013).
- Sana, T. G., et al. Salmonella Typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut. Proceedings of the National Academy of Sciences. 113 (34), 5044-5051 (2016).
- Bachmann, V., et al. Bile salts modulate the mucin-activated type VI secretion system of pandemic Vibrio cholerae. PLoS Neglected Tropical Diseases. 9 (8), 0004031 (2015).
- Ishikawa, T., et al. Pathoadaptive conditional regulation of the type VI secretion system in Vibrio cholerae O1 strains. Infection and Immunity. 80 (2), 575-584 (2012).
- Johnson, M. B., Criss, A. K. Fluorescence microscopy methods for determining the viability of bacteria in association with mammalian cells. Journal of Visualized Experiments. (79), e50729 (2013).
- Stiefel, P., Schmidt-Emrich, S., Maniura-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. 15 (1), 36 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유