Method Article
Tek Hücreli Floresan Görüntüleme Kullanılarak Interbakteriyel Rekabetin Nicelemesi
Bu Makalede
Özet
Bu makalede, kokültürdeki bakteriyel rekabeti görselleştirmek ve ölçmek için tek hücreli floresan mikroskopisi kullanma yöntemi açıklanmaktadır.
Özet
Interbakteriyel rekabet mikrobiyomların yapısını ve işlevini doğrudan etkileyebilir. Bu çalışma, tek hücreli düzeyde farklı bakteri suşları arasındaki rekabet etkileşimlerini görselleştirmek ve ölçmek için kullanılabilecek bir floresan mikroskopi yaklaşımını açıklar. Burada açıklanan protokol, hem dik hem de ters epifluoresans mikroskopları, canlı hücre ve hızlandırılmış görüntüleme teknikleri ve açık kaynaklı yazılım FIJI kullanılarak nicel görüntü analizi üzerinde slayt hazırlamada ileri yaklaşımlar için yöntemler sunmaktadır. Bu makaledeki yaklaşım, stabil plazmidlerden farklı floresan proteinleri ifade eden iki çakışan suş için zaman içinde alandaki değişimi ölçerek simbiyotik Vibrio fischeri popülasyonları arasındaki rekabet etkileşimlerinin nicelliğini özetlemektedir. Farklı büyüme koşulları gerektiren bakteriyel model sistemlerinde bu protokolün optimize edilmesi için alternatif yöntemler açıklanmıştır. Burada açıklanan test V. fischeriiçin optimize edilmiş koşullar kullansa da, bu yaklaşım son derece tekrarlanabilir ve çeşitli mikrobiyomlardan kült olabilir izolatlar arasındaki rekabeti incelemek için kolayca uyarlanabilir.
Giriş
Bu makalede, floresan mikroskopisi kullanılarak tek hücre düzeyinde bakteriyel rekabeti ölçmek için bir yöntem özetler. Mikrobiyal toplulukların yapısı ve işlevi genellikle mikroplar arasındaki rekabetçi etkileşimlerle şekillenir ve çoğu durumda bu etkileşimleri karakterize etmek, coincubation 1 , 2 , 3 ,4,5,6,7,8'de farklı bakteri suşlarının gözlemlenmesinigerektirir. . Geleneksel olarak, bakteriyel rekabet, bir coincubation döneminden önce ve sonra inhibitör ve hedef suşların koloni oluşturan birimleri (CFO'lar) sayılarak popülasyon düzeyinde ölçülür2,9. Mikrobiyal rekabet mekanizmaları bakteriler arasında geniş ölçüde dağıtılır ve hedef hücreleri inhibe etmek için difüzyon veya hücre-hücre temasına dayanabilir10,11,12,13,14,15,16,17,18,19.
Bakteri suşları genellikle popülasyon düzeyindeki coincubation'da gözlse de, bu makale bakteriyel rekabetin tek hücreli nicelliği için bir tahlil özetlemektedir. Ayrıca, bu çalışma protokolün diğer bakteri türleriyle kullanımı için uyarlamak için öneriler içerir. Bu makaledeki spesifik teknikler simbiyotik bakteri Vibrio fischeri20 , 21,22'ninsuşları arasındaki temasa bağımlı intraspesifik rekabeti incelemek için kullanılırken, birçok organizma arasındaki rekabete uyarlanabilirler. Bu makalede, hem dik hem de ters mikroskoplarda slayt kurulumu için yönergeler sağlanmaktadır ve yöntemin farklı görüntüleme kurulumlarına ve analiz programlarına erişimi olan araştırmacılar tarafından kullanılabilmesi için tüm analizler fiji23 açık kaynaklı yazılımı kullanılarak açıklanmaktadır. Mikrobiyal rekabeti hem nüfus hem de tek hücre düzeyinde incelemenin önemi göz önüne alındığında, bu yöntem, özellikle tescilli analiz yazılımına erişimi olmayanların rekabetçi etkileşimlerini ölçmek için araştırmacılar için değerli bir kaynak olacaktır.
Protokol
1. Bakteri suşlarının optimizasyonu
- Tek hücreli bakteriyel rekabet tahlilleri için iki bakteri türü seçin. Burada, iki V. fischeri suşu kullanılır: bir hedef suşu (ES11424) ve bir inhibitör suşu (MJ1125),kontakt bağımlı bir öldürme mekanizması olan kromozom II (T6SS2)1üzerindeki tip VI salgı sistemini kullanarak hedef suşu öldürdüğü bilinmektedir.
- Deneme için uygun denetimleri belirleyin. Bu örnekte, uygun kontrol, T6SS aracılı öldürmenin etkisini ölçmek için hem vahşi tip hem de T6SS mutant inhibitör suşlarını hedef suşla kuluçkaya yatırmaktır.
NOT: Ek kontroller, T6SS'ye bağımlı öldürmeyi önlemek için gerekli bağışıklık genlerini ifade eden bir hedef suşu veya T6SS aktivitesini geri yüklemek için transtaki mutasyona uğramış genlerin vahşi tip kopyalarını ifade eden bir inhibitör mutant suşu içerebilir1. - Mümkün olduğunda, mikroskop üzerindeki gerinim tiplerini görsel olarak ayırt etmek için farklı floresan proteinler (örneğin, GFP veya RFP) için genleri kodlayan kararlı plazmidlerle suşları dönüştürün. Burada, inhibitör suşu bir GFP kodlama plazmidi (pVSV102) ile etiketlenmiştir ve hedef gerinim bir dsRed kodlayıcı plazmid (pVSV208)26ile etiketlenmiştir.
NOT: Kararlı plazmidler kullanmak mümkün değilse, görselleştirme için bakteri kromozomuna floresan etiketler eklenebilir27,28. - İlk optimizasyon döneminde, hücrelerin yalnızca hedeflenen kanalda görünür olmasını sağlamak için deney sırasında kullanılacak floresan filtrelerin her birinin altındaki etiketli suşların görüntü klonal kültürleri. Örneğin, GFP etiketli bir gerinimin yalnızca FITC kanalında göründüğüne emin olun.
2. Agarose ped hazırlığı
- %2 düşük eriyik agarose (w/v) çözerek agarose ped çözeltisini mPBS'ye hazırlayın. Çözeltiyi mikrodalgada ve girdapta agarose tamamen çözünene kadar kısa bir süre ısıtın. Kullanıma hazır olana kadar 55°C'lik bir su banyosuna yerleştirerek bu çözeltiyi sıcak tutun. Agarose pedleri hazırlama hakkında daha fazla bilgi için Tartışma bölümüne bakın.
NOT: Burada mPBS standart 1x PBS'ye 20 g/L NaCl eklenerek hazırlanmıştır. - Bir laboratuvar kaseti parçasını cam kaydırağın etrafına beş kez sarın. Bu işlemi aynı slaytta ikinci kez tekrarlayın, böylece iki bant parçası arasındaki mesafe bir kapak genişliğine göre biraz daha küçüktür (Şekil 1A). Örneğin, 25 mm2 kapak kılıfı kullanıyorsanız, bant parçaları yaklaşık 20 mm aralıklı olmalıdır.
NOT: Agarose pedinin kalınlığını ayarlamak için bandın slayda sarılma sayısı değiştirilebilirken, agarose pedi düz kalacak şekilde bant katmanlarının slaydın her iki tarafında aynı yükseklikte olması önemlidir. - Pipet, iki bant parçası arasında sıcak agarose çözeltisi ve bant parçalarına dayanması için hemen bir kapakla üst üste. Bu, agarose pedinin yüzeyinin düz kalmasını sağlayacaktır. Bu adımda pipetlenmiş agarose çözeltisinin hacmi, kapak kapağının sıvı ile temas etmesi ve agarose çözeltisinde herhangi bir kabarcıkları dışarı itmesi için yeterli olmalıdır. Bu özel kurulum için 200 μL sıcak agarose yeterlidir.
- Agarose pedinin, coincubation testten önce oda sıcaklığında en az 1 saat katılaşmasına izin verin. Adım 2.2 yaklaşık 20 mm2agarose ped üretecektir.
- Bu agarose pedi jiletle görüntüleme için kullanılacak dört, 5 mm2 ped halinde kesin.
NOT: Agarose pedler deneyden bir hafta öncesine kadar yapılabilir ve kurumasını önlemek için parafilm ile kapatılmış boş, steril bir Petri plakasında 4°C'de saklanabilir.
3. Suşları birlikte inkübasyon için hazırlayın
- Coincubation testinde kullanılacak her bir suşu -80 °C stoklardan lbs agar plakalarına uygun antibiyotiklerle desteklenmiş ve 24°C'de bir gecede kuluçkaya yatırın. Bu örnekte, üç suş kullanılır: vahşi tip inhibitör suşu, tip VI salgı sistemi mutant ve hedef suşu.
- Ertesi gün, her suştan iki koloni seçerek ve uygun antibiyotiklerle desteklenmiş LBS ortamında yeniden oluşturarak biyolojik kopyada geceleme kültürlerine başlayın ve 24 °C'de 200 rpm'de sallanarak gece boyunca kuluçkaya yatırın.
- Ertesi sabah, alt kültür her biyolojik 1:1000'i antibiyotiksiz taze LBS ortamına çoğaltır ve 24 °C'de 4-5 saat boyunca sallanarak veya hücreler ~1,5'in600'üne ulaşana kadar kuluçkaya ya da inkübte eder.
NOT: 3.1, 3.2 ve 3.3 adımlarının zamanlaması, büyüme oranları önemli ölçüde değişebileceğinden farklı bakteri türleri için optimize edilmesi gerekebilir. Bu tahlil için, hücrelerin coincubation tahlilinin başlangıcında orta kütük aşamasında olması amaçlanmıştır.
4. Coincubate bakteri suşları
- 3.3 adımından itibaren orta günlük kültürlerinden başlayarak, optik yoğunluğu tüm örnekler için 600 nm 'de (OD600)ölçün ve kaydedin.
- Kültürü LBS ortamıyla seyrelterek, her örneği V. fischeriiçin yaklaşık 10 9 CFU/mL'ye karşılık gelen bir OD600 =1.0'a normalleştirin.
- Etiketli 1,5 mL'lik bir tüpe normalleştirilmiş her bir gerinimden 30 μL ekleyerek, iki rakip suşları hacme göre 1:1 oranında karıştırın. Vortex 1-2 s için karışık suş kültürü.
NOT: Bazı durumlarda, kokültürlerin farklı oranlarda karıştırılması uygun olabilir. Örneğin, bir suş diğerinden çok daha hızlı büyüdüğünde, rekabeti gözlemlemek için daha yavaş büyüyen suşu sayısal bir avantajla başlatmak gerekebilir. OD600 her iki suş için benzer CFU/mL'ye karşılık gelmiyorsa optimizasyon da gerekebilir. - Her biyolojik çoğaltma ve tedavi için 4.3 adımlarını tekrarlayın. Burada gösterilen örnekte, bu toplam dört karışık gerinim tüpü ile sonuçlanacaktır: hedef suşu ile karıştırılan vahşi tip inhibitör suşu ile iki biyolojik çoğaltma ve hedef suşu ile karıştırılan tip VI salgı sistemi mutant suşu ile iki biyolojik çoğaltma.
- Rakip hücrelerin agar pedi üzerindeki karbürasyonda temasa bağımlı öldürme için yeterince yoğun olduğundan emin olmak için, karışık kültürü standart bir 1,5 mL santrifüj tüpünde 21.130 x g'da1 dakika santrifüjleyarak, süpernatantı atarak ve her peleti 20 μL LBS ortamda yeniden oluşturarak her bir karışık kültürü 3 kat konsantre edin. Her örnek için tekrarlayın.
NOT: Bazı bakteri hücreleri yüksek rcf'de santrifüjleme ile hasara karşı hassastır; Bu gibi durumlarda karışık kültür 4600 x g29'da3 dakika santrifüjlenebilir. Ek olarak, temasa bağımlı rekabeti ölçtken, öldürmeyi gözlemlemek için slaytta yeterli hücre yoğunluğunun sağlanması önemlidir. Bu makalede, öldürmenin gözlendiği "kalabalık" tedaviler yaklaşık 10 hücre/20 μm2'yesahipti; daha fazla bilgi için Tartışma bölümüne bakın.
5. Slayt kurulumu
- Dik bir mikroskop kullanırken, standart bir 1 mm cam kaydırağa~5 mm 2 agarose ped yerleştirin. Agarose pedi üzerine karışık bir kültürün 2 μL'sini yerleştirin ve noktanın üzerine 1,5 numaralı bir kapak parçası (25 mm2)yerleştirin. Örnek olarak Şekil 1B'ye bakın.
- Ters bir mikroskop kullanırken, 35 mm Petri kabının 1,5 numaralı kapak tabanına karışık bir kültürün 2 μL'lik kısmını tespit edin ve coincubation noktasının üzerine~5 mm 2 agarose ped yerleştirin. Agarose pedi üzerine 12 mm dairesel cam kapaklı yerleştirin. Örnek olarak Şekil 1C'ye bakın.
- Kalan üç karma kültür için kullanılan mikroskop kurulumuna bağlı olarak 5.1 veya 5.2 adımını yineleyin ve dört slayt veya yemek görüntülenecek.
- 6. adıma geçmeden önce slaytların tezgahta yaklaşık 5 dakika oturmasına izin verin. Bu, hücrelerin agar pedi üzerine yerleşmesini sağlar ve görüntüleme işlemi sırasında hareketi ortadan kaldırır.
6. Floresan mikroskopi
- Fotoğraf ağartmanın etkilerini en aza indirmek için beyaz ışık (faz kontrastı veya DIC) kullanarak hücrelere odaklanarak başlayın. Tek bir bakteri hücresinin ortalama büyüklüğüne bağlı olarak, 60x veya 100x yağ hedefi kullanın.
- Hücrelerin en az arka plan algılamasıyla uygun kanalda görünür olması için her kanal için pozlama süresini ve edinme ayarlarını yapın.
NOT: Farklı kanallar için farklı pozlama süreleri kullanmak uygundur, ancak belirli bir kanal için tüm biyolojik çoğaltmalarda ve tedavilerde aynı maruz kalma süresi kullanılmalıdır. - Her örnek için en az beş görüş alanı (FOV) seçin ve adım 6.2'deki alma ayarlarını kullanarak her uygun kanalda görüntüler alın (Şekil 2'dekiörneklere bakın). XY noktalarını her FOV'dan kaydedin, böylece aynı FOV son zaman noktasında görüntülenebilir. Analiz adımları sırasında hedef veya inhibitör hücrelerin kapladığı alanın oranını belirlemek için her zaman noktasında aynı FOV'un görüntülenmesi gereklidir.
NOT: Bu örnekte, GFP floresan, 467 - 498 nm ekscitasyon dalga boylarına ve 513 - 556 nm emisyon filtresine sahip bir filtre kullanılarak algılanır ve yanlış renkli yeşildir. dsRed floresan, 542 - 582 nm ekscitasyon dalga boylarına ve 603 - 678 nm emisyon filtresine sahip bir filtre kullanılarak tespit edilir ve yanlış renkli macentadır. - 2 saat sonra, önceden kaydedilmiş XY noktalarını kullanarak her örnek için 6.3 adımını yineleyin (Şekil 2).
NOT: Sonraki görüntülerin zamanlamasının farklı büyüme oranlarına veya rekabet mekanizmalarına sahip organizmalar için optimize edilmesi gerekebilir.
7. FIJI'de görüntü analizi
- Fiji görüntü işleme yazılımını burada bulunan talimatları kullanarak indirin ve yükleyin: https://imagej.net/Fiji/Downloads
- FIJI'yi açın ve analiz için görüntü dosyalarını içe aktarın.
NOT: Çoğu durumda . TIFF dosyaları görüntü analizi için kullanılacaktır, ancak bazı görüntü alma yazılımları özel dosya türleri kullanılarak dışa aktarılacaktır. FIJI, çoğu özel dosya türünü tanıyabilir ve görüntüler aşağıdaki gibi içe aktarılabilir ve analiz edilebilir. - 6.3 ve 6.4 adımlarında elde edilen her görüntü için, görüntüyü gri tonlamalıya dönüştürün, kanalları ayırın ve eşik oluşturarak (Ctrl + Shift + T) ve önceden işlenmiş görüntünün ikili maskesini oluşturarak başlayın (Şekil 3A,B).
NOT: Burada, FIJI'deki varsayılan eşik ayarları kullanılır. Bazı durumlarda, bu ayarları değiştirmek gerekebilir, bu durumda aynı ayarlar bu denemedeki tüm görüntüler için kullanılmalıdır. - Görüntüde ölçeği ayarlama (| çözümle Ölçek Ayarla) mikroskopi kurulumu için uygun değerleri kullanarak23.
- Ölçümleri ayarlama (Analiz | Ölçümleri Ayarla) seçin ve Alan 'ıseçin.
NOT: Deney için uygunsa diğer ölçümler eklenebilir. Burada gösterilen örnek analiz için yalnızca Alan ölçümü nesnesi gereklidir. - Parçacıkları analiz etme (Analiz | Varsayılanayarları kullanarak Parçacıkları Çözümleyin (Şekil 3C). Numunede döküntü varsa, hücre dışı parçacıkları filtrelemek için boyutu veya döngüselliği ayarlamak gerekebilir. | Göster'i seçin Bu analizin çıktısının analiz edilen tüm parçacıkların numaralı bir anahattını içermesi için anahatlar (Şekil 3D).
NOT: Şekil 3D'deki anahattı ilk görüntüyle karşılaştırmak, (1) tüm hücrelerin analiz edildiğinden ve (2) herhangi bir döküntünün analizden dışlanmasını sağlamak için optimizasyon adımında özellikle önemlidir. - Ölçümleri adım 7.4'ten(Şekil 3E)daha fazla analiz ve grafik için bir elektronik tablo yazılımına dışa aktarın.
- Deneme sırasında elde edilen tüm kanallar ve görüntüler için 7.1 - 7.5 adımlarını yineleyin.
8. Zaman içinde ilk hedef alanın yüzdesini hesaplama
- Bölüm 7'de analiz edilen her görüş alanı için, dışa aktarılan dosyanın analiz edilen her parçacık için ayrı bir alan ölçümü içerdiğinden emin olun. Hedef gerinimin floresan kanalından başlayarak, her bir görüş alanı için toplam parçacık alanını hesaplayın. Her biri beş FOV ile iki biyolojik çoğaltma için, bu her zaman noktasında tedavi başına on toplam alanla sonuçlanmalıdır.
- Aşağıdaki denklemi kullanarak her FOV için zaman içinde ilk hedef alanın yüzdesini hesaplayın: (
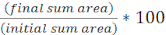 )
) - Tüm tedaviler için bu hesaplamayı tekrarlayın ve her tedavi için ilk hedef alanın yüzdesini (8.2 adımındaki denklemin sonucu) grafikleyin (Şekil 4A).
- Hedef popülasyonda net bir artış (büyümeyi gösteren), hedef popülasyonda net bir azalma (ölümü gösteren) veya her tedavi için herhangi bir değişiklik (büyüme veya ölüm olmadığını gösteren) olup olmadığını belirleyin.
NOT: Değerleri 100'den büyük olan ilk hedef alanın yüzdesi net hedef büyümesini, 100'den düşük değerler ise net hedef ölümünü gösterir. 100'de kalan ilk hedef değerlerin yüzdesi, hedef popülasyonda net bir değişiklik olmadığını gösterir. Önerilen takip deneyleri için tartışmaya bakın.
9. Zaman içinde ilk inhibitör alanının yüzdesini hesaplama
- 8.1 ile 8.3 arasındaki adımları tekrarlayın, bu kez bölüm 7'deki inhibitör suşun floresan kanalından toplanan ölçümleri kullanarak (Şekil 4B).
- inhibitör popülasyonunda net bir artış olup olmadığını belirlemek (büyüme); inhibitör popülasyonunda net bir azalma (ölüm) veya her tedavi için bir değişiklik yoktur. 100'den büyük değerler net inhibitör büyümesini, 100'den düşük değerler ise net inhibitör ölümünü gösterir.
Sonuçlar
Bakteriler arasındaki rekabet etkileşimlerini tek hücre düzeyinde görselleştirmek ve ölçmek için, köklü CFU tabanlı test 1,2'mizideğiştirerek V. fischeri için bir protokol geliştirildi ve optimize edildi. Bu yöntem, farklı V. fischerisuşlarını görsel olarak ayırt etmek için GFP ve dsRed kodlayıcı kararlı plazmidleri kullanır. Bu etkileşimlerin rekabetçi sonucu, açık kaynaklı yazılım FIJI kullanılarak bu testten elde edilen görüntülerin analiz edilmesiyle ölçülebilir. Örnek olarak, aşağıdaki deney V. fischeri izolatları kullanılarak gerçekleştirildi. Bir inhibitör suşu GFP'yi kodlayan bir plazmid barındırırdı ve bir hedef suşu dsRed'i kodlayan bir plazmid barındırırdı. inhibitör tarafından kodlanan T6SS2'nin temasa bağımlı bir öldürme mekanizması olduğu göz önüne alındığında, deneysel kurulumun bu tahlilin nihai sonuçları üzerindeki etkisini vurgulamak için hücrelerin kalabalık olduğu (yüksek hücre-hücre teması) veya bir slaytta dağıldığı (düşük hücre-hücre teması) tedaviler dahil edildi. Örnek verilerde, rakip suşlar 1:1 oranında karıştırıldı ve 2 saat boyunca bir agarose pedinde inkübe edildi ve hem ilk hem de son (2 saat) görüntüler çekildi. Kontrol olarak, bir T6SS2 mutant suşu da hem kalabalık hem de dağınık koşullarda hedef suşu ile çakıştı. Her türün kültürleri yukarıda açıklandığı gibi hazırlandı ve çakıştı ve Slaytlar Şekil 1'degösterildiği gibi hazırlandı.
Şekil 2, her deneysel tedavinin temsili floresan mikroskopi görüntülerini, ilk ve son zaman noktasında görüntülenen aynı görüş alanıyla göstermektedir. Her tedavi için, GFP kodlayıcı plazmid içeren vahşi tip bir inhibitör veya T6SS mutant suşu, dsRed kodlayıcı plazmid içeren hedef suş ile 1:1 oranında karıştırıldı. Bu deneysel kurulumla 2 saat süren bir coincubation döneminde, büyüyen V. fischeri hücreleri 1-2 bölümden geçebilir (Şekil 2; gri oklar). Şekil 2A'da,hücre hücresi teması slayta tespit etmeden önce karışık kültürü yoğunlaştırarak hedef ve inhibitör arasında zorlandı. Birden fazla hedef hücrenin inhibitör tarafından ortadan kaldırılmasıyla tutarlı olarak 2 saat boyunca yuvarlandığı ve/veya kaybolduğu gözlenir (Şekil 2; beyaz oklar). Yuvarlamayı yorumlama veya hedef hücreleri katlama hakkında daha fazla bilgi için Tartışma bölümüne bakın. Şekil 2B'de,aynı coincubation bir slaytta tespit edildi, bu sefer karışık kültürü konsantre etmeden, böylece hücreler dağınık kaldı ve slayttaki suşlar arasında minimum temas vardı. Burada, hiçbir hedef hücrenin kaybolduğu veya yuvarlak olmadığı gözlenmez, bu da hedef suşun bu tedavide inhibe olmadığını düşündürmektedir. Şekil 2C ve Şekil 2D, yukarıda açıklanan aynı kalabalık ve dağınık tedavileri gösterir, bu kez inhibitör suşu olarak bir T6SS mutant kullanarak. Hedef hücrelerin kalabalık veya dağınık koşullarda bir T6SS mutantıyla çakıştığında kaybolduğu veya yuvarlak olduğu gözlenmedi ve bu da hedefin her iki tedavide de inhibe olmadığını düşündürdü.
Şekil 3, bu protokoldeki rekabeti ölçmek için kullanılan FIJI analiz iş akışını gösterir. Hedef kanaldan temsili bir görüntü seçildi (Şekil 3A) ve FIJI'deki varsayılan eşik ayarları kullanılarak ikili maske oluşturuldu (Şekil 3B). Görüntü ölçeği bu mikroskopi kurulumu için uygun şekilde ayarlandı. Parçacıklar = 0 - sonsuzluk, döngüsellik parametresi = 0.00 - 1.00 boyut parametresi kullanılarak analiz edildi ve Anahatları Göster seçildi (Şekil 3C). Bu parçacık analizinin sonuçları hem her parçacığın numaralı bir anahattı (Şekil 3D) hem de parçacık numarası, dosya adı (etiket) ve parçacık alanı için sütunların bulunduğu bir tablo olarakμm 2 (alan) (Şekil 3E)olarak gösterilir.
Şekil 4'teŞekil 3E'den elde edilen veriler grafiklendirilir ve analiz edilir. Şekil 4A'da, son zaman noktasındaki ilk hedef alanın yüzdesi, adım 8.2'ye göre her tedavi için sunulmuştur. İlk hedef alanın yüzdesi 100'den büyükse, bu hedefte net artışı temsil eder (yani büyüme) ve hedef popülasyonun önemli ölçüde engellenmediği koşullarda gözlenir. Bununla birlikte, ilk hedef alanın yüzdesi 100'den düşükse, bu sonuç hedefte net bir düşüşe (yani ölüme) işaret eder ve hedef popülasyonun önemli ölçüde engellendiği koşullarda gözlenir. Hedef kalabalık koşullarda vahşi tip inhibitörle çakıştığında, veriler hedef alanda net bir azalma olduğunu gösterir. Bunun aksine, hedef dağınık koşullarda vahşi tip bir inhibitör veya kalabalık veya dağınık koşullarda bir T6SS mutant ile çakıştığında, veriler hedef alanda net bir artış gösterir. Hedef kalabalık koşullarda vahşi tip inhibitörle çakıştığında ilk hedef alanın yüzdesi 100'ün altındaydı ve tek yönlü bir ANOVA'ya göre diğer tüm tedavilerden önemli ölçüde daha düşüktü ve ardından tukey'in tüm tedavilerde çoklu karşılaştırma testi yapıldı(p < 0.0001). Bu veriler, hedef hücre ölümünün inhibitördeki işlevsel bir T6SS'ye bağlı olduğunu gösterir ve temasa bağımlı bir öldürme mekanizmasından hücre ölümünü tespit etmek için yeterli hücre hücresi temasına izin veren deneysel bir kurulumun öneminin altını çizer.
Şekil 4B, her tedavi için son zaman noktasında ilk inhibitör alanının yüzdesini sunar. Bu örnekte tüm tedavilerde inhibitör suşunun net büyümesi gözlenmiştir. Bununla birlikte, tek yönlü bir ANOVA'ya göre diğer tüm tedavilere kıyasla kalabalık koşullarda hedefe bir vahşi tip inhibitör yazıldığında ilk inhibitör alanının yüzdesi önemli ölçüde daha yüksekti ve ardından tukey'in tüm tedavilerde çoklu karşılaştırma testi yapıldı(p < 0.0001). Başlangıçta, inhibitör alandaki net artışın, hedef hücreler ortadan kaldırıldıkça büyümek için kullanılabilir alandaki artıştan kaynaklanabileceğini düşündük. Bununla birlikte, inhibitör hücrelerinin coincubation'ın başlangıcından itibaren büyümek için yer olduğu dispers tedavilerinde de aynı inhibitör büyümesi artışı gözlenmedi. Alternatif olarak, bu sonuç, hedef hücrelerden salınan besinlerin inhibitör popülasyonunda daha fazla artışa izin verdiğini düşündürebilir. Birlikte ele alındığında, bu sonuçlar inhibitör suşunun hedefi T6SS'ye bağımlı bir şekilde ortadan kaldırdığını, yalnızca slayttaki hücrelerin kalabalıklaşarak yüksek hücreli temasın zorlandığında olduğunu göstermektedir.
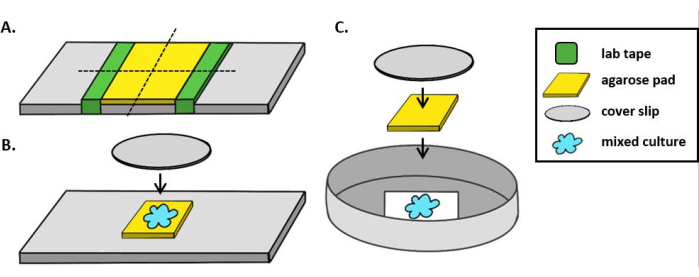
Şekil 1: Agarose ped hazırlama ve coincubation tahlilleri için slayt kurulumu. (A) % 2 agarose pedleri yapmak için kurulum. Beş kat laboratuvar bandı (yeşil), yaklaşık 20 mm arayla iki noktada bir kapak kaymasının etrafına sarılır. Daha sonra, mPBS'deki (sarı) ılık% 2 agarose bant parçaları arasında pipetlendirilir ve hemen 25 mm2 kapak kayması ile kaplanır ve oda sıcaklığında en az 1 saat katılaşmaya izin verilir. Agarose pedi ~5 mm2 parçaya kesmek için bir jilet kullanın ve pedi görüntüleme için yeni bir slayda aktarmak için cımbız kullanın. (B) Dik bir mikroskop üzerinde görüntüleme yaparken, 5 mm2 agarose pedi doğrudan kaydırağa yerleştirin, karışık kültürü (mavi) ve 12 mm dairesel #1.5 kapak fişini takip edin. (C) Ters bir mikroskop üzerinde görüntüleme yaparken, karışık kültürü doğrudan 35 mm Petri kabının 1,5 numaralı cam kapak kaymasının altına yerleştirin ve agarose pedi düzleştirmek için kültürün üzerine bir agarose ped ve ardından ikinci bir 12 mm dairesel kapak kayması yerleştirin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
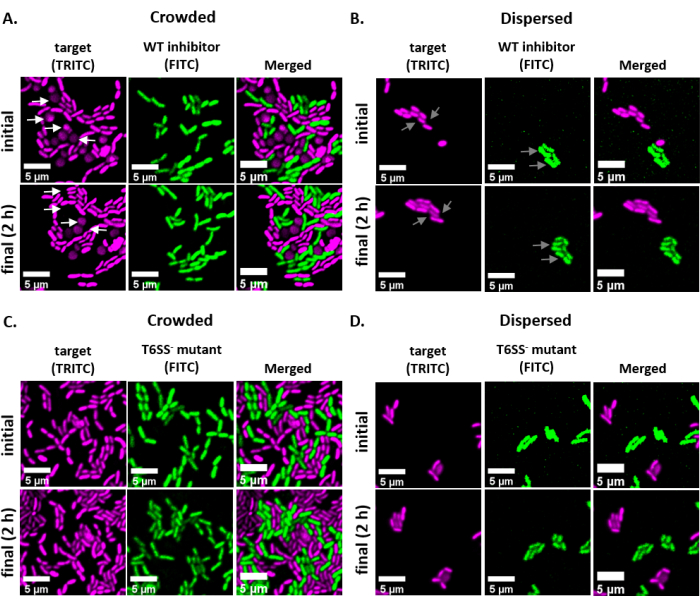
Şekil 2: Kalabalık veya dağınık koşullardaki coincubation noktalarının zaman atlamalı görüntüleri. (A) Suşlar arasında hücre hücresi temasını zorlamak için slaytta tespit edilmeden 3 kat önce karışık bir hedef ve vahşi tip inhibitörü kültürünün yoğunlaştığı başlangıç ve son zaman noktalarında temsili görüntüler. TRITC kanalındaki beyaz oklar, deneme boyunca yuvarlayan veya ıslayan hedef hücre örneklerini gösterir. (B) Hücrelerin dağılması ve suşlar arasında minimum hücre-hücre teması olması için konsantre olmadan karışık bir hedef ve vahşi tip inhibitör kültürünün tespit edildiği temsili görüntüler. FITC ve TRITC kanallarındaki gri oklar, deneme boyunca hücre bölünmesi örneklerini gösterir. (C) Hedef ve T6SS- mutantın karışık kültürünün, suşlar arasında hücre hücresi temasını zorlamak için slaytta tespit edilmeden önce 3 kat yoğunlaştığı temsili görüntüler. (D) Hedef ve T6SSkarışık kültür nerede temsili görüntüler - mutant hücreler dağılır ve suşlar arasında minimum hücre-hücre teması olması için konsantre olmadan tespit edildi. Ölçek çubukları = 5 μm ve tüm görüntülerde tutarlıdır; TRITC kanalı yanlış renkli macenta, FITC kanalı yanlış renkli yeşildir. Tüm görüntülerde dekonvolüzyon yapıldı; arka plan çıkarılır ve parlaklık/kontrast tüm görüntülerde eşit olarak ayarlanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
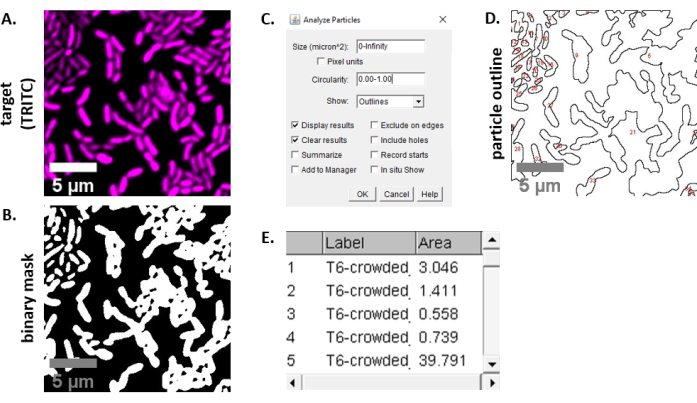
Şekil 3: FIJI analiz iş akışı. (A) Analiz için temsili görüntü. Bu iş akışı, tüm görünüm alanlarındaki ve örneklerdeki her iki kanal için de yinelenir. Ölçek çubukları = 5 μm ve tüm görüntülerde tutarlıdır; TRITC kanalı yanlış renkli macenta, FITC kanalı yanlış renkli yeşildir. (B) FIJI'deki varsayılan ayarlar kullanılarak görüntü eşik oluşturularak oluşturulan ikili maske. (C) Bu yazıda kullanılan parçacık analizi ayarları örneği. Boyut aralığı = 0 - sonsuzluk μm2; döngüsellik = 0.00 - 1.00; show = anahatlar. (D) Parçacık analizinin çıktısı olarak oluşturulan parçacık anahattı (C)içinde. Tüm hücrelerin parçacık analizinde yakalandığından emin olmak için (D) içinde parçacık anahattı orijinal görüntü (A) ile karşılaştırılmalıdır. (E) Sonuç tablosu (C) içinde parçacık analizinden bir çıktı olarak oluşturulmuştur. Nesne numarası (sütun 1), panelde(D)kırmızı ile özetlenen ve etiketlenen tek tek parçacıklara (bir veya daha fazla hücre) karşılık gelir. Etiket = çözümlenen görüntünün dosya adı; Alan = μm2'detoplam partikül alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
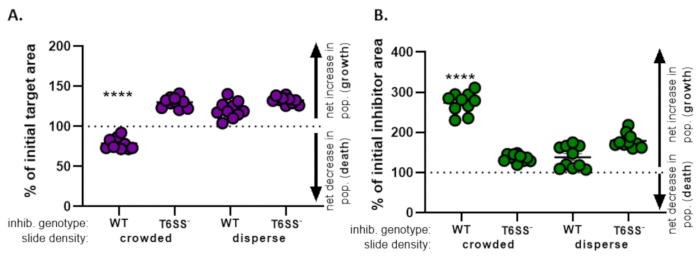
Şekil 4: Hedef suşun inhibe edilip edilmediğini değerlendirmek için örnek veriler. Hedef gerinim (A) ve inhibitör suşu (B) için son zaman noktalarındaki başlangıç alanının yüzdesi, farklı başlangıç hücre yoğunluklarında. Slayt yoğunluğu, Şekil 2'deaçıklandığı gibi kalabalık bir başlangıç hücresi yoğunluğunu (suşlar arasındaki yüksek hücre teması) veya daha fazla dağılımı (suşlar arasındaki düşük hücre teması) gösterir. Inhibitör genotip, bir vahşi tip veya T6SS mutant (T6SS-) suşunun hedef suşu ile çakıştığı sonucuna varıldığını gösterir. Yıldız işaretleri, tüm tedavileri karşılaştıran % değişimde önemli bir fark olduğunu gösterir (tek yönlü ANOVA ve ardından tüm tedavileri karşılaştıran bir Tukey'in çoklu karşılaştırma testi; (s < 0.0001). Kesikli çizgi, ilk ve son zaman noktası arasındaki gerinim alanında net bir değişiklik olmadığını gösterir; 100 > % değişim net artışa (yani büyümeye) ve 100 < % değişim net düşüşe (yani hücre ölümüne) işaret eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Yukarıda açıklanan protokol, tek hücre düzeyinde interbakteriyel rekabeti ölçmek ve karakterize etmek için güçlü bir araç sağlar. Agar plakaları1,2, V. fischeri izolatları arasında tek hücreli rekabetin görselleştirilmesine izin veren CFU tabanlı rekabet testimizin değiştirilmesiyle geliştirilen bu tahlil, yöntemin çok çeşitli sistemler ve mikroskopi kurulumları için optimize edilmesi için önerilerde bulunulmaktadır. Burada açıklanan yöntem için optimize edilmiş olmasına rağmen ışık-organ symbiont V. fischeri, birçok çeşitli, kültlenebilir mikropları barındıracak şekilde kolayca değiştirilebilir. Rekabet mekanizmalarının sıcaklık, tuzluluk ve viskozite30 ,31 , 32 , 33 , 34dahil olmak üzere herhangi bir sayıda çevresel değişken tarafından düzenlenebileceğini belirtmekönemlidir. Önceki çalışma, V. fischeri'nin yüzeylerde aktif olan temas bağımlı bir Tip VI Salgı Sistemi kullanarak rekabet ettiğini doğruladı30Bu testte açıklanan koşulları örnek suşlar arasındaki rekabeti incelemek için uygun hale getirdi. Bakteriyel rekabeti ölçelirken slayttaki hücrelerin ilk yoğunluğunu göz önünde bulundurmak da önemlidir. Öldürmenin gerçekleşmesi için genellikle hedef ve inhibitör hücreler arasındaki temasın gerekli olduğu göz önüne alındığında, karma kültür hücre-hücre temasının en üst düzeye çıkarılacağı ve hücrelerin slaytta tek bir düzlemde kalacağı şekilde yoğunlaştırılmalıdır. Hücre kültürleri benzer bir optik yoğunluğa (orta kütük fazı) yetiştirilmeli ve daha sonra farklı büyüme evrelerindeki hücrelerin fizyolojik değişimleri nedeniyle kültürleri daha yüksek bir optik yoğunluğa büyütmek yerine teması zorlamak için yoğunlaştırılmalıdır. Diğer sistemlerde, rekabet mekanizmasının etkin olduğundan ve coincubation koşulunda tespit edilebildiğine emin olmak için kültür koşullarının ve deneysel kurulumun değiştirilmesi gerekebilir.
Bu testte kullanılan agarose pedleri birkaç fayda sağlar: hücrelerin serbestçe hareket etmemesi için stabilizasyon sağlarlar ve kültürün deney boyunca kurumasını önlerler. Ek olarak, deney için izopropil-β-D-tiyogalactoside (IPTG) gibi kimyasal indükleyiciler gerekiyorsa, agarose çözeltisine kolayca eklenebilirler. Bununla birlikte, agarose preparatın muhtemelen farklı sistemler için ayarlanması gerekeceğini belirtmek önemlidir. Yukarıda açıklanan örnekte, agarose ped% 2 agarose (w / v) V. fischeri büyüme ortamında kullanılan standart tuzluluk olan 20 psu mPBS'ye çözülerek hazırlanmıştır. Ayrıca, bazı durumlarda hücrelerin daha uzun deneyler üzerinde büyümesi ve rekabet edebilmesi için agarose pedine bir karbon kaynağı eklenmesi gerekebilir. Böyle bir durumda, agarose pedlerindeki mPBS herhangi bir büyüme ortamı ile değiştirilebilir, ancak büyüme ortamındaki besinler ek arka plan floresanının dengelenmesiyle birlikte gelebilir.
Tescilli görüntü analiz yazılımı olmadan, hücre-hücre teması yüksek olduğunda bireysel hücre sayısı elde etmek çok zor olabilir, burada gösterdiğimiz gibi temasa bağımlı öldürmeyi gözlemlemek gerekir. Bu test, bireysel hücre sayılarına dayanmayan niceleme için alternatif bir yöntem sağlamak üzere tasarlanmıştır. Bunun yerine, her floresan kanalının toplam hücre alanı, çakışan suşlar arasındaki öldürmenin boyutunu ölçmek için kullanılır. Bu yöntem tek tek hücre sayıları yerine alana dayandığından, varsayılan eşik ayarları genellikle toplam hücre alanını özetleme için yeterlidir. Eşiklemenin doğruluğu, temsili bir görüş alanının toplam nesne alanını model organizmanın ortalama hücre boyutuna bölerek ve bu tahmini hücre numarasını aynı görüntü için el ile hücre sayısıyla karşılaştırarak doğrulanabilir.
Bir inhibitör ile bir hedef (katil olmayan) suşu arasındaki denkliklerde, inhibitörün net büyümesi öngörülür. Şekil 4'tegörüldüğü gibi, öldürmenin gözlendiği tedavilere kıyasla, belki de hedef hücrelerin yutarak salınan besinlerin inhibitör suşunun daha hızlı büyümesine izin vermesi nedeniyle inhibitör büyümesi önemli ölçüde daha yüksek olabilir. Burada gösterilen örnekte, T6SS aracılı rekabet hedefin fiziksel olarak ortadan kaldırıldığı hedef hücre lizi ile sonuçlandığı için net hedef ölüm gözlenmektedir. Bununla birlikte, tüm rekabet mekanizmalarının hedef hücrelerin fiziksel olarak ortadan kaldırılmasıyla sonuçlenmediğini belirtmek önemlidir. Bir hedef büyüme inhibisyonuna neden olan bir toksin tarafından etkisiz hale gelirse, burada özetlenen protokol, hedef hücreler artık büyümediği için görünür hedef popülasyonun zaman içinde sabit kalmasına neden olabilir. Böyle bir durumda, bu testin sonuçlarını koloni oluşturan üniteler (CFO'lar) için kaplama gibi hedef hücre canlılığı için takip testleri ile veya propidium iyodür veya SYTOXyeşili 35,36ile boyayarak canlı ölü tahlilleri gerçekleştirerek karşılaştırmak uygun olacaktır.
CFU sayılarına dayanan coincubation tahlilleri ile karşılaştırıldığında, bu test, suşlar arasındaki rekabetin mekansal yapısını gözlemlemeyi ve ölçmeyi ve zaman içinde hedef hücre morfolojislerindeki değişiklikleri izlemeyi mümkün kılar. Örneğin, bir T6SS kullanarak öldüren inhibitör hücrelerin, hedef hücre duvarını bozan LysM etki alanı proteinlerini kodladığı bilinmektedir, bu da ilk hücre yuvarlama ve daha sonralysis 13 Şekil 2A'da gösterilen örnekte gözlemledik. Ayrıca, bu protokol çok kısa zaman ölçeklerinde rekabeti yüksek çözünürlükte izlemek için kullanılabilir. Burada gösterilen örnekte, hücrelerin kalabalık olduğu ve hücre-hücre temasının suşlar arasında zorlandığı sadece iki saat sonra hedef alanda önemli bir azalma gözlenir (Şekil 4). Burada açıklanan görüntü analizi, çakışan suşların mekansal dağılımını bozmadan, bakteriyel rekabetin vivo veya karmaşık biyofilmlerde incelenmesini mümkün kılacak konfokal mikroskopi kullanılarak da yapılabilir.
Özetle, burada açıklanan test, floresan mikroskopisi kullanılarak bakteriyel rekabeti tek hücre düzeyinde görselleştirmek ve ölçmek için erişilebilir ve kolayca değiştirilmiş bir yaklaşım sağlamayı amaçlamaktadır. Bu yöntem çeşitli bakteriyel izolatlara uygulanabilir ve konak veya biyofilm matrisi gibi karmaşık ortamlarda bile bakteri rekabetini görselleştirmek için kullanılabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
A.N.S, NIGMS hibe R35 GM137886 tarafından, S.N.S ise Ulusal Savunma Bilimi ve Mühendisliği Lisansüstü Burs Programı tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Fisher | 05-408-129 | |
| 10 uL single channel pipette | |||
| 1000 uL single channel pipette | |||
| 20 uL single channel pipette | |||
| 200 uL single channel pipette | |||
| Agarose | Fisher | BP165-25 | Low melting agarose |
| Calculator | |||
| Cellvis 35 mm Dish | Fisher | NC0409658 | #1.5 cover glass bottom |
| Chloramphenicol | Sigma | C0378 | stock (20 mg/mL in Ethanol); final concentration in media (2 μg /mL LBS) |
| DAPI Nucleic Acid Stain | Fisher | EN62248 | optional (if not using stable plasmids) |
| FIJI image analysis sofware | ImageJ | https://imagej.net/Fiji/Downloads | open-source software |
| Fisherbrand Cover Glasses: Circles | Fisher | 12-545-81P | #1.5 cover glass; 12 mm diameter |
| Kanamycin Sulfate | Fisher | BP906-5 | stock (100 mg/mL in water, filter sterilize); final concentration in media (1 μg/mL LBS) |
| Lens Cleaning Tissue Paper | Fisher | S24530 | |
| Parafilm | Fisher | 13-374-12 | |
| Petri Plates | Fisher | FB0875713 | sterile with lid |
| Razor Blades | Fisher | S65921 | |
| Semi-micro Cuvettes | VWR | 97000-586 | |
| Spectrophotometer | |||
| SYBR Green Nucleic Acid Stain | Fisher | S7563 | optional (if not using stable plasmids) |
| Thermo Scientific Gold Seal Plain Microscope Slides | Fisher | 12-518-100B | |
| Thermo Scientific Richard-Allan Scientific Cover Glass | Fisher | 22-050-235 | #1.5 cover glass, 25 mm2 |
| Type F Immersion Oil | Fisher | NC0297589 | |
| Upright or inverted fluorescence microscope with camera and imaging software | Images in this article were acquired on a Nikon TI-2 inverted fluorescent microscope outfitted with an ORCA-Fusion Digital CMOS camera using NIS-Elements software. | ||
| Vortex | |||
| Water bath | Used to keep agarose warm prior to pipetting | ||
| LBS media | |||
| 1M Tris Buffer (pH ~7.5) | 50 mL 1 M stock buffer (62 mL HCl, 938 mL DI water, 121 g Trizma Base) | ||
| Agar Technical | Fisher | DF0812-17-9 | 15 g (Add only for plates) |
| DI water | 950 mL | ||
| Sodium Chloride | Fisher | S640-3 | 20 g |
| Tryptone | Fisher | BP97265 | 10 g |
| Yeast Extract | Fisher | BP9727-2 | 5 g |
| mPBS (marine PBS) | Phosphate buffered saline with marine salts added; used for making agarose pad | ||
| 10X PBS | Fisher | ICN1960454 | |
| Instant Ocean Sea Salt | Instant Ocean | SS1-160P | Adjust concentration to appropriate salinity; 20 psu used here |
| Sterile Vacuum Filter Units | Fisher | SCGVU01RE | Used to filter-sterilize mPBS |
| Vacuum pump | Used to filter-sterilize mPBS |
Referanslar
- Speare, L., et al. Bacterial symbionts use a type VI secretion system to eliminate competitors in their natural host. Proceedings of the National Academy of Sciences. 115 (36), 8528-8537 (2018).
- Speare, L., Septer, A. N. Coincubation assay for quantifying competitive interactions between Vibrio fischeri isolates. Journal of Visualized Experiments. (149), e59759(2019).
- Frost, I., et al. Cooperation, competition and antibiotic resistance in bacterial colonies. The ISME journal. 12 (6), 1582-1593 (2018).
- Stubbendieck, R. M., Vargas-Bautista, C., Straight, P. D. Bacterial communities: interactions to scale. Frontiers in Microbiology. 7, 1234(2016).
- Souza, D. P., et al. Bacterial killing via a type IV secretion system. Nature Communications. 6 (1), 1-9 (2015).
- Anderson, M. C., Vonaesch, P., Saffarian, A., Marteyn, B. S., Sansonetti, P. J. Shigella sonnei encodes a functional T6SS used for interbacterial competition and niche occupancy. Cell Host and Microbe. 21 (6), 769-776 (2017).
- Basler, M., Ho, B., Mekalanos, J. Tit-for-tat: Type VI secretion system counterattack during bacterial cell-cell interactions. Cell. 152 (4), 884-894 (2013).
- Guillemette, R., Ushijima, B., Jalan, M., Häse, C. C., Azam, F. Insight into the resilience and susceptibility of marine bacteria to T6SS attack by Vibrio cholerae and Vibrio coralliilyticus. PloS One. 15 (1), 0227864(2020).
- Hachani, A., Lossi, N. S., Filloux, A. A visual assay to monitor T6SS-mediated bacterial competition. Journal of Visualized Experiments. (73), e50103(2013).
- Hibbing, M. E., Fuqua, C., Parsek, M. R., Peterson, S. B. Bacterial competition: surviving and thriving in the microbial jungle. Nature Reviews Microbiology. 8 (1), 15-25 (2010).
- Ruhe, Z. C., Low, D. A., Hayes, C. S. Bacterial contact-dependent growth inhibition. Trends in Microbiology. 21 (5), 230-237 (2013).
- Wood, D. W., Pierson, L. S. The phzI gene of Pseudomonas aureofaciens 30-84 is responsible for the production of a diffusible signal required for phenazine antibiotic production. Gene. 168 (1), 49-53 (1996).
- Smith, W. P., et al. The evolution of the type VI secretion system as a disintegration weapon. PLoS Biology. 18 (5), 3000720(2020).
- Chen, L., Zou, Y., She, P., Wu, Y. Composition, function, and regulation of T6SS in Pseudomonas aeruginosa. Microbiological Research. 172, 19-25 (2015).
- Sana, T. G., Lugo, K. A., Monack, D. M. T6SS: The bacterial "fight club" in the host gut. PLoS Pathogens. 13 (6), 1006325(2017).
- Basler, M. Type VI secretion system: secretion by a contractile nanomachine. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1679), 20150021(2015).
- Joshi, A., et al. Rules of engagement: the type VI secretion system in Vibrio cholerae. Trends in Microbiology. 25 (4), 267-279 (2017).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nature Reviews Microbiology. 14 (9), 589-600 (2016).
- Stubbendieck, R. M., Straight, P. D. Multifaceted interfaces of bacterial competition. Journal of Bacteriology. 198 (16), 2145-2155 (2016).
- Septer, A. N. The Vibrio-squid symbiosis as a model for studying interbacterial competition. Msystems. 4 (3), (2019).
- Tischler, A. H., Hodge-Hanson, K. M., Visick, K. L. Vibrio fischeri-squid symbiosis. eLS. , 1-9 (2019).
- Mandel, M. J., Dunn, A. K. Impact and influence of the natural Vibrio-squid symbiosis in understanding bacterial-animal interactions. Frontiers in Microbiology. 7, 1982(2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Boettcher, K., Ruby, E. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna Scolopes. Journal of Bacteriology. 172 (7), 3701-3706 (1990).
- Doino, J. A., McFall-Ngai, M. J. A transient exposure to symbiosis-competent bacteria induces light organ morphogenesis in the host squid. The Biological Bulletin. 189 (3), 347-355 (1995).
- Dunn, A. K., Millikan, D. S., Adin, D. M., Bose, J. L., Stabb, E. V. New rfp-and pES213-derived tools for analyzing symbiotic Vibrio fischeri reveal patterns of infection and lux expression in situ. Applied and Environmental Microbiology. 72 (1), 802-810 (2006).
- Lambertsen, L., Sternberg, C., Molin, S. Mini-Tn7 transposons for site-specific tagging of bacteria with fluorescent proteins. Environmental Microbiology. 6 (7), 726-732 (2004).
- Koch, B., Jensen, L. E., Nybroe, O. A panel of Tn7-based vectors for insertion of the gfp marker gene or for delivery of cloned DNA into Gram-negative bacteria at a neutral chromosomal site. Journal of Microbiological Methods. 45 (3), 187-195 (2001).
- Peterson, B. W., Sharma, P. K., Van Der Mei, H. C., Busscher, H. J. Bacterial cell surface damage due to centrifugal compaction. Applied and Environmental Microbiology. 78 (1), 120-125 (2012).
- Speare, L., Smith, S., Salvato, F., Kleiner, M., Septer, A. N. Environmental viscosity modulates interbacterial killing during habitat transition. MBio. 11 (1), (2020).
- Salomon, D., Gonzalez, H., Updegraff, B. L., Orth, K. Vibrio parahaemolyticus type VI secretion system 1 is activated in marine conditions to target bacteria, and is differentially regulated from system 2. PloS One. 8 (4), 61086(2013).
- Sana, T. G., et al. Salmonella Typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut. Proceedings of the National Academy of Sciences. 113 (34), 5044-5051 (2016).
- Bachmann, V., et al. Bile salts modulate the mucin-activated type VI secretion system of pandemic Vibrio cholerae. PLoS Neglected Tropical Diseases. 9 (8), 0004031(2015).
- Ishikawa, T., et al. Pathoadaptive conditional regulation of the type VI secretion system in Vibrio cholerae O1 strains. Infection and Immunity. 80 (2), 575-584 (2012).
- Johnson, M. B., Criss, A. K. Fluorescence microscopy methods for determining the viability of bacteria in association with mammalian cells. Journal of Visualized Experiments. (79), e50729(2013).
- Stiefel, P., Schmidt-Emrich, S., Maniura-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. 15 (1), 36(2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır