Method Article
使用单细胞荧光成像对菌际竞争进行量化
摘要
本文稿描述了一种利用单细胞荧光显微镜可视化和量化共同栽培中细菌竞争的方法。
摘要
菌际竞争可以直接影响微生物群系的结构和功能。本文描述了一种荧光显微镜方法,可用于可视化和量化单细胞水平上不同细菌菌株之间的竞争相互作用。此处描述的协议为直立和倒置表膜显微镜、活细胞和延时成像技术以及使用开源软件 FIJI 进行定量图像分析的幻灯片制备方法提供了方法。本手稿中的方法概述了共生 Vibrio fischeri 种群之间竞争相互作用的量化,方法是测量两个硬币孵化菌株的面积变化,这些菌株表示与稳定质粒不同的荧光蛋白。在需要不同生长条件的细菌模型系统中,介绍了优化此协议的替代方法。虽然此处描述的检测使用为 V. fischeri优化的条件,但这种方法具有高度可重复性,可以很容易地适应研究可培养的微生物群落与不同微生物群落之间的竞争。
引言
本文概述了使用荧光显微镜对单细胞水平细菌竞争进行量化的方法。微生物群落的结构和功能通常由微生物之间的竞争相互作用形成,在许多情况下,这些相互作用的特征需要观察硬币孵化1、2、3、4、5、6、7、8中的不同细菌菌株.传统上,细菌竞争是通过计算抑制剂和目标菌株的菌落形成单位(CFUs)在硬币孵化期2,9前后在人口水平上量化的。微生物竞争机制广泛分布于细菌之间,可依靠扩散或细胞接触来抑制目标细胞10、11、12、13、14、15、16、17、18、19。
虽然细菌菌株经常在人口层面的硬币孵化中观察到,但这份手稿概述了对细菌竞争的单细胞量化的测定。此外,这项工作包括调整协议与其他细菌物种使用的建议。虽然本文中的具体技术用于研究共生细菌Vibrio fischeri20、21、22菌株之间的接触依赖性特异性竞争,但它们可以适应许多生物体之间的竞争。本文提供了直立和倒置显微镜上的幻灯片设置说明,并且使用开源软件 FIJI23描述所有分析,以便研究人员能够使用该方法,从而访问不同的成像设置和分析程序。鉴于研究人口和单细胞两种微生物竞争的重要性,这种方法将成为研究人员量化竞争互动的宝贵资源,尤其是那些无法访问专有分析软件的相互作用。
研究方案
1. 细菌菌株的优化
- 选择两种细菌菌株进行单细胞细菌竞争检测。在这里,使用了两种V.fischeri菌株:目标菌株(ES11424)和抑制剂菌株(MJ1125),已知使用染色体II(T6SS2)1上的VI型分泌系统杀死目标菌株,这是一种依赖接触的杀伤机制。
- 确定实验的适当控件。在此示例中,适当的控制是与目标菌株同时孵育野生型和 T6SS 突变抑制剂菌株,以量化 T6SS 介质杀灭的效果。
注:其他控制可以包括一个目标菌株,表达必要的免疫基因,以防止T6SS依赖性杀死或抑制剂突变菌株表达野生类型的变异基因副本在跨恢复T6SS活动1。 - 在可能的情况下,将具有稳定质粒编码基因的菌株转换为不同荧光蛋白(例如 GFP 或 RFP),以便在显微镜上直观地区分菌株类型。在这里,抑制剂菌株被标记为GFP编码质粒(pVSV102),目标菌株标记为dsRed编码质粒(pVSV208)26。
注意:如果不能使用稳定的质粒,荧光标签可以引入细菌染色体上,用于可视化27,28。 - 在初始优化期间,在实验期间将用于的每个荧光滤镜下标记菌株的图像克隆培养,以确保细胞仅在预期通道中可见。例如,确保 GFP 标记菌株仅在 FITC 通道中可见。
2. 阿加罗斯垫准备
- 通过将 2% 低熔化的阿加罗斯 (w/v) 溶解到 mPBS 中,准备阿加罗斯垫解决方案。在微波炉和漩涡中短暂加热溶液,直到玫瑰完全溶解。将溶液放在 55°C 的水浴中保暖,直到准备好使用。有关准备阿加罗斯垫的更多信息,请参阅 讨论 部分。
注:在这里,mPBS 是通过在标准 1x PBS 中添加 20 克/升 NaCl 来准备的。 - 将一块实验室胶带包裹在玻璃滑梯上五次。在同一幻灯片上第二次重复此过程,使两块胶带之间的距离略小于覆盖唇的宽度(图1A)。例如,如果使用 25 mm2 盖片,则磁带片应间隔约 20 mm。
注:虽然可以修改胶带缠绕在滑梯上的次数以调整玫瑰垫的厚度,但重要的是胶带层在滑梯两侧的高度相同,以便胶带垫保持平整。 - 派佩特在两片胶带之间加热玫瑰溶液,并立即用盖片顶部,使其落在胶带片上。这将确保玫瑰垫的表面保持平坦。此步骤中管道的气溶液体积应足以使盖唇与液体接触,并推出气糖溶液中的任何气泡。对于这个特殊的设置,200微升的暖气是足够的。
- 在硬币孵化分析之前,让玫瑰垫在室温下凝固至少 1 小时。第2.2步将产生一个约20毫米2的玫瑰垫。
- 将此玫瑰垫用剃须刀刀片切割成四个 5 mm2 垫,用于成像。
注:Agarose 垫可在实验前一周制成,并储存在 4°C 的空无菌 Petri 板中,用准胶片密封,以防止干燥。
3. 为共同孵化准备菌株
- 将每个菌株从 -80 °C 库存中分离出来,在 24°C 下隔夜孵育到 LBS Agar 板上,并辅以适当的抗生素。 例如,使用三种菌株:野生型抑制剂菌株、VI型分泌系统突变菌株和目标菌株。
- 第二天,从每个菌株中挑选两个菌落,在LBS介质中重新使用适当的抗生素,并在24°C时在24°C下孵育过夜,在200转/分时摇晃,从而开始生物复制的通宵培养。
- 第二天早上,每个生物的亚文化复制1:1000到新鲜的LBS介质没有抗生素和孵育在24°C与颤抖4-5小时或直到细胞达到OD600 的+1.5。
注:步骤 3.1、3.2 和 3.3 的时机可能需要针对不同的细菌物种进行优化,因为它们的生长速度可能差异很大。对于此测定,细胞在硬币孵化分析开始时处于中记录阶段。
4. 硬币菌株
- 从第 3.3 步的中日志培养物开始,测量并记录所有样品的光学密度为 600 nm (OD600)。
- 通过稀释 LBS 介质的培养物,将每个样品标准化为 OD600 = 1.0,对应于V. fischeri的大约10 9 CFU/mL。
- 将两个相互竞争的菌株以 1:1 的比例混合在一起,根据体积将每个规范化菌株的 30 μL 添加到标记为 1.5 mL 的管中。漩涡的混合应变培养为 1- 2 s 。
注意:在某些情况下,将共同文化混合到不同比例可能是合适的。例如,当一个菌株的生长速度比另一个菌株快得多时,可能需要以数字优势启动生长较慢的菌株,以便观察竞争。如果 OD600 与两种菌株的类似 CFU/mL 不对应,则可能需要优化。 - 对于每个生物复制和治疗,重复步骤 4.3。在此示例中,这将总共产生四个混合应变管:两个生物复制与野生型抑制剂菌株与目标菌株混合,两个生物复制与六型分泌系统突变菌株与目标菌株混合。
- 为了确保相互竞争的细胞足够密集,在阿加垫上的硬币孵化中产生接触依赖性杀灭,通过在标准的 1.5 mL 离心机管中离心将混合培养物离心 1 分钟,以 21,130 x g的速度将每个混合培养物集中到 3 倍,丢弃超高分子,并在 20 μL LBS 介质中重新吸收每个颗粒。每个示例重复。
注:一些细菌细胞对高rcf离心损伤敏感:在这种情况下,混合培养可以离心3分钟在4600×g 29。此外,在量化依赖接触的竞争时,确保幻灯片上的细胞密度足以观察杀戮非常重要。在本文中,"拥挤"的治疗,其中观察到杀戮,有大约10个细胞/20μm2:有关更多信息,请参阅讨论部分。
5. 幻灯片设置
- 使用直立显微镜时,将 +5 mm2 玫瑰垫放在标准 1 mm 玻璃滑梯上。将混合培养的 2 μL 点放在 agarose 垫上,并放置一个 #1.5 盖片(25 mm2)。请参阅 图 1B 以示示。
- 使用倒置显微镜时,将混合培养的 2 μL 点到 35 mm Petri 盘的 #1.5 盖片底部,并在硬币孵化点上放置 +5 mm2 玫瑰垫。在玫瑰垫上放置一个 12 mm 的圆形玻璃盖片。请参阅 图 1C 以示示。
- 重复步骤 5.1 或 5.2,具体取决于使用的显微镜设置,用于其余三种混合培养物,从而对四个幻灯片或菜肴进行成像。
- 允许幻灯片在台面上坐约 5 分钟,然后继续第 6 步。这允许细胞在阿加垫上安顿下来,并在成像过程中消除运动。
6. 荧光显微镜
- 首先,使用白光(相位对比度或DIC)聚焦细胞,以尽量减少光漂白的影响。根据单个细菌细胞的平均大小,使用 60 倍或 100 倍的油目标。
- 调整每个通道的曝光时间和采集设置,以便在适当的通道中以最小的背景检测来可见细胞。
注:对于不同的通道使用不同的暴露时间是合适的,但相同的暴露时间应用于所有生物复制和给定通道的治疗。 - 对于每个示例,选择至少五个视图字段 (FOV),并使用第 6.2 步的采集设置在每个适当的通道中获取图像(见 图 2中的示例)。从每个 FOV 中保存 XY 点,以便在最后的时间点中对相同的 FOV 进行成像。在分析步骤中确定目标或抑制剂细胞所占用的区域比例,需要在每个时间点成像相同的 FOV。
注:在此示例中,使用激发波长为 467 - 498 nm 的过滤器和 513 - 556 nm 的排放过滤器检测 GFP 的荧光,并且为假彩色绿色。dsRed 的荧光使用激发波长为 542 - 582 nm 的过滤器和 603 - 678 nm 的排放过滤器检测,并且为假色品红色。 - 2 小时后,使用以前保存的 XY 点(图 2)重复每个示例的步骤6.3。
注:对于具有不同增长率或竞争机制的生物体,可能需要优化后续图像的拍摄时间。
7. 斐济的图像分析
- 使用此处找到的说明下载并安装 FIJI 图像处理软件:https://imagej.net/Fiji/Downloads
- 打开 FIJI 并导入图像文件进行分析。
注意:在大多数情况下。TIFF 文件将用于图像分析,尽管某些图像采集软件将使用专有文件类型进行导出。FIJI 可以识别大多数专有文件类型,图像可以导入并分析如下。 - 对于在步骤 6.3 和 6.4 中获取的每个图像,将图像转换为灰度,分离通道,并首先通过阈值(Ctrl + Shift + T)创建预处理图像的二进制掩码(图 3A,B)。
注意:这里使用 FIJI 中的默认阈值设置。在某些情况下,可能需要更改这些设置,在这种情况下,该实验中的所有图像都应使用相同的设置。 - 设置图像上的刻度(分析|设置刻度) 使用显微镜设置23的适当值。
- 设置测量(分析|设置测量)和选择 区域。
注:如果其他测量结果适合实验,则可以添加其他测量结果。此处显示的示例分析仅需要对象 区域 测量。 - 分析粒子(分析|使用默认设置(图3C)分析粒子。如果样品中有碎屑,可能需要调整大小或圆形以过滤掉非细胞颗粒。选择显示|大纲,使这种分析的输出将包括所有粒子分析的编号轮廓(图3D)。
注:将 图 3D 中的轮廓与初始图像进行比较在优化步骤中尤为重要,以确保 (1) 所有单元格都经过分析,(2) 任何碎屑都排除在分析之外。 - 将第 7.4 步(图 3E)的测量结果导出到电子表格软件中,以便进一步分析和绘制。
- 对于在实验过程中获得的所有通道和图像,重复步骤 7.1 - 7.5。
8. 计算初始目标面积的百分比
- 对于第 7 节中分析的每个视场,确保导出的文件包含分析的每个粒子的单独区域测量。从目标应变的荧光通道开始,计算每个视场的总粒子面积。对于两个生物复制,每个 FOV 有五个 FOV,这应导致每次治疗的 10 个总和区域。
- 使用以下方程计算每个 FOV 初始目标面积的百分比: (
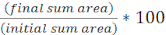 )
) - 重复此计算的所有治疗和图形的初始目标面积的百分比(从步骤8.2方程的结果)为每个治疗(图4A)。
- 确定目标人口(指示增长)、目标人口净减少(指示死亡)或每次治疗是否有变化(指示没有增长或死亡)。
注:值大于 100 的初始目标区域的百分比表示目标净增长,低于 100 的值表示净目标死亡。初始目标值的百分比保持在 100 表示目标人口没有净变化。请参阅讨论建议的后续实验。
9. 计算初始抑制剂面积的百分比
- 重复步骤 8.1 到 8.3,这次使用从抑制剂菌株荧光通道收集的测量结果(图 4B)。
- 确定抑制剂人口(增长)是否净增长;抑制剂数量(死亡)的净减少,或每次治疗无变化。大于 100 表示净抑制剂生长,值低于 100 表示净抑制剂死亡。
结果
为了可视化和量化单细胞水平细菌之间的竞争相互作用,通过修改我们成熟的基于CFU的检测1,2,为V.fischeri开发并优化了协议。这种方法利用GFP和dsRed编码稳定的质粒,以视觉上区分不同的V.菲舍里菌株。通过使用开源软件 FIJI 分析从此检测获得的图像,可以量化这些交互的竞争结果。例如,使用V. 菲舍里隔离剂执行以下实验。抑制剂菌株含有编码 GFP 的质粒,目标菌株中含有编码 dsRed 的质粒。鉴于抑制剂编码的 T6SS2 是一种依赖接触的杀伤机制,因此在细胞拥挤(高细胞接触)或分散(低细胞接触)的幻灯片上进行治疗,以突出实验设置对此检测最终结果的影响。在样本数据中,相互竞争的菌株以1:1的比例混合,在玫瑰垫上孵育2小时,并拍摄了初始和最终(2小时)图像。作为对照,T6SS2 突变菌株在拥挤和分散的条件下也与目标菌株结合。每个菌株的文化都准备和硬币孵化如上图所述,幻灯片准备如图1所示。
图2 显示了每个实验治疗的代表性荧光显微镜图像,在初始和最后时间点图像相同的视场。对于每个治疗,无论是野生类型的抑制剂或T6SS突变菌株窝藏GFP编码质粒混合在1:1的比例与目标应变窝藏一个dsRed编码质粒。在2小时硬币孵化期间,这种实验设置,生长 的V.菲舍里 细胞可能通过1-2个部门(图2:灰色箭头)。在 图2A中,细胞接触通过在滑梯上发现之前将混合培养集中到靶点和抑制剂之间。观察到多个目标细胞在2小时内变圆和/或消失,与抑制剂消除的目标细胞一致(图2:白箭头)。有关解释四舍五入或解剖目标单元的更多信息,请参阅 讨论 部分。在 图2B中,在幻灯片上发现了相同的硬币,这次没有集中混合培养,使细胞保持分散,滑梯上的菌株之间接触最少。在这里,没有观察到目标细胞消失或圆,这表明目标菌株没有抑制这种治疗。 图2C 和 图2D 显示相同的拥挤和分散的治疗上述,这一次使用T6SS突变体作为抑制剂应变。目标细胞在拥挤或分散的条件下与T6SS突变体结合时不会消失或圆形,这再次表明目标在任一治疗中都没有受到抑制。
图 3 显示了用于量化本协议中竞争的 FIJI 分析工作流程。从目标通道中选择了一个具有代表性的图像(图3A),并使用FIJI的默认阈值设置(图3B)创建了一个二进制掩码。为此显微镜设置设置了适当的图像刻度。粒子使用大小参数 = 0 - 无穷大,圆形参数 = 0.00 - 1.00 进行分析,并选择了 显示轮廓(图 3C)。此粒子分析的结果显示为每个粒子的编号轮廓(图 3D),以及以 μm2 (区域) (图3E)中的粒子编号、文件名(标签)和粒子区为列的表。
在 图4中,从 图3E 获得的数据被绘制和分析。在 图4A中,根据第8.2步,每个治疗在最终时间点初始目标面积的百分比显示。如果初始目标面积的百分比大于 100,则表示目标(即增长)的净增长,并且是在目标人口没有显著抑制的情况下观察到的。但是,如果初始目标面积的百分比低于 100,则此结果表示目标(即死亡)的净减少,并在目标人群受到显著抑制的条件下观察到。当目标在拥挤的条件下用野生抑制剂孵化时,数据显示目标区域净减少。相比之下,当目标在分散条件下使用野生抑制剂或在拥挤或分散条件下使用 T6SS 突变剂时,数据显示目标区域净增。根据单向 ANOVA,当目标在拥挤条件下用野生型抑制剂孵化时,初始目标区域的百分比低于 100,并且明显低于所有其他治疗,随后 Tukey 在所有治疗方法中进行了多次比较测试(p < 0.0001)。这些数据表明,靶点细胞死亡依赖于抑制剂中的功能性 T6SS,并强调了允许足够的细胞细胞接触的实验设置的重要性,以便从依赖接触的杀戮机制检测细胞死亡。
图4B 表示每次治疗的最终时间点初始抑制剂面积的百分比。在此示例中,所有治疗都观察到抑制剂菌株的净生长。然而,当野生型抑制剂在拥挤的条件下与目标结合时,初始抑制剂面积的百分比显著高于所有其他治疗,根据单向 ANOVA,然后是 Tukey 在所有治疗中进行的多次比较测试(p < 0.0001)。最初,我们认为抑制剂面积的净增加可能是由于目标细胞被消除后可用空间的增加而增长的。然而,在分散治疗中没有观察到抑制剂生长的同样增长,在分散治疗中,抑制细胞从硬币孵化开始有生长的空间。或者,这一结果可能表明,从解莱辛靶细胞中释放的营养物质允许抑制剂数量的更大增加。综合起来,这些结果表明,只有当高细胞细胞接触被滑梯上的细胞挤合时,抑制剂菌株才能以T6SS依赖的方式消除目标。
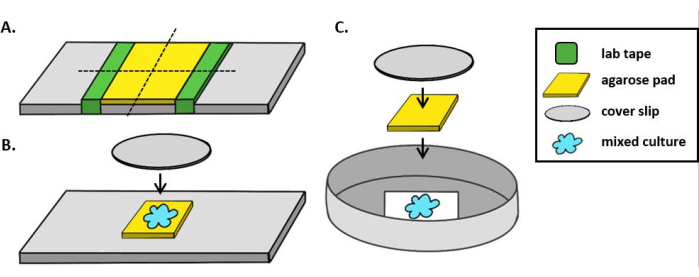
图1:阿加罗斯垫准备和幻灯片设置硬币孵化分析。(A )设置为使2%的玫瑰垫。五层实验室胶带(绿色)包裹在两个点相距约20毫米的盖子滑。接下来,在 mPBS(黄色)中加热 2% 的玫瑰在胶带之间管道,并立即覆盖 25 mm2盖滑,并允许在室温下凝固至少 1 小时。使用剃须刀刀片将玫瑰垫切成 +5 mm2片,并使用钳子将垫子转移到新的幻灯片进行成像。(B) 在直立显微镜上成像时,将 5 mm2的玫瑰垫直接放置在滑梯上,遵循混合培养物(蓝色)和 12 mm 圆形 #1.5 盖滑。(C) 在倒置显微镜上成像时,将混合培养物直接发现在 35 mm Petri 盘的 #1.5 玻璃盖滑底,并在培养物顶部放置一个玫瑰垫,然后放置第二个 12 mm 圆形盖滑,以平整玫瑰垫。请单击此处查看此图的较大版本。
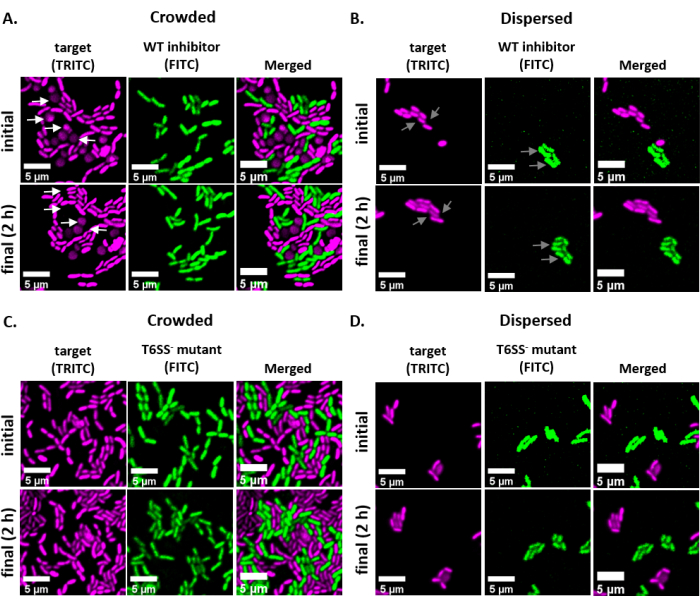
图2:在拥挤或分散的条件下,硬币凝结点的时间推移图像。 (A) 在初始和最后时间点,目标和野生型抑制剂的混合培养物在发现幻灯片之前集中了 3 倍,以迫使菌株之间的细胞细胞接触。TRITC 通道中的白箭头表示在整个实验过程中围绕或解莱的目标细胞的示例。(B) 代表图像,其中靶点和野生型抑制剂的混合培养物被发现,而不集中,使细胞分散,菌株之间的细胞细胞接触最小。FITC 和 TRITC 通道中的灰箭头表示整个实验过程中细胞分裂的例子。(C) 代表图像,其中目标和T6SS- 突变体的混合培养集中在幻灯片上3倍,以迫使细胞细胞之间的菌株接触。(D) 代表图像,其中目标和T6SS- 突变体的混合培养物被发现,而不集中,使细胞分散,菌株之间的细胞细胞接触最小。刻度条 = 5 μm,在所有图像中保持一致;TRITC 通道是假色品红色,FITC 通道是假色绿色。对所有图像进行进化:背景被减去,亮度/对比度在所有图像中均匀调整。 请单击此处查看此图的较大版本。
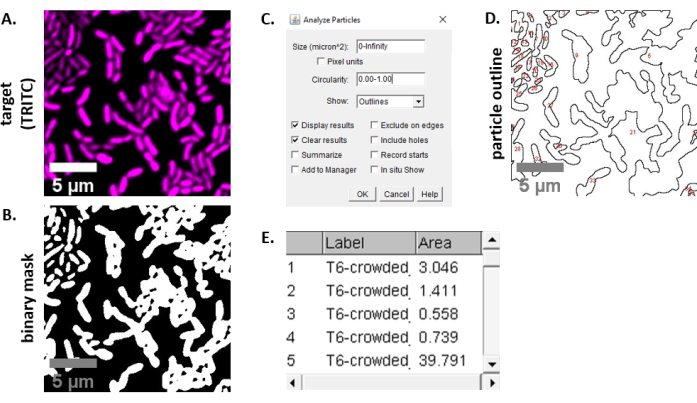
图3: FIJI 分析工作流程 。 (A) 代表形象进行分析。此工作流在所有视图和示例领域中重复用于两个通道。刻度条 = 5 μm,在所有图像中保持一致;TRITC 通道是假色品红色,FITC 通道是假色绿色。(B) 使用 FIJI 中的默认设置对图像设置阈值创建的二进制掩码。(C) 本手稿中使用的粒子分析设置示例。大小范围 = 0 - 无穷大 μm2;循环 = 0.00 - 1.00;显示 = 轮廓。(D) 粒子轮廓作为(C)粒子分析输出而创建。 应将(D)中的粒子轮廓与原始图像 (A) 进行比较,以确保在粒子分析中捕获所有细胞。(E) 结果表是作为(C)粒子分析的输出创建的。对象编号(列1)对应于单个粒子(一个或多个细胞)的轮廓和标记为红色面板(D)。标签 = 被分析图像的文件名称;面积 = μm2的总粒子面积 。 请单击此处查看此图的较大版本。
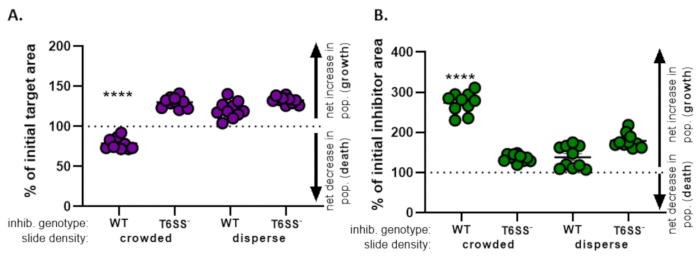
图4:用于评估目标菌株是否被抑制的样本数据。 目标应变(A)和抑制剂应变(B)在初始细胞密度的初始时间点初始区域的百分比。幻灯片密度表示开始细胞密度拥挤(菌株之间的高细胞接触),或更分散(菌株之间的低细胞接触),如 图2所述。抑制剂基因型表示野生类型或T6SS突变(T6SS-) 菌株与目标菌株结合。星号表示,与所有治疗方法相比,在%变化方面存在显著差异(单向 ANOVA,然后是 Tukey 的多项比较测试,比较所有治疗方法;(p<0.0001)。虚线表示初始时间点和最终时间点之间的应变区域没有净变化;100>变化表示净增长(即增长),100<变化百分比表示净增(即细胞死亡)。 请单击此处查看此图的较大版本。
讨论
上述协议为单细胞一级的菌间竞争提供量化和定性的有力工具。这项检测是通过修改我们在1、2号Agar板上的基于CFU的竞争检测而开发的,它允许对V. fischeri隔离体之间的单细胞竞争进行可视化,并提出了优化各种系统和显微镜设置的方法的建议。虽然这里描述的方法被优化为光器官共生V.菲舍里,它可以很容易地修改,以适应许多多样化的,可培养的微生物。需要注意的是,竞争机制可以由任意数量的环境变量来调节,包括温度、盐度和粘度 30、31、32、33、34。先前的工作已经证实,V. fischeri使用在30表面上活跃的接触依赖型VI型分泌系统进行竞争,使得此检测中描述的条件适合研究示例菌株之间的竞争。在量化细菌竞争时,考虑幻灯片上细胞的初始密度也很重要。鉴于目标细胞和抑制剂细胞之间的接触通常需要杀死发生,混合培养应该集中,使细胞细胞接触最大化,细胞保持在幻灯片上的单个平面上。细胞培养物应生长到类似的光学密度(中日志阶段),然后集中到强迫接触,而不是简单地将培养物培养成更高的光学密度,因为细胞在不同生长阶段的生理变化。在其他系统中,可能需要修改培养条件和实验设置,以确保竞争机制是活跃的,并且可以在硬币孵化条件下检测到。
此检测中使用的藻垫提供了几个好处:它们提供稳定,使细胞不能自由移动,并且它们防止培养物在实验过程中干涸。此外,如果实验需要化学诱导剂,如异丙基-β-D-硫高非他明(IPTG),它们可以很容易地添加到阿加罗斯溶液中。然而,必须指出,可能需要根据不同的系统调整藻类准备。在上面描述的示例中,通过将 2% 的阿加罗斯 (w/v) 溶解成 20 psu mPBS 来制备,这是 V. fischeri 生长介质中使用的标准盐度。此外,在某些情况下,可能需要在气垫中添加碳源,以便细胞生长和竞争更长的实验。在这种情况下,玫瑰垫中的 mPBS 可以替换为任何生长介质,尽管生长介质中的营养物质可能伴随着额外背景荧光的权衡。
如果没有专有的图像分析软件,当细胞接触量高时,很难获得单个细胞计数,正如我们在这里显示的那样,这需要观察接触依赖性杀戮。此检测旨在提供一种不依赖于单个细胞计数的量化替代方法。相反,每个荧光通道的总细胞面积用于量化硬币孵化菌株之间的杀灭程度。由于此方法依赖于区域而不是单个单元格计数,默认阈值设置通常足以概述整个单元格区域。阈值的准确性可以通过将具有代表性的视野的总对象面积除以模型生物体的平均细胞大小来验证,并将此估计的细胞数与同一图像的手动细胞计数进行比较。
在一个抑制剂和一个目标(非杀手)菌株之间的硬币孵化中,预测抑制剂的净生长。如图4所见,与未观察到杀伤的治疗相比,观察到杀戮的治疗中抑制剂的生长可能显著提高,也许是因为解莱辛靶细胞释放的营养物质使抑制剂菌株生长得更快。在此示例中,由于 T6SS 调解的竞争导致目标细胞裂解,目标在物理上被消除,因此观察到净目标死亡。然而,必须指出,并非所有竞争机制都会导致目标细胞的物理消除。如果目标被导致生长抑制的毒素丧失能力,此处概述的协议可能导致可见目标群体随着时间的推移保持稳定,因为目标细胞不再生长,但也不会解解。在这种情况下,将此检测结果与目标细胞生存能力的后续测试进行比较是合适的,例如对菌落形成单位(CFUs)进行电镀,或通过染色碘化物或SYTOX绿色35、36进行活死测定。
与依赖 CFU 计数的硬币孵化检测相比,此测定使观察和量化菌株之间的空间结构以及跟踪目标细胞形态的变化成为可能。例如,使用 T6SS 杀死的抑制细胞已知编码 LysM 域蛋白,这些蛋白质会降低目标细胞壁,导致初始细胞四舍五入,然后裂解13,我们在 图 2A中示例中观察到这一点。此外,此协议可用于在很短的时间尺度上以高分辨率跟踪竞争。在此示例中,当细胞拥挤且细胞细胞在菌株之间被迫接触时,目标区域在仅两小时后显著减少(图4)。这里描述的图像分析也可以使用共聚焦显微镜进行,这将有助于研究体内或复杂生物膜 中的 细菌竞争,而不会破坏硬币菌株的空间分布。
综上所述,此处描述的检测旨在提供一种易于访问且易于修改的方法,以便使用荧光显微镜对单细胞水平的细菌竞争进行可视化和量化。这种方法可用于多种细菌分离,即使在复杂的环境中(如主机或生物膜基质内)也可用于可视化细菌竞争。
披露声明
作者没有什么可透露的。
致谢
A.N.S得到了NIGMS授予R35 GM137886的支持,S.N.S得到了国防科学与工程研究生奖学金计划的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Fisher | 05-408-129 | |
| 10 uL single channel pipette | |||
| 1000 uL single channel pipette | |||
| 20 uL single channel pipette | |||
| 200 uL single channel pipette | |||
| Agarose | Fisher | BP165-25 | Low melting agarose |
| Calculator | |||
| Cellvis 35 mm Dish | Fisher | NC0409658 | #1.5 cover glass bottom |
| Chloramphenicol | Sigma | C0378 | stock (20 mg/mL in Ethanol); final concentration in media (2 μg /mL LBS) |
| DAPI Nucleic Acid Stain | Fisher | EN62248 | optional (if not using stable plasmids) |
| FIJI image analysis sofware | ImageJ | https://imagej.net/Fiji/Downloads | open-source software |
| Fisherbrand Cover Glasses: Circles | Fisher | 12-545-81P | #1.5 cover glass; 12 mm diameter |
| Kanamycin Sulfate | Fisher | BP906-5 | stock (100 mg/mL in water, filter sterilize); final concentration in media (1 μg/mL LBS) |
| Lens Cleaning Tissue Paper | Fisher | S24530 | |
| Parafilm | Fisher | 13-374-12 | |
| Petri Plates | Fisher | FB0875713 | sterile with lid |
| Razor Blades | Fisher | S65921 | |
| Semi-micro Cuvettes | VWR | 97000-586 | |
| Spectrophotometer | |||
| SYBR Green Nucleic Acid Stain | Fisher | S7563 | optional (if not using stable plasmids) |
| Thermo Scientific Gold Seal Plain Microscope Slides | Fisher | 12-518-100B | |
| Thermo Scientific Richard-Allan Scientific Cover Glass | Fisher | 22-050-235 | #1.5 cover glass, 25 mm2 |
| Type F Immersion Oil | Fisher | NC0297589 | |
| Upright or inverted fluorescence microscope with camera and imaging software | Images in this article were acquired on a Nikon TI-2 inverted fluorescent microscope outfitted with an ORCA-Fusion Digital CMOS camera using NIS-Elements software. | ||
| Vortex | |||
| Water bath | Used to keep agarose warm prior to pipetting | ||
| LBS media | |||
| 1M Tris Buffer (pH ~7.5) | 50 mL 1 M stock buffer (62 mL HCl, 938 mL DI water, 121 g Trizma Base) | ||
| Agar Technical | Fisher | DF0812-17-9 | 15 g (Add only for plates) |
| DI water | 950 mL | ||
| Sodium Chloride | Fisher | S640-3 | 20 g |
| Tryptone | Fisher | BP97265 | 10 g |
| Yeast Extract | Fisher | BP9727-2 | 5 g |
| mPBS (marine PBS) | Phosphate buffered saline with marine salts added; used for making agarose pad | ||
| 10X PBS | Fisher | ICN1960454 | |
| Instant Ocean Sea Salt | Instant Ocean | SS1-160P | Adjust concentration to appropriate salinity; 20 psu used here |
| Sterile Vacuum Filter Units | Fisher | SCGVU01RE | Used to filter-sterilize mPBS |
| Vacuum pump | Used to filter-sterilize mPBS |
参考文献
- Speare, L., et al. Bacterial symbionts use a type VI secretion system to eliminate competitors in their natural host. Proceedings of the National Academy of Sciences. 115 (36), 8528-8537 (2018).
- Speare, L., Septer, A. N. Coincubation assay for quantifying competitive interactions between Vibrio fischeri isolates. Journal of Visualized Experiments. (149), e59759 (2019).
- Frost, I., et al. Cooperation, competition and antibiotic resistance in bacterial colonies. The ISME journal. 12 (6), 1582-1593 (2018).
- Stubbendieck, R. M., Vargas-Bautista, C., Straight, P. D. Bacterial communities: interactions to scale. Frontiers in Microbiology. 7, 1234 (2016).
- Souza, D. P., et al. Bacterial killing via a type IV secretion system. Nature Communications. 6 (1), 1-9 (2015).
- Anderson, M. C., Vonaesch, P., Saffarian, A., Marteyn, B. S., Sansonetti, P. J. Shigella sonnei encodes a functional T6SS used for interbacterial competition and niche occupancy. Cell Host and Microbe. 21 (6), 769-776 (2017).
- Basler, M., Ho, B., Mekalanos, J. Tit-for-tat: Type VI secretion system counterattack during bacterial cell-cell interactions. Cell. 152 (4), 884-894 (2013).
- Guillemette, R., Ushijima, B., Jalan, M., Häse, C. C., Azam, F. Insight into the resilience and susceptibility of marine bacteria to T6SS attack by Vibrio cholerae and Vibrio coralliilyticus. PloS One. 15 (1), 0227864 (2020).
- Hachani, A., Lossi, N. S., Filloux, A. A visual assay to monitor T6SS-mediated bacterial competition. Journal of Visualized Experiments. (73), e50103 (2013).
- Hibbing, M. E., Fuqua, C., Parsek, M. R., Peterson, S. B. Bacterial competition: surviving and thriving in the microbial jungle. Nature Reviews Microbiology. 8 (1), 15-25 (2010).
- Ruhe, Z. C., Low, D. A., Hayes, C. S. Bacterial contact-dependent growth inhibition. Trends in Microbiology. 21 (5), 230-237 (2013).
- Wood, D. W., Pierson, L. S. The phzI gene of Pseudomonas aureofaciens 30-84 is responsible for the production of a diffusible signal required for phenazine antibiotic production. Gene. 168 (1), 49-53 (1996).
- Smith, W. P., et al. The evolution of the type VI secretion system as a disintegration weapon. PLoS Biology. 18 (5), 3000720 (2020).
- Chen, L., Zou, Y., She, P., Wu, Y. Composition, function, and regulation of T6SS in Pseudomonas aeruginosa. Microbiological Research. 172, 19-25 (2015).
- Sana, T. G., Lugo, K. A., Monack, D. M. T6SS: The bacterial "fight club" in the host gut. PLoS Pathogens. 13 (6), 1006325 (2017).
- Basler, M. Type VI secretion system: secretion by a contractile nanomachine. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1679), 20150021 (2015).
- Joshi, A., et al. Rules of engagement: the type VI secretion system in Vibrio cholerae. Trends in Microbiology. 25 (4), 267-279 (2017).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nature Reviews Microbiology. 14 (9), 589-600 (2016).
- Stubbendieck, R. M., Straight, P. D. Multifaceted interfaces of bacterial competition. Journal of Bacteriology. 198 (16), 2145-2155 (2016).
- Septer, A. N. The Vibrio-squid symbiosis as a model for studying interbacterial competition. Msystems. 4 (3), (2019).
- Tischler, A. H., Hodge-Hanson, K. M., Visick, K. L. Vibrio fischeri-squid symbiosis. eLS. , 1-9 (2019).
- Mandel, M. J., Dunn, A. K. Impact and influence of the natural Vibrio-squid symbiosis in understanding bacterial-animal interactions. Frontiers in Microbiology. 7, 1982 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Boettcher, K., Ruby, E. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna Scolopes. Journal of Bacteriology. 172 (7), 3701-3706 (1990).
- Doino, J. A., McFall-Ngai, M. J. A transient exposure to symbiosis-competent bacteria induces light organ morphogenesis in the host squid. The Biological Bulletin. 189 (3), 347-355 (1995).
- Dunn, A. K., Millikan, D. S., Adin, D. M., Bose, J. L., Stabb, E. V. New rfp-and pES213-derived tools for analyzing symbiotic Vibrio fischeri reveal patterns of infection and lux expression in situ. Applied and Environmental Microbiology. 72 (1), 802-810 (2006).
- Lambertsen, L., Sternberg, C., Molin, S. Mini-Tn7 transposons for site-specific tagging of bacteria with fluorescent proteins. Environmental Microbiology. 6 (7), 726-732 (2004).
- Koch, B., Jensen, L. E., Nybroe, O. A panel of Tn7-based vectors for insertion of the gfp marker gene or for delivery of cloned DNA into Gram-negative bacteria at a neutral chromosomal site. Journal of Microbiological Methods. 45 (3), 187-195 (2001).
- Peterson, B. W., Sharma, P. K., Van Der Mei, H. C., Busscher, H. J. Bacterial cell surface damage due to centrifugal compaction. Applied and Environmental Microbiology. 78 (1), 120-125 (2012).
- Speare, L., Smith, S., Salvato, F., Kleiner, M., Septer, A. N. Environmental viscosity modulates interbacterial killing during habitat transition. MBio. 11 (1), (2020).
- Salomon, D., Gonzalez, H., Updegraff, B. L., Orth, K. Vibrio parahaemolyticus type VI secretion system 1 is activated in marine conditions to target bacteria, and is differentially regulated from system 2. PloS One. 8 (4), 61086 (2013).
- Sana, T. G., et al. Salmonella Typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut. Proceedings of the National Academy of Sciences. 113 (34), 5044-5051 (2016).
- Bachmann, V., et al. Bile salts modulate the mucin-activated type VI secretion system of pandemic Vibrio cholerae. PLoS Neglected Tropical Diseases. 9 (8), 0004031 (2015).
- Ishikawa, T., et al. Pathoadaptive conditional regulation of the type VI secretion system in Vibrio cholerae O1 strains. Infection and Immunity. 80 (2), 575-584 (2012).
- Johnson, M. B., Criss, A. K. Fluorescence microscopy methods for determining the viability of bacteria in association with mammalian cells. Journal of Visualized Experiments. (79), e50729 (2013).
- Stiefel, P., Schmidt-Emrich, S., Maniura-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. 15 (1), 36 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。