Method Article
כימות של תחרות בין-בקטריאלית באמצעות הדמיית פלואורסצנטיות חד-תאית
In This Article
Summary
כתב יד זה מתאר שיטה לשימוש במיקרוסקופיה פלואורסצנטית חד-תאית כדי לדמיין ולתמת תחרות חיידקים בקוקולטורה.
Abstract
תחרות בין-בקטריאלית יכולה להשפיע ישירות על המבנה והתפקוד של מיקרוביום. עבודה זו מתארת גישה מיקרוסקופית פלואורסצנטית שניתן להשתמש בה כדי לדמיין ולתמת אינטראקציות תחרותיות בין זני חיידקים שונים ברמת התא הבודד. הפרוטוקול המתואר כאן מספק שיטות לגישות מתקדמות בהכנת שקופיות הן במיקרוסקופים אפיפלואורציאליים זקופים והן הפוך, טכניקות הדמיה של תאים חיים וזמן, וניתוח תמונה כמותי באמצעות תוכנת הקוד הפתוח FIJI. הגישה בכתב יד זה מתארת את הכימות של אינטראקציות תחרותיות בין אוכלוסיות ויבריו פישרי סימביו על ידי מדידת השינוי באזור לאורך זמן עבור שני זנים בקנה דופן המבטאים חלבונים פלואורסצנטיים שונים מפלסמידים יציבים. שיטות חלופיות מתוארות למיטוב פרוטוקול זה במערכות מודל חיידקים הדורשות תנאי גדילה שונים. למרות שהבחינה המתוארת כאן משתמשת בתנאים המותאמים ל- V. fischeri, גישה זו ניתנת לשחזור גבוהה וניתן להתאים אותה בקלות לחקר התחרות בין מבודדים הניתנים לכת ממיקרוביום מגוון.
Introduction
מאמר זה מתאר שיטה לכימות תחרות חיידקים ברמת התא הבודד באמצעות מיקרוסקופיה פלואורסצנטית. המבנה והתפקוד של קהילות מיקרוביות מעוצב לעתים קרובות על ידי אינטראקציות תחרותיות בין חיידקים, ובמקרים רבים המאפיינים אינטראקציות אלה דורש התבוננות בזני חיידקים שונים בדגירה1,2,3,4,5,6,7,8 . באופן מסורתי, תחרות חיידקים מכמתת ברמת האוכלוסייה על ידי ספירת יחידות יוצרות מושבה (CFUs) של מעכב וזני יעד לפני ואחרי תקופת דופיחות2,9. מנגנונים לתחרות מיקרוביאלית מופצים באופן נרחב בין חיידקים ועשויים להסתמך על דיפוזיה או מגע בין תאים כדי לעכב תאי יעד10,11,12,13,14,15,16,17,18,19.
למרות זנים חיידקיים נצפים לעתים קרובות בקנה דופן ברמת האוכלוסייה, כתב יד זה מתאר בדיקת לכימות חד תא של תחרות חיידקים. יתר על כן, עבודה זו כוללת הצעות להתאמת הפרוטוקול לשימוש עם מינים חיידקיים אחרים. בעוד הטכניקות הספציפיות במאמר זה משמשות לחקר תחרות פנים-ספציפית תלוית מגע בין זנים של החיידק הסימביוטי Vibrio fischeri20,21,22, הם יכולים להיות מותאמים לתחרות בין אורגניזמים רבים. מאמר זה מספק הוראות להגדרת שקופיות הן במיקרוסקופים זקופים והן במיקרוסקופים הפוכים, וכל הניתוח מתואר באמצעות תוכנת הקוד הפתוח FIJI23, כך שהחוקרים יוכלו להשתמש בשיטה עם גישה להגדרות וניתוח שונות של ההדמיה. בהתחשב בחשיבות של לימוד תחרות מיקרוביאלית הן ברמת האוכלוסייה והן ברמת התא הבודד, שיטה זו תהיה משאב בעל ערך לחוקרים לכמת אינטראקציות תחרותיות, במיוחד אלה שאין להן גישה לתוכנת ניתוח קניינית.
Protocol
1. אופטימיזציה של זני חיידקים
- בחר שני זני חיידקים לבדיקות תחרות חיידקים חד-תאית. כאן, שני זנים של V. fischeri משמשים: זן היעד (ES11424)וזן מעכב (MJ1125) כי ידוע להרוג את זן היעד באמצעות סוג VI הפרשת מערכת על כרומוזום II (T6SS2)1, שהוא מנגנון הרג תלוי מגע.
- קבע את הפקדים המתאימים לניסוי. בדוגמה זו, השליטה המתאימה היא לדגור הן על סוג הבר והן על זני מעכב המוטציה T6SS עם זן המטרה כדי לכמת את ההשפעה של הרג בתיווך T6SS.
הערה: פקדים נוספים יכולים לכלול זן מטרה המבטא את הגנים החסינות הדרושים כדי למנוע הרג תלוי T6SS או זן מוטנטי מעכב המבטא עותקים מסוג בר של הגנים שעברו מוטציה בטרנס כדי לשחזר את פעילות T6SS1. - במידת האפשר, להפוך זנים עם פלסמידים יציבים קידוד גנים עבור חלבונים פלואורסצנטיים שונים (למשל, GFP או RFP) כדי להבחין חזותית סוגי זנים על המיקרוסקופ. כאן, זן המעכב מתויג עם plasmid קידוד GFP (pVSV102), ואת זן היעד מתויג עם dsRed קידוד plasmid (pVSV208)26.
הערה: אם לא ניתן להשתמש plasmids יציב, תגי פלורסנט ניתן להציג על כרומוזום חיידקי להדמיה27,28. - במהלך תקופת האופטימיזציה הראשונית, תרביות כלנית תמונה של הזנים המתויגים תחת כל אחד מהמסננים הפלואורסצנטיים שישמשו במהלך הניסוי כדי להבטיח שהתאים יהיו גלויים רק בערוץ המיועד. לדוגמה, ודא שזן מתויג GFP גלוי רק בערוץ FITC.
2. הכנת כרית אגרוז
- הכן פתרון כרית אגרוז על ידי המסת 2% אגרוז נמוך להמיס (w /v) לתוך mPBS. מחממים את התמיסה לזמן קצר במיקרוגל ובמערבולת עד שהאגורוז מומס לחלוטין. שמור על פתרון זה חם על ידי הצבתו באמבט מים 55 מעלות צלזיוס עד מוכן לשימוש. עיין בסעיף דיון לקבלת מידע נוסף אודות הכנת רפידות אגרוז.
הערה: כאן, mPBS הוכן על ידי הוספת 20 g / L NaCl ל- PBS 1x סטנדרטי. - לעטוף חתיכת קלטת מעבדה סביב שקופית זכוכית חמש פעמים. חזור על תהליך זה בפעם השנייה באותה שקופית כך שהמרחק בין שתי חלקי הקלטת קטן במעט מרוחב כיסוי (איור 1A). לדוגמה, אם משתמשים ב-25 מ"מ2 כיסויים, יש מרווחים בין חלקי סרט מדידה במרחק של כ-20 מ"מ זה מזה.
הערה: בעוד שניתן לשנות את מספר הפעמים שהקלטת נעטפת סביב השקופית כדי להתאים את עובי משטח האגורוז, חשוב ששכבות הקלטת יהיו באותו גובה משני צידי השקופית כך שפנקס האגורוז יישאר שטוח. - תמיסת אגרוז חמה של פיפטה בין שתי חתיכות הסרט ומיד למעלה עם כיסוי כך שהוא נשען על חתיכות הסרט. זה יבטיח כי פני השטח של כרית אגרוז נשאר שטוח. נפח תמיסת אגרוז בצינורות בשלב זה צריך להספיק כדי כיסוי ליצור קשר עם הנוזל ודוחף את כל בועות בתמיסת agarose. עבור התקנה מסוימת זו, 200 μL של אגרוז חם מספיק.
- תן כרית אגרוז להתמצקות בטמפרטורת החדר לפחות 1 שעה לפני בדיקת הדגירה. שלב 2.2 יפיק כרית אגרוז של כ 20 מ"מ2.
- חותכים כרית אגרוז זה עם סכין גילוח לארבעה, 5 מ"מ2 רפידות לשמש להדמיה.
הערה: רפידות אגרוז יכולות להיות מיוצרות עד שבוע לפני הניסוי ומאוחסנות ב-4 מעלות צלזיוס בצלחת פטרי ריקה וסטרילית אטומה בפרפילם למניעת ייבוש.
3. הכינו זנים לדגירה משותפת
- יש להוציא כל זן שישמש ב-80 °C המלאי מ-80 °C על לוחות אגר LBS בתוספת האנטיביוטיקה המתאימה ודגרה למשך הלילה ב-24°C. לדוגמה זו, נעשה שימוש בשלושה זנים: זן מעכב מסוג בר, מוטציה של מערכת הפרשת הסוג השישי וזן המטרה.
- למחרת, להתחיל תרבויות לילה כפול ביולוגי על ידי בחירת שתי מושבות מכל זן ו resuspending אותם במדיום LBS בתוספת אנטיביוטיקה המתאימה לדגורת לילה ב 24 °C עם רועד ב 200 סל"ד.
- בבוקר שלמחרת, תת-תרבות כל שכפול ביולוגי 1:1000 לתוך מדיום LBS טרי ללא אנטיביוטיקה ודגורה ב 24 °C עם רועד במשך 4-5 שעות או עד התאים להגיע OD600 של ~ 1.5.
הערה: ייתכן שיהיה צורך אופטימיזציה של התזמון של שלבים 3.1, 3.2 ו- 3.3 עבור מינים חיידקיים שונים מכיוון שקצב הצמיחה שלהם עשוי להשתנות באופן משמעותי. לבדיקה זו, התאים נועדו להיות בשלב אמצע היומן בתחילת מבד הדגירה.
4. זני חיידקים בקו בקנה אחד
- החל מתרביות אמצע יומן הרישום מהשלב 3.3, מדוד ורשום את הצפיפות האופטית ב- 600 ננומטר (OD600)עבור כל הדגימות.
- לנרמל כל מדגם OD600 = 1.0, אשר מתאים כ 109 CFU / mL עבור V. fischeri, על ידי דילול התרבות עם מדיום LBS.
- מערבבים את שני הזנים המתחרים יחד ביחס של 1:1 המבוסס על נפח על ידי הוספת 30 μL של כל זן מנורמל לצינור 1.5 מ"ל שכותרתו. מערבולת את תרבות המתח המעורב עבור 1-2 s.
הערה: במקרים מסוימים, זה עשוי להיות מתאים לערבב cocultures ביחסים שונים. לדוגמה, כאשר זן אחד גדל הרבה יותר מהר מהשני, ייתכן שיהיה צורך להתחיל את המתח הגדל לאט יותר ביתרון מספרי על מנת לצפות בתחרות. מיטוב עשוי להידרש גם אם OD600 אינו תואם CFU / mL דומה עבור שני הזנים. - חזור על שלב 4.3 עבור כל שכפול וטיפול ביולוגיים. בדוגמה המוצגת כאן, התוצאה תהיה בסך הכל ארבעה צינורות זן מעורב: שני שכפולים ביולוגיים עם זן מעכב מסוג בר מעורבב עם זן היעד ושני שכפולים ביולוגיים עם סוג VI הפרשת זן מוטציה מערכת מעורבב עם זן היעד.
- כדי להבטיח שתאים מתחרים צפופים מספיק להרג תלוי מגע בדוביית המטבע על משטח אגר, מרכזים כל תרבית מעורבת פי 3 על ידי צנטריפוגה של התרבות המעורבת בצינור צנטריפוגה סטנדרטי של 1.5 מ"ל למשך דקה אחת ב-21,130 x g, משליכים את הסופר-טבעי, ומבטלים כל גלולה במדיום 20 μL LBS. חזור על הפעולה עבור כל דגימה.
הערה: תאים חיידקיים מסוימים רגישים לנזק על ידי צנטריפוגה ב rcf גבוה; במקרים כאלה ניתן לצנטריפוג את התרבות המעורבת במשך 3 דקות ב 4600 x ז29. בנוסף, בעת כימות תחרות תלוית מגע, חשוב להבטיח צפיפות תאים מספקת בשקופית כדי לצפות בהריגה. במאמר זה, טיפולים "צפופים", שבהם נצפתה ההרג, היו כ 10 תאים / 20 מיקרומטר2; עיין בסעיף דיון לקבלת מידע נוסף.
5. הגדרת שקופיות
- בעת שימוש במיקרוסקופ זקוף, הנח כרית אגרוז~5 מ"מ 2 על שקופית זכוכית סטנדרטית של 1 מ"מ. ספוט 2 μL של תרבות מעורבת על כרית agarose ומניחים #1.5 כיסוי (25 מ"מ2) מעל המקום. ראה איור 1B לדוגמה.
- בעת שימוש במיקרוסקופ הפוך, יש לזהות 2 מיקרו-אל של תרבות מעורבת על התחתית מס' 1.5 של צלחת פטרי 35 מ"מ ולהניח כרית אגרוזכ-5 מ"מ 2 מעל נקודת הדגירה. מניחים כיסוי זכוכית עגולה בקוברות 12 מ"מ מעל משטח האגורוז. ראה איור 1C לדוגמה.
- חזור על שלב 5.1 או 5.2, בהתאם להגדרת המיקרוסקופ המשמשת, עבור שלוש התרבויות המעורבות הנותרות, וכתוצאה מכך ארבע שקופיות או כלים להיווצר.
- אפשר לשקופיות לשבת על הספסל כ-5 דקות לפני שתמשיך לשלב 6. זה מאפשר לתאים להתיישב על כרית אגר ומבטל תנועה במהלך תהליך ההדמיה.
6. מיקרוסקופיית פלואורסצנטיות
- התחל על-ידי התמקדות בתאים המשתמשים באור לבן (ניגודיות פאזה או DIC) כדי למזער את ההשפעות של הלבנת תמונות. בהתבסס על הגודל הממוצע של תא חיידקי יחיד, השתמש במטרה שמן 60x או 100x.
- התאם את זמן החשיפה ואת הגדרות הרכישה עבור כל ערוץ כך שהתאים יתגלו בערוץ המתאים עם זיהוי רקע מינימלי.
הערה: ראוי להשתמש בזמני חשיפה שונים לערוצים שונים, אך יש להשתמש באותו זמן חשיפה בכל השכפולים והטיפולים הביולוגיים לערוץ נתון. - עבור כל דוגמה, בחרו לפחות חמישה שדות תצוגה (FOV) ורכשו תמונות בכל ערוץ מתאים באמצעות הגדרות הרכישה החל מהשלב 6.2 (ראו דוגמאות באיור 2). שמור את נקודות ה- XY מכל FOV כך שניתן יהיה לדמיין את אותו FOV במהלך נקודת הזמן הסופית. הדמיית אותו FOV בכל נקודת זמן יש צורך לקבוע את שיעור השטח הכבוש על ידי תאים היעד או מעכב במהלך שלבי הניתוח.
הערה: בדוגמה זו, הפלואורסצנטיות של GFP מזוהה באמצעות מסנן עם אורך גל עירור של 467 - 498 ננומטר ומסנן פליטה של 513 - 556 ננומטר והוא בצבע כוזב ירוק. פלואורסצנטיות של dsRed מזוהה באמצעות מסנן עם אורך גל עירור של 542 - 582 ננומטר ומסנן פליטה של 603 - 678 ננומטר והוא מגנטה בצבע כוזב. - לאחר 2 שעות, חזור על שלב 6.3 עבור כל מדגם באמצעות נקודות XY שנשמרו בעבר(איור 2).
הערה: ייתכן שיהיה צורך אופטימיזציה של התזמון של התמונות הבאות עבור אורגניזמים עם שיעורי צמיחה שונים או מנגנונים תחרותיים.
7. ניתוח תמונה בפיג'י
- הורד והתקן את תוכנת עיבוד התמונה של FIJI באמצעות ההוראות שנמצאו כאן: https://imagej.net/Fiji/Downloads
- פתח את FIJI וייבוא קבצי תמונה לניתוח.
הערה: ברוב המקרים . קבצי TIFF ישמשו לניתוח תמונה, אם כי תוכנות מסוימות לרכישת תמונות ייצאו באמצעות סוגי קבצים קנייניים. FIJI יכולה לזהות את רוב סוגי הקבצים הקנייניים וניתן לייבא ולנתח אותם באופן הבא. - עבור כל תמונה שנרכשה בשלבים 6.3 ו- 6.4, המר את התמונה לגווני אפור, הפרד את הערוצים ולהתחיל על-ידי סף (Ctrl + Shift + T) ויצירת מסיכה בינארית של התמונה המרוככת מראש (איור 3A, B).
הערה: כאן נעשה שימוש בהגדרות הסף המוגדרות כברירת מחדל ב- FIJI. במקרים מסוימים, ייתכן שיהיה צורך לשנות הגדרות אלה, ובמקרה זה יש להשתמש באותן הגדרות עבור כל התמונות בניסוי זה. - הגדרת קנה מידה בתמונה (ניתוח | הגדר קנה מידה) באמצעות הערכים המתאימים עבור הגדרת המיקרוסקופיה23.
- הגדרת מדידות (ניתוח | הגדר מידות) ובחר אזור.
הערה: ניתן להוסיף מדידות אחרות אם הן מתאימות לניסוי. רק מדידת אזור האובייקט נדרשת עבור הניתוח לדוגמה המוצג כאן. - ניתוח חלקיקים (ניתוח | ניתוח חלקיקים) באמצעות הגדרות ברירת המחדל (איור 3C). אם יש פסולת במדגם, ייתכן שיהיה צורך להתאים את הגודל או המעגליות כדי לסנן חלקיקים שאינם תאים. בחר הצג | קווי מתאר כך שהפלט של ניתוח זה יכלול חלוקה לרמות ממוספרת של כל החלקיקים שנותחו (איור 3D).
הערה: השוואת החלוקה לרמות באיור 3D לתמונה הראשונית חשובה במיוחד בשלב המיטוב כדי להבטיח ש-(1) כל התאים ניתחו, ו-(2) שכל הפסולת לא תיכלל בניתוח. - יצא את המדידות מהשלב 7.4 (איור 3E) לתוכנת גיליון אלקטרוני להמשך ניתוח וגרף.
- חזור על שלבים 7.1 - 7.5 עבור כל הערוצים והתמונות שנרכשו במהלך הניסוי.
8. חישוב אחוז היעד ההתחלתי לאורך זמן
- עבור כל שדה תצוגה שניתח בסעיף 7, ודא שהקובץ המיוצא מכיל מדידת אזור בודדת עבור כל חלקיק שניתח. החל מערוץ הפלואורסצנטיות של זן היעד, חשב את אזור החלקיקים הכולל עבור כל שדה ראייה בודד. עבור שני שכפולים ביולוגיים עם חמישה FOV כל אחד, זה אמור לגרום עשרה אזורים סכום לכל טיפול בכל נקודת זמן.
- חשב את אחוז אזור היעד ההתחלתי לאורך זמן עבור כל FOV באמצעות המשוואה הבאה: (
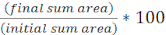 )
) - חזור על חישוב זה עבור כל הטיפולים וגרף את אחוז היעד ההתחלתי (תוצאה של המשוואה מהשלב 8.2) עבור כל טיפול (איור 4A).
- לקבוע אם יש גידול נטו באוכלוסיית היעד (המעידה על צמיחה), ירידה נטו באוכלוסיית היעד (המעידה על מוות) או שאין שינוי (המציין שאין גידול או מוות) לכל טיפול.
הערה: אחוז מאזור היעד ההתחלתי עם ערכים הגדולים מ- 100 מצביע על צמיחת יעד נטו, וערכים הנמוכים מ- 100 מצביעים על מוות של יעד נטו. אחוז מערכי היעד ההתחלתיים שנותרו ב- 100 מצביעים על כך שאין שינוי נטו באוכלוסיית היעד. עיין בדיון לקבלת ניסויי מעקב מוצעים.
9. חישוב אחוז אזור המעכב הראשוני לאורך זמן
- חזור על שלבים 8.1 עד 8.3, הפעם באמצעות המדידות שנאספו מערוץ הפלואורסצנטיות של זן המעכב בסעיף 7 (איור 4B).
- לקבוע אם הייתה עלייה נטו באוכלוסיית המעכבים (גידול); ירידה נטו באוכלוסיית המעכבים (מוות), או ללא שינוי עבור כל טיפול. ערכים הגדולים מ-100 מצביעים על צמיחת מעכב נטו, וערכים הנמוכים מ-100 מצביעים על מוות מעכב נטו.
תוצאות
כדי לדמיין ולכומת אינטראקציות תחרותיות בין חיידקים ברמת התא הבודד, פותח פרוטוקול ואופטימיזציה עבור V. fischeri על ידי שינוי ה- CFU מבוסס ה- CFU שלנו מבוסס היטב1,2. שיטה זו משתמשת GFP- ו dsRed-קידוד יציב plasmids כדי להבחין חזותית זנים שונים של V. fischeri. ניתן לכמת את התוצאה התחרותית של אינטראקציות אלה על ידי ניתוח התמונות שנרכשו מבחינת קוד פתוח באמצעות תוכנת הקוד הפתוח FIJI. כדוגמה, הניסוי הבא בוצע באמצעות בידוד V. fischeri. זן מעכב שמר על פלסמיד המקודד GFP, וזן מטרה שמר על פלסמיד המקודד dsRed. בהתחשב בכך T6SS2 מקודד על ידי המדכא הוא מנגנון הרג תלוי מגע, טיפולים נכללו שבו תאים היו צפופים (מגע תא תא גבוה) או לפזר (מגע תא תא נמוך) על שקופית כדי להדגיש את ההשפעה של התקנה ניסיונית על התוצאות הסופיות של בדיקות זה. בנתוני המדגם, זנים מתחרים היו מעורבים ביחס של 1:1 ודגרו על משטח אגרוז למשך 2 שעות, ותמונות ראשוניות וסופיות (2 שעות) צולמו. כשליטה, זן מוטנטי T6SS2 היה גם בקנה אחד עם זן היעד הן צפוף והן לפזר תנאים. תרבויות של כל זן הוכנו וצוותו כמתואר לעיל, ומגלשות הוכנו כפי שמוצג באיור 1.
איור 2 מציג תמונות מיקרוסקופיות פלואורסצנטיות מייצגות של כל טיפול ניסיוני עם אותו שדה ראייה בתמונה בנקודת זמן ראשונית ואחרונה. עבור כל טיפול, או מעכב מסוג בר או זן מוטנטי T6SS מחסה plasmid קידוד GFP היה מעורבב ביחס 1:1 עם זן היעד מחסה plasmid dsRed קידוד. במהלך תקופת דגירה של 2 שעות עם התקנה ניסיונית זו, גידול תאי V. fischeri עשוי לעבור חלוקה של 1-2(איור 2;חצים אפורים). באיור 2A,מגע בין התא נכפה בין היעד למעכב על-ידי ריכוז התרבות המעורבת לפני ההדבקה בשקופית. תאי יעד מרובים נצפים להיות מעוגלים ו / או להיעלם במהלך 2 שעות, עולה בקנה אחד עם תאי היעד להיות מסולקים על ידי המדכא (איור 2; חצים לבנים). עיין בסעיף דיון לקבלת מידע נוסף אודות פענוח עיגול או ליסינג של תאי יעד. באיור 2B, אותה דגירת מטבעות זוהתה על שקופית, הפעם מבלי לרכז את התרבות המעורבת כך שהתאים יישארו מפוזרים והיה מגע מינימלי בין זנים בשקופית. כאן, לא נצפו תאי יעד להיעלם או עגול, דבר המצביע על כך זן היעד לא היה מעוכב בטיפול זה. איור 2C ואיור 2D מראים את אותם טיפולים צפופים ומפזרים שתוארו לעיל, והפעם באמצעות מוטציה T6SS כזן המעכב. תאי יעד לא נצפו נעלמים או עגולים כאשר חופפים עם מוטציה T6SS בתנאים צפופים או מפוזרים, שוב רומז כי היעד לא היה מעוכב באף אחד מהטיפולים.
איור 3 מציג את זרימת העבודה של ניתוח FIJI המשמשת לכימות התחרות בפרוטוקול זה. נבחרה תמונה מייצגת מערוץ היעד (איור 3A) ומסכה בינארית באמצעות הגדרות הסף המוגדרות כברירת מחדל ב- FIJI (איור 3B). קנה המידה של התמונה הוגדר כראוי עבור הגדרת מיקרוסקופיה זו. חלקיקים נותחו באמצעות פרמטר הגודל = 0 - אינסוף, פרמטר מעגליות = 0.00 - 1.00, ונבחרה האפשרות הצג קווי מתאר ( איור3C). התוצאות של ניתוח חלקיקים זה מוצגות הן כחלוקה לרמות ממוספרת של כל חלקיק (איור 3D), והן כטבלה עם עמודות עבור מספר החלקיקים, שם הקובץ (תווית) ואזור החלקיקים ב- μm2 (אזור) (איור 3E).
באיור 4, נתונים המתקבלים מאיור 3E גרף ונותח. באיור 4א, אחוז היעד הראשוני בנקודת הזמן הסופית מוצג לכל טיפול לפי שלב 8.2. אם אחוז היעד הראשוני גדול מ-100, הדבר מייצג גידול נטו ביעד (כלומר, צמיחה) ונצפה בתנאים שבהם אוכלוסיית היעד אינה מעוכבת באופן משמעותי. עם זאת, אם אחוז היעד הראשוני נמוך מ-100, תוצאה זו מצביעה על ירידה נטו ביעד (כלומר, מוות) ונצפתה בתנאים שבהם אוכלוסיית היעד מעוכבת באופן משמעותי. כאשר המטרה חופפת עם מעכב מסוג פראי בתנאים צפופים, הנתונים מראים ירידה נטו באזור היעד. לעומת זאת, כאשר המטרה חופפת עם מעכב מסוג בר בתנאי פיזור או מוטציה T6SS בתנאים צפופים או מפוזרים, הנתונים מראים עלייה נטו באזור היעד. אחוז היעד הראשוני כאשר היעד היה בקנה אחד עם מעכב מסוג בר בתנאים צפופים היה מתחת ל -100 ונמוך משמעותית מכל הטיפולים האחרים על פי ANOVA בכיוון אחד ואחריו בדיקת השוואות מרובות של טוקי בכל הטיפולים (p < 0.0001). נתונים אלה מצביעים על כך שמות תאי היעד תלוי ב- T6SS פונקציונלי במדכא ומדגיש את החשיבות של התקנה ניסיונית המאפשרת מגע תא-תאים מספיק, על מנת לזהות מוות תאי ממנגנון הרג תלוי מגע.
איור 4B מציג את אחוז אזור המעכב הראשוני בנקודת הזמן הסופית עבור כל טיפול. בדוגמה זו, צמיחה נטו של זן המדכא נצפתה בכל הטיפולים. עם זאת, אחוז אזור המעכב הראשוני היה גבוה משמעותית כאשר מעכב מסוג בר היה בקנה אחד עם היעד בתנאים צפופים לעומת כל הטיפולים האחרים על פי ANOVA בכיוון אחד ואחריו בדיקת השוואות מרובות של Tukey על פני כל הטיפולים (p < 0.0001). בתחילה, לקחנו בחשבון כי הגידול נטו באזור המעכב עשוי להיות מונע על ידי הגידול בשטח הזמין לגדול לתוך כמו תאי היעד מסולקים. עם זאת, עלייה זו בצמיחת המעכבים לא נצפתה בטיפולים מפוזרים, שם לתאי המעכב היה מקום לגדול מתחילת הדגירה. לחלופין, תוצאה זו יכולה להציע כי חומרים מזינים ששוחררו מתאי היעד ליסינג לאפשר עלייה גדולה יותר באוכלוסיית המעכבים. יחד, תוצאות אלה מצביעות על כך שזן המעכב מבטל את המטרה באופן תלוי T6SS רק כאשר מגע גבוה בין תאים סלולריים נכפה על ידי צפיפות תאים בשקופית.
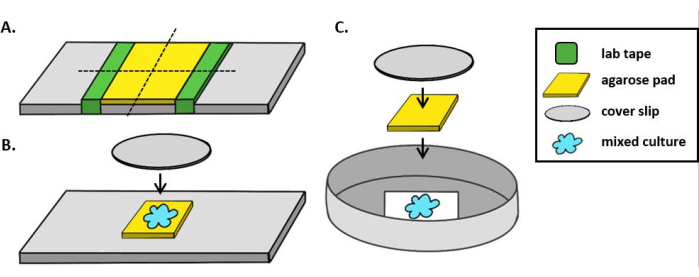
איור 1: הכנת כרית אגרוז והגדרת שקופיות לבדיקות של דגירה. (A)התקנה להכנת רפידות אגרוז של 2%. חמש שכבות של סרט מעבדה (ירוק) עטופים סביב תלוש כיסוי בשתי נקודות במרחק של כ-20 מ"מ זו מזו. לאחר מכן, חם 2% agarose ב mPBS (צהוב) הוא pipetted בין חתיכות של סרט הדבקה ומיד מכוסה עם 25 מ"מ2 כיסוי להחליק מותר להתמצק לפחות 1 שעה בטמפרטורת החדר. השתמש בסכין גילוח כדי לחתוך את כרית האגרוז לכ-5 מ"מ2 חתיכות והשתמשו בבטנצטה כדי להעביר את הפנקס לשקופית חדשה להדמיה. (B)בעת הדמיה על מיקרוסקופ זקוף, הנח את כרית אגרוז 5 מ"מ2 ישירות על השקופית, בעקבות התרבות המעורבת (כחול) ו 12 מ"מ עגול #1.5 כיסוי להחליק. (C)בעת הדמיה על מיקרוסקופ הפוך, לזהות את התרבות המעורבת ישירות על החלקת כיסוי זכוכית #1.5 להחליק את החלקה של צלחת פטרי 35 מ"מ, ומניח כרית אגרוז על גבי התרבות ואחריו כיסוי עגול 12 מ"מ שני להחליק כדי לשטח את כרית agarose. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
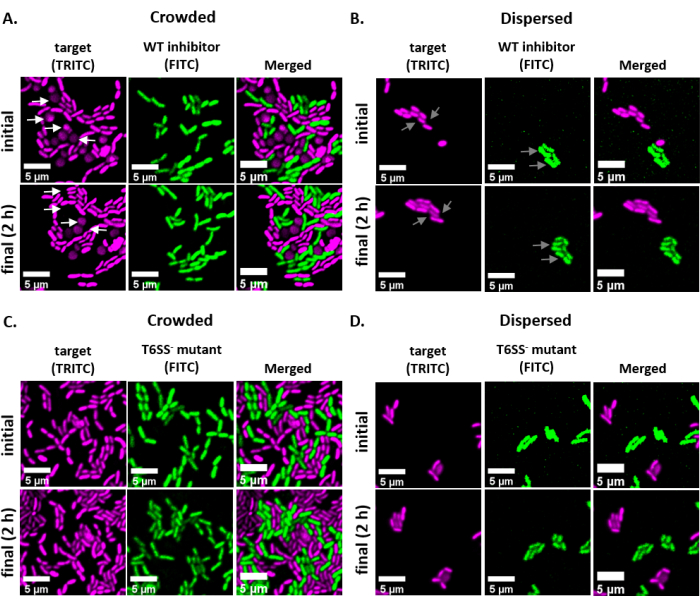
איור 2: תמונות של נקודות דגירה צפופות או מפוזרות בזמן צפוף או מפוזרות. (א)תמונות מייצגות בנקודות זמן ראשוניות ואחרונות שבהן תרבות מעורבת של מעכבי מטרה ופראיים התרכזה פי 3 לפני התצפית בשקופית כדי לכפות מגע בין תאי תא בין זנים. חצים לבנים בערוץ TRITC מצביעים על דוגמאות לתאי יעד הסובבים או מתנפחים במהלך הניסוי. (B)תמונות מייצגות שבהן זוהתה תרבות מעורבת של מעכבי מטרה ופראי מבלי להתרכז כך שהתאים מתפזרים ויש מגע מינימלי בין תאי התא בין זנים. חצים אפורים בערוצי FITC ו- TRITC מצביעים על דוגמאות לחלוקת תאים במהלך הניסוי. (C)תמונות מייצגות שבהן תרבות מעורבת של מטרה ו- T6SS- מוטציה התרכזה פי 3 לפני התצפית בשקופית כדי לכפות מגע בין תאים בין זנים. (D)תמונות מייצגות שבהן תרבות מעורבת של מטרה ו- T6SS- מוטציה זוהתה מבלי להתרכז כך שהתאים מתפזרים ויש מגע מינימלי בין תאי תא בין זנים. סרגלי קנה מידה = 5 מיקרומטר והם עקביים בכל התמונות; ערוץ TRITC הוא מגנטה בצבע כוזב, ערוץ FITC הוא ירוק בצבע כוזב. דה-אבולוטיון בוצע על כל התמונות; הרקע הופחת, והבהירות/ניגודיות הותאמו באופן אחיד בכל התמונות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
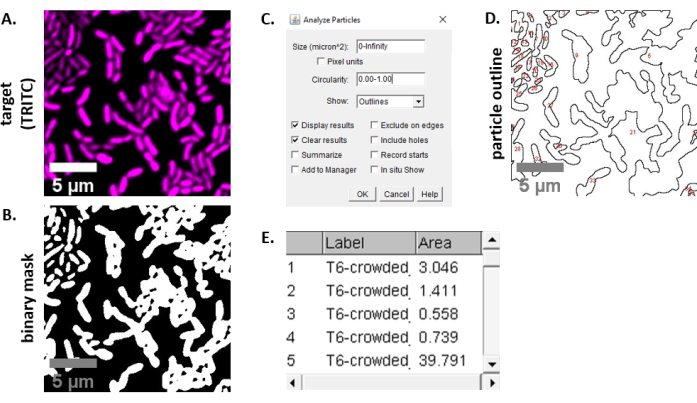
איור 3: זרימת עבודה של ניתוח FIJI. (A)תמונה מייצגת לניתוח. זרימת עבודה זו חוזרת על עצמה עבור שני הערוצים בכל שדות התצוגה והדוגמאות. סרגלי קנה מידה = 5 מיקרומטר והם עקביים בכל התמונות; ערוץ TRITC הוא מגנטה בצבע כוזב, ערוץ FITC הוא ירוק בצבע כוזב. (B)מסיכה בינארית שנוצרה על-ידי הוספת סף לתמונה באמצעות הגדרות ברירת המחדל ב- FIJI. (ג)דוגמה להגדרות לניתוח חלקיקים המשמשות בכתב יד זה. טווח גודל = 0 - אינסוף מיקרומטר2; מעגליות = 0.00 - 1.00; הצג = קווי מתאר. (D)מתאר חלקיקים שנוצר כפלט של ניתוח חלקיקים ב -C). יש להשוות את קו המתאר של החלקיקים ב- (D)לתמונה המקורית (A) כדי להבטיח שכל התאים נלכדו בניתוח החלקיקים. (E)טבלת תוצאות שנוצרה כפלט מניתוח חלקיקים ב- (C). מספר אובייקט (עמודה 1) מתאים לחלקיקים בודדים (תא אחד או יותר) המסומנים בקווים לרמות ומסומנים באדום בחלונית (D). תווית = שם קובץ של תמונה מנותחת; שטח = שטח חלקיקים כולל בμm2. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
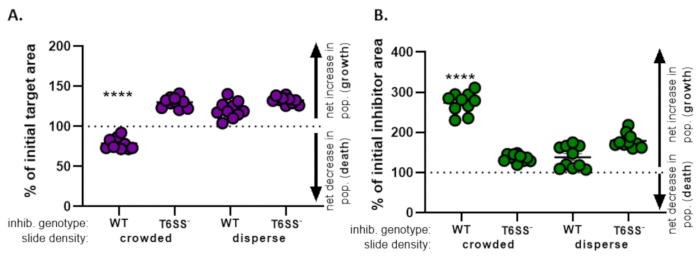
איור 4: נתונים לדוגמה להערכה אם זן היעד מעוכב. אחוז השטח ההתחלתי בנקודות הזמן הסופיות עבור זן היעד (A) ומתח מעכב (B), בצפיפות תאים ראשונית שונה. צפיפות השקופיות מצביעה על צפיפות תאים התחלתית צפופה (מגע גבוה בין זנים), או פיזור גבוה יותר (מגע נמוך בין זנים) כמתואר באיור 2. גנוטיפ מעכב מציין כי סוג פראי או מוטציה T6SS (T6SS-) זן היה בקנה אחד עם זן היעד. כוכביות מצביעות על הבדל משמעותי בשינוי % בהשוואה לכל הטיפולים (ANOVA בכיוון אחד ואחריו בדיקת השוואות מרובות של טוקי המשווה את כל הטיפולים; (p < 0.0001). קו מקווקו מציין שאין שינוי נטו באזור המתח בין נקודת הזמן ההתחלתית והאחרונה; % שינוי > 100 מצביע על עלייה נטו (כלומר, צמיחה) ו- % שינוי < 100 מצביע על ירידה נטו (כלומר, מוות מתא). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הפרוטוקול המתואר לעיל מספק כלי רב עוצמה לכימות ואפיון תחרות בין-בקטריאלית ברמת התא הבודד. בדיקה זו, אשר פותחה על ידי שינוי תחרות מבוססות CFU שלנו על לוחות אגר1,2, מותר להדמיה של תחרות תא יחיד בין מבודדים V. fischeri והצעות מסופקות לאופטימיזציה של השיטה עבור מגוון רחב של מערכות והגדרות מיקרוסקופיה. למרות שהשיטה המתוארת כאן הייתה מותאמת עבור סימביונט V. fischeriשל איבר אור , ניתן לשנות אותו בקלות כדי להכיל חיידקים רבים ומגוונים, culturable. חשוב לציין כי מנגנונים תחרותיים יכולים להיות מוסדרים על ידי כל מספר של משתנים סביבתיים, כולל טמפרטורה, מליחות, וצמיגות30,31,32,33,34. עבודה קודמת אישרה כי V. fischeri מתחרה באמצעות מערכת הפרשת סוג VI תלוי מגע כי הוא פעיל על משטחים30, מה שהופך את התנאים המתוארים בבדיקה זו מתאים לחקר התחרות בין זנים לדוגמה. חשוב גם לשקול את הצפיפות הראשונית של תאים בשקופית בעת כימות תחרות חיידקים. בהתחשב בכך שמגע בין תאי מטרה לתאי מעכב נדרש לעתים קרובות כדי להרוג להתרחש, יש להתרכז בתרבות המעורבת כך שמגע בין תאים הוא מוגדל ותאים נשארים במישור אחד בשקופית. תרביות תאים צריך לגדול לצפיפות אופטית דומה (שלב אמצע היומן) ולאחר מכן מרוכז לכפות מגע ולא רק להגדיל תרביות לצפיפות אופטית גבוהה יותר בשל השינויים הפיזיולוגיים של תאים בשלבי גדילה שונים. במערכות אחרות, ייתכן שיהיה צורך לשנות את תנאי התרבות ואת ההתקנה הניסיונית כדי להבטיח כי המנגנון התחרותי פעיל וניתן לזהותו בתנאי הדגירה.
רפידות אגרוז המשמשות ב- assay זה מספקות מספר יתרונות: הם מספקים ייצוב כך שהתאים לא יסתובבו בחופשיות, והם מונעים מהתרבות להתייבש במהלך הניסוי. בנוסף, אם תורמים כימיים, כגון איזופרופיל-β-D-thiogalactoside (IPTG), נדרשים לניסוי, ניתן להוסיף אותם בקלות לתמיסת האגרוז. עם זאת, חשוב לציין כי הכנת אגרוז יהיה ככל הנראה צורך להתאים עבור מערכות שונות. בדוגמה שתוארה לעיל, כרית אגרוז הוכן על ידי המסת 2% אגרוז (w / v) לתוך 20 psu mPBS, שהוא המליחות הסטנדרטית המשמשת V. fischeri צמיחה בינוני. יתר על כן, במקרים מסוימים ייתכן שיהיה צורך להוסיף מקור פחמן למשטח האגורוז על מנת שהתאים יגדלו ויתחרו על ניסויים ארוכים יותר. במקרה כזה, mPBS רפידות אגרוז ניתן להחליף עם כל אמצעי צמיחה, אם כי החומרים המזינים במדיום הצמיחה עשוי לבוא עם טרייד-אוף של פלואורסצנטיות רקע נוספת.
ללא תוכנת ניתוח תמונה קניינית, זה יכול להיות קשה מאוד לקבל ספירת תאים בודדים כאשר קשר תא הוא גבוה, אשר כפי שאנו מראים כאן נדרש כדי לראות הרג תלוי מגע. מאמץ זה נועד לספק שיטה חלופית לכימות שאינה מסתמכת על ספירת תאים בודדים. במקום זאת, אזור התא הכולל עבור כל ערוץ פלואורסצנטי משמש כדי לכמת את היקף ההרג בין זנים בקנה מידה. מאחר ששיטה זו מסתמכת על שטח ולא על ספירת תאים בודדים, הגדרות הסף המוגדרות כברירת מחדל מספיקות בדרך כלל כדי חלוקה מהשטח הכולל של התא. ניתן לאמת את הדיוק של סף הסף על-ידי חלוקת אזור האובייקט הכולל עבור שדה תצוגה מייצג לפי גודל התא הממוצע עבור האורגניזם לדוגמה והשוואת מספר תא משוער זה לספירת תאים ידנית עבור אותה תמונה.
במטבעות בין מעכב אחד לבין זן מטרה אחת (לא קטלנית), צפויה צמיחה נטו של המדכא. כפי שניתן לראות באיור 4, צמיחת המעכבים עשויה להיות גבוהה משמעותית בטיפולים שבהם נצפתה ההרג, בהשוואה לטיפולים שבהם לא נצפתה הרג, אולי משום שמ חומרים מזינים המשתחררים על ידי תאי יעד lysing מאפשרים לזן המדכא לגדול מהר יותר. בדוגמה המוצגת כאן, מוות היעד נטו נצפה כי תחרות בתיווך T6SS תוצאות תמיסת תא היעד שבו היעד מסולק פיזית. עם זאת, חשוב לציין כי לא כל המנגנונים התחרותיים גורמים לחיסול פיזי של תאי יעד. אם יעד נכה על ידי רעלן שגורם לעיכוב גדילה, הפרוטוקול המתואר כאן עלול לגרום לאוכלוסיית היעד הנראית להישאר יציבה לאורך זמן מכיוון שתאי היעד כבר לא גדלים אך גם אינם מתריסים. במקרה כזה, זה יהיה מתאים להשוות את התוצאות של בדיקה זו עם בדיקות מעקב עבור הכדאיות תא היעד, כגון ציפוי עבור יחידות יוצר מושבה (CFUs) או על ידי ביצוע בדיקות חיים מתים על ידי כתמים עם פרופיליום יודיד או ירוק SYTOX35,36.
בהשוואה לבחוןי דגירה המסתמכים על ספירת CFU, בדיקת זה מאפשרת להתבונן ולכומת את המבנה המרחבי של התחרות בין זנים ולעקוב אחר שינויים במורפולוגיה של תאי היעד לאורך זמן. לדוגמה, ידוע שתאי מעכבים שהורגים באמצעות T6SS ידועים כמקודדים חלבונים דומיין LysM המבזים את דופן תא היעד, וכתוצאה מכך עיגול תאים ראשוני ולאחר מכן תמה13, אשר ראינו בדוגמה המוצגת באיור 2A. יתר על כן, פרוטוקול זה יכול לשמש כדי לעקוב אחר תחרות ברזולוציה גבוהה על פני סולמות זמן קצרים מאוד. בדוגמה המוצגת כאן, נצפתה ירידה משמעותית באזור היעד לאחר שעתיים בלבד שבהן התאים צפופים ומגע בין תאים נכפה בין זנים (איור 4). ניתוח התמונה המתואר כאן יכול להתבצע גם באמצעות מיקרוסקופיה קונפוקלית, שתאפשר לחקור תחרות חיידקים ב- vivo או בביופילים מורכבים, מבלי לשבש את ההתפלגות המרחבית של זנים חופפים.
לסיכום, הבחינה המתוארת כאן נועדה לספק גישה נגישה ומשתנה בקלות להדמיה וכימות תחרות חיידקים ברמת התא הבודד באמצעות מיקרוסקופיה פלואורסצנטית. שיטה זו יכולה להיות מיושמת על מבודדים חיידקיים מגוונים וניתן להשתמש בה כדי לדמיין תחרות חיידקית גם בסביבות מורכבות כגון בתוך מטריצת מארח או ביופילם.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
A.N.S נתמך על ידי NIGMS מענק R35 GM137886 ו S.N.S נתמך על ידי התוכנית הלאומית למדעי ההגנה והנדסה בוגרי.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Fisher | 05-408-129 | |
| 10 uL single channel pipette | |||
| 1000 uL single channel pipette | |||
| 20 uL single channel pipette | |||
| 200 uL single channel pipette | |||
| Agarose | Fisher | BP165-25 | Low melting agarose |
| Calculator | |||
| Cellvis 35 mm Dish | Fisher | NC0409658 | #1.5 cover glass bottom |
| Chloramphenicol | Sigma | C0378 | stock (20 mg/mL in Ethanol); final concentration in media (2 μg /mL LBS) |
| DAPI Nucleic Acid Stain | Fisher | EN62248 | optional (if not using stable plasmids) |
| FIJI image analysis sofware | ImageJ | https://imagej.net/Fiji/Downloads | open-source software |
| Fisherbrand Cover Glasses: Circles | Fisher | 12-545-81P | #1.5 cover glass; 12 mm diameter |
| Kanamycin Sulfate | Fisher | BP906-5 | stock (100 mg/mL in water, filter sterilize); final concentration in media (1 μg/mL LBS) |
| Lens Cleaning Tissue Paper | Fisher | S24530 | |
| Parafilm | Fisher | 13-374-12 | |
| Petri Plates | Fisher | FB0875713 | sterile with lid |
| Razor Blades | Fisher | S65921 | |
| Semi-micro Cuvettes | VWR | 97000-586 | |
| Spectrophotometer | |||
| SYBR Green Nucleic Acid Stain | Fisher | S7563 | optional (if not using stable plasmids) |
| Thermo Scientific Gold Seal Plain Microscope Slides | Fisher | 12-518-100B | |
| Thermo Scientific Richard-Allan Scientific Cover Glass | Fisher | 22-050-235 | #1.5 cover glass, 25 mm2 |
| Type F Immersion Oil | Fisher | NC0297589 | |
| Upright or inverted fluorescence microscope with camera and imaging software | Images in this article were acquired on a Nikon TI-2 inverted fluorescent microscope outfitted with an ORCA-Fusion Digital CMOS camera using NIS-Elements software. | ||
| Vortex | |||
| Water bath | Used to keep agarose warm prior to pipetting | ||
| LBS media | |||
| 1M Tris Buffer (pH ~7.5) | 50 mL 1 M stock buffer (62 mL HCl, 938 mL DI water, 121 g Trizma Base) | ||
| Agar Technical | Fisher | DF0812-17-9 | 15 g (Add only for plates) |
| DI water | 950 mL | ||
| Sodium Chloride | Fisher | S640-3 | 20 g |
| Tryptone | Fisher | BP97265 | 10 g |
| Yeast Extract | Fisher | BP9727-2 | 5 g |
| mPBS (marine PBS) | Phosphate buffered saline with marine salts added; used for making agarose pad | ||
| 10X PBS | Fisher | ICN1960454 | |
| Instant Ocean Sea Salt | Instant Ocean | SS1-160P | Adjust concentration to appropriate salinity; 20 psu used here |
| Sterile Vacuum Filter Units | Fisher | SCGVU01RE | Used to filter-sterilize mPBS |
| Vacuum pump | Used to filter-sterilize mPBS |
References
- Speare, L., et al. Bacterial symbionts use a type VI secretion system to eliminate competitors in their natural host. Proceedings of the National Academy of Sciences. 115 (36), 8528-8537 (2018).
- Speare, L., Septer, A. N. Coincubation assay for quantifying competitive interactions between Vibrio fischeri isolates. Journal of Visualized Experiments. (149), e59759 (2019).
- Frost, I., et al. Cooperation, competition and antibiotic resistance in bacterial colonies. The ISME journal. 12 (6), 1582-1593 (2018).
- Stubbendieck, R. M., Vargas-Bautista, C., Straight, P. D. Bacterial communities: interactions to scale. Frontiers in Microbiology. 7, 1234 (2016).
- Souza, D. P., et al. Bacterial killing via a type IV secretion system. Nature Communications. 6 (1), 1-9 (2015).
- Anderson, M. C., Vonaesch, P., Saffarian, A., Marteyn, B. S., Sansonetti, P. J. Shigella sonnei encodes a functional T6SS used for interbacterial competition and niche occupancy. Cell Host and Microbe. 21 (6), 769-776 (2017).
- Basler, M., Ho, B., Mekalanos, J. Tit-for-tat: Type VI secretion system counterattack during bacterial cell-cell interactions. Cell. 152 (4), 884-894 (2013).
- Guillemette, R., Ushijima, B., Jalan, M., Häse, C. C., Azam, F. Insight into the resilience and susceptibility of marine bacteria to T6SS attack by Vibrio cholerae and Vibrio coralliilyticus. PloS One. 15 (1), 0227864 (2020).
- Hachani, A., Lossi, N. S., Filloux, A. A visual assay to monitor T6SS-mediated bacterial competition. Journal of Visualized Experiments. (73), e50103 (2013).
- Hibbing, M. E., Fuqua, C., Parsek, M. R., Peterson, S. B. Bacterial competition: surviving and thriving in the microbial jungle. Nature Reviews Microbiology. 8 (1), 15-25 (2010).
- Ruhe, Z. C., Low, D. A., Hayes, C. S. Bacterial contact-dependent growth inhibition. Trends in Microbiology. 21 (5), 230-237 (2013).
- Wood, D. W., Pierson, L. S. The phzI gene of Pseudomonas aureofaciens 30-84 is responsible for the production of a diffusible signal required for phenazine antibiotic production. Gene. 168 (1), 49-53 (1996).
- Smith, W. P., et al. The evolution of the type VI secretion system as a disintegration weapon. PLoS Biology. 18 (5), 3000720 (2020).
- Chen, L., Zou, Y., She, P., Wu, Y. Composition, function, and regulation of T6SS in Pseudomonas aeruginosa. Microbiological Research. 172, 19-25 (2015).
- Sana, T. G., Lugo, K. A., Monack, D. M. T6SS: The bacterial "fight club" in the host gut. PLoS Pathogens. 13 (6), 1006325 (2017).
- Basler, M. Type VI secretion system: secretion by a contractile nanomachine. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1679), 20150021 (2015).
- Joshi, A., et al. Rules of engagement: the type VI secretion system in Vibrio cholerae. Trends in Microbiology. 25 (4), 267-279 (2017).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nature Reviews Microbiology. 14 (9), 589-600 (2016).
- Stubbendieck, R. M., Straight, P. D. Multifaceted interfaces of bacterial competition. Journal of Bacteriology. 198 (16), 2145-2155 (2016).
- Septer, A. N. The Vibrio-squid symbiosis as a model for studying interbacterial competition. Msystems. 4 (3), (2019).
- Tischler, A. H., Hodge-Hanson, K. M., Visick, K. L. Vibrio fischeri-squid symbiosis. eLS. , 1-9 (2019).
- Mandel, M. J., Dunn, A. K. Impact and influence of the natural Vibrio-squid symbiosis in understanding bacterial-animal interactions. Frontiers in Microbiology. 7, 1982 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Boettcher, K., Ruby, E. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna Scolopes. Journal of Bacteriology. 172 (7), 3701-3706 (1990).
- Doino, J. A., McFall-Ngai, M. J. A transient exposure to symbiosis-competent bacteria induces light organ morphogenesis in the host squid. The Biological Bulletin. 189 (3), 347-355 (1995).
- Dunn, A. K., Millikan, D. S., Adin, D. M., Bose, J. L., Stabb, E. V. New rfp-and pES213-derived tools for analyzing symbiotic Vibrio fischeri reveal patterns of infection and lux expression in situ. Applied and Environmental Microbiology. 72 (1), 802-810 (2006).
- Lambertsen, L., Sternberg, C., Molin, S. Mini-Tn7 transposons for site-specific tagging of bacteria with fluorescent proteins. Environmental Microbiology. 6 (7), 726-732 (2004).
- Koch, B., Jensen, L. E., Nybroe, O. A panel of Tn7-based vectors for insertion of the gfp marker gene or for delivery of cloned DNA into Gram-negative bacteria at a neutral chromosomal site. Journal of Microbiological Methods. 45 (3), 187-195 (2001).
- Peterson, B. W., Sharma, P. K., Van Der Mei, H. C., Busscher, H. J. Bacterial cell surface damage due to centrifugal compaction. Applied and Environmental Microbiology. 78 (1), 120-125 (2012).
- Speare, L., Smith, S., Salvato, F., Kleiner, M., Septer, A. N. Environmental viscosity modulates interbacterial killing during habitat transition. MBio. 11 (1), (2020).
- Salomon, D., Gonzalez, H., Updegraff, B. L., Orth, K. Vibrio parahaemolyticus type VI secretion system 1 is activated in marine conditions to target bacteria, and is differentially regulated from system 2. PloS One. 8 (4), 61086 (2013).
- Sana, T. G., et al. Salmonella Typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut. Proceedings of the National Academy of Sciences. 113 (34), 5044-5051 (2016).
- Bachmann, V., et al. Bile salts modulate the mucin-activated type VI secretion system of pandemic Vibrio cholerae. PLoS Neglected Tropical Diseases. 9 (8), 0004031 (2015).
- Ishikawa, T., et al. Pathoadaptive conditional regulation of the type VI secretion system in Vibrio cholerae O1 strains. Infection and Immunity. 80 (2), 575-584 (2012).
- Johnson, M. B., Criss, A. K. Fluorescence microscopy methods for determining the viability of bacteria in association with mammalian cells. Journal of Visualized Experiments. (79), e50729 (2013).
- Stiefel, P., Schmidt-Emrich, S., Maniura-Weber, K., Ren, Q. Critical aspects of using bacterial cell viability assays with the fluorophores SYTO9 and propidium iodide. BMC Microbiology. 15 (1), 36 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved