Method Article
الخلط المائي كخزعة سائلة للورم الأرومي الشبكي: بزل القرنية الواضح والتحليل الجيني
In This Article
Summary
الخلط المائي هو خزعة سائلة عالية الغلة للورم الأرومي الشبكي ، وهو سرطان العين الذي لا يمكن أخذ خزعة في الجسم الحي بسبب خطر الانتشار خارج العين. هنا ، يتم تقديم طريقة لاستخراج الخلط المائي بأمان عن طريق بزل القرنية الواضح وخطوات التحليل الجيني لتحديد المؤشرات الحيوية التنبؤية.
Abstract
هناك فائدة سريرية محتملة كبيرة لتطبيق منصة الخزعة السائلة للورم الأرومي الشبكي ، نظرا لأن خزعة الورم المباشرة محظورة في هؤلاء المرضى. تتشكل الخلط المائي (AH) في حجرة منفصلة عن الورم ولكنها محاطة بنفس مساحة العين. وبالتالي ، فهو مصدر غني للمعلومات الجينومية الورمية الخاصة بالعين والتي يمكن استخدامها كخزعة سائلة أو بديل لخزعة الورم لهذا المرض. توضح هذه المخطوطة بالتفصيل منهجية لاستخراج AH بأمان من عيون الورم الأرومي الشبكي عن طريق بزل القرنية الصافي. بالإضافة إلى ذلك ، يتم تقديم خطوات التحليل الجيني ، بما في ذلك عزل الحمض النووي الخالي من الخلايا وتنقيته ، وتسلسل الجيل التالي ، وتحليل تغيير عدد النسخ الجسدي (SCNA) ، وتحديد طفرة متغير النوكليوتيدات المفردة RB1 (SNV) ، وتقدير جزء الورم. تم تقييم الصلاحية السريرية قبل التحليلية والتحليلية والمبكرة لمنصة الخزعة السائلة AH. ومع ذلك ، فإنه لا يخلو من القيود. هذه إلى حد كبير نتيجة لكمية الحمض النووي الخالي من الخلايا المطلوبة لخطوات معينة من الفحص. بالمقارنة مع منصات الخزعة السائلة الأخرى القائمة على الدم التي تخضع حاليا للتحقيق للورم الأرومي الشبكي ، فإن المنصة القائمة على AH محدودة بحجم السائل الحيوي (وبالتالي كمية الحمض النووي) التي يمكن استخراجها من العين. الفائدة هي أن AH خاص بالعين. المنصة التي تمت مناقشتها هنا فريدة من نوعها من حيث أنها تكتشف الحمض النووي للورم المنتشرة في AH عبر آليتين (SCNAs و RB1 SNVs) ، مما ينتج عنه حساسية أعلى لتحديد المعلومات الجينومية السرطانية. تتمتع الخزعة السائلة AH بالقدرة على التطبيق السريري المباشر لعلم الأورام الدقيق لمرضى الورم الأرومي الشبكي ، مع أهمية خاصة للمرضى الذين يعانون من مرض ثنائي حيث أن AH خاص بالأورام في كل عين. هناك بحث مستمر مع تطبيقات هذه المنصة للمرضى الذين يعانون من أورام العين الأخرى أيضا.
Introduction
الورم الأرومي الشبكي (RB) هو سرطان نادر وفريد من نوعه. في حين أنه أكثر الأورام الخبيثة الأولية شيوعا داخل العين التي تتشكل في شبكية العين النامية للرضع والأطفال الصغار ، إلا أنه لا يوجد سوى حوالي 7000 حالة في العالم سنويا ، وحوالي 250-300 حالة منها في الولايات المتحدة. على الرغم من أن بقاء المريض على قيد الحياة يقترب من 98٪ في البلدانالمتقدمة 1 ، إلا أن بقاء العين للعيون المتقدمة ، والتي تصنف سريريا على أنها التصنيف الدولي للرطوبة RB داخل العين (IIRC) 2 المجموعة D / E أو AJCC cT2b / 3 ، أقل بكثير. يتم استئصال العديد من هذه العيون المتقدمة إما في المقام الأول (كعلاج أول) أو ثانوي (بعد محاولات فاشلة في علاج إنقاذ الكرة الأرضية). في الممارسة السريرية الحالية لأورام العين ، لا توجد مؤشرات حيوية جزيئية مشتقة من الورم وخاصة بالعين تستخدم حاليا سريريا للمساعدة في التشخيص أو التشخيص ببقاء العين على قيد الحياة أو مراقبة علاج المرضى الذين يعانون من RB. ويرجع ذلك ، إلى حد كبير ، إلى حقيقة أن أنسجة الورم متاحة فقط للتحليلات الجزيئية والجينية من العيون المنزوع النواة لأن خزعة الورم المباشرة في RB محظورة بسبب القلق من انتشار الورم خارج العين3،4،5،6،7،8،9. بسبب هذا الحظر ، اقتصرت الدراسات السابقة بأثر رجعي حول علم الوراثة الورمي RB وارتباطاتها السريرية بتحليل أنسجة الورم التي تم الحصول عليها من العيون المنزوعالنواة فقط 10،11،12،13. لذلك ، كان هناك نقص في البيانات الجزيئية الموضوعية المشتقة من الورم المتاحة عند التشخيص وطوال فترة علاج إنقاذ العين. لم يحد هذا فقط من فهم بيولوجيا الورم في الجسم الحي والطرق التي تتغير بها هذه الأورام على المستوى الجزيئي طوال فترة العلاج ولكن أيضا القدرة على تطوير خطط علاج مخصصة خاصة بالعين وقائمة على الجينوم لمرضى السرطان الصغار.
بصرف النظر عن حظر الخزعة ، هناك جانب فريد آخر من هذا السرطان وهو أن معظم الأورام تبدأ عن طريق الفقدان ثنائي الأليل للجين المثبط للورم RB1 ، والذي يعدل دورة الخلية. شبكية العين النامية حساسة بشكل رائع لهذه الخسارة. في 60٪ من المرضى ، يحدث هذا التعطيل ثنائي الأليلات لجين RB1 في شبكية العين فقط كفقدان جسدي ويؤدي إلى مرض أحادي الجانب. ومع ذلك ، في 40٪ من المرضى ، تحدث طفرة RB1 الأولية في السلالة الجرثومية ، تليها "ضربة" ثانية في شبكية العين. في هؤلاء الأطفال ، غالبا ما تكون هناك أورام متعددة تؤثر على كلتا العينين. أخيرا ، يبدو أن مجموعة فرعية صغيرة جدا (<2٪) من الأورام مدفوعة بتضخيم MYCN دون طفرات في جين RB1 . في حين أن الأورام التي يحركها MYCN تفشل في العلاج بشكل عام تقريبا وتتطلب الاستئصال ، لا توجد حاليا طريقة واضحة وموضوعية لتحديد هذا النوع الفرعي من الورم العدواني عند التشخيص14،15. علاوة على ذلك ، تعتمد مراقبة نشاط ورم RB داخل العين بشكل حصري تقريبا على التصوير والملاحظات السريرية لكل عين من قبل أخصائي أورام العين المعالج. لا توجد طريقة موضوعية أو كمية للتشخيص أو التشخيص أو طريقة لمراقبة ديناميكيات الورم الخاصة بالعين طوال فترة العلاج. بسبب هذه القيود الفريدة ل RB ، فإن احتمال وجود منصة خزعة سائلة لهذا السرطان أمر مغري. تستخدم الخزعات السائلة سوائل الجسم لعزل الحمض النووي الخالي من الخلايا وتسلسله لتحديد ما إذا كان مشتقا من الورم ، والمعروف باسم الحمض النووي للورم الدائري (ctDNA). بينما يتم البحث عن المصل لأنواع السرطان الأخرى ، فإن RB ctDNA الموجود في المصل ليس خاصا بالعين ، والذي له قيود واضحة على 40٪ من المرضى الذين يعانون من مرض ثنائي. بالإضافة إلى ذلك ، تم وصفه فقط في وضع مرض متقدم داخل العين أو نقيلي ، بشكل عام مع جزء ورم منخفض (<5٪)16.
في محاولة لمعالجة هذه المشاكل السريرية الحقيقية التي تواجه المرضى والعائلات ، في عام 2017 ، أظهرنا أن الخلط المائي (AH ، السائل الصافي أمام العين) ، هو مصدر عالي الغلة ل ctDNA يمكن استخدامه كخزعة سائلة - أو أكثر من ذلك كبديل لخزعة الورم - لتقييم RB17 ، 18،19. مع أكثر من 200 عينة حتى الآن ، تم تحديد ctDNA في >95٪ من العينات ، بما في ذلك عيون IIRC الأقل تقدما في مجموعات A و B و C ، بالإضافة إلى الاختلافات الجينومية بين العيون في المرضى الثنائيين18،19. يمكن عزل هذا الحمض النووي بأمان وفعالية للكشف عن المؤشرات الحيوية الجزيئية ذات الصلة في العيون التي تخضع بنشاط للعلاج أو العلاج - ساذجة18،20،21. يمكن أيضا استخدام منصة الخزعة السائلة AH لتحديد المتغيرات المسببة للأمراض RB1 التشخيصية أو تضخيم MYCN الأولي الذي يبدأ تكوين الأورام21،22. الأهم من ذلك ، لقد حددنا التوقيع الجزيئي التنبؤي - وجود اكتساب كروموسوم 6p بسعة ≥1.5 إلى تضخيم MYCN المتوسط أو البؤري - والذي يرتبط بزيادة احتمالية فقدان السيطرة على الورم داخل العين بمقدار 16.5 مما يتطلب إزالة العين18،20،21. أخيرا ، ثبت أن التغيرات في جزء ورم ctDNA (TFx) في AH ترتبط بالاستجابة العلاجية حيث ترتبط المستويات الأعلى بالمرض النشط ، ويرتبط انخفاض المستويات بالاستجابة العلاجيةالإيجابية 23. بالنظر إلى هذه التطبيقات وفائدتها السريرية المحتملة ، أردنا تحديد منهجية خزعة AH وتقييمها. يتضمن ذلك طفيل القرنية الواضح للحصول على العينات وبروتوكول التحليل الجيني ، وتحديدا بناء مكتبة cfDNA وتسلسلها ، وتحديد سعة SCNA ، وتحديد متغير RB1 الممرض ، وحساب TFx.
Protocol
يتم إجراء هذا البحث تحت موافقة مستشفى الأطفال في لوس أنجلوس ومجلس المراجعة المؤسسية بجامعة جنوب كاليفورنيا ، وهو يلتزم بمبادئ إعلان هلسنكي. يتم الحصول دائما على موافقة خطية مستنيرة من الأوصياء القانونيين لجميع المشاركين.
يمكن رؤية مخطط لسير عمل الخزعة السائلة AH في الشكل 1.
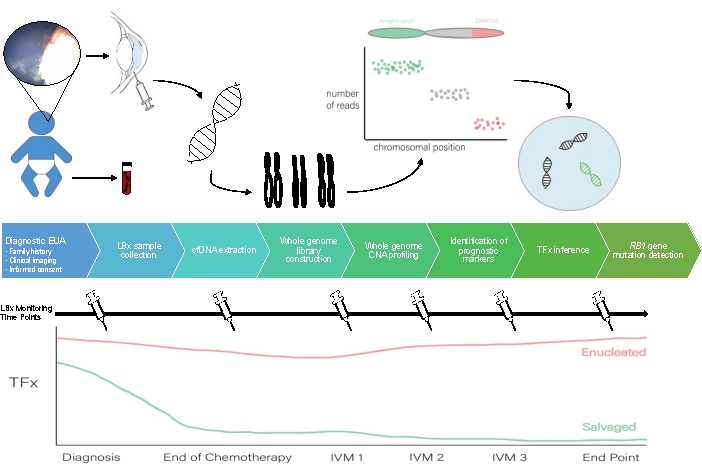
الشكل 1: سير عمل الخزعة السائلة AH لمرافقة البروتوكول الموضح هنا. EUA ، الفحص تحت التخدير ؛ LBX ، خزعة سائلة. cfDNA ، الحمض النووي الخالي من الخلايا. CNA ، تغيير رقم النسخ ؛ TFx ، جزء الورم. IVM ، ميلفالان داخل الجسم الزجاجي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. الإجراء الجراحي:
ملاحظة: يتم تنفيذ هذا الإجراء أثناء الفحص الروتيني تحت التخدير (EUA) للتقييم السريري للمرضى الذين يعانون من RB. يجب أن يتم إجراء بزل الزل لاستخراج AH فقط من قبل جراح عيون مدرب أكمل التدريب القياسي في جراحة العين.
- معايير اختيار المريض وإدراجه هي كما يلي.
- تأكد من أن الغرفة مكونة وواضحة دون أن تتسرب من الورم أو syneciae أو عدسة إعتام عدسة العين.
ملاحظة: في بعض العيون المتقدمة ، تكون الغرفة ضحلة جدا عند التشخيص بحيث لا يمكن استخراج AH بأمان. في هذه الحالات ، يوصى بالانتظار حتى بعد الدورة الأولى من العلاج الكيميائي الجهازي أو داخل الشرايين. بمجرد أن يتقلص الورم الرئيسي ، تتعمق الغرفة بشكل عام ، مما يسمح باتباع نهج آمن. - تأكد من وجود رؤية واضحة لجميع الهياكل وأن الضغط <22 مم زئبق بحيث لا يكون هناك ضحل سريع للغرفة بسبب ديناميكيات الضغط. هذا صحيح بالنسبة لجميع النقاط الزمنية ، ولكنه بالغ الأهمية بشكل خاص عند أخذ AH عند التشخيص.
- تأكد من عدم وجود تورط مباشر للجزء الأمامي من قبل الورم ، والذي يتم تقييمه عن طريق التصور المباشر والفحص المجهري الحيوي بالموجات فوق الصوتية. عادة ما يتم تحديد معيار التضمين هذا أثناء EUA.
- تأكد من أن الغرفة مكونة وواضحة دون أن تتسرب من الورم أو syneciae أو عدسة إعتام عدسة العين.
- بمجرد اعتبار المريض مناسبا وموافقته ، أحضر المريض إلى غرفة العمليات. اسمح لطبيب التخدير المعالج ببدء التخدير كما هو روتيني ل EUA للرعاية السريرية للمرضى الذين يعانون من RB.
- بمجرد تنبيب المريض وتخديره ، واكتمال جميع الفحص السريري والتصوير وأي احتياجات علاجية محلية (على سبيل المثال ، الليزر أو العلاج بالتبريد) المتعلقة ب EUA ، استخرج AH لمنصة الخزعة السائلة. تحضير العين وثنها بالطريقة المعقمة المعتادة. يمكن إكمال ذلك من قبل الممرضة المنتشرة أو جراح العمليات.
- قبل EUA ، ضع قطرات التوسيع المستخدمة بشكل روتيني في المؤسسة للحصول على EUA في العين الجراحية.
ملاحظة: هنا ، يتم استخدام قطرات العين المركبة التي تتكون من 2.5٪ فينيليفرين ، و 1٪ سيكلوبنتولات ، و 1٪ تروبيكاميد. ومع ذلك ، فإن أي قطرات قياسية تستخدم لتوسيع EUA كافية. لا يلزم توسيع العين لمجرد استخراج AH. - ضع قطرة 5٪ من البيتادين في العين الجراحية وقم بتطبيقها باستخدام إسفنجة تبدأ من المركز وتتحرك بشكل محيطي. قم بتضمين هوامش الجفن العلوية والسفلية في التحضير الجراحي. أكمل التحضير الجراحي باستخدام البيتادين ثلاث مرات ، ثم انتظر دقيقتين على الأقل قبل المتابعة.
- ضع منشفة زرقاء معقمة على رأس المريض وثنيها تحت رأسه لمنعه من السقوط. جفف الرموش والمنطقة حول الحجاج بمنشفة زرقاء معقمة أو شاش.
- دع جراح العملية يفرك ، ويرتدي ثوبا ، ويرتدي قفازات.
- قم بتغطية المريض بستائر زرقاء معقمة ، مع ترك العين الجراحية مكشوفة. ضع منظار غطاء معقم للتصور الأمثل للمجال المعقم.
ملاحظة: التخدير الموضعي الإضافي غير مطلوب في مؤسستنا لأن الطفل يخضع للتخدير العام ل EUA. - أداء المهلة وفقا للبروتوكول المؤسسي. هنا ، يتم إجراء مهلة أولية ل EUA ومهلة ثانية للتحقق من العين (العينين) قبل الإجراء.
- قبل EUA ، ضع قطرات التوسيع المستخدمة بشكل روتيني في المؤسسة للحصول على EUA في العين الجراحية.
- باستخدام مجهر التشغيل ، قم بإجراء بزل القرنية الشفاف مع استخراج 0.1 مل من AH بإبرة 32 جم على حقنة 1 سم مكعب.
- قبل بدء الإجراء ، بلل العين بمحلول ملح متوازن معقم (كل مل يحتوي على كلوريد الصوديوم 0.64٪ ، كلوريد البوتاسيوم 0.075٪ ، ثنائي هيدرات كلوريد الكالسيوم 0.048٪ ، سداسي هيدرات كلوريد المغنيسيوم 0.03٪ ، ثلاثي هيدرات أسيتات الصوديوم 0.39٪ ، ثنائي هيدرات سترات الصوديوم 0.17٪ ، هيدروكسيد الصوديوم و / أو حمض الهيدروكلوريك (لضبط درجة الحموضة) ، وماء للحقن) للحفاظ على تزييت القرنية ؛ هذا هو إعداد تجاري قياسي.
- تأكد من أن إبرة 32 G مقفلة بالحقنة 1 سم مكعب وأنه لا يوجد ضغط في المحقنة (عن طريق تحريك مكبس المحقنة للداخل والخارج عدة مرات قبل الاستخدام).
- بعد ذلك ، مرر الإبرة عبر القرنية الصافية عند الأطراف (عموديا عليها ، كما هو معيار بزل البزل) وابق داخل الغرفة الأمامية فوق القزحية المتوسعة المحيطية.
- حافظ على شطبة طرف الإبرة الأمامية للقزحية تحت الرؤية المباشرة عبر المجهر أثناء الاستخراج. إذا كنت تفضل ذلك ، قم بتثبيت العين باستخدام ملقط 0.12 أثناء مرور الإبرة عبر القرنية.
ملاحظة: يجب ألا يكون هناك اتصال بين طرف الإبرة وأي بنية عينية. يجب أن تبقى فوق القزحية الطرفية في الغرفة الأمامية الوسطى. - استخراج 0.1 مل من AH. قم بمعالجة مكبس المحقنة بيد الجراح غير المهيمنة (ولكن مع الممارسة) أو بواسطة مساعد مدرب دون تحريك الإبرة. لا تفقد التصور المباشر لطرف الإبرة. أعط الأولوية لتشريح العين وخذ كمية أقل من AH إذا لزم الأمر لضمان بقاء الغرفة مكونة
- بعد الاستخراج ، قم بإزالة الإبرة برفق من الغرفة الأمامية. تأكد من أن الغرفة لا تزال مكونة ولكنها ضحلة قليلا ؛ سيكون الضغط ناعما ولكنه فسيولوجي. بمجرد إزالة الإبرة من العين ، اغتسل العين بغزارة بالماء المعقم. يفضل الماء المعقم على محلول الملح المغطى في هذه الخطوة كإجراء أمان لأن الماء يحلل الخلايا.
- افحص موقع الإبرة بحثا عن أي تسرب. إذا كان هناك تسرب ، استخدم قضيب بطرف قطني لتطبيق ضغط لطيف في موقع الحقن لمدة 30 ثانية قبل التحقق مرة أخرى من وجود تسرب. كرر العملية إذا لزم الأمر.
ملاحظة: لم تكن هناك حاجة أبدا إلى استخدام طرق أكثر توغلا لوقف أي تسرب مع هذا النهج. في بعض الأحيان يتبع هذا الإجراء حقن العلاج الكيميائي داخل الجسم الزجاجي. بالنسبة لورقة الطرق هذه ، يركز البروتوكول على استخراج AH كإجراء أساسي.
- افحص موقع الإبرة بحثا عن أي تسرب. إذا كان هناك تسرب ، استخدم قضيب بطرف قطني لتطبيق ضغط لطيف في موقع الحقن لمدة 30 ثانية قبل التحقق مرة أخرى من وجود تسرب. كرر العملية إذا لزم الأمر.
- بمجرد عدم وجود تسرب ، يعتبر الإجراء كاملا. قم بإزالة الستائر المعقمة من المريض وتنظيف البيتادين من الوجه.
- قم بإزالة طرف الإبرة بعناية من المحقنة ، واستخدم غطاء معقم لإغلاق العينة عن طريق قفل لور حتى لا تفقد أي عينة ، وقم بتسمية المحقنة بشكل مناسب.
ملاحظة: يجب أن يتم ذلك من قبل منسق البحث السريري أو الجراح أثناء إخراج الطفل.- بعد استخراج العينة ، قم بتخزين العينة في حقنة مغطاة عند -80 درجة مئوية ؛ يمكن وضع العينات على الثلج الجاف لنقلها إلى الفريزر المناسب من غرفة العمليات.
- ضع قطرة واحدة من قطرات العين المضادة للمضادات الحيوية حسب تفضيل الجراح على سطح العين الجراحية قبل إرسال المريض إلى الشفاء. هنا ، يتم استخدام قطرات العين الستيرويدية والمضادات الحيوية المركبة ، ولا يتم ترقيع العين.
- بمجرد اكتمال الإجراء ، يضمن طبيب التخدير المعالج نزع الأنبوب المناسب. أحضر المريض إلى الشفاء.
- إخراج المريض إلى المنزل وفقا لبروتوكول ما بعد الجراحة المؤسسية.
- أبلغ المريض أنه لا يلزم تغطية العين بأي ضمادة أو غطاء واقي.
- أبلغ المريض بعدم غمر رأسه بالكامل في الحمام أو حمام السباحة لمدة 24 ساعة ، والوالدين بعدم فرك عين المريض (الطفل) ؛ لا توجد قيود أخرى على نشاط المريض.
- أبلغ المريض أنه من غير المحتمل أن يعاني من الألم من البزل ولكن قد يعاني من الألم من الإجراءات المرتبطة به أثناء EUA. قد يتناول المريض الأسيتامينوفين أو الإيبوبروفين في حالة حدوث أي إزعاج ، كما اقترح الجراح.
2. عزل وتنقية cfDNA
- إجراء عزل الحمض النووي ومعالجته في غضون 72 ساعة من استخراج AH.
- قم بإذابة الثلج في درجة حرارة الغرفة. افحص العينة بشكل متكرر وتحرك نحو الاستخراج فور اكتمال الذوبان.
- استخرج cfDNA من AH وقم بإزالته إلى 50 ميكرولتر من محلول AVE (المضمن في المجموعة) باستخدام مجموعة عزل وتنقية cfDNA (انظر جدول المواد للحصول على التفاصيل) وفقا لدليل تعليمات الشركة المصنعة.
3. تسلسل الجيل التالي (NGS) ومراقبة الجودة (QC)
- قم بإنشاء مكتبات الحمض النووي للتسلسل باستخدام مجموعة تسلسل مكتبة الحمض النووي (انظر جدول المواد) وفقا لدليل تعليمات الشركة المصنعة. قم بتضخيم الحمض النووي للمكتبة باستخدام 14 دورة من تفاعل البوليميراز المتسلسل (PCR) كما هو مفصل في دليل مجموعة تسلسل مكتبة الحمض النووي.
ملاحظة: يمكن تخزين المكتبات النهائية عند -20 درجة مئوية حتى شهر واحد قبل التسلسل النهائي للتحليل الجيني. - تسلسل مكتبات الحمض النووي على منصة NGS (انظر جدول المواد) وفقا لبروتوكول الشركة المصنعة باتباع بروتوكول 50 دورة أحادي الطرف أو بروتوكول 150 دورة مزدوج.
ملاحظة: ستعمل منصات NGS الأخرى من حيث المبدأ (على الرغم من عدم تجربتها هنا) ، مع محولات مناسبة لخلية تدفق التسلسل. - قم بإجراء مراقبة الجودة لأي عينات AH تم أخذها في وقت التشخيص أو الاستئصال الأولي.
ملاحظة: لا يمكن إجراء مراقبة الجودة للعينات المأخوذة في نقاط زمنية أخرى لأن كتلة الحمض النووي ستكون منخفضة جدا وخارج نطاق الكشف للخطوات الموضحة أدناه.- استخدم 1 ميكرولتر من الحمض النووي المستخرج لكل من مقايسة قياس الحمض النووي ومقايسة تحديد حجم الحجم (انظر جدول المواد) وفقا لبروتوكولات الشركة المصنعة.
ملاحظة: يجب أن تكون الذروة حوالي 300 نقطة أساس. إذا كانت أقصر من 150 نقطة أساس ، فقد تم اختراق العينة. راجع الملف التكميلي 1A للحصول على مثال لعينة يجب أن تجتاز مراقبة الجودة والملف التكميلي 1B للحصول على مثال على الملف الذي لا ينبغي أن يجتاز.
- استخدم 1 ميكرولتر من الحمض النووي المستخرج لكل من مقايسة قياس الحمض النووي ومقايسة تحديد حجم الحجم (انظر جدول المواد) وفقا لبروتوكولات الشركة المصنعة.
4. تحليل بيانات تغيير رقم النسخ الجسدي (SCNA)
- قم بتعيين القراءات التي تم الحصول عليها من NGS (القسم 3) إلى الجينوم البشري (hg19 ، Genome Reference Consortium GRCh37 ، قاعدة بيانات متصفح الجينوم بجامعة كاليفورنيا سانتا كروز) 24،25 باستخدام التقويم.
- قم بإزالة تكرارات PCR (samtools rmdup26).
- تطبيع محتوى الجوانين والسيتوزين عن طريق حساب النسبة المئوية لقواعد الجوانين والسيتوزين في كل حاوية من الجينوم المرجعي. تم وصف نموذج البرنامج في Baslan et al.27.
- للحصول على أرقام نسخ مقطع الحمض النووي ، قسم الجينوم إلى 5000 صندوق متغير الطول ثم احسب العدد النسبي للقراءات الموجودة في كل صندوق.
- استخدم نسب log2 الخالية من المراجع لتحديد تقديرات رقم النسخ. خذ متوسط عدد النوافذ للكروموسومات الوراثية الطبيعية.
- قم بإجراء التجزئة باستخدام التجزئة الثنائية الدائرية باستخدام نسخ الحمض النووي (Bioconductor28).
- تعريف SCNAs على أنها موجبة عند انحراف بنسبة 20٪ من خط الأساس (نسبة log2 = 0) ، مما يعني أن الخسائر عند نسب log2 ≤ 0.2 (نسبة 0.87 أو أقل تحدد الحذف) والمكاسب عند نسب log2 ≥ 0.2 (النسبة 1.15 أو أعلى تحدد التضخيم).
ملاحظة: تتوافق هذه العتبات مع تحليلات الخزعة السائلة التي تم إنشاؤهامسبقا 27،29.
5. تحليل طفرات RB1 لعينات AH
- علاوة على ذلك ، قم بتضخيم مكتبات الجينوم بأكملها إلى 500 نانوغرام لكل منها ل NGS المستهدف القائم على الالتقاط للكشف عن الطفرات وفقا لبروتوكول الشركة المصنعة.
- قم بإجراء تسلسل أحادي الطرف مقترن بمنصة NGS بمعدل 150 نقطة أساس أو 50 نقطة أساس على المكتبات التي تم التقاطها إلى >100x لكل بروتوكول الشركة المصنعة.
- معالجة بيانات NGS. في هذه الدراسة ، يتم استخدام خط أنابيب داخلي يعتمد على خط أنابيب bcbio في مركز CHLA للطب الشخصي30.
- قم بقص بيانات fastq الأولية من المحولات والقواعد منخفضة الجودة باستخدام Atropos31 وقم بمحاذاة مرجع GRCh37 البشري باستخدام BWA-MEM و NovoAlign (v3) 32،33.
- ضع علامة على التكرارات باستخدام FreeBayes34 ثم حدد متغير السلالة الجرثومة.
ملاحظة: في أدوات استدعاء متغير FreeBayes ، تتم مقارنة كل موضع من جينوم العينة بالجينوم المرجعي ويتم نمذجة أعداد الأليل رياضيا للحصول على مقاييس احتمالية النمط الجيني34. - قم بإجراء تعليق توضيحي متغير باستخدام Ensembl Variant Effect Predictor (v96)35 التالية للخطوات 5.3.4-5.3.5.
- استخدم VarDict لتحديد المتغيرات الجسدية في AH أو الورم بدون عينة الدم الطبيعية المزدوجة (أي أعمى لمتغير السلالة الجرثومية)36.
- استدعاء فقدان تغاير الزيجوت إذا كانت المتغيرات المستمرة للمنطقة تحتوي على أليلات بديلة بنسبة ≤3٪.
ملاحظة: يمكن أيضا استخدام برنامج التحليل الجيني التجاري مع المعلمات المشار إليها أعلاه.
6. تحديد cfDNA TFx
- تقدير TFx لكل عينة AH cfDNA متسلسلة باستخدام برنامج ichorCNA (برنامج تقدير TFx المستند إلى CNA) 37.
ملاحظة: هذا هو البرنامج القياسي المستخدم في الخزعات السائلة القائمة على الدم لتحديد cfDNA TFx38. تم نشر استخدام البرنامج على AH سابقا21،23. - قم بمراجعة الملامح الجينومية وحلول TFx المقابلة بشكل فردي للتحقق من أن تقدير TFx لكل عينة مناسب39.
النتائج
النتائج الشاملة من عينين (الحالتان 33 و 47) معروضة أدناه. تظل أرقام الحالات متسقة مع المنشورات السابقة لأغراضالمقارنة 18،20،21. أعمى الأطباء المعالجون عن نتائج الخزعة السائلة AH أثناء العلاج. كانت جميع قرارات العلاج غير عشوائية واتخذت وفقا لمعيار الرعاية الروتيني الذي تم نشره سابقا40،41. ظلت بيانات النتائج السريرية منفصلة عن البيانات الجينومية حتى التحليل النهائي. تتوفر البيانات الأولية من النتائج المقدمة عند الطلب من المؤلف المراسل. نظرا لتمويل المعاهد الوطنية للصحة ، تخضع البيانات لسياسة مشاركة البيانات الجينومية للمعاهد الوطنية للصحة وستكون متاحة للباحثين الآخرين عبر مستودع بيانات مخصص للمعاهد الوطنية للصحة (dbGAP) في المستقبل. كما أنه متاح عن طريق طلب من المؤلف المعني.
الحالتان 33 و 47 كلاهما عيون IIRC GroupD 2 اللتين كان لهما عروض سريرية متشابهة جدا. وهكذا ، تم علاجهم بعلاج إنقاذ الكرة الأرضية بناء على قرار الوالدين وعلاج أطباء الأورام في العيون والطبية - وتحديدا بالعلاج الكيميائي الجهازي للحالة 47 والعلاج الكيميائي داخل الشرايين للحالة 33. استنادا إلى التكهن السريري المقبول حاليا والذي يعتمد على مجموعة IIRC للعين2 ، كان النجاح المتوقع لإنقاذ الكرة الأرضية لعيون هذين المريضين هو نفسه: 65٪ -70٪ للمجموعة D هو متوسط ، على الرغم من أن هذا يختلف باختلاف مركز العلاج41. ومع ذلك ، بناء على بيانات المجموعة D التي تم جمعها حتى الآن من التنميط الجزيئي الموجه للورم في هذا المركز ، فإن النجاح المتوقع لإنقاذ الكرة الأرضية سيكون 72٪ للحالة 47 (بدون تحديد كسب 6p في AH) و 9٪ للحالة 33 (مع تحديد كسب 6p) 18،20،21. هذا موضح أدناه.
الحالة 47 هي مثال على عين تم الكشف عنها بنجاح SCNA و SNV باستخدام منصة الخزعة السائلة AH في وقت التشخيص ، جنبا إلى جنب مع اتجاهات TFx المقابلة لاستجابة العلاج طوليا. المريضة هي أنثى قدمت في عمر 15 شهرا مع 14 مم × 9 مم IIRC المجموعة D ، المرحلة cT2b RB مع البذر الزجاجي الكرة. كانت سلبية لطفرة السلالة الجرثومية RB1 على النحو الذي يحدده اختبار الكريات البيض السريري الروتيني في الدم. من AH ، تم تحديد ربح RB SCNAs 1q و 6p في AH عند التشخيص ، بالإضافة إلى اثنين آخرين غير متكررين من RB SCNAs 7p خسارة و 13q (الشكل 2). وتجدر الإشارة إلى أن اتساع كسب 6p كان 1.2 ، وقد ثبت أن السعات البالغة نسبة 1.5 ≥ إلى المتوسط فقط تنذر بسوء التشخيص. بالنظر إلى عدم وجود تضخيم بؤري ل MYCN وكان كسب 6p أقل من عتبة 1.5 ، كان تشخيص الإنقاذ بالمعالجة القائمة على السمات الجزيئية مرتفعا. تم أيضا تقييم نفس عينة AH المأخوذة عند التشخيص للكشف عن المتغيرات المسببة للأمراض RB1 ، والتي كشفت عن SNV c.958C>T ، p.Arg320 * داخل جين RB1 بتردد أليل متغير يبلغ 87.01٪ (فاصل ثقة 95٪ ، 79.7٪ -94.6٪). تم علاج هذا المريض بست دورات من Carboplatin و Etoposide و Vincristine (CEV) مع انحدار المرض ولكنه أظهر بذرة مستمرة تشبه الكرة والغبار تتطلب ثلاث حقن متتالية داخل الجسم الزجاجي (IVM). أثناء علاج IVM ، أظهرت عينات AH A-C (كل منها مفصولة لمدة أسبوعين) تطبيعا كاملا للملف الجيني ، وانخفاضا في TFx ، وانخفاضا في تركيز الحمض النووي - كل ذلك بالتزامن مع الانحدار السريري للمرض (الشكل 3). بعد التشخيص ، ظلت قيم TFx أقل من حد الكشف البالغ 5٪ لبقية العلاج. بعد 19 شهرا من المتابعة ، ظلت العين مستقرة مع عدم تكرار الورم أو انتشار المرض خارج العين.
وهذا على النقيض من الحالة 33. كان لهذا الذكر البالغ من العمر 22 شهرا عرضا سريريا مشابها بشكل عام مع كتلة شبكية 11 مم × 18 مم وبذر زجاجي من نوع الغبار ، بما يتفق مع IIRC أحادي الجانب من المجموعة D ، المرحلة cT2b. كان سلبيا أيضا لطفرة السلالة الجرثومية RB1 على النحو الذي يحدده اختبار الكريات البيض في المصل السريري الروتيني. أظهر AH المأخوذ عند التشخيص ربح RB SCNAs 1q ، وكسب 6p (في هذه الحالة بسعة 1.5 نسبة إلى المتوسط) ، وخسارة 16q جنبا إلى جنب مع خسارة 6q البؤرية (الشكل 4 أ). بناء على الملف الجزيئي التنبؤي ، كان لدى هذه العين احتمالات زيادة في الاستئصال بمقدار 16.5 بناء على وجود سعة 6p ≥ 1.5. لم يتم تحديد RB1 SNV في هذه العينة ، على الرغم من التغطية الكاملة للطول الكامل لجين RB1 . أحد أسباب عدم تحديد RB1 SNV هو الأورام الأولية التي يحركها MYCN ، حيث لا يتوقع دائما حدوث طفرة RB1 متزامنة14،15،42،43،44،45. ومع ذلك ، لم تظهر الحالة 33 أي دليل على تضخيم MYCN في أي من عينات AH أو أنسجة الورم المنزوع (الشكل 5). التفسير الأكثر ترجيحا لنتيجة RB1 SNV السلبية هو أن تكوين الورم الأولي كان مدفوعا بخلل التنظيم اللاجيني (على سبيل المثال ، مثيلة المحفز) 46،47 ، وهي ظاهرة معروفة في RB والتي لن يتم تحديدها بواسطة الفحص الموصوف هنا.
كان العلاج الأولي لهذا المريض عبارة عن أربع دورات إجمالية من العلاج الكيميائي داخل الشرايين مع الملفالان تليها أربع حقن IVM بسبب البذر الزجاجي المستمر. تم الحصول على ثلاث عينات AH (كل منها مفصولة بأربعة أسابيع) أثناء العلاج ب IVM وأظهرت نفس SCNAs الثلاثة التي كانت موجودة عند التشخيص (الشكل 5). ظلت قيم TFx مرتفعة طوال فترة العلاج ، على الرغم من انخفاض حجم الورم الأولي الذي يعكس بذور الورم النشطة في الجسم الزجاجي. يوضح هذا كيف يمثل TFx حالة المرض العامة في العين. بعد ستة أشهر من التشخيص ، بسبب المرض النشط المستمر ، تم استئصال العين. أظهر الملف الجيني الذي تم الحصول عليه من أنسجة الورم في ذلك الوقت توافقا بنسبة 92.81٪ مع عينة AH التي تم الحصول عليها في وقت التشخيص (الشكل 4 ب).
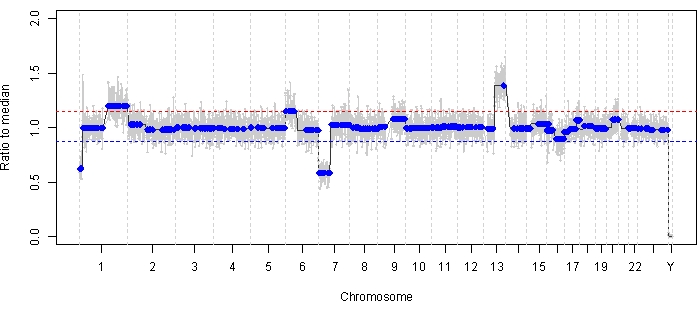
الشكل 2: الملف الجيني عند التشخيص للحالة 47. تم تحديد ربح RB SCNAs المتكرر للغاية 1q و 6p ، جنبا إلى جنب مع خسارة RB SCNAs غير المتكررة للغاية 7p وكسب 13q ، في AH المأخوذ في وقت التشخيص. يمثل الخط الأحمر عتبة الربح ، بينما يمثل الخط الأزرق عتبة الخسارة. والجدير بالذكر أن اتساع كسب 6p كان <1.5 نسبة إلى الوسيط ، وهو أقل من عتبة التوقيع الجزيئي الذي ينذر بتشخيص ضعيف. وبالتالي ، بناء على عدم وجود مؤشرات حيوية سلبية لإنقاذ العين ، من المتوقع أن تستجيب هذه العين للعلاج. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
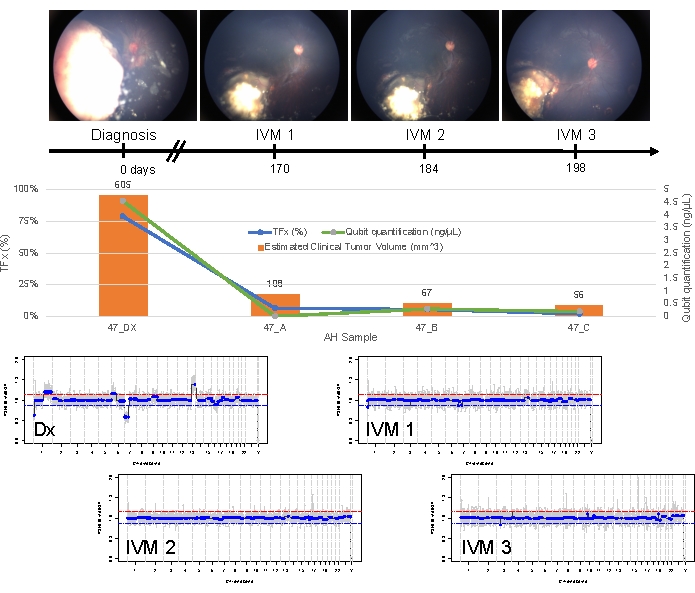
الشكل 3: المعلومات الطولية للحالة 47. يتضمن ذلك صور قاع العين ، والقياس الكمي cfDNA ، والحجم المقدر للورم السريري من قياسات B-scan ، والملامح الجينومية ، وتقديرات TFx لكل نقطة زمنية سريرية تم فيها أخذ عينات AH (Dx = التشخيص ، A = IVM1 ، B = IVM2 ، C = IVM3). استجابت هذه العين للعلاج وظلت منقذة بعد 19 شهرا من المتابعة. لوحظ انخفاض في كمية cfDNA بمرور الوقت ، بما يتفق مع الدراسات المنشورة سابقا والتي تظهر أعلى عائد تم الحصول عليه عند التشخيص. انخفض TFx أيضا على العلاج ، مما يعكس دقة البذر والانخفاض في حجم ورم الشبكية الرئيسي (يشار إلى أحجام الورم فوق الشريط البرتقالي لكل نقطة زمنية سريرية). كما هو متوقع مع الانحدار السريري للمرض ، تم تطبيع الملامح الجينومية أيضا. في الملامح الجينومية ، يمثل الخط الأحمر عتبة الربح ، بينما يمثل الخط الأزرق عتبة الخسارة. أعيد طبع هذا الرقم بإذن من Xu، L. et al.21. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
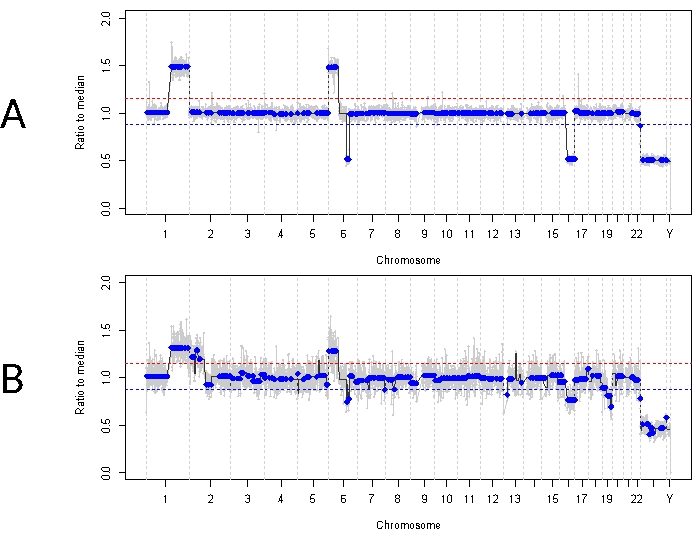
الشكل 4: الملامح الجينومية للحالة 33. يمثل الخط الأحمر عتبة الربح ، بينما يمثل الخط الأزرق عتبة الملف الجيني للخسارة (A) عند تشخيص الحالة 33. تم تحديد ربح RB SCNAs المتكرر للغاية 1q ، وكسب 6p ، و 16q خسارة في AH عند التشخيص ، بالإضافة إلى خسارة 6q البؤرية. والجدير بالذكر أن اتساع كسب 6p كان 1.5 نسبة إلى الوسيط ، مما يشير إلى ضعف المؤشر الحيوي الجزيئي التنبؤي. وبالتالي ، بناء على هذا التوقيع الجزيئي ، نتوقع أن هذه العين لديها احتمالية متزايدة بشكل كبير لفشل العلاج. (ب) المظهر الجيني الذي تم الحصول عليه من أنسجة الورم المفصولة ، والتي كانت متوافقة للغاية مع المظهر الجانبي الذي تم الحصول عليه من AH عند التشخيص. بسبب الاختلاط بأنسجة الشبكية الطبيعية ، يمكن أن تظهر SCNAs من أنسجة الورم سعة أقل مقارنة ب AH بسبب TFx المخفف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
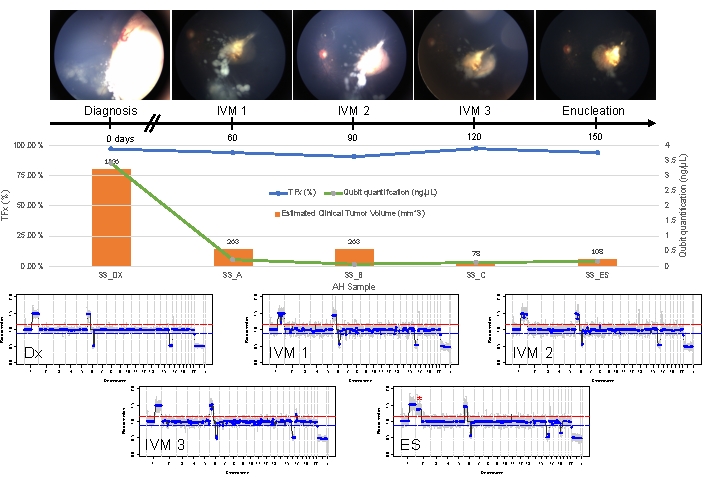
الشكل 5: المعلومات الطولية للحالة 33. يتضمن ذلك صور قاع العين ، وقياس الحمض النووي الخالي من الخلايا ، وحجم الورم السريري المقدر من قياسات المسح B (يشار إلى أحجام الورم فوق الشريط البرتقالي لكل نقطة زمنية سريرية) ، والملامح الجينومية ، وتقديرات TFx لكل نقطة زمنية سريرية تم فيها أخذ عينات من AH (Dx = التشخيص ، A = IVM1 ، B = IVM2 ، C = IVM3 ، SE = الاستئصال الثانوي). لم تستجب هذه العين للعلاج ، وتطلبت في النهاية استئصال ثانوي (ES). كان هذا بسبب البذر النشط باستمرار المصحوب بتكرار الورم القمي. انخفضت كمية CfDNA بمرور الوقت ، بما يتفق مع الدراسات المنشورة سابقا التي تظهر أعلى عائد تم الحصول عليه عند التشخيص (ربح 1q ، وكسب 6p ، وخسارة 16q ، وخسارة 6q البؤرية). ومع ذلك ، ظل TFx مرتفعا طوال فترة العلاج ، وهو نتاج البذر المستمر الذي لا يزال يلقي cfDNA المشتق من الورم في AH. كانت الملامح الجينومية متسقة وأظهرت نفس SCNAs الثلاثة التي كانت موجودة عند التشخيص. في AH الذي تم الحصول عليه في ES ، شوهد مكاسب جديدة واسعة النطاق 2p (*) وخسارة 19q ، مما يشير إلى التطور النسيلي في وقت تكرار الورم القمي. في الملامح الجينومية ، يمثل الخط الأحمر عتبة الربح ، بينما يمثل الخط الأزرق عتبة الخسارة. أعيد طبع هذا الرقم بإذن من Xu، L. et al.21. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: مثال على (أ) عينة يجب أن تجتاز مراقبة الجودة ، مع ذروتها حوالي 300 نقطة أساس و (ب) عينة لا يجب أن تجتاز مراقبة الجودة ، مع ذروتها حوالي 150 نقطة أساس. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
بزل القرنية الشفاف هو إجراء يتم إجراؤه بشكل شائع لمؤشرات تشخيصية و / أو علاجية متعددة في طب العيون. على وجه التحديد بالنسبة ل RB ، فهو جزء من بروتوكول حقن العلاج الكيميائي داخل الجسم الزجاجي القياسي لتقليل ضغط العين قبل الحقن لمنع الارتجاع إلى موقعالحقن 48. على الرغم من كونه إجراء شائعا ، إلا أنه لا يخلو تماما من المخاطر. كانت العقيدة السابقة هي أن الإبرة لا ينبغي أبدا أن تدخل العين مع RB النشط. تطورت هذه العقيدة على مدار العقد الماضي ، أولا من خلال العمل التكويني من باتريشيا شيفيز باريوس حول العلاج بالنواقل الفيروسية الغدية المحقون49 متبوعا بطرق معززة للسلامة التدريجية لحقن العين في RB بواسطة فرانسيس مونييه48. مهد هذا العمل الطريق لاستخراج AH لاستخدامه كخزعة سائلة ، أو بديل لخزعة الورم ، لهذا السرطان. نحن الآن أول مركز يبلغ عن فائدة المنصة ونتائج السلامة الأولية من AH التي تم أخذها في وقت التشخيص. يهدف جزء من الطرق الموضحة هنا إلى ضمان سلامة اختيار المريض والجوانب الإجرائية لاستخراج AH ل RB. أولا ، يمكن أن تدخل الإبر إلى الغرفة الأمامية فقط ويجب ألا تتلامس مع القزحية أو العدسة ، حيث يمكن أن يتسبب ذلك في تندب القزحية أو إعتام عدسة العين الذي يحد من قدرة الجراح على مراقبة الورم. من المهم جدا ألا تدخل الإبرة أبدا في التجويف الزجاجي (ما لم تقترن بتوصيل العلاج الكيميائي كما هو الحال بالنسبة للإدارة المتكاملة للركاب) ، أو تلامس الورم لأن هذا يزيد افتراضيا من خطر بذر الورم وتمدد المرض خارج العين3،4،5. كلا هذين الهيكلين خلفيان للغرفة الأمامية ويفصلان عنها العدسة والقزحية. لتجنب تلف أي هياكل عينية ، من المهم إبقاء الإبرة مشطوفة في جميع الأوقات ، فوق القزحية المحيطية ، ودائما تحت التصور المباشر باستخدام المجهر الجراحي. هناك خطر حدوث تسرب طفيف ل AH من موقع الإبرة. إذا حدث هذا ، حلها بضغط لطيف عبر قضيب بطرف قطني. سيؤدي استخدام أصغر إبرة قياس متاحة والتأكد من استخراج الإبرة ببطء من نفس المسالك دون أي قص جانبي إلى تقليل هذا الخطر. على الرغم من توقع ضحل طفيف في الغرفة الأمامية ، إلا أن الغرفة يجب أن تظل مكونة دون لمسة القزحية ، ويجب أن يكون ضغط العين ناعما ، ولكنه فسيولوجي.
فيما يتعلق بالتحليلات الجينومية ، هناك العديد من الخطوات الحاسمة المتضمنة. الأهم هو التعامل مع العينة ذات الحجم الصغير بمجرد استخراجها من العين. من الأهمية بمكان أن تظل العينة مجمدة طوال الوقت قبل المعالجة لمنع تدهور الحمض النووي الذي يمكن أن يحدث مع دورات التجميد والذوبانالمتكررة 50. يساعد ضمان وضع العينات على الثلج الجاف مباشرة بعد استخراجها ونقلها إلى فريزر -80 درجة مئوية على ضمان ذلك. بمجرد بدء معالجة العينات ، تكون خطوات مراقبة الجودة هي الفرصة الرئيسية لاستكشاف الأخطاء وإصلاحها من خلال ضمان إنشاء cfDNA في مكتبات عالية الجودة. باستخدام قياس الحمض النووي ومقايسة توصيف حجم جزء الحمض النووي ، يمكن إجراء مراقبة الجودة على العينات المأخوذة أثناء الاستئصال الأولي أو في وقت التشخيص بسبب ارتفاع إنتاجية cfDNA الموجودة في هذهالعينات 18،21. عندما تكون الذروة التي تم الحصول عليها حوالي 300 نقطة أساس ، فإن هذا يضمن التعرف على cfDNA بواسطة منصة NGS. إذا كانت الذروة التي تم الحصول عليها أقصر من 150 نقطة أساس مما يشير إلى أن غالبية الأجزاء المكتشفة هي بادئات بناء المكتبة أو أوليغوس محول ، فقد تم اختراق العينة ويجب عدم معالجتها بشكل أكبر من أجل SCNAs. ومع ذلك ، في تجربتنا في معالجة مئات العينات ، يجب إزالة أقل من 5٪ لمراقبة الجودة بسبب ضعف نسبة محاذاة القراءات20. إلى جانب الطرق التي قمنا بتوحيدها لجمع العينات ومعالجتها وتخزينها ومعالجتها ، يوضح هذا الإجراء الصلاحية التحليلية المسبقة لمنصة الخزعة السائلة AH.
أثبتت الخزعة السائلة AH أيضا صلاحية تحليلية بناء على قدرتها على اكتشاف الطفرات المسببة للأمراض RB1 و SCNAs بدقة وموثوقية ، مع متوسط التوافق باستمرار >95٪ بين الملامح الجينومية التي تم إنشاؤها من عينات AH والأنسجة السرطانية المقابلة18،20،21،22،23. على الرغم من الصلاحية التحليلية المثبتة للمنصة ، إلا أنها لا تخلو من قيود. لا يمكن إجراء التحليل الطفري RB1 إلا على عينات تحتوي على >10 نانوغرام من cfDNA ، والتي يتم الحصول عليها بشكل متكرر في عيون ساذجة العلاج في وقت التشخيص أو الاستئصال الأولي18،21. ويرجع ذلك إلى انخفاض تركيز cfDNA الموجود في عينات AH من العيون التي تخضع للعلاج بنشاط مقارنة ب AH عند التشخيص أو في وقت الاستئصال الأولي. هناك قيد إضافي يتمثل في أنه لا يمكن اكتشاف SCNAs عند TFxs أقل من 5٪ ، مما يمنع مراقبة المرض في العين حيث انخفض عبء الورم بشكل كبير. في تجربتنا ، يحدث هذا بشكل شائع في العيون المستجيبة للعلاج الكيميائي داخل الجسم الزجاجي23.
من أجل تحديد TFx ل cfDNA في AH ، يتم استخدام برنامج تقدير TFx المستند إلى CNA. هذا البرنامج هو أداة قياسية ومقبولة لحساب TFx في الخزعات السائلة ، وقد تم وصف خوارزميته بالتفصيل38،51. باختصار ، يتنبأ برنامج تقدير TFx المستند إلى CNA ب SCNAs واسعة النطاق داخل cfDNA المتتسلسل باستخدام نموذج ماركوف المخفي. يتم اشتقاق تقديرات TFx بناء على وجود SCNAs مع حساب الاختلافات في الاستنساخ الفرعي والبلويدي في كل موضع ، ومن هذه ، يختار برنامج تقدير TFx المستند إلى CNA حل TFx الأمثل38. ومع ذلك ، فإن القيد المتأصل في برنامج تقدير TFx المستند إلى CNA هو أن TFx يتم حسابه بناء على وجود SCNAs في العينة. وبالتالي ، فإنه غير قادر على تحديد TFx في العينات التي لا تحتوي على SCNAs (أي مع ملفات تعريف جينومية مسطحة)38. كما تم توضيح سابقا ، لا تحتوي جميع أورام RB علىSCNAs 14،15،18،21،23،45. لذلك ، فإن TFx المنخفض جدا كما هو محدد بواسطة برنامج تقدير TFx المستند إلى CNA يعني إما أن عينة AH لا تحتوي على cfDNA مشتق من الورم قابلة للقياس أو 2) يوجد cfDNA للورم ، ولكن لا يمكن اكتشافه بواسطة برنامج تقدير TFx المستند إلى CNA بسبب نقص SCNAs38. جزء الأليل المتغير (VAF) ل SNV هو بديل ل TFx. لهذا السبب ، نحن نعمل على تطوير خط أنابيب TFx قائم على RB1 يعتمد على VAF من أجل السماح لعيون RB بدون SCNAs بتلقي مراقبة TFx الطولية أيضا. بالنظر إلى أن جميع أورام RB ، مع استثناءات للأورام الأولية التي تحركها MYCN 14،15،42،43،44،45 ، تحتوي على طفرات جسدية في جين RB1 ، فإن خط الأنابيب الذي لا يعتمد على SCNAs من شأنه أن يوسع تطبيق بروتوكول الخزعة السائلة المقدم هنا. بالإضافة إلى ذلك ، نظرا لأنه يمكن مراقبة SNVs إلى TFxs أقل من 5٪ ، فإن هذا من شأنه أن يزيد من حساسية نظامنا الأساسي.
منصة الخزعة السائلة AH الموضحة هنا ليست منصة الخزعة السائلة الوحيدة الموجودة في الأدبيات الخاصة ب RB ، ولكن على وجه الخصوص ، فهي أول من يصف المائي بأنه مصدر غني للحمض النووي للورم وأول من يصف اكتشاف ctDNA عبر آليتين (SCNAs و RB1 SNVs) في أي سائل حيوي بناء على العمل المنشور حتى الآن. مع القدرة على اكتشاف ctDNA بطريقتين ، تتمتع الخزعة السائلة AH بحساسية أعلى من المنصات الأخرى في الأدبيات. على سبيل المثال ، نجحت مجموعة أخرى في اكتشاف RB ctDNA في AH مع RB1 SNVs52. ومع ذلك ، اعتمدت هذه المنصة على قراءات NGS المستهدفة بناء على معرفة مسبقة ب SNV. في المقابل ، تستخدم المنصة المفصلة في هذه المخطوطة WGS غير متحيزة ، مما يمنحها القدرة على اكتشاف SCNAs و SNVs. تمت تجربة الخزعات السائلة القائمة على الدم أيضا ، على الرغم من أن cfDNA الذي تم الحصول عليه كان دائما أقل من عتبة اكتشاف SCNA ، وهو التشخيص لاحتمالية إنقاذ العين (في هذا الوقت ، لم يثبت أن RB1 SNVs تنبؤية بإنقاذ العين ، ومع ذلك ، قد يكون هناك دور متطور للكشف عن المرض النقيلي)19. وصف Kothari et al. RB1 SNVs في بلازما مرضى RB ، ولكن فقط أولئك الذين يعانون من مرض متقدم داخل العين يتطلب الاستئصال16. تتمتع منصة الخزعة السائلة AH الموصوفة هنا بالقدرة على اكتشاف ctDNA في AH للعيون الأقل تقدما ، حتى بدون وجود بذر19،21. علاوة على ذلك ، فإن الخزعات السائلة القائمة على الدم ليست خاصة بالعين ، حيث قد يكون ctDNA المعزول من المصل من كلتا العينين في حالات RB الثنائي. هذا يحد من الفائدة السريرية للمنصات القائمة على الدم ، لا سيما في المرضى الثنائيين الذين يشكلون 40٪ من حالات RB ، بينما يظل AH خاصا بالعين ويمكن أن يظهر عدم التجانس بين العين في كل من مستويات SNV و SCNA53.
أهمية خزعة السائل AH لمجال RB أمر بالغ الأهمية. لا توفر الخزعة السائلة AH الفرصة لفهم الديناميكيات داخل الورم بشكل أفضل في العيون التي تخضع للعلاج بنشاط ، ولكن لديها أيضا القدرة على تحسين رعاية المرضى. بناء على الدراسات السابقة ، أنشأنا توقيعا جزيئيا - بناء على وجود تضخيم MYCN أو كسب الكروموسوم 6p بسعة ≥1.5 نسبة إلى الوسيط - وهو تنبؤي بزيادة احتمالية فشل العلاج بمقدار 16.5 ضعفا التي تتطلب الاستئصال18،20،21. مع هذه المعرفة في وقت التشخيص ، سيكون الأطباء أكثر قدرة على تقديم المشورة للعائلات بشأن خيارات العلاج المناسبة واحتمالية إنقاذ العين باستخدام العلاجات الحالية. على الرغم من أن الصلاحية السريرية لمنصة الخزعة السائلة AH ل RB قد تمتحديدها 17،18،19،20،21،22،23 ، إلا أنها معتمدة حاليا للبحث فقط. هناك حاجة إلى دراسات مستقبلية أكبر متعددة المراكز قبل تنفيذ الخزعة السائلة AH سريريا للمساعدة في توجيه رعاية المرضى ل RB. بغض النظر ، فإن الخزعة السائلة AH لديها القدرة على تمكين علم الأورام الدقيق في المستقبل ، ليس فقط لسرطان العين ، ولكن أيضا لأورام العين الأخرى.
Disclosures
قدم جيسي بيري ولييا شو وجيمس هيكس طلب براءة اختراع بعنوان الحمض النووي الخالي من الخلايا المائية للفكاهة للتقييم التشخيصي والتشخيصي لأمراض العيون. خلاف ذلك ، أبلغ المؤلفون عن عدم وجود تضارب محتمل في المصالح.
Acknowledgements
تم دعم هذا البحث من قبل المصادر التالية: NCI لجائزة المعاهد الوطنية للصحة K08CA232344 (إلى J. L. Berry) ؛ هيونداي هوب على عجلات RGA012351 (إلى جي إل بيري) ؛ صندوق سرطان العين في مرحلة الطفولة (إلى جي إل بيري) ؛ جمعية السرطان الأمريكية IRG-16-181-57 (إلى جي إل بيري) ؛ مؤسسة رايت (إلى جي إل بيري وإم إي كيم) ؛ مؤسسة فرسان الهيكل للعين (إلى جي إل بيري) ؛ مؤسسة لاري وسيليا موه (إلى جي إل بيري) ؛ معهد العائلات ، إنك ، مستشفى الأطفال في لوس أنجلوس (جي إل بيري) ؛ منحة إدارية غير مقيدة من البحث لمنع العمى (الكل) ؛ P30CA014089 المعهد الوطني للسرطان (الكل) ؛ صندوق أبحاث فيكي جوزيف (إلى P. Kuhn) ؛ صندوق أبحاث كارول فاسيلياديس (إلى P. Kuhn) ؛ وكلية USC Dornsife للآداب والفنون والعلوم (إلى P. Kuhn).
Materials
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | surgical grade, whatever available in hospital | ||
| 32 G needle | surgical grade, whatever available in hospital | ||
| Aligner | Authors use Bowtie2 (http://bowtie-bio.sourceforge.net/bowtie2/index.shtml) but other aligners such as BWA or GRCh38 will also work | ||
| Atropos | generic term: adapter remover. https://atropos.readthedocs.io/en/latest/index.html# | ||
| Bioanalyzer High Sensitivity DNA Kit | Agilent | 5067-4626 | generic term: DNA fragment size profiling assay |
| BWA-MEM | generic term: long sequence aligner. http://bio-bwa.sourceforge.net/bwa.shtml | ||
| DNAcopy | Bioconductor | generic term: DNA copy number data analysis. https://bioconductor.org/packages/release/bioc/html/DNAcopy.html | |
| dsDNA High Sensitivity Assay | Qubit | Q32851 | generic term: DNA quantification assay |
| FreeBayes | generic term: sequence variant determiner. https://github.com/freebayes/freebayes | ||
| ichorCNA software | generic term: CNA-based TFx estimation. https://github.com/broadinstitute/ichorCNA | ||
| Illumina platform | Illumina | generic term: NGS platform; please note that other NGS platforms will work in principle, but have not been trialed by these authors | |
| NovoAlign (v3) | Novocraft | generic term: mapping of short reads onto reference genome. http://www.novocraft.com/products/novoalign/ | |
| QIAamp Circulating Nucleic Acid Kit | Qiagen | 55114 | generic term: cfDNA isolation and purification kit |
| QIAseq Ultralow Input Library Kit | Qiagen | 180492 | generic term: DNA library sequencing kit |
| Samtools rmdup | generic term: tool to remove duplicate reads. http://www.htslib.org/doc/samtools-rmdup.html | ||
| VarDict | generic term: variant caller. https://github.com/AstraZeneca-NGS/VarDict | ||
| Variant Effect Predictor | Ensembl | generic term: variant effect determinator. https://uswest.ensembl.org/info/docs/tools/vep/index.html |
References
- Fernandes, A. G., Pollock, B. D., Rabito, F. A. Retinoblastoma in the United States: A 40-year incidence and survival analysis. Journal of Pediatric Ophthalmology & Strabismus. 55 (3), 182-188 (2018).
- Linn, A. M. Intraocular retinoblastoma: the case for a new group classification. Ophthalmology Clinics of North America. 18 (1), 41-53 (2005).
- Shields, J. A., Shields, C. L., Ehya, H., Eagle, R. C., De Potter, P. Fine-needle aspiration biopsy of suspected intraocular tumors. The 1992 Urwick lecture. Ophthalmology. 100 (11), 1677-1684 (1993).
- Karcioglu, Z. A., Gordon, R. A., Karcioglu, G. L. Tumor seeding in ocular fine needle aspiration biopsy. Ophthalmology. 92 (12), 1763-1767 (1985).
- Karcioglu, Z. A. Fine needle aspiration biopsy (FNAB) for retinoblastoma. Retina. 22 (6), 707-710 (2002).
- Eide, N., Syrdalen, P., Walaas, L., Hagmar, B. Fine needle aspiration biopsy in selecting treatment for inconclusive intraocular disease. Acta Ophthalmologica Scandinavica. 77 (4), 448-452 (1999).
- Eide, N., Walaas, L. Fine-needle aspiration biopsy and other biopsies in suspected intraocular malignant disease: a review. Acta Ophthalmologica. 87 (6), 588-601 (2009).
- Eriksson, O., Hagmar, B., Ryd, W. Effects of fine-needle aspiration and other biopsy procedures on tumor dissemination in mice. Cancer. 54 (1), 73-78 (1984).
- Ali, M. J., Honavar, S. G., Vemuganti, G. K., Singh, A. D. Fine needle aspiration biopsy of retinal tumors. Monographs in Clinical Cytology. 21, 72-81 (2012).
- Di Nicolantonio, F. a. l., et al. The chemosensitivity profile of retinoblastoma. Recent Results in Cancer Research. 161, 73-80 (2003).
- Francis, J. H., et al. Efficacy and toxicity of second-course ophthalmic artery chemosurgery for retinoblastoma. Ophthalmology. 122 (5), 1016-1022 (2015).
- Francis, J. H. Efficacy and toxicity of intravitreous chemotherapy for retinoblastoma: Four-year experience. Ophthalmology. 124 (4), 488-495 (2017).
- Francis, J. H., et al. Current treatment of bilateral retinoblastoma: The impact of intraarterial and intravitreous chemotherapy. Neoplasia. 20 (8), 757-763 (2018).
- Rushlow, D. E., et al. Characterisation of retinoblastomas without RB1 mutations: genomic, gene expression, and clinical studies. The Lancet Oncology. 14 (4), 327-334 (2013).
- Afshar, A. R., et al. Next-generation sequencing of retinoblastoma identifies pathogenic alterations beyond RB1 inactivation that correlate with aggressive histopathologic features. Ophthalmology. 127 (6), 804-813 (2020).
- Kothari, P. Cell-free DNA profiling in retinoblastoma patients with advanced intraocular disease: An MSKCC experience. Cancer Medicine. 9 (17), 6093-6101 (2020).
- Berry, J. L., et al. Potential of aqueous humor as a surrogate tumor biopsy for retinoblastoma. JAMA Ophthalmology. 135 (11), 1221-1230 (2017).
- Berry, J. L., et al. Genomic cfDNA analysis of aqueous humor in retinoblastoma predicts eye salvage: the surrogate tumor biopsy for retinoblastoma. Molecular Cancer Research. 16 (11), 1701-1712 (2018).
- Berry, J. L., et al. Aqueous humor is superior to blood as a liquid biopsy for retinoblastoma. Ophthalmology. 127 (4), 552-554 (2020).
- Xu, L., et al. Chromosome 6p amplification in aqueous humor cell-free DNA Is a prognostic biomarker for retinoblastoma ocular survival. Molecular Cancer Research. 18 (8), 1166-1175 (2020).
- Xu, L., et al. Establishing the clinical utility of ctDNA analysis for diagnosis, prognosis, and treatment monitoring of retinoblastoma: The aqueous humor liquid biopsy. Cancers. 13 (6), (2021).
- Xu, L. Simultaneous identification of clinically relevant RB1 mutations and copy number alterations in aqueous humor of retinoblastoma eyes. Ophthalmic Genetics. 41 (6), 526-532 (2020).
- Polski, A., et al. Longitudinal aqueous humor sampling reflects treatment response in retinoblastoma patients. Investigative Ophthalmology & Visual Science. 61 (7), 1394 (2020).
- . Genome Browser Available from: https://genome.ucsc.edu/cgi-bin/hgTracks?db=hg19&lastVirtModeType=default&lastVirtModeExtraState=&virtModeType=default&3A15578261%_2D15621068&hgsid=1135765621_qIuA0U (2021)
- Navarro Gonzalez, J., et al. The UCSC genome browser database: 2021 update. Nucleic Acids Research. 49 (1), 1046-1057 (2021).
- Li, H. A statistical framework for SNP calling, mutation discovery, association mapping and population genetical parameter estimation from sequencing data. Bioinformatics. 27 (21), 2987-2993 (2011).
- Baslan, T., et al. Genome-wide copy number analysis of single cells. Nature Protocols. 7 (6), 1024-1041 (2012).
- Huber, W., et al. Orchestrating high-throughput genomic analysis with Bioconductor. Nature Methods. 12 (2), 115-121 (2015).
- Baslan, T., et al. Erratum: Genome-wide copy number analysis of single cells. Nature Protocols. 11 (3), 1024-1041 (2016).
- Didion, J. P., Martin, M., Collins, F. S. Atropos: specific, sensitive, and speedy trimming of sequencing reads. PeerJ. 5, 3720 (2017).
- Li, H. Aligning sequence reads, clone sequences and assembly contigs with BWA-MEM. arXiv. , (2013).
- Garrison, E., Marth, G. Haplotype-based variant detection from short-read sequencing. arXiv. , (2012).
- McLaren, W., et al. The ensembl variant effect predictor. Genome Biology. 17 (1), 122 (2016).
- Lai, Z., et al. VarDict: a novel and versatile variant caller for next-generation sequencing in cancer research. Nucleic Acids Research. 44 (11), 108 (2016).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA (2017)
- Adalsteinsson, V. A., et al. Scalable whole-exome sequencing of cell-free DNA reveals high concordance with metastatic tumors. Nature Communications. 8 (1), 1-13 (2017).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA/wiki/Interpreting-ichorCNA-results (2017)
- Berry, J. L., et al. Long-term outcomes of Group D retinoblastoma eyes during the intravitreal melphalan era. Pediatric Blood & Cancer. 64 (12), (2017).
- Berry, J. L., et al. Long-term outcomes of Group D eyes in bilateral retinoblastoma patients treated with chemoreduction and low-dose IMRT salvage. Pediatric Blood & Cancer. 60 (4), 688-693 (2013).
- Francis, J. H., et al. Molecular changes in retinoblastoma beyond RB1: Findings from next-generation sequencing. Cancers (Basel). 13 (1), (2021).
- Schwermer, M., et al. Comprehensive characterization of RB1 mutant and MYCN amplified retinoblastoma cell lines. Experimental Cell Research. 375 (2), 92-99 (2019).
- Davies, H. R. Whole-genome sequencing of retinoblastoma reveals the diversity of rearrangements disrupting RB1 and uncovers a treatment-related mutational signature. Cancers. 13 (4), 754 (2021).
- Lillington, D. M., et al. Comparative genomic hybridization of 49 primary retinoblastoma tumors identifies chromosomal regions associated with histopathology, progression, and patient outcome. Genes, Chromosomes and Cancer. 36 (2), 121-128 (2003).
- Greger, V., et al. Frequency and parental origin of hypermethylated RB1 alleles in retinoblastoma. Human Genetics. 94 (5), 491-496 (1994).
- Raizis, A. M., et al. DNA hypermethylation/boundary control loss identified in retinoblastomas associated with genetic and epigenetic inactivation of the RB1 gene promoter. Epigenetics. 1-15, (2020).
- Munier, F. L., et al. Profiling safety of intravitreal injections for retinoblastoma using an anti-reflux procedure and sterilisation of the needle track. British Journal of Ophthalmology. 96 (8), 1084-1087 (2012).
- Chévez-Barrios, P., et al. Response of retinoblastoma with vitreous tumor seeding to adenovirus-mediated delivery of thymidine kinase followed by ganciclovir. Journal of Clinical Oncology. 23 (31), 7927-7935 (2005).
- Shao, W., Khin, S., Kopp, W. C. Characterization of effect of repeated freeze and thaw cycles on stability of genomic DNA using pulsed field gel electrophoresis. Biopreservation and Biobanking. 10 (1), 4-11 (2012).
- Choudhury, A. D., et al. Tumor fraction in cell-free DNA as a biomarker in prostate cancer. JCI Insight. 3 (21), (2018).
- Gerrish, A., et al. Non-invasive diagnosis of retinoblastoma using cell-free DNA from aqueous humour. British Journal of Ophthalmology. 103 (5), 721-724 (2019).
- Wong, E. Y., Xu, L., Shen, L. Inter-eye genomic heterogeneity in bilateral retinoblastoma via aqueous humor liquid biopsy. NPJ Precis Oncol. 5 (1), 73 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved