Method Article
Retinoblastomda Likit Biyopsi Olarak Sulu Mizah: Berrak Kornea Parasentezi ve Genomik Analiz
Bu Makalede
Özet
Sulu mizah, göz dışı yayılma riski nedeniyle in vivo biyopsi yapılamayan göz içi kanseri retinoblastom için yüksek verimli bir sıvı biyopsidir. Burada, şeffaf kornea parasentezi ile sulu mizahın güvenli bir şekilde ekstrakte edilmesi için bir yöntem ve prognostik biyobelirteçleri tanımlamak için genomik analiz adımları sunulmaktadır.
Özet
Bu hastalarda doğrudan tümör biyopsisinin yasak olduğu göz önüne alındığında, retinoblastom için bir sıvı biyopsi platformunun uygulanması için önemli bir potansiyel klinik fayda vardır. Sulu hümör (AH), tümörden ayrı bir bölmede oluşur, ancak aynı oküler boşluk içinde yer alır. Bu nedenle, bu hastalık için sıvı biyopsi veya tümör biyopsisine vekil olarak kullanılabilecek zenginleştirilmiş bir göze özgü tümöral genomik bilgi kaynağıdır. Bu el yazması, retinoblastom gözlerinden AH'nin şeffaf kornea parasentezi yoluyla güvenli bir şekilde çıkarılması için bir metodolojiyi detaylandırmaktadır. Ek olarak, hücresiz DNA izolasyonu ve saflaştırması, yeni nesil dizileme, somatik kopya sayısı değişikliği (SCNA) analizi, RB1 tek nükleotid varyantı (SNV) mutasyon tanımlaması ve tümör fraksiyonu tahmini dahil olmak üzere genomik analiz adımları sunulmaktadır. AH likit biyopsi platformunun pre-analitik, analitik ve erken klinik geçerliliği değerlendirildi; Ancak, sınırlamalar olmadan değildir. Bunlar büyük ölçüde, testin belirli adımları için gerekli olan hücresiz DNA miktarının bir sonucudur. Şu anda retinoblastom için araştırılmakta olan diğer kan bazlı sıvı biyopsi platformlarıyla karşılaştırıldığında, AH tabanlı bir platform, gözden çıkarılabilecek biyosıvı hacmi (ve dolayısıyla DNA miktarı) ile sınırlıdır; yararı, AH'nin göze özgü olmasıdır. Burada tartışılan platform, AH'de dolaşan tümör DNA'sını iki mekanizma (SCNA'lar ve RB1 SNV'ler) aracılığıyla tespit etmesi ve tümöral genomik bilgiyi tanımlamak için daha yüksek bir hassasiyet sağlaması bakımından benzersizdir. AH likit biyopsisi, retinoblastom hastaları için hassas onkolojiye doğrudan klinik uygulama potansiyeline sahiptir ve AH her gözdeki tümörlere özgü olduğu için iki taraflı hastalığı olan hastalar için özellikle önemlidir. Bu platformun diğer oküler tümörleri olan hastalara da uygulamaları ile ilgili araştırmalar devam etmektedir.
Giriş
Retinoblastom (RB) nadir ve kendine özgü bir kanserdir. Bebeklerin ve küçük çocukların gelişmekte olan retinasında oluşan en yaygın primer göz içi malignitesi olmakla birlikte, dünyada yılda sadece yaklaşık 7000 vaka vardır ve bunların yaklaşık 250-300'ü Amerika Birleşik Devletleri'ndedir. Gelişmişülkelerde hasta sağkalımı %98'e yaklaşmasına rağmen1, klinik olarak Uluslararası Göz İçi RB Sınıflandırması (IIRC)2 Grup D/E veya AJCC cT2b/3 olarak sınıflandırılan ileri gözler için oküler sağkalım çok daha düşüktür. Bu ilerlemiş gözlerin çoğu ya primer (ilk tedavi olarak) ya da ikincil olarak (başarısız glob kurtarma tedavisi girişimlerinden sonra) enüklee edilir. Oküler onkolojinin mevcut klinik pratiğinde, RB'li hastaların tanısına, göz sağkalımına yönelik prognostikasyona veya tedavinin izlenmesine yardımcı olmak için şu anda klinik olarak kullanılan tümör türevli, göze özgü moleküler biyobelirteçler yoktur. Bu, büyük ölçüde, tümör dokusunun sadece enükleasyonlu gözlerden moleküler ve genetik analizler için mevcut olmasından kaynaklanmaktadır, çünkü ekstraoküler tümör yayılımı endişesi nedeniyle RB'de doğrudan tümör biyopsisi yasaktır 3,4,5,6,7,8,9 . Bu yasak nedeniyle, RB tümör genetiği ve klinik korelasyonları ile ilgili önceki retrospektif çalışmalar, sadece enükleasyonlu gözlerden elde edilen tümör dokusunun analizi ile sınırlıydı 10,11,12,13. Bu nedenle, tanı sırasında ve göz kurtarma tedavisi boyunca mevcut olan objektif tümör kaynaklı moleküler veri eksikliği olmuştur. Bu, yalnızca in vivo tümör biyolojisinin anlaşılmasını ve bu tümörlerin tedavi boyunca moleküler düzeyde nasıl değiştiğini değil, aynı zamanda bu genç kanser hastaları için kişiselleştirilmiş, göze özgü, genomik tabanlı tedavi planları geliştirme yeteneğini de sınırlamıştır.
Biyopsi yasağının yanı sıra, bu kanserin bir başka benzersiz yönü, çoğu tümörün, hücre döngüsünü modüle eden RB1 tümör baskılayıcı geninin bi-alelik kaybıyla başlatılmasıdır. Gelişmekte olan retina bu kayba karşı son derece hassastır. Hastaların% 60'ında, RB1 geninin bu bi-alelik inaktivasyonu retinada sadece somatik kayıp olarak ortaya çıkar ve tek taraflı hastalıkla sonuçlanır. Bununla birlikte, hastaların% 40'ında, ilk RB1 mutasyonu germ hattında meydana gelir, ardından retinada ikinci bir 'vuruş' olur. Bu çocuklarda, genellikle her iki gözü de etkileyen birden fazla tümör vardır. Son olarak, tümörlerin çok küçük bir alt kümesi (% <2), RB1 geninde mutasyonlar olmadan MYCN amplifikasyonu tarafından yönlendiriliyor gibi görünmektedir. MYCN güdümlü tümörler neredeyse evrensel olarak tedavide başarısız olur ve enükleasyon gerektirirken, şu anda tanı 14,15'te bu agresif tümör alt tipini tanımlamanın net ve objektif bir yolu yoktur. Ayrıca, intraoküler RB tümör aktivitesinin izlenmesi, neredeyse yalnızca tedavi eden oküler onkolog tarafından her bir gözün görüntülenmesine ve klinik gözlemlerine dayanır. Tedavi boyunca göze özgü tümör dinamiklerini izlemenin altın standart objektif, kantitatif tanı yolu, prognoz veya yolu yoktur. RB için bu benzersiz sınırlamalar nedeniyle, bu kanser için bir sıvı biyopsi platformu olasılığı caziptir. Sıvı biyopsiler, dolaşımdaki tümör DNA'sı (ctDNA) olarak bilinen, tümör kaynaklı olup olmadığını belirlemek için hücresiz DNA'yı izole etmek ve sıralamak için vücut sıvılarını kullanır. Serum diğer kanserler için araştırılırken, serumda bulunan RB ctDNA göze özgü değildir, bu da iki taraflı hastalıktan muzdarip hastaların% 40'ı için açık sınırlamalara sahiptir. Ek olarak, sadece ilerlemiş göz içi veya metastatik hastalık ortamında, genellikle düşük tümör fraksiyonu (%<5) ile tanımlanmıştır16.
Hastaların ve ailelerin karşılaştığı bu gerçek klinik sorunları ele almak amacıyla, 2017 yılında, sulu mizahın (AH, gözün önündeki berrak sıvı), RB17'yi değerlendirmek için sıvı biyopsi olarak veya daha çok tümör biyopsisine vekil olarak kullanılabilecek yüksek verimli bir ctDNA kaynağı olduğunu gösterdik. 18,19. Bugüne kadar 200'den fazla örnekle, daha az gelişmiş IIRC Grup A, B ve C gözleri ve ayrıca iki taraflı hastalarda gözler arasındaki genomik farklılıklar dahil olmak üzere örneklerin %>95'inde ctDNA tanımlanmıştır18,19. Bu DNA, aktif olarak tedavi veya tedavi gören gözlerde ilgili moleküler biyobelirteçlerin tespiti için güvenli ve etkili bir şekilde izole edilebilir- 18,20,21. AH sıvı biyopsi platformu, tümör oluşumunu başlatan tanısal RB1 patojenik varyantlarını veya primer MYCN amplifikasyonunu tanımlamak için de kullanılabilir21,22. Daha da önemlisi, gözün çıkarılmasını gerektiren göz içi tümör kontrolünün kaybedilme olasılığının 16,5 artmasıyla ilişkili olan prognostik bir moleküler imza (medyan veya fokal MYCN amplifikasyonuna ≥1.5 genliğe sahip kromozom 6p kazancının varlığı)tanımladık 18,20,21. Son olarak, AH'deki ctDNA tümör fraksiyonundaki (TFx) değişikliklerin terapötik yanıtla ilişkili olduğu gösterilmiştir, çünkü daha yüksek seviyeler aktif hastalık ile ilişkilidir ve azalan seviyeler pozitif tedavi yanıtı ile ilişkilidir23. Bu uygulamalar ve potansiyel klinik yararlılıkları göz önüne alındığında, AH biyopsisi ve değerlendirmesi için metodolojiyi tanımlamak istedik. Bu, numune alımı için net kornea parasentezi ve genomik analiz protokolünü, özellikle cfDNA kütüphanesi yapımı ve dizilemesini, SCNA genlik tayinini, RB1 patojenik varyant tanımlamasını ve TFx hesaplamasını içerir.
Protokol
Bu araştırma, Los Angeles Çocuk Hastanesi ve Güney Kaliforniya Üniversitesi Kurumsal İnceleme Kurulu onayı altında yürütülmektedir ve Helsinki Bildirgesi'nin ilkelerine bağlı kalmaktadır. Yazılı bilgilendirilmiş onam her zaman tüm katılımcıların yasal vasilerinden alınır.
AH likit biyopsi iş akışı için bir şema Şekil 1'de görülebilir.
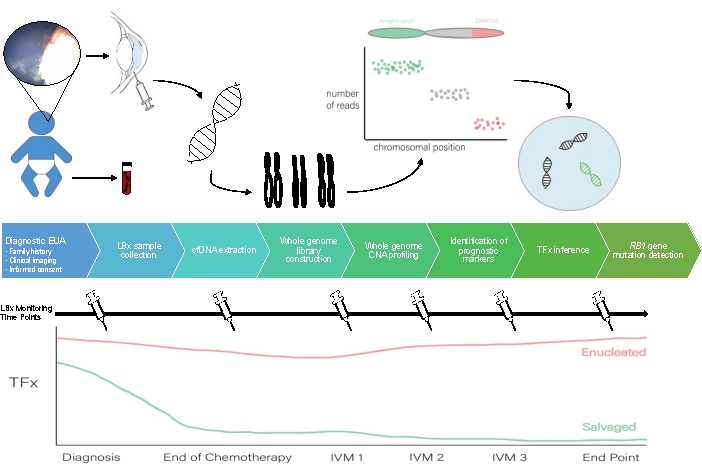
Şekil 1: Burada açıklanan protokole eşlik edecek AH sıvı biyopsisi için iş akışı. EUA, anestezi altında muayene; LBX, likit biyopsi; cfDNA, hücresiz DNA; CNA, kopya numarası değişikliği; TFx, tümör fraksiyonu; IVM, intravitreal melphalan. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Cerrahi prosedür:
NOT: Bu prosedür, RB'li hastaların klinik değerlendirmesi için anestezi altında rutin muayene (EUA) sırasında gerçekleştirilir. AH'yi çıkarmak için parasentez prosedürü sadece oküler cerrahide standart eğitimi tamamlamış eğitimli bir oftalmik cerrah tarafından yapılmalıdır.
- Hasta seçimi ve dahil edilme kriterleri aşağıdaki gibidir.
- Tümör, sineşi veya kataraktlı bir mercekten sığlaşmadan odanın oluşturulduğundan ve temizlendiğinden emin olun.
NOT: Bazı ileri gözlerde, oda tanı sırasında AH'yi güvenli bir şekilde çıkarmak için çok sığdır. Bu durumlarda, sistemik veya intra-arteriyel kemoterapinin ilk döngüsünden sonraya kadar beklemeniz önerilir. Ana tümör küçüldüğünde, oda genellikle derinleşir ve bu da güvenli bir yaklaşıma izin verir. - Tüm yapıların net bir şekilde görülebildiğinden ve basıncın <22 mm Hg olduğundan emin olun, böylece basınç dinamikleri nedeniyle odanın hızlı bir şekilde sığlaşması olmaz. Bu, tüm zaman noktaları için geçerlidir, ancak tanı sırasında AH alındığında özellikle kritiktir.
- Doğrudan görselleştirme ve ultrason biyomikroskopisi ile değerlendirilen tümörün ön segmentinin doğrudan katılımı olmadığından emin olun. Bu dahil etme kriteri genellikle EUA sırasında tanımlanır.
- Tümör, sineşi veya kataraktlı bir mercekten sığlaşmadan odanın oluşturulduğundan ve temizlendiğinden emin olun.
- Hasta uygun görülüp onay verildikten sonra hastayı ameliyathaneye getiriniz. İlgili anestezi uzmanının, RB'li hastaların klinik bakımı için EUA için rutin olduğu gibi anesteziyi başlatmasına izin verin.
- Hasta entübe edildikten ve sedasyona tabi tutulduktan ve tüm klinik muayene, görüntüleme ve EUA ile ilgili herhangi bir lokal terapötik ihtiyaç (örn., lazer veya kriyoterapi) tamamlanırsa, sıvı biyopsi platformu için AH'yi çıkarın. Gözü her zamanki steril şekilde hazırlayın ve örtün. Bu, dolaşımdaki hemşire veya ameliyat eden cerrah tarafından tamamlanabilir.
- EUA'dan önce, EUA için kurumda rutin olarak kullanılan dilatasyon damlalarını cerrahi göze yerleştirin.
NOT: Burada %2,5 fenilefrin, %1 siklopentolat ve %1 tropikamidden oluşan karma göz damlaları kullanılmaktadır. Bununla birlikte, EUA için dilatasyon için hangi standart damlalar kullanılırsa kullanılsın yeterlidir; AH'yi çıkarmak için sadece gözün genişletilmesi gerekmez. - Ameliyat gözüne %5'lik betadin damlası damlatın ve merkezden başlayarak periferik olarak hareket eden bir sünger kullanarak uygulayın. Cerrahi hazırlığa üst ve alt göz kapağı kenarlarını dahil edin. Cerrahi hazırlığı üç kez betadin kullanarak tamamlayın ve devam etmeden önce en az iki dakika bekleyin.
- Hastanın kafasına steril mavi bir havlu yerleştirin ve düşmesini önlemek için başının altına sokun. Kirpikleri ve periorbital bölgeyi steril mavi bir havlu veya gazlı bezle kurulayın.
- Ameliyat eden cerrahın fırçalamasına, önlük giymesine ve eldiven giymesine izin verin.
- Hastayı steril mavi örtülerle örtün ve cerrahi gözü açıkta bırakın. Steril alanın en iyi şekilde görselleştirilmesi için steril bir kapak spekulumu yerleştirin.
NOT: EUA için çocuk genel anestezi altında olduğu için kurumumuzda ek topikal anesteziye gerek yoktur. - Kurum protokolüne göre zaman aşımı gerçekleştirin. Burada, EUA için bir başlangıç zaman aşımı ve işlemden önce göz(ler)i doğrulamak için ikinci bir zaman aşımı yapılır.
- EUA'dan önce, EUA için kurumda rutin olarak kullanılan dilatasyon damlalarını cerrahi göze yerleştirin.
- Bir ameliyat mikroskobu kullanarak, 1 cc'lik bir şırınga üzerinde 32 G'lik bir iğne ile 0.1 mL AH ekstraksiyonu ile berrak bir kornea parasentezi gerçekleştirin.
- Prosedüre başlamadan önce, gözü steril dengeli bir tuz çözeltisiyle ıslatın (her mL sodyum klorür %0.64, potasyum klorür %0.075, kalsiyum klorür dihidrat %0.048, magnezyum klorür hekzahidrat %0.03, sodyum asetat trihidrat %0.39, sodyum sitrat dihidrat %0.17, sodyum hidroksit ve/veya hidroklorik asit (pH'ı ayarlamak için) ve enjeksiyon için su) kornea yağlamasını korumak için; Bu standart bir ticari hazırlıktır.
- 32 G iğnenin 1 cc'lik şırıngaya luer kilitli olduğundan ve şırıngada basınç olmadığından emin olun (kullanmadan önce şırınganın pistonunu birkaç kez içeri ve dışarı hareket ettirerek).
- Daha sonra, iğneyi limbustaki şeffaf korneadan geçirin (parasentez için standart olduğu gibi ona dik olarak) ve periferik dilate iris üzerindeki ön kamaranın içinde kalın.
- Ekstraksiyon sırasında mikroskop aracılığıyla doğrudan görüntüleme altında iğne ucu eğimini irisin önünde tutun. Tercih edilirse, iğne korneadan geçerken gözü 0.12 forseps ile sabitleyin.
NOT: İğne ucu ile herhangi bir oküler yapı arasında kesinlikle temas olmamalıdır; Orta ön kamarada periferik iris üzerinde kalmalıdır. - 0.1 mL AH ekstrakte edin. Şırınga pistonunu cerrahın baskın olmayan eliyle (ancak pratikle) veya iğneyi hareket ettirmeden eğitimli bir asistan tarafından manipüle edin. İğne ucunun doğrudan görselleştirilmesini kaybetmeyin. Gözün anatomisine öncelik verin ve odanın formda kalmasını sağlamak için gerekirse daha az AH alın.
- Ekstraksiyondan sonra, iğneyi ön kamaradan yavaşça çıkarın. Haznenin biçimli kaldığından ancak biraz sığ kaldığından emin olun; Basınç yumuşak ama fizyolojik olacaktır. İğne gözden çıkarıldıktan sonra, gözü bol miktarda steril su ile yıkayın; Bu adımda bir güvenlik önlemi olarak balaced tuz çözeltisi yerine steril su tercih edilir, çünkü su hücreleri parçalar.
- İğne bölgesinde herhangi bir sızıntı olup olmadığını inceleyin. Sızıntı varsa, sızıntı olup olmadığını tekrar kontrol etmeden önce enjeksiyon bölgesine 30 saniye boyunca hafif bir basınç uygulamak için pamuklu uçlu bir aplikatör kullanın. Gerekirse işlemi tekrarlayın.
NOT: Bu yaklaşımla herhangi bir sızıntıyı durdurmak için daha invaziv yöntemlerin kullanılmasına hiçbir zaman ihtiyaç duyulmamıştır. Bazen bu prosedürü intravitreal kemoterapi enjeksiyonu takip eder; bu yöntem makalesi için protokol, birincil prosedür olarak AH ekstraksiyonuna odaklanmaktadır.
- İğne bölgesinde herhangi bir sızıntı olup olmadığını inceleyin. Sızıntı varsa, sızıntı olup olmadığını tekrar kontrol etmeden önce enjeksiyon bölgesine 30 saniye boyunca hafif bir basınç uygulamak için pamuklu uçlu bir aplikatör kullanın. Gerekirse işlemi tekrarlayın.
- Sızıntı olmadığında, prosedür tamamlanmış sayılır. Steril örtüleri hastadan çıkarın ve betadini yüzünüzden temizleyin.
- İğne ucunu şırıngadan dikkatlice çıkarın, herhangi bir numuneyi kaybetmemek için numuneyi luer kilidi ile kapatmak için steril bir kapak kullanın ve şırıngayı uygun şekilde etiketleyin.
NOT: Bu, çocuk ekstübe edilirken klinik araştırma koordinatörü veya cerrah tarafından yapılmalıdır.- Numune ekstraksiyonundan sonra, numuneyi -80 °C'de kapaklı bir şırıngada saklayın; Numuneler, ameliyathaneden uygun bir dondurucuya taşınmak üzere kuru buz üzerine yerleştirilebilir.
- Hasta iyileşmeye gönderilmeden önce cerrahi gözün yüzeyine cerrahın tercihine göre tek bir damla antibiyotik göz damlası yerleştirin. Burada steroid-antibiyotik kombinasyonu göz damlaları kullanılır ve göze yama yapılmaz.
- İşlem tamamlandıktan sonra, ilgili anestezi uzmanı uygun ekstübasyonu sağlar. Hastayı iyileşmeye getirin.
- Ameliyat sonrası kurumsal protokole uygun olarak hastayı evine taburcu edin.
- Hastaya, gözün herhangi bir bandaj veya koruyucu örtü ile kapatılmasına gerek olmadığını bildirin.
- Hastayı 24 saat boyunca başını ne banyoya ne de yüzme havuzuna tamamen daldırmaması ve ebeveynleri hastanın (çocuğun) gözünü ovuşturmamaları konusunda bilgilendirin; Hasta aktivitesi ile ilgili başka bir sınırlama yoktur.
- Hastaya, parasentezden dolayı ağrı duyma ihtimalinin düşük olduğunu, ancak EUA sırasında ilişkili prosedürlerden dolayı ağrı çekebileceğini bildirin. Hasta, cerrahın önerdiği şekilde herhangi bir rahatsızlık durumunda asetaminofen veya ibuprofen alabilir.
2. cfDNA izolasyonu ve saflaştırılması
- AH ekstraksiyonundan sonraki 72 saat içinde DNA izolasyonu ve işlemesi gerçekleştirin.
- AH'yi oda sıcaklığında çözdürün. Numuneyi sık sık kontrol edin ve çözülme tamamlandıktan hemen sonra ekstraksiyona doğru hareket edin.
- Üreticinin talimat kılavuzuna göre cfDNA'yı AH'den çıkarın ve cfDNA izolasyon ve saflaştırma kitini (ayrıntılar için Malzeme Tablosuna bakın) kullanarak 50 μL AVE çözeltisine (kite dahildir) elüte edin.
3. Yeni nesil dizileme (NGS) ve kalite kontrol (QC)
- Üreticinin talimat kılavuzuna göre DNA kitaplığı dizileme kitini (Malzeme Tablosuna bakın) kullanarak dizileme için DNA kitaplıklarını oluşturun. Kütüphane DNA'sını, DNA kütüphanesi dizileme kiti kılavuzunda ayrıntılı olarak açıklandığı gibi 14 döngü polimeraz zincir reaksiyonu (PCR) ile çoğaltın.
NOT: Nihai kütüphaneler, genomik analiz için son dizilemeden 1 ay öncesine kadar -20 °C'de saklanabilir. - NGS platformundaki DNA kütüphanelerini (Malzeme Tablosuna bakınız) üreticinin protokolüne göre tek uçlu 50 döngü veya eşleştirilmiş uçlu 150 döngü protokolünü izleyerek sıralayın.
NOT: Diğer NGS platformları, sıralama akış hücresi için uygun adaptörlerle prensip olarak (burada denenmemiş olsa da) çalışacaktır. - Tanı veya birincil enükleasyon sırasında alınan herhangi bir AH örneği için QC gerçekleştirin.
NOT: DNA kütlesi çok düşük olacağından ve aşağıda açıklanan adımlar için algılama aralığının dışında olacağından, diğer zaman noktalarında alınan numuneler için kalite kontrol gerçekleştirilemez.- Üreticinin protokollerine göre DNA miktar tayini tahlili ve boyut profili tahlili için her biri 1 μL ekstrakte edilmiş DNA kullanın (Malzeme Tablosuna bakınız).
NOT: Tepe noktası 300 bp civarında olmalıdır. 150 bp'den kısaysa, numune tehlikeye girmiştir. QC'yi geçmesi gereken bir örnek örneği için Ek dosya 1A'ya ve geçmemesi gereken bir örnek için Ek dosya 1B'ye bakın.
- Üreticinin protokollerine göre DNA miktar tayini tahlili ve boyut profili tahlili için her biri 1 μL ekstrakte edilmiş DNA kullanın (Malzeme Tablosuna bakınız).
4. Somatik kopya sayısı değişikliği (SCNA) veri analizi
- NGS'den (bölüm 3) elde edilen okumaları bir hizalayıcı ile insan genomuna (hg19, Genom Referans Konsorsiyumu GRCh37, California Üniversitesi Santa Cruz Genom Tarayıcı veritabanı)24,25 eşleyin.
- PCR kopyalarını çıkarın (samtools rmdup26).
- Referans genomdan her bir kutudaki guanin ve sitozin bazlarının yüzdesini hesaplayarak guanin-sitozin içeriğini normalleştirin. Baslan ve ark.27'de örnek bir program açıklanmıştır.
- DNA segment kopya numaralarını elde etmek için, genomu 5000 değişken uzunluklu bölmeye bölün ve ardından her bir bölmede bulunan göreceli okuma sayısını hesaplayın.
- Kopya sayısı tahminlerini belirlemek için referanssız günlük2 oranlarını kullanın. Normal otozomal kromozomların medyan pencere sayısını alın.
- DNAcopy (Bioconductor28) ile dairesel ikili segmentasyon kullanarak segmentasyon gerçekleştirin.
- SCNA'ları taban çizgisinden %20 sapmada pozitif olarak tanımlayın (log2 oranı = 0), yani log2 oranlarındaki kayıplar 0,2≤ (0,87 veya daha düşük oran bir silmeyi tanımlar) ve log2 oranlarındaki kazançlar 0,2≥ (1,15 veya daha yüksek oran bir amplifikasyonu tanımlar).
NOT: Bu eşikler daha önce belirlenmiş likit biyopsi analizleri ile tutarlıdır27,29.
5. AH örneklerinin RB1 mutasyon analizi
- Ayrıca, üreticinin protokolüne göre mutasyon tespiti için yakalama tabanlı hedefli NGS için tüm genom kitaplıklarını her biri 500 ng'ye yükseltin.
- Yakalanan kitaplıklarda üreticinin protokolüne göre >100x'e kadar NGS platformu eşleştirilmiş uçlu 150 bp veya 50 bp tek uçlu sıralama gerçekleştirin.
- NGS verilerini işleyin. Bu çalışmada, CHLA Kişiselleştirilmiş Tıp Merkezi'ndeki bcbio boru hattına dayalı bir kurum içi boru hattı kullanılmıştır30.
- Atropos31 ile adaptörlerden ve düşük kaliteli tabanlardan ham fastq verilerini kırpın ve BWA-MEM ve NovoAlign (v3)32,33 ile insan GRCh37 referansına hizalayın.
- Kopyaları FreeBayes34 ile işaretleyin ve ardından germ hattı varyantını belirleyin.
NOT: FreeBayes varyant çağırma araçlarında, örnek genomun her pozisyonu referans genom ile karşılaştırılır ve alel sayıları, genotip olasılık ölçüleri34'ü elde etmek için matematiksel olarak modellenir. - 5.3.4-5.3.5 adımlarını izleyerek Ensembl Variant Effect Predictor (v96)35 ile varyant ek açıklaması yapın.
- Eşleştirilmiş normal kan örneği olmadan AH veya tümördeki somatik varyantları belirlemek için VarDict'i kullanın (yani, germ hattı varyantına kör olmuş)36.
- Bir bölgenin sürekli varyantları %≤3 alternatif alellere sahipse heterozigotluk kaybı olarak adlandırılır.
NOT: Ticari genomik analiz yazılımı da yukarıda belirtilen parametrelerle kullanılabilir.
6. cfDNA TFx tayini
- ichorCNA yazılımı (CNA tabanlı TFx tahmin yazılımı) kullanarak dizilenmiş her AH cfDNA örneği için TFx'i tahmin edin37.
NOT: Bu, cfDNA TFx38'i belirlemek için kan bazlı sıvı biyopsilerinde kullanılan standart yazılımdır. Yazılımın AH üzerinde kullanımı daha önce yayınlanmıştır21,23. - Her numune için TFx tahmininin uygun olduğunu doğrulamak için genomik profilleri ve ilgili TFx çözümlerini ayrı ayrı gözden geçirin39.
Sonuçlar
İki gözden (vaka 33 ve 47) elde edilen kapsamlı sonuçlar aşağıda sunulmuştur. Vaka sayıları, karşılaştırma amacıyla önceki yayınlarla tutarlı kalmaktadır 18,20,21. Tedavi eden doktorlar, tedavi sırasında AH sıvı biyopsisinin sonuçlarına kör edildi. Tüm tedavi kararları randomize değildi ve daha önce yayınlanmış olan rutin bakım standardına göre verildi40,41. Klinik sonuç verileri, son analize kadar genomik verilerden ayrı kaldı. Sunulan sonuçlardan elde edilen ham veriler, ilgili yazarın talebi üzerine temin edilebilir. NIH finansmanı nedeniyle, veriler NIH genomik veri paylaşım politikasına tabidir ve gelecekte kontrollü erişimli NIH tarafından belirlenmiş bir veri deposu (dbGAP) aracılığıyla diğer araştırmacılara sunulacaktır; Ayrıca sorumlu yazarın isteği üzerine de temin edilebilir.
Olgu 33 ve 47'nin her ikisi de çok benzer klinik tablolara sahip IIRC GrupD 2 gözleridir. Bu nedenle, ebeveynlerin kararına bağlı olarak dünya kurtarma tedavisi ile tedavi edildiler ve oküler ve medikal onkologları tedavi ettiler - özellikle vaka 47 için sistemik kemoterapi ve vaka 33 için intraarteriyel kemoterapi ile. GözünIIRC grubuna dayanan şu anda kabul edilen klinik prognostikasyona dayanarak 2, bu iki hastanın gözleri için küre kurtarmanın öngörülen başarısı aynı olurdu: Grup D için %65-%70 ortalamadır, ancak bu tedavi merkezinegöre değişir 41. Bununla birlikte, bu merkezde tümöre yönelik moleküler profillemeden şimdiye kadar toplanan Grup D verilerine dayanarak, küre kurtarmanın öngörülen başarısı vaka 47 için %72 (AH'de 6p kazancı tanımlanmadan) ve vaka 33 için %9 (6p kazancı tanımlanmış) olacaktır18,20,21. Bu aşağıda gösterilmiştir.
Vaka 47, tanı anında AH sıvı biyopsi platformunu kullanarak başarılı SCNA ve SNV tespitine sahip bir göz örneğidir ve uzunlamasına tedavi yanıtına karşılık gelen TFx eğilimleri ile birlikte. Hasta 15 aylıkken 14 mm x 9 mm IIRC Grup D, evre cT2b RB ile başvuran ve küre vitreus tohumlamalı bir kadındır. Rutin klinik serum lökosit testi ile belirlenen RB1 germ hattı mutasyonu için negatifti. AH'den, tanı sırasında AH'de RB SCNA'ları 1q kazancı ve 6p kazancı tespit edildi, ayrıca diğer iki yüksek derecede tekrarlayan RB SCNA'sı 7p kaybı ve 13q kazancı tespit edildi (Şekil 2). Dikkat çekici bir şekilde, 6p kazancının genliği 1.2 idi ve medyana sadece 1.5'lik ≥ oranın genliklerinin kötü bir prognoza işaret ettiği gösterilmiştir. Fokal MYCN amplifikasyonu olmadığı ve 6p kazancının 1.5 eşiğinin altında olduğu göz önüne alındığında, moleküler özelliklere dayalı tedavi ile kurtarma prognozu yüksekti. Tanı sırasında alınan aynı AH örneği, RB1 patojenik varyantlarının tespiti için de değerlendirildi ve bu da RB1 geni içinde SNV c.958C>T, p.Arg320*'yi %87.01 (% 95 güven aralığı,% 79.7 -% 94.6) ile ortaya çıkardı. Bu hasta, hastalığın gerilemesi ile altı döngü Karboplatin, Etoposid ve Vincristine (CEV) ile tedavi edildi, ancak üç ardışık intravitreal melphalan (IVM) enjeksiyonu gerektiren kalıcı küre ve toz benzeri tohumlama gösterdi. IVM tedavisi sırasında, AH örnekleri AC (her biri iki hafta arayla) genomik profilin tamamen normalleşmesini, TFx'te azalma ve DNA konsantrasyonunda azalma gösterdi - hepsi hastalığın klinik regresyonu ile eş zamanlı olarak (Şekil 3). Tanıyı takiben, tedavinin geri kalanında TFx değerleri %5'lik tespit sınırının altında kaldı. 19 aylık takipte, göz, tümör nüksü veya hastalığın ekstraoküler yayılımı olmadan stabil kaldı.
Bu, 33. durumun aksine. Bu 22 aylık erkek, tek taraflı IIRC Grup D, evre cT2b ile uyumlu, 11 mm x 18 mm retina kitlesi ve toz tipi vitreus tohumlaması ile genel olarak benzer bir klinik tabloya sahipti. Ayrıca rutin klinik serum lökosit testi ile belirlenen RB1 germ hattı mutasyonu için negatifti. Tanı sırasında alınan AH, RB SCNA'ları 1q kazancı, 6p kazancı (bu durumda medyana oranı 1.5 genlik ile) ve fokal 6q kaybı ile birlikte 16q kaybı gösterdi (Şekil 4A). Prognostik moleküler profile dayanarak, bu göz, 6p ≥ 1.5 genliğin varlığına bağlı olarak 16.5 artmış enükleasyon olasılığına sahipti. RB1 geninin tam uzunluğunu kapsamasına rağmen, bu örnekte hiçbir RB1 SNV tanımlanmamıştır. Bir RB1 SNV'nin tanımlanamamasının bir nedeni, eşzamanlı bir RB1 mutasyonunun her zaman beklenmediği primer MYCN güdümlü tümörlerdir 14,15,42,43,44,45. Bununla birlikte, vaka 33, AH örneklerinden herhangi birinde veya enükleasyonlu tümör dokusunda MYCN amplifikasyonuna dair bir kanıt göstermedi (Şekil 5). Negatif bir RB1 SNV sonucu için daha olası bir açıklama, ilk tümör oluşumunun, burada açıklanan tahlil ile tanımlanamayacak olan RB'de bilinen bir fenomen olan epigenetik düzensizlik (örneğin, promotorun metilasyonu)46,47 tarafından yönlendirildiğidir.
Bu hasta için ilk tedavi, melphalan ile toplam dört intraarteriyel kemoterapi döngüsü ve ardından kalıcı vitreus tohumlamasına bağlı dört IVM enjeksiyonu idi. IVM tedavisi sırasında üç AH örneği (her biri dört hafta arayla) elde edildi ve tanı sırasında mevcut olan aynı üç SCNA'yı gösterdi (Şekil 5). TFx değerleri, vitreustaki aktif tümör tohumlarını yansıtan azalan primer tümör hacmine rağmen tedavi boyunca yüksek kaldı. Bu, TFx'in gözdeki genel hastalık durumunu nasıl temsil ettiğini gösterir. Tanıdan altı ay sonra, kalıcı aktif hastalık nedeniyle, göz enüklee edildi. O dönemde tümör dokusundan elde edilen genomik profil, tanı anında elde edilen AH örneği ile %92.81 uyum gösterdi (Şekil 4B).
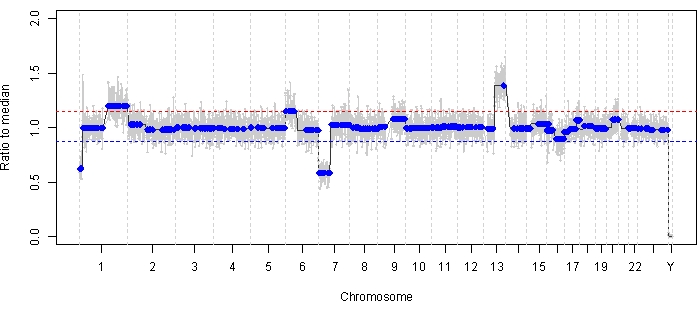
Şekil 2: Vaka 47 için tanı sırasındaki genomik profil. Tanı anında alınan AH'de yüksek derecede tekrarlayan RB SCNA'lar 1q kazancı ve 6p kazancı ile birlikte yüksek derecede tekrarlayan RB SCNA'ları 7p kaybı ve 13q kazancı tespit edildi. Kırmızı çizgi kazanç eşiğini, mavi çizgi ise kayıp eşiğini temsil eder. Özellikle, 6p kazancının genliği, kötü bir prognozu gösteren moleküler imzanın eşiğinin altında olan medyana <1.5 oranıydı. Bu nedenle, göz kurtarma için negatif biyobelirteçlerin eksikliğine dayanarak, bu gözün tedaviye yanıt vereceği tahmin edilecektir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
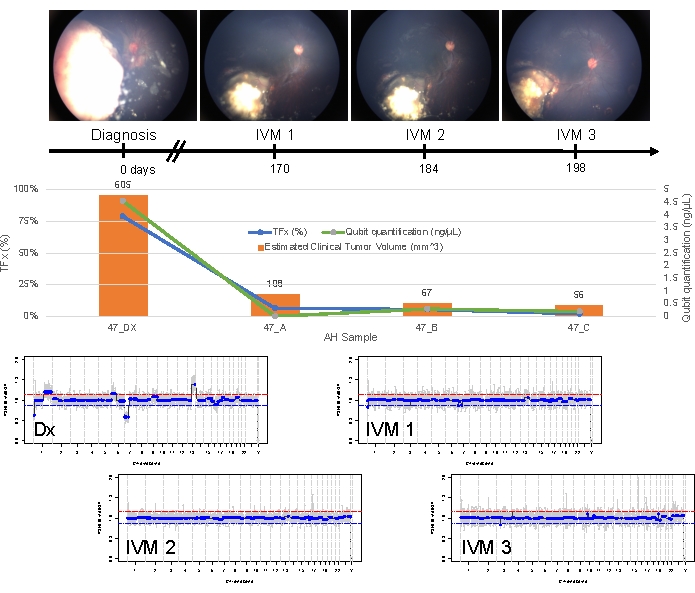
Şekil 3: Durum 47 için boylamsal bilgiler. Bu, fundus fotoğraflarını, cfDNA niceliğini, B-tarama ölçümlerinden tahmini klinik tümör hacmini, genomik profilleri ve AH'nin örneklendiği her klinik zaman noktası için TFx tahminlerini içerir (Dx = tanı, A = IVM1, B = IVM2, C = IVM3). Bu göz tedaviye yanıt verdi ve 19 aylık takipte kurtarıldı. Tanı sırasında elde edilen en yüksek verimi gösteren daha önce yayınlanmış çalışmalarla tutarlı olarak, zaman içinde cfDNA miktarında bir azalma gözlendi. TFx ayrıca, tohumlamanın çözünürlüğünü ve ana retinal tümör hacmindeki azalmayı yansıtacak şekilde tedavi boyunca azalmıştır (tümör hacimleri, her klinik zaman noktasının turuncu çubuğunun üzerinde belirtilmiştir). Hastalığın klinik regresyonu ile beklendiği gibi, genomik profiller de normale döndü. Genomik profillerde, kırmızı çizgi bir kazanç eşiğini temsil ederken, mavi çizgi bir kayıp eşiğini temsil eder. Bu figür Xu, L. ve ark.21'in izniyle yeniden basılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
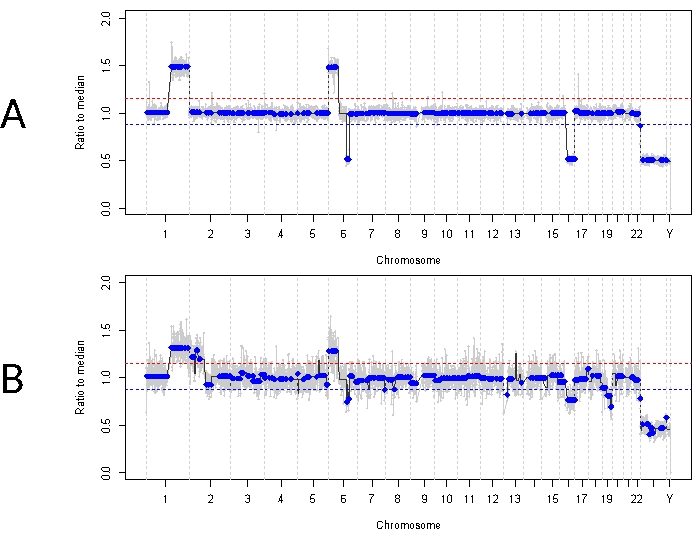
Şekil 4: Vaka 33 için genomik profiller. Kırmızı çizgi bir kazanç eşiğini temsil ederken, mavi çizgi bir kayıp eşiğini temsil eder (A) Vaka 33 için tanı sırasında genomik profil. Fokal 6q kaybına ek olarak, tanı sırasında AH'de yüksek derecede tekrarlayan RB SCNA'ları 1q kazancı, 6p kazancı ve 16q kaybı tespit edildi. Özellikle, 6p kazancının genliği medyana 1.5 oranıydı ve bu da zayıf bir prognostik moleküler biyobelirteç olduğunu gösteriyor. Bu nedenle, bu moleküler imzaya dayanarak, bu gözün tedavi başarısızlığı olasılığının önemli ölçüde arttığını tahmin edebiliriz. (B) Tanı sırasında AH'den elde edilen profille oldukça uyumlu olan enükleasyonlu tümör dokusundan elde edilen genomik profil. Normal retina dokusu ile karışması nedeniyle, tümör dokusundan gelen SCNA'lar, seyreltilmiş TFx nedeniyle AH'ye kıyasla daha düşük genlik gösterebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
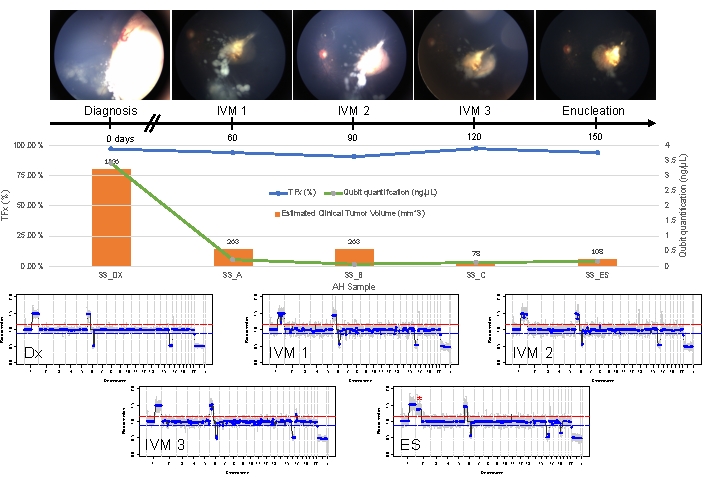
Şekil 5: Durum 33 için boylamsal bilgiler. Bu, fundus fotoğraflarını, hücresiz DNA niceliğini, B-tarama ölçümlerinden tahmini klinik tümör hacmini (tümör hacimleri her klinik zaman noktasının turuncu çubuğunun üzerinde belirtilmiştir), genomik profilleri ve AH'nin örneklendiği her klinik zaman noktası için TFx tahminlerini içerir (Dx = tanı, A = IVM1, B = IVM2, C = IVM3, SE = ikincil enükleasyon). Bu göz tedaviye yanıt vermedi ve sonuçta sekonder enükleasyon (ES) gerektirdi. Bunun nedeni, apikal tümör nüksü ile birlikte sürekli aktif tohumlamaydı. CfDNA miktarı, tanı sırasında elde edilen en yüksek verimi (1q kazanç, 6p kazanç, 16q kayıp ve fokal 6q kayıp) gösteren daha önce yayınlanmış çalışmalarla tutarlı olarak zamanla azalmıştır. Bununla birlikte, TFx, tümörden türetilmiş cfDNA'yı AH'ye hala döken kalıcı tohumlamanın bir ürünü olan tedavi boyunca yüksek kaldı. Genomik profiller tutarlıydı ve tanı sırasında mevcut olan aynı üç SCNA'yı gösterdi. ES'de elde edilen AH'de, apikal tümör nüksü sırasında klonal evrimi düşündüren yeni bir büyük ölçekli 2p kazancı (*) ve 19q kaybı görüldü. Genomik profillerde, kırmızı çizgi bir kazanç eşiğini temsil ederken, mavi çizgi bir kayıp eşiğini temsil eder. Bu figür Xu, L. ve ark.21'in izniyle yeniden basılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: (A) tepe noktası 300 bp civarında olan kalite kontrolünden geçmesi gereken bir numune ve (B) tepe noktası 150 bp civarında olan kalite kontrolünden geçmemesi gereken bir numune örneği. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Berrak kornea parasentezi, oftalmolojide birden fazla tanı ve/veya tedavi endikasyonu için yaygın olarak uygulanan bir işlemdir. Özellikle RB için, enjeksiyon bölgesine reflüyü önlemek için enjeksiyondan önce göz içi basıncını azaltmak için standart intravitreal kemoterapi enjeksiyon protokolününbir parçasıdır 48. Yaygın bir prosedür olmasına rağmen, tamamen risksiz değildir; önceki dogma, aktif RB ile bir iğnenin asla göze girmemesi gerektiğiydi. Bu dogma, son on yılda, ilk olarak Patricia Chévez-Barrios'un enjekte edilen adenoviral vektör tedavisi49 üzerine biçimlendirici çalışması ve ardından Francis Munier48 tarafından RB'de oküler enjeksiyonlar için ilerleyici güvenlik geliştirilmiş yöntemler yoluyla gelişmiştir. Bu çalışma, AH'nin bu kanser için sıvı biyopsi olarak veya tümör biyopsisine vekil olarak kullanılması için ekstraksiyonun yolunu açmıştır. Şu anda, platformun faydasını ve tanı anında alınan AH'den elde edilen ön güvenlik sonuçlarını bildiren ilk merkeziz. Burada açıklanan yöntemlerin bir kısmı, hasta seçiminin güvenliğini ve RB için AH ekstraksiyonunun prosedürel yönlerini sağlamayı amaçlamaktadır. İlk olarak, iğneler sadece ön kamaraya girebilir ve iris veya lens ile temas etmemelidir, çünkü bu, cerrahın tümörü izleme yeteneğini sınırlayan iris yara izine veya katarakta neden olabilir. İğnenin vitreus boşluğuna asla girmemesi (IVM'de olduğu gibi kemoterapi ile birleştirilmediği sürece) veya tümörle temas etmemesi çok önemlidir, çünkü bu varsayımsal olarak tümör tohumlanması ve hastalığın ekstraoküler yayılımı riskini artırır 3,4,5. Bu yapıların her ikisi de ön kamaranın arkasındadır ve ondan lens ve iris ile ayrılır. Herhangi bir oküler yapıya zarar vermemek için, iğne eğimini her zaman yukarıda, periferik irisin üzerinde ve her zaman cerrahi mikroskop kullanılarak doğrudan görüntüleme altında tutmak önemlidir. AH'nin iğne bölgesinden küçük bir sızıntı riski vardır; Bu meydana gelirse, pamuk uçlu bir aplikatör aracılığıyla hafif bir basınçla çözülür. Mevcut en küçük mastar iğnesinin kullanılması ve iğnenin herhangi bir yanal kesme olmadan aynı kanaldan yavaşça çıkarılmasının sağlanması bu riski azaltacaktır. Ön kamarada hafif sığlaşma beklense de, iris kornea teması olmadan odacık şeklinde kalmalı ve göz içi basıncı yumuşak, ancak fizyolojik olmalıdır.
Genomik analizlerle ilgili olarak, ilgili birkaç kritik adım vardır. En önemlisi, gözden çıkarıldıktan sonra küçük hacimli numunenin işlenmesidir; tekrarlanan donma ve çözülme döngülerinde meydana gelebilecek DNA bozulmasını önlemek için numunenin işlemden önceki tüm süre boyunca donmuş kalmasıçok önemlidir 50. Numunelerin ekstraksiyondan hemen sonra kuru buz üzerine yerleştirilmesini ve -80 °C'lik bir dondurucuya aktarılmasını sağlamak bunu sağlamaya yardımcı olur. Numuneler işlenmeye başladıktan sonra, kalite kontrol adımları, cfDNA'nın yüksek kaliteli kitaplıklar halinde oluşturulmasını garanti ederek sorun gidermek için ana fırsattır. DNA miktar tayini ve DNA fragman boyutu profilleme tahlili kullanılarak, bu numunelerde bulunan cfDNA veriminin daha yüksek olması nedeniyle primer enükleasyon sırasında veya tanı sırasında alınan numuneler üzerinde kalite kontrol yapılabilir18,21. Elde edilen tepe noktası 300 bp civarında olduğunda, bu, cfDNA'nın NGS platformu tarafından tanınacağını garanti eder. Elde edilen tepe noktası 150 bp'den kısaysa, tespit edilen parçaların çoğunun kütüphane yapı primerleri veya adaptör oligoları olduğunu gösterirse, numune tehlikeye girmiştir ve SCNA'lar için daha fazla işlenmemelidir. Bununla birlikte, yüzlerce numuneyi işleme deneyimimize göre, zayıf okuma hizalama oranı20 nedeniyle kalite kontrol için %5'ten daha azının çıkarılması gerekir. Numune toplama, taşıma, saklama ve işleme için standartlaştırdığımız yöntemlerin yanı sıra bu prosedür, AH sıvı biyopsi platformunun analitik öncesi geçerliliğini göstermektedir.
AH likit biyopsisi ayrıca, AH örneklerinden oluşturulan genomik profiller ve karşılık gelen tümör dokusu18,20,21,22,23 arasında tutarlı bir şekilde %>95 ortalama uyumla, RB1 patojenik mutasyonlarını ve SCNA'larını doğru ve güvenilir bir şekilde tespit etme yeteneğine dayalı olarak analitik geçerlilik kazanmıştır. Platformun kanıtlanmış analitik geçerliliğine rağmen, sınırlamalar olmadan değildir. RB1 mutasyon analizi, yalnızca tanı veya primer enükleasyon sırasında tedavi görmemiş gözlerde en sık elde edilen >10 ng cfDNA'ya sahip numuneler üzerinde yapılabilir18,21. Bunun nedeni, tanı sırasında veya birincil enükleasyon sırasında AH'ye kıyasla aktif olarak tedavi gören gözlerden alınan AH örneklerinde bulunan cfDNA konsantrasyonunun daha düşük olmasıdır. Ek bir kısıtlama, SCNA'ların %5'in altındaki TFx'lerde tespit edilememesidir, bu da tümör yükünün önemli ölçüde düştüğü gözlerde hastalığın izlenmesini engeller; Deneyimlerimize göre, bu en sık intravitreal kemoterapi tedavisine yanıt veren gözlerde görülür23.
AH'deki cfDNA'nın TFx'ini belirlemek için CNA tabanlı TFx tahmin yazılımı kullanılır. Bu yazılım, likit biyopsilerde TFx hesaplaması için standart ve kabul görmüş bir araçtır ve algoritması ayrıntılı olarak açıklanmıştır38,51. Kısaca, CNA tabanlı TFx tahmin yazılımı, gizli bir Markov modeli kullanarak dizilenmiş cfDNA içindeki büyük ölçekli SCNA'ları tahmin eder. TFx tahminleri, her lokusta subklonalite ve ploidi farklılıklarını hesaba katarken SCNA'ların varlığına dayalı olarak türetilir ve bunlardan, CNA tabanlı TFx tahmin yazılımı optimal bir TFx çözümü seçer38. Bununla birlikte, CNA tabanlı TFx tahmin yazılımının doğal bir sınırlaması, TFx'in bir örnekteki SCNA'ların varlığına dayalı olarak hesaplanmasıdır; bu nedenle, SCNA'ları olmayan örneklerde (yani düz genomik profillere sahip) TFx'i belirleyemez38. Daha önce gösterildiği gibi, tüm RB tümörleri SCNA'lara sahip değildir 14,15,18,21,23,45. Bu nedenle, CNA tabanlı TFx tahmin yazılımı tarafından belirlenen çok düşük bir TFx, 1) AH örneğinin içinde ölçülebilir tümör kaynaklı cfDNA olmadığı veya 2) tümör cfDNA'sının mevcut olduğu, ancak SCNA eksikliği nedeniyle CNA tabanlı TFx tahmin yazılımı tarafından tespit edilemediği anlamına gelir38. SNV için varyant alel fraksiyonu (VAF), TFx için bir vekildir. Bu nedenle, SCNA'ları olmayan RB gözlerinin de uzunlamasına TFx izlemesi almasına izin vermek için VAF'a dayalı RB1 tabanlı bir TFx boru hattı geliştirmek için çalışıyoruz. Primer MYCN güdümlü tümörler 14,15,42,43,44,45 istisnaları dışında tüm RB tümörlerinin RB1 geninde somatik mutasyonlar içerdiği göz önüne alındığında, SCNA'lara bağımlı olmayan bir boru hattı, burada sunulan likit biyopsi protokolünün uygulamasını genişletecektir. Ek olarak, SNV'ler %5'in altındaki TFx'lere kadar izlenebildiğinden, bu platformumuzun hassasiyetini artıracaktır.
Burada tarif edilen AH likit biyopsi platformu, RB için literatürde bulunan tek likit biyopsi platformu değildir, ancak özellikle, suluları zenginleştirilmiş bir tümör DNA'sı kaynağı olarak tanımlayan ve bugüne kadar yayınlanmış çalışmalara dayanan herhangi bir biyosıvıda iki mekanizma (SCNA'lar ve RB1 SNV'ler) yoluyla ctDNA'nın tespitini tanımlayan ilk platformdur. ctDNA'yı iki şekilde tespit edebilme özelliği ile AH likit biyopsisi, literatürdeki diğer platformlara göre daha yüksek bir duyarlılığa sahiptir. Örneğin, başka bir grup, RB1 SNV'ler52 ile AH'de RB ctDNA'yı başarıyla tespit etti. Bununla birlikte, bu platform, SNV'nin önceden bilgisine dayalı olarak hedeflenen NGS okumalarına dayanıyordu. Buna karşılık, bu el yazmasında ayrıntılı olarak açıklanan platform, SCNA'ları ve SNV'leri tespit etme yeteneği veren önyargısız WGS'yi kullanır. Kan bazlı sıvı biyopsiler de denenmiştir, ancak elde edilen cfDNA, oküler kurtarma olasılığının prognostiği olan SCNA tespiti için sürekli olarak eşiğin altında olmuştur (şu anda, RB1 SNV'lerin göz kurtarma için prognostik olduğu gösterilmemiştir, Bununla birlikte, metastatik hastalığın saptanması için gelişen bir rol olabilir)19. Kothari ve ark. RB hastalarının plazmasında RB1 SNV'leri tanımladı, ancak sadece enükleasyon gerektiren ileri göz içi hastalığı olanları tanımladı16. Burada açıklanan AH sıvı biyopsi platformu,tohumlama 19,21 olmadan bile daha az gelişmiş gözlerin AH'sinde ctDNA'yı tespit etme yeteneğine sahiptir. Ayrıca, kan bazlı sıvı biyopsileri göze özgü değildir, çünkü serumdan izole edilen ctDNA, bilateral RB vakalarında her iki gözden de olabilir. Bu, özellikle RB vakalarının %40'ını oluşturan bilateral hastalarda kan bazlı platformların klinik faydasını sınırlarken, AH göze özgü kalır ve hem SNV hem de SCNA seviyelerinde gözler arası heterojenlik gösterebilir53.
AH sıvı biyopsisinin RB alanı için önemi çok önemlidir. AH likit biyopsisi sadece aktif olarak tedavi gören gözlerde intratümöral dinamikleri daha iyi anlama fırsatı sağlamakla kalmaz, aynı zamanda hasta bakımını iyileştirme potansiyeline de sahiptir. Önceki çalışmalara dayanarak, medyana ≥1.5 oranında bir genlik ile MYCN amplifikasyonu veya kromozom 6p kazancının varlığına dayanan - bu, enükleasyon gerektiren16.5 kat artmış tedavi başarısızlığı olasılığı için prognostik olan bir moleküler imza oluşturduk 18,20,21. Tanı anındaki bu bilgiyle, klinisyenler ailelere uygun tedavi seçenekleri ve mevcut terapötiklerle göz kurtarma olasılığı konusunda daha iyi danışmanlık yapabileceklerdir. RB için AH likit biyopsi platformunun klinik geçerliliği belirlenmiş olmasına rağmen 17,18,19,20,21,22,23, şu anda sadece araştırma için onaylanmıştır; AH sıvı biyopsisinin RB için doğrudan hasta bakımına yardımcı olmak için klinik olarak uygulanabilmesi için daha büyük prospektif çok merkezli çalışmalara ihtiyaç vardır. Ne olursa olsun, AH likit biyopsisi gelecekte sadece RB için değil, diğer oküler tümörler için de hassas onkolojiyi mümkün kılma potansiyeline sahiptir.
Açıklamalar
Jesse Berry, Liya Xu ve James Hicks, Oftalmik Hastalığın Tanısal ve Prognostik Değerlendirmesi için Sulu Mizah Hücresiz DNA başlıklı bir patent başvurusunda bulundular. Aksi takdirde, yazarlar potansiyel bir çıkar çatışması bildirmemektedir.
Teşekkürler
Bu araştırma aşağıdaki kaynaklar tarafından desteklenmiştir: NIH Ödülü NCI K08CA232344 (J. L. Berry'ye); Hyundai Hope on Wheels RGA012351 (J. L. Berry'ye); Çocukluk Çağı Göz Kanseri Vakfı (JL Berry'ye); Amerikan Kanser Derneği IRG-16-181-57 (J. L. Berry'ye); Wright Vakfı (J.L. Berry ve M.E. Kim'e); Tapınak Şövalyeleri Göz Vakfı (J.L. Berry'ye); Larry ve Celia Moh Vakfı (J. L. Berry'ye); Aileler Enstitüsü, Inc., Los Angeles Çocuk Hastanesi (J. L. Berry); Körlüğü Önleme Araştırmalarından (tümü) sınırsız bir bölüm hibesi; NCI P30CA014089 (tümü); Vicky Joseph Araştırma Fonu (P. Kuhn'a); Carol Vassiliadis Araştırma Fonu (P. Kuhn'a); ve USC Dornsife Edebiyat, Sanat ve Bilim Koleji (P. Kuhn'a).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | surgical grade, whatever available in hospital | ||
| 32 G needle | surgical grade, whatever available in hospital | ||
| Aligner | Authors use Bowtie2 (http://bowtie-bio.sourceforge.net/bowtie2/index.shtml) but other aligners such as BWA or GRCh38 will also work | ||
| Atropos | generic term: adapter remover. https://atropos.readthedocs.io/en/latest/index.html# | ||
| Bioanalyzer High Sensitivity DNA Kit | Agilent | 5067-4626 | generic term: DNA fragment size profiling assay |
| BWA-MEM | generic term: long sequence aligner. http://bio-bwa.sourceforge.net/bwa.shtml | ||
| DNAcopy | Bioconductor | generic term: DNA copy number data analysis. https://bioconductor.org/packages/release/bioc/html/DNAcopy.html | |
| dsDNA High Sensitivity Assay | Qubit | Q32851 | generic term: DNA quantification assay |
| FreeBayes | generic term: sequence variant determiner. https://github.com/freebayes/freebayes | ||
| ichorCNA software | generic term: CNA-based TFx estimation. https://github.com/broadinstitute/ichorCNA | ||
| Illumina platform | Illumina | generic term: NGS platform; please note that other NGS platforms will work in principle, but have not been trialed by these authors | |
| NovoAlign (v3) | Novocraft | generic term: mapping of short reads onto reference genome. http://www.novocraft.com/products/novoalign/ | |
| QIAamp Circulating Nucleic Acid Kit | Qiagen | 55114 | generic term: cfDNA isolation and purification kit |
| QIAseq Ultralow Input Library Kit | Qiagen | 180492 | generic term: DNA library sequencing kit |
| Samtools rmdup | generic term: tool to remove duplicate reads. http://www.htslib.org/doc/samtools-rmdup.html | ||
| VarDict | generic term: variant caller. https://github.com/AstraZeneca-NGS/VarDict | ||
| Variant Effect Predictor | Ensembl | generic term: variant effect determinator. https://uswest.ensembl.org/info/docs/tools/vep/index.html |
Referanslar
- Fernandes, A. G., Pollock, B. D., Rabito, F. A. Retinoblastoma in the United States: A 40-year incidence and survival analysis. Journal of Pediatric Ophthalmology & Strabismus. 55 (3), 182-188 (2018).
- Linn, A. M. Intraocular retinoblastoma: the case for a new group classification. Ophthalmology Clinics of North America. 18 (1), 41-53 (2005).
- Shields, J. A., Shields, C. L., Ehya, H., Eagle, R. C., De Potter, P. Fine-needle aspiration biopsy of suspected intraocular tumors. The 1992 Urwick lecture. Ophthalmology. 100 (11), 1677-1684 (1993).
- Karcioglu, Z. A., Gordon, R. A., Karcioglu, G. L. Tumor seeding in ocular fine needle aspiration biopsy. Ophthalmology. 92 (12), 1763-1767 (1985).
- Karcioglu, Z. A. Fine needle aspiration biopsy (FNAB) for retinoblastoma. Retina. 22 (6), 707-710 (2002).
- Eide, N., Syrdalen, P., Walaas, L., Hagmar, B. Fine needle aspiration biopsy in selecting treatment for inconclusive intraocular disease. Acta Ophthalmologica Scandinavica. 77 (4), 448-452 (1999).
- Eide, N., Walaas, L. Fine-needle aspiration biopsy and other biopsies in suspected intraocular malignant disease: a review. Acta Ophthalmologica. 87 (6), 588-601 (2009).
- Eriksson, O., Hagmar, B., Ryd, W. Effects of fine-needle aspiration and other biopsy procedures on tumor dissemination in mice. Cancer. 54 (1), 73-78 (1984).
- Ali, M. J., Honavar, S. G., Vemuganti, G. K., Singh, A. D. Fine needle aspiration biopsy of retinal tumors. Monographs in Clinical Cytology. 21, 72-81 (2012).
- Di Nicolantonio, F. a. l., et al. The chemosensitivity profile of retinoblastoma. Recent Results in Cancer Research. 161, 73-80 (2003).
- Francis, J. H., et al. Efficacy and toxicity of second-course ophthalmic artery chemosurgery for retinoblastoma. Ophthalmology. 122 (5), 1016-1022 (2015).
- Francis, J. H. Efficacy and toxicity of intravitreous chemotherapy for retinoblastoma: Four-year experience. Ophthalmology. 124 (4), 488-495 (2017).
- Francis, J. H., et al. Current treatment of bilateral retinoblastoma: The impact of intraarterial and intravitreous chemotherapy. Neoplasia. 20 (8), 757-763 (2018).
- Rushlow, D. E., et al. Characterisation of retinoblastomas without RB1 mutations: genomic, gene expression, and clinical studies. The Lancet Oncology. 14 (4), 327-334 (2013).
- Afshar, A. R., et al. Next-generation sequencing of retinoblastoma identifies pathogenic alterations beyond RB1 inactivation that correlate with aggressive histopathologic features. Ophthalmology. 127 (6), 804-813 (2020).
- Kothari, P. Cell-free DNA profiling in retinoblastoma patients with advanced intraocular disease: An MSKCC experience. Cancer Medicine. 9 (17), 6093-6101 (2020).
- Berry, J. L., et al. Potential of aqueous humor as a surrogate tumor biopsy for retinoblastoma. JAMA Ophthalmology. 135 (11), 1221-1230 (2017).
- Berry, J. L., et al. Genomic cfDNA analysis of aqueous humor in retinoblastoma predicts eye salvage: the surrogate tumor biopsy for retinoblastoma. Molecular Cancer Research. 16 (11), 1701-1712 (2018).
- Berry, J. L., et al. Aqueous humor is superior to blood as a liquid biopsy for retinoblastoma. Ophthalmology. 127 (4), 552-554 (2020).
- Xu, L., et al. Chromosome 6p amplification in aqueous humor cell-free DNA Is a prognostic biomarker for retinoblastoma ocular survival. Molecular Cancer Research. 18 (8), 1166-1175 (2020).
- Xu, L., et al. Establishing the clinical utility of ctDNA analysis for diagnosis, prognosis, and treatment monitoring of retinoblastoma: The aqueous humor liquid biopsy. Cancers. 13 (6), (2021).
- Xu, L. Simultaneous identification of clinically relevant RB1 mutations and copy number alterations in aqueous humor of retinoblastoma eyes. Ophthalmic Genetics. 41 (6), 526-532 (2020).
- Polski, A., et al. Longitudinal aqueous humor sampling reflects treatment response in retinoblastoma patients. Investigative Ophthalmology & Visual Science. 61 (7), 1394 (2020).
- . Genome Browser Available from: https://genome.ucsc.edu/cgi-bin/hgTracks?db=hg19&lastVirtModeType=default&lastVirtModeExtraState=&virtModeType=default&3A15578261%_2D15621068&hgsid=1135765621_qIuA0U (2021)
- Navarro Gonzalez, J., et al. The UCSC genome browser database: 2021 update. Nucleic Acids Research. 49 (1), 1046-1057 (2021).
- Li, H. A statistical framework for SNP calling, mutation discovery, association mapping and population genetical parameter estimation from sequencing data. Bioinformatics. 27 (21), 2987-2993 (2011).
- Baslan, T., et al. Genome-wide copy number analysis of single cells. Nature Protocols. 7 (6), 1024-1041 (2012).
- Huber, W., et al. Orchestrating high-throughput genomic analysis with Bioconductor. Nature Methods. 12 (2), 115-121 (2015).
- Baslan, T., et al. Erratum: Genome-wide copy number analysis of single cells. Nature Protocols. 11 (3), 1024-1041 (2016).
- Didion, J. P., Martin, M., Collins, F. S. Atropos: specific, sensitive, and speedy trimming of sequencing reads. PeerJ. 5, 3720 (2017).
- Li, H. Aligning sequence reads, clone sequences and assembly contigs with BWA-MEM. arXiv. , (2013).
- Garrison, E., Marth, G. Haplotype-based variant detection from short-read sequencing. arXiv. , (2012).
- McLaren, W., et al. The ensembl variant effect predictor. Genome Biology. 17 (1), 122 (2016).
- Lai, Z., et al. VarDict: a novel and versatile variant caller for next-generation sequencing in cancer research. Nucleic Acids Research. 44 (11), 108 (2016).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA (2017)
- Adalsteinsson, V. A., et al. Scalable whole-exome sequencing of cell-free DNA reveals high concordance with metastatic tumors. Nature Communications. 8 (1), 1-13 (2017).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA/wiki/Interpreting-ichorCNA-results (2017)
- Berry, J. L., et al. Long-term outcomes of Group D retinoblastoma eyes during the intravitreal melphalan era. Pediatric Blood & Cancer. 64 (12), (2017).
- Berry, J. L., et al. Long-term outcomes of Group D eyes in bilateral retinoblastoma patients treated with chemoreduction and low-dose IMRT salvage. Pediatric Blood & Cancer. 60 (4), 688-693 (2013).
- Francis, J. H., et al. Molecular changes in retinoblastoma beyond RB1: Findings from next-generation sequencing. Cancers (Basel). 13 (1), (2021).
- Schwermer, M., et al. Comprehensive characterization of RB1 mutant and MYCN amplified retinoblastoma cell lines. Experimental Cell Research. 375 (2), 92-99 (2019).
- Davies, H. R. Whole-genome sequencing of retinoblastoma reveals the diversity of rearrangements disrupting RB1 and uncovers a treatment-related mutational signature. Cancers. 13 (4), 754 (2021).
- Lillington, D. M., et al. Comparative genomic hybridization of 49 primary retinoblastoma tumors identifies chromosomal regions associated with histopathology, progression, and patient outcome. Genes, Chromosomes and Cancer. 36 (2), 121-128 (2003).
- Greger, V., et al. Frequency and parental origin of hypermethylated RB1 alleles in retinoblastoma. Human Genetics. 94 (5), 491-496 (1994).
- Raizis, A. M., et al. DNA hypermethylation/boundary control loss identified in retinoblastomas associated with genetic and epigenetic inactivation of the RB1 gene promoter. Epigenetics. 1-15, (2020).
- Munier, F. L., et al. Profiling safety of intravitreal injections for retinoblastoma using an anti-reflux procedure and sterilisation of the needle track. British Journal of Ophthalmology. 96 (8), 1084-1087 (2012).
- Chévez-Barrios, P., et al. Response of retinoblastoma with vitreous tumor seeding to adenovirus-mediated delivery of thymidine kinase followed by ganciclovir. Journal of Clinical Oncology. 23 (31), 7927-7935 (2005).
- Shao, W., Khin, S., Kopp, W. C. Characterization of effect of repeated freeze and thaw cycles on stability of genomic DNA using pulsed field gel electrophoresis. Biopreservation and Biobanking. 10 (1), 4-11 (2012).
- Choudhury, A. D., et al. Tumor fraction in cell-free DNA as a biomarker in prostate cancer. JCI Insight. 3 (21), (2018).
- Gerrish, A., et al. Non-invasive diagnosis of retinoblastoma using cell-free DNA from aqueous humour. British Journal of Ophthalmology. 103 (5), 721-724 (2019).
- Wong, E. Y., Xu, L., Shen, L. Inter-eye genomic heterogeneity in bilateral retinoblastoma via aqueous humor liquid biopsy. NPJ Precis Oncol. 5 (1), 73 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır