Method Article
Водянистая влага как жидкая биопсия при ретинобластоме: прозрачный парацентез роговицы и геномный анализ
В этой статье
Резюме
Водянистая влагалище представляет собой высокопродуктивную жидкую биопсию при ретинобластоме, внутриглазном раке, который не может быть биопсирован in vivo из-за риска экстраокулярного распространения. В данной работе представлен метод безопасного извлечения водянистой влаги с помощью прозрачного парацентеза роговицы и этапы геномного анализа для выявления прогностических биомаркеров.
Аннотация
Существует значительная потенциальная клиническая полезность применения платформы для жидкой биопсии при ретинобластоме, учитывая, что прямая биопсия опухоли у этих пациентов запрещена. Водянистая влага (АГ) образуется в отдельном отсеке от опухоли, но заключена в том же глазном пространстве. Таким образом, это обогащенный источник глазной специфической опухолевой геномной информации, который может быть использован в качестве жидкой биопсии или суррогата биопсии опухоли при этом заболевании. В данной рукописи подробно описана методика безопасного извлечения АГ из глаз с ретинобластомой с помощью прозрачного парацентеза роговицы. Кроме того, представлены этапы геномного анализа, включая выделение и очистку внеклеточной ДНК, секвенирование нового поколения, анализ изменения числа соматических копий (SCNA), идентификацию мутации однонуклеотидного варианта RB1 (SNV) и оценку опухолевой фракции. Была оценена преаналитическая, аналитическая и ранняя клиническая валидность платформы жидкой биопсии АГ; Тем не менее, это не лишено ограничений. В значительной степени это является следствием количества внеклеточной ДНК, которое требуется для определенных этапов анализа. По сравнению с другими платформами жидкой биопсии на основе крови, которые в настоящее время исследуются для лечения ретинобластомы, платформа на основе АГ ограничена объемом биожидкости (и, следовательно, количеством ДНК), которая может быть извлечена из глаза; преимущество заключается в том, что АГ специфична для глаз. Рассматриваемая здесь платформа уникальна тем, что она обнаруживает циркулирующую опухолевую ДНК в АГ с помощью двух механизмов (SCNA и RB1 SNV), что обеспечивает более высокую чувствительность для идентификации геномной информации опухоли. Жидкостная биопсия АГ имеет потенциал для прямого клинического применения в прецизионной онкологии у пациентов с ретинобластомой, особенно для пациентов с двусторонним заболеванием, поскольку АГ специфична для опухолей в каждом глазу. В настоящее время ведутся исследования по применению этой платформы к пациентам с другими опухолями глаза.
Введение
Ретинобластома (РБ) – редкий и уникальный вид рака. Несмотря на то, что это наиболее распространенное первичное внутриглазное злокачественное новообразование, которое формируется в развивающейся сетчатке младенцев и детей ясельного возраста, в мире ежегодно регистрируется всего около 7000 случаев, и примерно 250-300 из них приходится на Соединенные Штаты. Несмотря нато, что в развитых странах выживаемость пациентов приближается к 98% 1, выживаемость глаз на поздних стадиях, которые клинически классифицируются как Международная интраокулярная классификация RB (IIRC)2 Group D/E или AJCC cT2b/3, намного ниже. Многие из этих усовершенствованных глаз энуклеируются либо в первую очередь (в качестве первого лечения), либо вторично (после неудачных попыток терапии по спасению глазного яблока). В современной клинической практике офтальмологической онкологии отсутствуют опухолевые, глазоспецифичные молекулярные биомаркеры, которые в настоящее время используются в клинической практике для помощи в диагностике, прогнозировании выживаемости глаз или мониторинге лечения пациентов с РБ. В значительной степени это связано с тем, что опухолевая ткань доступна только для молекулярного и генетического анализа из энуклеированных глаз, поскольку прямая биопсия опухоли при RB запрещена из-за опасений по поводу экстраокулярного распространения опухоли 3,4,5,6,7,8,9 . Из-за этого запрета предыдущие ретроспективные исследования генетики опухолей RB и их клинических корреляций были ограничены анализом опухолевой ткани, полученной из энуклеированных глаз только 10,11,12,13. Таким образом, при постановке диагноза и на протяжении всей терапии по спасению глаз отсутствовали объективные молекулярные данные, полученные от опухолей. Это ограничило не только понимание биологии опухолей in vivo и способов, которыми эти опухоли изменяются на молекулярном уровне на протяжении всей терапии, но и возможность разработки персонализированных, специфичных для глаз и основанных на геноме планов лечения для этих молодых онкологических больных.
Помимо запрета на биопсию, еще одним уникальным аспектом этого рака является то, что большинство опухолей инициируются биаллельной потерей гена-супрессора опухоли RB1, который модулирует клеточный цикл. Развивающаяся сетчатка чрезвычайно чувствительна к этой потере. У 60% пациентов эта биаллельная инактивация гена RB1 происходит в сетчатке только в виде соматической потери и приводит к одностороннему заболеванию. Тем не менее, у 40% пациентов первоначальная мутация RB1 происходит в зародышевой линии, за которой следует второй «удар» в сетчатке. У этих детей часто наблюдаются множественные опухоли, поражающие оба глаза. Наконец, очень небольшая подгруппа (<2%) опухолей, по-видимому, обусловлена амплификацией MYCN без мутаций в гене RB1. В то время как опухоли, вызванные MYCN, почти всегда не поддаются лечению и требуют энуклеации, в настоящее время нет четкого, объективного способа идентификации этого агрессивного подтипа опухоли при диагнозе14,15. Кроме того, мониторинг активности внутриглазной опухоли RB почти исключительно основан на визуализации и клинических наблюдениях каждого глаза лечащим офтальмологом-онкологом. Не существует золотого стандарта объективных, количественных средств диагностики, прогноза или способа мониторинга динамики опухоли, специфичной для глаза, на протяжении всего лечения. Из-за этих уникальных ограничений для RB перспектива платформы для жидкой биопсии для этого рака является заманчивой. При жидкостной биопсии используются жидкости организма для выделения и секвенирования внеклеточной ДНК, чтобы определить, является ли она опухолевой, известной как циркулирующая опухолевая ДНК (цДНК). В то время как сыворотка исследуется для лечения других видов рака, RB цДНК, обнаруженная в сыворотке, не является глазоспецифичной, что имеет явные ограничения для 40% пациентов, страдающих от двустороннего заболевания. Кроме того, он был описан только в условиях прогрессирующего внутриглазного или метастатического заболевания, как правило, с низкой опухолевой фракцией (<5%)16.
В попытке решить эти реальные клинические проблемы, стоящие перед пациентами и их семьями, в 2017 году мы продемонстрировали, что водянистая влага (AH, прозрачная жидкость перед глазом) является высокопродуктивным источником цДНК, который может быть использован в качестве жидкой биопсии — или, скорее, в качестве суррогата биопсии опухоли — для оценки RB17. 18,19. На сегодняшний день было выявлено более 200 образцов, цДНК в >95% образцов, включая менее продвинутые глаза IIRC групп A, B и C, а также геномные различия между глазами у двусторонних пациентов18,19. Эта ДНК может быть безопасно и эффективно выделена для обнаружения соответствующих молекулярных биомаркеров в глазах, которые активно проходят лечение или ранее не подвергались лечению 18,20,21. Платформа жидкой биопсии АГ также может быть использована для идентификации диагностических патогенных вариантов RB1 или первичной амплификации MYCN, которая инициирует онкогенез21,22. Важно отметить, что мы идентифицировали прогностическую молекулярную сигнатуру — наличие усиления хромосомы 6p с амплитудой ≥1,5 к медиане или фокальной амплификации MYCN, что связано с увеличением в 16,5 раз вероятности потери контроля над внутриглазной опухолью, требующей удаления глаза 18,20,21. Наконец, было продемонстрировано, что изменения фракции опухоли цДНК (TFx) в АГ коррелируют с терапевтическим ответом, поскольку более высокие уровни коррелируют с активным заболеванием, а более низкие уровни связаны с положительным ответом на лечение. Учитывая эти приложения и их потенциальную клиническую полезность, мы хотели описать методологию биопсии и оценки АГ. Это включает в себя прозрачный парацентез роговицы для получения образцов и протокол геномного анализа, в частности, построение и секвенирование библиотеки cfDNA, определение амплитуды SCNA, идентификацию патогенного варианта RB1 и расчет TFx.
протокол
Это исследование проводится с одобрения Детской больницы Лос-Анджелеса и Институционального наблюдательного совета Университета Южной Калифорнии и соответствует принципам Хельсинкской декларации. Письменное информированное согласие всегда получают от законных опекунов всех участников.
Схема рабочего процесса жидкой биопсии АГ представлена на рисунке 1.
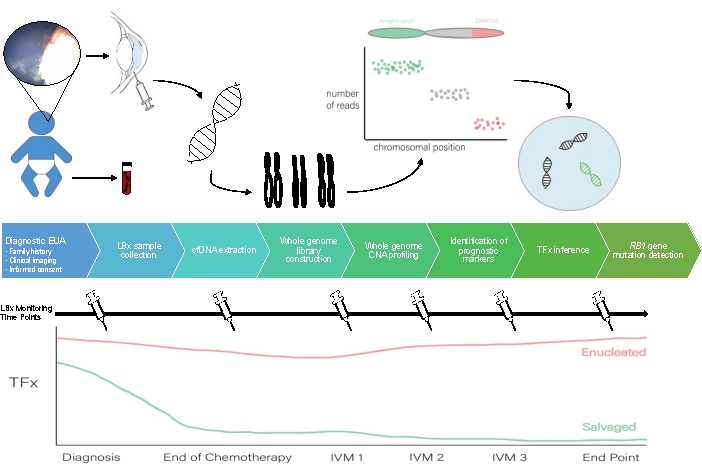
Рисунок 1: Рабочий процесс для жидкостной биопсии АГ в соответствии с протоколом, описанным в настоящем документе. ЭУА, обследование под наркозом; LBX, жидкая биопсия; cfDNA — внеклеточная ДНК; CNA, изменение номера копии; TFx — опухолевая фракция; ИВМ, интравитреальный мелфалан. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
1. Хирургическое вмешательство:
ПРИМЕЧАНИЕ: Эта процедура проводится во время планового обследования под наркозом (EUA) для клинической оценки пациентов с RB. Процедура парацентеза для удаления АГ должна проводиться только обученным офтальмологическим хирургом, прошедшим стандартное обучение в области глазной хирургии.
- Критерии отбора и включения пациентов следующие.
- Убедитесь, что камера сформирована и очищена без мелочения от опухоли, синехий или катарактозного хрусталика.
ПРИМЕЧАНИЕ: В некоторых глазах с продвинутыми заболеваниями камера слишком мелкая на момент постановки диагноза, чтобы безопасно извлечь АГ. В этих случаях рекомендуется подождать до окончания первого цикла системной или внутриартериальной химиотерапии. Как только основная опухоль уменьшается, камера, как правило, углубляется, что позволяет безопасно добраться до нее. - Убедитесь, что все конструкции хорошо видны, а давление составляет <22 мм рт.ст., чтобы не было быстрого обмеления камеры из-за динамики давления. Это верно для всех временных точек, но особенно критично, когда АГ принимается при постановке диагноза.
- Убедитесь в отсутствии прямого вовлечения переднего сегмента опухолью, что оценивается с помощью прямой визуализации и ультразвуковой биомикроскопии. Этот критерий включения обычно определяется во время EUA.
- Убедитесь, что камера сформирована и очищена без мелочения от опухоли, синехий или катарактозного хрусталика.
- После того, как пациент будет признан подходящим и даст согласие, отведите его в операционную. Позвольте лечащему анестезиологу начать анестезию в соответствии с обычной практикой ЭУА при оказании клинической помощи пациентам с РБ.
- После того, как пациент будет интубирован и помещен под действием седативных препаратов, а также после завершения всех клинических обследований, визуализации и любых местных терапевтических потребностей (например, лазерной или криотерапии), относящихся к EUA, извлеките АГ для платформы жидкой биопсии. Подготовьте и задрапируйте глаз обычным стерильным способом. Это может быть выполнено медсестрой или оперирующим хирургом.
- Перед EUA поместите расширяющие капли, обычно используемые в учреждении для EUA, в хирургический глаз.
ПРИМЕЧАНИЕ: Здесь используются комбинированные глазные капли, состоящие из 2,5% фенилэфрина, 1% циклопентолата и 1% тропикамид. Тем не менее, любых стандартных капель, используемых для расширения для EUA, достаточно; глаз не обязательно должен быть расширен просто для удаления АГ. - Поместите 5% каплю бетадина в хирургический глаз и нанесите ее с помощью губки, начиная от центра и двигаясь по периферии. Включите верхний и нижний края век в хирургическую подготовку. Завершите хирургическую подготовку с помощью бетадина три раза, а затем подождите не менее двух минут, прежде чем продолжить.
- Накройте голову пациента стерильным синим полотенцем и подложите его под голову, чтобы оно не упало. Высушите ресницы и периорбитальную область стерильным синим полотенцем или марлей.
- Дайте оперирующему хирургу потереться, наденьте халат и наденьте перчатки.
- Накройте пациента стерильными голубыми простынями, оставив хирургический глаз открытым. Поместите стерильную крышку на зеркало для оптимальной визуализации стерильного поля.
ПРИМЕЧАНИЕ: Дополнительная местная анестезия в нашем учреждении не требуется, так как ребенок находится под общей анестезией для EUA. - Выполняйте тайм-аут в соответствии с протоколом учреждения. В этом случае первый тайм-аут делается для EUA и второй тайм-аут для проверки глаза (глаз) перед процедурой.
- Перед EUA поместите расширяющие капли, обычно используемые в учреждении для EUA, в хирургический глаз.
- С помощью операционного микроскопа выполнить прозрачный парацентез роговицы с экстракцией 0,1 мл АГ иглой 32 G на шприце объемом 1 куб. см.
- Перед началом процедуры смочите глаз стерильным сбалансированным раствором соли (каждый мл содержит хлорид натрия 0,64%, хлорид калия 0,075%, дигидрат хлорида кальция 0,048%, гексагидрат хлорида магния 0,03%, тригидрат ацетата натрия 0,39%, дигидрат цитрата натрия 0,17%, гидроксид натрия и/или соляную кислоту (для регулировки pH), а также воду для инъекций) для поддержания смазки роговицы; Это стандартная коммерческая подготовка.
- Убедитесь, что игла 32 G зафиксирована по люэру на шприце объемом 1 куб. см и что в шприце нет давления (перемещая поршень шприца внутрь и наружу несколько раз перед использованием).
- После этого проведите иглу через прозрачную роговицу в лимбе (перпендикулярно ей, как это принято при парацентезе) и оставайтесь в передней камере над периферической расширенной радужной оболочкой.
- Держите кончик иглы скошенным вверх перед радужной оболочкой под прямой визуализацией через микроскоп во время экстракции. При желании стабилизируйте глаз с помощью щипцов 0,12, когда игла проходит через роговицу.
ПРИМЕЧАНИЕ: Никогда не должно быть контакта между кончиком иглы и какой-либо структурой глаза; Он должен оставаться над периферической радужной оболочкой в средней передней камере. - Извлеките 0,1 мл АГ. Манипулируйте поршнем шприца недоминирующей рукой хирурга (но с практикой) или с помощью обученного ассистента, не перемещая иглу. Не стоит терять прямую визуализацию кончика иглы. Уделяйте приоритетное внимание анатомии глаза и при необходимости принимайте меньше АГ, чтобы камера оставалась сформированной.
- После извлечения аккуратно извлеките иглу из передней камеры. Следите за тем, чтобы камера оставалась сформированной, но слегка мелкой; Давление будет мягким, но физиологичным. Как только игла будет извлечена из глаза, обильно промойте глаз стерильной водой; На этом этапе стерильная вода предпочтительнее, чем балацированный раствор соли в качестве меры безопасности, поскольку вода лизирует клетки.
- Осмотрите место установки иглы на предмет утечки. Если есть утечка, используйте аппликатор с ватным наконечником, чтобы слегка надавить на место инъекции в течение 30 секунд, прежде чем снова проверить наличие утечки. При необходимости повторите процесс.
ПРИМЕЧАНИЕ: При таком подходе никогда не требовалось использовать более инвазивные методы для предотвращения любых утечек. Иногда за этой процедурой следует интравитреальное введение химиотерапии; В данной методике протокол фокусируется на экстракции АГ в качестве первичной процедуры.
- Осмотрите место установки иглы на предмет утечки. Если есть утечка, используйте аппликатор с ватным наконечником, чтобы слегка надавить на место инъекции в течение 30 секунд, прежде чем снова проверить наличие утечки. При необходимости повторите процесс.
- Как только утечки не будет, процедура считается завершенной. Снимите стерильные простыни с пациента и очистите лицо от бетадина.
- Осторожно извлеките кончик иглы из шприца, закройте образец стерильным колпачком с помощью люэровского замка, чтобы не потерять образец, и наклейте соответствующую маркировку на шприц.
ПРИМЕЧАНИЕ: Это должно быть сделано координатором клинических исследований или хирургом во время экстубации ребенка.- После извлечения образца образец следует хранить в шприце с крышкой при температуре -80 °C; Образцы могут быть помещены на сухой лед для транспортировки в соответствующую морозильную камеру из операционной.
- Поместите одну каплю глазных капель с антибиотиком в соответствии с предпочтениями хирурга на поверхность хирургического глаза, прежде чем пациент будет отправлен на выздоровление. Здесь используется комбинация стероидно-антибиотических глазных капель, и глаз не зашивается.
- После завершения процедуры лечащий анестезиолог обеспечивает надлежащую экстубацию. Доведите пациента до выздоровления.
- Выписать пациента на дом в соответствии с послеоперационным протоколом учреждения.
- Сообщите пациенту, что глаз не нужно закрывать повязкой или защитным покрытием.
- Предупредить пациента не погружать полностью голову ни в ванну, ни в бассейн в течение 24 часов, а родителей не тереть глаз пациента (ребенка); Других ограничений на активность пациента нет.
- Сообщите пациенту, что он/она/они вряд ли будет испытывать боль от парацентеза, но может испытывать боль от сопутствующих процедур во время EUA. Пациент может принимать ацетаминофен или ибупрофен в случае любого дискомфорта, как предлагает хирург.
2. Выделение и очистка cfDNA
- Выполните выделение и обработку ДНК в течение 72 часов после экстракции АГ.
- Разморозьте АГ при комнатной температуре. Регулярно проверяйте образец и переходите к извлечению сразу после завершения размораживания.
- Извлеките cfDNA из AH и разбавьте его до 50 мкл раствора AVE (входит в комплект) с помощью набора для выделения и очистки cfDNA (подробнее см. Таблицу материалов ) в соответствии с инструкцией производителя.
3. Секвенирование нового поколения (NGS) и контроль качества (QC)
- Создайте библиотеки ДНК для секвенирования с помощью набора для секвенирования библиотеки ДНК (см. Таблицу материалов) в соответствии с инструкцией производителя. Амплифицируйте библиотечную ДНК с помощью 14 циклов полимеразной цепной реакции (ПЦР), как описано в руководстве по набору для секвенирования библиотеки ДНК.
ПРИМЕЧАНИЕ: Окончательные библиотеки могут храниться при температуре -20 °C до 1 месяца перед окончательным секвенированием для геномного анализа. - Секвенирование библиотек ДНК на платформе NGS (см. Таблицу материалов) в соответствии с протоколом производителя в соответствии с протоколом одностороннего 50 циклов или парного протокола 150 циклов.
ПРИМЕЧАНИЕ: Другие платформы NGS будут работать в принципе (хотя здесь это не было опробовано) с подходящими адаптерами для ячейки секвенирования потока. - Выполните контроль качества для любых образцов АГ, которые были взяты на момент постановки диагноза или первичной энуклеации.
ПРИМЕЧАНИЕ: Контроль качества не может быть выполнен для образцов, взятых в другие моменты времени, так как масса ДНК будет слишком низкой и выйдет за пределы диапазона обнаружения для описанных ниже этапов.- Используйте по 1 мкл экстрагированной ДНК для количественного анализа ДНК и анализа профилирования размера (см. Таблицу материалов) в соответствии с протоколами производителя.
ПРИМЕЧАНИЕ: Пик должен быть около 300.о. Если она меньше 150.о., образец был скомпрометирован. В Дополнительном файле 1A приведен пример образца, который должен пройти контроль качества, и в Дополнительном файле 1B приведен пример образца, который не должен проходить контроль.
- Используйте по 1 мкл экстрагированной ДНК для количественного анализа ДНК и анализа профилирования размера (см. Таблицу материалов) в соответствии с протоколами производителя.
4. Анализ данных по изменению числа соматических копий (SCNA)
- Сопоставьте чтения, полученные из NGS (раздел 3), с геномом человека (hg19, Genome Reference Consortium GRCh37, University of California Santa Cruz Genome Browser database)24,25 с помощью выравнивателя.
- Удалите дубликаты ПЦР (samtools rmdup26).
- Нормализовать содержание гуанина-цитозина путем вычисления процентного содержания оснований гуанина и цитозина в каждом контейнере из референсного генома. Пример программы описан в Baslan et al.27.
- Чтобы получить количество копий сегментов ДНК, разделите геном на 5000 контейнеров переменной длины, а затем рассчитайте относительное количество прочтений, содержащихся в каждом контейнере.
- Используйте безссылочные коэффициенты log2 для определения оценок числа копий. Возьмем среднее окно подсчета нормальных аутосомных хромосом.
- Выполните сегментацию с помощью круговой бинарной сегментации с помощью DNAcopy (Bioconductor28).
- Определите SCNA как положительные при отклонении на 20% от исходного уровня (коэффициент log2 = 0), что означает потери при коэффициенте log2 ≤ 0,2 (коэффициент 0,87 или ниже определяет удаление) и выигрыш при коэффициенте log2 ≥ 0,2 (коэффициент 1,15 или выше определяет усиление).
ПРИМЕЧАНИЕ: Эти пороговые значения согласуются с ранее установленными анализами жидкостной биопсии27,29.
5. Мутационный анализ образцов АГ на RB1
- Кроме того, амплифицируйте целые библиотеки генома до 500 нг каждая для целевого NGS на основе захвата для обнаружения мутаций в соответствии с протоколом производителя.
- Выполняйте парное секвенирование платформы NGS со скоростью 150.о. или 50.о. на захваченных библиотеках до >100x по протоколу производителя.
- Обработка данных NGS. В данном исследовании используется внутренний конвейер, основанный на конвейере bcbio в Центре персонализированной медицины CHLA.
- Отрежьте необработанные данные fastq от адаптеров и баз низкого качества с помощью Atropos31 и выровняйте его по эталону GRCh37 с помощью BWA-MEM и NovoAlign (v3)32,33.
- Пометьте дубликаты с помощью FreeBayes34 , а затем определите вариант зародышевой линии.
Примечание: В инструментах вызова вариантов FreeBayes каждая позиция генома образца сравнивается с референсным геномом, а количество аллелей математически моделируется для получения меры вероятности генотипа34. - Выполните аннотирование вариантов с помощью Ensembl Variant Effect Predictor (v96)35 , следуя шагам 5.3.4-5.3.5.
- Используйте VarDict для определения соматических вариантов в АГ или опухоли без парного нормального образца крови (т.е. слепых к варианту зародышевой линии)36.
- Вызов потери гетерозиготности, если непрерывные варианты региона имеют ≤3% альтернативных аллелей.
ПРИМЕЧАНИЕ: Коммерческое программное обеспечение для геномного анализа также может быть использовано с указанными выше параметрами.
6. Определение cfDNA TFx
- Оцените TFx для каждого секвенированного образца cfDNA AH с помощью программного обеспечения ichorCNA (программное обеспечение для оценки TFx на основе CNA)37.
ПРИМЕЧАНИЕ: Это стандартное программное обеспечение, используемое в жидкостных биопсиях крови для определения cfDNA TFx38. Использование программного обеспечения на АГ было ранее опубликовано21,23. - По отдельности рассмотрите геномные профили и соответствующие решения TFx, чтобы убедиться в правильности оценки TFx для каждого образца39.
Результаты
Всесторонние результаты обследования двух глаз (случаи 33 и 47) представлены ниже. Количество случаев остается в соответствии с предыдущими публикациями для целей сравнения 18,20,21. Лечащие врачи не обращали внимания на результаты жидкостной биопсии АГ во время терапии. Все решения о лечении не были рандомизированы и принимались в соответствии с ранее опубликованным стандартом рутинной медицинской помощи40,41. Данные о клинических исходах оставались отделенными от геномных данных до окончательного анализа. Исходные данные из представленных результатов доступны по запросу у автора, отвечающего за переписку. Благодаря финансированию NIH данные регулируются политикой обмена геномными данными NIH и в будущем будут доступны другим исследователям через репозиторий данных NIH с контролируемым доступом (dbGAP); Он также доступен по запросу от автора, отвечающего за переписку.
Случаи 33 и 47 относятся к IIRC группыD 2 с очень похожими клиническими проявлениями. Таким образом, по решению родителей они получали терапию с сохранением глазного яблока, а также лечили глазных и медицинских онкологов, в частности, системную химиотерапию в случае 47 и внутриартериальную химиотерапию в случае 33. Основываясь на принятом в настоящее время клиническом прогнозе, который опирается на группу IIRC глаза2, прогнозируемый успех спасения глазного яблока для глаз этих двух пациентов был бы одинаковым: 65%-70% для группы D является средним показателем, хотя этот показатель варьируется в зависимости от лечебного центра41. Однако, основываясь на данных группы D, собранных до сих пор с помощью молекулярного профилирования, направленного на опухоль в этом центре, прогнозируемый успех спасения глазного яблока составит 72% для случая 47 (без выявления прироста 6p в АГ) и 9% для случая 33 (с выявленным приростом 6p)18,20,21. Это показано ниже.
Случай 47 является примером глаза с успешным обнаружением SCNA и SNV с помощью платформы жидкой биопсии АГ на момент постановки диагноза, наряду с тенденциями TFx, соответствующими ответу на лечение в продольном отношении. Пациентка женского пола в возрасте 15 месяцев поступила с формой IIRC группы D размером 14 мм x 9 мм, стадией cT2b RB со сферическим посевом стекловидного тела. Она была отрицательной на мутацию зародышевой линии RB1 , что было определено по результатам рутинного клинического тестирования лейкоцитов сыворотки крови. Из АГ при постановке диагноза в АГ были идентифицированы 1q и 6p в АГ в дополнение к двум другим нечасто повторяющимся RB SCNA 7p и 13q (рис. 2). Следует отметить, что амплитуда прироста в 6 пенсов составила 1,2, и только амплитуды ≥ соотношения 1,5 к медиане предвещают плохой прогноз. Учитывая, что фокальная амплификация MYCN отсутствовала, а прирост 6p был ниже порога 1,5, прогноз для спасения при лечении на основе молекулярных особенностей был высоким. Тот же образец АГ, взятый при постановке диагноза, также был оценен на предмет выявления патогенных вариантов RB1 , которые выявили SNV c.958C>T, p.Arg320* в гене RB1 с частотой аллеля вариантов 87,01% (95% доверительный интервал, 79,7–94,6%). Этот пациент получал лечение шестью циклами карбоплатина, этопозида и винкристина (ВЦВ) с регрессией заболевания, но у него наблюдалось стойкое сферическое и пылевидное зарастание, которое потребовало трех последовательных интравитреальных инъекций мелфалана (IVM). Во время лечения ЭКО образцы А-С АГ (с интервалом в две недели) продемонстрировали полную нормализацию геномного профиля, снижение TFx и снижение концентрации ДНК — и все это одновременно с клиническим регрессом заболевания (рис. 3). После постановки диагноза значения TFx оставались ниже предела обнаружения в 5% в течение оставшейся части лечения. Через 19 месяцев наблюдения глаз оставался стабильным без рецидива опухоли или экстраокулярного распространения заболевания.
Это в отличие от случая 33. У этого 22-месячного мужчины наблюдалась в целом сходная клиническая картина с новообразованием сетчатки размером 11 мм x 18 мм и зарастанием стекловидного тела пылевидного типа, что соответствовало одностороннему IIRC группы D, стадия cT2b. Он также был отрицательным на мутацию зародышевой линии RB1, что было определено по результатам рутинного клинического тестирования лейкоцитов сыворотки крови. АГ, взятая при постановке диагноза, продемонстрировала прирост RB SCNA на 1q, на 6p (в данном случае с амплитудой 1,5 к медиане) и потерю на 16q вместе с фокальной потерей 6q (рис. 4A). Основываясь на прогностическом молекулярном профиле, этот глаз имел 16,5 повышенную вероятность энуклеации на основе наличия 6p ≥ амплитуде 1,5. В этом образце не был идентифицирован RB1 SNV, несмотря на полный охват всей длины гена RB1. Одна из причин, по которой RB1 SNV может быть не идентифицирован, заключается в первичных опухолях, вызванных MYCN, где не всегда ожидается одновременная мутация RB1 14,15,42,43,44,45. Тем не менее, в случае 33 не было продемонстрировано никаких доказательств амплификации MYCN ни в одном из образцов АГ или в энуклеированной опухолевой ткани (рис. 5). Более вероятным объяснением отрицательного результата RB1 SNV является то, что первоначальный онкогенез был обусловлен эпигенетической дисрегуляцией (например, метилированием промотора)46,47, известным явлением при RB, которое не может быть идентифицировано с помощью описанного здесь анализа.
Первоначальное лечение этого пациента состояло из четырех полных циклов внутриартериальной химиотерапии мелфаланом с последующими четырьмя инъекциями ЭКО из-за стойкого посева стекловидного тела. Три образца АГ (каждый с интервалом в четыре недели) были получены во время терапии IVM и продемонстрировали те же три ПХНК, которые присутствовали при постановке диагноза (Рисунок 5). Значения TFx оставались высокими на протяжении всего лечения, несмотря на уменьшение объема первичной опухоли, отражающее активные семена опухоли в стекловидном теле. Это демонстрирует, как TFx является репрезентативным для общего состояния заболевания глаза. Через шесть месяцев после постановки диагноза, из-за стойкого активного заболевания, глаз был энуклеирован. Геномный профиль, полученный из опухолевой ткани на тот момент, продемонстрировал 92,81% совпадение с образцом АГ, полученным на момент постановки диагноза (рис. 4В).
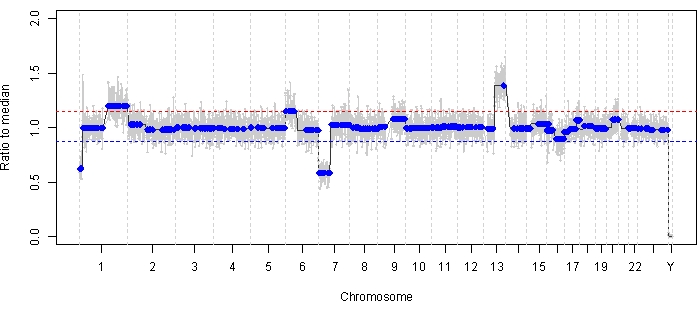
Рисунок 2: Геномный профиль при постановке диагноза для случая 47. В АГ, взятой на момент постановки диагноза, были выявлены высокорецидивные SCNA RB на 1q и 6p gain, а также с невысокорецидивными RB SCNA на 7p и 13q приросты. Красная линия представляет порог прибыли, а синяя линия представляет порог убытка. Примечательно, что амплитуда усиления 6p составила <1,5 отношения к медиане, что ниже порога молекулярной сигнатуры, предвещающего плохой прогноз. Таким образом, основываясь на отсутствии отрицательных биомаркеров для спасения глаза, можно было бы предсказать, что этот глаз будет реагировать на терапию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
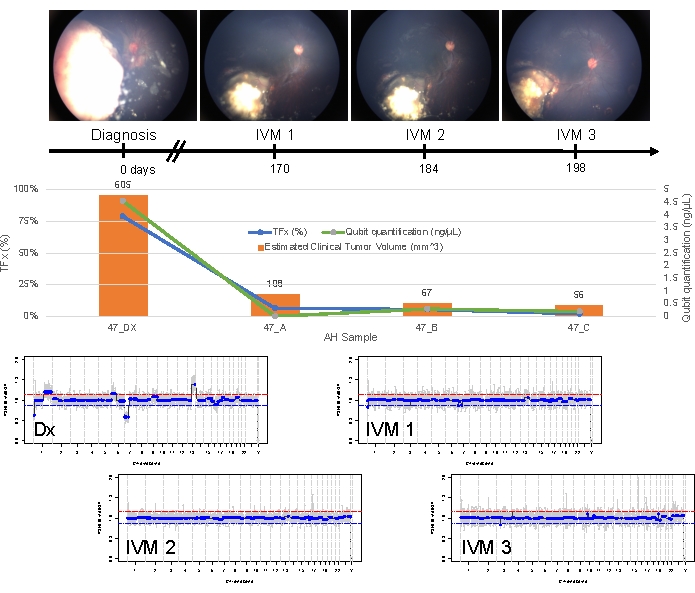
Рисунок 3: Продольная информация по случаю 47. Это включает в себя фотографии глазного дна, количественную оценку cfDNA, оценку клинического объема опухоли по результатам измерений B-сканирования, геномные профили и оценки TFx для каждого клинического момента времени, в который был взят образец АГ (Dx = диагноз, A = IVM1, B = IVM2, C = IVM3). Этот глаз отреагировал на лечение и оставался спасенным в течение 19 месяцев наблюдения. Со временем наблюдалось снижение количества cfDNA, что согласуется с ранее опубликованными исследованиями, показывающими самый высокий выход, полученный при постановке диагноза. TFx также уменьшался по мере лечения, отражая разрешение посева и уменьшение объема основной опухоли сетчатки (объемы опухоли указаны над оранжевой полосой каждой клинической точки времени). Как и ожидалось при клиническом регрессе заболевания, геномные профили также нормализовались. В геномных профилях красная линия представляет порог прироста, а синяя линия представляет порог потерь. Этот рисунок был перепечатан с разрешения Xu, L. et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
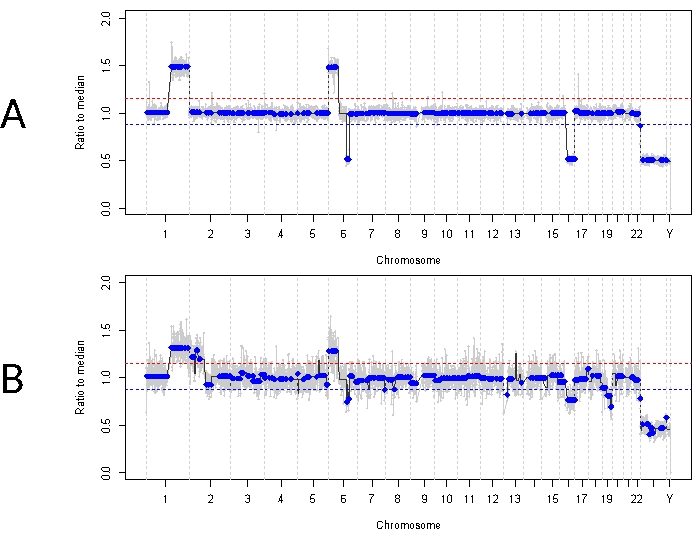
Рисунок 4: Геномные профили для случая 33. Красная линия представляет порог прироста, в то время как синяя линия представляет порог потери (А) геномного профиля при постановке диагноза для случая 33. При постановке диагноза в АГ были выявлены высокорецидивирующие РБ SCNA прирост 1q, прирост 6p и потеря 16q, в дополнение к фокальной потере 6q. Примечательно, что амплитуда усиления 6p составила 1,5 к медиане, что указывает на плохой прогностический молекулярный биомаркер. Таким образом, основываясь на этой молекулярной сигнатуре, мы можем предположить, что этот глаз имеет значительно повышенную вероятность неудачи лечения. (B) Геномный профиль, полученный из энуклеированной опухолевой ткани, который в значительной степени корординировался с профилем, полученным из АГ при постановке диагноза. Из-за смешивания с нормальной тканью сетчатки, ОЦНК из опухолевой ткани могут демонстрировать меньшую амплитуду по сравнению с АГ из-за разбавленного TFx. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
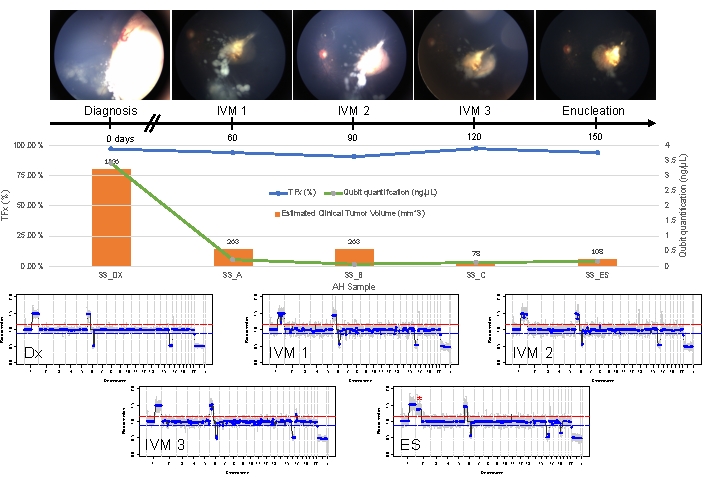
Рисунок 5: Продольная информация по Случаю 33. Это включает в себя фотографии глазного дна, количественную оценку внеклеточной ДНК, оценку клинического объема опухоли по результатам измерений B-сканирования (объемы опухоли указаны над оранжевой полосой каждой клинической временной точки), геномные профили и оценки TFx для каждой клинической точки времени, в которой была взята АГ (Dx = диагноз, A = IVM1, B = IVM2, C = IVM3, SE = вторичная энуклеация). Этот глаз не реагировал на лечение, что в конечном итоге потребовало вторичной энуклеации (ЭС). Это было связано с упорно активным посевом, сопровождающимся рецидивом апикальной опухоли. Количество CfDNA со временем уменьшалось, что согласуется с ранее опубликованными исследованиями, показывающими самый высокий результат, полученный при постановке диагноза (прирост 1q, прирост 6p, потеря 16q и фокальная потеря 6q). Тем не менее, TFx оставался высоким на протяжении всего лечения, что является результатом стойкого посева, который все еще выделяет cfDNA опухолевого происхождения в АГ. Геномные профили были последовательными и показывали те же три SCNA, которые присутствовали при постановке диагноза. В АГ, полученной на ES, был обнаружен новый крупномасштабный прирост 2p (*) и потеря 19q, что свидетельствует о клональной эволюции во время рецидива апикальной опухоли. В геномных профилях красная линия представляет порог прироста, а синяя линия представляет порог потерь. Этот рисунок был перепечатан с разрешения Xu, L. et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный файл 1: Пример (А) образца, который должен пройти контроль качества, с пиком около 300.н. и (Б) образца, который не должен пройти контроль качества, с пиком около 150.н. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Прозрачный парацентез роговицы — это процедура, обычно выполняемая по нескольким диагностическим и/или терапевтическим показаниям в офтальмологии. В частности, для РБ он является частью стандартного протокола интравитреальной химиотерапии, направленного на снижение внутриглазного давления перед инъекцией для предотвращения рефлюкса к месту инъекции48. Несмотря на то, что это обычная процедура, она не совсем лишена риска; Предыдущая догма заключалась в том, что игла никогда не должна входить в глаз с активным RB. Эта догма развивалась в течение последнего десятилетия, сначала благодаря формирующей работе Патрисии Шевес-Барриос по инъекционной аденовирусной векторнойтерапии49, за которой последовали прогрессивные методы повышения безопасности глазных инъекций при РБ, разработанные Франсисом Мунье48. Эта работа проложила путь к извлечению АГ для использования в качестве жидкой биопсии или суррогата биопсии опухоли для этого рака. Теперь мы являемся первым центром, сообщившим о полезности платформы и предварительных результатах безопасности от АГ, взятых на момент постановки диагноза. Часть описанных здесь методов предназначена для обеспечения безопасности отбора пациентов и процедурных аспектов экстракции АГ при РБ. Во-первых, иглы могут проникать только в переднюю камеру и не должны соприкасаться с радужной оболочкой или хрусталиком, так как это может вызвать рубцевание радужки или катаракту, что ограничивает возможности хирурга по контролю за опухолью. Наиболее важно, чтобы игла никогда не проникала в полость стекловидного тела (если только она не сочеталась с доставкой химиотерапии, как в случае с IVM) и не контактировала с опухолью, поскольку это гипотетически повышает риск посева опухоли и экстраокулярного распространения заболевания 3,4,5. Обе эти структуры находятся позади передней камеры и отделены от нее хрусталиком и радужной оболочкой. Чтобы избежать повреждения каких-либо структур глаза, важно постоянно держать скос иглы вверху, над периферической радужной оболочкой и всегда под прямой визуализацией с помощью хирургического микроскопа. Существует риск незначительного вытекания АГ из места введения иглы; Если это произойдет, он рассосется с помощью легкого надавливания с помощью аппликатора с ватным наконечником. Использование самой маленькой доступной иглы калибра и обеспечение медленного извлечения иглы из того же тракта без бокового сдвига снизит этот риск. Хотя ожидается небольшое обмеление передней камеры, камера должна оставаться сформированной без прикосновения роговицы радужной оболочки, а внутриглазное давление должно быть мягким, но физиологичным.
Что касается геномного анализа, то он включает в себя несколько важных этапов. Наиболее важным является обращение с образцом небольшого объема после извлечения из глаза; крайне важно, чтобы образец оставался замороженным в течение всего времени до обработки, чтобы предотвратить деградацию ДНК, которая может произойти при повторных циклах замораживания и размораживания50. Обеспечение того, чтобы образцы помещались на сухой лед сразу после экстракции и переносились в морозильную камеру при температуре -80 °C, помогает обеспечить это. После того, как образцы начали обработку, этапы контроля качества являются основной возможностью для устранения неполадок, гарантируя, что cfDNA собрана в высококачественные библиотеки. С помощью количественного определения ДНК и профилирования размера фрагментов ДНК можно проводить контроль качества образцов, взятых во время первичной энуклеации или во время постановки диагноза, благодаря более высокому выходу cfDNA, присутствующей в этих образцах18,21. Когда полученный пик составляет около 300.о., это гарантирует, что cfDNA будет распознана платформой NGS. Если полученный пик короче 150.о., что указывает на то, что большинство обнаруженных фрагментов являются библиотечными конструкционными праймерами или адапторными олигопластами, образец был скомпрометирован и не должен подвергаться дальнейшей обработке на SCNA. Однако, по нашему опыту обработки сотен образцов, менее 5% необходимо удалить для контроля качества из-за плохого коэффициента выравнивания показаний20. Наряду со стандартизированными нами методами сбора, обработки, хранения и обработки образцов, эта процедура демонстрирует преаналитическую валидность платформы жидкой биопсии АГ.
Биопсия жидкости АГ также имеет аналитическую валидность, основанную на ее способности точно и надежно обнаруживать патогенные мутации RB1 и СТАК, со средним соответствием >95% между геномными профилями, полученными из образцов АГ и соответствующей опухолевой ткани 18,20,21,22,23. Несмотря на продемонстрированную аналитическую валидность платформы, она не лишена ограничений. Мутационный анализ RB1 может быть проведен только на образцах с >10 нг cfDNA, которые чаще всего получают в глазах, не получающих лечения, на момент постановки диагноза или первичной энуклеации18,21. Это связано с более низкой концентрацией cfDNA, присутствующей в образцах АГ из глаз, которые активно проходят лечение, по сравнению с АГ на момент постановки диагноза или во время первичной энуклеации. Дополнительным ограничением является то, что SCNA не могут быть обнаружены при TFxs ниже 5%, что препятствует мониторингу заболевания в глазах, где опухолевая нагрузка значительно снизилась; По нашему опыту, чаще всего это происходит в глазах, реагирующих на интравитреальную химиотерапию23.
Для определения TFx cfDNA в АГ используется программное обеспечение для оценки TFx на основе CNA. Это программное обеспечение является стандартным и принятым инструментом для расчета TFx при жидкостной биопсии, а его алгоритм был подробно описан38,51. Вкратце, программное обеспечение для оценки TFx на основе CNA прогнозирует крупномасштабные SCNA в секвенированной cfDNA, используя скрытую марковскую модель. Оценки TFx рассчитываются на основе присутствия SCNA с учетом различий в субклональности и плоидности в каждом локусе, и из них программное обеспечение для оценки TFx на основе CNA выбирает оптимальное решение TFx38. Тем не менее, неотъемлемым ограничением программного обеспечения для оценки TFx на основе CNA является то, что TFx рассчитывается на основе наличия SCNA в выборке; таким образом, он не может определить TFx в образцах без SCNA (т.е. с плоскими геномными профилями)38. Как было продемонстрировано ранее, не все опухоли RB имеют SCNA 14,15,18,21,23,45. Таким образом, очень низкий уровень TFx, определенный с помощью программного обеспечения для оценки TFx на основе CNA, означает, что либо 1) образец AH не содержит измеримой cfDNA опухолевого происхождения, либо 2) опухолевая cfDNA присутствует, но она не может быть обнаружена программным обеспечением для оценки TFx на основе CNA из-за отсутствия SCNA38. Вариантная фракция аллеля (VAF) для SNV является суррогатом TFx. По этой причине мы работаем над разработкой конвейера TFx на основе RB1 на основе VAF, чтобы позволить глазам RB без SCNA также получать продольный мониторинг TFx. Учитывая, что все опухоли RB, за исключением первичных опухолей, вызванных MYCN 14,15,42,43,44,45, содержат соматические мутации в гене RB1, конвейер, не зависящий от SCNA, расширит применение протокола жидкостной биопсии, представленного в настоящем документе. Кроме того, поскольку SNV можно отслеживать до уровня TFxs ниже 5%, это повысит чувствительность нашей платформы.
Описанная здесь платформа жидкой биопсии АГ не является единственной платформой для жидкой биопсии, которая существует в литературе по RB, но, в частности, она является первой, которая описала водную воду как обогащенный источник опухолевой ДНК и первая, которая описала обнаружение цДНК с помощью двух механизмов (SCNA и RB1 SNV) в любой биожидкости на основе опубликованных на сегодняшний день работ. Обладая способностью обнаруживать цДНК двумя способами, жидкая биопсия АГ имеет более высокую чувствительность, чем другие платформы в литературе. Например, другая группа успешно обнаружила цоДНК RB в АГ с RB1 SNV52. Тем не менее, эта платформа полагалась на целевые чтения NGS, основанные на априорных знаниях SNV. В отличие от этого, платформа, описанная в этой рукописи, использует несмещенную WGS, что дает ей возможность обнаруживать SCNA и SNV. Также были опробованы жидкие биопсии на основе крови, хотя полученная cfDNA постоянно была ниже порога для обнаружения SCNA, который является прогностическим для вероятности спасения глаз (в настоящее время не было показано, что RB1 SNV являются прогностическими для спасения глаз, Тем не менее, роль в выявлении метастатического заболевания может меняться)19. Kothari et al. описали RB1 SNV в плазме крови пациентов с RB, но только у пациентов с прогрессирующим внутриглазным заболеванием, требующим энуклеации16. Описанная здесь платформа жидкой биопсии АГ обладает способностью обнаруживать цДНК в АГ менее продвинутых глаз даже без наличия посева19,21. Кроме того, жидкая биопсия на основе крови не специфична для глаз, так как цДНК, выделенная из сыворотки, может быть из обоих глаз в случаях двустороннего РБ. Это ограничивает клиническую полезность платформ на основе крови, особенно у двусторонних пациентов, которые составляют 40% случаев РБ, в то время как АГ остается глазоспецифичной и может демонстрировать межглазную гетерогенность как на уровнях SNV, так и на уровне SCNA53.
Значение жидкостной биопсии АГ для области РБ имеет первостепенное значение. Жидкая биопсия АГ не только дает возможность лучше понять внутриопухолевую динамику в глазах, которые активно проходят терапию, но и имеет потенциал для улучшения ухода за пациентами. Основываясь на предыдущих исследованиях, мы установили молекулярную сигнатуру, основанную на наличии либо амплификации MYCN, либо усиления хромосомы 6p с амплитудой отношения ≥1,5 к медиане, что является прогностическим для увеличения в 16,5 раз вероятности неудачи лечения, требующей энуклеации 18,20,21. Обладая этими знаниями на момент постановки диагноза, врачи смогут лучше консультировать семьи о подходящих вариантах лечения и вероятности спасения глаз с помощью современных методов лечения. Несмотря на то, что клиническая валидность платформы жидкой биопсии АГ для РБ была установлена 17,18,19,20,21,22,23, в настоящее время она одобрена только для исследований; необходимы более крупные проспективные многоцентровые исследования, прежде чем жидкая биопсия АГ может быть реализована клинически, чтобы помочь непосредственно ухаживать за пациентом с РБ. Несмотря на это, жидкостная биопсия АГ имеет потенциал для обеспечения точной онкологии в будущем, не только для RB, но и для других опухолей глаза.
Раскрытие информации
Джесси Берри, Лия Сюй и Джеймс Хикс подали заявку на патент под названием «Бесклеточная ДНК водянистого гумора для диагностической и прогностической оценки офтальмологических заболеваний». В остальном авторы не сообщают о потенциальном конфликте интересов.
Благодарности
Данное исследование было поддержано следующими источниками: NCI премии NIH K08CA232344 (Дж. Л. Берри); Hyundai Hope on Wheels RGA012351 (Дж. Л. Берри); Фонд по борьбе с детским раком глаз (Дж.Л. Берри); Американское онкологическое общество IRG-16-181-57 (Дж. Л. Берри); Фонд Райта (Дж.Л. Берри и М.Е. Киму); Knights Templar Eye Foundation (Дж.Л. Берри); Фонд Ларри и Селии Мо (Дж. Л. Берри); Институт семей, Inc., Детская больница Лос-Анджелеса (Дж. Л. Берри); неограниченный ведомственный грант от организации «Исследования по профилактике слепоты» (все); NCI P30CA014089 (все); Исследовательский фонд Вики Джозеф (. Кун); Исследовательский фонд Кэрол Вассилиадис (. Куну); и Колледж литературы, искусств и наук Университета Южной Калифорнии в Дорнсайфе (. Кун).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | surgical grade, whatever available in hospital | ||
| 32 G needle | surgical grade, whatever available in hospital | ||
| Aligner | Authors use Bowtie2 (http://bowtie-bio.sourceforge.net/bowtie2/index.shtml) but other aligners such as BWA or GRCh38 will also work | ||
| Atropos | generic term: adapter remover. https://atropos.readthedocs.io/en/latest/index.html# | ||
| Bioanalyzer High Sensitivity DNA Kit | Agilent | 5067-4626 | generic term: DNA fragment size profiling assay |
| BWA-MEM | generic term: long sequence aligner. http://bio-bwa.sourceforge.net/bwa.shtml | ||
| DNAcopy | Bioconductor | generic term: DNA copy number data analysis. https://bioconductor.org/packages/release/bioc/html/DNAcopy.html | |
| dsDNA High Sensitivity Assay | Qubit | Q32851 | generic term: DNA quantification assay |
| FreeBayes | generic term: sequence variant determiner. https://github.com/freebayes/freebayes | ||
| ichorCNA software | generic term: CNA-based TFx estimation. https://github.com/broadinstitute/ichorCNA | ||
| Illumina platform | Illumina | generic term: NGS platform; please note that other NGS platforms will work in principle, but have not been trialed by these authors | |
| NovoAlign (v3) | Novocraft | generic term: mapping of short reads onto reference genome. http://www.novocraft.com/products/novoalign/ | |
| QIAamp Circulating Nucleic Acid Kit | Qiagen | 55114 | generic term: cfDNA isolation and purification kit |
| QIAseq Ultralow Input Library Kit | Qiagen | 180492 | generic term: DNA library sequencing kit |
| Samtools rmdup | generic term: tool to remove duplicate reads. http://www.htslib.org/doc/samtools-rmdup.html | ||
| VarDict | generic term: variant caller. https://github.com/AstraZeneca-NGS/VarDict | ||
| Variant Effect Predictor | Ensembl | generic term: variant effect determinator. https://uswest.ensembl.org/info/docs/tools/vep/index.html |
Ссылки
- Fernandes, A. G., Pollock, B. D., Rabito, F. A. Retinoblastoma in the United States: A 40-year incidence and survival analysis. Journal of Pediatric Ophthalmology & Strabismus. 55 (3), 182-188 (2018).
- Linn, A. M. Intraocular retinoblastoma: the case for a new group classification. Ophthalmology Clinics of North America. 18 (1), 41-53 (2005).
- Shields, J. A., Shields, C. L., Ehya, H., Eagle, R. C., De Potter, P. Fine-needle aspiration biopsy of suspected intraocular tumors. The 1992 Urwick lecture. Ophthalmology. 100 (11), 1677-1684 (1993).
- Karcioglu, Z. A., Gordon, R. A., Karcioglu, G. L. Tumor seeding in ocular fine needle aspiration biopsy. Ophthalmology. 92 (12), 1763-1767 (1985).
- Karcioglu, Z. A. Fine needle aspiration biopsy (FNAB) for retinoblastoma. Retina. 22 (6), 707-710 (2002).
- Eide, N., Syrdalen, P., Walaas, L., Hagmar, B. Fine needle aspiration biopsy in selecting treatment for inconclusive intraocular disease. Acta Ophthalmologica Scandinavica. 77 (4), 448-452 (1999).
- Eide, N., Walaas, L. Fine-needle aspiration biopsy and other biopsies in suspected intraocular malignant disease: a review. Acta Ophthalmologica. 87 (6), 588-601 (2009).
- Eriksson, O., Hagmar, B., Ryd, W. Effects of fine-needle aspiration and other biopsy procedures on tumor dissemination in mice. Cancer. 54 (1), 73-78 (1984).
- Ali, M. J., Honavar, S. G., Vemuganti, G. K., Singh, A. D. Fine needle aspiration biopsy of retinal tumors. Monographs in Clinical Cytology. 21, 72-81 (2012).
- Di Nicolantonio, F. a. l., et al. The chemosensitivity profile of retinoblastoma. Recent Results in Cancer Research. 161, 73-80 (2003).
- Francis, J. H., et al. Efficacy and toxicity of second-course ophthalmic artery chemosurgery for retinoblastoma. Ophthalmology. 122 (5), 1016-1022 (2015).
- Francis, J. H. Efficacy and toxicity of intravitreous chemotherapy for retinoblastoma: Four-year experience. Ophthalmology. 124 (4), 488-495 (2017).
- Francis, J. H., et al. Current treatment of bilateral retinoblastoma: The impact of intraarterial and intravitreous chemotherapy. Neoplasia. 20 (8), 757-763 (2018).
- Rushlow, D. E., et al. Characterisation of retinoblastomas without RB1 mutations: genomic, gene expression, and clinical studies. The Lancet Oncology. 14 (4), 327-334 (2013).
- Afshar, A. R., et al. Next-generation sequencing of retinoblastoma identifies pathogenic alterations beyond RB1 inactivation that correlate with aggressive histopathologic features. Ophthalmology. 127 (6), 804-813 (2020).
- Kothari, P. Cell-free DNA profiling in retinoblastoma patients with advanced intraocular disease: An MSKCC experience. Cancer Medicine. 9 (17), 6093-6101 (2020).
- Berry, J. L., et al. Potential of aqueous humor as a surrogate tumor biopsy for retinoblastoma. JAMA Ophthalmology. 135 (11), 1221-1230 (2017).
- Berry, J. L., et al. Genomic cfDNA analysis of aqueous humor in retinoblastoma predicts eye salvage: the surrogate tumor biopsy for retinoblastoma. Molecular Cancer Research. 16 (11), 1701-1712 (2018).
- Berry, J. L., et al. Aqueous humor is superior to blood as a liquid biopsy for retinoblastoma. Ophthalmology. 127 (4), 552-554 (2020).
- Xu, L., et al. Chromosome 6p amplification in aqueous humor cell-free DNA Is a prognostic biomarker for retinoblastoma ocular survival. Molecular Cancer Research. 18 (8), 1166-1175 (2020).
- Xu, L., et al. Establishing the clinical utility of ctDNA analysis for diagnosis, prognosis, and treatment monitoring of retinoblastoma: The aqueous humor liquid biopsy. Cancers. 13 (6), (2021).
- Xu, L. Simultaneous identification of clinically relevant RB1 mutations and copy number alterations in aqueous humor of retinoblastoma eyes. Ophthalmic Genetics. 41 (6), 526-532 (2020).
- Polski, A., et al. Longitudinal aqueous humor sampling reflects treatment response in retinoblastoma patients. Investigative Ophthalmology & Visual Science. 61 (7), 1394 (2020).
- . Genome Browser Available from: https://genome.ucsc.edu/cgi-bin/hgTracks?db=hg19&lastVirtModeType=default&lastVirtModeExtraState=&virtModeType=default&3A15578261%_2D15621068&hgsid=1135765621_qIuA0U (2021)
- Navarro Gonzalez, J., et al. The UCSC genome browser database: 2021 update. Nucleic Acids Research. 49 (1), 1046-1057 (2021).
- Li, H. A statistical framework for SNP calling, mutation discovery, association mapping and population genetical parameter estimation from sequencing data. Bioinformatics. 27 (21), 2987-2993 (2011).
- Baslan, T., et al. Genome-wide copy number analysis of single cells. Nature Protocols. 7 (6), 1024-1041 (2012).
- Huber, W., et al. Orchestrating high-throughput genomic analysis with Bioconductor. Nature Methods. 12 (2), 115-121 (2015).
- Baslan, T., et al. Erratum: Genome-wide copy number analysis of single cells. Nature Protocols. 11 (3), 1024-1041 (2016).
- Didion, J. P., Martin, M., Collins, F. S. Atropos: specific, sensitive, and speedy trimming of sequencing reads. PeerJ. 5, 3720 (2017).
- Li, H. Aligning sequence reads, clone sequences and assembly contigs with BWA-MEM. arXiv. , (2013).
- Garrison, E., Marth, G. Haplotype-based variant detection from short-read sequencing. arXiv. , (2012).
- McLaren, W., et al. The ensembl variant effect predictor. Genome Biology. 17 (1), 122 (2016).
- Lai, Z., et al. VarDict: a novel and versatile variant caller for next-generation sequencing in cancer research. Nucleic Acids Research. 44 (11), 108 (2016).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA (2017)
- Adalsteinsson, V. A., et al. Scalable whole-exome sequencing of cell-free DNA reveals high concordance with metastatic tumors. Nature Communications. 8 (1), 1-13 (2017).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA/wiki/Interpreting-ichorCNA-results (2017)
- Berry, J. L., et al. Long-term outcomes of Group D retinoblastoma eyes during the intravitreal melphalan era. Pediatric Blood & Cancer. 64 (12), (2017).
- Berry, J. L., et al. Long-term outcomes of Group D eyes in bilateral retinoblastoma patients treated with chemoreduction and low-dose IMRT salvage. Pediatric Blood & Cancer. 60 (4), 688-693 (2013).
- Francis, J. H., et al. Molecular changes in retinoblastoma beyond RB1: Findings from next-generation sequencing. Cancers (Basel). 13 (1), (2021).
- Schwermer, M., et al. Comprehensive characterization of RB1 mutant and MYCN amplified retinoblastoma cell lines. Experimental Cell Research. 375 (2), 92-99 (2019).
- Davies, H. R. Whole-genome sequencing of retinoblastoma reveals the diversity of rearrangements disrupting RB1 and uncovers a treatment-related mutational signature. Cancers. 13 (4), 754 (2021).
- Lillington, D. M., et al. Comparative genomic hybridization of 49 primary retinoblastoma tumors identifies chromosomal regions associated with histopathology, progression, and patient outcome. Genes, Chromosomes and Cancer. 36 (2), 121-128 (2003).
- Greger, V., et al. Frequency and parental origin of hypermethylated RB1 alleles in retinoblastoma. Human Genetics. 94 (5), 491-496 (1994).
- Raizis, A. M., et al. DNA hypermethylation/boundary control loss identified in retinoblastomas associated with genetic and epigenetic inactivation of the RB1 gene promoter. Epigenetics. 1-15, (2020).
- Munier, F. L., et al. Profiling safety of intravitreal injections for retinoblastoma using an anti-reflux procedure and sterilisation of the needle track. British Journal of Ophthalmology. 96 (8), 1084-1087 (2012).
- Chévez-Barrios, P., et al. Response of retinoblastoma with vitreous tumor seeding to adenovirus-mediated delivery of thymidine kinase followed by ganciclovir. Journal of Clinical Oncology. 23 (31), 7927-7935 (2005).
- Shao, W., Khin, S., Kopp, W. C. Characterization of effect of repeated freeze and thaw cycles on stability of genomic DNA using pulsed field gel electrophoresis. Biopreservation and Biobanking. 10 (1), 4-11 (2012).
- Choudhury, A. D., et al. Tumor fraction in cell-free DNA as a biomarker in prostate cancer. JCI Insight. 3 (21), (2018).
- Gerrish, A., et al. Non-invasive diagnosis of retinoblastoma using cell-free DNA from aqueous humour. British Journal of Ophthalmology. 103 (5), 721-724 (2019).
- Wong, E. Y., Xu, L., Shen, L. Inter-eye genomic heterogeneity in bilateral retinoblastoma via aqueous humor liquid biopsy. NPJ Precis Oncol. 5 (1), 73 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены