Method Article
Humor acuoso como biopsia líquida para el retinoblastoma: paracentesis corneal clara y análisis genómico
En este artículo
Resumen
El humor acuoso es una biopsia líquida de alto rendimiento para el retinoblastoma, cáncer intraocular que no se puede biopsiar in vivo debido al riesgo de diseminación extraocular. En este artículo, se presenta un método para extraer de forma segura el humor acuoso mediante paracentesis corneal clara y los pasos para el análisis genómico con el fin de identificar biomarcadores pronósticos.
Resumen
Existe un potencial significativo de utilidad clínica para la aplicación de una plataforma de biopsia líquida para el retinoblastoma, dado que la biopsia directa del tumor está prohibida en estos pacientes. El humor acuoso (AH) se forma en un compartimento separado del tumor, pero está encerrado dentro del mismo espacio ocular. Por lo tanto, es una fuente enriquecida de información genómica tumoral específica del ojo que se puede utilizar como biopsia líquida o sustituto de la biopsia tumoral para esta enfermedad. Este manuscrito detalla una metodología para extraer de forma segura la AH de los ojos del retinoblastoma mediante paracentesis corneal clara. Además, se presentan los pasos para el análisis genómico, incluido el aislamiento y la purificación del ADN libre de células, la secuenciación de próxima generación, el análisis de alteración del número de copias somáticas (SCNA), la identificación de mutaciones de la variante de nucleótido único (SNV) de RB1 y la estimación de la fracción tumoral. Se ha evaluado la validez preanalítica, analítica y clínica temprana de la plataforma de biopsia líquida AH; Sin embargo, no está exento de limitaciones. Estos son en gran medida una consecuencia de la cantidad de ADN libre de células que se requiere para ciertos pasos del ensayo. En comparación con otras plataformas de biopsia líquida basada en sangre que se están investigando actualmente para el retinoblastoma, una plataforma basada en AH está limitada por el volumen de biolíquido (y, por lo tanto, la cantidad de ADN) que se puede extraer del ojo; la ventaja es que la AH es específica del ojo. La plataforma que se discute aquí es única en el sentido de que detecta el ADN tumoral circulante en el AH a través de dos mecanismos (SCNAs y RB1 SNVs), lo que produce una mayor sensibilidad para identificar la información genómica tumoral. La biopsia líquida de AH tiene el potencial de ser aplicada clínicamente directamente a la oncología de precisión para los pacientes con retinoblastoma, con particular importancia para los pacientes con enfermedad bilateral, ya que la AH es específica de los tumores de cada ojo. También hay investigaciones en curso con aplicaciones de esta plataforma a pacientes con otros tumores oculares.
Introducción
El retinoblastoma (RB) es un cáncer poco frecuente y único. Si bien es la neoplasia maligna intraocular primaria más común que se forma en la retina en desarrollo de bebés y niños pequeños, solo hay alrededor de 7000 casos en el mundo anualmente, y aproximadamente 250-300 de estos se encuentran en los Estados Unidos. Aunque la supervivencia de los pacientes se acerca al 98% en los países desarrollados1, la supervivencia ocular de los ojos avanzados, que se clasifican clínicamente como Clasificación Internacional Intraocular RB (IIRC)2 Grupo D/E o AJCC cT2b/3, es mucho menor. Muchos de estos ojos avanzados se enuclean principalmente (como primer tratamiento) o secundariamente (después de intentos fallidos de terapia de rescate del globo). En la práctica clínica actual de la oncología ocular, no existen biomarcadores moleculares específicos del ojo derivados del tumor que se utilicen clínicamente para ayudar en el diagnóstico, el pronóstico de la supervivencia ocular o el seguimiento del tratamiento de los pacientes con RB. Esto se debe, en gran parte, al hecho de que el tejido tumoral solo está disponible para análisis moleculares y genéticos de ojos enucleados, ya que la biopsia tumoral directa en RB está prohibida debido a la preocupación por la diseminación del tumor extraocular 3,4,5,6,7,8,9 . Debido a esta prohibición, los estudios retrospectivos previos sobre la genética tumoral de RB y sus correlaciones clínicas se restringieron al análisis de tejido tumoral obtenido de ojos enucleados solamente 10,11,12,13. Por lo tanto, ha habido una falta de datos moleculares objetivos derivados del tumor disponibles en el momento del diagnóstico y durante todo el tratamiento de rescate ocular. Esto ha limitado no solo la comprensión de la biología tumoral in vivo y las formas en que estos tumores cambian a nivel molecular a lo largo de la terapia, sino también la capacidad de desarrollar planes de tratamiento personalizados, específicos para el ojo y basados en la genómica para estos pacientes jóvenes con cáncer.
Aparte de la prohibición de la biopsia, otro aspecto único de este cáncer es que la mayoría de los tumores se inician por la pérdida bialélica del gen supresor de tumores RB1, que modula el ciclo celular. La retina en desarrollo es exquisitamente sensible a esta pérdida. En el 60% de los pacientes, esta inactivación bialélica del gen RB1 se produce en la retina solo como pérdida somática y da lugar a una enfermedad unilateral. Sin embargo, en el 40% de los pacientes, la mutación inicial de RB1 ocurre en la línea germinal, seguida de un segundo "golpe" en la retina. En estos niños, a menudo hay múltiples tumores que afectan a ambos ojos. Por último, un subconjunto muy pequeño (<2%) de tumores parece estar impulsado por la amplificación de MYCN sin mutaciones en el gen RB1. Si bien los tumores impulsados por MYCN casi universalmente fracasan en el tratamiento y requieren enucleación, actualmente no existe una forma clara y objetiva de identificar este subtipo tumoral agresivo en el momento del diagnóstico14,15. Además, la monitorización de la actividad del tumor RB intraocular se basa casi exclusivamente en las imágenes y las observaciones clínicas de cada ojo por parte del oncólogo ocular tratante. No existe un medio objetivo y cuantitativo de diagnóstico, pronóstico o forma de monitorear la dinámica tumoral específica del ojo durante todo el tratamiento. Debido a estas limitaciones únicas para la RB, la perspectiva de una plataforma de biopsia líquida para este cáncer es tentadora. Las biopsias líquidas utilizan fluidos corporales para aislar y secuenciar el ADN libre de células para determinar si es derivado del tumor, conocido como ADN tumoral circulante (ADNct). Si bien el suero se investiga para otros cánceres, el ADNct RB que se encuentra en el suero no es específico del ojo, lo que tiene claras limitaciones para el 40% de los pacientes que padecen enfermedad bilateral. Además, solo se ha descrito en el contexto de enfermedad intraocular avanzada o metastásica, generalmente con una fracción tumoral baja (<5%)16.
En un esfuerzo por abordar estos problemas clínicos reales que enfrentan los pacientes y sus familias, en 2017, demostramos que el humor acuoso (AH, el líquido transparente frente al ojo) es una fuente de ADNct de alto rendimiento que se puede usar como biopsia líquida, o más aún como sustituto de la biopsia tumoral, para evaluar RB17, Isaías 18,19. Con más de 200 muestras hasta la fecha, se identificó el ADNct en el >95% de las muestras, incluidos los ojos menos avanzados de los grupos A, B y C del IIRC, así como las diferencias genómicas entre los ojos en pacientes bilaterales18,19. Este ADN puede aislarse de forma segura y eficaz para la detección de biomarcadores moleculares relevantes en ojos que están en tratamiento activo o que no han recibido tratamientoprevio 18,20,21. La plataforma de biopsia líquida AH también se puede utilizar para identificar las variantes patógenas diagnósticas de RB1 o la amplificación primaria de MYCN que inicia la tumorigénesis21,22. Es importante destacar que hemos identificado una firma molecular pronóstica, la presencia de ganancia del cromosoma 6p con una amplitud de ≥1,5 a la amplificación mediana o focal de MYCN, que se asocia con un aumento del 16,5 en la probabilidad de pérdida del control tumoral intraocular que requiere la extirpación del ojo 18,20,21. Finalmente, se ha demostrado que los cambios en la fracción tumoral del ADNct (TFx) en la AH se correlacionan con la respuesta terapéutica, ya que los niveles más altos se correlacionan con la enfermedad activa, y los niveles decrecientes se asocian con una respuesta positiva al tratamiento23. Dadas estas aplicaciones y su potencial utilidad clínica, hemos querido delinear la metodología para la biopsia y evaluación de la AH. Esto incluye la paracentesis corneal clara para la adquisición de muestras y el protocolo para el análisis genómico, específicamente la construcción y secuenciación de bibliotecas de ADNcf, la determinación de la amplitud de SCNA, la identificación de variantes patógenas RB1 y el cálculo de TFx.
Protocolo
Esta investigación se lleva a cabo bajo la aprobación de la Junta de Revisión Institucional del Hospital Infantil de Los Ángeles y la Universidad del Sur de California, y se adhiere a los principios de la Declaración de Helsinki. Siempre se obtiene el consentimiento informado por escrito de los tutores legales de todos los participantes.
En la Figura 1 se puede ver un esquema del flujo de trabajo de biopsia líquida AH.
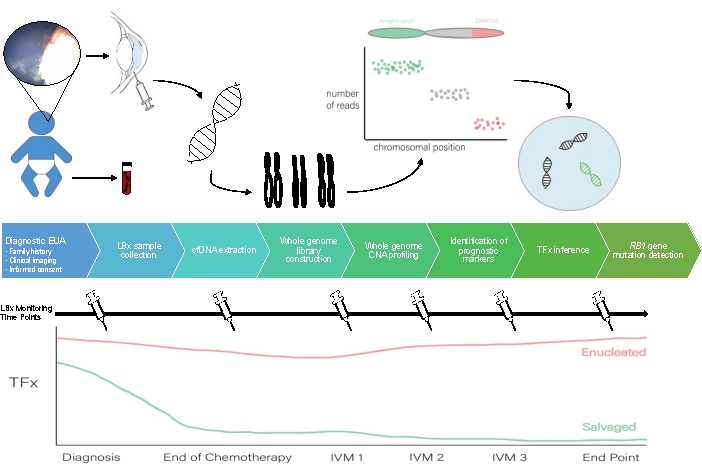
Figura 1: Flujo de trabajo para la biopsia líquida de AH que acompaña al protocolo descrito en este documento. EUA, examen bajo anestesia; LBX: biopsia líquida; cfDNA, ADN libre de células; CNA, alteración del número de copias; TFx: fracción tumoral; IVM: melfalán intravítreo. Haga clic aquí para ver una versión más grande de esta figura.
1. Procedimiento quirúrgico:
NOTA: Este procedimiento se realiza durante el examen de rutina bajo anestesia (EUA) para la evaluación clínica de pacientes con RB. El procedimiento de paracentesis para extraer AH solo debe ser realizado por un cirujano oftálmico capacitado que haya completado la capacitación estándar en cirugía ocular.
- Los criterios de selección e inclusión de pacientes son los siguientes.
- Asegúrese de que la cámara esté formada y despejada sin que se desprenda del tumor, las sinequias o el cristalino cataratoso.
NOTA: En algunos ojos avanzados, la cámara es demasiado superficial en el momento del diagnóstico para extraer la AH de manera segura. En estos casos, se recomienda esperar hasta después del primer ciclo de quimioterapia sistémica o intraarterial. Una vez que el tumor principal se encoge, la cámara generalmente se profundiza, lo que permite un abordaje seguro. - Asegúrese de que haya una visión clara de todas las estructuras y que la presión sea de <22 mm Hg para que no haya una rápida caída de la cámara debido a la dinámica de la presión. Esto es cierto para todos los puntos temporales, pero es particularmente crítico cuando se toma AH en el momento del diagnóstico.
- Asegurarse de que no haya afectación directa del segmento anterior por el tumor, lo que se evalúa mediante visualización directa y biomicroscopía ecográfica. Este criterio de inclusión generalmente se identifica durante la EUA.
- Asegúrese de que la cámara esté formada y despejada sin que se desprenda del tumor, las sinequias o el cristalino cataratoso.
- Una vez que el paciente haya sido considerado apropiado y consentido, llévelo al quirófano. Permitir que el anestesiólogo tratante inicie la anestesia como es de rutina para la EUA para el cuidado clínico de pacientes con RB.
- Una vez que el paciente esté intubado y sedado, y se hayan completado todos los exámenes clínicos, las imágenes y cualquier necesidad terapéutica local (p. ej., láser o crioterapia) relacionada con la EUA, extraiga el AH para la plataforma de biopsia líquida. Prepare y cubra el ojo de la manera estéril habitual. Esto puede ser completado por la enfermera circulante o el cirujano que opera.
- Antes de la EUA, coloque las gotas dilatadoras que se usan habitualmente en la institución para una EUA en el ojo quirúrgico.
NOTA: En este caso, se utilizan gotas oftálmicas combinadas que consisten en un 2,5 % de fenilefrina, un 1 % de ciclopentolato y un 1 % de tropicamida. Sin embargo, las gotas estándar que se utilizan para la dilatación de la EUA son suficientes; no es necesario dilatar el ojo simplemente para extraer el AH. - Coloque la gota de betadine al 5% en el ojo quirúrgico y aplíquela con una esponja comenzando desde el centro y moviéndose periféricamente. Incluir los márgenes del párpado superior e inferior en la preparación quirúrgica. Complete la preparación quirúrgica con betadine tres veces y luego espere al menos dos minutos antes de continuar.
- Coloque una toalla azul estéril sobre la cabeza del paciente y métala debajo de la cabeza para evitar que se caiga. Seque las pestañas y la zona periorbitaria con una toalla azul estéril o una gasa.
- Deje que el cirujano que opera se frote, se ponga una bata y guantes guantes.
- Cubra al paciente con paños azules estériles, dejando expuesto el ojo quirúrgico. Coloque un espéculo de tapa estéril para una visualización óptima del campo estéril.
NOTA: No se requiere anestesia tópica adicional en nuestra institución ya que el niño está bajo anestesia general para la EUA. - Realizar el tiempo fuera de acuerdo con el protocolo institucional. Aquí, se realiza un tiempo de espera inicial para la EUA y un segundo tiempo de espera para verificar los ojos antes del procedimiento.
- Antes de la EUA, coloque las gotas dilatadoras que se usan habitualmente en la institución para una EUA en el ojo quirúrgico.
- Utilizando un microscopio quirúrgico, realice una paracentesis corneal clara con la extracción de 0,1 mL de AH con una aguja de 32 G en una jeringa de 1 cc.
- Antes de comenzar el procedimiento, humedezca el ojo con una solución salina balanceada estéril (cada ml contiene cloruro de sodio 0.64%, cloruro de potasio 0.075%, cloruro de calcio dihidratado 0.048%, cloruro de magnesio hexahidratado 0.03%, acetato de sodio trihidrato 0.39%, citrato de sodio dihidratado 0.17%, hidróxido de sodio y/o ácido clorhídrico (para ajustar el pH) y agua para inyección) para mantener la lubricación de la córnea; Esta es una preparación comercial estándar.
- Asegúrese de que la aguja de 32 G esté bloqueada por luer en la jeringa de 1 cc y que no haya presión en la jeringa (moviendo el émbolo de la jeringa hacia adentro y hacia afuera varias veces antes de usarla).
- A continuación, pase la aguja a través de la córnea transparente en el limbo (perpendicular a ella, como es habitual en la paracentesis) y permanezca dentro de la cámara anterior sobre el iris dilatado periférico.
- Mantenga el bisel de la punta de la aguja por delante del iris bajo visualización directa a través del microscopio durante la extracción. Si lo prefiere, estabilice el ojo con pinzas de 0,12 a medida que la aguja pasa a través de la córnea.
NOTA: Nunca debe haber contacto entre la punta de la aguja y ninguna estructura ocular; Debe permanecer sobre el iris periférico en la cámara anterior media. - Extracto 0,1 mL de AH. Manipule el émbolo de la jeringa con la mano no dominante del cirujano (pero con práctica) o con un asistente capacitado sin mover la aguja. No pierda la visualización directa de la punta de la aguja. Priorice la anatomía del ojo y tome menos AH si es necesario para asegurarse de que la cámara permanezca formada.
- Después de la extracción, retire suavemente la aguja de la cámara anterior. Asegúrese de que la cámara permanezca formada pero ligeramente poco profunda; La presión será suave pero fisiológica. Una vez que se retira la aguja del ojo, bañe el ojo abundantemente con agua estéril; Se prefiere el agua estéril en lugar de una solución salina balada en este paso como medida de seguridad porque el agua lisa las células.
- Examine el sitio de la aguja en busca de fugas. Si hay fugas, use un aplicador de punta de algodón para aplicar una presión suave en el lugar de la inyección durante 30 segundos antes de volver a verificar si hay fugas. Repita el proceso si es necesario.
NOTA: El uso de métodos más invasivos para detener cualquier fuga nunca fue necesario con este enfoque. A veces, este procedimiento es seguido por una inyección intravítrea de quimioterapia; para este documento de métodos, el protocolo se centra en la extracción de AH como procedimiento primario.
- Examine el sitio de la aguja en busca de fugas. Si hay fugas, use un aplicador de punta de algodón para aplicar una presión suave en el lugar de la inyección durante 30 segundos antes de volver a verificar si hay fugas. Repita el proceso si es necesario.
- Una vez que no hay fugas, el procedimiento se considera completo. Retire los paños estériles del paciente y limpie el betadine de la cara.
- Retire con cuidado la punta de la aguja de la jeringa, use una tapa estéril para cerrar la muestra a través de luer lock para no perder ninguna muestra y etiquete la jeringa de manera adecuada.
NOTA: Esto debe ser hecho por el coordinador de investigación clínica o el cirujano mientras se extuba al niño.- Después de la extracción de la muestra, almacene la muestra en una jeringa tapada a -80 °C; Las muestras se pueden colocar en hielo seco para transportarlas a un congelador adecuado desde el quirófano.
- Coloque una sola gota de gotas oftálmicas antibióticas según la preferencia del cirujano en la superficie del ojo quirúrgico antes de enviar al paciente a recuperación. En este caso, se utilizan gotas oftálmicas combinadas de esteroides y antibióticos, y el ojo no se coloca un parche.
- Una vez finalizado el procedimiento, el anestesiólogo tratante asegura una extubación adecuada. Llevar al paciente a la recuperación.
- Dar de alta al paciente a su domicilio siguiendo el protocolo postoperatorio institucional.
- Informe al paciente que no es necesario cubrir el ojo con ningún vendaje o cubierta protectora.
- Informar al paciente que no sumerja completamente su cabeza en un baño o piscina durante 24 horas, y a los padres que no froten el ojo del paciente (niño); No hay otras limitaciones en la actividad del paciente.
- Informe al paciente que es poco probable que tenga dolor por la paracentesis, pero que podría tener dolor por los procedimientos asociados durante la EUA. El paciente puede tomar paracetamol o ibuprofeno en caso de cualquier molestia, según lo sugerido por el cirujano.
2. Aislamiento y purificación de cfDNA
- Realice el aislamiento y procesamiento del ADN dentro de las 72 horas posteriores a la extracción de AH.
- Descongele AH a temperatura ambiente. Revise la muestra con frecuencia y avance hacia la extracción inmediatamente después de que se complete la descongelación.
- Extraiga el ADNcf del AH y eluya en 50 μL de solución de AVE (incluida en el kit) utilizando el kit de aislamiento y purificación de ADNcf (consulte la Tabla de materiales para obtener más detalles) según el manual de instrucciones del fabricante.
3. Secuenciación de próxima generación (NGS) y control de calidad (QC)
- Construya las bibliotecas de ADN para la secuenciación utilizando el kit de secuenciación de bibliotecas de ADN (consulte la Tabla de materiales) según el manual de instrucciones del fabricante. Amplifique el ADN de la biblioteca con 14 ciclos de reacción en cadena de la polimerasa (PCR) como se detalla en el manual del kit de secuenciación de la biblioteca de ADN.
NOTA: Las bibliotecas finales pueden almacenarse a -20 °C hasta 1 mes antes de la secuenciación final para el análisis genómico. - Secuenciar las bibliotecas de ADN en la plataforma NGS (ver Tabla de Materiales) según el protocolo del fabricante siguiendo el protocolo de 50 ciclos de un solo extremo o el protocolo de 150 ciclos de extremo emparejado.
NOTA: Otras plataformas NGS funcionarán en principio (aunque no se han probado aquí), con adaptadores adecuados para la celda de flujo de secuenciación. - Realizar el control de calidad de cualquier muestra de AH que se haya tomado en el momento del diagnóstico o de la enucleación primaria.
NOTA: No se puede realizar el control de calidad para muestras tomadas en otros puntos de tiempo ya que la masa de ADN será demasiado baja y estará fuera del rango de detección para los pasos que se describen a continuación.- Utilice 1 μL del ADN extraído para el ensayo de cuantificación de ADN y el ensayo de perfil de tamaño (consulte la Tabla de materiales) según los protocolos del fabricante.
NOTA: El pico debe estar alrededor de 300 pb. Si es inferior a 150 pb, la muestra se ha visto comprometida. Consulte el archivo complementario 1A para ver un ejemplo de una muestra que debe pasar el control de calidad y el archivo complementario 1B para ver un ejemplo de uno que no debería.
- Utilice 1 μL del ADN extraído para el ensayo de cuantificación de ADN y el ensayo de perfil de tamaño (consulte la Tabla de materiales) según los protocolos del fabricante.
4. Análisis de datos de alteración del número de copias somáticas (SCNA)
- Mapeo de las lecturas obtenidas de NGS (sección 3) con el genoma humano (hg19, Genome Reference Consortium GRCh37, base de datos University of California Santa Cruz Genome Browser)24,25 con un alineador.
- Elimine los duplicados de PCR (samtools rmdup26).
- Normalice el contenido de guanina-citosina calculando el porcentaje de bases de guanina y citosina en cada contenedor del genoma de referencia. Un ejemplo de programa se describe en Baslan et al.27.
- Para obtener los números de copia de segmentos de ADN, divida el genoma en 5000 contenedores de longitud variable y, a continuación, calcule el número relativo de lecturas contenidas en cada contenedor.
- Utilice las proporciones log2 sin referencias para determinar las estimaciones del número de copias. Tome el recuento de ventanas medianas de los cromosomas autosómicos normales.
- Realizar segmentación mediante segmentación binaria circular con DNAcopy (Bioconductor28).
- Defina los SCNA como positivos con una deflexión del 20% desde la línea de base (relación log2 = 0), lo que significa que las pérdidas en relaciones log2 ≤ 0,2 (la relación de 0,87 o inferior define una deleción) y las ganancias en relaciones log2 ≥ 0,2 (la relación de 1,15 o superior define una amplificación).
NOTA: Estos umbrales son consistentes con los análisis de biopsia líquida previamente establecidos27,29.
5. Análisis mutacional RB1 de muestras de AH
- Además, amplifique las bibliotecas del genoma completo a 500 ng cada una para NGS dirigida basada en captura para la detección de mutaciones según el protocolo del fabricante.
- Realice la secuenciación de extremo emparejado de 150 bp o 50 bp en las bibliotecas capturadas a >100x según el protocolo del fabricante.
- Procese los datos NGS. En este estudio, se utiliza una línea interna basada en la tubería bcbio en el Centro de Medicina Personalizada de CHLA30.
- Recorte los datos fastq brutos de los adaptadores y las bases de baja calidad con Atropos31 y alinee con la referencia GRCh37 humana con BWA-MEM y NovoAlign (v3)32,33.
- Marque los duplicados con FreeBayes34 y, a continuación, determine la variante de la línea germinal.
NOTA: En las herramientas de llamada de variantes de FreeBayes, cada posición del genoma de la muestra se compara con el genoma de referencia y los recuentos de alelos se modelan matemáticamente para obtener las medidas de probabilidad del genotipo34. - Realice la anotación de variantes con Ensembl Variant Effect Predictor (v96)35 siguiendo los pasos 5.3.4-5.3.5.
- Utilice VarDict para determinar variantes somáticas en la AH o tumor sin la muestra de sangre normal emparejada (es decir, cegada a la variante de la línea germinal)36.
- Pérdida de heterocigosis si las variantes continuas de una región tienen ≤3% de alelos alternativos.
NOTA: También se puede utilizar software comercial de análisis genómico con los parámetros indicados anteriormente.
6. Determinación de cfDNA TFx
- Estimación de TFx para cada muestra secuenciada de ADNcf de AH utilizando el software ichorCNA (software de estimación de TFx basado en CNA)37.
NOTA: Este es el software estándar utilizado en las biopsias líquidas basadas en sangre para determinar cfDNA TFx38. El uso del software en AH ha sido publicado previamente21,23. - Revisar individualmente los perfiles genómicos y las soluciones de TFx correspondientes para verificar que la estimación de TFx para cada muestra sea adecuada39.
Resultados
A continuación se presentan los resultados completos de dos ojos (casos 33 y 47). Los números de casos se mantienen consistentes con publicaciones previas para fines de comparación 18,20,21. Los médicos tratantes no conocieron los resultados de la biopsia líquida de AH durante el tratamiento. Todas las decisiones de tratamiento fueron no aleatorizadas y se tomaron según el estándar de atención de rutina que se ha publicado previamente40,41. Los datos de resultados clínicos permanecieron separados de los datos genómicos hasta el análisis final. Los datos brutos de los resultados presentados están disponibles a petición del autor correspondiente. Debido a la financiación de los NIH, los datos se rigen por la política de intercambio de datos genómicos de los NIH y estarán disponibles para otros investigadores a través de un repositorio de datos designado por los NIH de acceso controlado (dbGAP) en el futuro; También está disponible a petición del autor de correspondencia.
Los casos 33 y 47 son ojos del grupo D2 del IIRC que tuvieron presentaciones clínicas muy similares. Por lo tanto, fueron tratados con terapia de rescate del globo a decisión de los padres y oncólogos oculares y médicos, específicamente con quimioterapia sistémica para el caso 47 y quimioterapia intraarterial para el caso 33. Sobre la base de los pronósticos clínicos actualmente aceptados que se basan en el grupo IIRC del ojo2, el éxito previsto del rescate del globo para los ojos de estos dos pacientes habría sido el mismo: 65%-70% para el grupo D es un promedio, aunque esto varía según el centro de tratamiento41. Sin embargo, con base en los datos del Grupo D recopilados hasta ahora a partir del perfil molecular dirigido al tumor en este centro, el éxito previsto del rescate del globo sería del 72% para el caso 47 (sin ganancia de 6p identificada en el AH) y del 9% para el caso 33 (con ganancia de 6p identificada)18,20,21. Esto se demuestra a continuación.
El caso 47 es un ejemplo de un ojo con detección exitosa de SCNA y SNV utilizando la plataforma de biopsia líquida AH en el momento del diagnóstico, junto con las tendencias de TFx correspondientes a la respuesta al tratamiento longitudinalmente. La paciente es una mujer que acudió a los 15 meses de edad con un IIRC del grupo D de 14 mm x 9 mm, estadio cT2b RB con siembra vítrea esférica. Dio negativo para la mutación de la línea germinal RB1 según lo determinado por las pruebas clínicas de rutina de leucocitos en suero. A partir de la AH, se identificaron las ganancias 1q y 6p de RB SCNAs en la AH en el momento del diagnóstico, además de otras dos pérdidas 7p y ganancia 13q de RB SCNAs no altamente recurrentes (Figura 2). Cabe destacar que la amplitud de la ganancia de 6p fue de 1,2, y solo se ha demostrado que las amplitudes de ≥ relación de 1,5 con respecto a la mediana auguran un mal pronóstico. Dado que no hubo amplificación focal de MYCN y que la ganancia de 6p estuvo por debajo del umbral de 1,5, el pronóstico de rescate con tratamiento basado en las características moleculares fue alto. La misma muestra de AH tomada en el momento del diagnóstico también se evaluó para la detección de variantes patógenas de RB1 , que reveló el SNV c.958C>T, p.Arg320* dentro del gen RB1 con una frecuencia alélica de variantes del 87,01 % (intervalo de confianza del 95 %, 79,7–94,6 %). Este paciente fue tratado con seis ciclos de carboplatino, etopósido y vincristina (CEV) con regresión de la enfermedad, pero demostró una siembra esférica y polvo persistente que requirió tres inyecciones secuenciales de melfalán intravítreo (IVM). Durante el tratamiento con MIV, las muestras de AH A-C (cada una separada por dos semanas) demostraron una normalización completa del perfil genómico, disminución de TFx y disminución de la concentración de ADN, todo ello concurrente con la regresión clínica de la enfermedad (Figura 3). Tras el diagnóstico, los valores de TFx se mantuvieron por debajo del límite de detección del 5% durante el resto del tratamiento. A los 19 meses de seguimiento, el ojo permaneció estable sin recidiva tumoral ni diseminación extraocular de la enfermedad.
Esto contrasta con el caso 33. Este varón de 22 meses de edad presentó una presentación clínica similar en general, con una masa retiniana de 11 mm x 18 mm y siembra vítrea tipo polvo, compatible con IIRC unilateral del grupo D, estadio cT2b. También fue negativo para la mutación de la línea germinal RB1 según lo determinado por las pruebas clínicas de rutina de leucocitos en suero. La AH tomada en el momento del diagnóstico mostró una ganancia de 1q de SCNAs de RB, ganancia de 6p (en este caso con una relación de amplitud de 1,5 con respecto a la mediana) y pérdida de 16q junto con una pérdida focal de 6q (Figura 4A). Según el perfil molecular pronóstico, este ojo tenía un aumento del 16,5 en las probabilidades de enucleación en función de la presencia de 6p ≥ 1,5 de amplitud. No se identificó ningún SNV RB1 en esta muestra, a pesar de la cobertura completa de la longitud completa del gen RB1. Una razón por la que es posible que no se identifique un SNV RB1 es en los tumores primarios impulsados por MYCN, donde no siempre se espera una mutación concurrente en RB1 14,15,42,43,44,45. Sin embargo, el caso 33 no mostró evidencia de amplificación de MYCN en ninguna de sus muestras de AH ni en su tejido tumoral enucleado (Figura 5). Una explicación más probable para un resultado negativo de SNV RB1 es que la tumorigénesis inicial fue impulsada por una desregulación epigenética (p. ej., metilación del promotor)46,47, un fenómeno conocido en RB que no se identificaría con el ensayo descrito en este documento.
El tratamiento inicial para este paciente fue de cuatro ciclos totales de quimioterapia intraarterial con melfalán seguidos de cuatro inyecciones de IVM debido a la siembra vítrea persistente. Se obtuvieron tres muestras de AH (cada una separada por cuatro semanas) durante el tratamiento con IVM y demostraron los mismos tres SCNA que estaban presentes en el momento del diagnóstico (Figura 5). Los valores de TFx se mantuvieron altos durante todo el tratamiento, a pesar de la disminución del volumen del tumor primario, lo que refleja las semillas tumorales activas en el vítreo. Esto demuestra cómo TFx es representativo del estado general de la enfermedad en el ojo. Seis meses después del diagnóstico, debido a la persistencia de la enfermedad activa, se enucleó el ojo. El perfil genómico obtenido del tejido tumoral en ese momento demostró una concordancia del 92,81% con la muestra de AH obtenida en el momento del diagnóstico (Figura 4B).
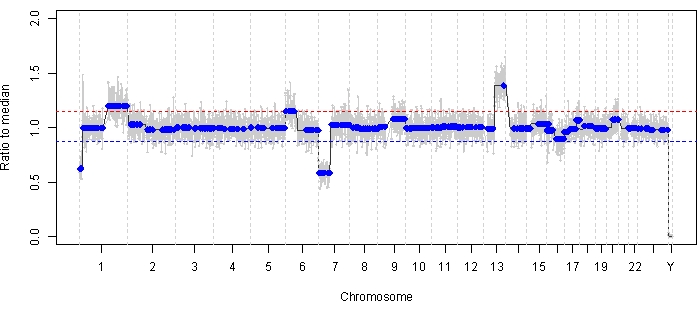
Figura 2: Perfil genómico en el momento del diagnóstico para el caso 47. En el AH tomado en el momento del diagnóstico se identificaron las SCNA RB altamente recurrentes con ganancia 1q y ganancia 6p, junto con la pérdida 7p y la ganancia 13q de RB SCNA no altamente recurrentes. La línea roja representa el umbral de una ganancia, mientras que la línea azul representa el umbral de una pérdida. En particular, la amplitud de la ganancia de 6p fue de <1,5 en relación con la mediana, que está por debajo del umbral de la firma molecular que presagia un mal pronóstico. Por lo tanto, sobre la base de la falta de biomarcadores negativos para la recuperación del ojo, se predeciría que este ojo respondería a la terapia. Haga clic aquí para ver una versión más grande de esta figura.
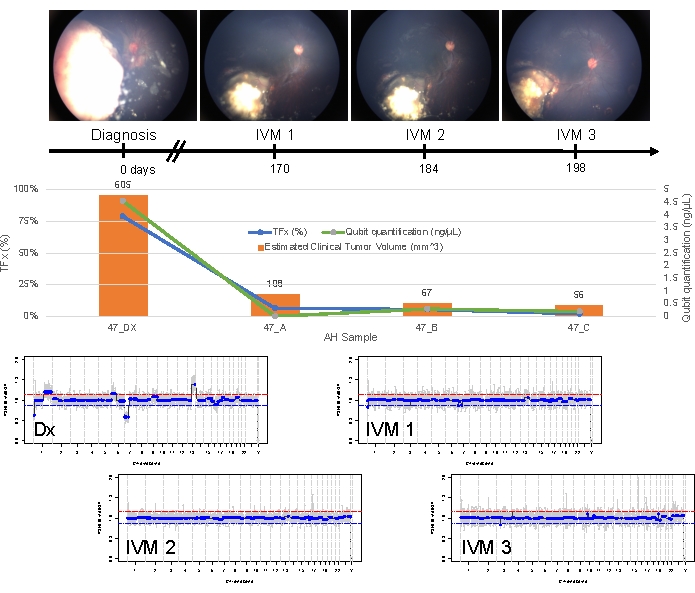
Figura 3: Información longitudinal del caso 47. Esto incluye fotos del fondo de ojo, cuantificación de cfDNA, volumen tumoral clínico estimado a partir de mediciones de B-scan, perfiles genómicos y estimaciones de TFx para cada punto de tiempo clínico en el que se tomó muestra de AH (Dx = diagnóstico, A = IVM1, B = IVM2, C = IVM3). Este ojo respondió al tratamiento y permaneció salvado a los 19 meses de seguimiento. Se observó una disminución en la cantidad de cfDNA a lo largo del tiempo, en consonancia con los estudios publicados anteriormente que mostraron el mayor rendimiento obtenido en el diagnóstico. La TFx también disminuyó con el tratamiento, lo que refleja la resolución de la siembra y la disminución del volumen del tumor principal de la retina (los volúmenes tumorales se indican encima de la barra naranja de cada punto de tiempo clínico). Como se esperaba con la regresión clínica de la enfermedad, los perfiles genómicos también se normalizaron. En los perfiles genómicos, la línea roja representa el umbral de una ganancia, mientras que la línea azul representa el umbral de una pérdida. Esta figura ha sido reimpresa con permiso de Xu, L. et al.21. Haga clic aquí para ver una versión más grande de esta figura.
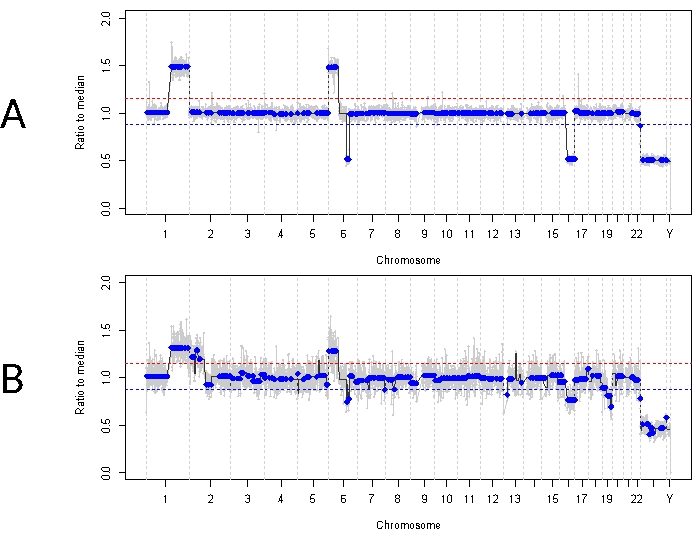
Figura 4: Perfiles genómicos del caso 33. La línea roja representa el umbral para una ganancia, mientras que la línea azul representa el umbral para una pérdida (A) Perfil genómico en el momento del diagnóstico para el caso 33. Se identificaron SCNAs de RB altamente recurrentes con ganancia 1q, ganancia 6p y pérdida 16q en el AH en el momento del diagnóstico, además de la pérdida focal 6q. En particular, la amplitud de la ganancia de 6p fue de 1,5 en relación con la mediana, lo que indica un biomarcador molecular de mal pronóstico. Por lo tanto, basándonos en esta firma molecular, predeciríamos que este ojo tenía una probabilidad significativamente mayor de fracaso del tratamiento. (B) Perfil genómico obtenido a partir de tejido tumoral enucleado, que fue altamente concordante con el perfil obtenido de AH en el momento del diagnóstico. Debido a la mezcla con tejido normal de la retina, las SCNA del tejido tumoral pueden mostrar una amplitud más baja en comparación con la AH debido a la dilución de TFx. Haga clic aquí para ver una versión más grande de esta figura.
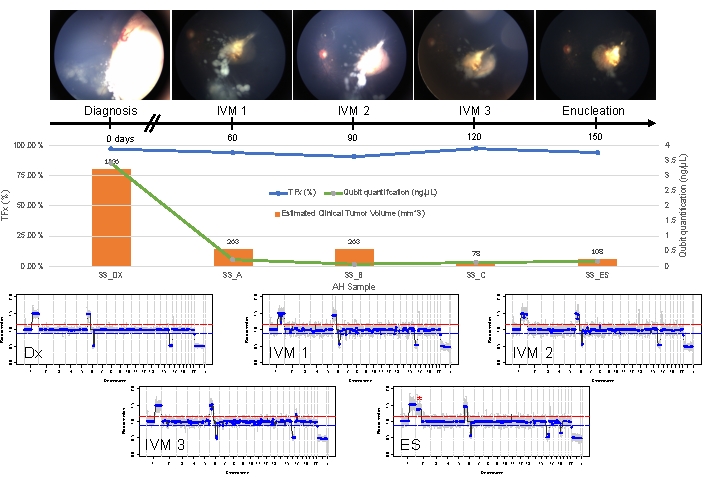
Figura 5: Información longitudinal del caso 33. Esto incluye fotos de fondo de ojo, cuantificación de ADN libre de células, volumen tumoral clínico estimado a partir de mediciones de B-scan (los volúmenes tumorales se indican encima de la barra naranja de cada punto de tiempo clínico), perfiles genómicos y estimaciones de TFx para cada punto de tiempo clínico en el que se muestreó AH (Dx = diagnóstico, A = IVM1, B = IVM2, C = IVM3, SE = enucleación secundaria). Este ojo no respondió al tratamiento, requiriendo finalmente una enucleación secundaria (CE). Esto se debió a la siembra persistentemente activa acompañada de una recidiva del tumor apical. La cantidad de ADNcf disminuyó con el tiempo, en consonancia con los estudios publicados anteriormente que mostraron el mayor rendimiento obtenido en el diagnóstico (ganancia 1q, ganancia 6p, pérdida 16q y pérdida focal 6q). Sin embargo, el TFx se mantuvo alto durante todo el tratamiento, producto de la siembra persistente que aún arroja ADNcf derivado del tumor en la AH. Los perfiles genómicos fueron consistentes y mostraron los mismos tres SCNA que estaban presentes en el momento del diagnóstico. En la AH obtenida en la ES, se observó una nueva ganancia de 2p a gran escala (*) y una pérdida de 19q, lo que sugiere una evolución clonal en el momento de la recidiva del tumor apical. En los perfiles genómicos, la línea roja representa el umbral de una ganancia, mientras que la línea azul representa el umbral de una pérdida. Esta figura ha sido reimpresa con permiso de Xu, L. et al.21. Haga clic aquí para ver una versión más grande de esta figura.
Legajo Complementario 1: Un ejemplo de (A) una muestra que debe pasar el control de calidad, con el pico alrededor de 300 pb y (B) una muestra que no debe pasar el control de calidad, con el pico alrededor de 150 pb. Por favor, haga clic aquí para descargar este archivo.
Discusión
La paracentesis corneal clara es un procedimiento que se realiza comúnmente para múltiples indicaciones diagnósticas y/o terapéuticas en oftalmología. Específicamente para la RB, es parte del protocolo estándar de inyección de quimioterapia intravítrea disminuir la presión intraocular antes de la inyección para prevenir el reflujo al sitio de inyección48. A pesar de ser un procedimiento común, no está completamente exento de riesgos; El dogma anterior era que una aguja nunca debía entrar en un ojo con RB activo. Este dogma ha evolucionado en la última década, primero a través del trabajo formativo de Patricia Chévez-Barrios sobre la terapia de vectores adenovirales inyectados49, seguido de métodos progresivos mejorados de seguridad para inyecciones oculares en RB por Francis Munier48. Este trabajo ha allanado el camino para que la extracción de la AH se utilice como biopsia líquida, o sustituta de la biopsia tumoral, para este cáncer. Ahora somos el primer centro en informar sobre la utilidad de la plataforma y los resultados preliminares de seguridad de la AH tomados en el momento del diagnóstico. Parte de los métodos descritos en este documento están destinados a garantizar la seguridad de la selección del paciente y los aspectos del procedimiento de la extracción de AH para la RB. En primer lugar, las agujas solo pueden entrar en la cámara anterior y no deben entrar en contacto con el iris o el cristalino, ya que esto puede causar cicatrices en el iris o cataratas que limitan la capacidad del cirujano para controlar el tumor. Lo más importante es que la aguja nunca penetre en la cavidad vítrea (a menos que se combine con la administración de quimioterapia como es el caso de la IVM), ni entre en contacto con el tumor, ya que esto hipotéticamente eleva el riesgo de diseminación tumoral y extensión extraocular de la enfermedad 3,4,5. Ambas estructuras son posteriores a la cámara anterior y están separadas de ella por el cristalino y el iris. Para evitar daños en cualquier estructura ocular, es importante mantener el bisel de la aguja en todo momento, por encima del iris periférico, y siempre bajo visualización directa con el microscopio quirúrgico. Existe el riesgo de una fuga menor de la AH desde el sitio de la aguja; Si esto ocurre, se resolverá con una presión suave a través de un aplicador de punta de algodón. El uso de la aguja de calibre más pequeño disponible y asegurarse de que la aguja se extraiga lentamente del mismo tracto sin ningún cizallamiento lateral disminuirá este riesgo. Aunque se espera un ligero hundimiento de la cámara anterior, la cámara debe permanecer formada sin contacto con la córnea del iris y la presión intraocular debe ser suave, pero fisiológica.
En lo que respecta a los análisis genómicos, hay varios pasos críticos involucrados. Lo más importante es la manipulación de la muestra de pequeño volumen una vez extraída del ojo; es crucial que la muestra permanezca congelada todo el tiempo antes del procesamiento para evitar la degradación del ADN que puede ocurrir con los ciclos repetidos de congelación y descongelación50. Asegurarse de que las muestras se coloquen en hielo seco inmediatamente después de la extracción y se transfieran a un congelador a -80 °C ayuda a garantizar esto. Una vez que las muestras han comenzado a procesarse, los pasos de control de calidad son la principal oportunidad para solucionar problemas al garantizar que el ADNcf se construya en bibliotecas de alta calidad. Mediante el uso de la cuantificación de ADN y el ensayo de perfil de tamaño de fragmentos de ADN, se puede realizar un control de calidad en muestras tomadas durante la enucleación primaria o en el momento del diagnóstico debido al mayor rendimiento de ADNcf presente en estas muestras18,21. Cuando el pico obtenido está en torno a los 300 pb, esto garantiza que el cfDNA será reconocido por la plataforma NGS. Si el pico obtenido es inferior a 150 pb, lo que indica que la mayoría de los fragmentos detectados son cebadores de construcción de bibliotecas u oligonucleótidos adaptadores, la muestra se ha visto comprometida y no debe procesarse más para detectar SCNA. Sin embargo, en nuestra experiencia de procesamiento de cientos de muestras, menos del 5% necesita ser eliminado para el control de calidad debido a una mala relación de alineación de lecturas20. Junto con los métodos que estandarizamos para la recolección, manipulación, almacenamiento y procesamiento de muestras, este procedimiento demuestra la validez preanalítica de la plataforma de biopsia líquida AH.
La biopsia líquida de AH también ha establecido una validez analítica basada en su capacidad para detectar de manera precisa y confiable mutaciones patógenas de RB1 y SCNAs, con concordancias medias consistentes >95% entre los perfiles genómicos generados a partir de muestras de AH y el tejido tumoral correspondiente 18,20,21,22,23. A pesar de la demostrada validez analítica de la plataforma, no está exenta de limitaciones. El análisis mutacional de RB1 solo se puede realizar en muestras con >10 ng de cfDNA, que se obtienen con mayor frecuencia en ojos sin tratamiento previo en el momento del diagnóstico o de la enucleación primaria18,21. Esto se debe a la menor concentración de ADNcf presente en las muestras de AH de los ojos que están en tratamiento activo en comparación con la AH en el momento del diagnóstico o en el momento de la enucleación primaria. Una limitación adicional es que las SCNA no se pueden detectar a TFxs por debajo del 5%, lo que impide el seguimiento de la enfermedad en los ojos en los que la carga tumoral ha disminuido significativamente; En nuestra experiencia, esto ocurre con mayor frecuencia en ojos que responden al tratamiento de quimioterapia intravítrea23.
Con el fin de determinar el TFx del cfDNA en el AH, se utiliza un software de estimación de TFx basado en CNA. Este software es una herramienta estándar y aceptada para el cálculo de TFx en biopsias líquidas, y su algoritmo ha sido descrito en detalle38,51. En resumen, el software de estimación TFx basado en CNA predice SCNAs a gran escala dentro del ADNcf secuenciado utilizando un modelo de Markov oculto. Las estimaciones de TFx se derivan en función de la presencia de SCNA, teniendo en cuenta las diferencias en la subclonalidad y la ploidía en cada locus, y a partir de ellas, el software de estimación de TFx basado en CNA elige una solución TFx óptima38. Sin embargo, una limitación inherente del software de estimación de TFx basado en CNA es que TFx se calcula en función de la presencia de SCNA en una muestra; por lo tanto, no es capaz de determinar TFx en muestras sin SCNAs (es decir, con perfiles genómicos planos)38. Como se ha demostrado anteriormente, no todos los tumores RB tienen SCNAs 14,15,18,21,23,45. Por lo tanto, un TFx muy bajo, determinado por el software de estimación de TFx basado en CNA, significa que 1) la muestra de AH no contiene ADNcf derivado del tumor medible o 2) el ADNcf tumoral está presente, pero es indetectable por el software de estimación de TFx basado en CNA debido a la falta de SCNAs38. La fracción alélica variante (VAF) para SNV es un sustituto de TFx. Por esta razón, estamos trabajando para desarrollar una tubería TFx basada en RB1 basada en VAF para permitir que los ojos RB sin SCNA también reciban un monitoreo longitudinal de TFx. Dado que todos los tumores RB, con la excepción de los tumores primarios impulsados por MYCN 14,15,42,43,44,45, contienen mutaciones somáticas en el gen RB1, una línea de productos que no dependa de los SCNA ampliaría la aplicación del protocolo de biopsia líquida presentado en este documento. Además, debido a que los SNV se pueden monitorear a TFxs por debajo del 5%, esto aumentaría la sensibilidad de nuestra plataforma.
La plataforma de biopsia líquida AH descrita aquí no es la única plataforma de biopsia líquida que existe en la literatura para RB, pero en particular, es la primera en describir el acuoso como una fuente enriquecida de ADN tumoral y la primera en describir la detección de ctDNA a través de dos mecanismos (SCNAs y RB1 SNVs) en cualquier biofluido basado en trabajos publicados hasta la fecha. Con la capacidad de detectar ctDNA de dos maneras, la biopsia líquida AH tiene una mayor sensibilidad que otras plataformas en la literatura. Por ejemplo, otro grupo ha detectado con éxito el ADNct RB en el AH con los SNV 52 de RB1. Sin embargo, esta plataforma se basaba en lecturas NGS específicas basadas en el conocimiento a priori del SNV. Por el contrario, la plataforma detallada en este manuscrito utiliza WGS no sesgado, lo que le da la capacidad de detectar SCNAs y SNVs. También se han probado biopsias líquidas basadas en sangre, aunque el ADNcf obtenido ha estado consistentemente por debajo del umbral para la detección de SCNA, que es el pronóstico para la probabilidad de rescate ocular (en este momento, no se ha demostrado que los SNV RB1 sean pronósticos para la recuperación ocular, sin embargo, puede haber un papel evolutivo en la detección de la enfermedad metastásica)19. Kothari et al. describieron SNVs RB1 en el plasma de pacientes con RB, pero solo en aquellos con una enfermedad intraocular avanzada que requirió enucleación16. La plataforma de biopsia líquida AH descrita aquí tiene la capacidad de detectar ctDNA en la AH de ojos menos avanzados, incluso sin la presencia de siembra 19,21. Además, las biopsias líquidas basadas en sangre no son específicas del ojo, ya que el ADNct aislado del suero puede ser de ambos ojos en los casos de RB bilateral. Esto limita la utilidad clínica de las plataformas basadas en la sangre, particularmente en pacientes bilaterales que representan el 40% de los casos de RB, mientras que la AH sigue siendo específica del ojo y puede demostrar heterogeneidad entre los ojos tanto a nivel de SNV como de SCNA53.
La importancia de la biopsia líquida AH para el campo de la RB es primordial. La biopsia líquida AH no solo brinda la oportunidad de comprender mejor la dinámica intratumoral en los ojos que se someten activamente a terapia, sino que también tiene el potencial de mejorar la atención al paciente. Sobre la base de estudios previos, hemos establecido una firma molecular, basada en la presencia de amplificación de MYCN o ganancia del cromosoma 6p con una amplitud de ≥1,5 en relación con la mediana, que es pronóstica para una probabilidad 16,5 veces mayor de fracaso del tratamiento que requiere enucleación 18,20,21. Con este conocimiento en el momento del diagnóstico, los médicos estarían en mejores condiciones de asesorar a las familias sobre las opciones de tratamiento adecuadas y la probabilidad de salvar el ojo con las terapias actuales. Aunque se ha establecido la validez clínica de la plataforma de biopsia líquida AH para RB 17,18,19,20,21,22,23, actualmente solo está aprobada para investigación; Se necesitan estudios multicéntricos prospectivos más grandes antes de que la biopsia líquida de AH pueda implementarse clínicamente para ayudar a dirigir la atención del paciente para la RB. En cualquier caso, la biopsia líquida AH tiene el potencial de permitir una oncología de precisión en el futuro, no solo para RB, sino también para otros tumores oculares.
Divulgaciones
Jesse Berry, Liya Xu y James Hicks han presentado una solicitud de patente titulada ADN libre de células de humor acuoso para la evaluación diagnóstica y pronóstica de la enfermedad oftálmica. De lo contrario, los autores no informan de ningún posible conflicto de intereses.
Agradecimientos
Esta investigación fue respaldada por las siguientes fuentes: NCI del K08CA232344 de Premios de los NIH (a J. L. Berry); Hyundai Hope on Wheels RGA012351 (a J. L. Berry); Childhood Eye Cancer Trust (a J.L. Berry); Sociedad Americana Contra El Cáncer IRG-16-181-57 (a J. L. Berry); Fundación Wright (a J.L. Berry y M.E. Kim); Fundación Oftalmológica de los Caballeros Templarios (a J.L. Berry); La Fundación Larry y Celia Moh (a J. L. Berry); el Instituto para las Familias, Inc., Hospital Infantil de Los Ángeles (J. L. Berry); una subvención departamental sin restricciones de Investigación para Prevenir la Ceguera (todos); El NCI P30CA014089 (todos); Fondo de Investigación Vicky Joseph (a P. Kuhn); Fondo de Investigación Carol Vassiliadis (a P. Kuhn); y la Facultad de Letras, Artes y Ciencias Dornsife de la USC (a P. Kuhn).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | surgical grade, whatever available in hospital | ||
| 32 G needle | surgical grade, whatever available in hospital | ||
| Aligner | Authors use Bowtie2 (http://bowtie-bio.sourceforge.net/bowtie2/index.shtml) but other aligners such as BWA or GRCh38 will also work | ||
| Atropos | generic term: adapter remover. https://atropos.readthedocs.io/en/latest/index.html# | ||
| Bioanalyzer High Sensitivity DNA Kit | Agilent | 5067-4626 | generic term: DNA fragment size profiling assay |
| BWA-MEM | generic term: long sequence aligner. http://bio-bwa.sourceforge.net/bwa.shtml | ||
| DNAcopy | Bioconductor | generic term: DNA copy number data analysis. https://bioconductor.org/packages/release/bioc/html/DNAcopy.html | |
| dsDNA High Sensitivity Assay | Qubit | Q32851 | generic term: DNA quantification assay |
| FreeBayes | generic term: sequence variant determiner. https://github.com/freebayes/freebayes | ||
| ichorCNA software | generic term: CNA-based TFx estimation. https://github.com/broadinstitute/ichorCNA | ||
| Illumina platform | Illumina | generic term: NGS platform; please note that other NGS platforms will work in principle, but have not been trialed by these authors | |
| NovoAlign (v3) | Novocraft | generic term: mapping of short reads onto reference genome. http://www.novocraft.com/products/novoalign/ | |
| QIAamp Circulating Nucleic Acid Kit | Qiagen | 55114 | generic term: cfDNA isolation and purification kit |
| QIAseq Ultralow Input Library Kit | Qiagen | 180492 | generic term: DNA library sequencing kit |
| Samtools rmdup | generic term: tool to remove duplicate reads. http://www.htslib.org/doc/samtools-rmdup.html | ||
| VarDict | generic term: variant caller. https://github.com/AstraZeneca-NGS/VarDict | ||
| Variant Effect Predictor | Ensembl | generic term: variant effect determinator. https://uswest.ensembl.org/info/docs/tools/vep/index.html |
Referencias
- Fernandes, A. G., Pollock, B. D., Rabito, F. A. Retinoblastoma in the United States: A 40-year incidence and survival analysis. Journal of Pediatric Ophthalmology & Strabismus. 55 (3), 182-188 (2018).
- Linn, A. M. Intraocular retinoblastoma: the case for a new group classification. Ophthalmology Clinics of North America. 18 (1), 41-53 (2005).
- Shields, J. A., Shields, C. L., Ehya, H., Eagle, R. C., De Potter, P. Fine-needle aspiration biopsy of suspected intraocular tumors. The 1992 Urwick lecture. Ophthalmology. 100 (11), 1677-1684 (1993).
- Karcioglu, Z. A., Gordon, R. A., Karcioglu, G. L. Tumor seeding in ocular fine needle aspiration biopsy. Ophthalmology. 92 (12), 1763-1767 (1985).
- Karcioglu, Z. A. Fine needle aspiration biopsy (FNAB) for retinoblastoma. Retina. 22 (6), 707-710 (2002).
- Eide, N., Syrdalen, P., Walaas, L., Hagmar, B. Fine needle aspiration biopsy in selecting treatment for inconclusive intraocular disease. Acta Ophthalmologica Scandinavica. 77 (4), 448-452 (1999).
- Eide, N., Walaas, L. Fine-needle aspiration biopsy and other biopsies in suspected intraocular malignant disease: a review. Acta Ophthalmologica. 87 (6), 588-601 (2009).
- Eriksson, O., Hagmar, B., Ryd, W. Effects of fine-needle aspiration and other biopsy procedures on tumor dissemination in mice. Cancer. 54 (1), 73-78 (1984).
- Ali, M. J., Honavar, S. G., Vemuganti, G. K., Singh, A. D. Fine needle aspiration biopsy of retinal tumors. Monographs in Clinical Cytology. 21, 72-81 (2012).
- Di Nicolantonio, F. a. l., et al. The chemosensitivity profile of retinoblastoma. Recent Results in Cancer Research. 161, 73-80 (2003).
- Francis, J. H., et al. Efficacy and toxicity of second-course ophthalmic artery chemosurgery for retinoblastoma. Ophthalmology. 122 (5), 1016-1022 (2015).
- Francis, J. H. Efficacy and toxicity of intravitreous chemotherapy for retinoblastoma: Four-year experience. Ophthalmology. 124 (4), 488-495 (2017).
- Francis, J. H., et al. Current treatment of bilateral retinoblastoma: The impact of intraarterial and intravitreous chemotherapy. Neoplasia. 20 (8), 757-763 (2018).
- Rushlow, D. E., et al. Characterisation of retinoblastomas without RB1 mutations: genomic, gene expression, and clinical studies. The Lancet Oncology. 14 (4), 327-334 (2013).
- Afshar, A. R., et al. Next-generation sequencing of retinoblastoma identifies pathogenic alterations beyond RB1 inactivation that correlate with aggressive histopathologic features. Ophthalmology. 127 (6), 804-813 (2020).
- Kothari, P. Cell-free DNA profiling in retinoblastoma patients with advanced intraocular disease: An MSKCC experience. Cancer Medicine. 9 (17), 6093-6101 (2020).
- Berry, J. L., et al. Potential of aqueous humor as a surrogate tumor biopsy for retinoblastoma. JAMA Ophthalmology. 135 (11), 1221-1230 (2017).
- Berry, J. L., et al. Genomic cfDNA analysis of aqueous humor in retinoblastoma predicts eye salvage: the surrogate tumor biopsy for retinoblastoma. Molecular Cancer Research. 16 (11), 1701-1712 (2018).
- Berry, J. L., et al. Aqueous humor is superior to blood as a liquid biopsy for retinoblastoma. Ophthalmology. 127 (4), 552-554 (2020).
- Xu, L., et al. Chromosome 6p amplification in aqueous humor cell-free DNA Is a prognostic biomarker for retinoblastoma ocular survival. Molecular Cancer Research. 18 (8), 1166-1175 (2020).
- Xu, L., et al. Establishing the clinical utility of ctDNA analysis for diagnosis, prognosis, and treatment monitoring of retinoblastoma: The aqueous humor liquid biopsy. Cancers. 13 (6), (2021).
- Xu, L. Simultaneous identification of clinically relevant RB1 mutations and copy number alterations in aqueous humor of retinoblastoma eyes. Ophthalmic Genetics. 41 (6), 526-532 (2020).
- Polski, A., et al. Longitudinal aqueous humor sampling reflects treatment response in retinoblastoma patients. Investigative Ophthalmology & Visual Science. 61 (7), 1394 (2020).
- . Genome Browser Available from: https://genome.ucsc.edu/cgi-bin/hgTracks?db=hg19&lastVirtModeType=default&lastVirtModeExtraState=&virtModeType=default&3A15578261%_2D15621068&hgsid=1135765621_qIuA0U (2021)
- Navarro Gonzalez, J., et al. The UCSC genome browser database: 2021 update. Nucleic Acids Research. 49 (1), 1046-1057 (2021).
- Li, H. A statistical framework for SNP calling, mutation discovery, association mapping and population genetical parameter estimation from sequencing data. Bioinformatics. 27 (21), 2987-2993 (2011).
- Baslan, T., et al. Genome-wide copy number analysis of single cells. Nature Protocols. 7 (6), 1024-1041 (2012).
- Huber, W., et al. Orchestrating high-throughput genomic analysis with Bioconductor. Nature Methods. 12 (2), 115-121 (2015).
- Baslan, T., et al. Erratum: Genome-wide copy number analysis of single cells. Nature Protocols. 11 (3), 1024-1041 (2016).
- Didion, J. P., Martin, M., Collins, F. S. Atropos: specific, sensitive, and speedy trimming of sequencing reads. PeerJ. 5, 3720 (2017).
- Li, H. Aligning sequence reads, clone sequences and assembly contigs with BWA-MEM. arXiv. , (2013).
- Garrison, E., Marth, G. Haplotype-based variant detection from short-read sequencing. arXiv. , (2012).
- McLaren, W., et al. The ensembl variant effect predictor. Genome Biology. 17 (1), 122 (2016).
- Lai, Z., et al. VarDict: a novel and versatile variant caller for next-generation sequencing in cancer research. Nucleic Acids Research. 44 (11), 108 (2016).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA (2017)
- Adalsteinsson, V. A., et al. Scalable whole-exome sequencing of cell-free DNA reveals high concordance with metastatic tumors. Nature Communications. 8 (1), 1-13 (2017).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA/wiki/Interpreting-ichorCNA-results (2017)
- Berry, J. L., et al. Long-term outcomes of Group D retinoblastoma eyes during the intravitreal melphalan era. Pediatric Blood & Cancer. 64 (12), (2017).
- Berry, J. L., et al. Long-term outcomes of Group D eyes in bilateral retinoblastoma patients treated with chemoreduction and low-dose IMRT salvage. Pediatric Blood & Cancer. 60 (4), 688-693 (2013).
- Francis, J. H., et al. Molecular changes in retinoblastoma beyond RB1: Findings from next-generation sequencing. Cancers (Basel). 13 (1), (2021).
- Schwermer, M., et al. Comprehensive characterization of RB1 mutant and MYCN amplified retinoblastoma cell lines. Experimental Cell Research. 375 (2), 92-99 (2019).
- Davies, H. R. Whole-genome sequencing of retinoblastoma reveals the diversity of rearrangements disrupting RB1 and uncovers a treatment-related mutational signature. Cancers. 13 (4), 754 (2021).
- Lillington, D. M., et al. Comparative genomic hybridization of 49 primary retinoblastoma tumors identifies chromosomal regions associated with histopathology, progression, and patient outcome. Genes, Chromosomes and Cancer. 36 (2), 121-128 (2003).
- Greger, V., et al. Frequency and parental origin of hypermethylated RB1 alleles in retinoblastoma. Human Genetics. 94 (5), 491-496 (1994).
- Raizis, A. M., et al. DNA hypermethylation/boundary control loss identified in retinoblastomas associated with genetic and epigenetic inactivation of the RB1 gene promoter. Epigenetics. 1-15, (2020).
- Munier, F. L., et al. Profiling safety of intravitreal injections for retinoblastoma using an anti-reflux procedure and sterilisation of the needle track. British Journal of Ophthalmology. 96 (8), 1084-1087 (2012).
- Chévez-Barrios, P., et al. Response of retinoblastoma with vitreous tumor seeding to adenovirus-mediated delivery of thymidine kinase followed by ganciclovir. Journal of Clinical Oncology. 23 (31), 7927-7935 (2005).
- Shao, W., Khin, S., Kopp, W. C. Characterization of effect of repeated freeze and thaw cycles on stability of genomic DNA using pulsed field gel electrophoresis. Biopreservation and Biobanking. 10 (1), 4-11 (2012).
- Choudhury, A. D., et al. Tumor fraction in cell-free DNA as a biomarker in prostate cancer. JCI Insight. 3 (21), (2018).
- Gerrish, A., et al. Non-invasive diagnosis of retinoblastoma using cell-free DNA from aqueous humour. British Journal of Ophthalmology. 103 (5), 721-724 (2019).
- Wong, E. Y., Xu, L., Shen, L. Inter-eye genomic heterogeneity in bilateral retinoblastoma via aqueous humor liquid biopsy. NPJ Precis Oncol. 5 (1), 73 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados