Method Article
L’humeur aqueuse comme biopsie liquide pour le rétinoblastome : paracentèse cornéenne claire et analyse génomique
Dans cet article
Résumé
L’humeur aqueuse est une biopsie liquide à haut rendement pour le rétinoblastome, un cancer intraoculaire qui ne peut pas être biopsié in vivo en raison du risque de propagation extraoculaire. Nous présentons ici une méthode permettant d’extraire en toute sécurité l’humeur aqueuse par paracentèse cornéenne claire et des étapes d’analyse génomique afin d’identifier des biomarqueurs pronostiques.
Résumé
L’application d’une plateforme de biopsie liquide pour le rétinoblastome présente une utilité clinique potentielle significative, étant donné que la biopsie tumorale directe est interdite chez ces patients. L’humeur aqueuse (AH) se forme dans un compartiment séparé de la tumeur mais est enfermée dans le même espace oculaire. Ainsi, il s’agit d’une source enrichie d’informations génomiques tumorales spécifiques à l’œil qui peuvent être utilisées comme biopsie liquide ou substitut à la biopsie tumorale pour cette maladie. Ce manuscrit détaille une méthodologie permettant d’extraire en toute sécurité l’AH des yeux de rétinoblastome via une paracentèse cornéenne claire. De plus, les étapes de l’analyse génomique, y compris l’isolement et la purification de l’ADN acellulaire, le séquençage de nouvelle génération, l’analyse de l’altération du nombre de copies somatiques (SCNA), l’identification de la mutation du variant mononucléotidique (SNV) RB1 et l’estimation de la fraction tumorale, sont présentées. La validité pré-analytique, analytique et clinique précoce de la plateforme de biopsie liquide AH a été évaluée ; Cependant, il n’est pas sans limites. Ceux-ci sont en grande partie une conséquence de la quantité d’ADN acellulaire nécessaire à certaines étapes du test. Comparativement à d’autres plateformes de biopsie liquide à base de sang actuellement à l’étude pour le rétinoblastome, une plateforme à base d’AH est limitée par le volume de biofluide (et donc la quantité d’ADN) qui peut être extrait de l’œil ; l’avantage est que l’AH est spécifique à l’œil. La plate-forme discutée ici est unique en ce sens qu’elle détecte l’ADN tumoral circulant dans l’AH via deux mécanismes (SCNAs et SNV RB1 ), ce qui permet une sensibilité plus élevée pour l’identification de l’information génomique tumorale. La biopsie liquide AH a le potentiel d’une application clinique directe à l’oncologie de précision pour les patients atteints de rétinoblastome, avec une importance particulière pour les patients atteints d’une maladie bilatérale car l’AH est spécifique aux tumeurs de chaque œil. Des recherches sont en cours avec des applications de cette plate-forme aux patients atteints d’autres tumeurs oculaires également.
Introduction
Le rétinoblastome (RB) est un cancer rare et unique. Bien qu’il s’agisse de la tumeur maligne intraoculaire primaire la plus courante qui se forme dans la rétine en développement des nourrissons et des tout-petits, il n’y a qu’environ 7000 cas dans le monde chaque année, dont environ 250 à 300 aux États-Unis. Bien que la survie des patients approche les 98 %dans les pays développés1, la survie oculaire des yeux avancés, qui sont cliniquement classés dans le groupe D/E de l’International Intraocular RB Classification (IIRC)2 ou AJCC cT2b/3, est beaucoup plus faible. Beaucoup de ces yeux avancés sont énucléés soit principalement (comme premier traitement), soit secondairement (après des tentatives infructueuses de thérapie de sauvetage du globe). Dans la pratique clinique actuelle de l’oncologie oculaire, il n’existe pas de biomarqueurs moléculaires spécifiques à l’œil dérivés de tumeurs qui sont actuellement utilisés cliniquement pour aider au diagnostic, au pronostic de la survie oculaire ou au suivi du traitement des patients atteints de RB. Cela est dû, en grande partie, au fait que le tissu tumoral n’est disponible que pour les analyses moléculaires et génétiques des yeux énucléés, car la biopsie tumorale directe dans la RB est interdite en raison de la crainte de propagation extraoculairede la tumeur 3,4,5,6,7,8,9 . En raison de cette interdiction, les études rétrospectives précédentes sur la génétique tumorale RB et leurs corrélations cliniques se limitaient à l’analyse du tissu tumoral obtenu à partir d’yeux énucléés uniquement 10,11,12,13. Par conséquent, il y a eu un manque de données moléculaires objectives dérivées de tumeurs disponibles au moment du diagnostic et tout au long de la thérapie de sauvetage oculaire. Cela a limité non seulement la compréhension de la biologie des tumeurs in vivo et la façon dont ces tumeurs changent au niveau moléculaire tout au long de la thérapie, mais aussi la capacité à développer des plans de traitement personnalisés, spécifiques à l’œil et basés sur la génomique pour ces jeunes patients atteints de cancer.
Outre l’interdiction de la biopsie, un autre aspect unique de ce cancer est que la plupart des tumeurs sont initiées par la perte bi-allélique du gène suppresseur de tumeur RB1, qui module le cycle cellulaire. La rétine en développement est extrêmement sensible à cette perte. Chez 60 % des patients, cette inactivation bi-allélique du gène RB1 ne se produit dans la rétine que sous forme de perte somatique et entraîne une maladie unilatérale. Cependant, chez 40 % des patients, la mutation initiale de RB1 se produit dans la lignée germinale, suivie d’un deuxième « coup » dans la rétine. Chez ces enfants, il y a souvent plusieurs tumeurs affectant les deux yeux. Enfin, un très petit sous-ensemble (<2 %) de tumeurs semble être entraîné par l’amplification MYCN sans mutations dans le gène RB1. Alors que les tumeurs induites par MYCN échouent presque universellement au traitement et nécessitent une énucléation, il n’existe actuellement aucun moyen clair et objectif d’identifier ce sous-type de tumeur agressive au moment du diagnostic14,15. De plus, la surveillance de l’activité tumorale intraoculaire RB repose presque exclusivement sur l’imagerie et les observations cliniques de chaque œil par l’oncologue oculaire traitant. Il n’existe pas d’objectif de référence, de moyen quantitatif de diagnostic, de pronostic ou de moyen de surveiller la dynamique tumorale spécifique à l’œil tout au long du traitement. En raison de ces limites uniques pour RB, la perspective d’une plateforme de biopsie liquide pour ce cancer est attrayante. Les biopsies liquides utilisent des fluides corporels pour isoler et séquencer l’ADN acellulaire afin de déterminer s’il est dérivé de la tumeur, connu sous le nom d’ADN tumoral circulant (ADNct). Bien que le sérum soit recherché pour d’autres cancers, l’ADNtc RB que l’on trouve dans le sérum n’est pas spécifique à l’œil, ce qui présente des limites évidentes pour les 40 % de patients qui souffrent d’une maladie bilatérale. De plus, il n’a été décrit que dans le cadre d’une maladie intraoculaire ou métastatique avancée, généralement avec une faible fraction tumorale (<5 %)16.
Dans le but de résoudre ces problèmes cliniques réels auxquels sont confrontés les patients et les familles, nous avons démontré en 2017 que l’humeur aqueuse (AH, le liquide clair devant l’œil), est une source à haut rendement d’ADNtc qui peut être utilisée comme biopsie liquide – ou plus encore comme substitut à la biopsie tumorale – pour évaluer RB17, 18 et 19. Avec plus de 200 échantillons à ce jour, l’ADNtc dans >95 % des échantillons a été identifié, y compris les yeux moins avancés des groupes A, B et C de l’IIRC, ainsi que les différences génomiques entre les yeux chez les patients bilatéraux18,19. Cet ADN peut être isolé de manière sûre et efficace pour la détection de biomarqueurs moléculaires pertinents dans les yeux qui suivent activement un traitement ou qui n’ont jamais été traités 18,20,21. La plateforme de biopsie liquide AH peut également être utilisée pour identifier les variants pathogènes diagnostiques de RB1 ou l’amplification primaire de MYCN qui initie la tumorigenèse21,22. Il est important de noter que nous avons identifié une signature moléculaire pronostique – la présence d’un gain chromosomique 6p avec une amplitude de ≥1,5 par rapport à l’amplification médiane ou focale de MYCN – qui est associée à une probabilité accrue de 16,5 de perte de contrôle de la tumeur intraoculaire nécessitant l’ablation de l’œil 18,20,21. Enfin, il a été démontré que les modifications de la fraction tumorale de l’ADNtc (TFx) dans l’AH sont corrélées avec la réponse thérapeutique, car des niveaux plus élevés sont corrélés à une maladie active, et des niveaux décroissants sont associés à une réponse positive au traitement23. Compte tenu de ces applications et de leur utilité clinique potentielle, nous avons voulu définir la méthodologie de biopsie et d’évaluation de l’AH. Cela comprend une paracentèse cornéenne claire pour l’acquisition d’échantillons et le protocole d’analyse génomique, en particulier la construction et le séquençage de la banque d’ADNcf, la détermination de l’amplitude de l’ARSCn, l’identification des variants pathogènes RB1 et le calcul de TFx.
Protocole
Cette recherche est menée avec l’approbation de l’hôpital pour enfants de Los Angeles et du conseil d’examen institutionnel de l’Université de Californie du Sud, et elle adhère aux principes de la Déclaration d’Helsinki. Le consentement éclairé écrit est toujours obtenu des tuteurs légaux de tous les participants.
Un schéma du flux de travail de la biopsie liquide AH est illustré à la figure 1.
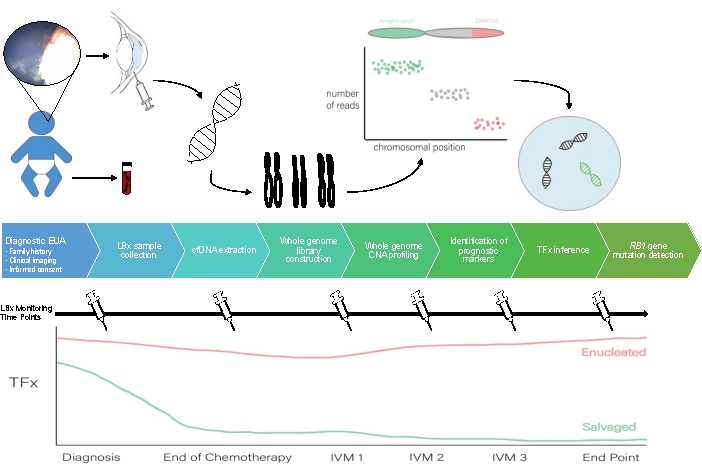
Figure 1 : Déroulement de la biopsie liquide AH pour accompagner le protocole décrit dans le présent document. EUA, examen sous anesthésie ; LBX, biopsie liquide ; cfDNA, ADN acellulaire ; CNA, modification du numéro de copie ; TFx, fraction tumorale ; MIV, melphalan intravitréen. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Intervention chirurgicale :
REMARQUE : Cette procédure est effectuée lors d’un examen de routine sous anesthésie (EUA) pour l’évaluation clinique des patients atteints de RB. La procédure de paracentèse pour extraire l’AH ne doit être effectuée que par un chirurgien ophtalmologue formé qui a suivi une formation standard en chirurgie oculaire.
- Les critères de sélection et d’inclusion des patients sont les suivants.
- Assurez-vous que la chambre est formée et dégagée sans être scintillante de la tumeur, des synéchies ou d’une lentille cataracte.
REMARQUE : Dans certains yeux avancés, la chambre est trop peu profonde au moment du diagnostic pour extraire en toute sécurité l’AH. Dans ces cas, il est recommandé d’attendre après le premier cycle de chimiothérapie systémique ou intra-artérielle. Une fois que la tumeur principale rétrécit, la chambre s’approfondit généralement, ce qui permet une approche sûre. - Assurez-vous qu’il y a une vue dégagée de toutes les structures et que la pression est de <22 mm Hg afin qu’il n’y ait pas de rétrécissement rapide de la chambre en raison de la dynamique de la pression. Cela est vrai pour tous les points temporels, mais particulièrement critique lorsque l’AH est prise au moment du diagnostic.
- Assurez-vous qu’il n’y a pas d’implication directe du segment antérieur par la tumeur, qui est évaluée par visualisation directe et biomicroscopie par échographie. Ce critère d’inclusion est généralement identifié lors de l’EUA.
- Assurez-vous que la chambre est formée et dégagée sans être scintillante de la tumeur, des synéchies ou d’une lentille cataracte.
- Une fois que le patient a été jugé apte et qu’il a donné son consentement, amenez-le au bloc opératoire. Permettre à l’anesthésiste traitant d’initier l’anesthésie comme il est courant pour l’EUA pour les soins cliniques des patients atteints de RB.
- Une fois que le patient est intubé et sédatif, et que tous les examens cliniques, l’imagerie et tous les besoins thérapeutiques locaux (par exemple, laser ou cryothérapie) relatifs à l’EUA sont terminés, extrayez l’AH pour la plateforme de biopsie liquide. Préparez et drapez l’œil de la manière stérile habituelle. Cela peut être complété par l’infirmière circulante ou le chirurgien qui l’opérationnait.
- Avant l’EUA, placez les gouttes dilatantes couramment utilisées dans l’établissement pour une EUA dans l’œil chirurgical.
REMARQUE : Ici, des gouttes ophtalmiques combinées composées de 2,5 % de phényléphrine, de 1 % de cyclopentolate et de 1 % de tropicamide sont utilisées. Cependant, toutes les gouttes standard utilisées pour la dilatation pour l’EUA sont suffisantes ; l’œil n’a pas besoin d’être dilaté simplement pour extraire l’AH. - Placez une goutte de bétadine à 5 % dans l’œil chirurgical et appliquez-la à l’aide d’une éponge en commençant par le centre et en se déplaçant vers la périphérie. Inclure les bords supérieurs et inférieurs des paupières dans la préparation chirurgicale. Terminez la préparation chirurgicale à l’aide de bétadine trois fois, puis attendez au moins deux minutes avant de continuer.
- Placez une serviette bleue stérile sur la tête du patient et glissez-la sous la tête pour l’empêcher de tomber. Séchez les cils et la zone périorbitaire avec une serviette bleue stérile ou une gaze.
- Laissez le chirurgien se frotter, enfilez une blouse et enfilez des gants.
- Couvrez le patient avec des champs bleus stériles, laissant l’œil chirurgical exposé. Placez un spéculum à couvercle stérile pour une visualisation optimale du champ stérile.
REMARQUE : Une anesthésie topique supplémentaire n’est pas nécessaire dans notre établissement car l’enfant est sous anesthésie générale pour l’EUA. - Effectuer une pause selon le protocole institutionnel. Ici, un premier temps d’arrêt est effectué pour l’EUA et un deuxième temps d’arrêt pour vérifier le ou les yeux avant la procédure.
- Avant l’EUA, placez les gouttes dilatantes couramment utilisées dans l’établissement pour une EUA dans l’œil chirurgical.
- À l’aide d’un microscope opératoire, effectuer une paracentèse cornéenne claire avec extraction de 0,1 mL d’AH avec une aiguille de 32 G sur une seringue de 1 cc.
- Avant de commencer l’intervention, mouiller l’œil avec une solution saline équilibrée stérile (chaque mL contenant du chlorure de sodium 0,64 %, du chlorure de potassium 0,075 %, du chlorure de calcium dihydraté 0,048 %, du chlorure de magnésium hexahydraté 0,03 %, de l’acétate de sodium trihydraté 0,39 %, du citrate de sodium dihydraté 0,17 %, de l’hydroxyde de sodium et/ou de l’acide chlorhydrique (pour ajuster le pH) et de l’eau pour injection) afin de maintenir la lubrification cornéenne ; Il s’agit d’une préparation commerciale standard.
- Assurez-vous que l’aiguille de 32 G est verrouillée sur la seringue de 1 cc et qu’il n’y a pas de pression dans la seringue (en déplaçant le piston de la seringue vers l’intérieur et vers l’extérieur plusieurs fois avant l’utilisation).
- Ensuite, passez l’aiguille à travers la cornée claire au niveau du limbe (perpendiculairement à celle-ci, comme c’est le cas pour la paracentèse) et restez dans la chambre antérieure au-dessus de l’iris dilaté périphérique.
- Gardez la pointe de l’aiguille biseautée vers le haut à l’avant de l’iris sous une visualisation directe au microscope pendant l’extraction. Si vous le souhaitez, stabilisez l’œil à l’aide d’une pince de 0,12 pendant que l’aiguille traverse la cornée.
REMARQUE : Il ne doit jamais y avoir de contact entre la pointe de l’aiguille et une structure oculaire ; Il doit rester sur l’iris périphérique dans la chambre antérieure moyenne. - Extraire 0,1 mL d’AH. Manipulez le piston de la seringue avec la main non dominante du chirurgien (mais avec de la pratique) ou par un assistant formé sans bouger l’aiguille. Ne perdez pas la visualisation directe de la pointe de l’aiguille. Privilégiez l’anatomie de l’œil et prenez moins d’AH si nécessaire pour vous assurer que la chambre reste formée.
- Après l’extraction, retirez délicatement l’aiguille de la chambre antérieure. Assurez-vous que la chambre reste formée mais légèrement peu profonde ; La pression sera douce mais physiologique. Une fois l’aiguille retirée de l’œil, baignez copieusement l’œil avec de l’eau stérile ; L’eau stérile est préférée à une solution saline équilibrée à cette étape par mesure de sécurité, car l’eau lyse les cellules.
- Examinez le site de l’aiguille pour détecter toute fuite. S’il y a une fuite, utilisez un applicateur à embout en coton pour appliquer une légère pression sur le site d’injection pendant 30 secondes avant de vérifier à nouveau s’il n’y a pas de fuite. Répétez le processus si nécessaire.
REMARQUE : L’utilisation de méthodes plus invasives pour arrêter toute fuite n’a jamais été nécessaire avec cette approche. Parfois, cette procédure est suivie d’une injection intravitréenne de chimiothérapie ; Pour cet article sur les méthodes, le protocole se concentre sur l’extraction de l’AH en tant que procédure principale.
- Examinez le site de l’aiguille pour détecter toute fuite. S’il y a une fuite, utilisez un applicateur à embout en coton pour appliquer une légère pression sur le site d’injection pendant 30 secondes avant de vérifier à nouveau s’il n’y a pas de fuite. Répétez le processus si nécessaire.
- Une fois qu’il n’y a pas de fuite, la procédure est considérée comme terminée. Retirez les champs stériles du patient et nettoyez la bétadine du visage.
- Retirez soigneusement l’extrémité de l’aiguille de la seringue, utilisez un capuchon stérile pour fermer l’échantillon via Luer Lock afin de ne pas perdre d’échantillon, et étiquetez la seringue de manière appropriée.
REMARQUE : Cela devrait être fait par le coordonnateur de la recherche clinique ou le chirurgien pendant que l’enfant est extubé.- Après l’extraction de l’échantillon, conservez l’échantillon dans une seringue bouchée à -80 °C ; Les échantillons peuvent être placés sur de la glace sèche pour être transportés dans un congélateur approprié à partir de la salle d’opération.
- Placez une seule goutte de gouttes ophtalmiques antibiotiques selon la préférence du chirurgien sur la surface de l’œil chirurgical avant que le patient ne soit envoyé en convalescence. Ici, des gouttes ophtalmiques combinées stéroïdes-antibiotiques sont utilisées, et l’œil n’est pas patché.
- Une fois l’intervention terminée, l’anesthésiste traitant assure une extubation correcte. Amener le patient à la guérison.
- Donner congé au patient à domicile en suivant le protocole postopératoire de l’établissement.
- Informez le patient qu’il n’est pas nécessaire de recouvrir l’œil d’un bandage ou d’un revêtement protecteur.
- Informer le patient de ne pas immerger complètement sa tête dans un bain ou une piscine pendant 24 heures, et aux parents de ne pas frotter l’œil du patient (enfant) ; Il n’y a pas d’autres limites à l’activité du patient.
- Informez le patient qu’il est peu probable qu’il ressente des douleurs dues à la paracentèse, mais qu’il pourrait ressentir des douleurs dues aux procédures associées pendant l’EUA. Le patient peut prendre de l’acétaminophène ou de l’ibuprofène en cas d’inconfort, comme suggéré par le chirurgien.
2. Isolement et purification de l’ADNcf
- Effectuez l’isolement et le traitement de l’ADN dans les 72 heures suivant l’extraction de l’AH.
- Décongeler AH à température ambiante. Vérifiez fréquemment l’échantillon et passez à l’extraction immédiatement après la décongélation.
- Extrayez l’ADNcf de l’AH et éluez-le dans 50 μL de solution AVE (incluse dans le kit) à l’aide du kit d’isolement et de purification de l’ADNcf (voir la table des matériaux pour plus de détails) conformément au manuel d’instructions du fabricant.
3. Séquençage de nouvelle génération (NGS) et contrôle de la qualité (QC)
- Construisez les banques d’ADN pour le séquençage à l’aide du kit de séquençage de la bibliothèque d’ADN (voir la table des matériaux) conformément au manuel d’instructions du fabricant. Amplifiez l’ADN de la banque avec 14 cycles de réaction en chaîne par polymérase (PCR), comme indiqué dans le manuel du kit de séquençage de la banque d’ADN.
REMARQUE : Les banques finales peuvent être stockées à -20 °C jusqu’à 1 mois avant le séquençage final pour l’analyse génomique. - Séquencez les banques d’ADN sur la plate-forme NGS (voir le tableau des matériaux) selon le protocole du fabricant selon le protocole à une extrémité de 50 cycles ou le protocole à une extrémité appariée de 150 cycles.
REMARQUE : D’autres plates-formes NGS fonctionneront en principe (bien que cela n’ait pas été essayé ici), avec des adaptateurs appropriés pour la cellule de séquençage. - Effectuer un contrôle de la qualité pour tous les échantillons d’AH prélevés au moment du diagnostic ou de l’énucléation primaire.
REMARQUE : Le CQ ne peut pas être effectué pour les échantillons prélevés à d’autres moments, car la masse d’ADN sera trop faible et hors de la plage de détection pour les étapes décrites ci-dessous.- Utiliser 1 μL de l’ADN extrait pour le dosage de l’ADN et le dosage du profil granulométrique (voir la Table des matériaux) selon les protocoles du fabricant.
REMARQUE : Le pic doit être d’environ 300 pb. S’il est inférieur à 150 pb, l’échantillon a été compromis. Voir le fichier supplémentaire 1A pour un exemple d’échantillon qui devrait réussir le contrôle de la qualité et le fichier supplémentaire 1B pour un exemple d’un échantillon qui ne devrait pas l’être.
- Utiliser 1 μL de l’ADN extrait pour le dosage de l’ADN et le dosage du profil granulométrique (voir la Table des matériaux) selon les protocoles du fabricant.
4. Analyse des données d’altération du nombre de copies somatiques (SCNA)
- Associez les lectures obtenues à partir du NGS (section 3) au génome humain (hg19, Genome Reference Consortium GRCh37, base de données Genome Browser de l’Université de Californie à Santa Cruz)24,25 à l’aide d’une gouttière.
- Supprimez les doublons PCR (samtools rmdup26).
- Normalisez la teneur en guanine-cytosine en calculant le pourcentage de guanine et de bases de cytosine dans chaque bac à partir du génome de référence. Un exemple de programme est décrit dans Baslan et al.27.
- Pour obtenir le nombre de copies de segments d’ADN, divisez le génome en 5000 bacs de longueur variable, puis calculez le nombre relatif de lectures contenues dans chaque bac.
- Utilisez des ratios log2 sans référence pour déterminer les estimations du nombre de copies. Prenez le nombre médian de fenêtres des chromosomes autosomiques normaux.
- Effectuez une segmentation à l’aide de la segmentation binaire circulaire avec DNAcopy (Bioconductor28).
- Définir les SCNA comme positifs à une déflexion de 20 % par rapport à la ligne de base (rapport log2 = 0), c’est-à-dire des pertes à des rapports log2 ≤ 0,2 (un rapport de 0,87 ou inférieur définit une délétion) et des gains à des rapports log2 ≥ 0,2 (rapport de 1,15 ou plus définit une amplification).
REMARQUE : Ces seuils sont conformes aux analyses de biopsie liquide précédemment établies27,29.
5. Analyse mutationnelle RB1 d’échantillons AH
- De plus, amplifier l’ensemble des bibliothèques de génomes à 500 ng chacune pour un NGS ciblé basé sur la capture pour la détection des mutations selon le protocole du fabricant.
- Effectuez un séquençage à extrémité unique apparié de 150 pb ou 50 pb sur les bibliothèques capturées jusqu’à > 100 fois par protocole du fabricant.
- Traiter les données NGS. Dans cette étude, un pipeline interne basé sur le pipeline bcbio du Centre de médecine personnalisée de l’ABCH est utilisé30.
- Réduisez les données brutes fastq des adaptateurs et des bases de mauvaise qualité avec Atropos31 et alignez-vous sur la référence humaine GRCh37 avec BWA-MEM et NovoAlign (v3)32,33.
- Marquez les doublons avec FreeBayes34 , puis déterminez la variante germinale.
REMARQUE : Dans les outils d’appel de variants FreeBayes, chaque position du génome de l’échantillon est comparée au génome de référence et le nombre d’allèles est modélisé mathématiquement pour obtenir les mesures de vraisemblance du génotype34. - Effectuez l’annotation des variants avec Ensembl Variant Effect Predictor (v96)35 en suivant les étapes 5.3.4 à 5.3.5.
- Utilisez VarDict pour déterminer les variantes somatiques dans l’AH ou la tumeur sans l’échantillon de sang normal apparié (c’est-à-dire en aveugle à la variante germinale)36.
- On parle de perte d’hétérozygotie si les variants continus d’une région ont ≤3 % d’allèles alternatifs.
REMARQUE : Un logiciel commercial d’analyse génomique peut également être utilisé avec les paramètres indiqués ci-dessus.
6. Détermination de l’ADNcf TFx
- Estimez le TFx pour chaque échantillon d’ADNcf AH séquencé à l’aide du logiciel ichorCNA (logiciel d’estimation TFx basé sur CNA)37.
REMARQUE : Il s’agit du logiciel standard utilisé dans les biopsies liquides à base de sang pour déterminer cfDNA TFx38. L’utilisation du logiciel sur AH a déjà été publiée21,23. - Examiner individuellement les profils génomiques et les solutions TFx correspondantes pour vérifier que l’estimation de TFx pour chaque échantillon est appropriée39.
Résultats
Les résultats complets obtenus pour deux yeux (cas 33 et 47) sont présentés ci-dessous. Les chiffres des cas restent cohérents avec les publications antérieures à des fins de comparaison 18,20,21. Les médecins traitants n’ont pas pris connaissance des résultats de la biopsie liquide AH pendant le traitement. Toutes les décisions de traitement ont été non randomisées et prises conformément à la norme de soins de routine qui a été publiée précédemment40,41. Les données sur les résultats cliniques sont restées séparées des données génomiques jusqu’à l’analyse finale. Les données brutes des résultats présentés sont disponibles sur demande auprès de l’auteur correspondant. En raison du financement des NIH, les données sont régies par la politique de partage des données génomiques des NIH et seront mises à la disposition d’autres chercheurs par l’intermédiaire d’un dépôt de données désigné par les NIH à accès contrôlé (dbGAP) à l’avenir. Il est également disponible sur demande auprès de l’auteur correspondant.
Les cas 33 et 47 sont tous deux des yeux du groupe D2 de l’IIRC qui présentaient des présentations cliniques très similaires. Ainsi, ils ont été traités avec une thérapie de sauvetage du globe à la décision des parents et des oncologues oculaires et médicaux, en particulier avec une chimiothérapie systémique pour le cas 47 et une chimiothérapie intra-artérielle pour le cas 33. Sur la base du pronostic clinique actuellement accepté qui repose sur le groupe IIRC de l’œil2, le succès prédit du sauvetage du globe pour les yeux de ces deux patients aurait été le même : 65 % à 70 % pour le groupe D est une moyenne, bien que cela varie selon le centre de traitement41. Cependant, sur la base des données du groupe D recueillies jusqu’à présent à partir du profilage moléculaire dirigé contre la tumeur dans ce centre, le succès prédit du sauvetage du globe serait de 72 % pour le cas 47 (sans gain de 6p identifié dans l’AH) et de 9 % pour le cas 33 (avec gain de 6p identifié)18,20,21. Ceci est démontré ci-dessous.
Le cas 47 est un exemple d’œil avec une détection réussie de l’ECNS et de la SNV à l’aide de la plateforme de biopsie liquide AH au moment du diagnostic, ainsi que des tendances TFx correspondant à la réponse au traitement longitudinalement. La patiente est une femme qui s’est présentée à l’âge de 15 mois avec un IIRC de groupe D de 14 mm x 9 mm, stade cT2b RB avec ensemencement vitré en sphère. Elle était négative pour la mutation germinale RB1 , telle que déterminée par le test clinique de routine des leucocytes sériques. À partir de l’AH, un gain de 1q et un gain de 6p ont été identifiés dans l’AH au moment du diagnostic, en plus de deux autres SCNA RB non récurrents, une perte de 7p et un gain de 13q (Figure 2). Il convient de noter que l’amplitude du gain de 6p était de 1,2, et que seules des amplitudes de ≥ rapport de 1,5 à la médiane ont été démontrées comme présageant un mauvais pronostic. Étant donné qu’il n’y avait pas d’amplification focale de MYCN et que le gain de 6p était inférieur au seuil de 1,5, le pronostic de sauvetage avec traitement basé sur les caractéristiques moléculaires était élevé. Le même échantillon AH prélevé au moment du diagnostic a également été évalué pour la détection de variants pathogènes RB1 , qui ont révélé le SNV c.958C>T, p.Arg320* dans le gène RB1 avec une fréquence d’allèles variants de 87,01 % (intervalle de confiance à 95 %, 79,7 % à 94,6 %). Ce patient a été traité avec six cycles de carboplatine, d’étoposide et de vincristine (CEV) avec régression de la maladie, mais a démontré un ensemencement persistant semblable à une sphère et à de la poussière qui a nécessité trois injections intravitréennes séquentielles de melphalan (IVM). Au cours du traitement par MIV, les échantillons AH A-C (chacun séparé de deux semaines) ont montré une normalisation complète du profil génomique, une diminution de TFx et une diminution de la concentration d’ADN, le tout en même temps qu’une régression clinique de la maladie (Figure 3). Après le diagnostic, les valeurs TFx sont restées inférieures à la limite de détection de 5 % pour le reste du traitement. À 19 mois de suivi, l’œil est resté stable, sans récidive tumorale ni propagation extraoculaire de la maladie.
Cela contraste avec le cas 33. Ce mâle de 22 mois présentait un tableau clinique globalement similaire avec une masse rétinienne de 11 mm x 18 mm et un ensemencement vitré de type poussière, compatible avec l’IIRC unilatéral du groupe D, stade cT2b. Il était également négatif pour la mutation germinale RB1, telle que déterminée par des tests cliniques de routine sur les leucocytes sériques. L’AH prise au moment du diagnostic a démontré un gain de 1q pour les SCNA RB, un gain de 6p (dans ce cas avec un rapport d’amplitude de 1,5 par rapport à la médiane) et une perte de 16q ainsi qu’une perte focale de 6q (Figure 4A). D’après le profil moléculaire pronostique, cet œil présentait une augmentation de 16,5 des chances d’énucléation en raison de la présence de 6p ≥ d’une amplitude de 1,5. Aucun SNV RB1 n’a été identifié dans cet échantillon, malgré une couverture complète de toute la longueur du gène RB1. L’une des raisons pour lesquelles un SNV RB1 peut ne pas être identifié est dans les tumeurs primaires induites par MYCN, où une mutation RB1 concomitante n’est pas toujours attendue 14,15,42,43,44,45. Cependant, le cas 33 n’a montré aucun signe d’amplification de MYCN dans aucun de ses échantillons d’AH ou dans son tissu tumoral énucléé (Figure 5). Une explication plus probable d’un résultat négatif de RB1 SNV est que la tumorigenèse initiale était due à une dérégulation épigénétique (par exemple, la méthylation du promoteur)46,47, un phénomène connu dans RB qui ne serait pas identifié par le test décrit ici.
Le traitement initial de ce patient consistait en quatre cycles totaux de chimiothérapie intraartérielle avec melphalan suivis de quatre injections IVM en raison d’un ensemencement vitré persistant. Trois échantillons d’AH (séparés de quatre semaines chacun) ont été obtenus au cours du traitement par MIV et ont révélé les mêmes trois NACS que ceux présents au moment du diagnostic (figure 5). Les valeurs TFx sont restées élevées tout au long du traitement, malgré la diminution du volume de la tumeur primaire reflétant les grains tumoraux actifs dans le vitré. Cela démontre comment TFx est représentatif de l’état général de la maladie dans l’œil. Six mois après le diagnostic, en raison d’une maladie active persistante, l’œil a été énucléé. Le profil génomique obtenu à partir du tissu tumoral à ce moment-là a démontré une concordance de 92,81 % avec l’échantillon AH obtenu au moment du diagnostic (Figure 4B).
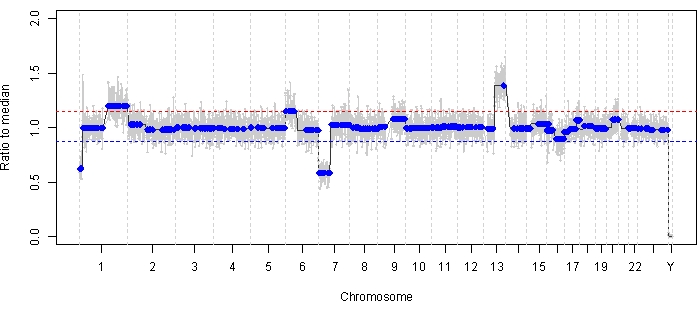
Figure 2 : Profil génomique au moment du diagnostic pour le cas 47. Des gains de 1q et de 6p d’ASCC RB très récurrents, ainsi que des pertes de 7p et un gain de 13q d’EASCNA RB très récurrents ont été identifiés dans l’AH prise au moment du diagnostic. La ligne rouge représente le seuil d’un gain, tandis que la ligne bleue représente le seuil d’une perte. Notamment, l’amplitude du gain 6p était de <1,5 rapport à la médiane, ce qui est inférieur au seuil de la signature moléculaire qui laisse présager un mauvais pronostic. Ainsi, sur la base de l’absence de biomarqueurs négatifs pour le sauvetage de l’œil, on prédirait que cet œil répondrait au traitement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
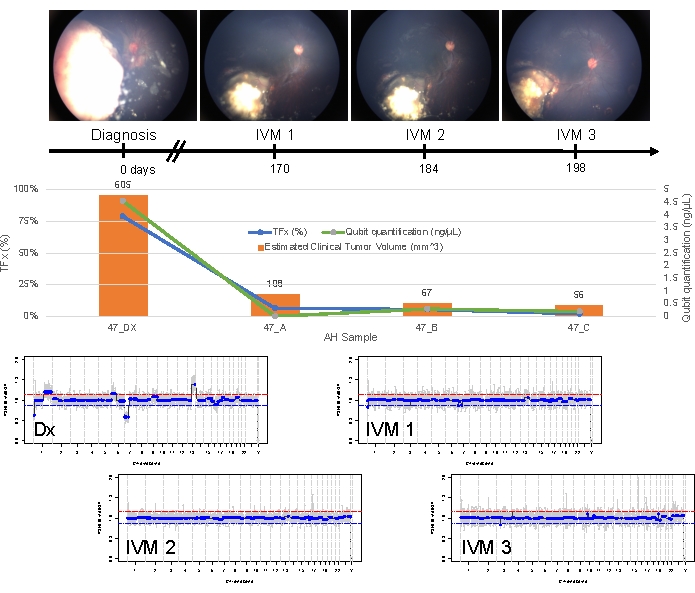
Figure 3 : Informations longitudinales pour le cas 47. Cela comprend des photos du fond d’œil, la quantification de l’ADNcf, l’estimation du volume tumoral clinique à partir des mesures B-scan, les profils génomiques et les estimations de TFx pour chaque point clinique auquel AH a été échantillonné (Dx = diagnostic, A = IVM1, B = IVM2, C = IVM3). Cet œil a répondu au traitement et est resté sauvé à 19 mois de suivi. Une diminution de la quantité d’ADNcf a été observée au fil du temps, ce qui correspond aux études publiées précédemment montrant le rendement le plus élevé obtenu au moment du diagnostic. TFx a également diminué au cours du traitement, reflétant la résolution de l’ensemencement et la diminution du volume de la tumeur rétinienne principale (les volumes tumoraux sont indiqués au-dessus de la barre orange de chaque point clinique dans le temps). Comme prévu avec la régression clinique de la maladie, les profils génomiques se sont également normalisés. Dans les profils génomiques, la ligne rouge représente le seuil d’un gain, tandis que la ligne bleue représente le seuil d’une perte. Cette figure a été reproduite avec la permission de Xu, L. et al.21. Veuillez cliquer ici pour voir une version agrandie de cette figure.
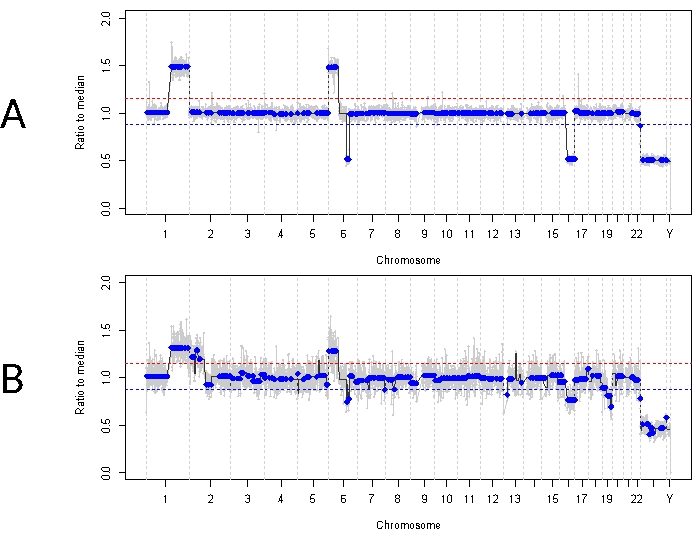
Figure 4 : Profils génomiques du cas 33. La ligne rouge représente le seuil d’un gain, tandis que la ligne bleue représente le seuil d’une perte (A) Profil génomique au diagnostic pour le cas 33. Des SCNA RB très récurrents Un gain de 1q, un gain de 6p et une perte de 16q ont été identifiés dans l’AH au moment du diagnostic, en plus de la perte focale de 6q. Notamment, l’amplitude du gain 6p était de 1,5 rapport à la médiane, indiquant un biomarqueur moléculaire de mauvais pronostic. Ainsi, sur la base de cette signature moléculaire, nous prédirions que cet œil avait une probabilité significativement accrue d’échec du traitement. (B) Profil génomique obtenu à partir de tissu tumoral énucléé, qui était très concordant avec le profil obtenu à partir de l’AH au moment du diagnostic. En raison du mélange avec du tissu rétinien normal, les SCNA du tissu tumoral peuvent présenter une amplitude plus faible par rapport à AH en raison de TFx dilué. Veuillez cliquer ici pour voir une version plus grande de cette figure.
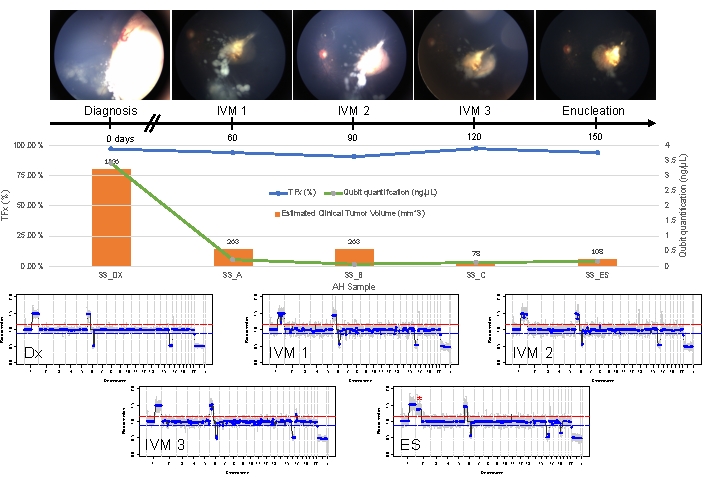
Figure 5 : Information longitudinale pour le cas 33. Cela comprend des photos du fond d’œil, la quantification de l’ADN acellulaire, l’estimation du volume tumoral clinique à partir des mesures B-scan (les volumes tumoraux sont indiqués au-dessus de la barre orange de chaque point temporel clinique), les profils génomiques et les estimations TFx pour chaque point temporel clinique auquel AH a été échantillonné (Dx = diagnostic, A = IVM1, B = IVM2, C = IVM3, SE = énucléation secondaire). Cet œil n’a pas répondu au traitement, nécessitant finalement une énucléation secondaire (ES). Cela était dû à un ensemencement actif persistant accompagné d’une récidive tumorale apicale. La quantité d’ADNcf a diminué au fil du temps, ce qui est cohérent avec les études précédemment publiées montrant le rendement le plus élevé obtenu au moment du diagnostic (gain 1q, gain 6p, perte 16q et perte focale 6q). Cependant, TFx est resté élevé tout au long du traitement, un produit de l’ensemencement persistant qui libère toujours de l’ADNcf dérivé de la tumeur dans l’AH. Les profils génomiques étaient cohérents et montraient les mêmes trois SCNA que ceux présents au moment du diagnostic. Dans l’AH obtenue à ES, un nouveau gain 2p (*) à grande échelle et une perte 19q ont été observés, suggérant une évolution clonale au moment de la récidive tumorale apicale. Dans les profils génomiques, la ligne rouge représente le seuil d’un gain, tandis que la ligne bleue représente le seuil d’une perte. Cette figure a été reproduite avec la permission de Xu, L. et al.21. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dossier supplémentaire 1 : Un exemple de (A) un échantillon qui devrait passer le contrôle de qualité, avec un pic d’environ 300 pb et (B) un échantillon qui ne devrait pas passer le contrôle de qualité, avec un pic d’environ 150 pb. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La paracentèse cornéenne claire est une procédure couramment pratiquée pour de multiples indications diagnostiques et/ou thérapeutiques en ophtalmologie. Plus précisément pour le RB, il fait partie du protocole d’injection standard de chimiothérapie intravitréenne pour diminuer la pression intraoculaire avant l’injection afin d’éviter le reflux vers le site d’injection48. Bien qu’il s’agisse d’une procédure courante, elle n’est pas totalement sans risque ; Le dogme précédent était qu’une aiguille ne devait jamais pénétrer dans un œil avec une RB active. Ce dogme a évolué au cours de la dernière décennie, d’abord grâce aux travaux formateurs de Patricia Chévez-Barrios sur la thérapie par vecteurs adénoviraux injectés49, puis aux méthodes progressives d’amélioration de la sécurité pour les injections oculaires dans le RB de Francis Munier48. Ces travaux ont ouvert la voie à l’extraction de l’AH pour être utilisé comme biopsie liquide, ou substitut à la biopsie tumorale, pour ce cancer. Nous sommes maintenant le premier centre à signaler l’utilité de la plate-forme et les résultats préliminaires de sécurité de l’AH pris au moment du diagnostic. Une partie des méthodes décrites dans le présent document vise à assurer la sécurité de la sélection des patients et les aspects procéduraux de l’extraction de l’AH pour le RB. Tout d’abord, les aiguilles ne peuvent pénétrer que dans la chambre antérieure et ne doivent pas entrer en contact avec l’iris ou le cristallin, car cela peut provoquer des cicatrices de l’iris ou une cataracte qui limite la capacité du chirurgien à surveiller la tumeur. Il est très important que l’aiguille ne pénètre jamais dans la cavité vitrée (à moins qu’elle ne soit associée à une chimiothérapie comme c’est le cas pour l’IVM), ou n’entre jamais en contact avec la tumeur, car cela augmente hypothétiquement le risque d’ensemencement tumoral et d’extension extraoculaire de la maladie 3,4,5. Ces deux structures sont postérieures à la chambre antérieure et séparées de celle-ci par le cristallin et l’iris. Pour éviter d’endommager les structures oculaires, il est important de maintenir le biseau de l’aiguille vers le haut à tout moment, au-dessus de l’iris périphérique, et toujours sous visualisation directe à l’aide du microscope chirurgical. Il existe un risque de fuite mineure de l’AH au site de l’aiguille ; Si cela se produit, il se résoudra avec une légère pression à l’aide d’un applicateur à embout cotonnier. L’utilisation de la plus petite aiguille disponible et l’assurance que l’aiguille est lentement extraite du même tractus sans cisaillement latéral réduiront ce risque. Bien qu’une légère superficialité de la chambre antérieure soit attendue, la chambre doit rester formée sans toucher l’iris cornéen et la pression intraoculaire doit être douce, mais physiologique.
En ce qui concerne les analyses génomiques, plusieurs étapes critiques sont impliquées. Le plus important est la manipulation de l’échantillon de petit volume une fois extrait de l’œil ; il est crucial que l’échantillon reste congelé tout le temps avant le traitement afin d’éviter la dégradation de l’ADN qui peut se produire lors de cycles répétés de congélation et de décongélation50. S’assurer que les échantillons sont placés sur de la glace carbonique immédiatement après l’extraction et transférés dans un congélateur à -80 °C permet de garantir cela. Une fois que le traitement des échantillons a commencé, les étapes de contrôle de la qualité sont la principale occasion de résoudre les problèmes en garantissant que l’ADNcf est construit dans des banques de haute qualité. À l’aide de la quantification de l’ADN et du profilage de la taille des fragments d’ADN, le contrôle de la qualité peut être effectué sur les échantillons prélevés lors de l’énucléation primaire ou au moment du diagnostic en raison du rendement plus élevé d’ADNcf présent dans ces échantillons18,21. Lorsque le pic obtenu se situe autour de 300 pb, cela garantit que l’ADNcf sera reconnu par la plateforme NGS. Si le pic obtenu est inférieur à 150 pb, ce qui indique que la majorité des fragments détectés sont des amorces de construction de banque ou des oligos adaptateurs, l’échantillon a été compromis et ne doit pas être traité davantage pour les SCNA. Cependant, d’après notre expérience du traitement de centaines d’échantillons, moins de 5 % doivent être retirés pour le contrôle de la qualité en raison d’un mauvais taux d’alignement des lecturesde 20. Avec les méthodes que nous avons normalisées pour la collecte, la manipulation, le stockage et le traitement des échantillons, cette procédure démontre la validité pré-analytique de la plateforme de biopsie liquide AH.
La biopsie liquide AH a également établi une validité analytique basée sur sa capacité à détecter avec précision et fiabilité les mutations pathogènes RB1 et les SCNA, avec des concordances moyennes constantes >95 % entre les profils génomiques générés à partir d’échantillons AH et le tissu tumoral correspondant 18,20,21,22,23. Malgré la validité analytique démontrée de la plateforme, elle n’est pas sans limites. L’analyse mutationnelle RB1 ne peut être effectuée que sur des échantillons contenant >10 ng d’ADNcf, qui sont le plus souvent obtenus dans des yeux naïfs de traitement au moment du diagnostic ou de l’énucléation primaire18,21. Cela est dû à la plus faible concentration d’ADNcf présente dans les échantillons d’AH provenant d’yeux qui subissent activement un traitement par rapport à l’AH au moment du diagnostic ou au moment de l’énucléation primaire. Une contrainte supplémentaire est que les SCNA ne peuvent pas être détectés à des TFxs inférieurs à 5 %, ce qui empêche la surveillance de la maladie dans les yeux où la charge tumorale a considérablement diminué ; D’après notre expérience, cela se produit le plus souvent dans les yeux sensibles au traitement de chimiothérapieintravitréenne 23.
Afin de déterminer le TFx de cfDNA dans l’AH, un logiciel d’estimation TFx basé sur CNA est utilisé. Ce logiciel est un outil standard et accepté pour le calcul de TFx dans les biopsies liquides, et son algorithme a été décrit en détail38,51. En bref, le logiciel d’estimation TFx basé sur CNA prédit des SCNA à grande échelle dans l’ADNcf séquencé à l’aide d’un modèle de Markov caché. Les estimations de TFx sont dérivées sur la base de la présence de SCNA tout en tenant compte des différences de subclonalité et de ploïdie à chaque locus, et à partir de ceux-ci, le logiciel d’estimation TFx basé sur CNA choisit une solution TFx optimale38. Cependant, une limitation inhérente aux logiciels d’estimation de TFx basés sur CNA est que TFx est calculé en fonction de la présence d’ANCC dans un échantillon ; par conséquent, il est impossible de déterminer le TFx dans des échantillons sans SCNA (c.-à-d. avec des profils génomiques plats)38. Comme cela a été démontré précédemment, toutes les tumeurs RB n’ont pas de SCNA 14,15,18,21,23,45. Par conséquent, un TFx très faible tel que déterminé par le logiciel d’estimation TFx basé sur CNA signifie que soit 1) l’échantillon AH ne contient pas d’ADNcf mesurable dérivé de la tumeur, soit 2) l’ADNcf tumoral est présent, mais il est indétectable par le logiciel d’estimation TFx basé sur CNA en raison d’un manque de SCNAs38. La fraction allélique variante, (VAF) pour SNV est un substitut de TFx. Pour cette raison, nous travaillons au développement d’un pipeline TFx basé sur RB1 basé sur VAF afin de permettre aux yeux RB sans SCNA de recevoir également une surveillance longitudinale TFx. Étant donné que toutes les tumeurs RB, à l’exception des tumeurs primaires induites par MYCN 14, 15, 42, 43, 44, 45, contiennent des mutations somatiques dans le gène RB1, un pipeline ne dépendant pas des SCNA élargirait l’application du protocole de biopsie liquide présenté ici. De plus, comme les SNV peuvent être surveillés à des TFxs inférieurs à 5 %, cela augmenterait la sensibilité de notre plateforme.
La plateforme de biopsie liquide AH décrite ici n’est pas la seule plateforme de biopsie liquide qui existe dans la littérature pour RB, mais elle est notamment la première à décrire l’aqueux comme une source enrichie d’ADN tumoral et la première à décrire la détection de l’ADNtc via deux mécanismes (SCNAs et RB1 SNVs) dans tout biofluide sur la base des travaux publiés à ce jour. Avec la capacité de détecter l’ADNtc de deux manières, la biopsie liquide AH a une sensibilité plus élevée que les autres plateformes de la littérature. Par exemple, un autre groupe a réussi à détecter l’ADNtc RB dans l’AH avec les SNV RB1 52. Cependant, cette plateforme s’appuyait sur des lectures NGS ciblées basées sur une connaissance a priori de la SNV. En revanche, la plateforme détaillée dans ce manuscrit utilise le WGS non biaisé, ce qui lui donne la capacité de détecter les SCNA et les SNV. Des biopsies liquides à base de sang ont également été essayées, bien que l’ADNcf obtenu ait toujours été inférieur au seuil de détection des SCNA, qui est le pronostic de la probabilité de sauvetage oculaire (à l’heure actuelle, les SNV RB1 n’ont pas montré de pronostic pour le sauvetage oculaire, cependant, il peut y avoir un rôle évolutif pour la détection de la maladie métastatique)19. Kothari et al. ont décrit les SNV RB1 dans le plasma des patients RB, mais uniquement ceux atteints d’une maladie intraoculaire avancée nécessitant une énucléation16. La plateforme de biopsie liquide AH décrite ici a la capacité de détecter l’ADNtc dans l’AH des yeux moins avancés, même sans la présence d’ensemencement19,21. De plus, les biopsies liquides à base de sang ne sont pas spécifiques à l’œil, car l’ADNtc isolé du sérum peut provenir des deux yeux en cas de RB bilatéral. Cela limite l’utilité clinique des plateformes à base de sang, en particulier chez les patients bilatéraux qui représentent 40 % des cas de RB, tandis que l’AH reste spécifique à l’œil et peut démontrer une hétérogénéité interoculaire aux niveaux SNV et SCNA53.
L’importance de la biopsie liquide AH pour le domaine de la RB est primordiale. Non seulement la biopsie liquide AH offre la possibilité de mieux comprendre la dynamique intratumorale dans les yeux qui suivent activement un traitement, mais elle a également le potentiel d’améliorer les soins aux patients. Sur la base d’études antérieures, nous avons établi une signature moléculaire – basée sur la présence d’une amplification MYCN ou d’un gain chromosomique 6p avec une amplitude de ≥1,5 rapport à la médiane – qui est pronostique pour une probabilité 16,5 fois accrue d’échec du traitement nécessitant une énucléation 18,20,21. Avec ces connaissances au moment du diagnostic, les cliniciens seraient mieux en mesure de conseiller les familles sur les options de traitement appropriées et la probabilité de sauvetage oculaire avec les traitements actuels. Bien que la validité clinique de la plateforme de biopsie liquide AH pour la RB ait été établie 17,18,19,20,21,22,23, elle n’est actuellement approuvée que pour la recherche ; Des études prospectives multicentriques de plus grande envergure sont nécessaires avant que la biopsie liquide AH puisse être mise en œuvre cliniquement pour aider à orienter les soins aux patients pour RB. Quoi qu’il en soit, la biopsie liquide AH a le potentiel de permettre une oncologie de précision à l’avenir, non seulement pour RB, mais aussi pour d’autres tumeurs oculaires.
Déclarations de divulgation
Jesse Berry, Liya Xu et James Hicks ont déposé une demande de brevet intitulée Aqueous Humor Cell-Free DNA for Diagnostic and Prognostic Evaluation of Ophthalmic Disease. Sinon, les auteurs ne signalent aucun conflit d’intérêts potentiel.
Remerciements
Cette recherche a été soutenue par les sources suivantes : NCI du NIH Award K08CA232344 (à J. L. Berry) ; Hyundai Hope on Wheels RGA012351 (à J. L. Berry) ; Childhood Eye Cancer Trust (à J.L. Berry) ; American Cancer Society, IRG-16-181-57 (à J. L. Berry) ; la Fondation Wright (à J.L. Berry et M.E. Kim) ; la Fondation de l’œil des Templiers (à J.L. Berry) ; la Fondation Larry et Celia Moh (à J. L. Berry) ; l’Institute for Families, Inc., Hôpital pour enfants de Los Angeles (J. L. Berry) ; une subvention ministérielle sans restriction de Research to Prevent Blindness (tous) ; Le NCI P30CA014089 (tous) ; Fonds de recherche Vicky Joseph (à P. Kuhn) ; Fonds de recherche Carol Vassiliadis (à P. Kuhn) ; et Collège des lettres, des arts et des sciences de l’USC Dornsife (à P. Kuhn).
matériels
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | surgical grade, whatever available in hospital | ||
| 32 G needle | surgical grade, whatever available in hospital | ||
| Aligner | Authors use Bowtie2 (http://bowtie-bio.sourceforge.net/bowtie2/index.shtml) but other aligners such as BWA or GRCh38 will also work | ||
| Atropos | generic term: adapter remover. https://atropos.readthedocs.io/en/latest/index.html# | ||
| Bioanalyzer High Sensitivity DNA Kit | Agilent | 5067-4626 | generic term: DNA fragment size profiling assay |
| BWA-MEM | generic term: long sequence aligner. http://bio-bwa.sourceforge.net/bwa.shtml | ||
| DNAcopy | Bioconductor | generic term: DNA copy number data analysis. https://bioconductor.org/packages/release/bioc/html/DNAcopy.html | |
| dsDNA High Sensitivity Assay | Qubit | Q32851 | generic term: DNA quantification assay |
| FreeBayes | generic term: sequence variant determiner. https://github.com/freebayes/freebayes | ||
| ichorCNA software | generic term: CNA-based TFx estimation. https://github.com/broadinstitute/ichorCNA | ||
| Illumina platform | Illumina | generic term: NGS platform; please note that other NGS platforms will work in principle, but have not been trialed by these authors | |
| NovoAlign (v3) | Novocraft | generic term: mapping of short reads onto reference genome. http://www.novocraft.com/products/novoalign/ | |
| QIAamp Circulating Nucleic Acid Kit | Qiagen | 55114 | generic term: cfDNA isolation and purification kit |
| QIAseq Ultralow Input Library Kit | Qiagen | 180492 | generic term: DNA library sequencing kit |
| Samtools rmdup | generic term: tool to remove duplicate reads. http://www.htslib.org/doc/samtools-rmdup.html | ||
| VarDict | generic term: variant caller. https://github.com/AstraZeneca-NGS/VarDict | ||
| Variant Effect Predictor | Ensembl | generic term: variant effect determinator. https://uswest.ensembl.org/info/docs/tools/vep/index.html |
Références
- Fernandes, A. G., Pollock, B. D., Rabito, F. A. Retinoblastoma in the United States: A 40-year incidence and survival analysis. Journal of Pediatric Ophthalmology & Strabismus. 55 (3), 182-188 (2018).
- Linn, A. M. Intraocular retinoblastoma: the case for a new group classification. Ophthalmology Clinics of North America. 18 (1), 41-53 (2005).
- Shields, J. A., Shields, C. L., Ehya, H., Eagle, R. C., De Potter, P. Fine-needle aspiration biopsy of suspected intraocular tumors. The 1992 Urwick lecture. Ophthalmology. 100 (11), 1677-1684 (1993).
- Karcioglu, Z. A., Gordon, R. A., Karcioglu, G. L. Tumor seeding in ocular fine needle aspiration biopsy. Ophthalmology. 92 (12), 1763-1767 (1985).
- Karcioglu, Z. A. Fine needle aspiration biopsy (FNAB) for retinoblastoma. Retina. 22 (6), 707-710 (2002).
- Eide, N., Syrdalen, P., Walaas, L., Hagmar, B. Fine needle aspiration biopsy in selecting treatment for inconclusive intraocular disease. Acta Ophthalmologica Scandinavica. 77 (4), 448-452 (1999).
- Eide, N., Walaas, L. Fine-needle aspiration biopsy and other biopsies in suspected intraocular malignant disease: a review. Acta Ophthalmologica. 87 (6), 588-601 (2009).
- Eriksson, O., Hagmar, B., Ryd, W. Effects of fine-needle aspiration and other biopsy procedures on tumor dissemination in mice. Cancer. 54 (1), 73-78 (1984).
- Ali, M. J., Honavar, S. G., Vemuganti, G. K., Singh, A. D. Fine needle aspiration biopsy of retinal tumors. Monographs in Clinical Cytology. 21, 72-81 (2012).
- Di Nicolantonio, F. a. l., et al. The chemosensitivity profile of retinoblastoma. Recent Results in Cancer Research. 161, 73-80 (2003).
- Francis, J. H., et al. Efficacy and toxicity of second-course ophthalmic artery chemosurgery for retinoblastoma. Ophthalmology. 122 (5), 1016-1022 (2015).
- Francis, J. H. Efficacy and toxicity of intravitreous chemotherapy for retinoblastoma: Four-year experience. Ophthalmology. 124 (4), 488-495 (2017).
- Francis, J. H., et al. Current treatment of bilateral retinoblastoma: The impact of intraarterial and intravitreous chemotherapy. Neoplasia. 20 (8), 757-763 (2018).
- Rushlow, D. E., et al. Characterisation of retinoblastomas without RB1 mutations: genomic, gene expression, and clinical studies. The Lancet Oncology. 14 (4), 327-334 (2013).
- Afshar, A. R., et al. Next-generation sequencing of retinoblastoma identifies pathogenic alterations beyond RB1 inactivation that correlate with aggressive histopathologic features. Ophthalmology. 127 (6), 804-813 (2020).
- Kothari, P. Cell-free DNA profiling in retinoblastoma patients with advanced intraocular disease: An MSKCC experience. Cancer Medicine. 9 (17), 6093-6101 (2020).
- Berry, J. L., et al. Potential of aqueous humor as a surrogate tumor biopsy for retinoblastoma. JAMA Ophthalmology. 135 (11), 1221-1230 (2017).
- Berry, J. L., et al. Genomic cfDNA analysis of aqueous humor in retinoblastoma predicts eye salvage: the surrogate tumor biopsy for retinoblastoma. Molecular Cancer Research. 16 (11), 1701-1712 (2018).
- Berry, J. L., et al. Aqueous humor is superior to blood as a liquid biopsy for retinoblastoma. Ophthalmology. 127 (4), 552-554 (2020).
- Xu, L., et al. Chromosome 6p amplification in aqueous humor cell-free DNA Is a prognostic biomarker for retinoblastoma ocular survival. Molecular Cancer Research. 18 (8), 1166-1175 (2020).
- Xu, L., et al. Establishing the clinical utility of ctDNA analysis for diagnosis, prognosis, and treatment monitoring of retinoblastoma: The aqueous humor liquid biopsy. Cancers. 13 (6), (2021).
- Xu, L. Simultaneous identification of clinically relevant RB1 mutations and copy number alterations in aqueous humor of retinoblastoma eyes. Ophthalmic Genetics. 41 (6), 526-532 (2020).
- Polski, A., et al. Longitudinal aqueous humor sampling reflects treatment response in retinoblastoma patients. Investigative Ophthalmology & Visual Science. 61 (7), 1394 (2020).
- . Genome Browser Available from: https://genome.ucsc.edu/cgi-bin/hgTracks?db=hg19&lastVirtModeType=default&lastVirtModeExtraState=&virtModeType=default&3A15578261%_2D15621068&hgsid=1135765621_qIuA0U (2021)
- Navarro Gonzalez, J., et al. The UCSC genome browser database: 2021 update. Nucleic Acids Research. 49 (1), 1046-1057 (2021).
- Li, H. A statistical framework for SNP calling, mutation discovery, association mapping and population genetical parameter estimation from sequencing data. Bioinformatics. 27 (21), 2987-2993 (2011).
- Baslan, T., et al. Genome-wide copy number analysis of single cells. Nature Protocols. 7 (6), 1024-1041 (2012).
- Huber, W., et al. Orchestrating high-throughput genomic analysis with Bioconductor. Nature Methods. 12 (2), 115-121 (2015).
- Baslan, T., et al. Erratum: Genome-wide copy number analysis of single cells. Nature Protocols. 11 (3), 1024-1041 (2016).
- Didion, J. P., Martin, M., Collins, F. S. Atropos: specific, sensitive, and speedy trimming of sequencing reads. PeerJ. 5, 3720 (2017).
- Li, H. Aligning sequence reads, clone sequences and assembly contigs with BWA-MEM. arXiv. , (2013).
- Garrison, E., Marth, G. Haplotype-based variant detection from short-read sequencing. arXiv. , (2012).
- McLaren, W., et al. The ensembl variant effect predictor. Genome Biology. 17 (1), 122 (2016).
- Lai, Z., et al. VarDict: a novel and versatile variant caller for next-generation sequencing in cancer research. Nucleic Acids Research. 44 (11), 108 (2016).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA (2017)
- Adalsteinsson, V. A., et al. Scalable whole-exome sequencing of cell-free DNA reveals high concordance with metastatic tumors. Nature Communications. 8 (1), 1-13 (2017).
- . GitHub Available from: https://github.com/broadinstitute/ichorCNA/wiki/Interpreting-ichorCNA-results (2017)
- Berry, J. L., et al. Long-term outcomes of Group D retinoblastoma eyes during the intravitreal melphalan era. Pediatric Blood & Cancer. 64 (12), (2017).
- Berry, J. L., et al. Long-term outcomes of Group D eyes in bilateral retinoblastoma patients treated with chemoreduction and low-dose IMRT salvage. Pediatric Blood & Cancer. 60 (4), 688-693 (2013).
- Francis, J. H., et al. Molecular changes in retinoblastoma beyond RB1: Findings from next-generation sequencing. Cancers (Basel). 13 (1), (2021).
- Schwermer, M., et al. Comprehensive characterization of RB1 mutant and MYCN amplified retinoblastoma cell lines. Experimental Cell Research. 375 (2), 92-99 (2019).
- Davies, H. R. Whole-genome sequencing of retinoblastoma reveals the diversity of rearrangements disrupting RB1 and uncovers a treatment-related mutational signature. Cancers. 13 (4), 754 (2021).
- Lillington, D. M., et al. Comparative genomic hybridization of 49 primary retinoblastoma tumors identifies chromosomal regions associated with histopathology, progression, and patient outcome. Genes, Chromosomes and Cancer. 36 (2), 121-128 (2003).
- Greger, V., et al. Frequency and parental origin of hypermethylated RB1 alleles in retinoblastoma. Human Genetics. 94 (5), 491-496 (1994).
- Raizis, A. M., et al. DNA hypermethylation/boundary control loss identified in retinoblastomas associated with genetic and epigenetic inactivation of the RB1 gene promoter. Epigenetics. 1-15, (2020).
- Munier, F. L., et al. Profiling safety of intravitreal injections for retinoblastoma using an anti-reflux procedure and sterilisation of the needle track. British Journal of Ophthalmology. 96 (8), 1084-1087 (2012).
- Chévez-Barrios, P., et al. Response of retinoblastoma with vitreous tumor seeding to adenovirus-mediated delivery of thymidine kinase followed by ganciclovir. Journal of Clinical Oncology. 23 (31), 7927-7935 (2005).
- Shao, W., Khin, S., Kopp, W. C. Characterization of effect of repeated freeze and thaw cycles on stability of genomic DNA using pulsed field gel electrophoresis. Biopreservation and Biobanking. 10 (1), 4-11 (2012).
- Choudhury, A. D., et al. Tumor fraction in cell-free DNA as a biomarker in prostate cancer. JCI Insight. 3 (21), (2018).
- Gerrish, A., et al. Non-invasive diagnosis of retinoblastoma using cell-free DNA from aqueous humour. British Journal of Ophthalmology. 103 (5), 721-724 (2019).
- Wong, E. Y., Xu, L., Shen, L. Inter-eye genomic heterogeneity in bilateral retinoblastoma via aqueous humor liquid biopsy. NPJ Precis Oncol. 5 (1), 73 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon