A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحريض وتقييم خلل الحركة الناجم عن ليفودوبا في نموذج الفئران لمرض باركنسون
In This Article
Summary
توضح هذه المقالة طرق تحفيز وتقييم خلل الحركة الناجم عن ليفودوبا في نموذج الفئران لمرض باركنسون. يقدم البروتوكول معلومات مفصلة بشأن شدة وتواتر مجموعة من السلوكيات خلل الحركة ، سواء خلل التوتر أو فرط الحركة ، مما يوفر أداة موثوقة لاختبار العلاجات التي تستهدف هذه الحاجة الطبية غير الملباة.
Abstract
لا يزال ليفودوبا (L-DOPA) هو العلاج القياسي الذهبي المستخدم لعلاج الأعراض الحركية لمرض باركنسون (PD). ومع ذلك ، فإن الحركات اللاإرادية غير المرغوب فيها المعروفة باسم خلل الحركة الناجم عن L-DOPA (LIDs) تتطور مع الاستخدام المطول لهذا السلائف الدوبامين. تشير التقديرات إلى أن حدوث LIDs يتصاعد إلى ما يقرب من 90٪ من الأفراد المصابين بمرض باركنسون في غضون 10-15 سنة من العلاج. يتطلب فهم آليات هذا المرض وتطوير علاجات جديدة وفعالة مضادة لخلل الحركة نمذجة متسقة ودقيقة للاختبار قبل السريري للتدخلات العلاجية. يتم عرض طريقة مفصلة للحث الموثوق به والتصنيف الشامل ل LIDs بعد الآفة النيجيرية التي يسببها 6-OHDA في نموذج الفئران من PD هنا. يوفر تقييم LID الذي يمكن الاعتماد عليه في الفئران أداة قوية يمكن استخدامها بسهولة عبر المختبرات لاختبار العلاجات الناشئة التي تركز على تقليل أو القضاء على هذا العبء المشترك الناجم عن العلاج للأفراد المصابين بمرض باركنسون.
Introduction
على الرغم من مرور أكثر من 50 عاما منذ أن تم تقديم ليفودوبا (L-DOPA) لأول مرة كعلاج للأفراد الذين يعانون من PD 1,2 ، إلا أنه لا يزال بشكل ملحوظ العلاج الأكثر فعالية للأعراض الحركية الباركنسونية. تنبع الأعراض الحركية السريرية المرتبطة ب PD من فقدان الخلايا العصبية الدوبامين (DA) في المادة السوداء (SN) pars compacta ، مما يؤدي إلى انخفاض كبير في الدوبامين المتاح في المخطط. L-DOPA يعيد بشكل فعال مستويات DA المخططة ، مما يؤدي إلى فائدة حركية في وقت مبكر من المرض 3,4. في غير الوقت المناسب ، مع العلاج على المدى الطويل ، فإن معظم الأفراد الذين يعانون من مرض باركنسون سيصابون بخلل الحركة الناجم عن L-DOPA (LID) ، بما في ذلك الرقاص ، خلل التوتر العضلي ، و athetosis ، والتي غالبا ما تؤثر بشكل كبير على أنشطة الحياة اليومية 5,6,7.
في حين توجد العديد من النماذج السلوكية ل LID في القوارض ، فإن الاختلافات في النمذجة والتقييم السلوكي ل LIDs قد أثارت الشكوك حول إمكانية تكرار النتائج بين المختبرات وكذلك موثوقية هذه الأدوات التجريبية لأبحاث PD قبل السريرية. تم تطوير البروتوكول الحالي بالتعاون مع أخصائي اضطراب الحركة السريرية8 ، وهو طريقة مباشرة لتحريض LID وتصنيفه وهو مناسب للاستخدام في نموذج الفئران من PD باستخدام 6-hydroxydopamine (6-OHDA) الناجم عن آفة nigral أحادية الجانب 9,10. يتضمن مقياس تصنيف LID المقدم هنا تسجيل درجات لكل من شدة وتواتر السلوك خلل الحركة في مختلف أجزاء الجسم الفردية. كما يتم توفير المعلومات ذات الصلة فيما يتعلق بتحسين سير العمل للتجارب والرعاية والتعامل المناسبين مع الحيوانات المصابة بالشلل الرعاش وعسر الحركة.
Protocol
تم الحفاظ على الحيوانات المعروضة هنا والتعامل معها وفقا للمبادئ التوجيهية المؤسسية. تمت الموافقة على جميع الإجراءات الحيوانية من قبل لجنة رعاية واستخدام الحيوانات المؤسسية بجامعة ولاية ميشيغان (IACUC) وفقا للوائح الفيدرالية ولوائح الولاية.
1. تأكيد خال من المخدرات لحالة آفة 6-OHDA
- اختبار تعليق الذيل الوضعي11,12,13
ملاحظة: تقييم حالة الآفة على الأقل 1 أسبوع بعد تحريض آفة 6-OHDA (انظر9،10،35 للحصول على تفاصيل حول الآفة) في الموضوعات التجريبية (على سبيل المثال ، ذكر أو أنثى ، البالغين Sprague Dawley أو فيشر 344 الفئران).- الفئران على ارتفاع حوالي 6 سم فوق قفصها ، مع الاحتفاظ بها بقوة في قاعدة الذيل ، لمدة 5 ثوان تقريبا.
- سجل اتجاه التواء الجسم ك + لحيوان آفة بنجاح التواء على النقيض من الجانب الآفة و - لعدم وجود التواء أو التواء في كلا الاتجاهين.
- ملاحظة: هذه الاختبارات اختيارية ولكن يوصى بها. انظر14،15،16،17 للحصول على خيارات / اختلافات إضافية للاختبار الخالي من المخدرات.
- اختبار سحب ضبط الخطوة (مقتبس من16)
ملاحظة: تقييم حالة الآفة على الأقل 1 أسبوع بعد تحريض آفة 6-OHDA من جانب واحد في الموضوعات التجريبية (على سبيل المثال ، ذكر أو أنثى ، أو فئران Sprague Dawley البالغة أو Fisher 344).- امسك الفئران من قاعدة ذيله ، ورفع القدمين الخلفيتين عن السطح بمقدار 6 سم تقريبا ؛ اسحب للخلف عبر سطح مستو وأملس ولكن ليس زلقا ، ~ 75 سم ، أكثر من 5-10 ثوان.
- مراقبة وتسجيل عدد حركات ضبط التنصت / الخطوة لكل مقدمة على مدى ثلاثة اختبارات متكررة.
- سجل الموضوع على أنه + للآفة الأحادية الجانب الناجحة عندما يتم ملاحظة 0-2 صنابير forepaw على الجانب المؤذي ، جنبا إلى جنب مع التنصت السريع (~ 10 صنابير) من forepaw ipsilateral إلى الجانب الآفة (على سبيل المثال ، الحيوانات التي آفت من جانب واحد على الجانب الأيسر تظهر عجز التنصت (0-2 صنابير) مع forepaw الأيمن المقابل).
- على العكس من ذلك ، سجل نقرا معتدلا إلى سريعا (5-10 نقرات) من كلا المخالب الأمامية على النحو التالي - للإشارة إلى حالة الآفة غير المكتملة أو غير المعروفة.
ملاحظة: يمكن للحيوان القلق أن يظهر التنصت السريع / تعديل الخطوة حتى لو كان قد أصيب بنجاح. إذا كان هناك اشتباه في ذلك ، فضع الفئران مرة أخرى في قفص المنزل وأعد اختبارها بعد ≥30 دقيقة.
2. إعداد الكواشف والمستلزمات
- حدد L-3,4-dihydroxyphenylalanine methyl ester hydrochloride (levodopa أو L-DOPA) و benserazide hydrochloride ، وهو مثبط ديكاربوكسيلاز المحيطي (انظر جدول المواد) الجرعة ، وتردد التصنيف ، والجدول الزمني التجريبي المناسب للسؤال البحثي12,18,19,20 (الشكل 1).
ملاحظة: يمكن طرح أسئلة استقصائية للبحث عن أي عدد من الأسئلة التي تتراوح بين السؤال عما إذا كان العلاج المحدد قد يقلل من LID الحالي أو يمنع تحريض LID. يمكنهم أيضا استكشاف ما إذا كانت الفعالية العلاجية تعتمد على جرعة ليفودوبا أو ما إذا كان تعبير LID و / أو الفعالية العلاجية يختلف اعتمادا على الجنس والأنواع وعمر الموضوع.
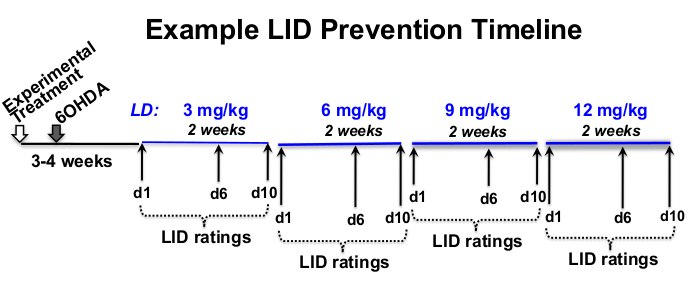
الشكل 1: مثال على الجدول الزمني للعلاج. مثال على الجدول الزمني لتصعيد جرعة L-DOPA من 12 أسبوعا في الطول الإجمالي ، مع 8 أسابيع من حقن L-DOPA تبدأ بعد 3 أسابيع من آفة 6-OHDA و 4 أسابيع بعد العلاج التجريبي. في هذا المثال ، يتم حقن L-DOPA تحت الجلد 5x في الأسبوع (من الاثنين إلى الجمعة) في نفس الوقت تقريبا كل يوم ، لمدة أسبوعين في كل جرعة L-DOPA الموصوفة (3 و 6 و 9 و 12 مجم / كجم). تتم تصنيفات LID السلوكية في الأيام 1 و 6 و 10 من كل مستوى جرعة L-DOPA. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- وزن الفئران أسبوعيا لحساب كمية الدواء المناسبة بناء على تغيرات الوزن المستمرة أثناء الدراسة.
ملاحظة: بسبب زيادة النشاط في الفئران LID+ ، هناك احتمال لفقدان الوزن مع علاجات L-DOPA طويلة الأجل. إذا حدث فقدان الوزن ، فقم بتزويد الفئران بعلاجات كاملة من الناحية التغذوية ومستساغة للغاية (انظر جدول المواد) بعد حقن L-DOPA. - احسب كمية L-DOPA و benserazide المطلوبة لكل تركيز أسبوعي ، ووزن الأليكوت المجفف بالتجميد لكل يوم من أيام الحقن ، وتخزينها في تركيبة لمدة 1-2 أسابيع عند -20 درجة مئوية في قوارير كهرمان زجاجية حتى يوم العلاج.
ملاحظة: الجرعة المستهدفة هي 12 مغ/كغ أو 12 مغ L-DOPA/1000 غرام من وزن الجسم. ويرد في الملف التكميلي 1 مثال على حسابات تحديد كمية L-DOPA والمحلول الملحي اللازم لكل يوم من أيام الأسبوع باستخدام 12 مغ L-DOPA/kg من وزن الجسم عند حجم حقن قدره 1 سم مكعب/كغ من وزن الفئران.
3. إعداد الغرفة والقفص
- في اليوم الأول من علاج L-DOPA بعد 3-4 أسابيع من جراحة آفة 6-OHDA ، قم بنقل الفئران إلى مسكن واحد ، بما في ذلك التخصيب المعتمد من IACUC.
- الحفاظ على السكن الفردي طوال الدراسة لتجنب تدخل الأقران في التقييمات السلوكية.
- في أيام تصنيف LID ، ضع الأقفاص المنزلية على رف من الأسلاك الفولاذية ، يتم تشغيله بزاوية 45 درجة تقريبا للحصول على عرض مثالي للفئران (الشكل 2A). اقلب علامات التعريف (الشكل 2B) لأعلى وقم بإزالة زجاجات المياه ورفوف الطعام وجميع أنواع التخصيب في القفص (الشكل 2C) لتجنب التدخل في التقييمات السلوكية.

الشكل 2: مثال على القفص الذي تم إعداده لتصنيفات LID لتجارب الفئران واسعة النطاق. (أ) يمكن إعداد أقفاص متعددة لتصنيف LID باستخدام رفوف معدنية كبيرة تسمح بمشاهدة مثالية لكل. يجب أن تنتشر الأقفاص بزاوية 45 درجة مع بطاقات الهوية المقلوبة لأعلى (B) ، وإزالة الطعام وزجاجات المياه ومواد التعشيش وغيرها من مواد الإثراء للحد من الغموض البصري للفئران والانحرافات إلى الفئران أثناء فحص السلوكيات خلل الحركة (C). يجب أن تكون الرفوف المعدنية على بعد أمتار قليلة من أي جدار للسماح للمقيم بفحص الفئران في الجزء الأمامي أو الخلفي من القفص حسب الحاجة. من الضروري تسمية أجهزة التخصيب (على سبيل المثال ، منازل تراجع الفئران الحمراء C) ببطاقات هوية حيوانية فردية لاستبدالها في نفس القفص الذي أتت منه. هذا مهم بشكل خاص عند استخدام الحيوانات من مختلف الجنسين لعدم زيادة التوتر على الموضوعات التجريبية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. حقن ليفودوبا وتصنيف خلل الحركة
- الحقن تحت الجلد من L-DOPA21,22
- قبل الحقن اليومي ل L-DOPA مباشرة ، أضف الحجم المناسب من محلول ملحي معقم إلى مزيج L-DOPA و benserazide المجفف بالتجميد مسبقا في قارورة العنبر ورجه جيدا لمدة 10 ثوان (الخطوة 2.3).
ملاحظة: حجم الحقن المستهدف هو 1 مل / 1000 غرام من وزن الجسم (مع 12 ملغ L-DOPA لكل مل). يعتمد حجم الملحة المعقمة على عدد الحيوانات في كل دراسة. - املأ المحاقن الفردية (على سبيل المثال ، 1.0 أو 0.5 مل بإبرة 26 جم) بالحجم المطلوب لكل (1 مل / كجم من وزن الفئران) وقم بتسمية كل حقنة بهوية حيوانية فردية.
ملاحظة: حافظ على حماية المحاقن المملوءة من الضوء في أكياس معقمة حتى وقت الحقن. L-DOPA يتأكسد بسرعة في وجود الأكسجين والضوء في بيئة مائية23،24،25،26. - أحضر القفص الأول إلى مقعد الحقن.
- قم بإزالة الفئران من قفصها ووضعها على سطح الحقن.
- كبح جماح الرأس والكتفين بلطف على السطح الذي يستريح عليه الفئران براحة اليد غير المهيمنة.
- بلطف ، قم بقص الجلد على الظهر فوق لوح الكتف بالإبهام والسبابة لليد غير المهيمنة ، وحقن حجم L-DOPA باليد المهيمنة في المساحة تحت الجلد بين / أسفل الأصابع ، مع الحفاظ على الإبرة موازية للجسم قدر الإمكان لتجنب الحقن العضلي.
ملاحظة: لا يتم تخدير الفئران قبل الحقن. - تخلص من كل حقنة فردية مستخدمة في حاوية حادة.
- استبدل الفئران في قفصها الفردي وأضف علاجا كاملا من الناحية التغذوية باستثناء أيام تصنيف LID لتجنب التدخل في التقييمات السلوكية حتى بعد اكتمال التقييمات.
- اضبط المؤقت لمدة 1-2 دقيقة اعتمادا على وقت التقييم المطلوب وعدد الفئران في الدراسة في أيام التقييم. استرجع القفص التالي وحقن الفئران التالية عندما يشير المؤقت.
- كرر هذا ، حقن فأر واحد كل 1-2 دقيقة ، حتى يتم حقن جميع الفئران.
- قبل الحقن اليومي ل L-DOPA مباشرة ، أضف الحجم المناسب من محلول ملحي معقم إلى مزيج L-DOPA و benserazide المجفف بالتجميد مسبقا في قارورة العنبر ورجه جيدا لمدة 10 ثوان (الخطوة 2.3).
- تصنيف خلل الحركة الناجم عن ليفودوبا بعد الحقن
- قم بتقييم شدة (الجدول 1) والتردد (الجدول 2) لحركات خلل الحركة المضطربة وفرط الحركة في العدد المطلوب من النقاط الزمنية ، والتي يجب أن تشمل البداية الأولية لسلوك LID ، وسلوك الذروة ، ومرحلة الانخفاض (انظر الملف التكميلي 2 للحصول على مثال على ورقة سجل تصنيف LID).
- بالنسبة للذكور والإناث البالغين Sprague Dawley أو Fisher 344 الفئران ، وحجم عينة N = 40 الفئران ، تبدأ تصنيفات خلل الحركة بعد 20 دقيقة من أول حقن L-DOPA ، ثم على فترات 50 دقيقة حتى 220 أو 270 دقيقة بعد الحقن ، اعتمادا على الوقت الذي توقفت فيه سلوكيات LID في 90٪ -100٪ من الفئران.
- إذا كنت تستخدم فواصل تقييم مدتها 1 دقيقة، فقم بتعيين مؤقت لمدة 1 دقيقة. قيم الفئران الأولى لمدة دقيقة واحدة. انتقل إلى الفئران التالية وقيمها لمدة 1 دقيقة. استمر من خلال جميع الفئران ، مع تصنيف لمدة 1 دقيقة على فترات زمنية.
- ضع جهاز توقيت بجوار القفص بشكل واضح بحيث يمكن ملاحظة شدة سلوك LID (الجدول 1) أثناء تقدير تكرار أي سلوك معين (الجدول 2) خلال فترة التصنيف.
- بعد الانتهاء من التقييمات لأول نقطة زمنية ، ابدأ مرة أخرى مع الفئران الأولى في النقطة الزمنية التالية (على سبيل المثال ؛ 70 دقيقة بعد الحقن) واستمر في الفاصل الزمني المطلوب (على سبيل المثال ، كل 50 دقيقة) حتى يتم الانتهاء من جميع النقاط الزمنية.
ملاحظة: نظرا لتداخل مهام حقن L-DOPA وتصنيف LID ، هناك حاجة إلى شخصين في أيام التصنيف ، أحدهما للحقن والآخر للتصنيفات السلوكية.
النتائج
يمكن أن تظهر LIDs في الفئران الباركنسون كمجموعة من الحركات اللاإرادية غير الطبيعية (AIMs) ، بما في ذلك السلوكيات المضطربة وفرط الحركة والنمطية. يتم عرض معايير تصنيف LID لمثل هذه السلوكيات هنا لتشمل كل من الشدة (الجدول 1) والتردد (الجدول 2). يوفر هذا درجة خطورة LID إجمالية لكل فأر ت?...
Discussion
تظهر هنا تفاصيل عن الحث القابل للتكرار وتصنيف LIDs في نموذج الفئران الباركنسونية بعد آفة 6-OHDA أحادية الجانب لنظام DA nigrostriatal. في حين كان يعتقد ذات مرة أن القوارض لم تطور LID وأن عدم التماثل الدوراني قد يكون تناظريا ل LID في الفئران31 ، فقد تم تمييز نماذج الفئران والفئران على مدى العقدي...
Disclosures
ولم يعلن عن أي تضارب في المصالح.
Acknowledgements
نريد أن نعترف بنضالات جميع المصابين بمرض باركنسون والقوة والمرونة التي يظهرونها كل يوم ، وخاصة الأب المحبوب ل KSC ، مارك ستيس. تم دعم العمل الممثل هنا من قبل المعهد الوطني للاضطرابات العصبية والسكتة الدماغية (NS090107 ، NS110398) وبرنامج المنح البحثية الدولية لمؤسسة مرض باركنسون ، وهو الآن مؤسسة باركنسون. ونود أيضا أن نعرب عن تقديرنا لمولي فاندرفيرب على مساعدتها التحريرية الممتازة.
Materials
| Name | Company | Catalog Number | Comments |
| 100 Minutes Digital Timer | Staples | 1111764 | |
| Compass CX Compact Scale | Ohaus | 30428202 | |
| 5-(2-aminoethyl)-1,2,4-benzenetriol, monohydrobromide | Cayman Chemicals | 25330 | 6-OHDA is a catecholaminergic neurotoxin that is used to induce dopaminergic lesions and parkinsonian symptoms in rodents. |
| Allentown cages | Allentown, LLC | Rat900 | Allentown cages provide the ability to view the rats from all sides. |
| BD Allergist Trays with Permanently Attached Needle | BD | BD 305540 | For subcutaneous L-DOPA injections |
| Benserazide hydrochloride | Sigma-Aldrich | B7283 | Benserazide is a peripheral decarboxylase inhibitor used with L-DOPA to to induce dyskinesia in rodent models of PD. |
| Glass amber scintillation vials | Thermo Scientific | B7921 | Used for storage of L-DOPA/benserazide at -20 °C until mixed with sterile saline. |
| L-3,4-Dihydroxyphenylalanine methyl ester hydrochloride | Sigma-Aldrich | D1507 | L-3,4-Dihydroxyphenylalanine methyl ester is a precursor to L-DOPA that crosses the blood-brain barrierand use to treat parkinsonian symptoms in rodents. |
| Paper Mate Sharpwriter Mechanical Pencils | Staples | 107250 | |
| Rodent nutritionally complete enrichment treats | Bio-Serv | F05478 | |
| Round Ice Bucket with Lid, 2.5 L | Corning | 432129 | |
| Standard Plastic Clipboard | Staples | 1227770 | |
| Steel wired 6' long movable shelving units | Uline | H9488 | Width/Height can be adjusted to need/number of rats per experiment |
| Sterile Saline 0.9% | Covidien/Argyle | 1020 | For mixing with L-DOPA/benserazide prior to subcutaneous injections. |
References
- Cotzias, G. C., Papavasiliou, P. S., Gellene, R. L-dopa in parkinson's syndrome. New England Journal of Medicine. 281, 272 (1969).
- Yahr, M. D., Duvoisin, R. C., Schear, M. J., Barrett, R. E., Hoehn, M. M. Treatment of parkinsonism with levodopa. Archives of Neurology. 21 (4), 343-354 (1969).
- Bastide, M. F., et al. Pathophysiology of L-dopa-induced motor and non-motor complications in Parkinson's disease. Progress in Neurobiology. 132, 96-168 (2015).
- Sellnow, R. C., et al. Regulation of dopamine neurotransmission from serotonergic neurons by ectopic expression of the dopamine D2 autoreceptor blocks levodopa-induced dyskinesia. Acta Neuropathologica Communications. 7 (1), 8 (2019).
- Bastide, M. F., Bezard, E. L-dopa induced dyskinesia in Parkinson's disease]. Bulletin de l'Académie Nationale de Médecine. 199 (2-3), 201-212 (2015).
- Hauser, R. A., et al. ADS-5102 (Amantadine) extended-release capsules for levodopa-induced dyskinesia in Parkinson's Disease (EASE LID 2 study): Interim results of an open-label safety study. Journal of Parkinson's Disease. 7 (3), 511-522 (2017).
- Huot, P., Johnston, T. H., Koprich, J. B., Fox, S. H., Brotchie, J. M. The pharmacology of L-DOPA-induced dyskinesia in Parkinson's disease. Pharmacological Reviews. 65 (1), 171-222 (2013).
- Steece-Collier, K., et al. Embryonic mesencephalic grafts increase levodopa-induced forelimb hyperkinesia in parkinsonian rats. Movement Disorders. 18 (12), 1442-1454 (2003).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments. (60), e3234 (2012).
- Simola, N., Morelli, M., Carta, A. R. The 6-hydroxydopamine model of Parkinson's disease. Neurotoxicity Research. 11 (3-4), 151-167 (2007).
- Borlongan, C. V., Hida, H., Nishino, H. Early assessment of motor dysfunctions aids in successful occlusion of the middle cerebral artery. Neuroreport. 9 (16), 3615-3621 (1998).
- Fleming, S. M. Behavioral outcome measures for the assessment of sensorimotor function in animal models of movement disorders. International Review of Neurobiology. 89, 57-65 (2009).
- Borlongan, C. V., Sanberg, P. R. Elevated body swing test: a new behavioral parameter for rats with 6-hydroxydopamine-induced hemiparkinsonism. Journal of Neuroscience. 15 (7), 5372-5378 (1995).
- Chang, J. W., Wachtel, S. R., Young, D., Kang, U. J. Biochemical and anatomical characterization of forepaw adjusting steps in rat models of Parkinson's disease: studies on medial forebrain bundle and striatal lesions. Neuroscience. 88 (2), 617-628 (1999).
- Lundblad, M., et al. Pharmacological validation of behavioural measures of akinesia and dyskinesia in a rat model of Parkinson's disease. European Journal of Neuroscience. 15 (1), 120-132 (2002).
- Olsson, M., Nikkhah, G., Bentlage, C., Bjorklund, A. Forelimb akinesia in the rat Parkinson model: differential effects of dopamine agonists and nigral transplants as assessed by a new stepping test. Journal of Neuroscience. 15 (5), 3863-3875 (1995).
- Monville, C., Torres, E. M., Dunnett, S. B. Comparison of incremental and accelerating protocols of the rotarod test for the assessment of motor deficits in the 6-OHDA model. Journal of Neuroscience Methods. 158 (2), 219-223 (2006).
- Steece-Collier, K., et al. Striatal Nurr1, but not FosB expression links a levodopa-induced dyskinesia phenotype to genotype in Fisher 344 vs. Lewis hemiparkinsonian rats. Experimental Neurology. 330, 113327 (2020).
- Steece-Collier, K., et al. Genetic silencing of striatal CaV1.3 prevents and ameliorates levodopa dyskinesia. Movement Disorders. 34 (5), 697-707 (2019).
- Tayarani-Binazir, K. A., Jackson, M. J., Strang, I., Jairaj, M., Rose, S., Jenner, P. Benserazide dosing regimen affects the response to L-3,4-dihydroxyphenylalanine in the 6-hydroxydopamine-lesioned rat. Behavioral Pharmacology. 23 (2), 126-133 (2012).
- Lindgren, H. S., Rylander, D., Ohlin, K. E., Lundblad, M., Cenci, M. A. The "motor complication syndrome" in rats with 6-OHDA lesions treated chronically with L-DOPA: relation to dose and route of administration. Behavioural Brain Research. 177 (1), 150-159 (2007).
- Suckow, M. A., Stevens, K. A., Wilson, R. P. . American College of Laboratory Animal Medicine series xvii. , 1268 (2012).
- Zhou, Y. Z., Alany, R. G., Chuang, V., Wen, J. Studies of the Rate Constant of l-DOPA Oxidation and Decarboxylation by HPLC. Chromatographia. 75, 597-606 (2012).
- Stroomer, A. E., Overmars, H., Abeling, N. G., van Gennip, A. H. Simultaneous determination of acidic 3,4-dihydroxyphenylalanine metabolites and 5-hydroxyindole-3-acetic acid in urine by high-performance liquid chromatography. Clinical Chemistry. 36 (10), 1834-1837 (1990).
- . PubChem Compound Summary for CID 6047, Levodopa Available from: https://pubchem.ncbi.nlm.nih.gov/compound/Levodopa (2021)
- Merck. . The Merck Index 13th edn. , (2021).
- Ortner, N. J., et al. Lower affinity of isradipine for L-Type Ca(2+) channels during substantia nigra dopamine neuron-like activity: Implications for neuroprotection in Parkinson's Disease. Journal of Neuroscience. 37 (228), 6761-6777 (2017).
- Hazra, A., Gogtay, N. Biostatistics series module 3: Comparing groups: Numerical variables. Indian Journal of Dermatology. 61 (3), 251-260 (2016).
- Mishra, P., Pandey, C. M., Singh, U., Keshri, A., Sabaretnam, M. Selection of appropriate statistical methods for data analysis. Annals of Cardiac Anaesthesia. 22 (3), 297-301 (2019).
- Divito, C. B., et al. Loss of VGLUT3 produces circadian-dependent hyperdopaminergia and ameliorates motor dysfunction and l-Dopa-Mediated dyskinesias in a model of Parkinson's Disease. Journal of Neuroscience. 35 (45), 14983-14999 (2015).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of enhanced behavioral responses to L-DOPA following repeated administration in the 6-hydroxydopamine-lesioned rat model of Parkinson's disease. Experimental Neurology. 151 (2), 334-342 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiology of Disease. 6 (6), 461-474 (1999).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. European Journal of Neuroscience. 10 (8), 2694-2706 (1998).
- Dekundy, A., Lundblad, M., Danysz, W., Cenci, M. A. Modulation of L-DOPA-induced abnormal involuntary movements by clinically tested compounds: further validation of the rat dyskinesia model. Behavioural Brain Research. 179 (1), 76-89 (2007).
- Collier, T. J., et al. Interrogating the aged striatum: robust survival of grafted dopamine neurons in aging rats produces inferior behavioral recovery and evidence of impaired integration. Neurobiology of Disease. 77, 191-203 (2015).
- Maries, E., et al. Focal not widespread grafts induce novel dyskinetic behavior in parkinsonian rats. Neurobiology of Disease. 21 (1), 165-180 (2006).
- Mercado, N. M., et al. The BDNF Val66Met polymorphism (rs6265) enhances dopamine neuron graft efficacy and side-effect liability in rs6265 knock-in rats. Neurobiology of Disease. 148, 105175 (2021).
- Cenci, M. A., Crossman, A. R. Animal models of l-dopa-induced dyskinesia in Parkinson's disease. Movement Disorders. 33 (6), 889-899 (2018).
- Lindenbach, D. Behavioral and cellular modulation of L-DOPA-induced dyskinesia by beta-adrenoceptor blockade in the 6-hydroxydopamine-lesioned rat. Journal of Pharmacology and Experimental Therapeutics. 337 (3), 755-765 (2011).
- Petzinger, G. M. Reliability and validity of a new global dyskinesia rating scale in the MPTP-lesioned non-human primate. Movement Disorders. 16 (2), 202-207 (2001).
- Fox, S. H., Johnston, T. H., Li, Q., Brotchie, J., Bezard, E. A critique of available scales and presentation of the Non-Human Primate Dyskinesia Rating Scale. Movement Disorders. 27 (11), 1373-1378 (2012).
- Cenci, M. A., Ohlin, K. E. Rodent models of treatment-induced motor complications in Parkinson's disease. Parkinsonism & Related Disorders. 15, 13-17 (2009).
- Cenci, M. A., Whishaw, I. Q., Schallert, T. Animal models of neurological deficits: how relevant is the rat. Nature Reviews: Neuroscience. 3 (7), 574-579 (2002).
- Zhang, Y., et al. Aberrant restoration of spines and their synapses in L-DOPA-induced dyskinesia: involvement of corticostriatal but not thalamostriatal synapses. Journal of Neuroscience. 33 (28), 11655-11667 (2013).
- Konradi, C., et al. Transcriptome analysis in a rat model of L-DOPA-induced dyskinesia. Neurobiology of Disease. 17 (2), 219-236 (2004).
- Morin, N., Jourdain, V. A., Di Paolo, T. Modeling dyskinesia in animal models of Parkinson disease. Experimental Neurology. 256, 105-116 (2014).
- Cenci, M. A., Riggare, S., Pahwa, R., Eidelberg, D., Hauser, R. A. Dyskinesia matters. Movement Disorders. 35 (3), 392-396 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved