需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
左旋多巴诱导的帕金森病大鼠模型中运动障碍的诱导与评估
摘要
本文描述了在帕金森病的大鼠模型中诱导和评估左旋多巴诱导的运动障碍的方法。该协议提供了有关一系列运动障碍行为(包括肌张力障碍和运动过度)的强度和频率的详细信息,为测试针对这种未满足的医疗需求的治疗提供了可靠的工具。
摘要
左旋多巴(L-DOPA)仍然是用于治疗帕金森病(PD)运动症状的金标准疗法。然而,长期使用这种多巴胺前体会发展为称为 L-DOPA 诱导的运动障碍 (LID) 的不需要的不自主运动。据估计,在治疗后 10-15 年内,LID 的发病率上升到约 90% 的 PD 患者。了解这种疾病的机制并开发新颖有效的抗运动障碍治疗需要为治疗干预的临床前测试提供一致和准确的建模。本文介绍了在PD大鼠模型中6-OHDA诱导的黑粒病变后对LID进行可靠诱导和全面评估的详细方法。大鼠中可靠的LID评估提供了一种强大的工具,可以很容易地在实验室中用于测试新兴疗法,重点是减少或消除PD患者的这种常见治疗负担。
引言
虽然左旋多巴(L-DOPA)首次作为PD1,2患者的治疗方法已经超过50年,但它仍然是帕金森病运动症状最有效的治疗方法。与PD相关的临床运动症状源于黑质(SN)中多巴胺(DA)神经元的丧失,导致纹状体中可用多巴胺的显着减少。左旋多巴可有效恢复纹状体 DA 水平,从而在疾病早期带来运动益处3,4.不合时宜地,通过长期治疗,大多数PD患者将发展为L-DOPA诱导的运动障碍(LID),包括舞蹈病,肌张力障碍和手足徐动症,这些通常会显着影响日常生活活动5,6,7。
虽然存在几种啮齿动物LID行为模型,但LID的建模和行为评估的差异使人们对实验室之间结果的可重复性以及这些实验工具在临床前PD研究中的可靠性提出了质疑。与临床运动障碍专家8联合开发,目前的方案是LID诱导和评级的直接方法,适用于利用6-羟基多巴胺(6-OHDA)诱导的单侧黑粒病变的大鼠PD模型9,10。此处提供的LID评分量表包括对身体各个部位运动障碍行为的强度和频率的评分。还提供了有关实验工作流程优化以及帕金森病和运动障碍动物的适当护理和处理的相关信息。
研究方案
这里介绍的动物按照机构指南进行了维护和处理。所有动物程序均由密歇根州立大学机构动物护理和使用委员会(IACUC)批准,符合联邦和州法规。
1. 无药物确认 6-OHDA 病变状态
- 姿势尾挂试验11,12,13
注意:在实验受试者(例如,雄性或雌性,成年Sprague Dawley或Fisher 344大鼠)的6-OHDA病变诱导(参见9,10,35有关病变的详细信息)后至少1周评估病变状态。- 将大鼠悬挂在笼子上方约6厘米处,牢牢抓住尾巴的底部,持续约5秒。
- 将身体扭曲的方向记录为+,对于成功病变的动物扭曲对侧到病变侧和 - 对于在两个方向上缺乏扭曲或扭曲。
- 注意:这些测试是可选的,但建议使用。参见14,15,16,17 以了解其他无药物检测选项/变体。
- 步进调整阻力测试(从16调整)
注意:在实验受试者(例如,男性或女性,成年Sprague Dawley或Fisher 344大鼠)的单侧6-OHDA病变诱导后至少1周评估病变状态。- 抓住老鼠的尾巴底部,将后脚从表面抬高约6厘米;在平坦,光滑但不滑溜的表面上向后拖动,〜75厘米,超过5-10秒。
- 观察并记录三次重复测试中每个前爪的敲击/步进调整运动次数。
- 当观察到对侧对侧前视敲击时,受试者评分为 +,以成功进行单侧皮损(+),同时从前爪同侧到病变侧快速敲击(约 10 次轻拍)(例如,左侧单侧病变的动物显示对侧右前爪轻拍缺陷(0-2 次轻拍)。
- 相反,从两个前爪进行中度至快速敲击(5-10 次轻拍)评分为 - 以指示不完全或未知的病变状态。
注意:焦虑的动物即使成功病变,也可能表现出快速的敲击/步进调整。如果怀疑这一点,将大鼠放回家笼子里,并在30分钟后≥重新测试。
2. 试剂和耗材的制备
- 确定 L-3,4-二羟基苯丙氨酸甲酯盐酸盐(左旋多巴或 L-DOPA)和盐酸苄丝肼(一种外周脱羧酶抑制剂(见 材料表)的剂量、评级频率和实验时间表,适用于研究性问题12、18、19、20 (图 1)。
注意:可以提出研究性问题来寻求任意数量的问题,包括询问特定疗法是否可以减少现有的LID或防止LID的诱导。他们还可以探索治疗效果是否取决于左旋多巴的剂量,或者LID表达和/或治疗效果是否因受试者的性别,物种和年龄而异。
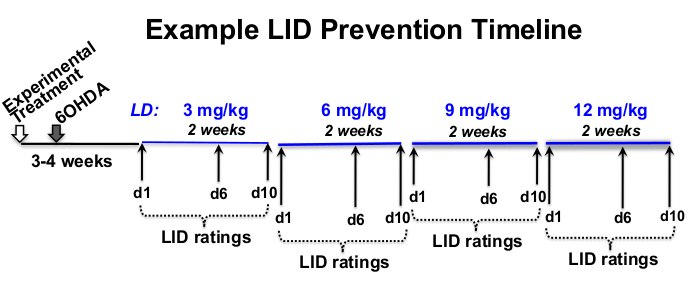
图1:治疗时间表示例。 示例 L-DOPA 剂量递增时间表为总长度为 12 周,8 周的 L-DOPA 注射在 6-OHDA 病变后 3 周开始,在实验治疗后 4 周开始。在这个例子中, l-DOPA 每周(星期一-星期五)在大约每天的同一时间皮下注射 5 次, 以每个处方的左旋多巴剂量 (3, 6, 9, 和 12 mg / kg) 持续 2 周.行为 LID 评级发生在每个 L-DOPA 剂量水平的第 1、6 和 10 天。 请点击此处查看此图的大图。
- 每周称量大鼠,以根据研究期间正在进行的体重变化计算适当的药物量。
注意:由于LID +大鼠的活性增加, 长期 L-DOPA 治疗有可能减轻体重.如果发生体重减轻,在注射L-DOPA后为大鼠提供营养完整,高度可口的零食(见 材料表)。 - 计算每周浓度所需的L-DOPA和苄丝肼的量,称出注射每一天的冻干等分试样,并在-20°C下在玻璃琥珀小瓶中组合储存1-2周,直到治疗当天。
注意:目标剂量为12毫克/千克或12毫克左旋多巴/1000克体重。 补充文件1给出了在1 cc / kg大鼠体重的注射体积下使用12mg L-DOPA / kg体重确定每周每天所需的L-DOPA和盐水量的计算示例。
3. 房间和笼子的设置
- 在6-OHDA病变手术后3-4周的左旋DOPA治疗的第一天,将大鼠转移到单一外壳,包括IACUC批准的富集。
- 在整个研究过程中保持单一住房,以避免同伴干扰行为评估。
- 在LID评级日,将家庭笼子放在钢丝架上,以约45° 角转动以最佳方式观察大鼠(图2A)。向上翻转识别标签(图2B),并取出水瓶,食品架和笼子中的所有类型的浓缩物(图2C),以避免干扰行为评估。

图2:为大型大鼠实验的LID等级设置的笼子示例。 (A)可以使用大型金属架设置多个笼子以进行LID评级,以便最佳地观察每只动物。笼子应以45°角分开,向上翻转身份证(B),去除食物,水瓶,筑巢材料和其他富集物,以限制大鼠的视觉模糊和对大鼠的干扰,同时检查运动障碍行为(C)。金属架需要距离任何墙壁几英尺,以便评分员根据需要检查笼子前面或后面的老鼠。必须用单独的动物ID标记富集设备(例如,C-红鼠撤退房屋),以将它们替换到它们来自的同一笼子中。当使用不同性别的动物不增加实验对象的压力时,这一点尤其重要。 请点击此处查看此图的大图。
4. 左旋多巴注射和运动障碍评级
- 皮下注射 L-DOPA21,22
- 在每天注射L-DOPA之前,立即将适当体积的无菌盐水加入琥珀小瓶中预先称重的冻干L-DOPA和苯醚嗪混合物中,并充分摇动10秒(步骤2.3)。
注意:目标注射量为1毫升/ 1000克体重(每毫升12毫克L-DOPA)。无菌盐水的体积将取决于每项研究的动物数量。 - 用每只动物所需的体积(1 mL / kg大鼠重量)填充单个注射器(例如,用26G针头填充1.0或0.5 mL),并在每个注射器上贴上单独的动物识别标签。
注意:将填充的注射器保存在无菌袋中避光,直到注射时。L-DOPA在氧和光存在下在水性环境中迅速氧化23,24,25,26。 - 将第一个笼子带到注射台上。
- 将大鼠从笼子中取出并将其放在注射表面上。
- 用非惯用手掌轻轻地将头部和肩膀限制在老鼠所倚靠的表面。
- 轻轻地,用非惯用手的拇指和食指擦拭肩胛骨上方的背部皮肤,将左旋DOPA体积与惯用手注射到手指之间/下方的皮下空间,使针头尽可能平行于身体,以避免肌内注射。
注意:大鼠在注射前未麻醉。 - 将每个用过的注射器丢弃在利器的容器中。
- 将大鼠放入其单独的笼子中,并添加营养完整的零食,除非在LID评级日,以避免干扰行为评估,直到评级完成后。
- 根据所需的评级时间和评级日研究中的大鼠数量,将计时器设置为1-2分钟。取回下一个笼子,并在计时器指示时注射下一只大鼠。
- 重复此操作,每1-2分钟注射一只大鼠,直到注射所有大鼠。
- 在每天注射L-DOPA之前,立即将适当体积的无菌盐水加入琥珀小瓶中预先称重的冻干L-DOPA和苯醚嗪混合物中,并充分摇动10秒(步骤2.3)。
- 左旋多巴诱导的注射后运动障碍评级
- 在所需时间点数处对肌张力障碍和运动过度运动运动的强度(表 1)和频率(表 2)进行评分,其中应包括 LID 行为的初始发作、峰值行为和下降阶段(有关 LID 评级日志表的示例,请参见 补充文件 2 )。
- 对于雄性和雌性成年Sprague Dawley或Fisher 344只大鼠,样本量为N = 40只大鼠,在第一次L-DOPA注射后20分钟开始运动障碍评级,然后在注射后50分钟直到220或270分钟,这取决于90%-100%的大鼠中LID行为何时停止。
- 如果使用 1 分钟额定间隔,请将计时器设置为 1 分钟。给第一只大鼠打一分钟。移动到下一个大鼠,并对其进行1分钟的评分。继续穿过所有大鼠,每隔1分钟评分。
- 在笼子旁边有一个可见的计时器,以便在估计额定期内任何给定行为的频率(表2)时可以观察到LID行为强度(表1)。
- 在第一个时间点的评级完成后,在下一个时间点(例如;注射后70分钟)再次开始第一只大鼠,并以所需的间隔(例如,每50分钟)继续,直到所有时间点完成。
注意:由于左旋多巴注射和LID评级任务的重叠,评级日需要两个人,一个用于注射,一个用于行为评级。
结果
帕金森病大鼠的LID可以表现为一系列异常不自主运动(AIM),包括肌张力障碍,运动过度和刻板行为。此处介绍了此类行为的LID评级标准,包括强度(表1)和频率(表2)。这为每只大鼠提供了总体LID严重程度评分,反映了在每个评级时间点参与这些行为的质量(强度)和时间(频率)的数量。最终的LID严重程度评分是通过将强度评分乘以每个行为成分的频率评分来计算?...
讨论
这里介绍的是黑纹体DA系统单侧6-OHDA病变后帕金森病大鼠模型中LID的可重复诱导和评级的详细信息。虽然曾经认为啮齿动物没有发展LID并且旋转不对称可能是大鼠31中LID的类似物,但在过去二十年中已经对大鼠和小鼠模型进行了表征,并且是LID研究的公认工具15,32,33,34。这里给出?...
披露声明
没有宣布任何利益冲突。
致谢
我们要承认所有帕金森病患者的挣扎以及他们每天表现出的力量和韧性,特别是KSC心爱的父亲Mark Steece。这里代表的工作得到了国家神经疾病和中风研究所(NS090107,NS110398)和帕金森病基金会国际研究资助计划(现为帕金森基金会)的支持。我们还要感谢Molly VanderWerp出色的编辑协助。
材料
| Name | Company | Catalog Number | Comments |
| 100 Minutes Digital Timer | Staples | 1111764 | |
| Compass CX Compact Scale | Ohaus | 30428202 | |
| 5-(2-aminoethyl)-1,2,4-benzenetriol, monohydrobromide | Cayman Chemicals | 25330 | 6-OHDA is a catecholaminergic neurotoxin that is used to induce dopaminergic lesions and parkinsonian symptoms in rodents. |
| Allentown cages | Allentown, LLC | Rat900 | Allentown cages provide the ability to view the rats from all sides. |
| BD Allergist Trays with Permanently Attached Needle | BD | BD 305540 | For subcutaneous L-DOPA injections |
| Benserazide hydrochloride | Sigma-Aldrich | B7283 | Benserazide is a peripheral decarboxylase inhibitor used with L-DOPA to to induce dyskinesia in rodent models of PD. |
| Glass amber scintillation vials | Thermo Scientific | B7921 | Used for storage of L-DOPA/benserazide at -20 °C until mixed with sterile saline. |
| L-3,4-Dihydroxyphenylalanine methyl ester hydrochloride | Sigma-Aldrich | D1507 | L-3,4-Dihydroxyphenylalanine methyl ester is a precursor to L-DOPA that crosses the blood-brain barrierand use to treat parkinsonian symptoms in rodents. |
| Paper Mate Sharpwriter Mechanical Pencils | Staples | 107250 | |
| Rodent nutritionally complete enrichment treats | Bio-Serv | F05478 | |
| Round Ice Bucket with Lid, 2.5 L | Corning | 432129 | |
| Standard Plastic Clipboard | Staples | 1227770 | |
| Steel wired 6' long movable shelving units | Uline | H9488 | Width/Height can be adjusted to need/number of rats per experiment |
| Sterile Saline 0.9% | Covidien/Argyle | 1020 | For mixing with L-DOPA/benserazide prior to subcutaneous injections. |
参考文献
- Cotzias, G. C., Papavasiliou, P. S., Gellene, R. L-dopa in parkinson's syndrome. New England Journal of Medicine. 281, 272 (1969).
- Yahr, M. D., Duvoisin, R. C., Schear, M. J., Barrett, R. E., Hoehn, M. M. Treatment of parkinsonism with levodopa. Archives of Neurology. 21 (4), 343-354 (1969).
- Bastide, M. F., et al. Pathophysiology of L-dopa-induced motor and non-motor complications in Parkinson's disease. Progress in Neurobiology. 132, 96-168 (2015).
- Sellnow, R. C., et al. Regulation of dopamine neurotransmission from serotonergic neurons by ectopic expression of the dopamine D2 autoreceptor blocks levodopa-induced dyskinesia. Acta Neuropathologica Communications. 7 (1), 8 (2019).
- Bastide, M. F., Bezard, E. L-dopa induced dyskinesia in Parkinson's disease]. Bulletin de l'Académie Nationale de Médecine. 199 (2-3), 201-212 (2015).
- Hauser, R. A., et al. ADS-5102 (Amantadine) extended-release capsules for levodopa-induced dyskinesia in Parkinson's Disease (EASE LID 2 study): Interim results of an open-label safety study. Journal of Parkinson's Disease. 7 (3), 511-522 (2017).
- Huot, P., Johnston, T. H., Koprich, J. B., Fox, S. H., Brotchie, J. M. The pharmacology of L-DOPA-induced dyskinesia in Parkinson's disease. Pharmacological Reviews. 65 (1), 171-222 (2013).
- Steece-Collier, K., et al. Embryonic mesencephalic grafts increase levodopa-induced forelimb hyperkinesia in parkinsonian rats. Movement Disorders. 18 (12), 1442-1454 (2003).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments. (60), e3234 (2012).
- Simola, N., Morelli, M., Carta, A. R. The 6-hydroxydopamine model of Parkinson's disease. Neurotoxicity Research. 11 (3-4), 151-167 (2007).
- Borlongan, C. V., Hida, H., Nishino, H. Early assessment of motor dysfunctions aids in successful occlusion of the middle cerebral artery. Neuroreport. 9 (16), 3615-3621 (1998).
- Fleming, S. M. Behavioral outcome measures for the assessment of sensorimotor function in animal models of movement disorders. International Review of Neurobiology. 89, 57-65 (2009).
- Borlongan, C. V., Sanberg, P. R. Elevated body swing test: a new behavioral parameter for rats with 6-hydroxydopamine-induced hemiparkinsonism. Journal of Neuroscience. 15 (7), 5372-5378 (1995).
- Chang, J. W., Wachtel, S. R., Young, D., Kang, U. J. Biochemical and anatomical characterization of forepaw adjusting steps in rat models of Parkinson's disease: studies on medial forebrain bundle and striatal lesions. Neuroscience. 88 (2), 617-628 (1999).
- Lundblad, M., et al. Pharmacological validation of behavioural measures of akinesia and dyskinesia in a rat model of Parkinson's disease. European Journal of Neuroscience. 15 (1), 120-132 (2002).
- Olsson, M., Nikkhah, G., Bentlage, C., Bjorklund, A. Forelimb akinesia in the rat Parkinson model: differential effects of dopamine agonists and nigral transplants as assessed by a new stepping test. Journal of Neuroscience. 15 (5), 3863-3875 (1995).
- Monville, C., Torres, E. M., Dunnett, S. B. Comparison of incremental and accelerating protocols of the rotarod test for the assessment of motor deficits in the 6-OHDA model. Journal of Neuroscience Methods. 158 (2), 219-223 (2006).
- Steece-Collier, K., et al. Striatal Nurr1, but not FosB expression links a levodopa-induced dyskinesia phenotype to genotype in Fisher 344 vs. Lewis hemiparkinsonian rats. Experimental Neurology. 330, 113327 (2020).
- Steece-Collier, K., et al. Genetic silencing of striatal CaV1.3 prevents and ameliorates levodopa dyskinesia. Movement Disorders. 34 (5), 697-707 (2019).
- Tayarani-Binazir, K. A., Jackson, M. J., Strang, I., Jairaj, M., Rose, S., Jenner, P. Benserazide dosing regimen affects the response to L-3,4-dihydroxyphenylalanine in the 6-hydroxydopamine-lesioned rat. Behavioral Pharmacology. 23 (2), 126-133 (2012).
- Lindgren, H. S., Rylander, D., Ohlin, K. E., Lundblad, M., Cenci, M. A. The "motor complication syndrome" in rats with 6-OHDA lesions treated chronically with L-DOPA: relation to dose and route of administration. Behavioural Brain Research. 177 (1), 150-159 (2007).
- Suckow, M. A., Stevens, K. A., Wilson, R. P. . American College of Laboratory Animal Medicine series xvii. , 1268 (2012).
- Zhou, Y. Z., Alany, R. G., Chuang, V., Wen, J. Studies of the Rate Constant of l-DOPA Oxidation and Decarboxylation by HPLC. Chromatographia. 75, 597-606 (2012).
- Stroomer, A. E., Overmars, H., Abeling, N. G., van Gennip, A. H. Simultaneous determination of acidic 3,4-dihydroxyphenylalanine metabolites and 5-hydroxyindole-3-acetic acid in urine by high-performance liquid chromatography. Clinical Chemistry. 36 (10), 1834-1837 (1990).
- . PubChem Compound Summary for CID 6047, Levodopa Available from: https://pubchem.ncbi.nlm.nih.gov/compound/Levodopa (2021)
- Merck. . The Merck Index 13th edn. , (2021).
- Ortner, N. J., et al. Lower affinity of isradipine for L-Type Ca(2+) channels during substantia nigra dopamine neuron-like activity: Implications for neuroprotection in Parkinson's Disease. Journal of Neuroscience. 37 (228), 6761-6777 (2017).
- Hazra, A., Gogtay, N. Biostatistics series module 3: Comparing groups: Numerical variables. Indian Journal of Dermatology. 61 (3), 251-260 (2016).
- Mishra, P., Pandey, C. M., Singh, U., Keshri, A., Sabaretnam, M. Selection of appropriate statistical methods for data analysis. Annals of Cardiac Anaesthesia. 22 (3), 297-301 (2019).
- Divito, C. B., et al. Loss of VGLUT3 produces circadian-dependent hyperdopaminergia and ameliorates motor dysfunction and l-Dopa-Mediated dyskinesias in a model of Parkinson's Disease. Journal of Neuroscience. 35 (45), 14983-14999 (2015).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of enhanced behavioral responses to L-DOPA following repeated administration in the 6-hydroxydopamine-lesioned rat model of Parkinson's disease. Experimental Neurology. 151 (2), 334-342 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiology of Disease. 6 (6), 461-474 (1999).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. European Journal of Neuroscience. 10 (8), 2694-2706 (1998).
- Dekundy, A., Lundblad, M., Danysz, W., Cenci, M. A. Modulation of L-DOPA-induced abnormal involuntary movements by clinically tested compounds: further validation of the rat dyskinesia model. Behavioural Brain Research. 179 (1), 76-89 (2007).
- Collier, T. J., et al. Interrogating the aged striatum: robust survival of grafted dopamine neurons in aging rats produces inferior behavioral recovery and evidence of impaired integration. Neurobiology of Disease. 77, 191-203 (2015).
- Maries, E., et al. Focal not widespread grafts induce novel dyskinetic behavior in parkinsonian rats. Neurobiology of Disease. 21 (1), 165-180 (2006).
- Mercado, N. M., et al. The BDNF Val66Met polymorphism (rs6265) enhances dopamine neuron graft efficacy and side-effect liability in rs6265 knock-in rats. Neurobiology of Disease. 148, 105175 (2021).
- Cenci, M. A., Crossman, A. R. Animal models of l-dopa-induced dyskinesia in Parkinson's disease. Movement Disorders. 33 (6), 889-899 (2018).
- Lindenbach, D. Behavioral and cellular modulation of L-DOPA-induced dyskinesia by beta-adrenoceptor blockade in the 6-hydroxydopamine-lesioned rat. Journal of Pharmacology and Experimental Therapeutics. 337 (3), 755-765 (2011).
- Petzinger, G. M. Reliability and validity of a new global dyskinesia rating scale in the MPTP-lesioned non-human primate. Movement Disorders. 16 (2), 202-207 (2001).
- Fox, S. H., Johnston, T. H., Li, Q., Brotchie, J., Bezard, E. A critique of available scales and presentation of the Non-Human Primate Dyskinesia Rating Scale. Movement Disorders. 27 (11), 1373-1378 (2012).
- Cenci, M. A., Ohlin, K. E. Rodent models of treatment-induced motor complications in Parkinson's disease. Parkinsonism & Related Disorders. 15, 13-17 (2009).
- Cenci, M. A., Whishaw, I. Q., Schallert, T. Animal models of neurological deficits: how relevant is the rat. Nature Reviews: Neuroscience. 3 (7), 574-579 (2002).
- Zhang, Y., et al. Aberrant restoration of spines and their synapses in L-DOPA-induced dyskinesia: involvement of corticostriatal but not thalamostriatal synapses. Journal of Neuroscience. 33 (28), 11655-11667 (2013).
- Konradi, C., et al. Transcriptome analysis in a rat model of L-DOPA-induced dyskinesia. Neurobiology of Disease. 17 (2), 219-236 (2004).
- Morin, N., Jourdain, V. A., Di Paolo, T. Modeling dyskinesia in animal models of Parkinson disease. Experimental Neurology. 256, 105-116 (2014).
- Cenci, M. A., Riggare, S., Pahwa, R., Eidelberg, D., Hauser, R. A. Dyskinesia matters. Movement Disorders. 35 (3), 392-396 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。