このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
パーキンソン病のラットモデルにおけるレボドパ誘発性ジスキネジアの誘導と評価
要約
この記事では、パーキンソン病のラットモデルにおけるレボドパ誘発性ジスキネジアを誘導および評価する方法について説明します。このプロトコルは、ジストニックおよび過運動性の両方のさまざまな運動異常行動の強度と頻度に関する詳細な情報を提供し、この満たされていない医療ニーズを標的とする治療をテストするための信頼性の高いツールを提供します。
要約
レボドパ(L-DOPA)は、パーキンソン病(PD)の運動症状の治療に使用されるゴールドスタンダード療法のままです。しかしながら, L-DOPA誘発性ジスキネジアとして知られている不要な不随意運動 (LID) このドーパミン前駆体の長期使用で発症します。.LIDの発生率は、治療から10〜15年以内にPD患者の約90%にエスカレートすると推定されています。この疾患のメカニズムを理解し、新規かつ効果的な抗ジスキネジア治療薬を開発するには、治療介入の前臨床試験のための一貫した正確なモデリングが必要です。PDのラットモデルにおける6-OHDA誘導性黒質病変後のLIDの信頼性の高い誘導および包括的な評価のための詳細な方法をここに提示する。ラットにおける信頼性の高いLID評価は、PD患者に対するこの一般的な治療誘発性の負担を軽減または排除することに焦点を当てた新しい治療法をテストするために、実験室全体で容易に利用できる強力なツールを提供する。
概要
レボドパ(L-DOPA)がPD 1,2の患者の治療法として最初に導入されてから50年以上が経ちましたが、パーキンソン病の運動症状に対する最も効果的な治療法として非常に効果的です。PDに関連する臨床運動症状は、黒質(SN)パースコンパクタにおけるドーパミン(DA)ニューロンの喪失に由来し、線条体において利用可能なドーパミンの劇的な減少をもたらす。L-DOPAは線条体DAレベルを効果的に回復させ、疾患の早期に運動利益をもたらす3,4。不適切なことに、長期治療では、PDを有するほとんどの個人は、舞踏病、ジストニア、およびアテトーシスを含むL-DOPA誘発性ジスキネシア(LID)を発症し、これはしばしば日常生活の活動に重大な影響を及ぼす5,6,7。
げっ歯類におけるLIDの行動モデルはいくつか存在するが、LIDのモデリングと行動評価の違いは、実験室間の結果の再現性、および前臨床PD研究のためのこれらの実験ツールの信頼性に疑問を投げかけている。臨床運動障害専門医8と共同で開発された現在のプロトコルは、LID誘導および評価のための簡単な方法であり、6-ヒドロキシドーパミン(6-OHDA)誘発片側性ニグラル病変9,10を利用するPDのラットモデルでの使用に適している。ここで提供されるLID評価尺度には、さまざまな個々の身体部分における運動異常行動の強度と頻度の両方についてのスコアリングが含まれる。実験のワークフロー最適化、パーキンソン病およびジスキネティック動物の適切なケアおよび取り扱いに関する関連情報も提供される。
プロトコル
ここに提示された動物は、制度上のガイドラインに従って維持され、取り扱われた。すべての動物処置は、ミシガン州立大学機関動物ケアおよび使用委員会(IACUC)によって、連邦および州の規制に準拠して承認されました。
1. 6-OHDA病変状態の無薬物確認
- 姿勢尾ぶれ試験11,12,13
注:実験対象(例えば、雄または雌、成人のスプレイグ・ドーリーまたはフィッシャー344匹)における6-OHDA病変誘導の少なくとも1週間後(病変の詳細については9、10、35を参照)に病変状態を評価する。- ラットをケージから約6cm上に吊り下げ、尾の付け根を約5秒間しっかりと保持します。
- 身体のねじれの方向を、病変した側に反対側にねじれている首尾よく病変した動物の場合+として記録し、 - 両方向にねじれまたはねじれがない。
- メモ: これらのテストはオプションですが、推奨されます。追加の薬物フリー検査オプション/バリエーションについては、14,15,16,17を参照してください。
- ステップ調整ドラッグテスト(16から適応)
注:実験対象(例えば、雄または雌、成人のスプレイグ・ドーリーまたはフィッシャー344匹)における一方的な6-OHDA病変誘導の少なくとも1週間後に病変状態を評価する。- ラットを尾の付け根で保持し、後ろ足を表面から約6cm持ち上げます。平らで滑らかだが滑りにくい表面を横切って後方にドラッグし、約75 cm、5〜10秒以上。
- 3回の繰り返しテストで各前足のタッピング/ステップ調整の動きを観察し、記録します。
- 0〜2個の前足タップが病変側に対して対側から病変側へ、前足同側から病変側への急速なタッピング(〜10タップ)とともに観察される場合の片側病変の成功について対象を+としてスコア付けする(例えば、左側に一方的に病変した動物は、対側右前足を有するタッピング欠損(0〜2タップ)を示す)。
- 逆に、両方の前足からの中等度から急速なタッピング(5〜10タップ)をスコアとして−として、不完全または未知の病変状態を示す。
注:不安な動物は、病変がうまくいっても急速なタッピング/ステップ調整を示すことがあります。これが疑われる場合は、ラットを自宅のケージに戻し、≥30分後に再テストします。
2. 試薬および供給品の調製
- L-3,4-ジヒドロキシフェニルアラニンメチルエステル塩酸塩(レボドパまたはL-DOPA)および末梢脱炭酸酵素阻害剤である塩酸ベンセラジド(材料表を参照)の用量、評価頻度、および治験上の質問12,18,19,20に適した実験タイムラインを決定する(図1)。
注:治験中の質問は、特定の治療法が既存のLIDを減少させるか、またはLIDの誘導を妨げる可能性があるかどうかを尋ねることから、任意の数の質問を求めるために提起することができる。また、治療有効性がレボドパの用量に依存するかどうか、またはLID発現および/または治療有効性が被験者の性別、種、および年齢によって異なるかどうかを調べることもできる。
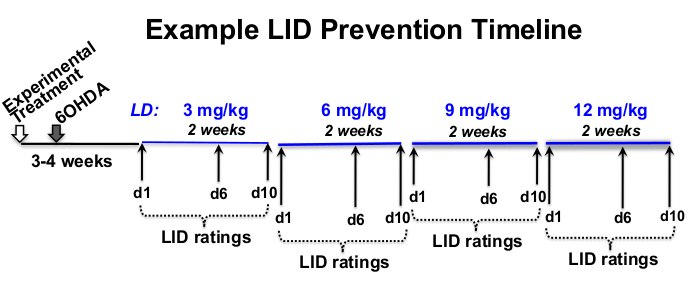
図1:治療タイムラインの例。 実施例L-DOPA用量漸増タイムラインは全長で12週間、6-OHDA病変後3週間後および実験的処置後4週間後に開始される8週間のL-DOPA注射を用いた。この例では、L-DOPAは、毎日ほぼ同じ時間に、各処方L-DOPA用量(3、6、9、および12mg / kg)で2週間、週に5回(月曜日〜金曜日)皮下注射される。行動LID評価は、各L-DOPA投与量の1日目、6日目、および10日目に行われます。 この図の拡大版を表示するには、ここをクリックしてください。
- ラットを毎週計量し、試験中に進行中の体重変化に基づいて適切な薬物量を計算する。
注:LID+ラットの活性の増加により、長期のL-DOPA治療で体重減少の可能性があります。体重減少が発生した場合は、L-DOPA注射後にラットに栄養的に完全で非常に嗜好性の高いおやつ( 材料表を参照)を提供します。 - 毎週の濃度ごとに必要なL-DOPAおよびベンセラジドの量を計算し、注射の日ごとに凍結乾燥アリコートを計量し、ガラス琥珀バイアル中で-20°Cで1〜2週間、治療日まで組み合わせて保存する。
注:目標用量は12mg / kgまたは12mg L-DOPA/1000g体重です。ラット体重1cc/kgの注射量で12mgのL-DOPA/kg体重を用いて、1曜日毎に必要なL-DOPA及び生理食塩水の量を求める計算例を 付記1に記載する。
3. 部屋とケージのセットアップ
- 6-OHDA病変手術後3〜4週間のL-DOPA治療の初日に、ラットをIACUC承認濃縮を含む単一のハウジングに移す。
- 行動評価に対するピアの干渉を避けるために、研究を通して単一の住宅に維持する。
- LID評価日には、ラットを最適に見るために、家庭用ケージを約45° の角度で回したスチールワイヤーラックの上に置きます(図2A)。識別タグ(図2B)を上向きに反転させ、水筒、食料ラック、およびケージ内のあらゆる種類の濃縮物(図2C)を取り外して、行動評価の妨げにならないようにします。

図2:大規模ラット実験のLID評価用に設置されたケージの例 (A)各動物を最適に見ることができる大きな金属ラックを使用して、LID定格用に複数のケージを設定できます。ケージは45°の角度で広げ、IDカードを上向きにひっくり返し(B)、食べ物、水筒、ネスティング材料、その他の濃縮物を取り除き、ラットの視覚的な不明瞭さを制限し、ラットの気を散らすようにします(C)。金属製のラックは、必要に応じてケージの前面または背面にあるラットを検査できるように、壁から数フィート離れている必要があります。濃縮装置(例えば、C-レッドラットの隠れ家)に個々の動物IDをラベル付けして、それらが来たのと同じケージに交換することが不可欠です。これは、実験対象へのストレスを増大させないように、性別の異なる動物を使用する場合に特に重要である。 この図の拡大版を表示するには、ここをクリックしてください。
4.レボドパ注射およびジスキネジア評価
- L-ドーパの皮下注射21,22
- L-DOPAの毎日の注射の直前に、アンバーバイアル中の予め秤量された凍結乾燥L-DOPAおよびベンセラジドミックスに適切な量の滅菌生理食塩水を加え、10秒間よく振る(ステップ2.3)。
注:目標注射量は1mL/1000g体重(1mLあたり12mgのL-DOPAを含む)です。滅菌生理食塩水の体積は、1回の研究あたりの動物の数に依存するであろう。 - 個々のシリンジ(例えば、1.0または0.5mLに26G針)を各動物に必要な容量(1mL/kgラット重量)で充填し、各シリンジに個々の動物識別でラベルを付けます。
注:充填されたシリンジは、注射時まで滅菌パウチ内の光から保護してください。L-DOPAは、水性環境中で酸素および光の存在下で急速に酸化する23、24、25、26。 - 最初のケージを注射ベンチに持って行きます。
- ラットをケージから取り出し、注射面に置きます。
- ラットが非利き手の手のひらで休んでいる表面に対して頭と肩を静かに拘束する。
- 非利き手の親指と人差し指で肩甲骨の上に横たわる背中の皮膚を優しくなめ、利き手でL-DOPAボリュームを指の間/下の皮下腔に注入し、筋肉内注射を避けるために針をできるだけ体に平行に保ちます。
注:ラットは注射前に麻酔をかけない。 - 使用済みの個々のシリンジをシャープの容器に廃棄します。
- ラットを個々のケージに入れ替え、評価が完了するまで行動評価への干渉を避けるために、LID評価日を除いて栄養的に完全なおやつを加えます。
- タイマーを 1 ~ 2 分間設定するには、希望する評価時間と、評価日の試験に参加したラットの数によって異なります。次のケージを取り出し、タイマーが示すように次のラットを注射します。
- これを繰り返し、すべてのラットが注射されるまで、1〜2分ごとに1匹のラットを注射する。
- L-DOPAの毎日の注射の直前に、アンバーバイアル中の予め秤量された凍結乾燥L-DOPAおよびベンセラジドミックスに適切な量の滅菌生理食塩水を加え、10秒間よく振る(ステップ2.3)。
- 注射後のレボドパ誘発性ジスキネジア評価
- ジストニックおよび過運動性ジスキネジア運動の強度(表1)および頻度(表2)を、LID行動の初期発症、ピーク挙動、および衰退段階を含む所望の時点数で評価する(LID評価ログシートの例については 、補足ファイル2 を参照)。
- オスおよびメスの成人Sprague DawleyまたはFisher 344ラット、およびサンプルサイズがN = 40ラットの場合、ラットの90%〜100%でLID行動がいつ中止したかに応じて、最初のL-DOPA注射の20分後20分または270分まで50分間隔でジスキネジア評価を開始する。
- 1 分間の評価間隔を使用する場合は、タイマーを 1 分間に設定します。最初のラットを1分間評価する。次のラットに移動し、1分間評価します。すべてのラットを通して、1分間隔で評価を続ける。
- レーティング期間中の任意の動作(表2)の頻度を推定しながら、LID挙動強度(表1)を観察できるように、ケージの隣にタイマーを可視的に配置します。
- 最初の時点の評価が完了した後、次の時点(例えば、注射後70分)で最初のラットで再び開始し、すべての時点が完了するまで所望の間隔(例えば、50分ごと)で継続する。
注:L-DOPA注射とLID評価タスクが重複しているため、評価日には、注射用と行動評価用の2人が必要です。
結果
パーキンソン病ラットのLIDは、ジストニック、過運動、およびステレオタイプの行動を含む、異常な不随意運動(AIM)の範囲として現れる可能性がある。このような動作のLID評価基準は、強度(表1)と周波数(表2)の両方を含むようにここに示されています。これにより、各ラットの全体的なLID重症度スコアが提供され、各評価時点でのこれらの行動に関与するのに費やさ?...
ディスカッション
ここでは、黒質線条体DA系の片側的6-OHDA病変後のパーキンソン病ラットモデルにおけるLIDの再現性のある誘導および評価の詳細を提示する。かつてはげっ歯類はLIDを発症しておらず、回転非対称性はラット31のLIDの類似体である可能性があると考えられていましたが、ラットとマウスのモデルは過去20年間に特徴付けられており、LID研究のためのよく受け入れられたツールで?...
開示事項
利益相反は宣言されませんでした。
謝辞
私たちは、パーキンソン病を患っているすべての人々の闘いと、彼らが毎日示す強さと回復力、特にKSCの最愛の父、マーク・スティースに感謝したいと思います。ここに示されている研究は、国立神経障害・脳卒中研究所(NS090107、NS110398)とパーキンソン病財団国際研究助成プログラム(現在のパーキンソン財団)の支援を受けました。また、Molly VanderWerpの優れた編集支援にも感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 100 Minutes Digital Timer | Staples | 1111764 | |
| Compass CX Compact Scale | Ohaus | 30428202 | |
| 5-(2-aminoethyl)-1,2,4-benzenetriol, monohydrobromide | Cayman Chemicals | 25330 | 6-OHDA is a catecholaminergic neurotoxin that is used to induce dopaminergic lesions and parkinsonian symptoms in rodents. |
| Allentown cages | Allentown, LLC | Rat900 | Allentown cages provide the ability to view the rats from all sides. |
| BD Allergist Trays with Permanently Attached Needle | BD | BD 305540 | For subcutaneous L-DOPA injections |
| Benserazide hydrochloride | Sigma-Aldrich | B7283 | Benserazide is a peripheral decarboxylase inhibitor used with L-DOPA to to induce dyskinesia in rodent models of PD. |
| Glass amber scintillation vials | Thermo Scientific | B7921 | Used for storage of L-DOPA/benserazide at -20 °C until mixed with sterile saline. |
| L-3,4-Dihydroxyphenylalanine methyl ester hydrochloride | Sigma-Aldrich | D1507 | L-3,4-Dihydroxyphenylalanine methyl ester is a precursor to L-DOPA that crosses the blood-brain barrierand use to treat parkinsonian symptoms in rodents. |
| Paper Mate Sharpwriter Mechanical Pencils | Staples | 107250 | |
| Rodent nutritionally complete enrichment treats | Bio-Serv | F05478 | |
| Round Ice Bucket with Lid, 2.5 L | Corning | 432129 | |
| Standard Plastic Clipboard | Staples | 1227770 | |
| Steel wired 6' long movable shelving units | Uline | H9488 | Width/Height can be adjusted to need/number of rats per experiment |
| Sterile Saline 0.9% | Covidien/Argyle | 1020 | For mixing with L-DOPA/benserazide prior to subcutaneous injections. |
参考文献
- Cotzias, G. C., Papavasiliou, P. S., Gellene, R. L-dopa in parkinson's syndrome. New England Journal of Medicine. 281, 272 (1969).
- Yahr, M. D., Duvoisin, R. C., Schear, M. J., Barrett, R. E., Hoehn, M. M. Treatment of parkinsonism with levodopa. Archives of Neurology. 21 (4), 343-354 (1969).
- Bastide, M. F., et al. Pathophysiology of L-dopa-induced motor and non-motor complications in Parkinson's disease. Progress in Neurobiology. 132, 96-168 (2015).
- Sellnow, R. C., et al. Regulation of dopamine neurotransmission from serotonergic neurons by ectopic expression of the dopamine D2 autoreceptor blocks levodopa-induced dyskinesia. Acta Neuropathologica Communications. 7 (1), 8 (2019).
- Bastide, M. F., Bezard, E. L-dopa induced dyskinesia in Parkinson's disease]. Bulletin de l'Académie Nationale de Médecine. 199 (2-3), 201-212 (2015).
- Hauser, R. A., et al. ADS-5102 (Amantadine) extended-release capsules for levodopa-induced dyskinesia in Parkinson's Disease (EASE LID 2 study): Interim results of an open-label safety study. Journal of Parkinson's Disease. 7 (3), 511-522 (2017).
- Huot, P., Johnston, T. H., Koprich, J. B., Fox, S. H., Brotchie, J. M. The pharmacology of L-DOPA-induced dyskinesia in Parkinson's disease. Pharmacological Reviews. 65 (1), 171-222 (2013).
- Steece-Collier, K., et al. Embryonic mesencephalic grafts increase levodopa-induced forelimb hyperkinesia in parkinsonian rats. Movement Disorders. 18 (12), 1442-1454 (2003).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments. (60), e3234 (2012).
- Simola, N., Morelli, M., Carta, A. R. The 6-hydroxydopamine model of Parkinson's disease. Neurotoxicity Research. 11 (3-4), 151-167 (2007).
- Borlongan, C. V., Hida, H., Nishino, H. Early assessment of motor dysfunctions aids in successful occlusion of the middle cerebral artery. Neuroreport. 9 (16), 3615-3621 (1998).
- Fleming, S. M. Behavioral outcome measures for the assessment of sensorimotor function in animal models of movement disorders. International Review of Neurobiology. 89, 57-65 (2009).
- Borlongan, C. V., Sanberg, P. R. Elevated body swing test: a new behavioral parameter for rats with 6-hydroxydopamine-induced hemiparkinsonism. Journal of Neuroscience. 15 (7), 5372-5378 (1995).
- Chang, J. W., Wachtel, S. R., Young, D., Kang, U. J. Biochemical and anatomical characterization of forepaw adjusting steps in rat models of Parkinson's disease: studies on medial forebrain bundle and striatal lesions. Neuroscience. 88 (2), 617-628 (1999).
- Lundblad, M., et al. Pharmacological validation of behavioural measures of akinesia and dyskinesia in a rat model of Parkinson's disease. European Journal of Neuroscience. 15 (1), 120-132 (2002).
- Olsson, M., Nikkhah, G., Bentlage, C., Bjorklund, A. Forelimb akinesia in the rat Parkinson model: differential effects of dopamine agonists and nigral transplants as assessed by a new stepping test. Journal of Neuroscience. 15 (5), 3863-3875 (1995).
- Monville, C., Torres, E. M., Dunnett, S. B. Comparison of incremental and accelerating protocols of the rotarod test for the assessment of motor deficits in the 6-OHDA model. Journal of Neuroscience Methods. 158 (2), 219-223 (2006).
- Steece-Collier, K., et al. Striatal Nurr1, but not FosB expression links a levodopa-induced dyskinesia phenotype to genotype in Fisher 344 vs. Lewis hemiparkinsonian rats. Experimental Neurology. 330, 113327 (2020).
- Steece-Collier, K., et al. Genetic silencing of striatal CaV1.3 prevents and ameliorates levodopa dyskinesia. Movement Disorders. 34 (5), 697-707 (2019).
- Tayarani-Binazir, K. A., Jackson, M. J., Strang, I., Jairaj, M., Rose, S., Jenner, P. Benserazide dosing regimen affects the response to L-3,4-dihydroxyphenylalanine in the 6-hydroxydopamine-lesioned rat. Behavioral Pharmacology. 23 (2), 126-133 (2012).
- Lindgren, H. S., Rylander, D., Ohlin, K. E., Lundblad, M., Cenci, M. A. The "motor complication syndrome" in rats with 6-OHDA lesions treated chronically with L-DOPA: relation to dose and route of administration. Behavioural Brain Research. 177 (1), 150-159 (2007).
- Suckow, M. A., Stevens, K. A., Wilson, R. P. . American College of Laboratory Animal Medicine series xvii. , 1268 (2012).
- Zhou, Y. Z., Alany, R. G., Chuang, V., Wen, J. Studies of the Rate Constant of l-DOPA Oxidation and Decarboxylation by HPLC. Chromatographia. 75, 597-606 (2012).
- Stroomer, A. E., Overmars, H., Abeling, N. G., van Gennip, A. H. Simultaneous determination of acidic 3,4-dihydroxyphenylalanine metabolites and 5-hydroxyindole-3-acetic acid in urine by high-performance liquid chromatography. Clinical Chemistry. 36 (10), 1834-1837 (1990).
- . PubChem Compound Summary for CID 6047, Levodopa Available from: https://pubchem.ncbi.nlm.nih.gov/compound/Levodopa (2021)
- Merck. . The Merck Index 13th edn. , (2021).
- Ortner, N. J., et al. Lower affinity of isradipine for L-Type Ca(2+) channels during substantia nigra dopamine neuron-like activity: Implications for neuroprotection in Parkinson's Disease. Journal of Neuroscience. 37 (228), 6761-6777 (2017).
- Hazra, A., Gogtay, N. Biostatistics series module 3: Comparing groups: Numerical variables. Indian Journal of Dermatology. 61 (3), 251-260 (2016).
- Mishra, P., Pandey, C. M., Singh, U., Keshri, A., Sabaretnam, M. Selection of appropriate statistical methods for data analysis. Annals of Cardiac Anaesthesia. 22 (3), 297-301 (2019).
- Divito, C. B., et al. Loss of VGLUT3 produces circadian-dependent hyperdopaminergia and ameliorates motor dysfunction and l-Dopa-Mediated dyskinesias in a model of Parkinson's Disease. Journal of Neuroscience. 35 (45), 14983-14999 (2015).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of enhanced behavioral responses to L-DOPA following repeated administration in the 6-hydroxydopamine-lesioned rat model of Parkinson's disease. Experimental Neurology. 151 (2), 334-342 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiology of Disease. 6 (6), 461-474 (1999).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. European Journal of Neuroscience. 10 (8), 2694-2706 (1998).
- Dekundy, A., Lundblad, M., Danysz, W., Cenci, M. A. Modulation of L-DOPA-induced abnormal involuntary movements by clinically tested compounds: further validation of the rat dyskinesia model. Behavioural Brain Research. 179 (1), 76-89 (2007).
- Collier, T. J., et al. Interrogating the aged striatum: robust survival of grafted dopamine neurons in aging rats produces inferior behavioral recovery and evidence of impaired integration. Neurobiology of Disease. 77, 191-203 (2015).
- Maries, E., et al. Focal not widespread grafts induce novel dyskinetic behavior in parkinsonian rats. Neurobiology of Disease. 21 (1), 165-180 (2006).
- Mercado, N. M., et al. The BDNF Val66Met polymorphism (rs6265) enhances dopamine neuron graft efficacy and side-effect liability in rs6265 knock-in rats. Neurobiology of Disease. 148, 105175 (2021).
- Cenci, M. A., Crossman, A. R. Animal models of l-dopa-induced dyskinesia in Parkinson's disease. Movement Disorders. 33 (6), 889-899 (2018).
- Lindenbach, D. Behavioral and cellular modulation of L-DOPA-induced dyskinesia by beta-adrenoceptor blockade in the 6-hydroxydopamine-lesioned rat. Journal of Pharmacology and Experimental Therapeutics. 337 (3), 755-765 (2011).
- Petzinger, G. M. Reliability and validity of a new global dyskinesia rating scale in the MPTP-lesioned non-human primate. Movement Disorders. 16 (2), 202-207 (2001).
- Fox, S. H., Johnston, T. H., Li, Q., Brotchie, J., Bezard, E. A critique of available scales and presentation of the Non-Human Primate Dyskinesia Rating Scale. Movement Disorders. 27 (11), 1373-1378 (2012).
- Cenci, M. A., Ohlin, K. E. Rodent models of treatment-induced motor complications in Parkinson's disease. Parkinsonism & Related Disorders. 15, 13-17 (2009).
- Cenci, M. A., Whishaw, I. Q., Schallert, T. Animal models of neurological deficits: how relevant is the rat. Nature Reviews: Neuroscience. 3 (7), 574-579 (2002).
- Zhang, Y., et al. Aberrant restoration of spines and their synapses in L-DOPA-induced dyskinesia: involvement of corticostriatal but not thalamostriatal synapses. Journal of Neuroscience. 33 (28), 11655-11667 (2013).
- Konradi, C., et al. Transcriptome analysis in a rat model of L-DOPA-induced dyskinesia. Neurobiology of Disease. 17 (2), 219-236 (2004).
- Morin, N., Jourdain, V. A., Di Paolo, T. Modeling dyskinesia in animal models of Parkinson disease. Experimental Neurology. 256, 105-116 (2014).
- Cenci, M. A., Riggare, S., Pahwa, R., Eidelberg, D., Hauser, R. A. Dyskinesia matters. Movement Disorders. 35 (3), 392-396 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved