Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Induktion und Bewertung von Levodopa-induzierten Dyskinesien in einem Rattenmodell der Parkinson-Krankheit
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt Methoden zur Induktion und Bewertung von Levodopa-induzierten Dyskinesien in einem Rattenmodell der Parkinson-Krankheit. Das Protokoll bietet detaillierte Informationen über die Intensität und Häufigkeit einer Reihe von dyskinetischen Verhaltensweisen, sowohl dystonisch als auch hyperkinetisch, und bietet ein zuverlässiges Werkzeug zum Testen von Behandlungen, die auf diesen ungedeckten medizinischen Bedarf abzielen.
Zusammenfassung
Levodopa (L-DOPA) bleibt die Goldstandard-Therapie zur Behandlung der motorischen Symptome der Parkinson-Krankheit (PD). Unerwünschte unwillkürliche Bewegungen, die als L-DOPA-induzierte Dyskinesien (LIDs) bekannt sind, entwickeln sich jedoch bei längerem Gebrauch dieses Dopaminvorläufers. Es wird geschätzt, dass die Inzidenz von LIDs innerhalb von 10-15 Jahren nach der Behandlung auf etwa 90% der Personen mit Parkinson eskaliert. Das Verständnis der Mechanismen dieser Krankheit und die Entwicklung sowohl neuartiger als auch wirksamer Anti-Dyskinesie-Behandlungen erfordert eine konsistente und genaue Modellierung für präklinische Tests therapeutischer Interventionen. Eine detaillierte Methode zur zuverlässigen Induktion und umfassenden Bewertung von LIDs nach 6-OHDA-induzierter nigraler Läsion in einem Rattenmodell von PD wird hier vorgestellt. Die zuverlässige LID-Bewertung bei Ratten bietet ein leistungsfähiges Werkzeug, das in allen Labors eingesetzt werden kann, um neue Therapien zu testen, die sich auf die Verringerung oder Beseitigung dieser häufigen behandlungsinduzierten Belastung für Personen mit Parkinson konzentrieren.
Einleitung
Obwohl es mehr als 50 Jahre her ist, seit Levodopa (L-DOPA) zum ersten Mal als Behandlung für Personen mit PD1,2 eingeführt wurde, bleibt es bemerkenswerterweise die effektivste Therapie für parkinsonische motorische Symptome. Die mit PD assoziierten klinischen motorischen Symptome stammen aus dem Verlust von Dopamin (DA) -Neuronen in der Substantia nigra (SN) Pars compacta, was zu einer dramatischen Abnahme des verfügbaren Dopamins im Striatum führt. L-DOPA stellt die striatalen DA-Spiegel effektiv wieder her, was zu einem motorischen Nutzen zu einem frühen Zeitpunkt der Erkrankungführt 3,4. Unpassenderweise entwickeln die meisten Menschen mit PD bei Langzeitbehandlung L-DOPA-induzierte Dyskinesien (LID), einschließlich Chorea, Dystonie und Athetose, die sich oft erheblich auf die Aktivitäten des täglichen Lebensauswirken 5,6,7.
Während mehrere Verhaltensmodelle von LID bei Nagetieren existieren, haben Unterschiede in der Modellierung und Verhaltensbewertung von LIDs die Reproduzierbarkeit der Ergebnisse zwischen Labors sowie die Zuverlässigkeit dieser experimentellen Werkzeuge für die präklinische PD-Forschung in Frage gestellt. Das aktuelle Protokoll, das in Zusammenarbeit mit einem Spezialisten für klinische Bewegungsstörungen8 entwickelt wurde, ist eine einfache Methode für die LID-Induktion und -Bewertung und eignet sich für die Verwendung in einem Rattenmodell von PD unter Verwendung von 6-Hydroxydopamin (6-OHDA)-induzierter einseitiger nigraler Läsion 9,10. Die hier bereitgestellte LID-Bewertungsskala umfasst sowohl die Intensität als auch die Häufigkeit des dyskinetischen Verhaltens in verschiedenen einzelnen Körperteilen. Einschlägige Informationen zur Workflow-Optimierung von Experimenten und zur sachgerechten Pflege und Handhabung von Parkinson- und dyskinetischen Tieren werden ebenfalls bereitgestellt.
Protokoll
Die hier vorgestellten Tiere wurden in Übereinstimmung mit den institutionellen Richtlinien gepflegt und behandelt. Alle Tierverfahren wurden vom Michigan State University Institutional Animal Care and Use Committee (IACUC) in Übereinstimmung mit den Bundes- und Landesvorschriften genehmigt.
1. Arzneimittelfreie Bestätigung des 6-OHDA-Läsionsstatus
- Haltungsschwanz Hang Test11,12,13
HINWEIS: Beurteilen Sie den Läsionsstatus mindestens 1 Woche nach der 6-OHDA-Läsionsinduktion (siehe 9,10,35 für Details zur Läsion) bei Versuchspersonen (z. B. männlich oder weiblich, erwachsene Sprague Dawley oder Fisher 344 Ratten).- Hängen Sie die Ratte etwa 6 cm über ihrem Käfig auf und halten Sie sie fest an der Basis des Schwanzes, für ~ 5 s.
- Notieren Sie die Richtung der Körperverrenkung als + für eine erfolgreich läsionierte Tierverdrehung kontralateral zur läsionierten Seite und - für das Fehlen von Verdrehung oder Verdrehung in beide Richtungen.
- HINWEIS: Diese Tests sind optional, werden aber empfohlen. Siehe14,15,16,17 für weitere drogenfreie Testoptionen/-variationen.
- Schritteinstellungs-Schlepptest (angepasst ab16)
HINWEIS: Beurteilen Sie den Läsionsstatus mindestens 1 Woche nach einseitiger 6-OHDA-Läsionsinduktion bei Versuchspersonen (z. B. männlich oder weiblich, erwachsene Sprague Dawley oder Fisher 344 Ratten).- Halten Sie die Ratte an der Basis ihres Schwanzes und heben Sie die Hinterfüße um ~ 6 cm von der Oberfläche ab; Ziehen Sie rückwärts über eine flache, glatte, aber nicht rutschige Oberfläche, ~ 75 cm, über 5-10 s.
- Beobachten und zeichnen Sie die Anzahl der Klopf- / Schrittanpassungsbewegungen jeder Vorderpfote über drei wiederholte Tests auf.
- Bewerten Sie das Subjekt als + für eine erfolgreiche einseitige Läsion, wenn 0-2 Vorderpfoten-Taps kontralateral zur läsionierten Seite beobachtet werden, zusammen mit schnellem Klopfen (~ 10 Taps) von der Vorderpfote ipsilateral zur läsionierten Seite (z. B. zeigen Tiere, die einseitig auf der linken Seite läsioniert sind, ein Klopfdefizit (0-2 Taps) mit der kontralateralen rechten Vorderpfote).
- Umgekehrt erhalten Sie ein moderates bis schnelles Klopfen (5-10 Taps) von beiden Vorderpfoten als - um einen unvollständigen oder unbekannten Läsionsstatus anzuzeigen.
HINWEIS: Ein ängstliches Tier kann auch bei erfolgreicher Läsion ein schnelles Klopfen / Stufenanpassung zeigen. Wenn dies vermutet wird, legen Sie die Ratte zurück in ihren Hauskäfig und testen Sie ≥ 30 Minuten später erneut.
2. Herstellung von Reagenzien und Verbrauchsmaterialien
- Bestimmung der L-3,4-Dihydroxyphenylalaninmethylesterhydrochlorid (Levodopa oder L-DOPA) und des Benserazidhydrochlorids, eines peripheren Decarboxylaseinhibitors (siehe Materialverzeichnis), der Dosis, der Ratinghäufigkeit und des experimentellen Zeitplans, der für die Prüffrage12,18,19,20 angemessen ist (Abbildung 1).
HINWEIS: Prüffragen können gestellt werden, um eine beliebige Anzahl von Fragen zu stellen, die von der Frage reichen, ob eine bestimmte Therapie das bestehende LID reduzieren oder die Induktion von LID verhindern könnte. Sie können auch untersuchen, ob die therapeutische Wirksamkeit von der Dosis von Levodopa abhängt oder ob die LID-Expression und / oder die therapeutische Wirksamkeit je nach Geschlecht, Spezies und Alter des Probanden variieren.
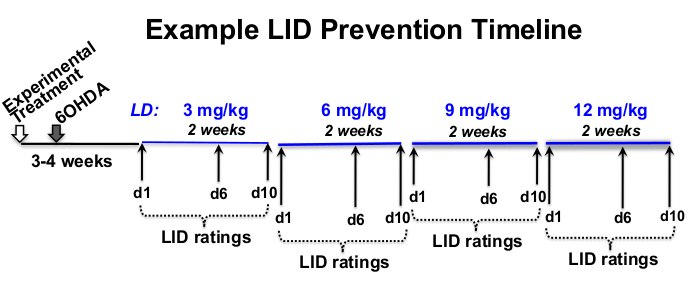
Abbildung 1: Beispiel für einen Behandlungszeitplan. Beispiel L-DOPA-Dosiseskalationszeitleiste von insgesamt 12 Wochen, wobei 8 Wochen L-DOPA-Injektionen 3 Wochen nach 6-OHDA-Läsion und 4 Wochen nach experimenteller Behandlung beginnen. In diesem Beispiel wird L-DOPA subkutan 5x pro Woche (Montag bis Freitag) ungefähr zur gleichen Tageszeit für 2 Wochen bei jeder verschriebenen L-DOPA-Dosis (3, 6, 9 und 12 mg / kg) injiziert. Verhaltens-LID-Bewertungen finden an den Tagen 1, 6 und 10 jeder L-DOPA-Dosierungsstufe statt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Wiegen Sie die Ratten wöchentlich, um die geeignete Arzneimittelmenge basierend auf den laufenden Gewichtsänderungen während der Studie zu berechnen.
HINWEIS: Aufgrund der erhöhten Aktivität bei LID+-Ratten besteht die Möglichkeit einer Gewichtsabnahme mit langfristigen L-DOPA-Behandlungen. Wenn Gewichtsverlust auftritt, versorgen Sie Ratten nach L-DOPA-Injektionen mit ernährungsphysiologisch vollständigen, sehr schmackhaften Leckereien (siehe Materialtabelle). - Berechnen Sie die Menge an L-DOPA und Benserazid, die für jede wöchentliche Konzentration benötigt wird, wiegen Sie lyophilisierte Aliquots für jeden Injektionstag aus und lagern Sie in Kombination für 1-2 Wochen bei -20 ° C in bernsteinfarbenen Glasfläschchen bis zum Tag der Behandlung.
HINWEIS: Die Zieldosis beträgt 12 mg/kg oder 12 mg L-DOPA/1000 g Körpergewicht. Ein Beispiel für Berechnungen zur Bestimmung der Menge an L-DOPA und Kochsalzlösung, die für jeden Wochentag benötigt wird, unter Verwendung von 12 mg L-DOPA/kg Körpergewicht bei einem Injektionsvolumen von 1 cc/kg Rattengewicht ist in der Ergänzungsdatei 1 enthalten.
3. Einrichtung von Raum und Käfig
- Am ersten Tag der L-DOPA-Behandlung 3-4 Wochen nach der 6-OHDA-Läsionsoperation werden die Ratten in ein einzelnes Gehäuse verlegt, einschließlich der IACUC-zugelassenen Anreicherung.
- Pflegen Sie während der gesamten Studie in einem einzigen Gehäuse, um Störungen durch Gleichaltrige bei Verhaltensbewertungen zu vermeiden.
- Stellen Sie an LID-Bewertungstagen die Hauskäfige auf ein Stahldrahtgestell, das in einem Winkel von etwa 45 ° gedreht ist, um die Ratte optimal zu betrachten (Abbildung 2A). Drehen Sie die Identifikationsetiketten (Abbildung 2B) nach oben und entfernen Sie Wasserflaschen, Lebensmittelregale und alle Arten der Anreicherung im Käfig (Abbildung 2C), um Interferenzen mit Verhaltensbewertungen zu vermeiden.

Abbildung 2: Beispiel für den Käfig, der für LID-Ratings großer Rattenexperimente eingerichtet wurde. (A) Mehrere Käfige können für die LID-Bewertung mit großen Metallgestellen eingerichtet werden, die eine optimale Betrachtung jedes Tieres ermöglichen. Die Käfige sollten in einem Winkel von 45 ° auseinander gespreizt werden, wobei die Ausweise nach oben gedreht werden (B), Futter, Wasserflaschen, Nistmaterial und andere Anreicherungen entfernt werden, um die visuelle Dunkelheit der Ratte und die Ablenkung der Ratte zu begrenzen, während das dyskinetische Verhalten untersucht wird (C). Die Metallgestelle müssen einige Meter von jeder Wand entfernt sein, damit der Bewerter die Ratte bei Bedarf an der Vorder- oder Rückseite des Käfigs untersuchen kann. Es ist wichtig, Anreicherungsapparate (z.B. C-rote Ratten-Exerzitienhäuser) mit individuellen Tierausweisen zu kennzeichnen, um sie in demselben Käfig zu ersetzen, aus dem sie kamen. Dies ist besonders wichtig, wenn Tiere unterschiedlichen Geschlechts verwendet werden, um den Stress für die Versuchspersonen nicht zu erhöhen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Levodopa-Injektionen und Dyskinesie-Bewertung
- Subkutane Injektionen von L-DOPA21,22
- Unmittelbar vor der täglichen Injektion von L-DOPA wird das entsprechende Volumen steriler Kochsalzlösung in die vorgewogene lyophilisierte L-DOPA- und Benserazidmischung in der bernsteinfarbenen Durchstechflasche gegeben und 10 s gut schüttelt (Schritt 2.3).
HINWEIS: Das angestrebte Injektionsvolumen beträgt 1 ml/1000 g Körpergewicht (mit 12 mg L-DOPA pro ml). Das Volumen der sterilen Kochsalzlösung hängt von der Anzahl der Tiere pro Studie ab. - Füllen Sie einzelne Spritzen (z. B. 1,0 oder 0,5 ml mit 26 G Nadel) mit dem erforderlichen Volumen für jedes Tier (1 ml/kg Rattengewicht) und kennzeichnen Sie jede Spritze mit einer individuellen Tierkennzeichnung.
HINWEIS: Bewahren Sie die gefüllten Spritzen bis zum Zeitpunkt der Injektion lichtgeschützt in sterilen Beuteln auf. L-DOPA oxidiert schnell in Gegenwart von Sauerstoff und Licht in einer wässrigen Umgebung23,24,25,26. - Bringen Sie den ersten Käfig auf die Injektionsbank.
- Entfernen Sie die Ratte aus ihrem Käfig und legen Sie sie auf die Injektionsoberfläche.
- Halten Sie den Kopf und die Schultern vorsichtig an die Oberfläche zurück, auf der die Ratte mit der Handfläche der nicht dominanten Hand ruht.
- Schäumen Sie vorsichtig die Haut auf dem Rücken, der die Schulterblätter überzieht, mit Daumen und Zeigefinger der nicht dominanten Hand, injizieren Sie L-DOPA-Volumen mit der dominanten Hand in den subkutanen Raum zwischen / unter den Fingern und halten Sie die Nadel so parallel wie möglich zum Körper, um eine intramuskuläre Injektion zu vermeiden.
HINWEIS: Die Ratten werden vor der Injektion nicht betäubt. - Entsorgen Sie jede gebrauchte einzelne Spritze in einem scharfen Behälter.
- Ersetzen Sie die Ratte in ihrem individuellen Käfig und fügen Sie ernährungsphysiologisch vollständige Leckereien hinzu, außer an LID-Bewertungstagen, um Interferenzen mit Verhaltensbewertungen zu vermeiden, bis die Bewertungen abgeschlossen sind.
- Stellen Sie den Timer auf 1–2 Minuten ein, abhängig von der gewünschten Einstufungszeit und der Anzahl der Ratten in der Studie an Bewertungstagen. Holen Sie sich den nächsten Käfig und injizieren Sie die nächste Ratte, wenn der Timer dies anzeigt.
- Wiederholen Sie dies und injizieren Sie alle 1-2 Minuten eine Ratte, bis alle Ratten injiziert sind.
- Unmittelbar vor der täglichen Injektion von L-DOPA wird das entsprechende Volumen steriler Kochsalzlösung in die vorgewogene lyophilisierte L-DOPA- und Benserazidmischung in der bernsteinfarbenen Durchstechflasche gegeben und 10 s gut schüttelt (Schritt 2.3).
- Levodopa-induzierte Dyskinesie-Bewertung nach der Injektion
- Bewerten Sie die Intensität (Tabelle 1) und Häufigkeit (Tabelle 2) von dytonischen und hyperkinetischen Dyskinesiebewegungen an der gewünschten Anzahl von Zeitpunkten, die den anfänglichen Beginn des LID-Verhaltens, das Spitzenverhalten und die Phase des Rückgangs umfassen sollten (siehe Ergänzende Datei 2 für ein Beispiel für ein LID-Bewertungsprotokollblatt).
- Für männliche und weibliche erwachsene Sprague Dawley oder Fisher 344 Ratten und eine Stichprobengröße von N = 40 Ratten beginnen die Dyskinesie-Bewertungen 20 Minuten nach der ersten L-DOPA-Injektion und dann in 50-minütigen Intervallen bis 220 oder 270 min nach der Injektion, je nachdem, wann das LID-Verhalten bei 90% -100% der Ratten abgebrochen wurde.
- Wenn Sie 1-minütige Bewertungsintervalle verwenden, stellen Sie einen Timer auf 1 Minute ein. Bewerten Sie die erste Ratte für eine Minute. Gehen Sie zur nächsten Ratte und bewerten Sie sie für 1 Minute. Fahren Sie mit allen Ratten fort, Bewertung für 1-minütige Intervalle.
- Lassen Sie einen Timer sichtbar neben dem Käfig positionieren, so dass die LID-Verhaltensintensität (Tabelle 1) beobachtet werden kann, während die Häufigkeit eines bestimmten Verhaltens (Tabelle 2) während des Bewertungszeitraums geschätzt wird.
- Nachdem die Bewertungen für den ersten Zeitpunkt abgeschlossen sind, beginnen Sie am nächsten Zeitpunkt (z. B. 70 Minuten nach der Injektion) erneut mit der ersten Ratte und fahren Sie im gewünschten Intervall (z. B. alle 50 Minuten) fort, bis alle Zeitpunkte abgeschlossen sind.
HINWEIS: Aufgrund der Überschneidung von L-DOPA-Injektions- und LID-Rating-Aufgaben werden an den Rating-Tagen zwei Personen benötigt, eine für die Injektion und eine für die Verhaltensbewertung.
Ergebnisse
LIDs bei Parkinson-Ratten können sich als eine Reihe von abnormalen unwillkürlichen Bewegungen (AIMs) manifestieren, einschließlich dystonischer, hyperkinetischer und stereotyper Verhaltensweisen. LID-Bewertungskriterien für solche Verhaltensweisen werden hier vorgestellt, um sowohl die Intensität (Tabelle 1) als auch die Häufigkeit (Tabelle 2) zu umfassen. Dies liefert einen Gesamtwert für den LID-Schweregrad für jede Ratte, der sowohl die Qualität (Intensität) als auch die Qu...
Diskussion
Hier werden Details zur reproduzierbaren Induktion und Bewertung von LIDs in einem Parkinson-Rattenmodell nach einseitiger 6-OHDA-Läsion des nigrostriatalen DA-Systems vorgestellt. Während einst angenommen wurde, dass Nagetiere kein LID entwickelt haben und dass Rotationsasymmetrie das Analogon von LID bei Ratten31 sein könnte, wurden Ratten- und Mausmodelle in den letzten zwei Jahrzehnten charakterisiert und sind ein gut akzeptiertes Werkzeug für die LID-Forschung 15,32,33,34.
Offenlegungen
Es wurden keine Interessenkonflikte gemeldet.
Danksagungen
Wir möchten die Kämpfe aller Menschen mit Parkinson-Krankheit und die Stärke und Widerstandsfähigkeit, die sie jeden Tag zeigen, anerkennen, insbesondere des geliebten Vaters von KSC, Mark Steece. Die hier vertretene Arbeit wurde vom National Institute of Neurological Disorders and Stroke (NS090107, NS110398) und dem Parkinson Disease Foundation International Research Grant Program, jetzt Parkinson Foundation, unterstützt. Wir danken auch Molly VanderWerp für ihre hervorragende redaktionelle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 Minutes Digital Timer | Staples | 1111764 | |
| Compass CX Compact Scale | Ohaus | 30428202 | |
| 5-(2-aminoethyl)-1,2,4-benzenetriol, monohydrobromide | Cayman Chemicals | 25330 | 6-OHDA is a catecholaminergic neurotoxin that is used to induce dopaminergic lesions and parkinsonian symptoms in rodents. |
| Allentown cages | Allentown, LLC | Rat900 | Allentown cages provide the ability to view the rats from all sides. |
| BD Allergist Trays with Permanently Attached Needle | BD | BD 305540 | For subcutaneous L-DOPA injections |
| Benserazide hydrochloride | Sigma-Aldrich | B7283 | Benserazide is a peripheral decarboxylase inhibitor used with L-DOPA to to induce dyskinesia in rodent models of PD. |
| Glass amber scintillation vials | Thermo Scientific | B7921 | Used for storage of L-DOPA/benserazide at -20 °C until mixed with sterile saline. |
| L-3,4-Dihydroxyphenylalanine methyl ester hydrochloride | Sigma-Aldrich | D1507 | L-3,4-Dihydroxyphenylalanine methyl ester is a precursor to L-DOPA that crosses the blood-brain barrierand use to treat parkinsonian symptoms in rodents. |
| Paper Mate Sharpwriter Mechanical Pencils | Staples | 107250 | |
| Rodent nutritionally complete enrichment treats | Bio-Serv | F05478 | |
| Round Ice Bucket with Lid, 2.5 L | Corning | 432129 | |
| Standard Plastic Clipboard | Staples | 1227770 | |
| Steel wired 6' long movable shelving units | Uline | H9488 | Width/Height can be adjusted to need/number of rats per experiment |
| Sterile Saline 0.9% | Covidien/Argyle | 1020 | For mixing with L-DOPA/benserazide prior to subcutaneous injections. |
Referenzen
- Cotzias, G. C., Papavasiliou, P. S., Gellene, R. L-dopa in parkinson's syndrome. New England Journal of Medicine. 281, 272 (1969).
- Yahr, M. D., Duvoisin, R. C., Schear, M. J., Barrett, R. E., Hoehn, M. M. Treatment of parkinsonism with levodopa. Archives of Neurology. 21 (4), 343-354 (1969).
- Bastide, M. F., et al. Pathophysiology of L-dopa-induced motor and non-motor complications in Parkinson's disease. Progress in Neurobiology. 132, 96-168 (2015).
- Sellnow, R. C., et al. Regulation of dopamine neurotransmission from serotonergic neurons by ectopic expression of the dopamine D2 autoreceptor blocks levodopa-induced dyskinesia. Acta Neuropathologica Communications. 7 (1), 8 (2019).
- Bastide, M. F., Bezard, E. L-dopa induced dyskinesia in Parkinson's disease]. Bulletin de l'Académie Nationale de Médecine. 199 (2-3), 201-212 (2015).
- Hauser, R. A., et al. ADS-5102 (Amantadine) extended-release capsules for levodopa-induced dyskinesia in Parkinson's Disease (EASE LID 2 study): Interim results of an open-label safety study. Journal of Parkinson's Disease. 7 (3), 511-522 (2017).
- Huot, P., Johnston, T. H., Koprich, J. B., Fox, S. H., Brotchie, J. M. The pharmacology of L-DOPA-induced dyskinesia in Parkinson's disease. Pharmacological Reviews. 65 (1), 171-222 (2013).
- Steece-Collier, K., et al. Embryonic mesencephalic grafts increase levodopa-induced forelimb hyperkinesia in parkinsonian rats. Movement Disorders. 18 (12), 1442-1454 (2003).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments. (60), e3234 (2012).
- Simola, N., Morelli, M., Carta, A. R. The 6-hydroxydopamine model of Parkinson's disease. Neurotoxicity Research. 11 (3-4), 151-167 (2007).
- Borlongan, C. V., Hida, H., Nishino, H. Early assessment of motor dysfunctions aids in successful occlusion of the middle cerebral artery. Neuroreport. 9 (16), 3615-3621 (1998).
- Fleming, S. M. Behavioral outcome measures for the assessment of sensorimotor function in animal models of movement disorders. International Review of Neurobiology. 89, 57-65 (2009).
- Borlongan, C. V., Sanberg, P. R. Elevated body swing test: a new behavioral parameter for rats with 6-hydroxydopamine-induced hemiparkinsonism. Journal of Neuroscience. 15 (7), 5372-5378 (1995).
- Chang, J. W., Wachtel, S. R., Young, D., Kang, U. J. Biochemical and anatomical characterization of forepaw adjusting steps in rat models of Parkinson's disease: studies on medial forebrain bundle and striatal lesions. Neuroscience. 88 (2), 617-628 (1999).
- Lundblad, M., et al. Pharmacological validation of behavioural measures of akinesia and dyskinesia in a rat model of Parkinson's disease. European Journal of Neuroscience. 15 (1), 120-132 (2002).
- Olsson, M., Nikkhah, G., Bentlage, C., Bjorklund, A. Forelimb akinesia in the rat Parkinson model: differential effects of dopamine agonists and nigral transplants as assessed by a new stepping test. Journal of Neuroscience. 15 (5), 3863-3875 (1995).
- Monville, C., Torres, E. M., Dunnett, S. B. Comparison of incremental and accelerating protocols of the rotarod test for the assessment of motor deficits in the 6-OHDA model. Journal of Neuroscience Methods. 158 (2), 219-223 (2006).
- Steece-Collier, K., et al. Striatal Nurr1, but not FosB expression links a levodopa-induced dyskinesia phenotype to genotype in Fisher 344 vs. Lewis hemiparkinsonian rats. Experimental Neurology. 330, 113327 (2020).
- Steece-Collier, K., et al. Genetic silencing of striatal CaV1.3 prevents and ameliorates levodopa dyskinesia. Movement Disorders. 34 (5), 697-707 (2019).
- Tayarani-Binazir, K. A., Jackson, M. J., Strang, I., Jairaj, M., Rose, S., Jenner, P. Benserazide dosing regimen affects the response to L-3,4-dihydroxyphenylalanine in the 6-hydroxydopamine-lesioned rat. Behavioral Pharmacology. 23 (2), 126-133 (2012).
- Lindgren, H. S., Rylander, D., Ohlin, K. E., Lundblad, M., Cenci, M. A. The "motor complication syndrome" in rats with 6-OHDA lesions treated chronically with L-DOPA: relation to dose and route of administration. Behavioural Brain Research. 177 (1), 150-159 (2007).
- Suckow, M. A., Stevens, K. A., Wilson, R. P. . American College of Laboratory Animal Medicine series xvii. , 1268 (2012).
- Zhou, Y. Z., Alany, R. G., Chuang, V., Wen, J. Studies of the Rate Constant of l-DOPA Oxidation and Decarboxylation by HPLC. Chromatographia. 75, 597-606 (2012).
- Stroomer, A. E., Overmars, H., Abeling, N. G., van Gennip, A. H. Simultaneous determination of acidic 3,4-dihydroxyphenylalanine metabolites and 5-hydroxyindole-3-acetic acid in urine by high-performance liquid chromatography. Clinical Chemistry. 36 (10), 1834-1837 (1990).
- . PubChem Compound Summary for CID 6047, Levodopa Available from: https://pubchem.ncbi.nlm.nih.gov/compound/Levodopa (2021)
- Merck. . The Merck Index 13th edn. , (2021).
- Ortner, N. J., et al. Lower affinity of isradipine for L-Type Ca(2+) channels during substantia nigra dopamine neuron-like activity: Implications for neuroprotection in Parkinson's Disease. Journal of Neuroscience. 37 (228), 6761-6777 (2017).
- Hazra, A., Gogtay, N. Biostatistics series module 3: Comparing groups: Numerical variables. Indian Journal of Dermatology. 61 (3), 251-260 (2016).
- Mishra, P., Pandey, C. M., Singh, U., Keshri, A., Sabaretnam, M. Selection of appropriate statistical methods for data analysis. Annals of Cardiac Anaesthesia. 22 (3), 297-301 (2019).
- Divito, C. B., et al. Loss of VGLUT3 produces circadian-dependent hyperdopaminergia and ameliorates motor dysfunction and l-Dopa-Mediated dyskinesias in a model of Parkinson's Disease. Journal of Neuroscience. 35 (45), 14983-14999 (2015).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of enhanced behavioral responses to L-DOPA following repeated administration in the 6-hydroxydopamine-lesioned rat model of Parkinson's disease. Experimental Neurology. 151 (2), 334-342 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiology of Disease. 6 (6), 461-474 (1999).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. European Journal of Neuroscience. 10 (8), 2694-2706 (1998).
- Dekundy, A., Lundblad, M., Danysz, W., Cenci, M. A. Modulation of L-DOPA-induced abnormal involuntary movements by clinically tested compounds: further validation of the rat dyskinesia model. Behavioural Brain Research. 179 (1), 76-89 (2007).
- Collier, T. J., et al. Interrogating the aged striatum: robust survival of grafted dopamine neurons in aging rats produces inferior behavioral recovery and evidence of impaired integration. Neurobiology of Disease. 77, 191-203 (2015).
- Maries, E., et al. Focal not widespread grafts induce novel dyskinetic behavior in parkinsonian rats. Neurobiology of Disease. 21 (1), 165-180 (2006).
- Mercado, N. M., et al. The BDNF Val66Met polymorphism (rs6265) enhances dopamine neuron graft efficacy and side-effect liability in rs6265 knock-in rats. Neurobiology of Disease. 148, 105175 (2021).
- Cenci, M. A., Crossman, A. R. Animal models of l-dopa-induced dyskinesia in Parkinson's disease. Movement Disorders. 33 (6), 889-899 (2018).
- Lindenbach, D. Behavioral and cellular modulation of L-DOPA-induced dyskinesia by beta-adrenoceptor blockade in the 6-hydroxydopamine-lesioned rat. Journal of Pharmacology and Experimental Therapeutics. 337 (3), 755-765 (2011).
- Petzinger, G. M. Reliability and validity of a new global dyskinesia rating scale in the MPTP-lesioned non-human primate. Movement Disorders. 16 (2), 202-207 (2001).
- Fox, S. H., Johnston, T. H., Li, Q., Brotchie, J., Bezard, E. A critique of available scales and presentation of the Non-Human Primate Dyskinesia Rating Scale. Movement Disorders. 27 (11), 1373-1378 (2012).
- Cenci, M. A., Ohlin, K. E. Rodent models of treatment-induced motor complications in Parkinson's disease. Parkinsonism & Related Disorders. 15, 13-17 (2009).
- Cenci, M. A., Whishaw, I. Q., Schallert, T. Animal models of neurological deficits: how relevant is the rat. Nature Reviews: Neuroscience. 3 (7), 574-579 (2002).
- Zhang, Y., et al. Aberrant restoration of spines and their synapses in L-DOPA-induced dyskinesia: involvement of corticostriatal but not thalamostriatal synapses. Journal of Neuroscience. 33 (28), 11655-11667 (2013).
- Konradi, C., et al. Transcriptome analysis in a rat model of L-DOPA-induced dyskinesia. Neurobiology of Disease. 17 (2), 219-236 (2004).
- Morin, N., Jourdain, V. A., Di Paolo, T. Modeling dyskinesia in animal models of Parkinson disease. Experimental Neurology. 256, 105-116 (2014).
- Cenci, M. A., Riggare, S., Pahwa, R., Eidelberg, D., Hauser, R. A. Dyskinesia matters. Movement Disorders. 35 (3), 392-396 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten