Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Индукция и оценка дискинезий, вызванных леводопой, в крысиной модели болезни Паркинсона
В этой статье
Резюме
В этой статье описываются методы индуцирования и оценки дискинезий, вызванных леводопой, на крысиной модели болезни Паркинсона. Протокол предлагает подробную информацию об интенсивности и частоте диапазона дискинетического поведения, как дистонического, так и гиперкинетического, обеспечивая надежный инструмент для тестирования методов лечения, направленных на эту неудовлетворенную медицинскую потребность.
Аннотация
Леводопа (L-DOPA) остается золотым стандартом терапии, используемой для лечения двигательных симптомов болезни Паркинсона (БП). Однако нежелательные непроизвольные движения, известные как L-DOPA-индуцированные дискинезии (LIDs), развиваются при длительном использовании этого предшественника дофамина. По оценкам, заболеваемость LID возрастает примерно до 90% людей с БП в течение 10-15 лет лечения. Понимание механизмов этого заболевания и разработка как новых, так и эффективных методов лечения антидискинезии требует последовательного и точного моделирования для доклинического тестирования терапевтических вмешательств. Здесь представлен подробный метод надежной индукции и всесторонней оценки ЛИД после 6-OHDA-индуцированного нигрального поражения на крысиной модели БП. Надежная оценка LID на крысах обеспечивает мощный инструмент, который может быть легко использован в лабораториях для тестирования новых методов лечения, ориентированных на снижение или устранение этого общего бремени, вызванного лечением, для людей с БП.
Введение
Хотя прошло более 50 лет с тех пор, как леводопа (L-DOPA) была впервые введена в качестве лечения для людей с БП 1,2, она удивительно остается наиболее эффективной терапией двигательных симптомов паркинсонизма. Клинические двигательные симптомы, связанные с БП, связаны с потерей дофаминовых (DA) нейронов в черной субстанции (SN) pars compacta, что приводит к резкому снижению доступного дофамина в полосатом теле. L-DOPA эффективно восстанавливает стриатальный уровень DA, что приводит к двигательной пользе на ранних стадиях заболевания 3,4. Некстати, при длительном лечении у большинства людей с БП развиваются дискинезии, вызванные L-DOPA (LID), включая хорею, дистонию и атетоз, которые часто значительно влияют на повседневную деятельность 5,6,7.
Хотя существует несколько поведенческих моделей LID у грызунов, различия в моделировании и поведенческой оценке LID поставили под сомнение воспроизводимость результатов между лабораториями, а также надежность этих экспериментальных инструментов для доклинических исследований БП. Разработанный совместно со специалистом по клиническим двигательным расстройствам8, текущий протокол является простым методом индукции и рейтинга LID и подходит для использования в крысиной модели БП с использованием 6-гидроксидотамина (6-OHDA), индуцированного односторонним нигральным поражением 9,10. Шкала оценки LID, представленная здесь, включает оценку как интенсивности, так и частоты дискинетического поведения в различных отдельных частях тела. Также предоставляется соответствующая информация об оптимизации рабочего процесса экспериментов и надлежащем уходе и обращении с паркинсоническими и дискинетическими животными.
протокол
Животные, представленные здесь, содержались и обрабатывались в соответствии с институциональными руководящими принципами. Все процедуры для животных были одобрены Комитетом по институциональному уходу и использованию животных Мичиганского государственного университета (IACUC) в соответствии с федеральными и государственными правилами.
1. Безмедикаментозное подтверждение статуса поражения 6-OHDA
- Тест на повешение постурального хвоста 11,12,13
ПРИМЕЧАНИЕ: Оцените статус поражения по крайней мере через 1 неделю после индукции поражения 6-OHDA (см. 9,10,35 для получения подробной информации о поражении) у экспериментальных субъектов (например, самца или женщины, взрослых Крыс Sprague Dawley или Fisher 344).- Подвешивайте крысу примерно на 6 см выше своей клетки, крепко держась у основания хвоста, в течение ~5 с.
- Запишите направление искривления тела как + для успешно пораженного животного, скручивание контралатерально к пораженной стороне и - за отсутствие скручивания или скручивания в обе стороны.
- ПРИМЕЧАНИЕ: Эти тесты являются необязательными, но рекомендуются. Смотрите 14,15,16,17 для дополнительных вариантов / вариаций тестирования без наркотиков.
- Тест перетаскивания с регулировкой шага (адаптирован из16)
ПРИМЕЧАНИЕ: Оцените статус поражения по крайней мере через 1 неделю после односторонней индукции поражения 6-OHDA у экспериментальных субъектов (например, самцов или самок, взрослых крыс Sprague Dawley или Fisher 344).- Держите крысу за основание ее хвоста, поднимая задние лапы от поверхности на ~6 см; перетащите назад по ровной, гладкой, но не скользкой поверхности, ~75 см, более 5–10 с.
- Наблюдайте и записывайте количество движений постукивания/шага регулировки каждой передней лапы в течение трех повторных тестов.
- Оцените испытуемого как + для успешного одностороннего поражения, когда 0-2 постукивания передней лапы наблюдаются контралатерально к пораженной стороне, вместе с быстрым постукиванием (~ 10 постукиваний) от ипсилатеральной передней лапы к пораженной стороне (например, животные, в одностороннем порядке пораженные с левой стороны, демонстрируют дефицит постукивания (0-2 постукивания) с контралатеральной правой передней лапой).
- И наоборот, оцените умеренное или быстрое постукивание (5–10 постукиваний) от обеих передних лап как - для указания неполного или неизвестного статуса поражения.
ПРИМЕЧАНИЕ: Тревожное животное может показать быстрое постукивание / регулировку шага, даже если оно успешно повреждено. Если это подозревается, поместите крысу обратно в домашнюю клетку и повторно протестируйте ≥30 минут спустя.
2. Подготовка реагентов и расходных материалов
- Определяют L-3,4-дигидроксифенилаланина метиловый эфир гидрохлорид (леводопа или L-ДОФА) и бенсеразида гидрохлорид, дозу периферического ингибитора декарбоксилазы (см. Таблицу материалов), номинальную частоту и экспериментальную временную шкалу, подходящую для исследуемого вопроса 12,18,19,20 (рисунок 1).
ПРИМЕЧАНИЕ: Исследуемые вопросы могут быть поставлены для поиска любого количества вопросов, начиная от вопроса о том, может ли конкретная терапия уменьшить существующую LID или предотвратить индукцию LID. Они также могут изучить, зависит ли терапевтическая эффективность от дозы леводопы или экспрессия LID и / или терапевтическая эффективность варьируется в зависимости от пола, вида и возраста субъекта.
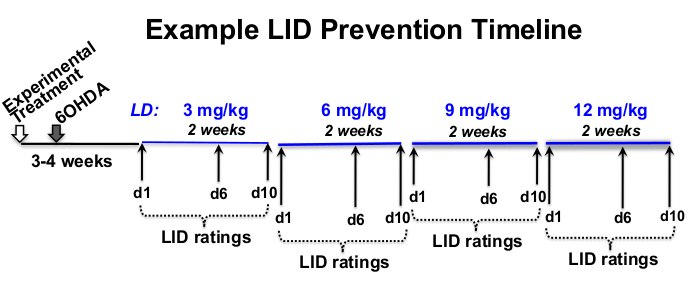
Рисунок 1: Пример временной шкалы лечения. Пример временной шкалы эскалации дозы L-DOPA составляет 12 недель в общей продолжительности, при этом 8 недель инъекций L-DOPA начинаются через 3 недели после поражения 6-OHDA и через 4 недели после экспериментального лечения. В этом примере L-DOPA подкожно вводят 5 раз в неделю (с понедельника по пятницу) примерно в одно и то же время каждый день, в течение 2 недель при каждой предписанной дозе L-DOPA (3, 6, 9 и 12 мг / кг). Поведенческие рейтинги LID проводятся в дни 1, 6 и 10 каждого уровня дозировки L-DOPA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Взвешивайте крыс еженедельно, чтобы рассчитать соответствующее количество препарата на основе текущих изменений веса во время исследования.
ПРИМЕЧАНИЕ: Из-за повышенной активности у крыс LID+ существует потенциал для потери веса при долгосрочном лечении L-DOPA. Если происходит потеря веса, обеспечьте крыс питательно полными, очень вкусными лакомствами (см. Таблицу материалов) после инъекций L-DOPA. - Рассчитайте количество L-ДОФА и бенсеразида, необходимое для каждой недельной концентрации, взвешивая лиофилизированные аликвоты за каждый день инъекции и храня в комбинации в течение 1–2 недель при -20 °C в стеклянных янтарных флаконах до дня обработки.
ПРИМЕЧАНИЕ: Целевая доза составляет 12 мг/кг или 12 мг L-DOPA/1000 г массы тела. Пример расчетов для определения количества L-DOPA и физиологического раствора, необходимых для каждого дня недели с использованием 12 мг L-DOPA/кг массы тела при объеме инъекции 1 куб.см/кг массы крысы приведен в Дополнительном файле 1.
3. Установка комнаты и клетки
- В первый день лечения L-DOPA через 3-4 недели после операции по поражению 6-OHDA переведите крыс в одиночное жилье, включая обогащение, одобренное IACUC.
- Содержание в одном жилье на протяжении всего исследования, чтобы избежать вмешательства сверстников в поведенческие оценки.
- В дни рейтинга LID поместите домашние клетки на стальную проволочную стойку, повернутую под углом примерно 45° для оптимального обзора крысы (рисунок 2A). Переверните идентификационные бирки (рисунок 2B) вверх и удалите бутылки с водой, стойки для еды и все виды обогащения в клетке (рисунок 2C), чтобы избежать вмешательства в поведенческие оценки.

Рисунок 2: Пример клетки, установленной для рейтингов LID крупномасштабных экспериментов на крысах. (A) Несколько клеток могут быть настроены для рейтинга LID с использованием больших металлических стоек, которые позволяют оптимально просматривать каждое животное. Клетки должны быть разделены под углом 45 ° с удостоверениями личности, перевернутыми вверх (B), пищей, бутылками с водой, материалами для гнездования и другим обогащением, чтобы ограничить визуальную неясность крысы и отвлекающие факторы для крысы при изучении дискинетического поведения (C). Металлические стойки должны быть в нескольких футах от любой стены, чтобы позволить оценщику осмотреть крысу в передней или задней части клетки по мере необходимости. Важно маркировать аппараты обогащения (например, дома для отдыха красных крыс) индивидуальными идентификаторами животных, чтобы заменить их в той же клетке, из которой они пришли. Это особенно важно при использовании животных разного пола, чтобы не увеличивать стресс для подопытных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Рейтинг инъекций леводопы и дискинезии
- Подкожные инъекции L-DOPA21,22
- Непосредственно перед ежедневной инъекцией L-DOPA добавляют соответствующий объем стерильного физиологического раствора к предварительно взвешенной лиофилизированной смеси L-DOPA и бенсеразида во флаконе янтаря и хорошо встряхивают в течение 10 с (стадия 2.3).
ПРИМЕЧАНИЕ: Целевой объем инъекции составляет 1 мл/1000 г массы тела (с 12 мг L-DOPA на мл). Объем стерильного физиологического раствора будет зависеть от количества животных в одном исследовании. - Наполните отдельные шприцы (например, 1,0 или 0,5 мл иглой 26 г) требуемым объемом для каждого животного (вес крысы 1 мл /кг) и нанесите на каждый шприц индивидуальную идентификацию животных.
ПРИМЕЧАНИЕ: Держите наполненные шприцы защищенными от света в стерильных пакетах до момента инъекции. L-DOPA быстро окисляется в присутствии кислорода и света в водной среде 23,24,25,26. - Поднесите первую клетку к инъекционному стенду.
- Извлеките крысу из клетки и поместите ее на поверхность инъекции.
- Осторожно прижмите голову и плечи к поверхности, на которой покоится крыса, ладонью недоминирующей руки.
- Аккуратно нанесите кожу на спину, покрывающую лопатки, большим и указательным пальцами недоминирующей руки, введите объем L-DOPA доминирующей рукой в подкожное пространство между/ниже пальцев, держа иглу как можно параллельнее телу, чтобы избежать внутримышечной инъекции.
ПРИМЕЧАНИЕ: Крыс не анестезируют перед инъекцией. - Утилизируйте каждый использованный отдельный шприц в контейнере ошейника.
- Замените крысу в ее индивидуальную клетку и добавьте питательные лакомства, за исключением дней рейтинга LID, чтобы избежать вмешательства в поведенческие оценки до тех пор, пока рейтинги не будут завершены.
- Установите таймер на 1–2 мин в зависимости от желаемого времени рейтинга и количества крыс в исследовании на рейтинговые дни. Извлеките следующую клетку и введите следующую крысу, когда таймер укажет.
- Повторяйте это, вводя одну крысу каждые 1-2 минуты, пока все крысы не будут введены.
- Непосредственно перед ежедневной инъекцией L-DOPA добавляют соответствующий объем стерильного физиологического раствора к предварительно взвешенной лиофилизированной смеси L-DOPA и бенсеразида во флаконе янтаря и хорошо встряхивают в течение 10 с (стадия 2.3).
- Рейтинг дискинезии, вызванной леводопой, после инъекции
- Оцените интенсивность (таблица 1) и частоту (таблица 2) движений дистонической и гиперкинетической дискинезии в желаемом количестве временных точек, которые должны включать начальное начало поведения LID, пиковое поведение и фазу снижения (см. Дополнительный файл 2 для примера журнала рейтинга LID).
- Для самцов и самок взрослых крыс Sprague Dawley или Fisher 344 и размер выборки N = 40 крыс начинают оценку дискинезии через 20 мин после первой инъекции L-DOPA, а затем с интервалом 50 мин до 220 или 270 мин после инъекции, в зависимости от того, когда поведение LID прекратилось у 90%-100% крыс.
- Если используются 1-минутные интервалы рейтинга, установите таймер на 1 мин. Оцените первую крысу в течение одной минуты. Перейдите к следующей крысе и оцените ее в течение 1 мин. Продолжайте через всех крыс, оценивая с интервалом в 1 мин.
- Расположите таймер рядом с клеткой так, чтобы интенсивность поведения LID (таблица 1) можно было наблюдать при оценке частоты любого заданного поведения (таблица 2) в течение периода рейтинга.
- После того, как оценки для первой точки времени завершены, начните снова с первой крысы в следующий момент времени (например, через 70 минут после инъекции) и продолжайте с желаемым интервалом (например, каждые 50 минут) до тех пор, пока не будут завершены все временные точки.
ПРИМЕЧАНИЕ: Из-за перекрытия задач по внедрению L-DOPA и рейтингу LID в дни рейтинга необходимы два человека, один для инъекций и один для поведенческих рейтингов.
Результаты
ЛИДы у паркинсонических крыс могут проявляться в виде ряда аномальных непроизвольных движений (ИМ), включая дистоническое, гиперкинетическое и стереотипное поведение. Критерии оценки LID для такого поведения представлены здесь, чтобы включить как интенсивность (таблица 1), так ...
Обсуждение
Здесь представлены подробные сведения о воспроизводимой индукции и рейтинге LID в модели крысы-паркинсониста после одностороннего поражения 6-OHDA нигростриатальной системы DA. Хотя когда-то считалось, что у грызунов не развивается LID и что ротационная асимметрия может быть аналогом LID у к?...
Раскрытие информации
Никаких конфликтов интересов объявлено не было.
Благодарности
Мы хотим отметить борьбу всех людей с болезнью Паркинсона, а также силу и стойкость, которые они демонстрируют каждый день, особенно любимого отца KSC, Марка Стиса. Представленная здесь работа была поддержана Национальным институтом неврологических расстройств и инсульта (NS090107, NS110398) и Международной программой исследовательских грантов Фонда болезни Паркинсона, ныне ФондОм Паркинсона. Мы также хотели бы поблагодарить Молли ВандерВерп за ее отличную редакционную помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 Minutes Digital Timer | Staples | 1111764 | |
| Compass CX Compact Scale | Ohaus | 30428202 | |
| 5-(2-aminoethyl)-1,2,4-benzenetriol, monohydrobromide | Cayman Chemicals | 25330 | 6-OHDA is a catecholaminergic neurotoxin that is used to induce dopaminergic lesions and parkinsonian symptoms in rodents. |
| Allentown cages | Allentown, LLC | Rat900 | Allentown cages provide the ability to view the rats from all sides. |
| BD Allergist Trays with Permanently Attached Needle | BD | BD 305540 | For subcutaneous L-DOPA injections |
| Benserazide hydrochloride | Sigma-Aldrich | B7283 | Benserazide is a peripheral decarboxylase inhibitor used with L-DOPA to to induce dyskinesia in rodent models of PD. |
| Glass amber scintillation vials | Thermo Scientific | B7921 | Used for storage of L-DOPA/benserazide at -20 °C until mixed with sterile saline. |
| L-3,4-Dihydroxyphenylalanine methyl ester hydrochloride | Sigma-Aldrich | D1507 | L-3,4-Dihydroxyphenylalanine methyl ester is a precursor to L-DOPA that crosses the blood-brain barrierand use to treat parkinsonian symptoms in rodents. |
| Paper Mate Sharpwriter Mechanical Pencils | Staples | 107250 | |
| Rodent nutritionally complete enrichment treats | Bio-Serv | F05478 | |
| Round Ice Bucket with Lid, 2.5 L | Corning | 432129 | |
| Standard Plastic Clipboard | Staples | 1227770 | |
| Steel wired 6' long movable shelving units | Uline | H9488 | Width/Height can be adjusted to need/number of rats per experiment |
| Sterile Saline 0.9% | Covidien/Argyle | 1020 | For mixing with L-DOPA/benserazide prior to subcutaneous injections. |
Ссылки
- Cotzias, G. C., Papavasiliou, P. S., Gellene, R. L-dopa in parkinson's syndrome. New England Journal of Medicine. 281, 272 (1969).
- Yahr, M. D., Duvoisin, R. C., Schear, M. J., Barrett, R. E., Hoehn, M. M. Treatment of parkinsonism with levodopa. Archives of Neurology. 21 (4), 343-354 (1969).
- Bastide, M. F., et al. Pathophysiology of L-dopa-induced motor and non-motor complications in Parkinson's disease. Progress in Neurobiology. 132, 96-168 (2015).
- Sellnow, R. C., et al. Regulation of dopamine neurotransmission from serotonergic neurons by ectopic expression of the dopamine D2 autoreceptor blocks levodopa-induced dyskinesia. Acta Neuropathologica Communications. 7 (1), 8 (2019).
- Bastide, M. F., Bezard, E. L-dopa induced dyskinesia in Parkinson's disease]. Bulletin de l'Académie Nationale de Médecine. 199 (2-3), 201-212 (2015).
- Hauser, R. A., et al. ADS-5102 (Amantadine) extended-release capsules for levodopa-induced dyskinesia in Parkinson's Disease (EASE LID 2 study): Interim results of an open-label safety study. Journal of Parkinson's Disease. 7 (3), 511-522 (2017).
- Huot, P., Johnston, T. H., Koprich, J. B., Fox, S. H., Brotchie, J. M. The pharmacology of L-DOPA-induced dyskinesia in Parkinson's disease. Pharmacological Reviews. 65 (1), 171-222 (2013).
- Steece-Collier, K., et al. Embryonic mesencephalic grafts increase levodopa-induced forelimb hyperkinesia in parkinsonian rats. Movement Disorders. 18 (12), 1442-1454 (2003).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments. (60), e3234 (2012).
- Simola, N., Morelli, M., Carta, A. R. The 6-hydroxydopamine model of Parkinson's disease. Neurotoxicity Research. 11 (3-4), 151-167 (2007).
- Borlongan, C. V., Hida, H., Nishino, H. Early assessment of motor dysfunctions aids in successful occlusion of the middle cerebral artery. Neuroreport. 9 (16), 3615-3621 (1998).
- Fleming, S. M. Behavioral outcome measures for the assessment of sensorimotor function in animal models of movement disorders. International Review of Neurobiology. 89, 57-65 (2009).
- Borlongan, C. V., Sanberg, P. R. Elevated body swing test: a new behavioral parameter for rats with 6-hydroxydopamine-induced hemiparkinsonism. Journal of Neuroscience. 15 (7), 5372-5378 (1995).
- Chang, J. W., Wachtel, S. R., Young, D., Kang, U. J. Biochemical and anatomical characterization of forepaw adjusting steps in rat models of Parkinson's disease: studies on medial forebrain bundle and striatal lesions. Neuroscience. 88 (2), 617-628 (1999).
- Lundblad, M., et al. Pharmacological validation of behavioural measures of akinesia and dyskinesia in a rat model of Parkinson's disease. European Journal of Neuroscience. 15 (1), 120-132 (2002).
- Olsson, M., Nikkhah, G., Bentlage, C., Bjorklund, A. Forelimb akinesia in the rat Parkinson model: differential effects of dopamine agonists and nigral transplants as assessed by a new stepping test. Journal of Neuroscience. 15 (5), 3863-3875 (1995).
- Monville, C., Torres, E. M., Dunnett, S. B. Comparison of incremental and accelerating protocols of the rotarod test for the assessment of motor deficits in the 6-OHDA model. Journal of Neuroscience Methods. 158 (2), 219-223 (2006).
- Steece-Collier, K., et al. Striatal Nurr1, but not FosB expression links a levodopa-induced dyskinesia phenotype to genotype in Fisher 344 vs. Lewis hemiparkinsonian rats. Experimental Neurology. 330, 113327 (2020).
- Steece-Collier, K., et al. Genetic silencing of striatal CaV1.3 prevents and ameliorates levodopa dyskinesia. Movement Disorders. 34 (5), 697-707 (2019).
- Tayarani-Binazir, K. A., Jackson, M. J., Strang, I., Jairaj, M., Rose, S., Jenner, P. Benserazide dosing regimen affects the response to L-3,4-dihydroxyphenylalanine in the 6-hydroxydopamine-lesioned rat. Behavioral Pharmacology. 23 (2), 126-133 (2012).
- Lindgren, H. S., Rylander, D., Ohlin, K. E., Lundblad, M., Cenci, M. A. The "motor complication syndrome" in rats with 6-OHDA lesions treated chronically with L-DOPA: relation to dose and route of administration. Behavioural Brain Research. 177 (1), 150-159 (2007).
- Suckow, M. A., Stevens, K. A., Wilson, R. P. . American College of Laboratory Animal Medicine series xvii. , 1268 (2012).
- Zhou, Y. Z., Alany, R. G., Chuang, V., Wen, J. Studies of the Rate Constant of l-DOPA Oxidation and Decarboxylation by HPLC. Chromatographia. 75, 597-606 (2012).
- Stroomer, A. E., Overmars, H., Abeling, N. G., van Gennip, A. H. Simultaneous determination of acidic 3,4-dihydroxyphenylalanine metabolites and 5-hydroxyindole-3-acetic acid in urine by high-performance liquid chromatography. Clinical Chemistry. 36 (10), 1834-1837 (1990).
- . PubChem Compound Summary for CID 6047, Levodopa Available from: https://pubchem.ncbi.nlm.nih.gov/compound/Levodopa (2021)
- Merck. . The Merck Index 13th edn. , (2021).
- Ortner, N. J., et al. Lower affinity of isradipine for L-Type Ca(2+) channels during substantia nigra dopamine neuron-like activity: Implications for neuroprotection in Parkinson's Disease. Journal of Neuroscience. 37 (228), 6761-6777 (2017).
- Hazra, A., Gogtay, N. Biostatistics series module 3: Comparing groups: Numerical variables. Indian Journal of Dermatology. 61 (3), 251-260 (2016).
- Mishra, P., Pandey, C. M., Singh, U., Keshri, A., Sabaretnam, M. Selection of appropriate statistical methods for data analysis. Annals of Cardiac Anaesthesia. 22 (3), 297-301 (2019).
- Divito, C. B., et al. Loss of VGLUT3 produces circadian-dependent hyperdopaminergia and ameliorates motor dysfunction and l-Dopa-Mediated dyskinesias in a model of Parkinson's Disease. Journal of Neuroscience. 35 (45), 14983-14999 (2015).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of enhanced behavioral responses to L-DOPA following repeated administration in the 6-hydroxydopamine-lesioned rat model of Parkinson's disease. Experimental Neurology. 151 (2), 334-342 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiology of Disease. 6 (6), 461-474 (1999).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. European Journal of Neuroscience. 10 (8), 2694-2706 (1998).
- Dekundy, A., Lundblad, M., Danysz, W., Cenci, M. A. Modulation of L-DOPA-induced abnormal involuntary movements by clinically tested compounds: further validation of the rat dyskinesia model. Behavioural Brain Research. 179 (1), 76-89 (2007).
- Collier, T. J., et al. Interrogating the aged striatum: robust survival of grafted dopamine neurons in aging rats produces inferior behavioral recovery and evidence of impaired integration. Neurobiology of Disease. 77, 191-203 (2015).
- Maries, E., et al. Focal not widespread grafts induce novel dyskinetic behavior in parkinsonian rats. Neurobiology of Disease. 21 (1), 165-180 (2006).
- Mercado, N. M., et al. The BDNF Val66Met polymorphism (rs6265) enhances dopamine neuron graft efficacy and side-effect liability in rs6265 knock-in rats. Neurobiology of Disease. 148, 105175 (2021).
- Cenci, M. A., Crossman, A. R. Animal models of l-dopa-induced dyskinesia in Parkinson's disease. Movement Disorders. 33 (6), 889-899 (2018).
- Lindenbach, D. Behavioral and cellular modulation of L-DOPA-induced dyskinesia by beta-adrenoceptor blockade in the 6-hydroxydopamine-lesioned rat. Journal of Pharmacology and Experimental Therapeutics. 337 (3), 755-765 (2011).
- Petzinger, G. M. Reliability and validity of a new global dyskinesia rating scale in the MPTP-lesioned non-human primate. Movement Disorders. 16 (2), 202-207 (2001).
- Fox, S. H., Johnston, T. H., Li, Q., Brotchie, J., Bezard, E. A critique of available scales and presentation of the Non-Human Primate Dyskinesia Rating Scale. Movement Disorders. 27 (11), 1373-1378 (2012).
- Cenci, M. A., Ohlin, K. E. Rodent models of treatment-induced motor complications in Parkinson's disease. Parkinsonism & Related Disorders. 15, 13-17 (2009).
- Cenci, M. A., Whishaw, I. Q., Schallert, T. Animal models of neurological deficits: how relevant is the rat. Nature Reviews: Neuroscience. 3 (7), 574-579 (2002).
- Zhang, Y., et al. Aberrant restoration of spines and their synapses in L-DOPA-induced dyskinesia: involvement of corticostriatal but not thalamostriatal synapses. Journal of Neuroscience. 33 (28), 11655-11667 (2013).
- Konradi, C., et al. Transcriptome analysis in a rat model of L-DOPA-induced dyskinesia. Neurobiology of Disease. 17 (2), 219-236 (2004).
- Morin, N., Jourdain, V. A., Di Paolo, T. Modeling dyskinesia in animal models of Parkinson disease. Experimental Neurology. 256, 105-116 (2014).
- Cenci, M. A., Riggare, S., Pahwa, R., Eidelberg, D., Hauser, R. A. Dyskinesia matters. Movement Disorders. 35 (3), 392-396 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены