È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Induzione e valutazione delle discinesie indotte da levodopa in un modello di ratto della malattia di Parkinson
In questo articolo
Riepilogo
Questo articolo descrive i metodi per indurre e valutare le discinesie indotte da levodopa in un modello di ratto di malattia di Parkinson. Il protocollo offre informazioni dettagliate sull'intensità e la frequenza di una serie di comportamenti discinetici, sia distonici che ipercinetici, fornendo uno strumento affidabile per testare trattamenti mirati a questo bisogno medico insoddisfatto.
Abstract
La levodopa (L-DOPA) rimane la terapia gold standard usata per trattare i sintomi motori del morbo di Parkinson (PD). Tuttavia, movimenti involontari indesiderati noti come discinesie indotte da L-DOPA (LID) si sviluppano con l'uso prolungato di questo precursore della dopamina. Si stima che l'incidenza di LID aumenti a circa il 90% degli individui con PD entro 10-15 anni dal trattamento. Comprendere i meccanismi di questa malattia e sviluppare trattamenti anti-discinesia sia nuovi che efficaci richiede una modellazione coerente e accurata per i test pre-clinici degli interventi terapeutici. Un metodo dettagliato per un'induzione affidabile e una valutazione completa dei LID a seguito di lesione nigrale indotta da 6-OHDA in un modello di RATto di PD è presentato qui. La valutazione LID affidabile nei ratti fornisce un potente strumento che può essere prontamente utilizzato in tutti i laboratori per testare terapie emergenti incentrate sulla riduzione o l'eliminazione di questo onere comune indotto dal trattamento per gli individui con PD.
Introduzione
Sebbene siano passati più di 50 anni da quando la levodopa (L-DOPA) è stata introdotta per la prima volta come trattamento per gli individui con PD 1,2, rimane notevolmente la terapia più efficace per i sintomi motori parkinsoniani. I sintomi motori clinici associati al PD derivano dalla perdita di neuroni della dopamina (DA) nella substantia nigra (SN) pars compacta, con conseguente drastica diminuzione della dopamina disponibile nello striato. La L-DOPA ripristina efficacemente i livelli di DA striatale, con conseguente beneficio motorio all'inizio della malattia 3,4. Inopportunamente, con il trattamento a lungo termine, la maggior parte degli individui con PD svilupperà discinesie indotte da L-DOPA (LID), tra cui corea, distonia e atetosi, che spesso hanno un impatto significativo sulle attività della vita quotidiana 5,6,7.
Mentre esistono diversi modelli comportamentali di LID nei roditori, le differenze nella modellazione e nella valutazione comportamentale dei LID hanno messo in discussione la riproducibilità dei risultati tra i laboratori e l'affidabilità di questi strumenti sperimentali per la ricerca pre-clinica sul PD. Sviluppato in associazione con uno specialista clinico di disturbi del movimento8, l'attuale protocollo è un metodo semplice per l'induzione e la valutazione della LID ed è appropriato per l'uso in un modello di RATto di PD che utilizza la lesione nigrale unilaterale indotta da 6-idrossidopamina (6-OHDA) 9,10. La scala di valutazione LID fornita qui include il punteggio sia per l'intensità che per la frequenza del comportamento discinetico in varie singole parti del corpo. Vengono inoltre fornite informazioni pertinenti riguardanti l'ottimizzazione del flusso di lavoro degli esperimenti e la cura e la gestione appropriate degli animali parkinsoniani e discinetici.
Protocollo
Gli animali qui presentati sono stati mantenuti e trattati nel rispetto delle linee guida istituzionali. Tutte le procedure per gli animali sono state approvate dal Michigan State University Institutional Animal Care and Use Committee (IACUC) in conformità con le normative federali e statali.
1. Conferma senza farmaci dello stato della lesione 6-OHDA
- Prova di sospensione della coda posturale 11,12,13
NOTA: Valutare lo stato della lesione almeno 1 settimana dopo l'induzione della lesione 6-OHDA (vedere 9,10,35 per i dettagli sulla lesione) in soggetti sperimentali (ad esempio, maschio o femmina, ratti adulti Sprague Dawley o Fisher 344).- Sospendere il ratto a circa 6 cm sopra la sua gabbia, tenendo saldamente alla base della coda, per ~ 5 s.
- Registrare la direzione della contorsione del corpo come + per un animale lesionato con successo che torce il controlaterale sul lato lesionato e - per mancanza di torsione o torsione in entrambe le direzioni.
- NOTA: questi test sono facoltativi ma consigliati. Vedere 14,15,16,17 per ulteriori opzioni/variazioni di test senza droga.
- Test di trascinamento della regolazione del passo (adattato da16)
NOTA: Valutare lo stato della lesione almeno 1 settimana dopo l'induzione unilaterale della lesione 6-OHDA in soggetti sperimentali (ad es. ratti maschi o femmine, Sprague Dawley adulti o Fisher 344).- Tenere il topo per la base della coda, sollevando i piedi posteriori dalla superficie di ~ 6 cm; trascinare all'indietro su una superficie piatta, liscia ma non scivolosa, ~ 75 cm, oltre 5-10 s.
- Osservare e registrare il numero di movimenti di regolazione del tocco/passo di ciascuna zampa anteriore su tre test ripetuti.
- Segna il soggetto come + per una lesione unilaterale di successo quando si osservano 0-2 rubinetti di zampa anteriore sul lato lesionato, insieme a un rapido tocco (~ 10 rubinetti) dall'ipsilaterale della zampa anteriore al lato lesionato (ad esempio, gli animali lesionati unilateralmente sul lato sinistro mostrano deficit di picchiettamento (0-2 rubinetti) con la zampa anteriore destra controlaterale).
- Al contrario, segnare un tocco da moderato a rapido (5-10 tocchi) da entrambe le zampe anteriori come - per indicare uno stato di lesione incompleto o sconosciuto.
NOTA: un animale ansioso può mostrare una rapida regolazione del tapping / step anche se lesionato con successo. Se questo è sospettato, rimetti il topo nella loro gabbia di casa e ri-testa ≥30 minuti dopo.
2. Preparazione dei reagenti e delle forniture
- Determinare L-3,4-diidrossifenilalanina estere metilico cloridrato (levodopa o L-DOPA) e benserazide cloridrato, una dose periferica di inibitore della decarbossilasi (vedere Tabella dei materiali), frequenza di valutazione e tempistica sperimentale appropriata per la domanda sperimentale 12,18,19,20 (Figura 1).
NOTA: Le domande sperimentali possono essere poste per cercare qualsiasi numero di domande che vanno dal chiedere se una terapia specifica potrebbe ridurre il LID esistente o prevenire l'induzione di LID. Possono anche esplorare se l'efficacia terapeutica dipende dalla dose di levodopa o se l'espressione della LID e / o l'efficacia terapeutica varia a seconda del sesso, della specie e dell'età del soggetto.
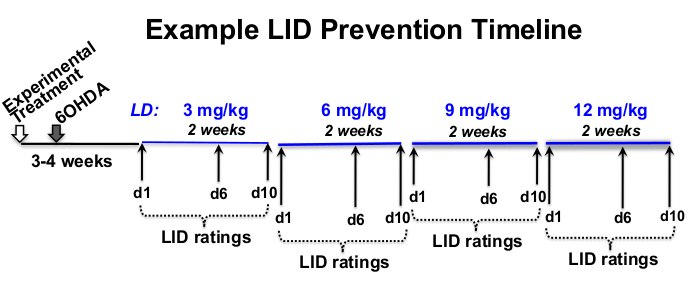
Figura 1: Esempio di tempistica del trattamento. Esempio di L-DOPA dose-escalation timeline di 12 settimane di lunghezza totale, con 8 settimane di iniezioni di L-DOPA a partire da 3 settimane dopo la lesione 6-OHDA e 4 settimane dopo il trattamento sperimentale. In questo esempio, la L-DOPA viene iniettata per via sottocutanea 5 volte a settimana (dal lunedì al venerdì) all'incirca alla stessa ora ogni giorno, per 2 settimane a ciascuna dose di L-DOPA prescritta (3, 6, 9 e 12 mg / kg). Le valutazioni LID comportamentali si svolgono nei giorni 1, 6 e 10 di ciascun livello di dosaggio di L-DOPA. Fare clic qui per visualizzare una versione più grande di questa figura.
- Pesare i ratti settimanalmente per calcolare la quantità di farmaco appropriata in base alle variazioni di peso in corso durante lo studio.
NOTA: A causa dell'aumento dell'attività nei ratti LID +, esiste un potenziale di perdita di peso con trattamenti L-DOPA a lungo termine. Se si verifica una perdita di peso, fornire ai ratti prelibatezze nutrizionalmente complete e altamente appetibili (vedere tabella dei materiali) dopo le iniezioni di L-DOPA. - Calcolare la quantità di L-DOPA e benserazide necessaria per ogni concentrazione settimanale, soppesando le aliquote liofilizzate per ogni giorno di iniezione e conservando in combinazione per 1-2 settimane a -20 °C in flaconcini di vetro ambrato fino al giorno del trattamento.
NOTA: La dose target è di 12 mg/kg o 12 mg di L-DOPA/1000 g di peso corporeo. Esempi di calcoli per determinare la quantità di L-DOPA e soluzione salina necessaria per ogni giorno della settimana utilizzando 12 mg di L-DOPA/kg di peso corporeo ad un volume di iniezione di 1 cc/kg di peso del ratto sono riportati nel fascicolo supplementare 1.
3. Allestimento della stanza e della gabbia
- Il primo giorno di trattamento con L-DOPA 3-4 settimane dopo l'intervento chirurgico alla lesione 6-OHDA, trasferire i ratti in un singolo alloggiamento, incluso l'arricchimento approvato dalla IACUC.
- Mantenere in un unico alloggio durante lo studio per evitare interferenze tra pari con le valutazioni comportamentali.
- Nei giorni di valutazione LID, posizionare le gabbie domestiche su una griglia di acciaio, ruotata con un angolo di circa 45 ° per una visione ottimale del ratto (Figura 2A). Capovolgere i tag di identificazione (Figura 2B) verso l'alto e rimuovere bottiglie d'acqua, rack di cibo e tutti i tipi di arricchimento nella gabbia (Figura 2C) per evitare interferenze con le valutazioni comportamentali.

Figura 2: Esempio della gabbia predisposta per le classificazioni LID di esperimenti su ratti su larga scala. (A) È possibile impostare gabbie multiple per la classificazione LID utilizzando grandi scaffalature metalliche che consentono una visione ottimale di ciascun animale. Le gabbie dovrebbero essere distribuite con un angolo di 45 ° con carte d'identità capovolte verso l'alto (B), cibo, bottiglie d'acqua, materiali di nidificazione e altri arricchimenti rimossi per limitare l'oscurità visiva del ratto e le distrazioni al ratto durante l'esame dei comportamenti discinetici (C). Le scaffalature metalliche devono essere a pochi metri di distanza da qualsiasi parete per consentire al valutatore di esaminare il ratto nella parte anteriore o posteriore della gabbia, se necessario. È essenziale etichettare gli apparecchi di arricchimento (ad esempio, le case di ritiro dei ratti rossi C) con i singoli ID degli animali per sostituirli nella stessa gabbia da cui provengono. Ciò è particolarmente importante quando si utilizzano animali di sesso diverso per non aumentare lo stress ai soggetti sperimentali. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Iniezioni di levodopa e valutazione della discinesia
- Iniezioni sottocutanee di L-DOPA21,22
- Immediatamente prima dell'iniezione giornaliera di L-DOPA, aggiungere il volume appropriato di soluzione salina sterile alla miscela di L-DOPA liofilizzata e benserazide pre-pesata nel flaconcino ambrato e agitare bene per 10 s (fase 2.3).
NOTA: il volume target di iniezione è di 1 mL/1000 g di peso corporeo (con 12 mg di L-DOPA per mL). Il volume della soluzione salina sterile dipenderà dal numero di animali per studio. - Riempire le singole siringhe (ad esempio, 1,0 o 0,5 mL con ago da 26 G) con il volume richiesto per ciascun animale (1 ml/kg di peso del ratto) ed etichettare ciascuna siringa con l'identificazione individuale dell'animale.
NOTA: Tenere le siringhe riempite al riparo dalla luce in sacchetti sterili fino al momento dell'iniezione. La L-DOPA si ossida rapidamente in presenza di ossigeno e luce in ambiente acquoso 23,24,25,26. - Portare la prima gabbia al banco di iniezione.
- Rimuovere il ratto dalla sua gabbia e posizionarlo sulla superficie di iniezione.
- Trattenere delicatamente la testa e le spalle contro la superficie su cui il ratto è appoggiato con il palmo della mano non dominante.
- Tamponare delicatamente la pelle sulla schiena sovrastante le scapole con il pollice e l'indice della mano non dominante, iniettare il volume di L-DOPA con la mano dominante nello spazio sottocutaneo tra/sotto le dita, mantenendo l'ago il più parallelo possibile al corpo per evitare l'iniezione intramuscolare.
NOTA: I ratti non vengono anestetizzati prima dell'iniezione. - Smaltire ogni singola siringa usata in un contenitore tagliente.
- Sostituire il ratto nella sua gabbia individuale e aggiungere prelibatezze nutrizionalmente complete tranne nei giorni di valutazione LID per evitare interferenze con le valutazioni comportamentali fino a quando le valutazioni non sono complete.
- Impostare il timer per 1-2 minuti a seconda del tempo di valutazione desiderato e del numero di ratti nello studio nei giorni di valutazione. Recupera la gabbia successiva e inietta il ratto successivo quando il timer lo indica.
- Ripeti questo, iniettando un ratto ogni 1-2 minuti, fino a quando tutti i ratti non vengono iniettati.
- Immediatamente prima dell'iniezione giornaliera di L-DOPA, aggiungere il volume appropriato di soluzione salina sterile alla miscela di L-DOPA liofilizzata e benserazide pre-pesata nel flaconcino ambrato e agitare bene per 10 s (fase 2.3).
- Valutazione della discinesia indotta da levodopa post-iniezione
- Valutare l'intensità (Tabella 1) e la frequenza (Tabella 2) dei movimenti di discinesia distonica e ipercinetica al numero desiderato di timepoint, che dovrebbe includere l'inizio iniziale del comportamento LID, il comportamento di picco e la fase di declino (vedere il file supplementare 2 per un esempio di foglio di registro di valutazione LID).
- Per i ratti adulti di sesso maschile e femmina Sprague Dawley o Fisher 344 e una dimensione del campione di N = 40 ratti, iniziare le valutazioni di discinesia 20 minuti dopo la prima iniezione di L-DOPA e quindi a intervalli di 50 minuti fino a 220 o 270 minuti dopo l'iniezione, a seconda di quando i comportamenti LID sono stati interrotti nel 90%-100% dei ratti.
- Se si utilizzano intervalli di valutazione di 1 minuto, impostare un timer per 1 minuto. Valuta il primo ratto per un minuto. Passa al ratto successivo e valutalo per 1 minuto. Continua attraverso tutti i ratti, valutando intervalli di 1 minuto.
- Avere un timer posizionato accanto alla gabbia in modo visibile in modo che l'intensità del comportamento LID (Tabella 1) possa essere osservata mentre si stima la frequenza di un dato comportamento (Tabella 2) durante il periodo di valutazione.
- Dopo che le valutazioni per il primo punto temporale sono state completate, ricominciare con il primo ratto al punto temporale successivo (ad esempio, 70 minuti dopo l'iniezione) e continuare all'intervallo desiderato (ad esempio, ogni 50 minuti) fino a quando tutti i punti temporali sono completati.
NOTA: A causa della sovrapposizione delle attività di iniezione di L-DOPA e lid rating, sono necessarie due persone nei giorni di valutazione, una per l'iniezione e una per le valutazioni comportamentali.
Risultati
I LLD nei ratti parkinsoniani possono manifestarsi come una serie di movimenti involontari anormali (AAM), inclusi comportamenti distonici, ipercinetici e stereotipati. I criteri di valutazione LID per tali comportamenti sono presentati qui per includere sia l'intensità (Tabella 1) che la frequenza (Tabella 2). Ciò fornisce un punteggio complessivo di gravità LID per ciascun ratto che riflette sia la qualità (intensità) che la quantità di tempo trascorso a impegnarsi (frequenza) in...
Discussione
Qui sono presentati i dettagli per l'induzione riproducibile e la valutazione dei LIT in un modello di ratto parkinsoniano a seguito di lesione unilaterale 6-OHDA del sistema DA nigrostriatale. Mentre una volta si pensava che i roditori non sviluppassero LID e che l'asimmetria rotazionale potesse essere l'analogo di LID nei ratti31, i modelli di ratti e topi sono stati caratterizzati negli ultimi due decenni e sono uno strumento ben accettato per la ricerca LID 15,32,33,34....
Divulgazioni
Non sono stati dichiarati conflitti di interesse.
Riconoscimenti
Vogliamo riconoscere le lotte di tutti coloro che hanno il morbo di Parkinson e la forza e la resilienza che mostrano ogni giorno, in particolare l'amato padre di KSC, Mark Steece. Il lavoro qui rappresentato è stato sostenuto dal National Institute of Neurological Disorders and Stroke (NS090107, NS110398) e dal Parkinson Disease Foundation International Research Grant Program, ora Parkinson Foundation. Vorremmo anche ringraziare Molly VanderWerp per la sua eccellente assistenza editoriale.
Materiali
| Name | Company | Catalog Number | Comments |
| 100 Minutes Digital Timer | Staples | 1111764 | |
| Compass CX Compact Scale | Ohaus | 30428202 | |
| 5-(2-aminoethyl)-1,2,4-benzenetriol, monohydrobromide | Cayman Chemicals | 25330 | 6-OHDA is a catecholaminergic neurotoxin that is used to induce dopaminergic lesions and parkinsonian symptoms in rodents. |
| Allentown cages | Allentown, LLC | Rat900 | Allentown cages provide the ability to view the rats from all sides. |
| BD Allergist Trays with Permanently Attached Needle | BD | BD 305540 | For subcutaneous L-DOPA injections |
| Benserazide hydrochloride | Sigma-Aldrich | B7283 | Benserazide is a peripheral decarboxylase inhibitor used with L-DOPA to to induce dyskinesia in rodent models of PD. |
| Glass amber scintillation vials | Thermo Scientific | B7921 | Used for storage of L-DOPA/benserazide at -20 °C until mixed with sterile saline. |
| L-3,4-Dihydroxyphenylalanine methyl ester hydrochloride | Sigma-Aldrich | D1507 | L-3,4-Dihydroxyphenylalanine methyl ester is a precursor to L-DOPA that crosses the blood-brain barrierand use to treat parkinsonian symptoms in rodents. |
| Paper Mate Sharpwriter Mechanical Pencils | Staples | 107250 | |
| Rodent nutritionally complete enrichment treats | Bio-Serv | F05478 | |
| Round Ice Bucket with Lid, 2.5 L | Corning | 432129 | |
| Standard Plastic Clipboard | Staples | 1227770 | |
| Steel wired 6' long movable shelving units | Uline | H9488 | Width/Height can be adjusted to need/number of rats per experiment |
| Sterile Saline 0.9% | Covidien/Argyle | 1020 | For mixing with L-DOPA/benserazide prior to subcutaneous injections. |
Riferimenti
- Cotzias, G. C., Papavasiliou, P. S., Gellene, R. L-dopa in parkinson's syndrome. New England Journal of Medicine. 281, 272 (1969).
- Yahr, M. D., Duvoisin, R. C., Schear, M. J., Barrett, R. E., Hoehn, M. M. Treatment of parkinsonism with levodopa. Archives of Neurology. 21 (4), 343-354 (1969).
- Bastide, M. F., et al. Pathophysiology of L-dopa-induced motor and non-motor complications in Parkinson's disease. Progress in Neurobiology. 132, 96-168 (2015).
- Sellnow, R. C., et al. Regulation of dopamine neurotransmission from serotonergic neurons by ectopic expression of the dopamine D2 autoreceptor blocks levodopa-induced dyskinesia. Acta Neuropathologica Communications. 7 (1), 8 (2019).
- Bastide, M. F., Bezard, E. L-dopa induced dyskinesia in Parkinson's disease]. Bulletin de l'Académie Nationale de Médecine. 199 (2-3), 201-212 (2015).
- Hauser, R. A., et al. ADS-5102 (Amantadine) extended-release capsules for levodopa-induced dyskinesia in Parkinson's Disease (EASE LID 2 study): Interim results of an open-label safety study. Journal of Parkinson's Disease. 7 (3), 511-522 (2017).
- Huot, P., Johnston, T. H., Koprich, J. B., Fox, S. H., Brotchie, J. M. The pharmacology of L-DOPA-induced dyskinesia in Parkinson's disease. Pharmacological Reviews. 65 (1), 171-222 (2013).
- Steece-Collier, K., et al. Embryonic mesencephalic grafts increase levodopa-induced forelimb hyperkinesia in parkinsonian rats. Movement Disorders. 18 (12), 1442-1454 (2003).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments. (60), e3234 (2012).
- Simola, N., Morelli, M., Carta, A. R. The 6-hydroxydopamine model of Parkinson's disease. Neurotoxicity Research. 11 (3-4), 151-167 (2007).
- Borlongan, C. V., Hida, H., Nishino, H. Early assessment of motor dysfunctions aids in successful occlusion of the middle cerebral artery. Neuroreport. 9 (16), 3615-3621 (1998).
- Fleming, S. M. Behavioral outcome measures for the assessment of sensorimotor function in animal models of movement disorders. International Review of Neurobiology. 89, 57-65 (2009).
- Borlongan, C. V., Sanberg, P. R. Elevated body swing test: a new behavioral parameter for rats with 6-hydroxydopamine-induced hemiparkinsonism. Journal of Neuroscience. 15 (7), 5372-5378 (1995).
- Chang, J. W., Wachtel, S. R., Young, D., Kang, U. J. Biochemical and anatomical characterization of forepaw adjusting steps in rat models of Parkinson's disease: studies on medial forebrain bundle and striatal lesions. Neuroscience. 88 (2), 617-628 (1999).
- Lundblad, M., et al. Pharmacological validation of behavioural measures of akinesia and dyskinesia in a rat model of Parkinson's disease. European Journal of Neuroscience. 15 (1), 120-132 (2002).
- Olsson, M., Nikkhah, G., Bentlage, C., Bjorklund, A. Forelimb akinesia in the rat Parkinson model: differential effects of dopamine agonists and nigral transplants as assessed by a new stepping test. Journal of Neuroscience. 15 (5), 3863-3875 (1995).
- Monville, C., Torres, E. M., Dunnett, S. B. Comparison of incremental and accelerating protocols of the rotarod test for the assessment of motor deficits in the 6-OHDA model. Journal of Neuroscience Methods. 158 (2), 219-223 (2006).
- Steece-Collier, K., et al. Striatal Nurr1, but not FosB expression links a levodopa-induced dyskinesia phenotype to genotype in Fisher 344 vs. Lewis hemiparkinsonian rats. Experimental Neurology. 330, 113327 (2020).
- Steece-Collier, K., et al. Genetic silencing of striatal CaV1.3 prevents and ameliorates levodopa dyskinesia. Movement Disorders. 34 (5), 697-707 (2019).
- Tayarani-Binazir, K. A., Jackson, M. J., Strang, I., Jairaj, M., Rose, S., Jenner, P. Benserazide dosing regimen affects the response to L-3,4-dihydroxyphenylalanine in the 6-hydroxydopamine-lesioned rat. Behavioral Pharmacology. 23 (2), 126-133 (2012).
- Lindgren, H. S., Rylander, D., Ohlin, K. E., Lundblad, M., Cenci, M. A. The "motor complication syndrome" in rats with 6-OHDA lesions treated chronically with L-DOPA: relation to dose and route of administration. Behavioural Brain Research. 177 (1), 150-159 (2007).
- Suckow, M. A., Stevens, K. A., Wilson, R. P. . American College of Laboratory Animal Medicine series xvii. , 1268 (2012).
- Zhou, Y. Z., Alany, R. G., Chuang, V., Wen, J. Studies of the Rate Constant of l-DOPA Oxidation and Decarboxylation by HPLC. Chromatographia. 75, 597-606 (2012).
- Stroomer, A. E., Overmars, H., Abeling, N. G., van Gennip, A. H. Simultaneous determination of acidic 3,4-dihydroxyphenylalanine metabolites and 5-hydroxyindole-3-acetic acid in urine by high-performance liquid chromatography. Clinical Chemistry. 36 (10), 1834-1837 (1990).
- . PubChem Compound Summary for CID 6047, Levodopa Available from: https://pubchem.ncbi.nlm.nih.gov/compound/Levodopa (2021)
- Merck. . The Merck Index 13th edn. , (2021).
- Ortner, N. J., et al. Lower affinity of isradipine for L-Type Ca(2+) channels during substantia nigra dopamine neuron-like activity: Implications for neuroprotection in Parkinson's Disease. Journal of Neuroscience. 37 (228), 6761-6777 (2017).
- Hazra, A., Gogtay, N. Biostatistics series module 3: Comparing groups: Numerical variables. Indian Journal of Dermatology. 61 (3), 251-260 (2016).
- Mishra, P., Pandey, C. M., Singh, U., Keshri, A., Sabaretnam, M. Selection of appropriate statistical methods for data analysis. Annals of Cardiac Anaesthesia. 22 (3), 297-301 (2019).
- Divito, C. B., et al. Loss of VGLUT3 produces circadian-dependent hyperdopaminergia and ameliorates motor dysfunction and l-Dopa-Mediated dyskinesias in a model of Parkinson's Disease. Journal of Neuroscience. 35 (45), 14983-14999 (2015).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of enhanced behavioral responses to L-DOPA following repeated administration in the 6-hydroxydopamine-lesioned rat model of Parkinson's disease. Experimental Neurology. 151 (2), 334-342 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiology of Disease. 6 (6), 461-474 (1999).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. European Journal of Neuroscience. 10 (8), 2694-2706 (1998).
- Dekundy, A., Lundblad, M., Danysz, W., Cenci, M. A. Modulation of L-DOPA-induced abnormal involuntary movements by clinically tested compounds: further validation of the rat dyskinesia model. Behavioural Brain Research. 179 (1), 76-89 (2007).
- Collier, T. J., et al. Interrogating the aged striatum: robust survival of grafted dopamine neurons in aging rats produces inferior behavioral recovery and evidence of impaired integration. Neurobiology of Disease. 77, 191-203 (2015).
- Maries, E., et al. Focal not widespread grafts induce novel dyskinetic behavior in parkinsonian rats. Neurobiology of Disease. 21 (1), 165-180 (2006).
- Mercado, N. M., et al. The BDNF Val66Met polymorphism (rs6265) enhances dopamine neuron graft efficacy and side-effect liability in rs6265 knock-in rats. Neurobiology of Disease. 148, 105175 (2021).
- Cenci, M. A., Crossman, A. R. Animal models of l-dopa-induced dyskinesia in Parkinson's disease. Movement Disorders. 33 (6), 889-899 (2018).
- Lindenbach, D. Behavioral and cellular modulation of L-DOPA-induced dyskinesia by beta-adrenoceptor blockade in the 6-hydroxydopamine-lesioned rat. Journal of Pharmacology and Experimental Therapeutics. 337 (3), 755-765 (2011).
- Petzinger, G. M. Reliability and validity of a new global dyskinesia rating scale in the MPTP-lesioned non-human primate. Movement Disorders. 16 (2), 202-207 (2001).
- Fox, S. H., Johnston, T. H., Li, Q., Brotchie, J., Bezard, E. A critique of available scales and presentation of the Non-Human Primate Dyskinesia Rating Scale. Movement Disorders. 27 (11), 1373-1378 (2012).
- Cenci, M. A., Ohlin, K. E. Rodent models of treatment-induced motor complications in Parkinson's disease. Parkinsonism & Related Disorders. 15, 13-17 (2009).
- Cenci, M. A., Whishaw, I. Q., Schallert, T. Animal models of neurological deficits: how relevant is the rat. Nature Reviews: Neuroscience. 3 (7), 574-579 (2002).
- Zhang, Y., et al. Aberrant restoration of spines and their synapses in L-DOPA-induced dyskinesia: involvement of corticostriatal but not thalamostriatal synapses. Journal of Neuroscience. 33 (28), 11655-11667 (2013).
- Konradi, C., et al. Transcriptome analysis in a rat model of L-DOPA-induced dyskinesia. Neurobiology of Disease. 17 (2), 219-236 (2004).
- Morin, N., Jourdain, V. A., Di Paolo, T. Modeling dyskinesia in animal models of Parkinson disease. Experimental Neurology. 256, 105-116 (2014).
- Cenci, M. A., Riggare, S., Pahwa, R., Eidelberg, D., Hauser, R. A. Dyskinesia matters. Movement Disorders. 35 (3), 392-396 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon