Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Induction et évaluation des dyskinésies induites par la lévodopa dans un modèle rat de la maladie de Parkinson
Dans cet article
Résumé
Cet article décrit les méthodes pour induire et évaluer les dyskinésies induites par la lévodopa dans un modèle de rat de la maladie de Parkinson. Le protocole offre des informations détaillées concernant l’intensité et la fréquence d’une gamme de comportements dyskinétiques, à la fois dystoniques et hyperkinétiques, fournissant un outil fiable pour tester les traitements ciblant ce besoin médical non satisfait.
Résumé
La lévodopa (L-DOPA) reste le traitement de référence utilisé pour traiter les symptômes moteurs de la maladie de Parkinson (MP). Cependant, des mouvements involontaires indésirables connus sous le nom de dyskinésies induites par la L-DOPA (LID) se développent avec l’utilisation prolongée de ce précurseur de la dopamine. On estime que l’incidence des MIA augmente à environ 90 % des personnes atteintes de MP dans les 10 à 15 ans suivant le traitement. Comprendre les mécanismes de cette maladie et développer des traitements anti-dyskinésie nouveaux et efficaces nécessite une modélisation cohérente et précise pour les essais précliniques d’interventions thérapeutiques. Une méthode détaillée pour une induction fiable et une évaluation complète des LID après une lésion nigrale induite par 6-OHDA dans un modèle de chez le rat est présentée ici. L’évaluation fiable de la LID chez le rat fournit un outil puissant qui peut être facilement utilisé dans tous les laboratoires pour tester les thérapies émergentes axées sur la réduction ou l’élimination de ce fardeau commun induit par le traitement pour les personnes atteintes de MP.
Introduction
Bien que plus de 50 ans se soient écoulés depuis l’introduction de la lévodopa (L-DOPA) comme traitement pour les personnes atteintes de MP 1,2, elle reste remarquablement le traitement le plus efficace pour les symptômes moteurs parkinsoniens. Les symptômes moteurs cliniques associés à la MP proviennent de la perte de neurones dopaminergiques (DA) dans la substantia nigra (SN) pars compacta, entraînant une diminution spectaculaire de la dopamine disponible dans le striatum. La L-DOPA restaure efficacement les niveaux de DA striatal, ce qui entraîne un bénéfice moteur précoce dans la maladie 3,4. De manière inopportune, avec un traitement à long terme, la plupart des personnes atteintes de MP développeront des dyskinésies induites par la L-DOPA (LID), y compris la chorée, la dystonie et l’athétose, qui ont souvent un impact significatif sur les activités de la vie quotidienne 5,6,7.
Bien qu’il existe plusieurs modèles comportementaux de LID chez les rongeurs, des différences dans la modélisation et l’évaluation comportementale des LID ont remis en question la reproductibilité des résultats entre les laboratoires ainsi que la fiabilité de ces outils expérimentaux pour la recherche préclinique sur la MP. Développé en association avec un spécialiste clinique des troubles du mouvement8, le protocole actuel est une méthode simple d’induction et d’évaluation de la LID et convient à une utilisation dans un modèle de MP chez le rat utilisant une lésion nnigrale unilatérale induite par la 6-hydroxydopamine (6-OHDA) 9,10. L’échelle d’évaluation LID fournie ici comprend la notation de l’intensité et de la fréquence du comportement dyskinétique dans diverses parties individuelles du corps. Des informations pertinentes concernant l’optimisation du flux de travail des expériences et les soins et manipulations appropriés des animaux parkinsoniens et dyskinétiques sont également fournies.
Protocole
Les animaux présentés ici ont été entretenus et manipulés conformément aux directives institutionnelles. Toutes les procédures animales ont été approuvées par le Michigan State University Institutional Animal Care and Use Committee (IACUC) conformément aux réglementations fédérales et étatiques.
1. Confirmation sans médicament de l’état de la lésion 6-OHDA
- Test postural de suspension de la queue 11,12,13
REMARQUE : Évaluer l’état de la lésion au moins 1 semaine après l’induction de la lésion 6-OHDA (voir 9,10,35 pour plus de détails sur la lésion) chez des sujets expérimentaux (p. ex. mâle ou femelle, Sprague Dawley adulte ou rats Fisher 344).- Suspendez le rat à environ 6 cm au-dessus de sa cage, en le tenant fermement à la base de la queue, pendant environ 5 s.
- Enregistrez la direction de la contorsion corporelle comme + pour un animal ayant subi une lésion réussie en tordant le controlatéral sur le côté lésionné et - pour manque de torsion ou de torsion dans les deux sens.
- REMARQUE: Ces tests sont facultatifs mais recommandés. Voir 14,15,16,17 pour d’autres options/variations de tests sans drogue.
- Test de traînée de réglage par étape (adapté de16)
REMARQUE : Évaluer l’état de la lésion au moins 1 semaine après l’induction unilatérale de la lésion 6-OHDA chez des sujets expérimentaux (p. ex. mâle ou femelle, rats adultes Sprague Dawley ou Fisher 344).- Tenez le rat par la base de sa queue, en élevant les pattes arrière de la surface d’environ 6 cm; glisser vers l’arrière sur une surface plane, lisse mais non glissante, ~ 75 cm, sur 5–10 s.
- Observez et enregistrez le nombre de mouvements de tapotement / ajustement des pas de chaque avant-plan au cours de trois tests répétés.
- Notez le sujet comme + pour une lésion unilatérale réussie lorsque 0 à 2 robinets de la patte avant sont observés controlatéral au côté lésionné, ainsi qu’un tapotement rapide (~ 10 robinets) de l’avant-patte ipsilatérale au côté lésionné (par exemple, les animaux unilatéralement sectionnés sur le côté gauche présentent un déficit de tapotement (0 à 2 robinets) avec la patte avant droite controlatérale).
- Inversement, marquez un tapotement modéré à rapide (5 à 10 tapotements) des deux pattes antérieures comme - pour indiquer un état de lésion incomplet ou inconnu.
REMARQUE: Un animal anxieux peut montrer un tapotement rapide / ajustement des pas même s’il est correctement blessé. Si cela est suspecté, replacez le rat dans sa cage d’origine et testez à nouveau ≥30 minutes plus tard.
2. Préparation des réactifs et des fournitures
- Déterminer le chlorhydrate d’ester méthylique de L-3,4-dihydroxyphénylalanine (lévodopa ou L-DOPA) et le chlorhydrate de bensérazide, une dose périphérique d’inhibiteur de la décarboxylase (voir tableau des matériaux), la fréquence nominale et le calendrier expérimental appropriés pour la question expérimentale 12,18,19,20 (figure 1).
REMARQUE: Des questions expérimentales peuvent être posées pour rechercher un certain nombre de questions allant de demander si un traitement spécifique pourrait réduire la LID existante ou prévenir l’induction de la LID. Ils peuvent également explorer si l’efficacité thérapeutique dépend de la dose de lévodopa ou si l’expression de la LID et / ou l’efficacité thérapeutique varie en fonction du sexe, de l’espèce et de l’âge du sujet.
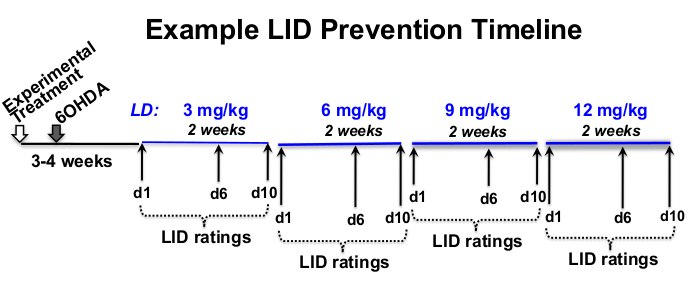
Figure 1 : Exemple de chronologie du traitement. Exemple de délai d’escalade de la dose de L-DOPA de 12 semaines de durée totale, avec 8 semaines d’injections de L-DOPA commençant 3 semaines après la lésion 6-OHDA et 4 semaines après le traitement expérimental. Dans cet exemple, la L-DOPA est injectée par voie sous-cutanée 5x par semaine (du lundi au vendredi) à peu près à la même heure chaque jour, pendant 2 semaines à chaque dose prescrite de L-DOPA (3, 6, 9 et 12 mg / kg). Les évaluations comportementales de la LID ont lieu les jours 1, 6 et 10 de chaque dose de L-DOPA. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Pesez les rats chaque semaine pour calculer la quantité de médicament appropriée en fonction des changements de poids en cours au cours de l’étude.
REMARQUE: En raison de l’activité accrue chez les rats LID +, il existe un potentiel de perte de poids avec les traitements À long terme L-DOPA. Si une perte de poids se produit, fournissez aux rats des friandises nutritionnellement complètes et très appétissantes (voir le tableau des matériaux) après les injections de L-DOPA. - Calculer la quantité de L-DOPA et de bensérazide nécessaire pour chaque concentration hebdomadaire, peser les aliquotes lyophilisées pour chaque jour d’injection et les conserver en association pendant 1 à 2 semaines à -20 °C dans des flacons d’ambre de verre jusqu’au jour du traitement.
REMARQUE: La dose cible est de 12 mg / kg ou 12 mg de L-DOPA / 1000 g de poids corporel. Un exemple de calcul pour déterminer la quantité de L-DOPA et de solution saline nécessaire pour chaque jour d’une semaine en utilisant 12 mg de L-DOPA/kg de poids corporel à un volume d’injection de 1 cc/kg de poids de rat est donné dans le dossier supplémentaire 1.
3. Mise en place de la pièce et de la cage
- Le premier jour du traitement par L-DOPA 3 à 4 semaines après la chirurgie de lésion 6-OHDA, transférez les rats dans un seul boîtier, y compris l’enrichissement approuvé par l’IACUC.
- Maintenir dans un seul logement tout au long de l’étude pour éviter l’interférence des pairs avec les évaluations comportementales.
- Les jours d’évaluation LID, placez les cages de la maison sur un support en fil d’acier, tourné à un angle d’environ 45 ° pour une visualisation optimale du rat (Figure 2A). Retournez les étiquettes d’identification (Figure 2B) vers le haut et retirez les bouteilles d’eau, les supports alimentaires et tous les types d’enrichissement dans la cage (Figure 2C) pour éviter toute interférence avec les évaluations comportementales.

Figure 2 : Exemple de cage mise en place pour les cotes LID d’expériences sur des rats à grande échelle. (A) Plusieurs cages peuvent être configurées pour l’évaluation LID à l’aide de grands supports métalliques qui permettent une visualisation optimale de chaque animal. Les cages doivent être écartées à un angle de 45° avec des cartes d’identité retournées vers le haut (B), de la nourriture, des bouteilles d’eau, des matériaux de nidification et d’autres enrichissements enlevés pour limiter l’obscurité visuelle du rat et les distractions pour le rat lors de l’examen des comportements dyskinétiques (C). Les supports métalliques doivent être à quelques mètres de tout mur pour permettre à l’évaluateur d’examiner le rat à l’avant ou à l’arrière de la cage au besoin. Il est essentiel d’étiqueter les appareils d’enrichissement (par exemple, les maisons de retraite pour rats rouges C)) avec des identifiants d’animaux individuels pour les remplacer dans la même cage d’où ils proviennent. Ceci est particulièrement important lors de l’utilisation d’animaux de sexes différents pour ne pas augmenter le stress des sujets expérimentaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Injections de lévodopa et évaluation de la dyskinésie
- Injections sous-cutanées de L-DOPA 21,22
- Immédiatement avant l’injection quotidienne de L-DOPA, ajouter le volume approprié de solution saline stérile au mélange lyophilisé pré-pesé L-DOPA et bensérazide dans le flacon ambré et bien agiter pendant 10 s (étape 2.3).
REMARQUE: Le volume d’injection cible est de 1 mL / 1000 g de poids corporel (avec 12 mg de L-DOPA par mL). Le volume de la solution saline stérile dépendra du nombre d’animaux par étude. - Remplissez les seringues individuelles (p. ex., 1,0 ou 0,5 mL avec une aiguille de 26 G) avec le volume requis pour chaque animal (1 mL/kg de poids de rat) et étiquetez chaque seringue avec l’identification individuelle de l’animal.
REMARQUE: Gardez les seringues remplies à l’abri de la lumière dans des sachets stériles jusqu’au moment de l’injection. La L-DOPA s’oxyde rapidement en présence d’oxygène et de lumière dans un environnement aqueux 23,24,25,26. - Apportez la première cage au banc d’injection.
- Retirez le rat de sa cage et placez-le sur la surface d’injection.
- Retenez doucement la tête et les épaules contre la surface sur laquelle repose le rat avec la paume de la main non dominante.
- Frottez doucement la peau du dos recouvrant les omoplates avec le pouce et l’index de la main non dominante, injectez du volume de L-DOPA avec la main dominante dans l’espace sous-cutané entre / sous les doigts, en gardant l’aiguille aussi parallèle que possible au corps pour éviter l’injection intramusculaire.
REMARQUE: Les rats ne sont pas anesthésiés avant l’injection. - Jetez chaque seringue individuelle usagée dans un récipient tranchant.
- Remplacez le rat dans sa cage individuelle et ajoutez des friandises nutritionnellement complètes, sauf les jours d’évaluation LID pour éviter toute interférence avec les évaluations comportementales jusqu’à ce que les évaluations soient terminées.
- Réglez la minuterie pendant 1 à 2 minutes en fonction du temps d’évaluation souhaité et du nombre de rats dans l’étude les jours d’évaluation. Récupérez la cage suivante et injectez le rat suivant lorsque la minuterie l’indique.
- Répétez cette opération, en injectant un rat toutes les 1 à 2 minutes, jusqu’à ce que tous les rats soient injectés.
- Immédiatement avant l’injection quotidienne de L-DOPA, ajouter le volume approprié de solution saline stérile au mélange lyophilisé pré-pesé L-DOPA et bensérazide dans le flacon ambré et bien agiter pendant 10 s (étape 2.3).
- Évaluation de la dyskinésie induite par la lévodopa après l’injection
- Évaluez l’intensité (tableau 1) et la fréquence (tableau 2) des mouvements de dyskinésie dystonique et hyperkinétique au nombre de points temporels souhaité, ce qui devrait inclure le début initial du comportement LID, le comportement maximal et la phase de déclin (voir le fichier supplémentaire 2 pour un exemple de feuille de journal d’évaluation LID).
- Pour les rats Sprague Dawley ou Fisher adultes mâles et femelles, 344 rats, et une taille d’échantillon de N = 40 rats, commencez les cotes de dyskinésie 20 minutes après la première injection de L-DOPA, puis à des intervalles de 50 minutes jusqu’à 220 ou 270 minutes après l’injection, selon le moment où les comportements LID ont cessé chez 90% à 100% des rats.
- Si vous utilisez des intervalles d’évaluation de 1 min, réglez une minuterie sur 1 min. Évaluez le premier rat pendant une minute. Passez au rat suivant et évaluez-le pendant 1 min. Continuez à travers tous les rats, en évaluant pendant 1 min d’intervalles.
- Avoir une minuterie positionnée à côté de la cage de manière visible afin que l’intensité du comportement lid (tableau 1) puisse être observée tout en estimant la fréquence d’un comportement donné (tableau 2) pendant la période d’évaluation.
- Une fois les évaluations pour le premier point de temps terminées, recommencez avec le premier rat au point de temps suivant (par exemple, 70 minutes après l’injection) et continuez à l’intervalle souhaité (par exemple, toutes les 50 minutes) jusqu’à ce que tous les points de temps soient terminés.
REMARQUE: En raison du chevauchement des tâches d’injection de L-DOPA et d’évaluation LID, deux personnes sont nécessaires les jours d’évaluation, une pour l’injection et une pour les évaluations comportementales.
Résultats
Les LID chez les rats parkinsoniens peuvent se manifester par une gamme de mouvements involontaires anormaux (AAM), y compris des comportements dystoniques, hyperkinétiques et stéréotypés. Les critères d’évaluation LID pour de tels comportements sont présentés ici pour inclure à la fois l’intensité (tableau 1) et la fréquence (tableau 2). Cela fournit un score global de gravité LID pour chaque rat qui reflète à la fois la qualité (intensité) et la quantité de temps p...
Discussion
Voici les détails de l’induction et de l’évaluation reproductibles des LID dans un modèle de rat parkinsonien après une lésion unilatérale 6-OHDA du système DA nigrostriatal. Alors qu’on pensait autrefois que les rongeurs ne développaient pas de LID et que l’asymétrie rotationnelle pouvait être l’analogue de lid chez les rats31, des modèles de rats et de souris ont été caractérisés au cours des deux dernières décennies et sont un outil bien accepté pour la recherche LID...
Déclarations de divulgation
Aucun conflit d’intérêts n’a été déclaré.
Remerciements
Nous voulons reconnaître les luttes de tous ceux qui souffrent de la maladie de Parkinson et la force et la résilience dont ils font preuve chaque jour, en particulier le père bien-aimé de KSC, Mark Steece. Les travaux représentés ici ont été soutenus par l’Institut national des troubles neurologiques et des accidents vasculaires cérébraux (NS090107, NS110398) et le Programme international de subventions de recherche de la Fondation Parkinson, maintenant la Fondation Parkinson. Nous tenons également à remercier Molly VanderWerp pour son excellente assistance éditoriale.
matériels
| Name | Company | Catalog Number | Comments |
| 100 Minutes Digital Timer | Staples | 1111764 | |
| Compass CX Compact Scale | Ohaus | 30428202 | |
| 5-(2-aminoethyl)-1,2,4-benzenetriol, monohydrobromide | Cayman Chemicals | 25330 | 6-OHDA is a catecholaminergic neurotoxin that is used to induce dopaminergic lesions and parkinsonian symptoms in rodents. |
| Allentown cages | Allentown, LLC | Rat900 | Allentown cages provide the ability to view the rats from all sides. |
| BD Allergist Trays with Permanently Attached Needle | BD | BD 305540 | For subcutaneous L-DOPA injections |
| Benserazide hydrochloride | Sigma-Aldrich | B7283 | Benserazide is a peripheral decarboxylase inhibitor used with L-DOPA to to induce dyskinesia in rodent models of PD. |
| Glass amber scintillation vials | Thermo Scientific | B7921 | Used for storage of L-DOPA/benserazide at -20 °C until mixed with sterile saline. |
| L-3,4-Dihydroxyphenylalanine methyl ester hydrochloride | Sigma-Aldrich | D1507 | L-3,4-Dihydroxyphenylalanine methyl ester is a precursor to L-DOPA that crosses the blood-brain barrierand use to treat parkinsonian symptoms in rodents. |
| Paper Mate Sharpwriter Mechanical Pencils | Staples | 107250 | |
| Rodent nutritionally complete enrichment treats | Bio-Serv | F05478 | |
| Round Ice Bucket with Lid, 2.5 L | Corning | 432129 | |
| Standard Plastic Clipboard | Staples | 1227770 | |
| Steel wired 6' long movable shelving units | Uline | H9488 | Width/Height can be adjusted to need/number of rats per experiment |
| Sterile Saline 0.9% | Covidien/Argyle | 1020 | For mixing with L-DOPA/benserazide prior to subcutaneous injections. |
Références
- Cotzias, G. C., Papavasiliou, P. S., Gellene, R. L-dopa in parkinson's syndrome. New England Journal of Medicine. 281, 272 (1969).
- Yahr, M. D., Duvoisin, R. C., Schear, M. J., Barrett, R. E., Hoehn, M. M. Treatment of parkinsonism with levodopa. Archives of Neurology. 21 (4), 343-354 (1969).
- Bastide, M. F., et al. Pathophysiology of L-dopa-induced motor and non-motor complications in Parkinson's disease. Progress in Neurobiology. 132, 96-168 (2015).
- Sellnow, R. C., et al. Regulation of dopamine neurotransmission from serotonergic neurons by ectopic expression of the dopamine D2 autoreceptor blocks levodopa-induced dyskinesia. Acta Neuropathologica Communications. 7 (1), 8 (2019).
- Bastide, M. F., Bezard, E. L-dopa induced dyskinesia in Parkinson's disease]. Bulletin de l'Académie Nationale de Médecine. 199 (2-3), 201-212 (2015).
- Hauser, R. A., et al. ADS-5102 (Amantadine) extended-release capsules for levodopa-induced dyskinesia in Parkinson's Disease (EASE LID 2 study): Interim results of an open-label safety study. Journal of Parkinson's Disease. 7 (3), 511-522 (2017).
- Huot, P., Johnston, T. H., Koprich, J. B., Fox, S. H., Brotchie, J. M. The pharmacology of L-DOPA-induced dyskinesia in Parkinson's disease. Pharmacological Reviews. 65 (1), 171-222 (2013).
- Steece-Collier, K., et al. Embryonic mesencephalic grafts increase levodopa-induced forelimb hyperkinesia in parkinsonian rats. Movement Disorders. 18 (12), 1442-1454 (2003).
- Thiele, S. L., Warre, R., Nash, J. E. Development of a unilaterally-lesioned 6-OHDA mouse model of Parkinson's disease. Journal of Visualized Experiments. (60), e3234 (2012).
- Simola, N., Morelli, M., Carta, A. R. The 6-hydroxydopamine model of Parkinson's disease. Neurotoxicity Research. 11 (3-4), 151-167 (2007).
- Borlongan, C. V., Hida, H., Nishino, H. Early assessment of motor dysfunctions aids in successful occlusion of the middle cerebral artery. Neuroreport. 9 (16), 3615-3621 (1998).
- Fleming, S. M. Behavioral outcome measures for the assessment of sensorimotor function in animal models of movement disorders. International Review of Neurobiology. 89, 57-65 (2009).
- Borlongan, C. V., Sanberg, P. R. Elevated body swing test: a new behavioral parameter for rats with 6-hydroxydopamine-induced hemiparkinsonism. Journal of Neuroscience. 15 (7), 5372-5378 (1995).
- Chang, J. W., Wachtel, S. R., Young, D., Kang, U. J. Biochemical and anatomical characterization of forepaw adjusting steps in rat models of Parkinson's disease: studies on medial forebrain bundle and striatal lesions. Neuroscience. 88 (2), 617-628 (1999).
- Lundblad, M., et al. Pharmacological validation of behavioural measures of akinesia and dyskinesia in a rat model of Parkinson's disease. European Journal of Neuroscience. 15 (1), 120-132 (2002).
- Olsson, M., Nikkhah, G., Bentlage, C., Bjorklund, A. Forelimb akinesia in the rat Parkinson model: differential effects of dopamine agonists and nigral transplants as assessed by a new stepping test. Journal of Neuroscience. 15 (5), 3863-3875 (1995).
- Monville, C., Torres, E. M., Dunnett, S. B. Comparison of incremental and accelerating protocols of the rotarod test for the assessment of motor deficits in the 6-OHDA model. Journal of Neuroscience Methods. 158 (2), 219-223 (2006).
- Steece-Collier, K., et al. Striatal Nurr1, but not FosB expression links a levodopa-induced dyskinesia phenotype to genotype in Fisher 344 vs. Lewis hemiparkinsonian rats. Experimental Neurology. 330, 113327 (2020).
- Steece-Collier, K., et al. Genetic silencing of striatal CaV1.3 prevents and ameliorates levodopa dyskinesia. Movement Disorders. 34 (5), 697-707 (2019).
- Tayarani-Binazir, K. A., Jackson, M. J., Strang, I., Jairaj, M., Rose, S., Jenner, P. Benserazide dosing regimen affects the response to L-3,4-dihydroxyphenylalanine in the 6-hydroxydopamine-lesioned rat. Behavioral Pharmacology. 23 (2), 126-133 (2012).
- Lindgren, H. S., Rylander, D., Ohlin, K. E., Lundblad, M., Cenci, M. A. The "motor complication syndrome" in rats with 6-OHDA lesions treated chronically with L-DOPA: relation to dose and route of administration. Behavioural Brain Research. 177 (1), 150-159 (2007).
- Suckow, M. A., Stevens, K. A., Wilson, R. P. . American College of Laboratory Animal Medicine series xvii. , 1268 (2012).
- Zhou, Y. Z., Alany, R. G., Chuang, V., Wen, J. Studies of the Rate Constant of l-DOPA Oxidation and Decarboxylation by HPLC. Chromatographia. 75, 597-606 (2012).
- Stroomer, A. E., Overmars, H., Abeling, N. G., van Gennip, A. H. Simultaneous determination of acidic 3,4-dihydroxyphenylalanine metabolites and 5-hydroxyindole-3-acetic acid in urine by high-performance liquid chromatography. Clinical Chemistry. 36 (10), 1834-1837 (1990).
- . PubChem Compound Summary for CID 6047, Levodopa Available from: https://pubchem.ncbi.nlm.nih.gov/compound/Levodopa (2021)
- Merck. . The Merck Index 13th edn. , (2021).
- Ortner, N. J., et al. Lower affinity of isradipine for L-Type Ca(2+) channels during substantia nigra dopamine neuron-like activity: Implications for neuroprotection in Parkinson's Disease. Journal of Neuroscience. 37 (228), 6761-6777 (2017).
- Hazra, A., Gogtay, N. Biostatistics series module 3: Comparing groups: Numerical variables. Indian Journal of Dermatology. 61 (3), 251-260 (2016).
- Mishra, P., Pandey, C. M., Singh, U., Keshri, A., Sabaretnam, M. Selection of appropriate statistical methods for data analysis. Annals of Cardiac Anaesthesia. 22 (3), 297-301 (2019).
- Divito, C. B., et al. Loss of VGLUT3 produces circadian-dependent hyperdopaminergia and ameliorates motor dysfunction and l-Dopa-Mediated dyskinesias in a model of Parkinson's Disease. Journal of Neuroscience. 35 (45), 14983-14999 (2015).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of enhanced behavioral responses to L-DOPA following repeated administration in the 6-hydroxydopamine-lesioned rat model of Parkinson's disease. Experimental Neurology. 151 (2), 334-342 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiology of Disease. 6 (6), 461-474 (1999).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. European Journal of Neuroscience. 10 (8), 2694-2706 (1998).
- Dekundy, A., Lundblad, M., Danysz, W., Cenci, M. A. Modulation of L-DOPA-induced abnormal involuntary movements by clinically tested compounds: further validation of the rat dyskinesia model. Behavioural Brain Research. 179 (1), 76-89 (2007).
- Collier, T. J., et al. Interrogating the aged striatum: robust survival of grafted dopamine neurons in aging rats produces inferior behavioral recovery and evidence of impaired integration. Neurobiology of Disease. 77, 191-203 (2015).
- Maries, E., et al. Focal not widespread grafts induce novel dyskinetic behavior in parkinsonian rats. Neurobiology of Disease. 21 (1), 165-180 (2006).
- Mercado, N. M., et al. The BDNF Val66Met polymorphism (rs6265) enhances dopamine neuron graft efficacy and side-effect liability in rs6265 knock-in rats. Neurobiology of Disease. 148, 105175 (2021).
- Cenci, M. A., Crossman, A. R. Animal models of l-dopa-induced dyskinesia in Parkinson's disease. Movement Disorders. 33 (6), 889-899 (2018).
- Lindenbach, D. Behavioral and cellular modulation of L-DOPA-induced dyskinesia by beta-adrenoceptor blockade in the 6-hydroxydopamine-lesioned rat. Journal of Pharmacology and Experimental Therapeutics. 337 (3), 755-765 (2011).
- Petzinger, G. M. Reliability and validity of a new global dyskinesia rating scale in the MPTP-lesioned non-human primate. Movement Disorders. 16 (2), 202-207 (2001).
- Fox, S. H., Johnston, T. H., Li, Q., Brotchie, J., Bezard, E. A critique of available scales and presentation of the Non-Human Primate Dyskinesia Rating Scale. Movement Disorders. 27 (11), 1373-1378 (2012).
- Cenci, M. A., Ohlin, K. E. Rodent models of treatment-induced motor complications in Parkinson's disease. Parkinsonism & Related Disorders. 15, 13-17 (2009).
- Cenci, M. A., Whishaw, I. Q., Schallert, T. Animal models of neurological deficits: how relevant is the rat. Nature Reviews: Neuroscience. 3 (7), 574-579 (2002).
- Zhang, Y., et al. Aberrant restoration of spines and their synapses in L-DOPA-induced dyskinesia: involvement of corticostriatal but not thalamostriatal synapses. Journal of Neuroscience. 33 (28), 11655-11667 (2013).
- Konradi, C., et al. Transcriptome analysis in a rat model of L-DOPA-induced dyskinesia. Neurobiology of Disease. 17 (2), 219-236 (2004).
- Morin, N., Jourdain, V. A., Di Paolo, T. Modeling dyskinesia in animal models of Parkinson disease. Experimental Neurology. 256, 105-116 (2014).
- Cenci, M. A., Riggare, S., Pahwa, R., Eidelberg, D., Hauser, R. A. Dyskinesia matters. Movement Disorders. 35 (3), 392-396 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon