Method Article
توصيف الوصلات العصبية العضلية في الفئران عن طريق الفحص المجهري المتحدي البؤري والفائق الدقة
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول طريقة للتحليل المورفومتري للوصلات العصبية العضلية عن طريق الفحص المجهري متحد البؤر و STED المشترك الذي يستخدم لتحديد التغيرات المرضية في نماذج الفئران من SMA و ColQ-related CMS.
Abstract
الوصلات العصبية العضلية (NMJs) هي نقاط اشتباك عصبي عالية التخصص بين الخلايا العصبية الحركية السفلية وألياف العضلات الهيكلية التي تلعب دورا أساسيا في نقل الجزيئات من الجهاز العصبي إلى العضلات الإرادية ، مما يؤدي إلى الانقباض. تتأثر بالعديد من الأمراض البشرية ، بما في ذلك الاضطرابات العصبية العضلية الموروثة مثل ضمور العضلات دوشين (DMD) ، ومتلازمات الوهن العضلي الخلقي (CMS) ، وضمور العضلات الشوكي (SMA) ، والتصلب الجانبي الضموري (ALS). لذلك ، فإن مراقبة مورفولوجيا الوصلات العصبية العضلية وتغييراتها في نماذج الفئران المرضية تمثل أداة قيمة للدراسات المرضية والتقييم قبل السريري للنهج العلاجية. هنا ، يتم وصف طرق وضع العلامات وتحليل التشكل ثلاثي الأبعاد (3D) للأجزاء قبل وبعد المشبكي من الألواح الطرفية الحركية من ألياف العضلات المثارة بالفئران. تم تفصيل إجراءات تحضير العينات وقياس حجم NMJ والمساحة والتعرج ومورفولوجيا / إشغال المحطة المحورية عن طريق التصوير متحد البؤر ، والمسافة بين طيات الوصلة بعد المشبكية وعرض شريط مستقبلات الأسيتيل كولين (AChR) بواسطة الفحص المجهري لاستنفاد الانبعاثات المحفزة فائقة الدقة (STED). يتم توضيح التعديلات في معلمات NMJ هذه في الفئران الطافرة المتأثرة ب SMA و CMS.
Introduction
الوصلة العصبية العضلية (NMJ) عبارة عن بنية معقدة تتكون من طرف محوري حركي ، وخلية شوان حول المشبكي ، وجزء من الألياف العضلية الهيكلية يشارك في نقل المعلومات الكيميائية واقتران نشاط الخلايا العصبية الحركية السفلية بتقلص العضلات. في الثدييات ، يتغير مورفولوجيا الوصلة العصبية العضلية أثناء التطور ، ويتخذ شكلا نموذجيا يشبه البسكويت المملح بعد النضج ، مع وجود اختلافات في الشكل والتعقيد بين الأنواع ، ويظهر درجة معينة من اللدونة استجابة للعمليات الفسيولوجية مثل التمرين أو الشيخوخة1،2،3،4 . تشكل الصفيحة الطرفية الحركية بعد المشبكية غزوات غشائية تسمى الطيات الموصلية ، حيث يكون الجزء العلوي الذي يحتوي على مستقبلات الأسيتيل كولين (AChR) على اتصال وثيق بفرع المحور المحوري الطرفي قبل المشبكي5.
تساهم التغيرات المورفولوجية والوظيفية في الوصلات العصبية العضلية في الفيزيولوجيا المرضية للعديد من الاضطرابات التنكسية العصبية مثل ضمور العضلات الشوكي (SMA) والتصلب الجانبي الضموري (ALS) ، والاعتلالات العضلية مثل الحثل العضلي الدوشيني (DMD) ، ومتلازمات الوهن العضلي الخلقي (CMS) ، والوهن العضلي الوبيل (MG) والاعتلالات العضلية المركزية (CNM) ، والساركوبينيا المرتبطة بالشيخوخة3،6،7،8،9 ، 10،11،12. في هذه الأمراض ، لوحظت تغيرات هيكلية NMJ مثل تجزئة الصفيحة الطرفية ، وانخفاض حجم طية الوصلة بعد المشبكية و / أو إزالة التعصيب. يمكن أن يكون علم أمراض NMJs حدثا أوليا أو مبكرا أثناء تطور المرض أو يظهر مؤخرا كحدث ثانوي يساهم في المظاهر السريرية. على أي حال ، فإن مراقبة مورفولوجيا NMJs في النماذج الحيوانية لهذه الأمراض تمثل معلمة قيمة لدراسة التغيرات المرضية وتقييم فعالية العلاجات المحتملة.
عادة ما يتم تحليل مورفولوجيا الوصلات العصبية العضلية من خلال التقنيات التي تستخدم المجهر متحد البؤر2،13،14،15 أو المجهر الإلكتروني5،16 ، مع قيودها المتأصلة مثل الدقة أو الصعوبات التقنية ، على التوالي. في الآونة الأخيرة ، تم استخدام الفحص المجهري فائق الدقة أيضا لتصور مناطق معينة من NMJ ، مثل المناطق النشطة قبل المشبكية أو توزيع AChR على الغشاء بعد المشبكي16،17،18 ، كنهج بديل أو تكميلي للتحليل البنيوي الفائق بواسطة المجهر الإلكتروني.
يهدف هذا البروتوكول إلى توفير طريقة مفصلة وقابلة للتكرار لتقييم المعلمات المورفولوجية NMJ من خلال الجمع بين الفحص المجهري الفلوري متحد البؤر ومستنفد الانبعاثات المحفز (STED). تم تحديد السمات المهمة للصفائح الطرفية قبل المشبكية وما بعد المشبكية ، مثل الحجم والمساحة والتعرج النسبي وعرض شريط AChR والتوزيع الطرفي المحوري في ألياف العضلات المعصبة من الساق الساقي و tibialis الأمامي في سياق الظروف الطبيعية والمريضة. على وجه الخصوص ، تم تجسيد عيوب NMJ في نموذج Smn 2B / - للفأر لضمور العضلات الشوكي ، وهو مرض عصبي عضلي مع تنكس الخلايا العصبية الحركية الناجم عن طفرات في جين SMN1 11,19 ، وفي وحدة فرعية من ذيل يشبه الكولاجين من فئران أستيل كولينستراز غير المتماثلة (ColQ Dex2 / Dex2 أو ColQ-KO) ، كنموذج لمتلازمة الوهن العضلي الخلقي 20 ، 21,22.
Protocol
تم إجراء رعاية الفئران والتلاعب بها وفقا للتشريعات الوطنية والأوروبية بشأن التجارب على الحيوانات ووافقت عليها اللجنة الأخلاقية المؤسسية. تم استخدام الذكور والإناث من الفئران Smn2B / - (خلفية C57Bl / 6J) و ColQ Dex2 / Dex2 (خلفية B6D2F1 / J) في عمر 3 و 6 أسابيع ، على التوالي ، في الدراسة.
1. القتل الرحيم للفئران وتشريح العضلات: الظنبوب الأمامي والساق
- انتقل إلى تخدير الفأر عن طريق الحقن داخل الصفاق لمحلول مختلط كيتامين (87.5 ملغ/كغ)/زيلازين (12.5 ملغ/كغ) (0.1 مل/20 غرام من وزن الجسم) قبل القتل الرحيم عن طريق خلع عنق الرحم.
ملاحظة: نظرا لأن SMA و ColQ-CMS يؤثران على الأفراد بشكل مستقل عن جنسهم ، فقد تم استخدام الفئران الذكور والإناث في البروتوكول الحالي. - قم بإزالة شعر الأطراف الخلفية باستخدام ماكينة حلاقة كهربائية صغيرة وشطف الساقين بنسبة 70٪ من الإيثانول.
ملاحظة: سيختلف إجراء التشريح لكل عضلة. لتشريح الظنبوب الأمامي (TA) ، اتبع الخطوات 1.2.1-1.2.3 ، وبالنسبة للساق (GA) (الأجزاء الإنسية والجانبية) ، اتبع الخطوات 1.2.4-1.2.6. تعامل مع العضلات برفق لمنع تلف الأنسجة وسحقها أو تمديدها أثناء التشريح.- ضع الماوس في وضع ضعيف.
- قم بعمل شق جلدي يبلغ 5 مم باستخدام مقص حاد حاد على طول الجزء الأمامي الخارجي من الطرف الخلفي البعيد ، بالتوازي مع الساق ، لفضح العضلات. استخدم مقصا رفيعا جدا لإزالة اللفافة.
- اقطع الوتر البعيد أولا (بالقرب من المخلب) ثم الوتر القريب (بالقرب من الركبة) باستخدام مقص رفيع للغاية وملقط رفيع منحني. تعامل مع العضلات بعناية لتجنب تلف الألياف العضلية والأعصاب.
ملاحظة: يجب تقسيم الوتر القريب قدر الإمكان من العظم لحصاد العضلات بأكملها. - ضع الماوس في وضعية الانبطاح ، واستخدم مقصا حادا حادا لعمل شق جلدي من الجزء العلوي من المقصورة الخلفية البعيدة إلى المخلب ، وقم بإزالة الجلد.
- أمسك وتر العرقوب بملقط مسنن متوسط ، واقطعه بمقص رفيع للغاية وافصل GA برفق عن الأنسجة المحيطة مرة أخرى إلى إدخاله القريب.
- على الجانب القريب ، أدخل الملقط المسنن المتوسط في الجيب المتشكل بين العضلة ذات الرأسين الفخذية (BF) و GA. افصل بين العضلتين لقطع وتر GA في أقرب وقت ممكن من إدخال العظم بمقص رفيع للغاية.
- لتثبيت الأنسجة ، ضع كل عضلة في أنبوب طرد مركزي دقيق سعة 2 مل يحتوي على 1 مل من محلول بارافورمالدهيد (PFA) 4٪ وزن / فولت مخفف في محلول ملحي عازل للفوسفات (PBS بدون Ca2 + Mg 2+) واحتفظ به عند 4 درجات مئوية لمدة18-24 ساعة.
تنبيه: بارافورمالدهيد والفورمالديهايد سامان ويجب التعامل معهما في غطاء دخان كيميائي مع معدات واقية كافية. - في اليوم التالي ، اغسل العضلات الثابتة 3 مرات لمدة 5 دقائق باستخدام PBS في 12 لوحة جيدة عن طريق الهز برفق في درجة حرارة الغرفة (RT) داخل غطاء دخان كيميائي.
ملاحظة: يمكن إيقاف البروتوكول في هذه الخطوة ومتابعته في غضون شهر. في هذه الحالة ، أضف PBS المكمل ب 0.01٪ أزيد الصوديوم لتخزين العينات عند 4 درجات مئوية. - ندف كل عضلة في حزم ألياف صغيرة بعرض حوالي 1 مم باستخدام ملقطين مسنين ناعمين.
ملاحظة: من الضروري التعامل مع العضلات بلطف شديد باستخدام الملقط ، دون استخدام القوة المفرطة ، لمنع تلف الأنسجة أثناء الإغاظة.- افصل عضلة TA إلى 3 أو 4 حزم حسب حجمها.
- بالنسبة إلى GA ، افصل الأجزاء الإنسية والجانبية من العضلات ثم افصل كل جزء إلى 4-5 حزم حسب حجمها.
2. تلطيخ المناعة
- المضي قدما في نفاذية الألياف العضلية: انقل حزم العضلات إلى 24 لوحة بئر تحتوي على 1٪ (v / v) Triton X-100 في PBS واحتفظ بها تحت التحريك اللطيف (50 دورة في الدقيقة) لمدة 1 ساعة عند RT أو 5 ساعات عند 4 درجات مئوية.
ملاحظة: قسم حزم العضلات بين لوحين للمضي قدما في تلطيخ مناعي منفصل وتقليل خطر ارتباك الأجسام المضادة. لا تقسمها إلى أكثر من بئرين (1 بئر / لوحة) ؛ خلاف ذلك ، قد يكون عدد (N) من NMJs التي تمثل حالتها العامة في العضلات التي تم تحليلها غير كافية. - اغسل العينات 3 مرات لمدة 5 دقائق باستخدام PBS في RT واحتضنها بمحلول مانع يتكون من 4٪ ألبومين مصل بقري (BSA) في PBS / Triton X-100 1٪ لمدة 4 ساعات عند 4 درجات مئوية ، تحت تحريض لطيف (50 دورة في الدقيقة).
ملاحظة: لا تستخدم مضخة شفط أثناء خطوات الغسيل ، بل قم بشفط المحلول يدويا باستخدام ماصة سعة 200 ميكرولتر وأطراف صغيرة الحجم (يشار إلى المرجع في جدول المواد). - احتضان العينات طوال الليل (O / N) عند 4 درجات مئوية تحت التحريك اللطيف (50 دورة في الدقيقة) مع محلول الحجب المشار إليه في الخطوة 2.2 الذي يحتوي على أجسام مضادة أولية وحيدة النسيلة ضد الخيوط العصبية M (NF-M ، 2H3 ، التخفيف 1/200) أو البروتين السكري الحويصلي المشبكي 2 (SV2 ، التخفيف 1/200) لتسمية نهايات المحور العصبي قبل المشبكي أو المناطق النشطة ، على التوالي.
- في اليوم التالي ، اغسل حزم العضلات 3 مرات لمدة 5 دقائق في برنامج تلفزيوني تحت الإثارة (50 دورة في الدقيقة).
- للتصوير متحد البؤر: احتضان حزم العضلات بأجسام مضادة ثانوية مضادة للفأر مترافقة مع فلوروفور ينبعث منه اللون الأحمر (F594) (تخفيف 1/500) و α-bungarotoxin مترافق مع فلوروفور باعث للأخضر (α-BTX-F488) (تخفيف 1/1000) في PBS لمدة 2 ساعة في RT تحت الإثارة (50 دورة في الدقيقة).
- للتصوير بالاتصال الجنسي: احتضان حزم العضلات بأجسام مضادة ثانوية مضادة للفأر مقترنة بفلوروفور ينبعث منه اللون الأخضر (F488) (التخفيف 1/500) و α-bungarotoxin مترافق مع فلوروفور ينبعث منه اللون الأحمر البعيد يتميز بثبات ضوئي عالي (α-BTX-F633) (تخفيف 1/1000) في PBS لمدة 2 ساعة عند RT تحت الإثارة (50 دورة في الدقيقة).
ملاحظة: لا تعرض العينات للضوء أثناء الحضانة لتجنب التبييض الضوئي.
- اغسل حزم العضلات المصنفة 3x لمدة 5 دقائق باستخدام PBS تحت التحريض (50 دورة في الدقيقة) وضعها على شريحة بوسيط تركيب.
ملاحظة: ضع من 4 إلى 5 حزم عضلية كحد أقصى لكل شريحة للسماح بإحكام الغلق. - أضف غطاء زجاجي من الدرجة # 1.5 (أو # 1.5H) (سمك 0.17 مم) في الأعلى ، وضع مغناطيسا أسطوانيا على جانبي الشريحة للضغط وتسطيح العضلات.
- حافظ على الشرائح محمية من الضوء O / N عند 4 درجات مئوية. أغلق الشرائح بشكل دائم باستخدام طلاء الأظافر.
3. الحصول على الصور
- عمليات الاستحواذ بواسطة مجهر متحد البؤر
ملاحظة: تم جمع الصور باستخدام مجهر متحد البؤر مقلوب للمسح بالليزر باستخدام هدف غمر الزيت بقوة 63x (HCX Plan Apo CS ، فتحة عددية 1.4 (NA)).- بالنسبة للتحليل الأعمى ، دع شخصا غير مشارك في التحليل يرمز إلى كل شريحة برقم معين. ابق أعمى عن المجموعات التجريبية حتى يكتمل القياس الكمي لمعلمات NMJ لجميع العينات.
- قم بتشغيل برنامج المجهر في وضع التكوين > machine.xlhw (الشكل التكميلي 1).
- ضع الشريحة على مرحلة المجهر وابحث عن مستوى المراقبة داخل العينة من خلال النظر تحت إضاءة مضان المجال الواسع DAPI باستخدام مجموعة مرشح DAPI.
- انقر فوق فتح مشروع > مشاريع جديدة وقم بإنشاء مجلد لتخزين عمليات الاستحواذ على الصور (الشكل التكميلي 1).
ملاحظة: إنشاء مشروع جديد لكل NMJ للحد من حجم المجلد ومنع مشاكل ذاكرة الكمبيوتر. - لإدارة معلمات الاستحواذ ، انقر فوق نافذة علامة التبويب الاستحواذ واضبط الثقب متحد البؤر على وحدة 1.0 Airy وطاقة الليزر لتحسين مستويات الكسب والإزاحة للمضان الأخضر / F488 (α-BTX) باستخدام ليزر 488 نانومتر في لوحة النهاية التي يجب تصويرها (الوضع المباشر ON).
- بعد ذلك ، قم بتحسين اكتساب التألق الأحمر / F594 (NF-M أو SV2) باستخدام ليزر يتكيف مع مراقبة F594. في هذه الدراسة ، تم استخدام ليزر 552 نانومتر (الوضع المباشر ON). اضبط طيف انبعاث الصبغة بالنطاقات التالية لكل ليزر: ليزر 405 (DAPI) من 414 إلى 483 نانومتر ، ليزر 488 (F488-α-BTX) من 506-531 نانومتر ، وليزر 552 (NF-M / SV2) من 622-650 نانومتر.
- اجمع أكوام الصور للتقاطعات العصبية العضلية في كل مجموعة تجريبية بنفس الإعدادات: حجم الصورة 1024 × 1024 بكسل (73.7 × 73.7 ميكرومتر) بمعدل أخذ عينات 400 هرتز ، ثنائي الاتجاه X ON ، عامل التكبير 2.5 ، حجم Z-step 0.5 ميكرومتر في وضع Z-Wide.
ملاحظة: لكل NMJ ، يتم تعيين عدد الشرائح للحصول على التقاطع بأكمله. تفي إعدادات الاستحواذ الموضحة أعلاه بنظرية أخذ العينات Nyquist-Shanon. ومع ذلك ، يمكن للمستخدم النقر فوق الزر " تحسين التنسيق" ، الموجود في جميع برامج التشغيل البؤرية الحديثة ، لضمان أن حجم البكسل والخطوة Z تلبي معدل أخذ العينات المثالي من Nyquist. سيؤدي هذا الإجراء إلى تجنب الصور الزائدة أو التي تم أخذ عينات منها ، مما سيؤدي إلى فقدان الدقة في قياسات الحجم. - احفظ الملف الأصلي (.lif) أو صور Z-stack (.tif) في مجلد باسم يتضمن الاسم الرمزي للشريحة ونوع التلوين ورقم لوحة النهاية.
ملاحظة: اجمع بالتسلسل (وليس في وقت واحد) عمليات المسح باستخدام ليزر 488 نانومتر و 552 نانومتر (F488 و F594) لتجنب الحديث المتبادل لمضان F488 في قناة F594 والعكس صحيح (التسييل). ملاحظة: يمكن تكوين مسار الشعاع باستخدام مساعد الصبغة في برنامج المجهر. - قم بالتغيير إلى الشريحة المشفرة التالية وكرر الخطوات 3.1.3-3.1.8 لكل NMJ.
- في نهاية الجلسة ، انقر فوق فتح في عارض 3D واختر ممثل NMJ لمجموعة تجريبية لتصور وضع العلامات ثلاثية الأبعاد.
ملاحظة: سيساعد وضع العرض هذا في التحقق من صحة معلمات الاكتساب. - أغلق برنامج المجهر ، وقم بتنظيف الأهداف باستخدام أنسجة العدسة ، ثم قم بإيقاف تشغيل النظام.
- عمليات الاستحواذ بواسطة الفحص المجهري STED
ملاحظة: تم جمع الصور باستخدام مجهر متحد البؤر مقلوب للمسح الضوئي بالليزر مزود ب Gated STED عند 775 نانومتر باستخدام هدف غمر الزيت 100x (HC PL APO CS2 1.4 NA).- بالنسبة للتحليل الأعمى ، دع شخصا غير مشارك في التحليل يرمز إلى كل شريحة برقم معين. ابق أعمى عن المجموعات التجريبية حتى يكتمل القياس الكمي لمعلمات NMJ لجميع العينات.
- قم بتشغيل برنامج المجهر في وضع التكوين > machine.xlhw و STED ON (الشكل التكميلي 2).
- انقر فوق فتح مشروع > مشاريع جديدة لإنشاء مجلد لتخزين عمليات الاستحواذ على الصور.
ملاحظة: إنشاء مجلد جديد لكل شريحة للحد من حجم المجلد ومنع مشاكل ذاكرة الكمبيوتر. - ضع الشريحة على مسرح المجهر وشاهدها تحت إضاءة مضان واسعة المجال باستخدام ليزر 488 نانومتر للعثور على مستوى المراقبة داخل العينة.
- ابحث عن NMJ المسمى بالخيوط العصبية M (NF-M) أو تلطيخ SV2 باستخدام ليزر 488 نانومتر مع اكتشاف طيفي من 506-531 نانومتر.
- عندما يتم تحديد NMJ ، انقر فوق تنشيط STED وابدأ في الحصول على صور في منطقة تحتوي على عدة طيات تقاطع (الشكل التكميلي 3) باستخدام ليزر 635 نانومتر مع اكتشاف طيفي من 640-750 نانومتر.
ملاحظة: كن حذرا من جدول البحث عن التشبع أثناء الحصول على الصورة وانقر فوق الزر Quick LUT لتجنب التعرض المفرط (القيم الرمادية >255؛ ل 8 بت). - اجمع صور كل مجموعة تجريبية بنفس الإعدادات: حجم الصورة 2048 × 2048 بكسل (38.75 × 38.75 ميكرومتر) بمعدل أخذ عينات 400 هرتز.
ملاحظة: تم ضبط طاقة ليزر الاستنفاد (STED) على 65٪. - احفظ الصور باسم ملف يتضمن رمز الشريحة.
ملاحظة: من الممكن النقر فوق تنسيق XY المحسن: تعيين التنسيق للحصول على أفضل إعداد اكتساب باستخدام تصوير STED. - قم بالتغيير إلى الشريحة المشفرة التالية وكرر الخطوات 3.2.3-3.2.8. كرر هذا الإجراء لجميع الشرائح.
- في نهاية جلسة الفحص المجهري STED ، انقل ملفات الصور إلى كمبيوتر آخر واحفظ الملفات الأصلية (. lif) في محرك أقراص خارجي أو خادم.
- قم بإيقاف تشغيل برنامج المجهر ، وتنظيف الأهداف باستخدام أنسجة العدسة ، ثم قم بإيقاف تشغيل النظام.
4. تحليل الصور - الفحص المجهري متحد البؤر
ملاحظة: تمت معالجة جميع الصور باستخدام أجهزة الكمبيوتر التي تستخدم نظام التشغيل Microsoft Windows 10 الاحترافي.
- قم بتشغيل ImageJ والماكرو المخصص لحساب حجم لوحة نهاية NMJ بعد المشبكي ومنطقة إسقاط الكثافة القصوى (MIP) والالتواء النسبي.
- قم بمعالجة مكدسات صور NMJ باستخدام برنامج NIH ImageJ المجاني23 والمكون الإضافي iGeodesic والماكرو المخصص للحصول على قياسات معلمات NMJ. قم بتشغيل برنامج ImageJ.
ملاحظة: أحدث إصدار من ImageJ متاح مجانا ويمكن تنزيله24. من أجل فتح تنسيقات الملفات الخاصة ، يجب تنزيل المكون الإضافي Bio-Format Package25 26 . هذه الخطوة ليست ضرورية في حالة استخدام المشغل لفيجي لأن المكون الإضافي مثبت بالفعل في البرنامج. البرنامج المساعد iGeodesic27 لحساب التعرج متاح أيضا عبر الإنترنت28 ؛ تحقق من توفر هذا المكون الإضافي في إصدار ImageJ/Fiji الذي سيتم استخدامه. تتوفر وحدات الماكرو المخصصة أيضا عبر الإنترنت29. - قم بسحب وإسقاط Macro_NMJ_VOL_Marinelloetal.ijm (مخصص ، ملف ترميز تكميلي 1) إلى نافذة ImageJ ؛ سيتم فتح الماكرو في نافذة ثانية. في هذه النافذة الجديدة ، انقر فوق وحدات الماكرو > تشغيل ماكرو.
ملاحظة: يمكن للماكرو معالجة كل من ملفات الملكية وملفات TIFF. يجب أن تفي الملفات بالمعايير التالية: بالنسبة لتنسيقات الملفات المسجلة الملكية ، احفظ تقاطعا واحدا فقط (أي كومة الصور) لكل ملف ، مرتبة في مجلد ؛ بالنسبة لصور TIFF ، يجب حفظ الملفات في مجلد يحتوي على مجلدات فرعية ، كل منها يسمى JunctionX (X يتوافق مع رقم NMJ) مع مكدسات الصور لتقاطع معين (RGB TIFF) (الشكل التكميلي 4). - حدد المجلد الأصلي الذي يحتوي على مجلدات Junction الفرعية التي يجب تحليلها وانقر فوق تحديد.
- في القائمة المنبثقة الجديدة المسماة حفظ المجلد ، حدد مجلد التخزين وانقر فوق تحديد.
- في القائمة المنبثقة الجديدة المسماة نوع الصورة، حدد تنسيق عمليات الاستحواذ Z-stack.
- حدد قناة RGB المقابلة لتلطيخ الاهتمام وحدد حجم بكسل XY والخطوة Z (z). سيقوم الماكرو بإجراء التحليل تلقائيا.
ملاحظة: في حالة تحديد تنسيقات الملفات الاحتكارية، يقرأ الماكرو مباشرة حجم البكسل والخطوة Z (z). ومع ذلك ، لا يزال يتعين على المستخدم الإشارة إلى قناة الاهتمام (C1 أو C2 أو C3). سيوفر الماكرو ورقة بيانات (.csv) لكل معلمة تقاطع (حجم لوحة النهاية ومنطقة MIP والتعارف) في مجلد الحفظ. يولد الماكرو أيضا ثلاثة . TIF ، والتي تتوافق مع محيط Drawing_MaxprojX.tif تلطيخ α-BTX و DrawingJunctionX.tif و MIP MaxprojX.tif. يتم إنشاء ملفات TIFF هذه للتحقق من جودة عمليات الاستحواذ ولضمان إجراء معالجة الصور بشكل صحيح.
حجم NMJ بعد المشبكي (V): سيفصل الماكرو الصور عن NMJ واحد ويحتفظ بقناة α-bungarotoxin F488 المقابلة للوحة النهاية بعد المشبكي. يتم تقسيم المكدس باستخدام عتبة Otsu30 على الشريحة الوسيطة من المكدس. الصورة الثنائية الناتجة هي 1 بكسل متوسعة ، ويتم استخدام ميزة تحليل الجسيمات لقياس مساحة اللوحة النهائية لكل كائن تم اكتشافه. للحصول على حجم NMJ بعد المشبكي ، يجمع الماكرو جميع مناطق اللوحة الطرفية المقاسة للمكدس ويضربها في قيمة Z-step (z) بالميكرومتر.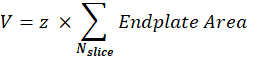
منطقة لوحة نهاية الإسقاط الأقصى للكثافة (MIP): بعد عتبة المكدس ، يتم الحصول على إسقاط الكثافة القصوى (MIP) باستخدام ميزة Z-project ImageJ. ثم يتم استخدام ميزة تحليل الجسيمات لتحديد منطقة لوحة نهاية MIP.
تعرج NMJ MIP (T): يتم حساب تعرج NMJ ، الذي يعكس درجة تعقيد الصفيحة الطرفية للمحرك بعد المشبكي بما في ذلك الطيات والثقوب31 ، بناء على كل MIP باستخدام الصيغة التالية ، حيث d Obj (AB) هي المسافة بين A و B على طول محيط الكائن ، و dEuc (AB) هي المسافة الإقليدية بين A و B (خط مستقيم).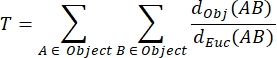
- قم بتعيين أعلى قيمة تعرج في مجموعة النوع البري لكل حالة تجريبية إلى 100٪ ، وقم بتطبيع جميع القيم الأخرى للحالة التجريبية إلى هذه القيمة من أجل الحصول على تعرج NMJ النسبي.
- قم بمعالجة مكدسات صور NMJ باستخدام برنامج NIH ImageJ المجاني23 والمكون الإضافي iGeodesic والماكرو المخصص للحصول على قياسات معلمات NMJ. قم بتشغيل برنامج ImageJ.
- قم بتشغيل ImageJ والماكرو المخصص لتحديد تراكم الخيوط العصبية قبل المشبكية وتلطيخ البروتين السكري الحويصلي المشبكي 2.
ملاحظة: تراكم الخيوط العصبية (هنا ، NF-M) و / أو التوزيع المتغير للحويصلات المشبكية (هنا ، SV2) هي علامات على النقل المحوري غير الطبيعي و / أو ضعف الاتجار بالحويصلات وقد لوحظت سابقا في NMJs لمختلف نماذج الماوس SMA32،33،34.- قم بسحب وإسقاط Macro_NMJ_ACCU_Marinelloetal.ijm (مخصص ، ملف ترميز تكميلي 2) إلى نافذة ImageJ ؛ سيتم فتح الماكرو في نافذة ثانية. في هذه النافذة الجديدة ، انقر فوق وحدات الماكرو > تشغيل ماكرو.
ملاحظة: يمكن للماكرو معالجة كل من تنسيقات الملفات الخاصة وملفات TIFF. يجب أن تفي الملفات بالمعايير المشار إليها في الملاحظة أدناه الخطوة 4.1.2. - حدد المجلد الأصلي الذي يحتوي على مجلدات Junction الفرعية التي يجب تحليلها وانقر فوق تحديد.
- في القائمة المنبثقة الجديدة المسماة حفظ المجلد ، حدد مجلد التخزين وانقر فوق تحديد.
- في القائمة المنبثقة الجديدة المسماة نوع الصورة، حدد تنسيق عمليات الاستحواذ Z-stack.
- في النافذة المنبثقة Staining Infos ، أشر إلى التسمية واللون قبل المشبكي وما بعد المشبكي وانقر فوق موافق. على سبيل المثال ، التسمية قبل المشبكية: SV2 أو NF ، اللون قبل المشبكي: R ، التسمية بعد المشبكية: BTX ، لون ما بعد المشبكي: G.
ملاحظة: بالنسبة لتنسيقات الملفات المسجلة الملكية ، يجب الإشارة إلى الملصقات والقنوات المقابلة (C1 أو C2 أو C3). - في النافذة المنبثقة حجم البكسل ، حدد حجم بكسل XY 0.072 ميكرومتر وخطوة Z 0.5 ميكرومتر (z) وانقر فوق موافق. سيقوم الماكرو بإجراء التحليل تلقائيا.
ملاحظة: تتوافق هذه المعلمة مع حجم الصورة 1024 × 1024 بكسل (73.7 × 73.7 ميكرومتر) المحدد قبل اكتساب المجهر متحد البؤر ، وهي مرتبطة بإعدادات الهدف والتكبير. إذا تم تحديد تنسيقات الملفات الخاصة ، فإن الماكرو يقرأ مباشرة حجم البكسل والخطوة Z (z). سيخزن الماكرو ، في مجلد الحفظ ، ورقة بيانات (.csv) لوحدات التخزين قبل المشبكية وما بعد المشبكية ، صورة TIFF متعددة الصفحات للكشف الحالي لكل تسمية (قبل وبعد المشبكي). كما هو موضح أعلاه ، يتم إنشاء ملفات TIFF هذه للتحقق من جودة عمليات الاستحواذ ولضمان إجراء معالجة الصور بشكل صحيح.
يحسب الماكرو حجم تلطيخ M للخيوط العصبية المحورية (حجم NF) من قناة NF-M-F594 التي تتزامن مع وضع العلامات α-bungarotoxin-F488 وحجم تلطيخ البروتين السكري الحويصلي المتشابك NMJ 2 (حجم SV2) من قناة SV2-F594 التي تتوافق مع وضع العلامات α-BTX-F488. يتم قياس تراكم NF-M عن طريق حساب النسبة بين حجم NF وحجم لوحة النهاية بعد المشبكي (α-BTX) وإشغال محطة محور NMJ بنسبة أحجام SV2 و α-BTX ، كما هو موضح أدناه.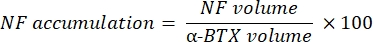
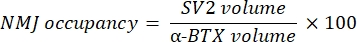
- قم بسحب وإسقاط Macro_NMJ_ACCU_Marinelloetal.ijm (مخصص ، ملف ترميز تكميلي 2) إلى نافذة ImageJ ؛ سيتم فتح الماكرو في نافذة ثانية. في هذه النافذة الجديدة ، انقر فوق وحدات الماكرو > تشغيل ماكرو.
5. تحليل الصور - الفحص المجهري STED
ملاحظة: تم إجراء معالجة الصور باستخدام البرنامج غير المتصل بالشركة المصنعة للمجهر STED.
- قم بتشغيل برنامج المجهر.
- افتح المشروع بالنقر فوق الزر "فتح مشروع ". حدد ملف المشروع (.lif) وافتحه. يتم عرض الصور على الشاشة مع أسمائها.
- في نافذة العملية : انقر فوق تقليل الضوضاء > الوسيط. في الجزء السفلي من النافذة الوسطى ، اضبط نصف القطر على 5.00 والتكرار على 1.00 ، وقم بإلغاء تحديد التصفية ثلاثية الأبعاد.
- ثم حدد علامة التبويب فتح المشاريع في الجزء العلوي الأيسر من النافذة واختر صورة.
- انقر فوق تطبيق للتحقق من صحة المعلمات. يتم إنشاء صورة جديدة تسمى "nameofimage_median001".
ملاحظة: من الممكن النقر فوق معاينة قبل تطبيق لمراقبة تأثير مرشح الوسيط ، مما سيعزز تباين الصورة ويسهل ملفات تعريف الخط المستخدمة في القياس الكمي. - قم بتطبيق المرشح على جميع الصور كما هو موضح في الخطوات 5.4-5.5.
- في علامات التبويب Open Projects ، انقر فوق رمز محرك الأقراص المرنة لحفظ جميع المشاريع ، بما في ذلك الصور التي تمت تصفيتها حديثا.
ملاحظة: سيتم تنفيذ الخطوة التالية باستخدام الصورة التي تمت تصفيتها المسماة "nameofimage_median001". - احسب المسافة بين خطوط AChR
ملاحظة: غالبا ما يتم ملاحظة التغييرات في مورفولوجيا طيات ما بعد الوصلة في الاضطرابات العصبية العضلية كعلامة على علم أمراض NMJ (عدم النضج أو الانحطاط). يتم حساب المسافة (د) بين خطوط AChR ، والتي يتم اكتشافها بواسطة تلطيخ α-bungarotoxin ، عن طريق إنشاء ملفات تعريف الكثافة وتحديد المسافة بين كل ذروة شدة قصوى عن طريق رسم ملف تعريف خط (الشكل التكميلي 5).- باستخدام برنامج المجهر ، حدد قائمة Quantify أعلى النافذة المركزية.
- انقر فوق علامة التبويب أدوات في الجزء العلوي الأيسر. حدد الكثافة في اللوحة العلوية اليسرى وانقر على أيقونة ملف تعريف الخط . اضبط أخذ العينات الزائدة على 1 ، وحدد فرز القنوات.
- انقر فوق علامات التبويب Open Projects وحدد الصورة التي تمت تصفيتها ليتم تحليلها.
ملاحظة: من الممكن تكبير الصورة عن طريق التمرير باستخدام فأرة الكمبيوتر. يمكن تعديل النطاق الديناميكي للصورة باستخدام الشريط الموجود على الجانب الأيسر بجوار الصورة المعروضة ، مما يسهل تصور الخطوط. - ثم ، انقر فوق رمز Draw Line في القائمة العلوية للنافذة اليمنى وتتبع خطا يتقاطع بشكل عمودي عدة خطوط / طيات وصلة.
ملاحظة: يتم عرض ملف تعريف الكثافة في النافذة المركزية. - انقر فوق الجزء العلوي من القمة الأولى وحرك مؤشر الماوس مع الاستمرار في الضغط على زر الماوس الأيسر حتى يتم الوصول إلى الذروة القصوى التالية.
ملاحظة: يتم عرض المعلومات في ملف تعريف الشدة ، بينما يتم عرض المسافة بين القمتين أسفل الرسم البياني بفئة "dx". - انقر بزر الماوس الأيمن أثناء وجودك في صورة النافذة اليمنى وحدد حفظ عائد الاستثمار. افتح عائد الاستثمار المحفوظ (مناطق الاهتمام) بالنقر فوق تحميل عائد الاستثمار.
- انقر على أيقونة السهم في الجزء العلوي الأيسر من النافذة اليمنى ، وانقر فوق عائد الاستثمار واحذفه بالنقر فوق رمز bin.
- كرر هذه العملية عدة مرات حسب الحاجة من ملفات تعريف شدة مختلفة للحصول على العدد المتوقع للمسافات الشريطية AChR التي ستمثل القيمة العالمية في العضلات التي تم تحليلها.
ملاحظة: يمكن حساب قيمة N المثلى مقدما بناء على الفرق المقدر بين المجموعات ومخاطر α والطاقة واختبار الطرف الواحد أو الطرفين. في التصميم التجريبي الحالي ، تم تطبيق اختبار مان ويتني أحادي الطرف (خطر α = 10٪ ؛ الطاقة = 80٪) ، وقدرت قيمة N بما لا يقل عن خمس مسافات شريط AChR لكل NMJ من أجل مقارنة مجموعتي الحيوانات.
- عرض شريط AChR
ملاحظة: يتوافق عرض الشريط (w) مع نصف الحد الأقصى للعرض الكامل (FWHM) لملف تعريف الشدة ، وهي المسافة بين النقاط التي تكون فيها قيمة مضان إشارة α-BTX نصف شدتها القصوى (الشكل التكميلي 5).- باستخدام برنامج المجهر ، حدد قائمة Quantify في النافذة المركزية.
- انقر فوق علامة التبويب أدوات في أعلى الجانب الأيسر. حدد الكثافة في اللوحة العلوية اليسرى وانقر على أيقونة تحديد FWHM . ضع علامة على فرز القنوات.
ملاحظة: لتحسين ذروة الكشف بواسطة البرنامج، تم تعيين تعيين العتبة والعرض على 50 و3 على التوالي. قم بتكييف هذه القيم لكل تجربة واطلب المشورة من عالم تصوير متمرس. - انقر فوق علامات التبويب فتح المشاريع وحدد الصورة التي تمت تصفيتها ليتم تحليلها.
ملاحظة: من الممكن تكبير الصورة المعروضة في النافذة اليمنى عن طريق التمرير باستخدام فأرة الكمبيوتر. كما هو موضح أعلاه (ملاحظة بعد الخطوة 5.8.3) ، يمكن تعديل النطاق الديناميكي للصورة للحصول على تصور الشريط الأمثل. - بعد ذلك ، انقر فوق رمز رسم المستطيل في القائمة العلوية للنافذة اليمنى. حدد شريطا أفقيا أو رأسيا وارسم مستطيلا بشكل عمودي على الشريط. يظهر ملف تعريف في النافذة المركزية.
- انقر فوق عمودي أو أفقي من قائمة متوسط الإسقاط الموجودة في اللوحة اليمنى ، اعتمادا على ما إذا كان اتجاه الشريط رأسيا أو أفقيا.
- انقر فوق الإحصائيات في النافذة المركزية واقرأ قيمة FWHM.
- قم بالنقر بزر الماوس الأيمن باستخدام فأرة الكمبيوتر على الصورة المعروضة في النافذة اليمنى وحدد حفظ عائد الاستثمار.
ملاحظة: افتح عائد الاستثمار المحفوظ بالنقر فوق تحميل عائد الاستثمار. - انقر على أيقونة السهم في الجزء العلوي الأيسر من النافذة اليمنى ، وانقر فوق عائد الاستثمار واحذفه بالنقر فوق رمز bin.
- كرر هذه العملية عدة مرات حسب الحاجة من عائد استثمار مستطيل مختلف حتى الحصول على العدد المتوقع من عروض شريط AChR ، والتي ستكون ممثلة للقيمة العالمية في العضلات التي تم تحليلها.
6. التصميم التجريبي والاختبارات الإحصائية
- إجراء التحليلات الإحصائية باستخدام برامج محددة.
ملاحظة: تم جمع البيانات من N ≥ 3 مكررات بيولوجية وما لا يقل عن 20 NMJs لكل نمط جيني للتصوير المجهري متحد البؤر ، و N ≥ 5 مكررات بيولوجية و N = 5 NMJs لكل نمط جيني لتصوير STED ، في كل مجموعة تجريبية. تم تقييم الأهمية من خلال اختبار Mann-Whitney غير المزاوج (غير معلمي) ، ويشار إلى قيم p في أساطير الشكل المقابلة.
النتائج
من أجل تسهيل التحليل المورفولوجي للوصلات العصبية العضلية على مستوى ما قبل وبعد المشبكي بطريقة قابلة للتكرار ، تم تطوير سير عمل من حصاد العضلات إلى التصوير والقياس الكمي باستخدام برنامج المجهر ووحدات الماكرو المخصصة ImageJ (الشكل 1). لتوضيح فائدة هذا البروتوكول ، تم تقييم مورفولوجيا NMJs في نموذجين من الفئران للاضطرابات الوراثية ، Smn2B / - و ColQDex2 / Dex2 الفئران المتضررة من ضمور العضلات الشوكي (SMA) وشكل متلازمة الوهن العضلي الخلقي (CMS) ، على التوالي ، وتمت مقارنة البيانات مع زملائها المتطابقين مع العمر الضابط.
تم تقييم بنية NMJ من عضلات الظنبوب الأمامية والساقية لفئران Smn2B / - البالغة من العمر 3 و 6 أسابيع (خلفية C57Bl / 6) و ColQ Dex2 / Dex2 (خلفية B6D2F1 / J) ، على التوالي ، عندما تكون علامات المرض موجودة بالفعل في هذه الحيوانات. في عمر 3 أسابيع ، تظهر الفئران Smn2B / - علامات تأخر نمو العضلات الهيكلية وإزالة التعصيب ، مثل ضمور NMJ وفقدان35,36. الفئران CMS لديها علم الأمراض الأولية في NMJs ويظهر انخفاضا في وزن الجسم من الأسبوع الأول من الحياة وضعف العضلاتملحوظ 20 (البيانات غير معروضة). كما هو موضح في الشكل 2 أ ، بدت لوحة نهاية المحرك بعد المشبكي الموسومة بالفلورسنت α-bungarotoxin أصغر و / أو مجزأة في طفرات خطي الفأر بواسطة الفحص المجهري متحد البؤر. كشف القياس الكمي لمكدسات NMJ Z باستخدام وحدات ماكرو ImageJ المخصصة هذه عن انخفاضات ملحوظة في حجم اللوحة الطرفية ، وإسقاط الكثافة القصوى (MIP) ، والتعرج النسبي في كل من فئران SMA و CMS مقارنة بعناصر التحكم ، كعلامات على عيوب نضج NMJ32 (الشكل 2B-D). انخفض حجم الصفيحة الطرفية بعد المشبكية و MIP في الحيوانات المريضة (تغيير الطي 2.7 و 2.0 للحجم ، و 2.5 و 2.0 ل MIP ، في الفئران Smn2B / - و ColQDex2 / Dex2 ، على التوالي). كان التعرج النسبي أيضا أصغر في عضلات SMN و ColQ الناقصة من WT (16.97٪ ± 1.33٪ في SMA مقابل 48.84٪ ± 5.90٪ من الفئران WT ، و 13.29٪ ± 2.79٪ في CMS مقابل 30.20٪ ± 4.44٪ من الفئران الضابطة). بالإضافة إلى ذلك ، كشف القياس الكمي لتوزيع الفروع الطرفية للمحور العصبي قبل المشبكي باستخدام الماكرو المخصص ImageJ عن نمط متغير في توزيع الخيوط العصبية M في النموذجين الحيوانيين ، مع زيادة وضع العلامات المناعية (84.65٪ ± 0.32٪ مقابل 16.57٪ ± 2.03٪ و 23.64٪ ± 2.78٪ مقابل 18.77٪ ± 1.73٪ في الفئران Smn2B / - و ColQDex2 / Dex2 مقارنة بالشواهد ، على التوالي) (الشكل 3A-D ). من خلال تلطيخ SV2 ، لوحظ أيضا انخفاض بنسبة 43٪ في نسبة الإشغال ، أي النسبة المئوية للمناطق المحتوية على AChR مع المناطق النشطة الطرفية العصبية المجاورة ، في الفئران Smn2B / - (49.36٪ ± 3.76٪ في SMA مقابل 85.69٪ ± 2.34٪ من الفئران WT) (الشكل 3E ، F). تم حساب معلمة NMJ هذه أيضا في GA من طفرات ColQ Dex2 / Dex2 ، ولكن لم يتم العثور على فرق ذي دلالة إحصائية مقارنة بزملاء القمامة الضابطين (البيانات غير معروضة).
قمنا كذلك بتحليل خصائص الغشاء بعد المشبكي من خلال تحديد المسافة بين الطيات الموصلة وعرض خطوط AChR ، الموجودة في قمة هذه الطيات ، في العضلات التي تعاني من نقص ColQ باستخدام الفحص المجهري لاستنفاد الانبعاثات المحفزة فائقة الدقة (STED). كما هو موضح في الشكل 4 ، يمكن تصور جانب هذه الهياكل بوضوح من خلال وضع العلامات الفلورية α-bungarotoxin وتحليل ملف تعريف الكثافة. قمنا بتقييم معلمات NMJ هذه ووجدنا زيادة في مسافة الطي الموصلة (d) والعرض (w) لخطوط AChR في عضلة الساق للمتحولات (358.3 نانومتر ± 11.97 نانومتر و 320.8 نانومتر ± 10.90 نانومتر للمسافة ، و 216.9 نانومتر ± 10.51 نانومتر و 186.3 نانومتر ± 7.015 نانومتر للعرض ، في ColQ Dex2 / Dex2 مقارنة بالفئران من النوع البري ، على التوالي ، p < 0.05) (الشكل 4C ، D).
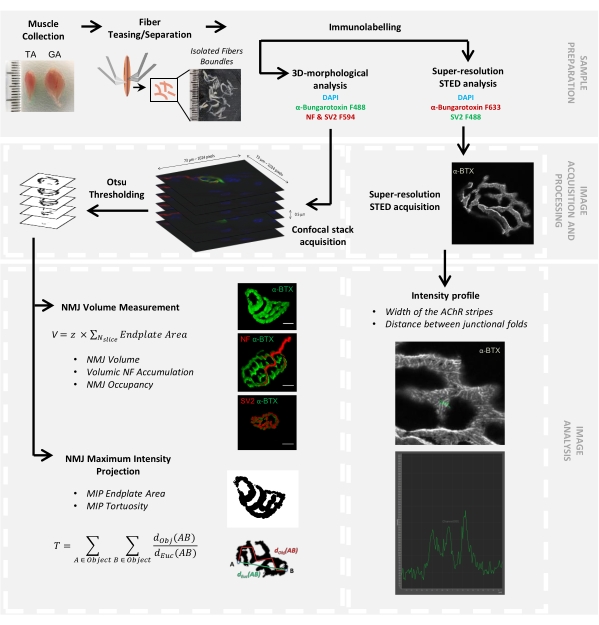
الشكل 1: مخطط انسيابي لبروتوكول الفيديو لتوصيف NMJ متعدد المقاييس 3D بواسطة المجهر متحد البؤر و STED. تم جمع عضلات الظنبوب الأمامية (TA) وعضلات الساق (GA) من الفئران ، وتم مضايقة ألياف العضلات قبل وضع العلامات باستخدام α-bungarotoxin-F488 أو α-bungarotoxin-F633 ، DAPI ، الأجسام المضادة الأولية الموجهة ضد الخيوط العصبية M (NF-M) والبروتين السكري الحويصلي المشبكي 2 (SV2) ، والأجسام المضادة الثانوية المترافقة بالفلوروفور (F488 أو F594). تم الحصول على مكدسات الصور بواسطة الفحص المجهري متحد البؤر ومعالجتها لقياس حجم NMJ بعد المشبكي ، وتراكم NF-M قبل المشبكي ، وإشغال محطة محور NMJ ، ومنطقة لوحة نهاية إسقاط الكثافة القصوى بعد المشبكي (MIP) ، والالتواء (d Obj (AB) هي المسافة بين A و B على طول محيط الكائن (الخط الأحمر) ، بينما dEuc (AB) هي المسافة الإقليدية بين A و B (الخط الأخضر)). بالنسبة لتحليل الفحص المجهري STED ، تم تحديد عرض خطوط مستقبلات الأسيتيل كولين (AChR) والمسافة بين الطيات الموصلة من ملامح الكثافة لتلطيخ α-BTX-F633. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
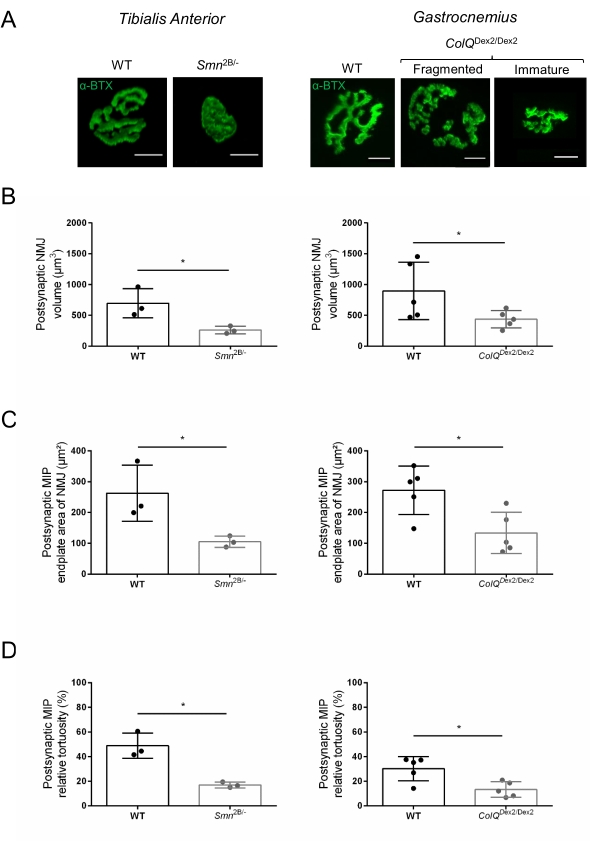
الشكل 2: توصيف NMJ متعدد المعلمات بعد المشبكي في نماذج الفئران لضمور العضلات الشوكي (SMA) ومتلازمة الوهن العضلي الخلقي المرتبطة ب ColQ (CMS). (أ) صور تمثيلية لألواح النهاية الحركية بعد المشبكية من عضلات TA و GA الموسومة ب α-bungarotoxin-F488 (α-BTX). (ب) القياس الكمي لحجم الصفيحة الطرفية بعد المشبكية NMJ ، (C) منطقة إسقاط الكثافة القصوى (MIP) و (D) التعرج النسبي في TA للفئران البرية من النوع البري البالغ من العمر 3 أسابيع (WT) و Smn2B / - الفئران (الرسوم البيانية اليسرى ، N = 3 لكل نمط وراثي ، n = 37 و n = 56 NMJs ، على التوالي) و WT و ColQ Dex2 / Dex2 البالغ من العمر 6 أسابيع الفئران (الرسوم البيانية اليمنى ، N = 5 فئران لكل نمط وراثي ، n = 89 و n = 97 NMJs ، على التوالي). يتم التعبير عن البيانات كمتوسط لكل فأر (نقطة) ± SEM. تم تحليل الاختلافات بين المجموعات بواسطة اختبار مان ويتني (* p < 0.05). شريط المقياس هو 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
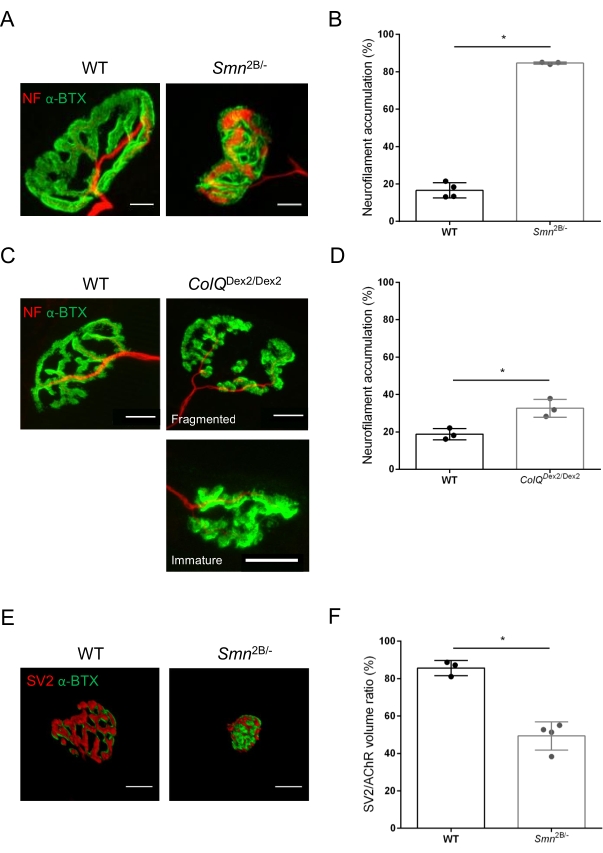
الشكل 3: التحليل المورفومتري للتوزيع المحوري قبل المشبكي في عضلات WT والفئران الطافرة. نمط تعصيب NMJ في عضلات الظنبوب الأمامية (TA) وعضلات الساق (GA) للفئران ذات الصلة ب SMA و ColQ من النوع البري و ColQ. (أ، ب) تقاطعات عصبية عضلية تمثيلية من TA من WT و Smn2B / - الفئران في عمر 21 يوما موسومة بأجسام مضادة ضد الخيوط العصبية M (NF-M ، أحمر) و α-bungarotoxin-F488 (α-BTX ، أخضر) (A) ، ونتائج التحليل الكمي لتراكم الخيوط العصبية (B) ؛ (ج، د) تقاطعات عصبية عضلية تمثيلية من GA لفئران WT و ColQDex2 / Dex2 البالغة من العمر 6 أسابيع موسومة بأجسام مضادة ضد الخيوط العصبية M (NF-M ، أحمر) و α-bungarotoxin-F488 (α-BTX ، أخضر) ، تظهر لوحات نهاية مجزأة وغير ناضجة بعد المشبكي (C) ، ونتائج تراكم الخيوط العصبية في مجموعتي الحيوانات (D). N = 4 (n = 34 NMJs) (B) و N = 3 (n = 54 NMJs) (D) WT ، و N = 3 (n = 36 NMJs) Smn2B / - و N = 3 (n = 55 NMJs) تم تحليل الفئران ColQ Dex2 / Dex2 في التجارب (B ، D). (ه، واو) صور تمثيلية لإشغال المحطة المحورية في NMJs من TA لفئران WT و Smn 2B / - عمرها 3 أسابيع موسومة بأجسام مضادة ضد البروتين السكري الحويصلي المشبكي 2 (SV2 ، أحمر) و α-bungarotoxin-F488 (α-BTX ، أخضر) (E) ، ونتائج إشغال NMJ (نسبة حجم SV2 / AChR) (F). تم تحليل العضلات من N = 3 (n = 50 NMJs) من النوع البري و N = 4 (n = 62 NMJs) Smn2B / - الفئران. يتم التعبير عن البيانات كمتوسط قيمة لكل ماوس (نقطة) ± SEM. تم تحليل الاختلافات بين المجموعات بواسطة اختبار مان ويتني (* p < 0.05). قضبان المقياس 20 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
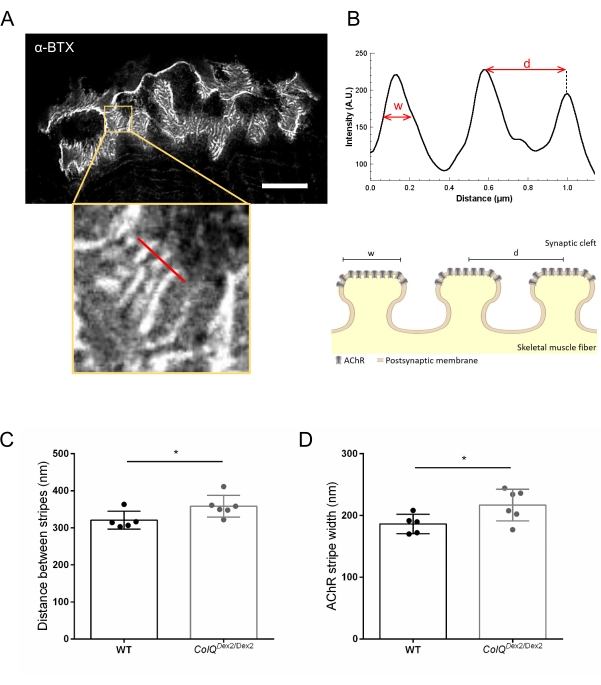
الشكل 4: تصوير STED لألواح النهاية بعد المشبكية NMJ. (أ) صورة تمثيلية STED ل NMJ تحمل علامة α-bungarotoxin-F633 (α-BTX) من gastrocnemius لفأر من النوع البري يبلغ من العمر 6 أسابيع يظهر خطوط AChR بعد الوصلة (شريط المقياس هو 5 ميكرومتر). (ب) تكبير أعلى لمنطقة ذات خطوط AChR (اللوحة السفلية) التي تم استخدامها لإنشاء ملف تعريف الكثافة. تم تحديد عرض (w) لخطوط AChR والمسافة بين شريطين متجاورين (د) لهذه المنطقة وعرضها في الرسم البياني الشريطي. تمثيل تخطيطي للوحة النهاية بعد المشبكي لتوضيح عرض شريط AChR (w) والمسافة (d). تم قياس هذه المعلمات ، (C) مسافة شريط AChR و (D) العرض ، في الفئران ColQ Dex2 / Dex2 وزملاء القمامة الضابطين في عمر 6 أسابيع. تم تحليل NMJs من 5 WT (إجمالي n = 29 NMJs) و 6 ColQ Dex2 / Dex2 (إجمالي n = 43 NMJs) الحيوانات بشكل أعمى. يتم التعبير عن البيانات كمتوسط لكل فأر (نقطة) ± SEM. تم تحليل الفروق الإحصائية بين المجموعات باستخدام اختبار مان ويتني (* p < 0.05). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل التكميلي 1: إطلاق برمجيات ومعلمات LAS X لعمليات الاستحواذ متحدة التركيز. ويرد وصف لمختلف الخطوات للحصول على صور متحدة البؤر في الأقسام من 3-1-2 إلى 3-1-7 من البروتوكول. لكل عملية اقتناء مكدس NMJ ، يتم فتح مشروع (الخطوة 3.1.4) ويتم تحديد معلمات حجم الصورة وسرعة الاكتساب ومحاور X و Y و Z (الخطوة 3.1.7) ، مع الإشارة إلى كل مسح متسلسل (Seq.1 ، laser 405 for DAPI; Seq.2 ، ليزر 488 ل α-BTX-F488 ؛ و Seq.3 ، ليزر 552 للأجسام المضادة الثانوية المترافقة F594). الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 2: إطلاق برمجيات ومعلمات LAS X لعمليات الاستحواذ على الأمراض المنقولة بالاتصال الجنسي. يتم وصف خطوات الحصول على صور STED في الأقسام 3.2.2 إلى 3.2.8 من البروتوكول. يتم تشغيل المجهر في وضع التكوين STED ON (الخطوة 3.2.2) ، ويتم فتح مشروع (الخطوة 3.2.3). يشار إلى معلمات الحصول على الصورة (الخطوة 3.2.7) (حجم الصورة ، سرعة الاكتساب ، عامل التكبير ، المحور X) ، مع كل مسح متسلسل (Seq.1 for α-BTX-F633; Seq.2 للأجسام المضادة الثانوية المترافقة F488). الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 3: صور طيات الوصلات الملطخة ب α-BTX التي تم الحصول عليها بواسطة الفحص المجهري STED. أمثلة على صورة للوحة نهاية ما بعد المشبكي تحمل علامة α-BTX-F633 من ماوس من النوع البري عمره 6 أسابيع تم الحصول عليها إما بتركيز صحيح (يسار) أو غير صحيح (يمين). الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 4: النوافذ المنبثقة ل Windows لوصف بيانات الإدخال والإخراج التي تم الحصول عليها بواسطة وحدات ماكرو ImageJ المخصصة. يتم عرض أمثلة بيانات الإدخال (ملفات .tif و .lif) لصور NMJ في العمود الأيسر. يتم حفظ بيانات الإخراج من وحدات الماكرو (العمود الأيمن) في مجلدات (Save_Volume ، Save_Accu) تحتوي على صور للتقاطع (.tif) وأوراق بيانات تحتوي على النتائج (.csv الملفات). الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 5: تحليل مسافة وعرض شريط AChR من اقتناء STED باستخدام برنامج LAS X. يتم وصف خطوات تحليل صور NMJ STED في القسم 5 من البروتوكول. أ) صورة لمنطقة صفيحة نهاية ما بعد المشبكية المسماة تحتوي على خطوط AChR. يتم تحديد المنطقة ذات الأهمية لتحليل الشريط عن طريق رسم خط عمودي (خط أخضر ، لمسافة الشريط) ، أو مستطيل عمودي (مستطيل أرجواني ، لعرض الشريط). (ب، ج) يتم عرض ملفات تعريف الكثافة للمناطق المحددة والقياسات لحساب المسافة بين خطوط AChR (B) وعرض شريط AChR (C). الرجاء الضغط هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 1: Macro_NMJ_VOL_Marinelloetal. ماكرو مخصص ImageJ لاستخراج قياسات معلمات NMJ (حجم NMJ ومنطقة لوحة نهاية MIP وتعرج NMJ). الرجاء الضغط هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 2: Macro_NMJ_ACCU_Marinelloetal. ماكرو مخصص ImageJ لاستخراج تراكم NF-M وتلطيخ SV2. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يوفر بروتوكول الفيديو الموصوف طريقة مفصلة لتحديد بنية 3D للتقاطعات العصبية العضلية من خلال الجمع بين الفحص المجهري البؤري و STED الذي يمكن استخدامه لتوصيف التغيرات المرضية على مستويات ما قبل وبعد المشبكي. تسمح الدقة العالية للفحص المجهري STED بالتصور والتحليل المورفومتري للهياكل النانوية التي لا يمكن التعرف عليها عن طريق التصوير البؤري التقليدي. مكننا هذا الإجراء من قياس التغيرات الهيكلية ل NMJs في عضلتين زائديتين ، الظنبوب الأمامي والساقي ، من SMA وفئران CMS المرتبطة ب ColQ.
للحصول على نتائج موثوقة مع هذه التقنية ، من الأهمية بمكان تشريح العضلات وإغاظتها بشكل صحيح ، مع إيلاء اهتمام خاص للفافة المحيطة بالعضلات والقوة المطبقة لفصل حزم العضلات. خلاف ذلك ، يمكن أن يتعطل نمط التعصيب مما يعوق تقييم NMJ المناسب قبل المشبكي. على الرغم من توفير معلومات مفصلة لتحليل NMJs من TA و GA ، من حيث المبدأ ، يمكن تكييف هذا البروتوكول مع العضلات الأخرى ، بما في ذلك العضلات المسطحة ، مثل الحجاب الحاجز أو البطنالمستعرض 37 ، والتي لا تتطلب خطوة الإغاظة. تثبيت الأنسجة أمر بالغ الأهمية أيضا لضمان تلطيخ ذات نوعية جيدة. لذلك ، يوصى باستخدام PFA عالي الجودة بحجم مناسب (15-20 مرة من العضلات). بالإضافة إلى ذلك ، يعد وقت التعرض للمثبت خطوة مهمة لأن القطع الأثرية ، مثل الانكماش والتكتل ، قد تظهر بسبب التثبيت الزائد والتأثير على ميزات NMJ. بالنظر إلى حجم العينات ومعدل تغلغل محلول بارافورمالدهيد في الأنسجة38 ، يوصى بوقت تثبيت 18-24 ساعة لهذا النوع من العضلات. في حالة التخطيط لخطوة التلوين بعد أكثر من أسبوع من حصاد الأنسجة ، يقترح الحفاظ على عضلات PFA الثابتة في PBS مكملة بأزيد الصوديوم عند 4 درجات مئوية لمنع انتشار البكتيريا.
يقدم هذا البروتوكول نهجا يستخدم α-BTX-F488 للبؤر و α-BTX-F633 للتصوير STED. تم اختيار هذه الفلوروفورات لتتناسب مع التصميم التجريبي الموصوف ولكن يمكن تعديلها وفقا للمعدات والمواد المتاحة. على سبيل المثال ، يمكن تحديد ملصق α-BTX F488 عند استخدام ليزر STED CW 592 nm للحصول على الصور وقياسها. ومع ذلك ، يبدو أن التكوين الذي تم تطبيقه في الدراسة الحالية (STED ذو بوابات الإثارة النبضية ، استنفاد 775 نانومتر) يظهر أداء أعلى ودقة أفضل من الأساليب الأخرى ، مثل الموجة المستمرة STED39 ، مما يجعلها أكثر ملاءمة للتطبيق الحالي. من المهم أيضا تحديد إعدادات طاقة الليزر بعناية ، خاصة بالنسبة ل STED (كل من الإثارة والنضوب) ، حيث لا يمكن قياس خصائص ملف تعريف الشدة في حالة التشبع ، وبالتالي فإن أي إشارة مشبعة في صورة NMJ يمكن أن تعرض التحليل بأكمله للخطر.
تم تطوير سير العمل التفصيلي هذا ، بما في ذلك الحصول على الصور وتحليلها باستخدام برنامج المجهر ووحدات ماكرو ImageJ ، لتسهيل التحليل المورفومتري NMJ المستقل عن طريق الفحص المجهري متحد البؤر و STED من عضلة واحدة. مهدت تدفقات العمل الموصوفة سابقا للتحليل البؤري NMJ ، مثل NMJ-morph2 أو NMJ-Analyzer14 ، الطريق لتصميم طرق شبه آلية تسهل التحليل المورفولوجي ل NMJs والدراسات المقارنة. NMJ-morph (ونسخته المحدثة aNMJ-morph15) عبارة عن منصة مجانية قائمة على ImageJ تستخدم إسقاط الكثافة القصوى لقياس 21 ميزة مورفولوجية ، ويستخدم NMJ-Analyzer نصا تم تطويره في Python يولد 29 معلمة ذات صلة من بنية 3D NMJ بأكملها. العتبة اليدوية هي الخطوة الوحيدة أثناء معالجة الصور في هاتين الطريقتين اللتين تتطلبان تحليل المستخدم. يفصل هذا البروتوكول المتكامل خطوات تحضير الأنسجة ، واكتساب الصور متحدة البؤر 3D ، والمعالجة القائمة على ImageJ ل NMJs من عضلات الهيكل العظمي بأكملها ويوفر نظرة عامة مبسطة على خمسة معلمات مهمة لما بعد المشبكي (الحجم ، منطقة الإسقاط القصوى ، والالتواء) و presynaptic (الإشغال المحوري الطرفي وتراكم الخيوط العصبية) الصفائح النهائية. تم دمج معلمة إضافية ذات أهمية بيولوجية ، وهي نمط تنظيم AChR للطيات الموصلية بعد المشبكية ، للتحليل المورفومتري على المستوى النانوي بواسطة الفحص المجهري STED فائق الدقة (الدقة 20-30 نانومتر)40. ومن المثير للاهتمام ، أن تحضير الأنسجة لتصوير STED أبسط من الطرق الأخرى المستخدمة في دراسات البنية التحتية NMJ ، مثل المجهر الإلكتروني التقليدي (TEM)9 ، وهو إجراء معقد إلى حد ما ويستغرق وقتا طويلا ويتطلب مناورا ماهرا من أجل الحصول على أقسام فائقة النحافة من منطقة العضلات المناسبة. بالإضافة إلى ذلك ، يمكن الحصول على البيانات الكمية من طيات وصلات متعددة تلقائيا باستخدام البرنامج المرتبط ب STED.
تم تطبيق هذا البروتوكول لتوضيح عيوب NMJs المعروفة سابقا في العضلات الناقصة SMN و ColQ20،36،41،42. تم العثور على تغييرات شائعة في نموذجي الفئران عن طريق الفحص المجهري متحد البؤر ، مثل انخفاض حجم الصفيحة الطرفية بعد المشبكي ، ومنطقة MIP ، والالتواء النسبي ، وزيادة تراكم الخيوط العصبية ، في حين أن بعض النتائج الأكثر تحديدا (انخفاض إشغال NMJ) ، لوحظت فقط في الفئران SMA ، كمؤشر على ضعف الاتجار بالحويصلات36. أخيرا ، تم الكشف عن زيادة في مسافة وعرض شريط AChR في ColQ-KO بواسطة تحليل STED ، وهي علامات على وجود عيوب هيكلية فائقة في طيات الوصلات بعد المشبكية ، كما لوحظ سابقا بواسطة TEM20. الأهم من ذلك ، قد يساعد هذا البروتوكول في توصيف مورفولوجي أكثر تعمقا للتقاطعات العصبية العضلية أثناء التطوير والصيانة وتحت ظروف مرضية مختلفة.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح فيما يتعلق بهذا العمل.
Acknowledgements
نشكر "المرفق الأساسي للتصوير وقياس الخلايا" في Genethon ، بالإضافة إلى خدمة الأنسجة ، والتي يتم دعمها جزئيا من خلال أموال المعدات من منطقة إيل دو فرانس ، والمجلس العام للإيسون ، وأبحاث Genopole في Evry ، وجامعة Evry Val d'Essonne و INSERM ، فرنسا. نحن ممتنون أيضا للدكتور راشمي كوثاري لتوفير خط الماوس Smn 2B / 2B (جامعة أوتاوا ، كندا) والدكتور إريك كريجسي لخط الماوس ColQDex2 / + (غير منشور ، جامعة باريس ، فرنسا). ونشكر غيوم كوري على دعمه في التحليل الإحصائي. تم الحصول على الأجسام المضادة أحادية النسيلة 2H3 (التي طورها Jessel، T.M. و Dodd، J.) و SV2 (التي طورها Buckley، K.M.) من بنك الدراسات التنموية الهجين (DSHB) ، الذي أنشأه NICHD التابع للمعاهد الوطنية للصحة وتم الحفاظ عليه في جامعة أيوا ، قسم علم الأحياء ، مدينة أيوا ، IA 52242. تم دعم هذا العمل من قبل الرابطة الفرنسية لمكافحة الاعتلالات العضلية (AFM-Telethon) و INSERM وجامعة إيفري فال ديسون.
Materials
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
References
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304(2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671(2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677(2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220(2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251(2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128(2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- ImageJ. , Available from: http://imagej.nih.gov/ij (2021).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Bio-Formats. , Available from: http://www.openmicroscopy.org/bio-formats/downloads/ (2021).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, Supplement C 253-261 (2013).
- ImageJ documentation. , Available from: http://imagejdocu.tudor.lu/plugin/analysis/geodesic_distances/start (2021).
- GitHUb. , Available from: https://github.com/Genethon/ImCy (2021).
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162(2014).
- Baker, J. R. Principles of biological microtechnique; a study of fixation and dyeing. , Wiley. London Methuen; New York. at http://archive.org/details/principlesofbiol01bake (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421(2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644(2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605(2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved