Method Article
Caracterización de uniones neuromusculares en ratones mediante microscopía combinada confocal y de superresolución
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un método para el análisis morfométrico de uniones neuromusculares mediante microscopía combinada confocal y STED que se utiliza para cuantificar cambios patológicos en modelos de ratón de SMA y CMS relacionados con ColQ.
Resumen
Las uniones neuromusculares (NMJ) son sinapsis altamente especializadas entre las neuronas motoras inferiores y las fibras musculares esqueléticas que desempeñan un papel esencial en la transmisión de moléculas del sistema nervioso a los músculos voluntarios, lo que lleva a la contracción. Se ven afectados en muchas enfermedades humanas, incluidos los trastornos neuromusculares hereditarios como la distrofia muscular de Duchenne (DMD), los síndromes miasténicos congénitos (CMS), la atrofia muscular espinal (AME) y la esclerosis lateral amiotrófica (ELA). Por lo tanto, el monitoreo de la morfología de las uniones neuromusculares y sus alteraciones en modelos de ratón enfermos representa una herramienta valiosa para estudios patológicos y evaluación preclínica de enfoques terapéuticos. Aquí, se describen métodos para etiquetar y analizar la morfología tridimensional (3D) de las partes pre y postsinápticas de las placas terminales motoras a partir de fibras musculares murinas. Se detallan los procedimientos para preparar muestras y medir el volumen, el área, la tortuosidad y la morfología/ocupación terminal del axón por imágenes confocales, y la distancia entre los pliegues de la unión postsináptica y el ancho de la banda del receptor de acetilcolina (AChR) mediante microscopía de agotamiento por emisión estimulada de súper resolución (STED). Las alteraciones en estos parámetros NMJ se ilustran en ratones mutantes afectados por SMA y CMS.
Introducción
La unión neuromuscular (NMJ) es una estructura compleja compuesta por un terminal del axón motor, una célula de Schwann perisináptica y una porción de miofibra esquelética involucrada en la transmisión de información química y el acoplamiento de la actividad de la neurona motora inferior a la contracción muscular. En los mamíferos, la morfología de la unión neuromuscular cambia durante el desarrollo, adoptando una forma típica similar a un pretzel después de la maduración, con diferencias de forma y complejidad entre especies, y muestra cierto grado de plasticidad en respuesta a procesos fisiológicos como el ejercicio o el envejecimiento 1,2,3,4 . La placa terminal motora postsináptica forma invaginaciones de membrana llamadas pliegues de unión, donde la parte superior que contiene receptores de acetilcolina (AChR) está en estrecho contacto conla rama 5 del axón terminal presináptico.
Los cambios morfológicos y funcionales en las uniones neuromusculares contribuyen a la fisiopatología de varios trastornos neurodegenerativos como la atrofia muscular espinal (AME) y la esclerosis lateral amiotrófica (ELA), miopatías como la distrofia muscular de Duchenne (DMD), los síndromes miasténicos congénitos (CMS), la miastenia gravis (MG) y las miopatías centronucleares (CNM), y la sarcopenia asociada al envejecimiento 3,6,7,8,9, 10,11,12. En estas enfermedades, se observan alteraciones estructurales de NMJ como fragmentación de la placa terminal, reducción del tamaño del pliegue de la unión postsináptica y/o denervación. La patología de las NMJ puede ser un evento primario o temprano durante la progresión de la enfermedad o aparecer más recientemente como un evento secundario que contribuye a las manifestaciones clínicas. En cualquier caso, el seguimiento de la morfología de las NMJ en modelos animales de estas enfermedades representa un parámetro valioso para estudiar los cambios patológicos y evaluar la eficacia de los posibles tratamientos.
La morfología de las uniones neuromusculares suele analizarse mediante técnicas que utilizan microscopía confocal 2,13,14,15 o microscopía electrónica 5,16, con sus limitaciones inherentes como resolución o dificultades técnicas, respectivamente. Más recientemente, la microscopía de superresolución también se utilizó para visualizar regiones particulares de la NMJ, como las zonas activas presinápticas o la distribución de AChR en la membrana postsináptica16,17,18, como un enfoque alternativo o complementario al análisis ultraestructural por microscopía electrónica.
Este protocolo tiene como objetivo proporcionar un método detallado y reproducible para evaluar los parámetros morfológicos de NMJ mediante la combinación de microscopía de agotamiento por emisión estimulada y confocal de fluorescencia (STED). Las características importantes de las placas terminales presinápticas y postsinápticas, como el volumen, el área, la tortuosidad relativa, el ancho de la franja AChR y la distribución terminal axonal en las fibras musculares inervadas de gastrocnemio y tibial anterior de ratón se cuantificaron en el contexto de condiciones normales y enfermas. En particular, los defectos de NMJ se ejemplificaron en el modelo de ratón Smn2B / - de atrofia muscular espinal, una enfermedad neuromuscular con degeneración de la neurona motora causada por mutaciones en el gen SMN1 11,19, y en una subunidad de cola similar al colágeno de ratones con acetilcolinesterasa asimétrica (ColQ Dex2 / Dex2 o ColQ-KO), como modelo del síndrome miasténico congénito20, 21,22.
Protocolo
El cuidado y la manipulación de ratones se realizaron de acuerdo con la legislación nacional y europea sobre experimentación animal y aprobados por el comité ético institucional. En el estudio se utilizaron machos y hembras de ratones Smn2B/- (fondo C57Bl/6J) y ColQ Dex2/Dex2 (fondo B6D2F1/J) a las 3 y 6 semanas de edad, respectivamente.
1. Eutanasia de ratones y disección de músculos: tibial anterior y gastrocnemio
- Proceder a la anestesia en ratón mediante inyección intraperitoneal de una solución mixta de ketamina (87,5 mg/kg)/xilazina (12,5 mg/kg) (0,1 mL/20 g de peso corporal) antes de la eutanasia por luxación cervical.
NOTA: Dado que SMA y ColQ-CMS afectan a los individuos independientemente de su sexo, se utilizaron ratones machos y hembras en el presente protocolo. - Retire el vello de las extremidades posteriores con una pequeña afeitadora eléctrica y enjuague las piernas con etanol al 70%.
NOTA: El procedimiento de disección será diferente para cada músculo. Para la disección del tibial anterior (AT), siga los pasos 1.2.1-1.2.3, y para el gastrocnemio (AG) (partes medial y lateral), siga los pasos 1.2.4-1.2.6. Maneje los músculos suavemente para evitar daños en los tejidos y aplastarlos o estirarlos durante la disección.- Coloque el ratón en posición supina.
- Haga una incisión en la piel de 5 mm con tijeras afiladas-romas a lo largo de la parte antero-externa de la extremidad posterior distal, paralela a la tibia, para exponer el músculo. Use tijeras extrafinas para eliminar la fascia.
- Corte primero el tendón distal (cerca de la pata) y luego el tendón proximal (cerca de la rodilla) con tijeras extrafinas y pinzas delgadas curvas. Maneje el músculo con cuidado para evitar daños a las miofibras y los nervios.
NOTA: El tendón proximal debe seccionarse lo más cerca posible del hueso para cosechar todo el músculo. - Coloque el ratón en posición prona, use tijeras afiladas y romas para hacer una incisión en la piel desde la parte superior del compartimiento posterior distal de la extremidad posterior hasta la pata y retire la piel.
- Agarre el tendón de Aquiles con pinzas dentadas medianas, córtelo con una tijera extrafina y separe suavemente el AG del tejido circundante hasta su inserción proximal.
- En el lado proximal, inserte las pinzas serradas medianas en el bolsillo formado entre el bíceps femoral (BF) y la AG. Separe los dos músculos para cortar el tendón GA lo más cerca posible de la inserción ósea con una tijera extrafina.
- Para la fijación tisular, colocar cada músculo en un tubo de microcentrífuga de 2 ml que contenga 1 ml de solución de paraformaldehído (PFA) al 4% p/v diluida en solución salina tampón fosfato (PBS sin Ca 2+Mg 2+) y mantener a 4 °C durante18-24 h.
PRECAUCIÓN: El paraformaldehído y el formaldehído son tóxicos y deben manipularse en una campana extractora de humos químicos con el equipo de protección adecuado. - Al día siguiente, lave los músculos fijos 3 veces durante 5 minutos con PBS en placas de 12 pocillos agitando suavemente a temperatura ambiente (RT) dentro de una campana extractora de humos químicos.
NOTA: El protocolo se puede detener en este paso y continuar dentro de un mes. En este caso, añadir PBS suplementado con azida sódica al 0,01% para almacenar las muestras a 4 °C. - Burlarse de cada músculo en pequeños haces de fibra de aproximadamente 1 mm de ancho usando dos pinzas dentadas finas.
NOTA: Es crucial manipular los músculos muy suavemente con los fórceps, sin fuerza excesiva, para evitar daños en los tejidos durante las burlas.- Disociar el músculo TA en 3 o 4 haces dependiendo de su tamaño.
- Para AG, separe las partes medial y lateral del músculo y luego disocie cada parte en 4-5 paquetes dependiendo de su tamaño.
2. Inmunotinción
- Proceda con la permeabilización de la fibra muscular: Transfiera los haces musculares a placas de 24 pocillos que contengan 1% (v/v) de Triton X-100 en PBS y manténgalos bajo agitación suave (50 rpm) durante 1 h a RT o 5 h a 4 °C.
NOTA: Divida los haces musculares entre dos placas para proceder con inmunotinciones separadas y minimizar el riesgo de confusión de anticuerpos. No los divida en más de dos pocillos (1 pozo/placa); de lo contrario, el número (N) de NMJ que son representativos de su estado general en el músculo analizado puede ser insuficiente. - Lavar las muestras 3 veces durante 5 min con PBS a RT e incubarlas con una solución bloqueante compuesta de albúmina sérica bovina (BSA) al 4% en PBS/Triton X-100 al 1% durante 4 h a 4 °C, bajo agitación suave (50 rpm).
NOTA: No utilice una bomba de aspiración durante los pasos de lavado, sino que aspire la solución manualmente con una pipeta de 200 μL y puntas de tamaño pequeño (la referencia se indica en la Tabla de materiales). - Incubar las muestras durante la noche (O/N) a 4 °C bajo agitación suave (50 rpm) con la solución bloqueante indicada en la etapa 2.2 que contiene anticuerpos monoclonales primarios contra el neurofilamento M (NF-M, 2H3, dilución 1/200) o la glicoproteína 2 de la vesícula sináptica (SV2, dilución 1/200) para marcar terminales axonales presinápticos o zonas activas, respectivamente.
- Al día siguiente, lave los haces musculares 3 veces durante 5 minutos en PBS bajo agitación (50 rpm).
- Para imágenes confocales: Incubar los haces musculares con anticuerpos secundarios anti-ratón conjugados con un fluoróforo emisor de rojo (F594) (dilución 1/500) y α-bungarotoxina conjugada con un fluoróforo emisor verde (α-BTX-F488) (dilución 1/1000) en PBS durante 2 h a RT bajo agitación (50 rpm).
- Para imágenes de ETS: Incubar los haces musculares con anticuerpos secundarios anti-ratón conjugados con un fluoróforo emisor de verde (F488) (dilución 1/500) y α-bungarotoxina conjugada con un fluoróforo emisor de rojo lejano caracterizado por una alta fotoestabilidad (α-BTX-F633) (dilución 1/1000) en PBS durante 2 h a RT bajo agitación (50 rpm).
NOTA: No exponga las muestras a la luz durante la incubación para evitar el fotoblanqueo.
- Lave los haces musculares etiquetados 3 veces durante 5 minutos con PBS bajo agitación (50 rpm) y colóquelos en un portaobjetos con un medio de montaje.
NOTA: Coloque un máximo de 4 a 5 haces musculares por portaobjetos para permitir el sellado. - Agregue un cubreobjetos de vidrio de grado # 1.5 (o # 1.5H) (0.17 mm de espesor) en la parte superior, y coloque imanes cilíndricos a ambos lados de la diapositiva para aplicar presión y aplanar los músculos.
- Mantenga las guías protegidas de la luz O/N a 4°C. Selle las diapositivas permanentemente con esmalte de uñas.
3. Adquisición de imágenes
- Adquisiciones por microscopio confocal
NOTA: Las imágenes se recolectaron con un microscopio confocal de barrido láser invertido utilizando un objetivo de inmersión en aceite de magnitud 63x (HCX Plan Apo CS, apertura numérica (NA) de 1.4).- Para el análisis ciego, deje que una persona que no esté involucrada en el análisis codifique cada diapositiva con un número determinado. Permanecer cegado a los grupos experimentales hasta que se complete la cuantificación de los parámetros NMJ para todas las muestras.
- Inicie el software del microscopio en modo de configuración > machine.xlhw (Figura complementaria 1).
- Coloque el portaobjetos en la plataforma del microscopio y encuentre el plano de observación dentro de la muestra mirando bajo la iluminación de fluorescencia de campo amplio DAPI con el conjunto de filtros DAPI.
- Haga clic en Abrir proyecto > nuevos proyectos y cree una carpeta para almacenar las adquisiciones de imágenes (Figura complementaria 1).
Nota : cree un nuevo proyecto para cada NMJ para limitar el tamaño de la carpeta y evitar problemas de memoria del equipo. - Para administrar los parámetros de adquisición, haga clic en la ventana de la pestaña Adquisición y configure el agujero de alfiler confocal en 1.0 Airy y la potencia del láser para optimizar los niveles de ganancia y compensación para la fluorescencia verde / F488 (α-BTX) utilizando un láser de 488 nm en la placa terminal que debe ser fotografiada (modo Live ON).
- A continuación, optimice la adquisición de fluorescencia roja/F594 (NF-M o SV2) utilizando un láser adaptado a la observación F594. En este estudio, se utilizó un láser de 552 nm (Live mode ON). Ajuste el espectro de emisión de colorante con los siguientes rangos para cada láser: láser 405 (DAPI) de 414 a 483 nm, láser 488 (F488-α-BTX) de 506-531 nm y láser 552 (NF-M/SV2) de 622-650 nm.
- Recopile pilas de imágenes de uniones neuromusculares en cada grupo experimental con la misma configuración: tamaño de imagen 1024 x 1024 píxeles (73,7 x 73,7 μm) a una frecuencia de muestreo de 400 Hz, bidireccional X ON, factor de zoom 2,5, tamaño de paso Z 0,5 μm en modo Z-Wide.
NOTA: Para cada NMJ, el número de sectores se establece para adquirir toda la unión. Los ajustes de adquisición descritos anteriormente cumplen con el teorema de muestreo de Nyquist-Shanon. Sin embargo, el usuario puede hacer clic en el botón Optimizar formato , presente en todo el software operativo confocal reciente, para garantizar que el tamaño de píxel y el paso Z cumplan con la frecuencia de muestreo ideal de Nyquist. Esta acción evitará imágenes sobremuestreadas o submuestreadas, lo que provocará una pérdida de precisión en las mediciones de volumen. - Guarde el archivo original (.lif) o las imágenes de pila Z (.tif) en una carpeta con un nombre que incluya el nombre en clave de la diapositiva, el tipo de tinción y el número de placa final.
NOTA: Recopile secuencialmente (no simultáneamente) los escaneos utilizando los láseres de 488 nm y 552 nm (F488 y F594) para evitar la diafonía de la fluorescencia F488 en el canal F594 y viceversa (sangrado). Nota: la trayectoria del haz se puede configurar con el Dye Assistant en el software del microscopio. - Cambie a la siguiente diapositiva codificada y repita los pasos 3.1.3-3.1.8 para cada NMJ.
- Al final de la sesión, haga clic en Abrir en el Visor 3D y elija un representante de NMJ de un grupo experimental para visualizar el etiquetado 3D.
NOTA: Este modo de vista ayudará a verificar que los parámetros de adquisición eran correctos. - Cierre el software del microscopio, limpie los objetivos con tejidos de la lente y, a continuación, apague el sistema.
- Adquisiciones por microscopía STED
NOTA: Las imágenes se recolectaron con un microscopio confocal de barrido láser invertido equipado con STED cerrado a 775 nm utilizando un objetivo de inmersión en aceite de 100x (HC PL APO CS2 1.4 NA).- Para el análisis ciego, deje que una persona que no esté involucrada en el análisis codifique cada diapositiva con un número determinado. Permanecer cegado a los grupos experimentales hasta que se complete la cuantificación de los parámetros NMJ para todas las muestras.
- Inicie el software del microscopio en modo de configuración > machine.xlhw y STED ON (Figura complementaria 2).
- Haga clic en Abrir proyecto > Nuevos proyectos para crear una carpeta para almacenar las adquisiciones de imágenes.
NOTA: genere una nueva carpeta para cada diapositiva para limitar el tamaño de la carpeta y evitar problemas de memoria del equipo. - Coloque el portaobjetos en la platina del microscopio y véalo bajo iluminación de fluorescencia de campo amplio utilizando el láser de 488 nm para encontrar el plano de observación dentro de la muestra.
- Busque una NMJ marcada con tinciones de neurofilamento M (NF-M) o SV2 utilizando el láser de 488 nm con una detección espectral de 506-531 nm.
- Cuando se haya identificado un NMJ, haga clic en Activar STED y comience a adquirir imágenes en una región que contenga varios pliegues de unión (Figura suplementaria 3) utilizando el láser de 635 nm con una detección espectral de 640-750 nm.
NOTA: Tenga cuidado con la tabla de búsqueda de saturación durante la adquisición de imágenes y haga clic en el botón LUT rápida para evitar la sobreexposición (valores de gris >255; para 8 bits). - Recopile las imágenes de cada grupo experimental con la misma configuración: tamaño de imagen 2048 x 2048 píxeles (38,75 x 38,75 μm) a una frecuencia de muestreo de 400 Hz.
NOTA: La potencia del láser de agotamiento (STED) se establece en 65%. - Guarde las imágenes con un nombre de archivo que incluya el código de la diapositiva.
NOTA: Es posible hacer clic en Formato XY optimizado: Establecer formato para obtener la mejor configuración de adquisición con imágenes STED. - Cambie a la siguiente diapositiva codificada y repita los pasos 3.2.3-3.2.8. Repita este procedimiento para todas las diapositivas.
- Al final de la sesión de microscopía STED, transfiera los archivos de imagen a otro equipo y guarde los archivos originales (. lif) en una unidad o servidor externo.
- Apague el software del microscopio, limpie los objetivos con tejidos de la lente y luego apague el sistema.
4. Análisis de imágenes: microscopía confocal
NOTA: Todas las imágenes se procesaron con computadoras que utilizan el sistema operativo profesional Microsoft Windows 10.
- Inicie ImageJ y la macro personalizada para calcular el volumen de la placa final NMJ postsináptica, el área de proyección de intensidad máxima (MIP) y la tortuosidad relativa.
- Procese pilas de imágenes NMJ utilizando el software gratuitoNIH ImageJ 23, el complemento iGeodesic y la macro personalizada para obtener mediciones de parámetros NMJ. Inicie el software ImageJ.
NOTA: La última versión de ImageJ está disponible gratuitamente y se puede descargar24. Para abrir formatos de archivo propietarios, el complemento Bio-Formats Package25 debe descargarse26 . Este paso no es necesario en caso de que el operador utilice Fiji porque el complemento ya está instalado en el software. El plugin iGeodesic27 para calcular la tortuosidad también está disponible en línea28; verificar la disponibilidad de este plugin en la versión ImageJ/Fiji que se utilizará. Las macros hechas a medida también están disponibles en línea29. - Arrastre y suelte el archivo Macro_NMJ_VOL_Marinelloetal.ijm (personalizado, archivo de codificación suplementario 1) a la ventana de ImageJ; La macro se abrirá en una segunda ventana. En esta nueva ventana, haga clic en Macros > Ejecutar macro.
Nota: La macro puede procesar archivos propietarios y TIFF. Los archivos deben cumplir los siguientes criterios: para formatos de archivo propietarios, guardar solo una unión (es decir, la pila de imágenes) por archivo, ordenada en una carpeta; para las imágenes TIFF, los archivos deben guardarse en una carpeta que contenga subcarpetas, cada una denominada JunctionX (X corresponde a un número NMJ) con las pilas de imágenes de una unión determinada (RIFF RGB) (Figura complementaria 4). - Seleccione la carpeta nativa que contiene las subcarpetas de Junction que deben analizarse y haga clic en Seleccionar.
- En el nuevo menú emergente llamado Guardar carpeta, seleccione la carpeta de almacenamiento y haga clic en Seleccionar.
- En el nuevo menú emergente llamado Tipo de imagen, seleccione el formato de las adquisiciones de la pila Z.
- Seleccione el canal RGB correspondiente a la tinción de interés e indique el tamaño del píxel XY y el paso Z (z). La macro realizará automáticamente el análisis.
NOTA: En caso de que se seleccionen formatos de archivo propietarios, la macro lee directamente el tamaño del píxel y el paso Z (z). Sin embargo, el usuario todavía tiene que indicar el canal de interés (C1, C2 o C3). La macro proporcionará una hoja de datos (.csv) para cada parámetro de unión (volumen de placa final, área MIP y tortuosidad) en la carpeta de guardado. La macro también genera tres archivos . Archivos TIF , que corresponden al perímetro de la tinción α-BTX Drawing_MaxprojX.tif, DrawingJunctionX.tif y MIP MaxprojX.tif. Estos archivos TIFF se generan para verificar la calidad de las adquisiciones y para garantizar que el procesamiento de imágenes se haya realizado correctamente.
Volumen de NMJ postsináptica (V): La macro separará las imágenes de una sola NMJ y mantendrá el canal F488 de α-bungarotoxina correspondiente a la placa terminal postsináptica. La pila se segmenta utilizando el umbral30 de Otsu en el segmento intermedio de la pila. La imagen binaria resultante tiene una dilatación de 1 píxel y la función Analizar partículas se utiliza para medir el área de la placa final de cada objeto detectado. Para obtener el volumen NMJ postsináptico, la macro suma todas las áreas de placa final medidas de la pila y lo multiplica por el valor del paso Z (z) en μm.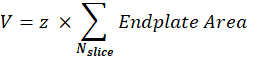
Área de la placa final de proyección de intensidad máxima (MIP): después de que se establece el umbral de la pila, se obtiene la proyección de intensidad máxima (MIP) mediante la función ImageJ del proyecto Z . La función Analizar partículas se utiliza para cuantificar el área de la placa terminal MIP.
Tortuosidad de NMJ MIP (T): La tortuosidad de NMJ, que refleja el grado de complejidad de la placa terminal motora postsináptica incluyendo pliegues y perforaciones31, se calcula en base a cada MIP usando la siguiente fórmula, donde d Obj(AB) es la distancia entre A y B a lo largo del perímetro del objeto, y dEuc(AB) es la distancia euclidiana entre A y B (línea recta).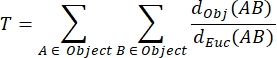
- Establezca el valor de tortuosidad más alto en el grupo de tipo salvaje de cada condición experimental en 100%, y normalice todos los demás valores de la condición experimental a este valor para obtener la tortuosidad NMJ relativa.
- Procese pilas de imágenes NMJ utilizando el software gratuitoNIH ImageJ 23, el complemento iGeodesic y la macro personalizada para obtener mediciones de parámetros NMJ. Inicie el software ImageJ.
- Inicie ImageJ y macro personalizada para cuantificar la acumulación de neurofilamentos presinápticos y la tinción de glicoproteína 2 de vesículas sinápticas.
NOTA: La acumulación de neurofilamentos (aquí, NF-M) y/o la distribución alterada de vesículas sinápticas (aquí, SV2) son marcadores de transporte axonal anormal y/o alteración del tráfico de vesículas y se observaron previamente en NMJ de varios modelos de ratón SMA32,33,34.- Arrastre y suelte el archivo Macro_NMJ_ACCU_Marinelloetal.ijm (archivo de codificación suplementario 2 hecho a medida) a la ventana de ImageJ; La macro se abrirá en una segunda ventana. En esta nueva ventana, haga clic en Macros > Ejecutar macro.
Nota: La macro puede procesar formatos de archivo propietarios y archivos TIFF. Los archivos deben cumplir los criterios indicados en la NOTA a continuación paso 4.1.2. - Seleccione la carpeta nativa que contiene las subcarpetas de Junction que deben analizarse y haga clic en Seleccionar.
- En el nuevo menú emergente llamado Guardar carpeta, seleccione la carpeta de almacenamiento y haga clic en Seleccionar.
- En el nuevo menú emergente llamado Tipo de imagen, seleccione el formato de las adquisiciones de la pila Z.
- En la ventana emergente Información de tinción , indique la etiqueta presináptica y postsináptica y el color y haga clic en Aceptar. Por ejemplo, etiqueta presináptica: SV2 o NF, color presináptico: R, etiqueta postsináptica: BTX, color postsináptico: G.
NOTA: Para los formatos de archivo propietarios, se deben indicar las etiquetas y los canales correspondientes (C1, C2 o C3). - En la ventana emergente Tamaño de píxel, indique el tamaño de píxel XY 0.072 μm y el paso Z 0.5 μm (z) y haga clic en Aceptar. La macro realizará automáticamente el análisis.
NOTA: Este parámetro corresponde al tamaño de imagen 1024 x 1024 píxeles (73,7 x 73,7 μm) seleccionado antes de la adquisición del microscopio confocal, y se correlaciona con el objetivo y la configuración del zoom. Si se seleccionan los formatos de archivo propietarios, la macro lee directamente el tamaño de píxel y el paso Z (z). La macro almacenará, en la carpeta de guardado, una hoja de datos (.csv) de volúmenes presinápticos y postsinápticos, una imagen TIFF de varias páginas de la detección actual para cada etiquetado (pre y postsináptico). Como se indicó anteriormente, estos archivos TIFF se generan para verificar la calidad de las adquisiciones y para garantizar que el procesamiento de imágenes se haya realizado correctamente.
La macro calcula el volumen de tinción axonal del neurofilamento M (volumen NF) del canal NF-M-F594 que colocaliza con el marcado de α-bungarotoxina-F488 y el volumen de tinción de glicoproteína 2 de vesículas sinápticas NMJ (volumen SV2) del canal SV2-F594 que colocaliza con el etiquetado α-BTX-F488. La acumulación de NF-M se cuantifica calculando la relación entre el volumen de NF y el volumen de la placa terminal postsináptica (α-BTX) y la ocupación terminal del axón NMJ por la relación de volúmenes SV2 y α-BTX, como se muestra a continuación.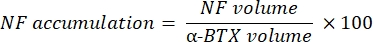
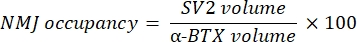
- Arrastre y suelte el archivo Macro_NMJ_ACCU_Marinelloetal.ijm (archivo de codificación suplementario 2 hecho a medida) a la ventana de ImageJ; La macro se abrirá en una segunda ventana. En esta nueva ventana, haga clic en Macros > Ejecutar macro.
5. Análisis de imágenes- Microscopía STED
NOTA: El procesamiento de imágenes se realizó con el software fuera de línea del fabricante del microscopio STED.
- Inicie el software del microscopio.
- Abra el proyecto haciendo clic en el botón Abrir proyecto . Seleccione el archivo de proyecto (.lif) y ábralo. Las imágenes se muestran en la pantalla junto con sus nombres.
- En la ventana Proceso : Haga clic en Reducción de ruido > Mediana. En la parte inferior de la ventana central, establezca Radio en 5,00 e Iteración en 1,00 y desmarque Filtrado 3D.
- Luego seleccione la pestaña Abrir proyectos en la parte superior izquierda de la ventana y elija una imagen.
- Haga clic en Aplicar para validar los parámetros. Se crea una nueva imagen llamada "nameofimage_median001".
NOTA: Es posible hacer clic en Vista previa antes de Aplicar para monitorear el efecto del filtro mediano, lo que mejorará el contraste de la imagen y suavizará los perfiles de línea utilizados para la cuantificación. - Aplique el filtro a todas las imágenes como se indica en los pasos 5.4-5.5.
- En las pestañas Abrir proyectos, haga clic en el icono de la unidad de disquete para guardar todos los proyectos , incluidas las imágenes filtradas recién creadas.
NOTA: El siguiente paso se realizará utilizando la imagen filtrada llamada "nameofimage_median001". - Calcular la distancia entre las bandas de AChR
NOTA: Los cambios en la morfología de los pliegues postjuncionales se observan a menudo en los trastornos neuromusculares como un signo de patología NMJ (inmadurez o degeneración). La distancia (d) entre las franjas de AChR, que se detectan mediante tinción de α-bungarotoxina, se calcula generando perfiles de intensidad y cuantificando la distancia entre cada pico de intensidad máxima dibujando un perfil de línea (Figura complementaria 5).- Usando el software del microscopio, seleccione el menú Cuantificar en la parte superior de la ventana central.
- Haga clic en la pestaña Herramientas en la parte superior izquierda. Seleccione Intensidad en el panel superior izquierdo y haga clic en el icono Perfil de línea . Establezca Sobremuestreo en 1 y marque Ordenar canales.
- Haga clic en las pestañas Abrir proyectos y seleccione la imagen filtrada a analizar.
NOTA: Es posible ampliar la imagen desplazándose con el ratón del ordenador. El rango dinámico de la imagen se puede modificar utilizando la barra en el lado izquierdo junto a la imagen mostrada, lo que facilita la visualización de las rayas. - Luego, haga clic en el icono Dibujar línea en el menú superior de la ventana derecha y trace una línea que cruce perpendicularmente varias rayas / pliegues de unión.
NOTA: El perfil de intensidad se muestra en la ventana central. - Haga clic en la parte superior del primer pico y mueva el puntero del ratón mientras mantiene presionado el botón izquierdo del ratón hasta que se alcance el siguiente pico máximo.
NOTA: La información se muestra en el perfil de intensidad, mientras que la distancia entre los dos picos se muestra debajo del gráfico con la denominación "dx". - Haga clic derecho en el ratón mientras está en la imagen de la ventana derecha y seleccione Guardar ROIs. Abra los ROI guardados (Regiones de interés) haciendo clic en Cargar ROI.
- Haga clic en el icono de flecha en la parte superior izquierda de la ventana derecha, haga clic en el ROI y elimínelo haciendo clic en el icono de la papelera.
- Repita esta operación tantas veces como sea necesario a partir de diferentes perfiles de intensidad para obtener el número previsto de distancias de rayas AChR que representarán el valor global en el músculo analizado.
NOTA: El valor óptimo de N se puede calcular de antemano en función de la diferencia estimada entre los grupos, el riesgo α, la potencia y la prueba de una o dos colas. En el diseño experimental actual, se aplicó una prueba de Mann-Whitney de una cola (riesgo α = 10%; potencia = 80%), y el valor de N se estimó en al menos cinco distancias de rayas AChR por NMJ para comparar los dos grupos de animales.
- Ancho de banda AChR
NOTA: El ancho de banda (w) corresponde al medio máximo de ancho completo (FWHM) del perfil de intensidad, que es la distancia entre los puntos donde el valor de fluorescencia de la señal α-BTX es la mitad de su intensidad máxima (Figura complementaria 5).- Usando el software del microscopio, seleccione el menú Cuantificar en la ventana central.
- Haga clic en la pestaña Herramientas en la parte superior izquierda. Seleccione Intensidad en el panel superior izquierdo y haga clic en el icono Determinar FWHM . Marque Ordenar canales.
NOTA: Para optimizar la detección de picos por parte del software, Set Threshold y Width se establecieron en 50 y 3, respectivamente. Adapte estos valores para cada experimento y pida consejo a un científico experimentado en imágenes. - Haga clic en las pestañas Abrir proyectos y seleccione la imagen filtrada a analizar.
NOTA: Es posible ampliar la imagen mostrada en la ventana derecha desplazándose con el ratón del ordenador. Como se indicó anteriormente (NOTA siguiendo el paso 5.8.3), el rango dinámico de la imagen se puede modificar para una visualización óptima de la banda. - A continuación, haga clic en el icono Dibujar rectángulo en el menú superior de la ventana derecha. Seleccione una franja horizontal o vertical y dibuje un rectángulo perpendicularmente a la banda. Aparece un perfil en la ventana central.
- Haga clic en Vertical u Horizontal del menú Proyección media situado en el panel izquierdo, dependiendo de si la orientación de la franja es vertical u horizontal.
- Haga clic en Estadísticas en la ventana central y lea el valor FWHM.
- Haga clic derecho con el mouse de la computadora en la imagen que se muestra en la ventana derecha y seleccione Guardar ROI.
NOTA: Abra los ROI guardados haciendo clic en Cargar ROI. - Haga clic en el icono de flecha en la parte superior izquierda de la ventana derecha, haga clic en el ROI y elimínelo haciendo clic en el icono de la papelera.
- Repita esta operación tantas veces como sea necesario a partir de diferentes ROI rectangulares hasta obtener el número previsto de anchos de banda AChR, que será representativo del valor global en el músculo analizado.
6. Diseño experimental y pruebas estadísticas
- Realizar análisis estadísticos utilizando software específico.
NOTA: Los datos se recopilaron de N ≥ 3 réplicas biológicas y al menos 20 NMJ por genotipo para imágenes de microscopio confocal, y N ≥ 5 réplicas biológicas y N = 5 NMJ por genotipo para imágenes STED, en cada grupo experimental. La significancia se evaluó mediante la prueba de Mann-Whitney no pareada (no paramétrica), y los valores de p se indican en las leyendas de las figuras correspondientes.
Resultados
Con el fin de facilitar el análisis morfológico de las uniones neuromusculares a nivel pre y postsináptico de una manera reproducible, se desarrolló un flujo de trabajo desde la recolección muscular hasta la obtención de imágenes y la cuantificación utilizando el software de microscopio y macros personalizadas ImageJ (Figura 1). Para ejemplificar la utilidad de este protocolo, se evaluó la morfología de las NMJ en dos modelos de ratón de trastornos genéticos, ratones Smn2B / - y ColQ Dex2 / Dex2 afectados por atrofia muscular espinal (AME) y una forma de síndrome miasténico congénito (CMS), respectivamente, y los datos se compararon con compañeros de camada de control de la misma edad.
La estructura de la NMJ se evaluó a partir de los músculos tibial anterior y gastrocnemio de ratones Smn2B/- (fondo C57Bl/6) y ColQ Dex2/Dex2 (fondo B6D2F1/J) de 3 y 6 semanas de edad, respectivamente, cuando los signos de la enfermedad ya están presentes en estos animales. A las 3 semanas de edad, los ratones Smn2B/- muestran signos de retraso en el desarrollo y denervación del músculo esquelético, como atrofia y pérdida de NMJ35,36. Los ratones CMS tienen una patología primaria en las NMJ y manifiestan una reducción del peso corporal desde la primera semana de vida y una marcada debilidad muscular20 (datos no mostrados). Como se muestra en la Figura 2A, la placa terminal motora postsináptica marcada con α-bungarotoxina fluorescente apareció más pequeña y/o fragmentada en mutantes de las dos líneas de ratón por microscopía confocal. La cuantificación de las pilas Z de NMJ utilizando estas macros ImageJ personalizadas reveló disminuciones marcadas en el volumen de la placa terminal, la proyección de intensidad máxima (MIP) y la tortuosidad relativa en ratones SMA y CMS en comparación con los controles, como signos de defectos de maduración de NMJ32 (Figura 2B-D). El volumen de la placa terminal postsináptica y la MIP disminuyeron en animales enfermos (cambio de pliegue de 2.7 y 2.0 para el volumen, y 2.5 y 2.0 para MIP, en ratones Smn2B / - y ColQ Dex2 / Dex2, respectivamente). La tortuosidad relativa también fue menor en los músculos deficientes de SMN y ColQ que en WT (16,97% ± 1,33% en SMA frente a 48,84% ± 5,90% ratones WT, y 13,29% ± 2,79% en CMS frente a 30,20% ± 4,44% ratones control). Además, la cuantificación de la distribución de las ramas terminales del axón presináptico utilizando la macro personalizada ImageJ reveló un patrón alterado en la distribución de neurofilamentos M en los dos modelos animales, con un aumento del inmunomarcaje (84,65% ± 0,32% frente a 16,57% ± 2,03% y 23,64% ± 2,78% frente a 18,77% ± 1,73% en ratones Smn2B/- y ColQ Dex2/Dex2 en comparación con los controles, respectivamente) (Figura 3A-D ). Mediante la tinción SV2, también se observó una reducción del 43% en la razón de ocupación, es decir, el porcentaje de regiones que contienen AChR con zonas activas terminales nerviosas adyacentes, en ratones Smn2B / - (49.36% ± 3.76% en SMA versus 85.69% ± 2.34% ratones WT) (Figura 3E, F). Este parámetro NMJ también se calculó en GA de los mutantes ColQ Dex2 / Dex2, pero no se encontraron diferencias estadísticamente significativas en comparación con los compañeros de camada de control (datos no mostrados).
Además, analizamos las características de la membrana postsináptica cuantificando la distancia entre los pliegues de unión y el ancho de las rayas de AChR, que se encuentran en la cresta de estos pliegues, en el músculo deficiente en ColQ utilizando microscopía de agotamiento por emisión estimulada de súper resolución (STED). Como se muestra en la Figura 4, el aspecto de estas estructuras se puede visualizar claramente mediante el etiquetado fluorescente de α-bungarotoxina y el análisis del perfil de intensidad. Evaluamos estos parámetros NMJ y encontramos un aumento en la distancia del pliegue de unión (d) y el ancho (w) de las rayas AChR en el músculo gastrocnemio de los mutantes (358.3 nm ± 11.97 nm y 320.8 nm ± 10.90 nm para la distancia, y 216.9 nm ± 10.51 nm y 186.3 nm ± 7.015 nm para el ancho, en ColQ Dex2 / Dex2 en comparación con ratones de tipo salvaje, respectivamente, p < 0,05) (Figura 4C,D).
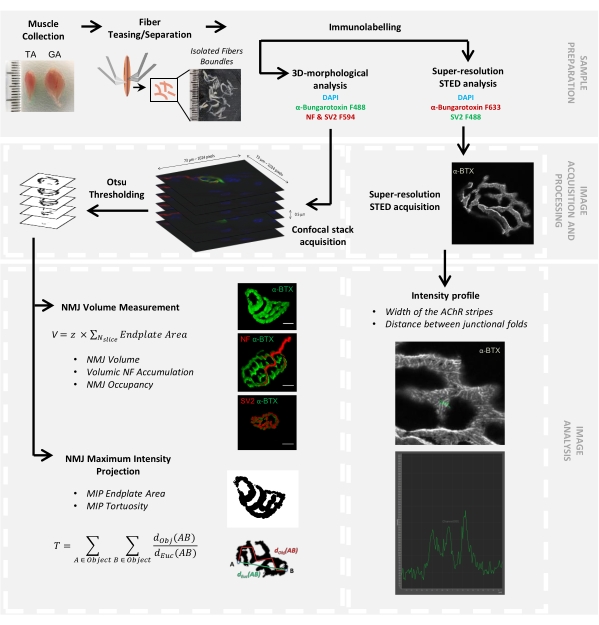
Figura 1: Diagrama de flujo del protocolo de video para la caracterización 3D multiescala de NMJ mediante microscopía confocal y STED. Los músculos tibial anterior (TA) y gastrocnemio (GA) se recolectaron de ratones, y las fibras musculares se burlaron antes de etiquetar con α-bungarotoxina-F488 o α-bungarotoxina-F633, DAPI, anticuerpos primarios dirigidos contra el neurofilamento M (NF-M) y la glicoproteína de vesícula sináptica 2 (SV2), y los anticuerpos secundarios conjugados fluoróforos (F488 o F594). Las pilas de imágenes se adquirieron mediante microscopía confocal y se procesaron para medir el volumen de NMJ postsináptico, la acumulación presináptica de NF-M, la ocupación terminal del axón NMJ, el área de la placa terminal de proyección de intensidad máxima postsináptica (MIP) y la tortuosidad (d Obj (AB) es la distancia entre A y B a lo largo del perímetro del objeto (línea roja), mientras que dEuc (AB) es la distancia euclidiana entre A y B (línea verde)). Para el análisis de microscopía STED, el ancho de las rayas del receptor de acetilcolina (AChR) y la distancia entre los pliegues de unión se cuantificaron a partir de perfiles de intensidad de tinción α-BTX-F633. Haga clic aquí para ver una versión más grande de esta figura.
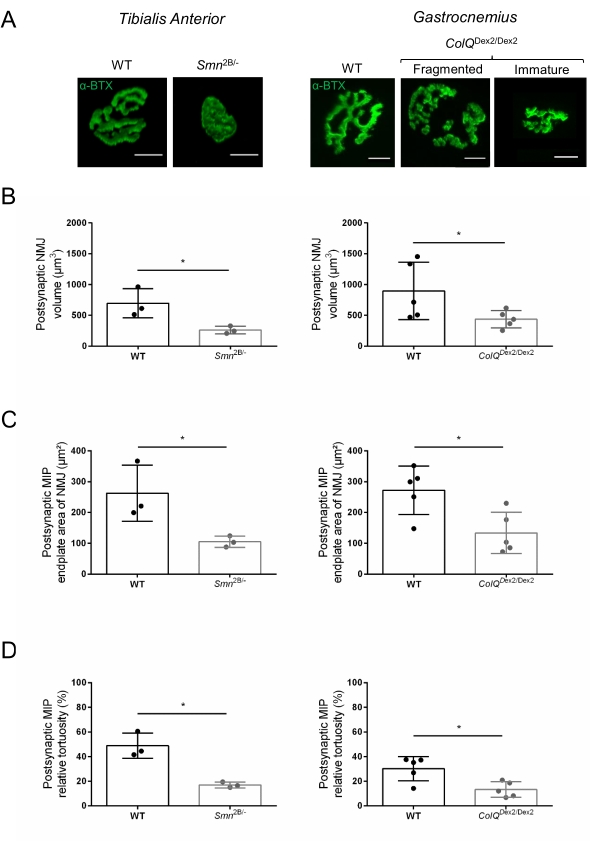
Figura 2: Caracterización multiparamétrica postsináptica de NMJ en modelos murinos de atrofia muscular espinal (AME) y síndrome miasténico congénito (CMS) relacionado con ColQ. (A) Imágenes representativas de las placas terminales motoras postsinápticas de los músculos TA y GA marcadas con α-bungarotoxina-F488 (α-BTX). (B) Cuantificación del volumen de la placa terminal postsináptica de NMJ, (C) área de proyección de intensidad máxima (MIP) y (D) tortuosidad relativa en TA de ratones de tipo salvaje (WT) y Smn2B/- de 3 semanas de edad (gráficos de la izquierda, N = 3 animales por genotipo, n = 37 y n = 56 NMJ, respectivamente) y WT de 6 semanas y ColQ Dex2/Dex2 ratones (gráficos de la derecha, N = 5 ratones por genotipo, n = 89 y n = 97 NMJ, respectivamente). Los datos se expresan como la media por ratón (punto) ± SEM. Las diferencias entre los grupos fueron analizadas por la prueba de Mann-Whitney (* p < 0,05). La barra de escala es de 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
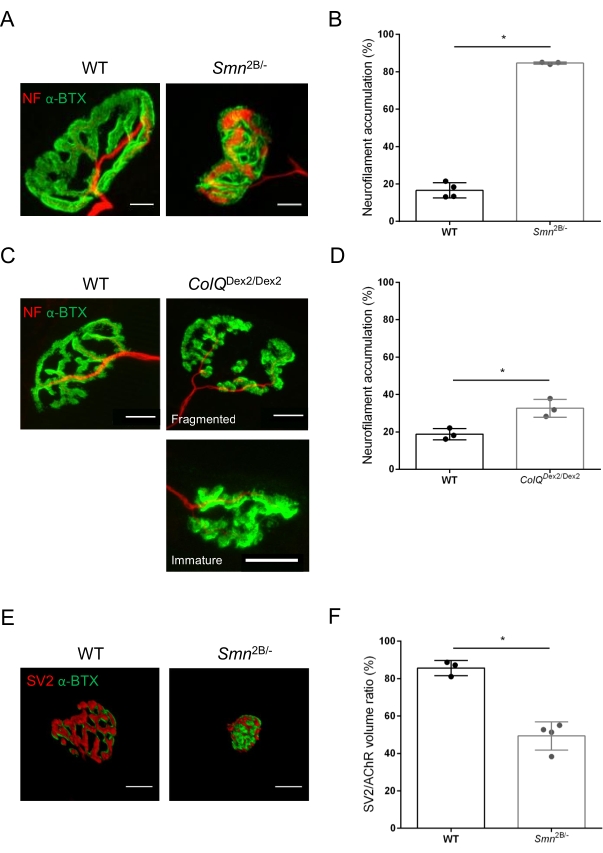
Figura 3: Análisis morfométrico de la distribución terminal del axón presináptico en músculos de ratones WT y mutantes. Patrón de inervación de NMJ en los músculos tibial anterior (TA) y gastrocnemio (GA) de ratones CMS de tipo salvaje, SMA y ColQ. (A, B) Uniones neuromusculares representativas de TA de ratones WT y Smn2B/- a los 21 días de edad marcados con anticuerpos contra el neurofilamento M (NF-M, rojo) y α-bungarotoxina-F488 (α-BTX, verde) (A), y resultados del análisis cuantitativo de la acumulación de neurofilamentos (B); (C, D) Uniones neuromusculares representativas de GA de ratones WT y ColQ Dex2/Dex2 de 6 semanas de edad marcados con anticuerpos contra el neurofilamento M (NF-M, rojo) y α-bungarotoxina-F488 (α-BTX, verde), mostrando placas terminales postsinápticas fragmentadas e inmaduras (C), y resultados de acumulación de neurofilamentos en los dos grupos de animales (D). En los experimentos se analizaron N= 4 (n = 34 NMJs) (B) y N = 3 (n = 54 NMJs) (D) animales WT, y N=3 (n = 36 NMJs) Smn2B/- y N = 3 (n = 55 NMJs) en los experimentos se analizaron ratones ColQ Dex2/Dex2 (B, D). (E, F) Imágenes representativas de la ocupación terminal del axón en NMJ de TA de ratones WT y Smn2B/- de 3 semanas de edad marcados con anticuerpos contra la glicoproteína de vesícula sináptica 2 (SV2, rojo) y α-bungarotoxina-F488 (α-BTX, verde) (E), y resultados de ocupación de NMJ (relación de volumen SV2/AChR) (F). Se analizaron los músculos de N = 3 (n = 50 NMJs) de tipo salvaje y N = 4 (n = 62 NMJs) Smn2B/- ratones. Los datos se expresan como el valor medio por ratón (punto) ± SEM. Las diferencias entre los grupos fueron analizadas por la prueba de Mann-Whitney (* p < 0,05). Las barras de escala son de 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
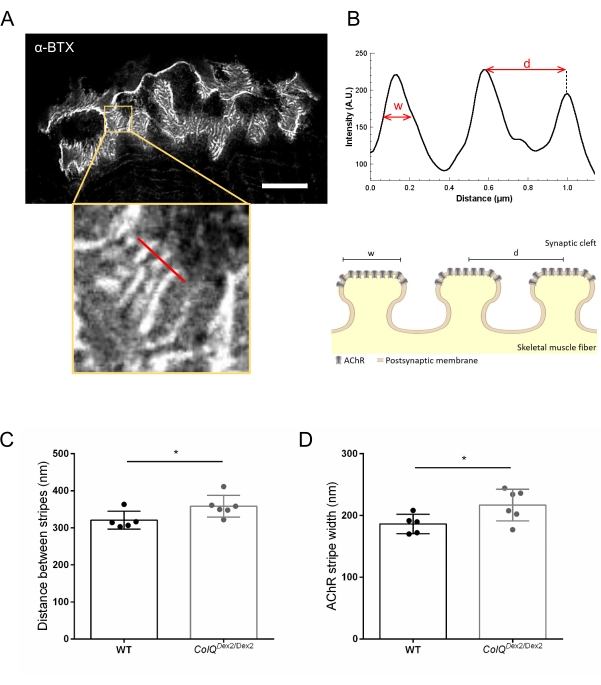
Figura 4: Imágenes STED de las placas terminales postsinápticas de la NMJ. (A) Imagen STED representativa de una NMJ marcada con α-bungarotoxin-F633 (α-BTX) de gastrocnemio de un ratón de tipo salvaje de 6 semanas de edad que muestra rayas AChR postjuncionales (la barra de escala es de 5 μm). (B) Mayor aumento de una región con rayas AChR (panel inferior) que se utilizó para generar el perfil de intensidad. El ancho (w) de las franjas AChR y la distancia entre dos franjas adyacentes (d) de esta región fueron cuantificadas y presentadas en el gráfico de barras. Representación esquemática de la placa final postsináptica para ilustrar el ancho de banda AChR (w) y la distancia (d). Estos parámetros, (C) distancia de la franja AChR y (D) ancho, se midieron en ratones ColQ Dex2 / Dex2 y compañeros de camada de control a las 6 semanas de edad. Se analizaron a ciegas NMJ de 5 WT (n total = 29 NMJ) y 6 animales ColQ Dex2/Dex2 (total n = 43 NMJ). Los datos se expresan como la media por ratón (punto) ± SEM. Las diferencias estadísticas entre los grupos se analizaron mediante la prueba de Mann-Whitney (* p < 0,05). Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Lanzamiento del software LAS X y parámetros para adquisiciones confocales. Los distintos pasos para adquirir imágenes confocales se describen en las secciones 3.1.2 a 3.1.7 del protocolo. Para cada adquisición de pila NMJ, se abre un proyecto (paso 3.1.4) y se seleccionan los parámetros de tamaño de imagen, velocidad de adquisición, ejes X, Y y Z (paso 3.1.7), con cada escaneo secuencial indicado (Seq.1, láser 405 para DAPI; Seq.2, láser 488 para α-BTX-F488; y Seq.3, láser 552 para anticuerpos secundarios conjugados F594). Haga clic aquí para descargar este archivo.
Figura complementaria 2: Lanzamiento del software LAS X y parámetros para adquisiciones STED. Los pasos para adquirir imágenes STED se describen en las secciones 3.2.2 a 3.2.8 del protocolo. El microscopio se inicia en modo de configuración STED ON (paso 3.2.2) y se abre un proyecto (paso 3.2.3). Se indican los parámetros para la adquisición de imágenes (paso 3.2.7) (tamaño de imagen, velocidad de adquisición, factor de zoom, eje X), con cada escaneo secuencial (Seq.1 para α-BTX-F633; Seq.2 para anticuerpos secundarios conjugados F488). Haga clic aquí para descargar este archivo.
Figura complementaria 3: Imágenes de pliegues de unión teñidos con α-BTX obtenidos por microscopía STED. Ejemplos de imágenes de una placa terminal postsináptica etiquetada con α-BTX-F633 de un ratón de tipo salvaje de 6 semanas de edad que se adquirieron con un enfoque correcto (izquierda) o incorrecto (derecha). Haga clic aquí para descargar este archivo.
Figura complementaria 4: Ventanas emergentes de Windows para describir los datos de entrada y salida obtenidos por las macros personalizadas de ImageJ. Los ejemplos de datos de entrada (archivos .tif y .lif) de imágenes NMJ se muestran en la columna izquierda. Los datos de salida de las macros (columna derecha) se guardan en carpetas (Save_Volume, Save_Accu) que contienen imágenes de la unión (.tif) y hojas de datos que contienen los resultados (archivos .csv). Haga clic aquí para descargar este archivo.
Figura complementaria 5: Análisis de distancia y anchura de bandas AChR a partir de una adquisición STED utilizando el software LAS X. Los pasos para analizar imágenes NMJ STED se describen en la sección 5 del protocolo. A) Imagen de una región de placa terminal postsináptica marcada que contiene rayas de AChR. La región de interés para el análisis de franjas se selecciona dibujando una línea perpendicular (línea verde, para la distancia de la raya) o un rectángulo perpendicular (rectángulo púrpura, para el ancho de la banda). (B, C) Se muestran los perfiles de intensidad de las regiones seleccionadas y las medidas para calcular la distancia entre las franjas de AChR (B) y el ancho de banda de AChR (C). Haga clic aquí para descargar este archivo.
Archivo de codificación suplementario 1: Macro_NMJ_VOL_Marinelloetal. Macro personalizada de ImageJ para extraer mediciones de parámetros NMJ (volumen NMJ, área de placa final MIP y tortuosidad NMJ). Haga clic aquí para descargar este archivo.
Archivo de codificación complementario 2: Macro_NMJ_ACCU_Marinelloetal. Macro personalizada de ImageJ para extraer la acumulación de NF-M y la tinción SV2. Haga clic aquí para descargar este archivo.
Discusión
El protocolo de video descrito proporciona un método detallado para cuantificar la estructura 3D de las uniones neuromusculares mediante la combinación de microscopía confocal y STED que se puede utilizar para caracterizar los cambios patológicos en los niveles pre y postsináptico. La alta resolución de la microscopía STED permite la visualización y el análisis morfométrico de nanoestructuras que no son identificables por imágenes confocales convencionales. Este procedimiento nos permitió medir las alteraciones estructurales de las NMJ en dos músculos apendiculares, tibial anterior y gastrocnemio, de ratones SMA y CMS relacionados con ColQ.
Para obtener resultados confiables con esta técnica, es fundamental diseccionar y burlarse de los músculos correctamente, prestando especial atención a la fascia que rodea el músculo y la fuerza aplicada para separar los haces musculares; de lo contrario, el patrón de inervación podría interrumpirse impidiendo una evaluación presináptica adecuada de la NMJ. Aunque se proporciona información detallada para analizar las NMJ de TA y GA, en principio, este protocolo podría adaptarse a otros músculos, incluidos los músculos planos, como el diafragma o el abdomen transverso37, que no requieren el paso de burla. La fijación de los tejidos también es crucial para garantizar una tinción de buena calidad; por lo tanto, se recomienda usar PFA de alta calidad a un volumen apropiado (15-20 veces el del músculo). Además, el tiempo de exposición al fijador es un paso importante porque los artefactos, como la contracción y la aglutinación, pueden aparecer debido a la sobrefijación e influir en las características de NMJ. Dado el tamaño de las muestras y la velocidad de penetración de la solución de paraformaldehído en los tejidos38, se recomienda un tiempo de fijación de 18-24 h para este tipo de músculo. En caso de que el paso de tinción se planifique más de una semana después de la recolección de tejido, se sugiere mantener los músculos fijados con PFA en PBS suplementados con azida de sodio a 4 ° C para evitar la proliferación bacteriana.
Este protocolo presenta un enfoque que utiliza α-BTX-F488 para imágenes confocales y α-BTX-F633 para imágenes STED. Estos fluoróforos fueron elegidos para encajar con el diseño experimental descrito, pero pueden modificarse de acuerdo con el equipo y los materiales disponibles. Por ejemplo, se puede seleccionar el etiquetado α-BTX F488 cuando se utiliza un láser STED CW 592 nm para la adquisición y cuantificación de imágenes. Sin embargo, parece que la configuración que se aplicó en el presente estudio (STED de excitación pulsada cerrada, agotamiento de 775 nm) exhibe un mayor rendimiento y mejor resolución que otros enfoques, como la onda continua STED39, lo que la hace más adecuada para la aplicación actual. También es importante seleccionar cuidadosamente los ajustes de potencia del láser, especialmente para STED (tanto excitación como agotamiento), ya que las características de un perfil de intensidad no se pueden medir en caso de saturación y, por lo tanto, cualquier señal saturada en una imagen NMJ podría poner en peligro todo el análisis.
Este flujo de trabajo detallado, que incluye adquisiciones y análisis de imágenes utilizando software de microscopio y macros ImageJ, se desarrolló para facilitar el análisis morfométrico autónomo de NMJ mediante microscopía confocal y STED de un solo músculo. Los flujos de trabajo descritos anteriormente para el análisis confocal de NMJ, como NMJ-morph2 o NMJ-Analyser14, allanaron el camino para el diseño de métodos semiautomáticos que facilitan el análisis morfológico de NMJ y estudios comparativos. NMJ-morph (y su versión actualizada aNMJ-morph15) es una plataforma gratuita basada en ImageJ que utiliza la proyección de intensidad máxima para medir 21 características morfológicas, y NMJ-Analyser utiliza un script desarrollado en Python que genera 29 parámetros relevantes a partir de toda la estructura 3D NMJ. El umbral manual es el único paso durante el procesamiento de imágenes en estos dos métodos que requieren análisis del usuario. Este protocolo integrado detalla los pasos para la preparación de tejidos, las adquisiciones de imágenes confocales 3D y el procesamiento basado en ImageJ de NMJ de músculos esqueléticos completos y proporciona una visión general simplificada de cinco parámetros importantes de las placas terminales postsinápticas (volumen, área de proyección máxima y tortuosidad) y presinápticas (ocupación terminal del axón y acumulación de neurofilamentos). Un parámetro adicional de relevancia biológica, el patrón de organización AChR de los pliegues de unión postsinápticos, fue incorporado para el análisis morfométrico a nivel nanométrico por microscopía STED de superresolución (resolución 20-30 nm)40. Curiosamente, la preparación del tejido para imágenes STED es más simple que otros métodos utilizados para estudios ultraestructurales de NMJ, como la microscopía electrónica de transmisión convencional (TEM)9, que es un procedimiento bastante complejo y lento que requiere un manipulador experto para obtener secciones ultrafinas de la región muscular apropiada. Además, los datos cuantitativos de múltiples pliegues de unión se pueden obtener automáticamente utilizando el software asociado a STED.
Este protocolo se aplicó para ilustrar defectos NMJ previamente conocidos en músculos deficientes en SMN y ColQ 20,36,41,42. Se encontraron cambios comunes en los dos modelos de ratón por microscopía confocal, como disminución del volumen de la placa terminal postsináptica, área MIP y tortuosidad relativa, y aumento de la acumulación de neurofilamentos, mientras que algunos hallazgos más específicos (disminución de la ocupación de NMJ), se observaron solo en ratones SMA, como un indicador de tráfico de vesículas deterioradas36. Finalmente, se detectó un aumento en la distancia y anchura de la franja AChR en ColQ-KO mediante análisis STED, que son signos de defectos ultraestructurales en los pliegues de unión postsinápticos, como se observó previamente en TEM20. Es importante destacar que este protocolo puede ayudar en una caracterización morfológica más profunda de las uniones neuromusculares durante el desarrollo, el mantenimiento y bajo diversas condiciones patológicas.
Divulgaciones
Los autores declaran no tener conflictos de intereses relacionados con este trabajo.
Agradecimientos
Agradecemos a la "Imaging and Cytometry Core Facility" de Genethon, así como al servicio de histología, que cuentan con el apoyo parcial de fondos de equipos de la Región Ile-de-France, el Conseil General de l'Essonne, el Genopole Recherche de Evry, la Universidad de Evry Val d'Essonne y el INSERM, Francia. También agradecemos al Dr. Rashmi Kothary por proporcionar la línea de ratón Smn 2B/2B (Universidad de Ottawa, Canadá) y al Dr. Eric Krejci por la línea de ratón ColQDex2/+ (inédito, Universidad de París, Francia). Agradecemos a Guillaume Corre por su apoyo en el análisis estadístico. Los anticuerpos monoclonales 2H3 (desarrollados por Jessel, T.M. y Dodd, J.) y SV2 (desarrollados por Buckley, K.M.) se obtuvieron del Banco de Hibridoma de Estudios del Desarrollo (DSHB), creado por el NICHD del NIH y mantenido en la Universidad de Iowa, Departamento de Biología, Iowa City, IA 52242. Este trabajo fue apoyado por la Asociación Francesa contra las Miopatías (AFM-Teletón), el INSERM y la Universidad de Evry Val d'Essonne.
Materiales
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
Referencias
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304(2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671(2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677(2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220(2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251(2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128(2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- ImageJ. , Available from: http://imagej.nih.gov/ij (2021).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Bio-Formats. , Available from: http://www.openmicroscopy.org/bio-formats/downloads/ (2021).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, Supplement C 253-261 (2013).
- ImageJ documentation. , Available from: http://imagejdocu.tudor.lu/plugin/analysis/geodesic_distances/start (2021).
- GitHUb. , Available from: https://github.com/Genethon/ImCy (2021).
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162(2014).
- Baker, J. R. Principles of biological microtechnique; a study of fixation and dyeing. , Wiley. London Methuen; New York. at http://archive.org/details/principlesofbiol01bake (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421(2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644(2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605(2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados