Method Article
通过联合共聚焦和超分辨率显微镜表征小鼠的神经肌肉接头
* 这些作者具有相同的贡献
摘要
该协议描述了一种通过组合共聚焦和STED显微镜对神经肌肉接头进行形态学分析的方法,该方法用于量化SMA和ColQ相关CMS小鼠模型中的病理变化。
摘要
神经肌肉接头(NMJ)是下运动神经元和骨骼肌纤维之间的高度特化的突触,在分子从神经系统传递到随意肌肉中起着至关重要的作用,从而导致收缩。它们在许多人类疾病中受到影响,包括遗传性神经肌肉疾病,如杜氏肌营养不良症 (DMD)、先天性肌无力综合征 (CMS)、脊髓性肌萎缩症 (SMA) 和肌萎缩侧索硬化症 (ALS)。因此,监测神经肌肉接头的形态及其在疾病小鼠模型中的改变是病理研究和治疗方法临床前评估的宝贵工具。在这里,描述了标记和分析来自小鼠挑逗的肌纤维的运动终板突触前和突触后部分的三维(3D)形态的方法。通过共聚焦成像制备样品和测量NMJ体积,面积,曲折度和轴突末端形态/占据率的程序,以及突触后连接褶皱与乙酰胆碱受体(AChR)条纹宽度之间的距离通过超分辨率受激发射耗竭(STED)显微镜详细介绍。这些NMJ参数的改变在受SMA和CMS影响的突变小鼠中说明。
引言
神经肌肉接头(NMJ)是由运动轴突末端,突触周围雪旺细胞和骨骼肌纤维部分组成的复杂结构,参与化学信息的传递和下运动神经元活动与肌肉收缩的耦合。在哺乳动物中,神经肌肉接头的形态在发育过程中发生变化,成熟后呈现出典型的椒盐脆饼状形状,物种之间的形状和复杂性存在差异,并且响应运动或衰老等生理过程表现出一定程度的可塑性1,2,3,4.突触后运动终板形成称为连接褶皱的膜内陷,其中含有乙酰胆碱受体(AChR)的上部与突触前末端轴突分支5紧密接触。
神经肌肉接头的形态和功能变化有助于几种神经退行性疾病的病理生理学,例如脊髓性肌萎缩症 (SMA) 和肌萎缩侧索硬化症 (ALS)、杜氏肌营养不良症 (DMD)、先天性肌无力综合征 (CMS)、重症肌无力 (MG) 和中心核肌病 (CNM) 以及衰老相关的肌肉减少症3,6,7,8,9,10,11,12.在这些疾病中,观察到NMJ结构改变,例如终板碎裂,突触后连接褶皱大小减小和/或去神经支配。NMJ的病理学可以是疾病进展期间的主要或早期事件,也可以是最近出现的次要事件,导致临床表现。无论如何,监测这些疾病的动物模型中NMJ的形态是研究病理变化和评估潜在治疗效果的宝贵参数。
神经肌肉接头的形态通常通过使用共聚焦显微镜2,13,14,15或电子显微镜5,16的技术进行分析,分别具有其固有的局限性,例如分辨率或技术困难。最近,超分辨率显微镜还用于可视化NMJ的特定区域,例如突触前活性区或突触后膜16,17,18上的AChR分布,作为电子显微镜超微结构分析的替代或补充方法。
该协议旨在通过结合荧光共聚焦和受激发射消耗(STED)显微镜提供一种详细且可重复的方法来评估NMJ形态参数。在正常和患病条件下量化了小鼠腓肠肌和胫骨前神经支配肌纤维中突触前和突触后终板的重要特征,例如体积、面积、相对曲折度、AChR 条纹宽度和轴突末端分布。特别是,NMJ缺陷在脊髓性肌萎缩症的Smn2B / -小鼠模型中得到例证,这是一种由SMN1基因11,19突变引起的具有运动神经元变性的神经肌肉疾病,以及不对称乙酰胆碱酯酶敲除(ColQ Dex2 / Dex2或ColQ-KO)小鼠的胶原样尾部亚基,作为先天性肌无力综合征的模型20, 21,22.
研究方案
根据国家和欧洲关于动物实验的立法进行小鼠的护理和操作,并得到机构伦理委员会的批准。该研究分别使用了3周龄和6周龄的Smn2B / -(C57Bl / 6J背景)和ColQ Dex2 / Dex2(B6D2F1 / J背景)小鼠的雄性和雌性。
1.小鼠安乐死和肌肉解剖: 胫骨前部和腓肠肌
- 在通过颈椎脱位安乐死之前,通过腹膜内注射氯胺酮(87.5mg / kg)/甲苯噻嗪(12.5mg / kg)混合溶液(0.1mL / 20g体重)进行小鼠麻醉。
注意:由于SMA和ColQ-CMS独立于其性别影响个体,因此在本协议中使用雄性和雌性小鼠。 - 使用小型电动剃须刀去除后肢毛发,并用70%乙醇冲洗腿部。
注意:解剖程序因每块肌肉而异。对于 胫骨前 部 (TA) 的清扫,请遵循步骤 1.2.1-1.2.3,对于 腓肠肌 (GA)(内侧和外侧),请遵循步骤 1.2.4-1.2.6。轻柔地处理肌肉以防止组织损伤以及在解剖过程中挤压或拉伸它们。- 将鼠标置于仰卧位。
- 用锋利的钝剪刀沿着后肢远端的前外侧部分(平行于胫骨)切开 5 毫米的皮肤切口,以露出肌肉。使用超细剪刀去除筋膜。
- 首先切断远端肌腱(靠近爪子),然后使用超细剪刀和弯曲的细镊子切割近端肌腱(靠近膝盖)。小心处理肌肉,避免损伤肌纤维和神经。
注意:近端肌腱必须尽可能靠近骨骼进行切割,以收获整个肌肉。 - 将鼠标置于俯卧位,用锋利的钝剪刀从后肢远端后室的上部向下到爪子做一个皮肤切口,然后去除皮肤。
- 用中等锯齿状镊子抓住跟腱,用超细剪刀将其剪断,然后将GA与周围组织轻轻分离回其近端插入处。
- 在近端侧,将中等锯齿状镊子插入股二头肌 (BF) 和 GA 之间形成的口袋中。 用超细剪刀将两块肌肉分开,以尽可能靠近骨插入处切割 GA 肌腱。
- 对于组织固定,将每块肌肉放入含有1mL在磷酸盐缓冲盐水(不含Ca 2 + Mg 2+的PBS)中稀释的4%w / v多聚甲醛(PFA)溶液的2 mL微量离心管中,并保持在4°C下18-24小时。
注意:多聚甲醛和甲醛有毒,必须在装有足够防护设备的化学通风橱中处理。 - 第二天,在化学通风橱内的室温(RT)下轻轻摇晃,用PBS在12孔板中洗涤固定肌肉3次5分钟。
注意:协议可以在此步骤中停止,并在一个月内继续。在这种情况下,加入补充有0.01%叠氮化钠的PBS以将样品储存在4°C。 - 使用两个细锯齿状镊子在约 1 毫米宽的小纤维束中挑逗每块肌肉。
注意:用镊子非常轻柔地操纵肌肉至关重要,不要过度用力,以防止在挑逗过程中组织损伤。- 根据 TA 肌肉的大小将 TA 肌肉解离成 3 或 4 束。
- 对于 GA,将肌肉的内侧和外侧分开,然后根据其大小将每个部分解离成 4-5 束。
2. 免疫染色
- 进行肌纤维透化:将肌肉束转移到PBS中含有1%(v / v)Triton X-100的24孔板中,并在室温下保持温和搅拌(50rpm)1小时或在4°C下保持5小时。
注意:将肌肉束分开在两个板之间,以进行单独的免疫染色,并将抗体混淆的风险降至最低。不要将它们分成两个以上的孔(1孔/板);否则,代表其在分析肌肉中的一般状态的NMJ的数量(N)可能不足。 - 在室温下用PBS洗涤样品3次5分钟,并在4°C下用PBS / Triton X-100 1%中的4%牛血清白蛋白(BSA)组成的封闭溶液孵育4小时,在轻轻搅拌(50rpm)。
注意:在洗涤步骤中不要使用抽吸泵,而是使用200μL移液器和小尺寸吸头手动吸出溶液(参考文献在 材料表中注明)。 - 将样品在4°C下轻轻搅拌(50rpm)孵育过夜(O / N),步骤2.2中指示的封闭溶液含有针对神经丝M(NF-M,2H3,稀释1/200)或突触囊泡糖蛋白2(SV2,稀释1/200)的一级单克隆抗体,分别标记突触前轴突末端或活性区。
- 第二天,在搅拌(50rpm)下在PBS中洗涤肌肉束3次5分钟。
- 对于共聚焦成像:将肌肉束与与红色发光荧光团(F594)(稀释度1/500)和α-bungarotoxin偶联的二级抗小鼠抗体孵育,与绿色发光荧光团(α-BTX-F488)(稀释1/1000)偶联在PBS中搅拌(50rpm)下在室温下2小时。
- 对于STED成像:将肌肉束与与绿色发光荧光团(F488)(稀释1/500)和α-bungarotoxin偶联的二级抗小鼠抗体孵育,该抗小鼠蛋白与具有高光稳定性(α-BTX-F633)(稀释度1/1000)的远红发射荧光团偶联在PBS中搅拌(50rpm)下在室温下2小时。
注意:孵育期间不要将样品暴露在光线下,以免光漂白。
- 在搅拌(50rpm)下用PBS洗涤标记的肌肉束3次5分钟,并将它们放在带有安装介质的载玻片上。
注意:每张载玻片最多放置 4 到 5 个肌肉束以允许密封。 - 在顶部添加#1.5级(或#1.5H)玻璃盖玻片(0.17毫米厚),并在载玻片的两侧放置圆柱形磁铁以施加压力并使肌肉变平。
- 保持载玻片免受 4°C 光照 O/N 的影响。 用指甲油永久密封载玻片。
3. 图像采集
- 通过共聚焦显微镜采集
注意:使用倒置激光扫描共聚焦显微镜使用63倍星等油浸物镜(HCX Plan Apo CS,1.4数值孔径(NA))收集图像。- 对于盲法分析,让未参与分析的人员使用给定编号对每张幻灯片进行编码。对实验组保持盲法,直到所有样品的NMJ参数定量完成。
- 在 machine.xlhw >配置模式下启动显微镜软件(补充图 1)。
- 将载玻片放在显微镜载物台上,并使用DAPI滤光片组在DAPI宽场荧光照明下观察样品中的观察平面。
- 单击" 打开项目">"新建项目 "并创建一个文件夹来存储图像采集(补充图 1)。
注意:为每个 NMJ 创建一个新项目,以限制文件夹大小并防止出现计算机内存问题。 - 要管理采集参数,请单击 采集 选项卡窗口并将共聚焦针孔设置为 1.0 Airy 单位和激光功率,以优化绿色/F488 (α-BTX) 荧光的增益和偏移水平,在必须成像的端板上使用 488 nm 激光(实时模式打开)。
- 接下来,使用适用于F594观察的激光优化红色/ F594(NF-M或SV2)荧光采集。在这项研究中,使用了 552 nm 激光器(实时模式 ON)。为每个激光器设置具有以下范围的染料发射光谱:从 414 到 483 nm 的激光 405 (DAPI),从 506-531 nm 的激光 488 (F488-α-BTX),从 622-650 nm 的激光 552 (NF-M/SV2)。
- 使用相同的设置收集每个实验组中神经肌肉接头的图像堆栈:图像大小 1024 x 1024 像素 (73.7 x 73.7 μm),采样率为 400 Hz,双向 X ON,变焦系数 2.5,Z 宽模式下的 Z 步长尺寸 0.5 μm。
注意:对于每个NMJ,将片数设置为获取整个结点。上述采集设置满足奈奎斯特-香农采样定理。但是,用户可以单击所有最新的共聚焦操作软件上的" 优化格式 "按钮,以确保像素大小和Z步长满足理想的奈奎斯特采样率。此操作将避免图像采样过多或采样不足,这将导致体积测量精度下降。 - 将原始文件 (.lif) 或 Z 堆栈图像 (.tif) 保存在名称包含载玻片代号、染色类型和端板编号的文件夹中。
注意:使用 488 nm 和 552 nm 激光器(F488 和 F594)按顺序(不是同时)收集扫描,以避免 F488 荧光进入 F594 通道的串扰,反之亦然(渗漏)。注意:光束路径可以使用显微镜软件中的染料助手进行配置。 - 切换到下一张编码幻灯片,并为每个 NMJ 重复步骤 3.1.3-3.1.8。
- 在会话结束时,单击" 在 3D 查看器中打开 ",然后选择实验组的 NMJ 代表以可视化 3D 标记。
注意:此视图模式将有助于验证采集参数是否正确。 - 关闭显微镜软件,用镜头纸巾清洁物镜,然后关闭系统。
- STED显微镜的收购
注意:使用配备门控STED的倒置激光扫描共聚焦显微镜使用100倍油浸物镜(HC PL APO CS2 1.4 NA)在775 nm处收集图像。- 对于盲法分析,让未参与分析的人员使用给定编号对每张幻灯片进行编码。对实验组保持盲法,直到所有样品的NMJ参数定量完成。
- 在 machine.xlhw 和 STED ON >配置模式下启动显微镜软件(补充图 2)。
- 单击" 打开项目">"新建项目 "以创建一个文件夹来存储图像采集。
注意:为每张幻灯片生成一个新文件夹,以限制文件夹大小并防止出现计算机内存问题。 - 将载玻片放在显微镜载物台上,并使用488 nm激光在宽场荧光照明下观察它,以找到样品内的观察平面。
- 使用 488 nm 激光搜索用神经丝 M (NF-M) 或 SV2 染色标记的 NMJ,光谱检测范围为 506-531 nm。
- 识别出NMJ后,单击 激活STED 并开始使用635 nm激光器采集包含多个结褶皱的区域的图像(补充图3),光谱检测范围为640-750 nm。
注:在图像采集过程中,请小心饱和度查找表,然后单击 快速LUT 按钮以避免过度曝光(灰度值>255;8位)。 - 以相同的设置收集每个实验组的图像:图像大小2048 x 2048像素(38.75 x 38.75μm),采样率为400 Hz。
注意:耗尽激光 (STED) 功率设置为 65%。 - 使用包含幻灯片代码的文件名保存图像。
注意:可以单击优化的XY格式:设置格式以获得STED成像的最佳采集设置。 - 切换到下一张编码幻灯片并重复步骤 3.2.3-3.2.8。对所有幻灯片重复此过程。
- 在STED显微镜会话结束时,将图像文件传输到另一台计算机并保存原始文件(.LIF) 在外部驱动器或服务器中。
- 关闭显微镜软件,用镜头纸巾清洁物镜,然后关闭系统。
4. 图像分析-共聚焦显微镜
注意:所有图像均使用使用Microsoft Windows 10专业操作系统的计算机处理。
- 启动 ImageJ 和自定义宏以计算突触后 NMJ 终板体积、最大强度投影 (MIP) 面积和相对曲折度。
- 使用 NIH ImageJ 免费软件23、iGeodesic 插件和自定义宏处理 NMJ 图像堆栈,以获得 NMJ 参数测量值。启动 ImageJ 软件。
注意:最新版本的 ImageJ 是免费提供的,可以24 年下载。为了打开专有文件格式,必须下载生物格式包25 插件26 。如果操作员使用斐济,则此步骤不是必需的,因为插件已安装在软件中。用于计算曲折度的 iGeodesic 插件27 也可在线获得28;验证此插件在将使用的 ImageJ/Fiji 版本中的可用性。定制的宏也可在线获得29. - 将 Macro_NMJ_VOL_Marinelloetal.ijm (定制的 补充编码文件 1)拖放到 ImageJ 窗口中;宏将在第二个窗口中打开。在这个新窗口中,单击宏 >运行宏。
注意:宏可以处理专有文件和 TIFF 文件。文件必须满足以下条件:对于专有文件格式,每个文件仅保存一个交汇点(即图像堆栈),在文件夹中排序;对于 TIFF 图像,文件必须保存在包含子文件夹的文件夹中,每个子文件夹名为 JunctionX (X 对应于一个 NMJ 编号),其中包含给定交汇点 (RGB TIFF) 的图像堆栈(补充图 4)。 - 选择包含必须分析的 交汇点 子文件夹的本机文件夹,然后单击 选择。
- 在名为 "保存文件夹"的新弹出菜单中,选择存储文件夹,然后单击 "选择"。
- 在名为" 图像类型"的新弹出菜单中,选择 Z 堆栈采集的格式。
- 选择与感兴趣的染色相对应的RGB通道,并指示XY像素大小和Z步长(z)。宏将自动执行分析。
注意:如果选择了专有文件格式,宏将直接读取像素大小和 Z 步长 (z)。但是,用户仍然必须指示感兴趣的通道(C1、C2 或 C3)。宏将为保存文件夹中的每个交汇点参数(端板体积、MIP 面积和曲折度)提供数据表 (.csv)。宏还会生成三个 .TIF 文件,对应于 α-BTX 染色 Drawing_MaxprojX.tif、 DrawingJunctionX.tif 和 MIP MaxprojX.tif 的周长。生成这些TIFF文件是为了验证采集的质量,并确保图像处理已正确执行。
突触后NMJ体积(V):宏将从单个NMJ中分离图像,并保持与突触后终板相对应的α-bungarotoxin F488通道。堆栈在堆栈的中间切片上使用Otsu 阈值 30 进行分段。生成的二值图像被放大 1 像素,并且 分析颗粒 功能用于测量每个检测到的对象的端板区域。为了获得突触后NMJ体积,宏将堆栈的所有测量终板区域相加,并将其乘以Z步长值(z)(以μm为单位)。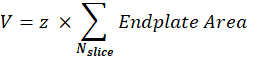
最大强度投影 (MIP) 端板区域:对堆栈进行阈值化后,使用 Z 项目 ImageJ 功能获得最大强度投影 (MIP)。然后使用 分析颗粒 特征来量化 MIP 端板面积。
NMJ MIP 曲折度 (T):NMJ 曲折度反映了突触后运动终板(包括褶皱和穿孔31)的复杂程度,基于每个 MIP 使用以下公式计算,其中 d Obj(AB) 是 A 和 B 沿物体周长的距离,dEuc(AB) 是 A 和 B 之间的欧几里得距离(直线)。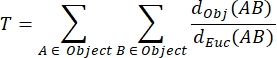
- 将每个实验条件的野生型组中的最高曲折度值设置为 100%,并将实验条件的所有其他值归一化为该值,以获得相对 NMJ 曲折度。
- 使用 NIH ImageJ 免费软件23、iGeodesic 插件和自定义宏处理 NMJ 图像堆栈,以获得 NMJ 参数测量值。启动 ImageJ 软件。
- 启动 ImageJ 和自定义宏以量化突触前神经丝积累和突触囊泡糖蛋白 2 染色。
注意:神经丝积累(此处为NF-M)和/或突触囊泡分布改变(此处为SV2)是轴突转运异常和/或囊泡运输受损的标志物,之前在各种SMA小鼠模型的NMJ中观察到32,33,34。- 将 Macro_NMJ_ACCU_Marinelloetal.ijm(自定义, 补充编码文件 2)拖放到 ImageJ 窗口中;宏将在第二个窗口中打开。在这个新窗口中,单击宏 >运行宏。
注意:宏可以处理专有文件格式和 TIFF 文件。文件必须满足以下步骤 4.1.2 注释中指示的条件。 - 选择包含必须分析的 交汇点 子文件夹的本机文件夹,然后单击 选择。
- 在名为 "保存文件夹"的新弹出菜单中,选择存储文件夹,然后单击 "选择"。
- 在名为" 图像类型"的新弹出菜单中,选择 Z 堆栈采集的格式。
- 在染色 信息 弹出窗口中,指示突触前和突触后标签和颜色,然后单击 确定。例如,突触前标签:SV2 或 NF,突触前颜色:R,突触后标签:BTX,突触后颜色:G。
注意:对于专有文件格式,必须指示标签和相应的通道(C1、C2 或 C3)。 - 在 像素大小 弹出窗口中,指示 XY 像素大小 0.072 μm 和 Z 步长 0.5 μm (z),然后单击 确定。宏将自动执行分析。
注意:此参数对应于共聚焦显微镜采集前选择的图像尺寸1024 x 1024像素(73.7 x 73.7 μm),并且与物镜和变焦设置相关。如果选择了专有文件格式,则宏将直接读取像素大小和 Z 步长 (z)。该宏将在保存文件夹中存储突触前和突触后体积的数据表 (.csv),每个(突触前和突触后)标记的当前检测的多页 TIFF 图像。如上所述,生成这些TIFF文件是为了检查采集的质量并确保正确执行图像处理。
宏观计算来自与 α-BTX-F488 标记共定位的 NF-M-F594 通道的轴突神经丝 M 染色体积(NF 体积)和来自与 α-BTX-F488 标记共定位的 SV2-F594 通道的 NMJ 突触囊泡糖蛋白 2 染色(SV2 体积)。NF-M积累通过计算NF体积与突触后终板(α-BTX)体积之间的比率以及NMJ轴突末端占用率与SV2和α-BTX体积之比来量化,如下所示。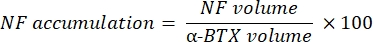
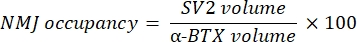
- 将 Macro_NMJ_ACCU_Marinelloetal.ijm(自定义, 补充编码文件 2)拖放到 ImageJ 窗口中;宏将在第二个窗口中打开。在这个新窗口中,单击宏 >运行宏。
5. 图像分析-STED显微镜
注:图像处理是使用STED显微镜制造商的离线软件进行的。
- 启动显微镜软件。
- 通过单击打开 项目 按钮打开项目。选择项目文件 (.lif) 并将其打开。图像与其名称一起显示在屏幕上。
- 在 "处理 "窗口中:单击" 降噪">"中值"。在中间窗口的底部,将 半径 设置为 5.00,将 迭代设置为 1.00,然后取消选中 3D 过滤。
- 然后选择窗口左上角的" 打开项目 "选项卡并选择一个图像。
- 单击 应用以 验证参数。将创建一个名为"nameofimage_median001"的新映像。
注意:可以在应用之前单击预览以监控中值滤光片的效果,这将增强图像对比度并平滑用于量化的线轮廓。 - 按照步骤 5.4-5.5 中的指示将过滤器应用于所有图像。
- 在 "打开 项目"选项卡中,单击软盘驱动器图标以保存所有项目,包括新创建的过滤图像。
注意:下一步将使用名为"nameofimage_median001"的过滤图像完成。 - 计算 AChR 条纹之间的距离
注意:在神经肌肉疾病中经常观察到结后褶皱形态的变化,作为NMJ病理学(不成熟或变性)的征兆。通过α-bungarotoxin染色检测的AChR条纹之间的距离(d)是通过生成强度曲线并通过绘制线轮廓来量化每个最大强度峰之间的距离来计算的(补充图5)。- 使用显微镜软件,选择中央窗口顶部的 "量化 "菜单。
- 单击左上角的 "工具 "选项卡。在左上角面板中选择 强度 ,然后单击 线配置文件 图标。将 过采样 设置为 1,然后勾选排序 通道。
- 单击 "打开项目 "选项卡,然后选择要分析的过滤图像。
注意:可以通过使用计算机鼠标滚动来放大图像。可以使用显示图像旁边的左侧条来修改图像的动态范围,这有助于条纹的可视化。 - 然后,单击右侧窗口顶部菜单中的 "绘制线 "图标,并跟踪垂直穿过几条条纹/交界褶皱的线。
注意:强度曲线显示在中央窗口中。 - 单击第一个峰值的顶部并移动鼠标指针,同时按住鼠标左键,直到达到下一个最大峰值。
注意:信息显示在强度曲线中,而两个峰之间的距离以"dx"面额显示在图表下方。 - 在右侧窗口的图像中单击鼠标右键,然后选择 保存投资回报率。通过单击加载 ROI 打开保存的 ROI(感兴趣区域)。
- 单击右侧窗口左上角的箭头图标,单击ROI并通过单击垃圾箱图标将其删除。
- 根据需要从不同的强度曲线多次重复此操作,以获得预测的AChR条纹距离数,该距离将代表所分析肌肉中的全局值。
注意:可以根据组之间的估计差异、α风险、功效和单尾或双尾检验提前计算最佳 N 值。在目前的实验设计中,应用了单尾曼-惠特尼检验(α风险= 10%;功效= 80%),并且N值估计为每个NMJ至少五个AChR条纹距离,以便比较两组动物。
- AChR 条纹宽度
注意:条纹宽度(w)对应于强度曲线的全宽半最大值(FWHM),即α-BTX信号荧光值为其最大强度的一半之间的距离(补充图5)。- 使用显微镜软件,选择中央窗口中的 量化 菜单。
- 点击 工具 左上角的选项卡。在左上角面板中选择 强度 ,然后单击 确定 FWHM 图标。勾选排序 通道。
注意:为了优化软件的峰值检测, 设置阈值 和 宽度 分别设置为50和3。为每个实验调整这些值,并向经验丰富的成像科学家寻求建议。 - 单击 "打开项目 "选项卡,然后选择要分析的过滤图像。
注意:可以通过使用计算机鼠标滚动来放大右侧窗口中显示的图像。如上所述(注意步骤5.8.3之后的注释),可以修改图像的动态范围以获得最佳条纹可视化。 - 接下来,点击 绘制矩形 右侧窗口顶部菜单中的图标。选择水平或垂直的条带,然后垂直于该条带绘制一个矩形。配置文件将显示在中央窗口中。
- 单击位于左侧面板中的"平均投影"菜单的"垂直"或"水平",具体取决于条纹方向是垂直还是水平。
- 单击中央窗口中的 统计信息 并读取 FWHM 值。
- 用计算机鼠标右键单击右侧窗口中显示的图像,然后选择 保存投资回报率。
注意:通过单击加载投资回报率打开保存的 投资回报率。 - 单击右侧窗口左上角的箭头图标,单击ROI并通过单击垃圾箱图标将其删除。
- 根据需要从不同的矩形ROI多次重复此操作,直到获得预测的AChR条纹宽度数量,这将代表所分析肌肉中的全局值。
6. 实验设计和统计测试
- 使用特定软件执行统计分析。
注意:数据来自N≥3个生物学重复和每个基因型至少20个NMJs用于共聚焦显微镜成像,以及N ≥5个生物重复和N = 5个NMJs用于STED成像,在每个实验组中。通过非配对曼-惠特尼检验(非参数)评估显著性,并在相应的图形图例中指示 p 值。
结果
为了便于以可重复的方式在突触前和突触后水平对神经肌肉接头进行形态学分析,使用显微镜软件和 ImageJ 自定义宏开发了从肌肉收获到成像和定量的工作流程(图 1)。为了举例说明该协议的效用,分别评估了受脊髓性肌萎缩症(SMA)和先天性肌无力综合征(CMS)形式的两种遗传性疾病小鼠 Smn2B / -和 ColQDex2 / Dex2 小鼠中NMJ的形态,并将数据与年龄匹配的对照同窝进行比较。
分别从3周龄和6周龄Smn2B / -(C57Bl / 6背景)和ColQ Dex2 / Dex2(B6D2F1 / J背景)小鼠的胫骨前肌和腓肠肌评估NMJ结构,当这些动物中已经存在疾病迹象时。在3周龄时,Smn2B / -小鼠表现出骨骼肌发育和去神经支配延迟的迹象,例如NMJ萎缩和丢失35,36。CMS小鼠在NMJ中具有原发性病理,并且从出生后的第一周开始体重减轻,并显着出现肌肉无力20(数据未显示)。如图2A所示,用荧光α-邦加毒素标记的突触后运动终板通过共聚焦显微镜在两个小鼠系的突变体中显得更小和/或碎片化。使用这种定制的 ImageJ 宏对 NMJ Z 堆栈进行定量显示,与对照组相比,SMA 和 CMS 小鼠的终板体积、最大强度投影 (MIP) 和相对曲折度显着降低,这是 NMJ 成熟缺陷的迹象32(图 2B-D)。在患病动物中,突触后终板体积和MIP减少(Smn2B / -和ColQ Dex2 / Dex2小鼠的体积倍数变化分别为2.7和2.0,MIP的倍数变化为2.5和2.0)。SMN和ColQ缺陷肌肉的相对曲折度也小于WT(SMA为16.97%±1.33%,5.90%WT小鼠±为48.84%,CMS为13.29%±2.79%,对照组为30.20%,±4.44%对照小鼠为30.20%)。此外,使用ImageJ定制宏对突触前轴突末端分支分布的定量揭示了两种动物模型中神经丝M分布的改变模式,免疫标记增加(84.65%±0.32%对16.57%,±2.03%和23.64%±2.78%±Smn2B / - 和ColQ Dex2 / Dex2小鼠分别为1.73%(图3A-D).通过SV2染色,在Smn2B / -小鼠中也观察到占用率降低43%,即具有相邻神经末梢活动区的含AChR区域的百分比(SMA中为49.36%±3.76%,而2.34%WT小鼠±为85.69%)(图3E,F)。该NMJ参数也在ColQ Dex2 / Dex2突变体的GA中计算,但与对照同窝相比没有发现统计学上的显着差异(数据未显示)。
我们使用超分辨率刺激发射损耗(STED)显微镜量化ColQ缺陷肌肉中连接褶皱之间的距离和位于这些褶皱顶部的AChR条纹宽度,进一步分析了突触后膜特征。如图4所示,通过荧光α-bungarotoxin标记和强度分布分析,可以清楚地看到这些结构的外观。我们评估了这些NMJ参数,发现与野生型小鼠相比,在ColQ Dex2 / Dex2±突变体腓肠肌中AChR条纹的交界褶皱距离(d)和宽度(w)增加(358.3 nm ± 11.97 nm和320.8 nm,距离增加,±10.51 nm和186.3 nm±宽度为7.015 nm, 分别为p < 0.05)(图4C,D)。
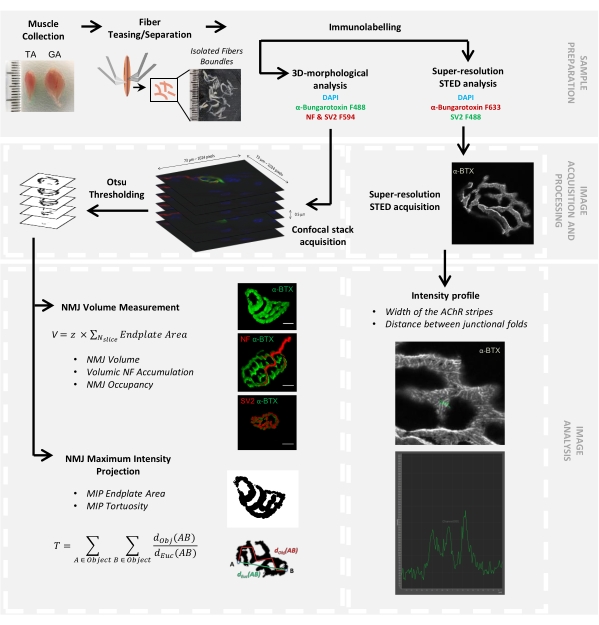
图 1:通过共聚焦和 STED 显微镜进行 3D 多尺度 NMJ 表征的视频协议流程图。 从小鼠中收集胫骨前(TA)和腓肠肌(GA)肌肉,并在用α-bungarotoxin-F488或α-bungarotoxin-F633,DAPI,针对神经丝M(NF-M)和突触囊泡糖蛋白2(SV2)的一抗以及荧光团(F488或F594)偶联的二抗标记之前挑逗肌肉纤维。通过共聚焦显微镜获取图像堆栈并进行处理以测量突触后NMJ体积,突触前NF-M积累,NMJ轴突末端占据,突触后最大强度投影(MIP)终板面积和曲折度(d Obj(AB)是A和B沿物体周长(红线)的距离,而dEuc(AB) 是 A 和 B 之间的欧几里得距离(绿线))。对于STED显微镜分析,从α-BTX-F633染色的强度曲线中量化乙酰胆碱受体(AChR)条纹的宽度和连接褶皱之间的距离。请点击此处查看此图的大图。
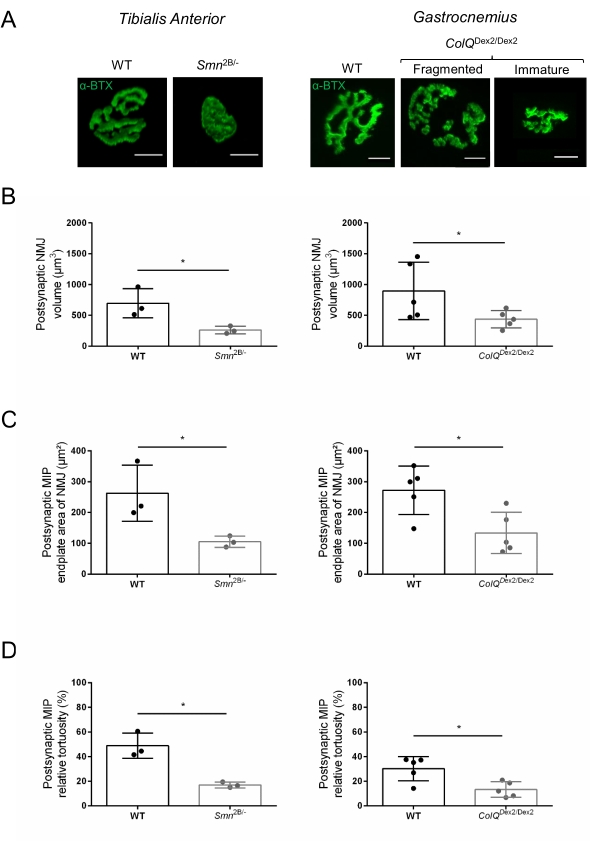
图 2:脊髓性肌萎缩症 (SMA) 和 ColQ 相关先天性肌无力综合征 (CMS) 小鼠模型中的多参数突触后 NMJ 表征。 (A)来自TA和GA肌肉的突触后运动终板的代表性图像,用α-bungarotoxin-F488(α-BTX)标记。(B) 3 周龄野生型 (WT) 和 Smn2B/- 小鼠 TA 中 NMJ 突触后终板体积的定量,(C) 最大强度投影 (MIP) 面积和 (D) TA 中的相对曲折度(左图,每个基因型 N = 3 只动物,分别为 n = 37 和 n = 56 NMJ)和 6 周龄 WT 和 ColQ Dex2/Dex2 小鼠(右图,每个基因型N = 5只小鼠,分别为n = 89和n = 97 NMJ)。数据表示为每只小鼠(点)±SEM的平均值。 采用曼-惠特尼检验(* p < 0.05)分析组间差异。比例尺为 10 μm。 请点击此处查看此图的大图。
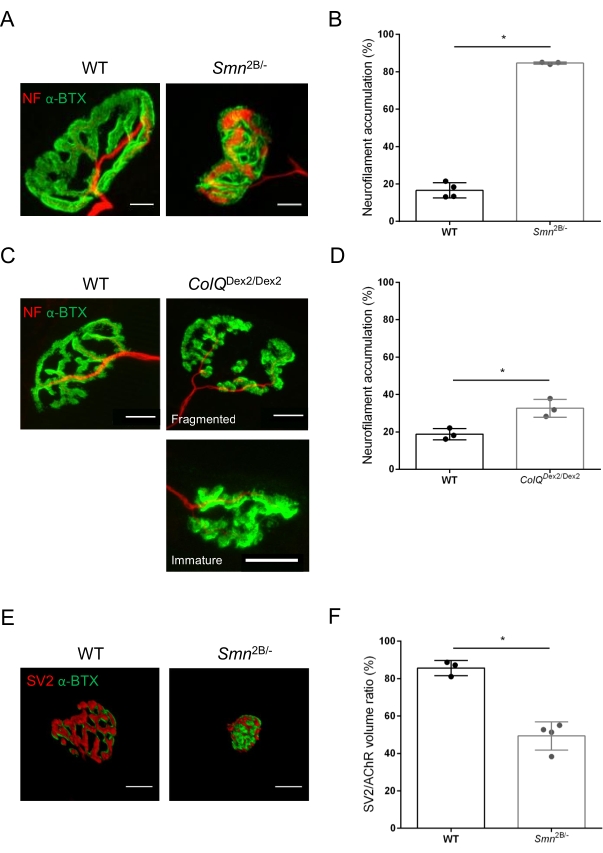
图3:WT和突变小鼠肌肉中突触前轴突末端分布的形态学分析。野生型、SMA 和 ColQ 相关 CMS 小鼠的胫骨前 (TA) 和腓肠肌 (GA) 肌肉中的 NMJ 神经支配模式。(一、二)来自WT和Smn2B / -小鼠TA的代表性神经肌肉接头在21日龄时标记了抗神经丝M(NF-M,红色)和α-bungarotoxin-F488(α-BTX,绿色)的抗体(A),以及神经丝积累的定量分析结果(B);(中、丁)来自 6 周龄 WT 和 ColQ Dex2/Dex2 小鼠的 GA 的代表性神经肌肉接头,标记有抗神经丝 M(NF-M,红色)和 α-bungarotoxin-F488 (α-BTX,绿色)抗体,显示突触后终板碎片化和未成熟 (C),以及两组动物中神经丝积累的结果 (D)。N = 4 (n = 34 NMJ) (B) 和 N = 3 (n = 54 NMJ) (D) WT 动物和 N = 3 (n = 36 NMJ) Smn2B/- 和 N = 3 (n = 55 NMJ) ColQ Dex2/Dex2 小鼠在实验中进行分析 (B, D)。(东、女)来自 3 周龄 WT 和 Smn2B/- 小鼠的 3 周龄 WT 和 Smn 2B/- 小鼠的 NMJ 轴突末端占据的代表性图像,这些小鼠标记有针对突触囊泡糖蛋白 2(SV2,红色)和 α-bungarotoxin-F488 (α-BTX,绿色) (E) 和 NMJ 占用结果(SV2/AChR 体积比)(F)。分析来自N = 3(n = 50 NMJ)野生型和N = 4(n = 62 NMJ)Smn2B / -小鼠的肌肉。数据表示为每只小鼠(点)±SEM的平均值。 采用曼-惠特尼检验分析组间差异(* p < 0.05)。比例尺为 20 μm。 请点击此处查看此图的大图。
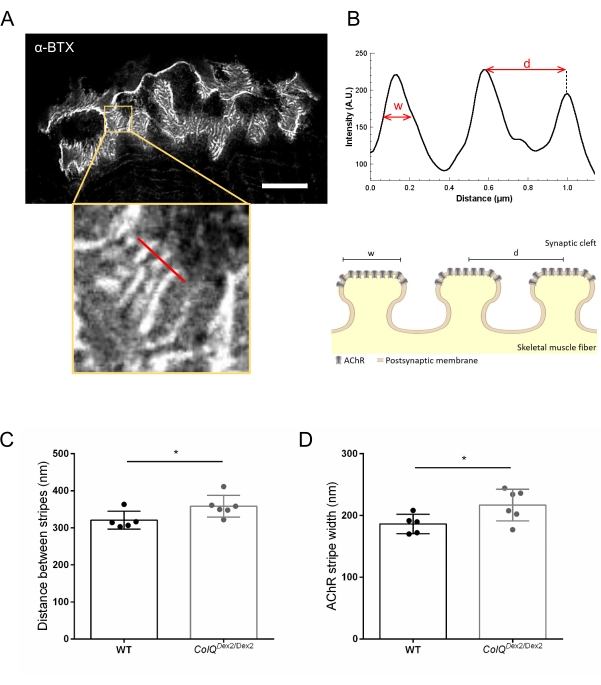
图 4:NMJ 突触后终板的 STED 成像。 (A) 来自 6 周龄野生型小鼠腓肠肌的 α-bungarotoxin-F633 (α-BTX) 标记的 NMJ 的代表性 STED 图像,显示结后 AChR 条纹(比例尺为 5 μm)。(B) 具有AChR条纹的区域(底图)的更高放大倍率,用于生成强度分布。量化了AChR条纹的宽度(w)和该区域的两个相邻条纹(d)之间的距离,并在条形图中表示。突触后终板的示意图,以说明AChR条纹宽度(w)和距离(d)。这些参数,(C)AChR条纹距离和(D)宽度,在6周龄时在ColQ Dex2 / Dex2小鼠和对照同窝小鼠中测量。盲目分析来自5 WT(总n = 29 NMJ)和6只ColQ Dex2 / Dex2(总共n = 43 NMJ)动物的NMJ。数据表示为每只小鼠(点)±SEM的平均值。 使用曼-惠特尼检验分析组间统计学差异(* p < 0.05)。请点击此处查看此图的大图。
补充图 1:推出用于共聚焦采集的 LAS X 软件和参数。 获取共聚焦图像的各个步骤在协议的第3.1.2至3.1.7节中描述。对于每个NMJ堆栈采集,打开一个项目(步骤3.1.4),并选择图像大小,采集速度,X,Y和Z轴的参数(步骤3.1.7),并指示每个顺序扫描(Seq.1,DAPI的激光405;Seq.2, 激光 488 用于 α-BTX-F488;和Seq.3,用于F594偶联二抗的激光552)。 请点击此处下载此文件。
补充图 2:推出 LAS X 软件和 STED 采集参数。 获取 STED 映像的步骤在协议的第 3.2.2 至 3.2.8 节中描述。显微镜以配置模式STED ON(步骤3.2.2)启动,并打开一个项目(步骤3.2.3)。指示图像采集参数(步骤3.2.7)(图像尺寸,采集速度,变焦系数,X轴),以及每次连续扫描(α-BTX-F633的Seq.1;F488偶联二抗的Seq.2)。 请点击此处下载此文件。
补充图3:通过STED显微镜获得的α-BTX染色的交界褶皱图像。 用 α-BTX-F633 标记的突触后终板的图像示例,该终板来自 6 周龄野生型小鼠,这些小鼠以正确(左)或不正确的焦点(右)获得。 请点击此处下载此文件。
补充图 4:用于描述自定义 ImageJ 宏获取的输入和输出数据的 Windows 弹出窗口。 NMJ 图像的输入数据示例(.tif 和 .lif 文件)显示在左栏中。宏(右列)的输出数据保存在文件夹(Save_Volume、Save_Accu)中,这些文件夹包含交汇点的图像(.tif)和包含结果的数据表(.csv文件)。 请点击此处下载此文件。
补充图 5:使用 LAS X 软件进行 STED 采集的 AChR 条带距离和宽度分析。 分析NMJ STED图像的步骤在协议的第5节中描述。 A)包含AChR条纹的标记突触后终板区域的图像。通过绘制垂直线(绿线,表示条纹距离)或垂直矩形(紫色矩形,表示条纹宽度)来选择条纹分析的感兴趣区域。(乙、 丙)显示了所选区域的强度分布和测量值,以计算AChR条纹(B)和AChR条纹宽度(C)之间的距离。 请点击此处下载此文件。
补充编码文件 1:Macro_NMJ_VOL_Marinelloetal。 用于提取 NMJ 参数测量值(NMJ 体积、MIP 端板面积和 NMJ 曲折度)的 ImageJ 自定义宏。 请点击此处下载此文件。
补充编码文件 2:Macro_NMJ_ACCU_Marinelloetal。用于提取 NF-M 积累和 SV2 染色的 ImageJ 自定义宏。 请点击此处下载此文件。
讨论
所描述的视频协议提供了一种详细的方法,通过结合共聚焦和STED显微镜来量化神经肌肉接头的3D结构,可用于表征突触前和突触后水平的病理变化。STED显微镜的高分辨率允许对传统共聚焦成像无法识别的纳米结构进行可视化和形态测量分析。该程序使我们能够测量SMA和ColQ相关CMS小鼠的两种阑尾肌( 胫骨前 肌和 腓肠肌)中NMJ的结构改变。
为了通过这种技术获得可靠的结果,正确解剖和挑逗肌肉至关重要,特别注意肌肉周围的筋膜和分离肌肉束的施加力量;否则,神经支配模式可能会被破坏,阻碍适当的突触前NMJ评估。尽管提供了来自TA和GA的NMJ的详细信息,但原则上,该协议可以适用于其他肌肉,包括扁平肌肉,例如横膈膜或 横腹37,它们不需要戏弄步骤。组织固定对于确保高质量的染色也至关重要;因此,建议以适当的体积(肌肉的15-20倍)使用高质量的PFA。此外,固定剂的曝光时间是一个重要步骤,因为过度固定可能会出现伪影,例如收缩和结块,并影响NMJ特征。考虑到样品的大小和多聚甲醛溶液在组织中的渗透率38,建议这种类型的肌肉固定时间为18-24小时。如果计划在组织收获后一周以上进行染色步骤,建议将PFA固定的肌肉保持在4°C补充叠氮化钠的PBS中,以防止细菌增殖。
该协议提出了一种使用α-BTX-F488进行共聚焦和α-BTX-F633进行STED成像的方法。选择这些荧光团以适合所描述的实验设计,但可以根据可用的设备和材料进行修改。例如,当使用STED CW 592 nm激光器进行图像采集和定量时,可以选择α-BTX F488标记。然而,似乎本研究中应用的配置(脉冲激发门控STED,775nm耗尽)表现出比其他方法(例如连续波STED39)更高的性能和更好的分辨率,使其更适合当前的应用。仔细选择激光功率设置也很重要,特别是对于STED(激发和耗尽),因为在饱和的情况下无法测量强度分布的特征,因此NMJ图像中的任何饱和信号都可能危及整个分析。
这种详细的工作流程,包括使用显微镜软件和 ImageJ 宏进行图像采集和分析,旨在通过共聚焦和 STED 显微镜从单个肌肉进行自主 NMJ 形态测量分析。前面描述的NMJ共聚焦分析工作流程,如NMJ-morph2 或NMJ分析仪14,为半自动方法的设计铺平了道路,该方法有助于NMJ的形态学分析和比较研究。NMJ-morph(及其更新版本aNMJ-morph15)是一个免费的基于ImageJ的平台,它使用最大强度投影来测量21个形态特征,NMJ-Analyser使用用Python开发的脚本,从整个3D NMJ结构生成29个相关参数。手动阈值是这两种需要用户分析的方法中图像处理过程中的唯一步骤。该集成协议详细介绍了组织制备、3D 共聚焦图像采集和基于 ImageJ 处理整个骨骼肌的 NMJ 的步骤,并简化了突触后(体积、最大投影面积和曲折度)和突触前(轴突末端占据和神经丝积累)终板的五个重要参数的概述。生物学相关的另一个参数,突触后连接褶皱的AChR组织模式,通过超分辨率STED显微镜(分辨率20-30nm)40在纳米级进行形态学分析。有趣的是,STED成像的组织制备比用于NMJ超微结构研究的其他方法更简单,例如传统的透射电子显微镜(TEM)9,这是一个相当复杂和耗时的过程,需要熟练的机械手才能获得适当肌肉区域的超薄切片。此外,通过使用STED相关软件,可以自动获得来自多个交界处褶皱的定量数据。
该协议用于说明SMN和ColQ缺陷肌肉中先前已知的NMJ缺陷20,36,41,42。通过共聚焦显微镜在两种小鼠模型中发现了共同的变化,例如突触后终板体积,MIP面积和相对曲折度减少,以及神经丝积累增加,而仅在SMA小鼠中观察到一些更具体的发现(NMJ占位降低),作为囊泡运输受损的指标36。最后,通过STED分析在ColQ-KO中检测到AChR条纹距离和宽度的增加,这是突触后连接褶皱中超微结构缺陷的迹象,如TEM20先前观察到的那样。重要的是,该协议可能有助于在发育,维持和各种病理条件下对神经肌肉接头进行更深入的形态学表征。
披露声明
作者声明与这项工作没有利益冲突。
致谢
我们感谢Genethon的"成像和细胞术核心设施"以及组织学服务,这些服务部分得到了法兰西岛地区,埃松总理事会,埃夫里热那极研究,埃夫里瓦尔德埃松大学和法国INSERM的设备资金的支持。我们也感谢Rashmi Kothary博士提供Smn 2B / 2B小鼠系(加拿大渥太华大学)和Eric Krejci博士提供ColQDex2 / +小鼠系(未发表,法国巴黎大学)。我们感谢纪尧姆·科雷在统计分析方面的支持。2H3(由Jessel,T.M.和Dodd,J.开发)和SV2(由Buckley,K.M开发)单克隆抗体是从发育研究杂交瘤库(DSHB)获得的,该库由NIH的NICHD创建,并在爱荷华大学生物学系,爱荷华城,IA 52242维护。这项工作得到了法国反肌病协会(AFM-Telethon),INSERM和Evry Val d'Essonne大学的支持。
材料
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
参考文献
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304 (2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671 (2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677 (2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220 (2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251 (2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128 (2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, 253-261 (2013).
- . GitHUb Available from: https://github.com/Genethon/ImCy (2021)
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -. P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162 (2014).
- Baker, J. R. . Principles of biological microtechnique; a study of fixation and dyeing. , (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421 (2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644 (2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605 (2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。