Method Article
共焦点顕微鏡と超解像顕微鏡の組み合わせによるマウスの神経筋接合部のキャラクタリゼーション
* これらの著者は同等に貢献しました
要約
このプロトコルは、SMAおよびColQ関連のCMSのマウスモデルの病理学的変化を定量化するために使用される共焦点顕微鏡とSTED顕微鏡の組み合わせによる神経筋接合部の形態測定分析の方法を説明しています。
要約
神経筋接合部(NMJ)は、下位運動ニューロンと骨格筋線維の間の高度に特殊化されたシナプスであり、神経系から随意筋への分子の伝達に不可欠な役割を果たし、収縮につながります。それらは、デュシェンヌ型筋ジストロフィー(DMD)、先天性筋無力症候群(CMS)、脊髄性筋萎縮症(SMA)、筋萎縮性側索硬化症(ALS)などの遺伝性神経筋障害を含む多くの人間の病気に罹患しています。したがって、疾患モデルマウスにおける神経筋接合部の形態とその変化を監視することは、病理学的研究および治療アプローチの前臨床評価のための貴重なツールとなります。ここでは、マウスからかわれた筋線維から運動エンドプレートのシナプス前およびシナプス後の部分の3次元(3D)形態を標識および解析する方法について説明する。共焦点イメージングによるNMJの体積、面積、曲がり角、軸索終末の形態/占有率、および超解像誘導放出枯渇(STED)顕微鏡によるシナプス後接合襞とアセチルコリン受容体(AChR)の縞幅間の距離をサンプルを準備して測定する手順を詳しく説明します。これらのNMJパラメータの変化は、SMAおよびCMSの影響を受けた変異マウスにおいて例示される。
概要
神経筋接合部(NMJ)は、運動軸索終末、シナプス周囲シュワン細胞、骨格筋線維部分からなる複雑な構造であり、化学情報の伝達と運動ニューロン活動の低下と筋肉収縮の結合に関与しています。哺乳類では、神経筋接合部の形態は発生中に変化し、成熟後に典型的なプレッツェルのような形状を採用し、種間で形状と複雑さに違いがあり、運動や老化などの生理学的プロセスに応じてある程度の可塑性を示します1,2,3,4 .シナプス後運動終板は、接合襞と呼ばれる膜陥入を形成し、アセチルコリン受容体(AChR)を含む上部がシナプス前末端軸索枝5と密接に接触している。
神経筋接合部の形態学的および機能的変化は、脊髄性筋萎縮症(SMA)および筋萎縮性側索硬化症(ALS)、デュシェンヌ型筋ジストロフィー(DMD)、先天性筋無力症候群(CMS)、重症筋無力症(MG)および中心核ミオパチー(CNM)、および加齢関連サルコペニアなどのいくつかの神経変性疾患の病態生理に寄与します3,6,7,8,9、10、11、12。これらの疾患では、エンドプレートの断片化、シナプス後接合襞サイズの減少、および/または除神経などのNMJ構造変化が観察されます。NMJの病理は、疾患進行中の一次的または初期のイベントであるか、臨床症状に寄与する二次的なイベントとしてより最近現れる可能性があります。いずれにせよ、これらの疾患の動物モデルにおけるNMJの形態をモニタリングすることは、病理学的変化を研究し、潜在的な治療の有効性を評価するための貴重なパラメータを表しています。
神経筋接合部の形態は、通常、共焦点顕微鏡2,13,14,15または電子顕微鏡5,16を使用する技術によって分析され、分解能や技術的困難などの固有の制限があります。最近では、電子顕微鏡による超微細構造解析の代替的または補完的なアプローチとして、シナプス前活性ゾーンやシナプス後膜上のAChR分布など、NMJの特定の領域を視覚化するために超解像顕微鏡法も使用されました16,17,18。
このプロトコルは、蛍光共焦点顕微鏡と誘導放出枯渇(STED)顕微鏡を組み合わせることにより、NMJ形態学的パラメータを評価するための詳細で再現性のある方法を提供することを目的としています。マウス腓腹筋および前脛骨筋の神経支配されたからかい筋線維における体積、面積、相対的屈曲率、AChRストライプ幅、軸索終末分布などのシナプス前およびシナプス後エンドプレートの重要な特徴は、正常および罹患状態の状況で定量化されました。特に、先天性筋無力症候群のモデルとして、SMN1遺伝子の変異によって引き起こされる運動ニューロン変性を伴う神経筋疾患である脊髄性筋萎縮症のSmn2B/-マウスモデル11,19、および不斉アセチルコリンエステラーゼノックアウト(ColQ Dex2/Dex2またはColQ-KO)マウスのコラーゲン様尾部サブユニットにおいて、NMJ欠損が例示されました20。21,22。
プロトコル
マウスの世話と操作は、動物実験に関する国内およびヨーロッパの法律に従って行われ、制度倫理委員会によって承認されました。 Smn2B/- (C57Bl/6Jバックグラウンド)および ColQDex2/Dex2 (B6D2F1/Jバックグラウンド)マウスのそれぞれ3週齢および6週齢の雄および雌を試験に使用した。
1.マウスの安楽死と筋肉の解剖: 前脛骨筋と腓腹筋
- 子宮頸部脱臼による安楽死の前に、ケタミン(87.5 mg / kg)/キシラジン(12.5 mg / kg)混合溶液(0.1 mL / 20 g体重)の腹腔内注射によるマウス麻酔に進みます。.
注:SMAおよびColQ-CMSは性別とは無関係に個体に影響を与えるため、本プロトコルでは雄および雌マウスを使用した。 - 小さな電気シェーバーを使用して後肢の毛を取り除き、70%エタノールで脚を洗い流します。
注意: 解剖手順は筋肉ごとに異なります。 前脛骨筋 (TA)の解剖は手順1.2.1〜1.2.3に従い、 腓腹筋 (GA)(内側および外側部分)の解剖は手順1.2.4〜1.2.6に従います。筋肉をやさしく扱い、解剖中の組織の損傷や押しつぶしや伸張を防ぎます。- マウスを仰臥位に置きます。
- 筋肉を露出させるために、遠位後肢の前外側部分に沿って鋭利な鈍いハサミで5mmの皮膚切開を行います。極薄のハサミを使用して筋膜を取り除きます。
- 極細のハサミと湾曲した細い鉗子を使用して、最初に遠位腱(足の近く)を切り、次に近位腱(膝の近く)を切ります。筋線維や神経への損傷を避けるために、筋肉を慎重に取り扱ってください。
注:筋肉全体を採取するには、近位腱を骨のできるだけ近くに切片化する必要があります。 - マウスを腹臥位に置き、鋭利な鈍いハサミを使用して、遠位後肢後部コンパートメントの上部から足まで皮膚を切開し、皮膚を取り除きます。
- 中程度の鋸歯状の鉗子でアキレス腱をつかみ、極薄のハサミで切断し、GAを周囲の組織から近位挿入まで静かに分離します。
- 近位側では、中鋸歯状の鉗子を大腿二頭筋(BF)とGAの間に形成されたポケットに挿入します。 2つの筋肉を分離して、極細のハサミでGA腱を骨挿入のできるだけ近くで切断します。
- 組織固定のために、各筋肉をリン酸緩衝生理食塩水(Ca2 + Mg 2+を含まないPBS)で希釈した1mLの4%w / vパラホルムアルデヒド(PFA)溶液を含む2mLの微量遠心チューブに入れ、4°Cで18〜24時間保ちます。
注意: パラホルムアルデヒドとホルムアルデヒドは有毒であり、適切な保護具を備えた化学ヒュームフードで取り扱う必要があります。 - 翌日、化学ヒュームフード内で室温(RT)で穏やかに振って、12ウェルプレートのPBSで固定筋肉を3回5分間洗浄します。
注: プロトコルはこの手順で停止し、1 か月以内に続行できます。この場合、0.01%アジ化ナトリウムを添加したPBSを加えてサンプルを4°Cで保存します。 - 2つの細かい鋸歯状の鉗子を使用して、幅約1 mmの小さな繊維束で各筋肉をいじります。
注意: からかい中の組織の損傷を防ぐために、過度の力をかけずに鉗子で筋肉を非常に穏やかに操作することが重要です。- TA筋肉をそのサイズに応じて3つまたは4つの束に解離します。
- GAの場合、筋肉の内側部分と外側部分を分離し、サイズに応じて各部分を4〜5個の束に解離します。
2.免疫染色
- 筋繊維透過処理の進行:PBS中の1%(v/v)Triton X-100を含む24ウェルプレートに筋束を移し、室温で1時間、または4°Cで5時間、穏やかな攪拌(50 rpm)下に保ちます。
注:筋肉束を2つのプレートに分割して、別々の免疫染色を進め、抗体の混乱のリスクを最小限に抑えます。それらを2つ以上のウェル(1ウェル/プレート)に分割しないでください。そうでなければ、分析された筋肉におけるそれらの一般的な状態を表すNMJの数(N)は不十分である可能性がある。 - サンプルをRTでPBSで3回5分間洗浄し、PBS/Triton X-100 1%中の4%ウシ血清アルブミン(BSA)からなるブロッキング溶液で、穏やかな攪拌(50 rpm)下で4°Cで4時間インキュベートします。
注意: 洗浄ステップでは吸引ポンプを使用せず、200 μLのピペットと小型のチップを使用して手動で溶液を吸引してください(参照は 材料の表に示されています)。 - ニューロフィラメントM(NF-M、2H3、希釈1/200)またはシナプス小胞糖タンパク質2(SV2、希釈1/200)のいずれかに対する一次モノクローナル抗体を含むステップ2.2で示されるブロッキング溶液を使用して、サンプルを穏やかな攪拌(50 rpm)で4°Cで一晩(O/N)インキュベートし、シナプス前軸索末端または活性ゾーンをそれぞれ標識します。
- 翌日、筋肉束を攪拌(50 rpm)しながらPBSで5分間3回洗浄します。
- 共焦点イメージングの場合:赤色発光蛍光色素(F594)(希釈率1/500)を結合させた二次抗マウス抗体と、緑色発光蛍光色素(α-BTX-F488)を結合させたα-ブンガロトキシン(希釈率1/1000)をPBS中でRT攪拌(50 rpm)下で2時間インキュベートします。
- STEDイメージングの場合:緑色発光蛍光色素(F488)(希釈率1/500)と結合したα-ブンガロトキシンをPBS中で高い光安定性(α-BTX-F633)(希釈1/1000)と結合させた二次抗マウス抗体を、撹拌下(50 rpm)でRTで2時間インキュベートします。
注意: 光退色を避けるために、インキュベーション中にサンプルを光にさらさないでください。
- ラベルを付けた筋肉束を攪拌(50 rpm)しながらPBSで5分間3回洗浄し、封入剤を入れたスライドに置きます。
注意: シールできるように、スライドごとに最大4〜5個の筋肉束を配置します。 - 上部にグレード#1.5(または#1.5H)のガラスカバースリップ(厚さ0.17 mm)を追加し、スライドの両側に円筒形の磁石を置いて圧力をかけ、筋肉を平らにします。
- スライドを4°Cの軽いO / Nから保護してください。 スライドをマニキュアで永久に密封します。
3. 画像取得
- 共焦点顕微鏡による取得
注:画像は、63倍の大きさの油浸対物レンズ(HCX Plan Apo CS、1.4開口数(NA))を使用して、倒立レーザー走査型共焦点顕微鏡で収集されました。- 盲検分析の場合は、分析に関与していない人に、指定された番号の各スライドをコーディングさせます。すべてのサンプルについてNMJパラメータの定量が完了するまで、実験群を盲検のままにします。
- 顕微鏡ソフトウェアをmachine.xlhw>コンフィギュレーションモードで起動します(補足図1)。
- スライドを顕微鏡ステージに置き、DAPIフィルターセットを使用してDAPI広視野蛍光照明の下を見て、サンプル内の観察面を見つけます。
- [ プロジェクトを開く] > [新しいプロジェクト] をクリックし、画像取得を保存するフォルダーを作成します (補足図 1)。
注: NMJごとに新しいプロジェクトを作成して、フォルダサイズを制限し、コンピュータのメモリの問題を防ぎます。 - 取得パラメータを管理するには、[ 取得 ]タブウィンドウをクリックし、共焦点ピンホールを1.0エアリーユニットとレーザー出力に設定して、イメージングする必要があるエンドプレートで488 nmレーザーを使用して、緑色/F488(α-BTX)蛍光のゲインとオフセットレベルを最適化します(ライブモードオン)。
- 次に、F594観察に適合したレーザーを使用して、赤色/F594(NF-MまたはSV2)蛍光取得を最適化します。この研究では、552 nmレーザーを使用しました(ライブモード オン)。各レーザーに次の範囲で色素発光のスペクトルを設定します:414〜483 nmのレーザー405(DAPI)、506〜531 nmのレーザー488(F488-α-BTX)、および622〜650 nmのレーザー552(NF-M / SV2)。
- 400 Hzサンプリングレートで画像サイズ1024 x 1024ピクセル(73.7 x 73.7 μm)、双方向X ON、ズーム係数2.5、ZワイドモードでZステップサイズ0.5 μmの画像サイズを同じ設定で各実験グループの神経筋接合部の画像スタックを収集します。
注: NMJごとに、スライスの数が設定され、ジャンクション全体が集録されます。上記の取得設定は、ナイキスト・シャノンサンプリング定理を満たします。ただし、最近のすべての共焦点オペレーティング・ソフトウェアにある 「フォーマットの最適化 」ボタンをクリックして、ピクセル・サイズとZステップが理想的なナイキスト・サンプリング・レートを満たすようにすることができます。このアクションにより、体積測定の精度が低下する原因となる画像のオーバーサンプリングまたはアンダーサンプリングを回避できます。 - 元のファイル(.lif)またはZスタック画像(.tif)を、スライドのコード名、染色タイプ、エンドプレート番号を含む名前のフォルダーに保存します。
注意: 488 nmおよび552 nmレーザー(F488およびF594)を使用してスキャンを順番に(同時にではなく)収集して、F488蛍光がF594チャネルに、またはその逆(ブリードスルー)のクロストークを回避します。注意:ビームパスは、顕微鏡ソフトウェアのDyeアシスタントを使用して構成できます。 - 次のコード化されたスライドに変更し、NMJごとに手順3.1.3-3.1.8を繰り返します。
- セッションの最後に、 3Dビューアで開く をクリックし、実験グループのNMJ代表を選択して3Dラベリングを視覚化します。
注:この表示モードは、取得パラメータが正しいことを確認するのに役立ちます。 - 顕微鏡ソフトウェアを閉じ、レンズティッシュで対物レンズを洗浄してから、システムの電源を切ります。
- STED顕微鏡による取得
注:画像は、100倍の油浸対物レンズ(HC PL APO CS2 1.4 NA)を使用して、775 nmのゲート付きSTEDを備えた倒立レーザー走査型共焦点顕微鏡で収集されました。- 盲検分析の場合は、分析に関与していない人に、指定された番号の各スライドをコーディングさせます。すべてのサンプルについてNMJパラメータの定量が完了するまで、実験群を盲検のままにします。
- 顕微鏡ソフトウェアを コンフィギュレーションモードで起動し> machine.xlhw とSTED をオンにします (補足図2)。
- [ プロジェクトを開く] > [新しいプロジェクト ] をクリックして、画像取り込みを保存するフォルダーを作成します。
注: スライドごとに新しいフォルダを生成して、フォルダのサイズを制限し、コンピュータのメモリの問題を防止します。 - スライドを顕微鏡ステージに置き、488 nmレーザーを使用して広視野蛍光照明下で観察し、サンプル内の観察面を見つけます。
- 506-531 nmのスペクトル検出を備えた488 nmレーザーを使用して、ニューロフィラメントM(NF-M)またはSV2染色で標識されたNMJを検索します。
- NMJが特定されたら、[ STEDのアクティブ化 ]をクリックし、640〜750 nmのスペクトル検出を備えた635 nmレーザーを使用して、いくつかの接合部の折り目を含む領域で画像の取得を開始します(補足図3)。
注意: 画像取得中は彩度ルックアップテーブルに注意し、露出オーバー(グレー値>255、8ビットの場合)を避けるために[ クイックLUT ]ボタンをクリックしてください。 - 400 Hzのサンプリングレートで画像サイズ2048 x 2048ピクセル(38.75 x 38.75 μm)の同じ設定で各実験グループの画像を収集します。
注意: 空乏レーザー(STED)出力は65%に設定されています。 - スライドのコードを含むファイル名で画像を保存します。
注意: クリックすることができます 最適化されたXYフォーマット:フォーマットを設定する STED イメージングで最適な取得設定を取得します。 - 次のコード化されたスライドに変更し、手順 3.2.3-3.2.8 を繰り返します。すべてのスライドに対してこの手順を繰り返します。
- STED 顕微鏡セッションの最後に、画像ファイルを別のコンピューターに転送し、元のファイル (.lif) を外部ドライブまたはサーバーに保存します。
- 顕微鏡ソフトウェアの電源を切り、レンズティッシュで対物レンズを清掃してから、システムの電源を切ります。
4.画像分析-共焦点顕微鏡
注:すべての画像は、Microsoft Windows 10プロフェッショナルオペレーティングシステムを使用するコンピューターで処理されました。
- ImageJとカスタムマクロを起動して、シナプス後NMJエンドプレートボリューム、最大強度投影(MIP)領域、および相対的な曲がりを計算します。
- NIH ImageJフリーウェア23、iGeodesicプラグイン、およびカスタムマクロを使用してNMJ画像スタックを処理し、NMJパラメータ測定値を取得します。ImageJソフトウェアを起動します。
注:ImageJの最新バージョンは無料で入手でき、ダウンロードできます24。独自のファイル形式を開くには、Bio-Formatsパッケージ25 プラグインをダウンロードする必要があります26 。プラグインはすでにソフトウェアにインストールされているため、オペレーターがフィジーを使用する場合、この手順は必要ありません。曲がりくねりを計算するためのiGeodesicプラグイン27 は、オンラインでも利用できます28;使用されるImageJ/Fijiバージョンでこのプラグインが使用可能であることを確認してください。カスタムメイドのマクロはオンラインでも入手できます29。 - Macro_NMJ_VOL_Marinelloetal.ijm (カスタムメイド、補足コーディングファイル1) を ImageJ ウィンドウにドラッグアンドドロップします。マクロは 2 番目のウィンドウで開きます。この新しいウィンドウで、[マクロ]をクリックして[マクロを実行]>をクリックします。
注 : マクロは、専有ファイルと TIFF ファイルの両方を処理できます。ファイルは次の基準を満たす必要があります:独自のファイル形式の場合、ファイルごとに1つのジャンクション(つまり、画像のスタック)のみをフォルダーに保存します。TIFF イメージの場合、ファイルは、特定のジャンクション (RGB TIFF) のイメージ スタックと共に 、それぞれ JunctionX (X は NMJ 番号に対応) という名前のサブフォルダーを含むフォルダーに保存する必要があります (補足図 4)。 - 分析する必要がある Junction サブフォルダーを含むネイティブ フォルダーを選択し、[ 選択] をクリックします。
- [フォルダの保存]という新しいポップアップメニューで、ストレージフォルダを選択し、[選択]をクリックします。
- 「 画像タイプ」という新しいポップアップメニューで、Z スタック取り込みのフォーマットを選択します。
- 目的の染色に対応するRGBチャンネルを選択し、XYピクセルサイズとZステップ(z)を示します。マクロは自動的に分析を実行します。
注: 独自のファイル形式が選択されている場合、マクロはピクセル サイズと Z ステップ (z) を直接読み取ります。ただし、ユーザーは目的のチャネル (C1、C2、または C3) を指定する必要があります。マクロは、保存フォルダ内の各ジャンクションパラメータ(エンドプレートボリューム、MIP面積、曲がりくねり)のデータシート(.csv)を提供します。このマクロでは、3 つの .TIF ファイルは、α-BTX染色 Drawing_MaxprojX.tif、 DrawingJunctionX.tif、およびMIP MaxprojX.tifの境界に対応します。これらのTIFFファイルは、取得の品質を検証し、画像処理が正しく実行されたことを確認するために生成されます。
シナプス後NMJボリューム(V):マクロは単一のNMJから画像を分離し、シナプス後エンドプレートに対応するα-ブンガロトキシンF488チャネルを維持します。スタックは、スタックの中間スライスで Otsu しきい値30 を使用してセグメント化されます。結果のバイナリ画像は1ピクセル拡張され、 パーティクルの分析 機能を使用して、検出された各オブジェクトのエンドプレート領域を測定します。シナプス後NMJ体積を得るために、マクロはスタックのすべての測定された終板領域を合計し、それにμm単位のZステップ値(z)を掛けます。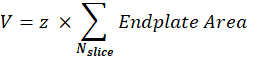
最大強度投影 (MIP) エンドプレート領域: スタックがしきい値に達した後、 Z プロジェクト ImageJ 機能を使用して最大強度投影 (MIP) が取得されます。次に、 パーティクルの解析 機能を使用して、MIPエンドプレート面積を定量化します。
NMJ MIPの曲がり(T):折り目と穿孔31を含むシナプス後運動終板の複雑さの程度を反映するNMJの曲がりは、次の式を使用して各MIPに基づいて計算されます。 ここで、d Obj(AB)は物体の周囲に沿ったAとBの間の距離、dEuc(AB)はAとBの間のユークリッド距離(直線)。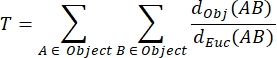
- 各実験条件の野生型群における最も高い屈曲値を100%とし、相対NMJ据曲度を得るために、実験条件の他のすべての値をこの値に正規化する。
- NIH ImageJフリーウェア23、iGeodesicプラグイン、およびカスタムマクロを使用してNMJ画像スタックを処理し、NMJパラメータ測定値を取得します。ImageJソフトウェアを起動します。
- ImageJとカスタムマクロを起動して、シナプス前ニューロフィラメントの蓄積とシナプス小胞糖タンパク質2染色を定量します。
注:ニューロフィラメントの蓄積(ここではNF-M)および/またはシナプス小胞の分布の変化(ここではSV2)は、異常な軸索輸送および/または小胞輸送障害のマーカーであり、さまざまなSMAマウスモデルのNMJで以前に観察されました32,33,34。- Macro_NMJ_ACCU_Marinelloetal.ijm (カスタムメイド、補足コーディングファイル2) を ImageJ ウィンドウにドラッグアンドドロップします。マクロが 2 番目のウィンドウで開きます。この新しいウィンドウで、[マクロ]をクリックして[マクロを実行]>をクリックします。
注 : このマクロは、独自のファイル形式と TIFF ファイルの両方を処理できます。ファイルは、以下の手順4.1.2のNOTEに示されている基準を満たしている必要があります。 - 分析する必要がある Junction サブフォルダーを含むネイティブ フォルダーを選択し、[ 選択] をクリックします。
- [フォルダの保存]という新しいポップアップメニューで、ストレージフォルダを選択し、[選択]をクリックします。
- 「 画像タイプ」という新しいポップアップメニューで、Z スタック取り込みのフォーマットを選択します。
- 染色情報ポップアップで、シナプス前およびシナプス後のラベルと色を指定し、[OK]をクリックします。たとえば、シナプス前ラベル:SV2またはNF、シナプス前色:R、シナプス後ラベル:BTX、シナプス後色:G。
注:独自のファイル形式の場合、ラベルと対応するチャネル(C1、C2、またはC3)を示す必要があります。 - [ピクセル サイズ] ポップアップで、XY ピクセル サイズ 0.072 μm と Z ステップ 0.5 μm (z) を指定し、[ OK] をクリックします。マクロは自動的に分析を実行します。
注:このパラメータは、共焦点顕微鏡の取得前に選択された画像サイズ1024 x 1024ピクセル(73.7 x 73.7 μm)に対応し、対物レンズとズーム設定に関連付けられています。独自のファイル形式が選択されている場合、マクロはピクセル サイズと Z ステップ (z) を直接読み取ります。マクロは、保存フォルダーに、シナプス前およびシナプス後ボリュームのデータシート(.csv)を、各(シナプス前およびシナプス後)ラベルの現在の検出の複数ページのTIFF画像に保存します。上記のように、これらのTIFFファイルは、取得の品質をチェックし、画像処理が正しく実行されたことを確認するために生成されます。
このマクロは、α-ブンガロトキシン-F488標識と共局在するNF-M-F594チャネルからの軸索ニューロフィラメントM染色の体積(NF体積)と、α-BTX-F488標識と共局在するSV2-F594チャネルからのNMJシナプス小胞糖タンパク質2染色の体積(SV2体積)を計算します。NF-M蓄積は、以下に示すように、NF体積とシナプス後終板(α-BTX)体積の比率、およびNMJ軸索終末占有率をSV2とα-BTX体積の比率で計算することによって定量化されます。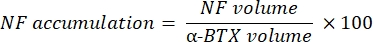
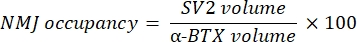
- Macro_NMJ_ACCU_Marinelloetal.ijm (カスタムメイド、補足コーディングファイル2) を ImageJ ウィンドウにドラッグアンドドロップします。マクロが 2 番目のウィンドウで開きます。この新しいウィンドウで、[マクロ]をクリックして[マクロを実行]>をクリックします。
5.画像分析-STED顕微鏡
注:画像処理は、STED顕微鏡メーカーのオフラインソフトウェアで実行しました。
- 顕微鏡ソフトウェアを起動します。
- [ プロジェクトを開く ] ボタンをクリックしてプロジェクトを開きます。プロジェクト ファイル (.lif) を選択して開きます。画像は名前とともに画面に表示されます。
- プロセスウィンドウで:ノイズリダクション>中央値をクリックします。中央のウィンドウの下部で、[半径]を[5.00]、[反復]を[1.00]に設定し、[3Dフィルタリング]のチェックを外します。
- 次に、ウィンドウの左上にある[ プロジェクトを開く ]タブを選択し、画像を選択します。
- [ 適用 ] をクリックして、パラメーターを検証します。"nameofimage_median001" という新しいイメージが作成されます。
注:適用する前に[プレビュー]をクリックしてメディアンフィルターの効果を監視すると、画像のコントラストが向上し、定量に使用されるラインプロファイルが滑らかになります。 - 手順5.4〜5.5に示すように、すべての画像にフィルターを適用します。
- [ プロジェクトを開く ]タブで、フロッピードライブアイコンをクリックして、新しく作成されたフィルタリングされたイメージを含むすべてのプロジェクトを保存します。
注:次の手順は、「nameofimage_median001」という名前のフィルタリングされた画像を使用して実行されます。 - AChRストライプ間の距離を計算する
注:接合後襞の形態の変化は、NMJ病理(未熟または変性)の兆候として神経筋障害でしばしば観察されます。α-ブンガロトキシン染色によって検出されるAChRストライプ間の距離(d)は、強度プロファイルを生成し、ラインプロファイルを描画して各最大強度ピーク間の距離を定量化することによって計算されます(補足図5)。- 顕微鏡ソフトウェアを使用して、中央ウィンドウの上部にある [定量] メニューを選択します。
- 左上の[ ツール ]タブをクリックします。左上のパネルで [強度 ]を選択し、[ ラインプロファイル ]アイコンをクリックします。 [オーバーサンプリング ] を 1 に設定し、[ チャンネルの並べ替え] にチェックマークを付けます。
- [ プロジェクトを開く ]タブをクリックし、分析するフィルタリングされた画像を選択します。
注意: コンピュータのマウスでスクロールすると、画像を拡大することができます。画像のダイナミックレンジは、表示された画像の横の左側のバーを使用して変更でき、ストライプの視覚化を容易にします。 - 次に、右側のウィンドウのトップメニューにある [線の描画 ]アイコンをクリックして、いくつかのストライプ/ジャンクションフォールドを垂直に交差する線をトレースします。
注意: 強度プロファイルは中央のウィンドウに表示されます。 - 最初のピークの上部をクリックし、次の最大ピークに達するまでマウスの左ボタンを押したままマウスポインタを移動します。
注:情報は強度プロファイルに表示され、2つのピーク間の距離はチャートの下に「dx」金種で表示されます。 - 右側のウィンドウの画像を表示しているときにマウスを右クリックし、[ ROIの保存]を選択します。保存したROI(関心領域)を開くには、[ ROIの読み込み]をクリックします。
- 右ウィンドウの左上にある矢印アイコンをクリックし、ROIをクリックして、ビンアイコンをクリックして削除します。
- 異なる強度プロファイルからこの操作を必要な回数だけ繰り返して、分析された筋肉のグローバル値を表すAChRストライプ距離の予測数を取得します。
注:最適なN値は、グループ間の推定差、αリスク、検出力、および片側検定または両側検定に基づいて事前に計算できます。現在の実験計画では、片側マン・ホイットニー検定(αリスク= 10%、検出力= 80%)を適用し、N値は、2つの動物群を比較するために、NMJあたり少なくとも5つのAChRストライプ距離であると推定されました。
- AChR ストライプ幅
注:ストライプ幅(w)は、強度プロファイルの全幅半値(FWHM)に対応し、α-BTXシグナル蛍光値が最大強度の半分になるポイント間の距離です(補足図5)。- 顕微鏡ソフトウェアを使用して、中央のウィンドウにある 定量 メニューを選択します。
- 左上の[ ツール ]タブをクリックします。左上のパネルで[ 強度 ]を選択し、[ FWHMの決定 ]アイコンをクリックします。[ チャンネルを並べ替える] にチェックマークを付けます。
注意: ソフトウェアによるピーク検出を最適化するために、 設定しきい値 と 幅 はそれぞれ50と3に設定されました。これらの値を実験ごとに調整し、経験豊富なイメージング科学者にアドバイスを求めてください。 - [ プロジェクトを開く ]タブをクリックし、分析するフィルタリングされた画像を選択します。
注意: コンピュータのマウスでスクロールすることで、右側のウィンドウに表示されている画像を拡大することができます。上記のように(ステップ5.8.3の後の注記)、最適なストライプの視覚化のために画像のダイナミックレンジを変更できます。 - 次に、右側のウィンドウのトップメニューにある [長方形の描画 ]アイコンをクリックします。水平または垂直のストライプを選択し、ストライプに対して垂直に長方形を描画します。中央のウィンドウにプロファイルが表示されます。
- 左側のパネルにある平均投影メニューの[垂直]または[水平]のいずれかをクリックし、ストライプの向きが垂直か水平かによって異なります。
- 中央のウィンドウで [統計 ]をクリックし、FWHM値を読み取ります。
- 右側のウィンドウに表示されている画像をコンピューターのマウスで右クリックし、[ ROIの保存]を選択します。
注: [ROI のロード] をクリックして、保存した ROI を開きます。 - 右ウィンドウの左上にある矢印アイコンをクリックし、ROIをクリックして、ビンアイコンをクリックして削除します。
- 分析された筋肉のグローバル値を表すAChRストライプ幅の予測数を取得するまで、異なる長方形のROIから必要な回数だけこの操作を繰り返します。
6.実験計画と統計的検定
- 特定のソフトウェアを使用して統計分析を実行します。
注:データは、共焦点顕微鏡イメージングではN≥3の生物学的反復と遺伝子型あたり少なくとも20NMJ、STEDイメージングではN≥5の生物学的反復と遺伝子型あたりN = 5NMJから収集されました。有意性は対応のないマン・ホイットニー検定(ノンパラメトリック)によって評価され、 p値は対応する図の凡例に示されています。
結果
シナプス前およびシナプス後レベルでの神経筋接合部の形態学的解析を再現可能な方法で容易にするために、筋肉の収穫から顕微鏡ソフトウェアとImageJカスタムマクロを使用したイメージングおよび定量化までのワークフローが開発されました(図1)。このプロトコルの有用性を例示するために、脊髄性筋萎縮症(SMA)および先天性筋萎縮症候群(CMS)形態にそれぞれ影響を受けた遺伝性疾患の2つのマウスモデル、Smn2B /-およびColQ Dex2 / Dex2マウスにおけるNMJの形態を評価し、データを年齢を一致させた対照同腹仔と比較した。
NMJ構造は、3週齢および6週齢のSmn2B/-(C57Bl/6バックグラウンド)およびColQ Dex2/Dex2(B6D2F1/Jバックグラウンド)マウスの前脛骨筋および腓腹筋から、これらの動物に疾患の兆候がすでに存在する場合に評価されました。3週齢で、Smn2B /-マウスは、NMJ萎縮や喪失などの骨格筋の発達と除神経の遅延の兆候を示します35,36。CMSマウスは、NMJsにおいて主要な病理を有し、生後1週目からの体重の減少および顕著な筋力低下20を示す(データは示さず)。図2Aに示すように、蛍光α-ブンガロトキシンで標識されたシナプス後運動終板は、共焦点顕微鏡検査によって2つのマウス系統の変異体でより小さく、および/または断片化して見えました。このカスタマイズされたImageJマクロを使用してNMJ Zスタックを定量化すると、NMJ成熟欠陥の兆候として、コントロールと比較して、SMAマウスとCMSマウスの両方でエンドプレート体積、最大強度投影(MIP)、および相対的な曲がりくねりの顕著な減少が明らかになりました32(図2B-D)。シナプス後終板体積とMIPは、罹患動物で減少しました(Smn2B /-およびColQ Dex2 / Dex2マウスでは、体積でそれぞれ2.7および2.0、MIPで2.5および2.0の倍増変化)。相対的な屈曲も、SMNおよびColQ欠損筋ではWTよりも小さかった(SMAで16.97%±1.33%対5.90%WTマウス±48.84%、CMSで13.29%±2.79%対対照マウス±30.20%4.44%)。さらに、ImageJカスタムマクロを使用してシナプス前軸索末端枝の分布を定量化したところ、2つの動物モデルでニューロフィラメントM分布のパターンが変化し、免疫標識が増加していることが明らかになりました(対照と比較して、Smn2B/-マウス±それぞれ2.03%±84.65%0.32%対16.57%、23.64%±2.78%対18.77%±1.73%)(図3A-D).SV2染色により、占有率の43%の減少、すなわち隣接する神経終末活動ゾーンを有するAChR含有領域の割合もSmn2B/-マウスで観察された(SMAで49.36%±3.76%対2.34%WTマウスで85.69%±2.34%)(図3E、F)。このNMJパラメータは、ColQ Dex2/Dex2変異体のGAでも計算されましたが、対照の同腹仔と比較して統計的に有意な差は見られませんでした(データは示されていません)。
さらに、超解像誘導放出枯渇(STED)顕微鏡を用いて、ColQ欠損筋における接合襞間の距離と、その襞の頂部に位置するAChRストライプの幅を定量化することにより、シナプス後膜の特徴を解析しました。図4に示すように、これらの構造の様相は、蛍光α-ブンガロトキシン標識および強度プロファイル解析によって明確に可視化することができる。これらのNMJパラメータを評価し、野生型マウスと比較して、変異体の腓腹筋におけるAChRストライプの接合襞距離(d)と幅(11.97 nm±±320.8 nm、幅10.90 nm±216.9 nm、幅186.3 nm、幅±7.015 nm)の増加を見出した。 それぞれ、p < 0.05)(図4C、D)。
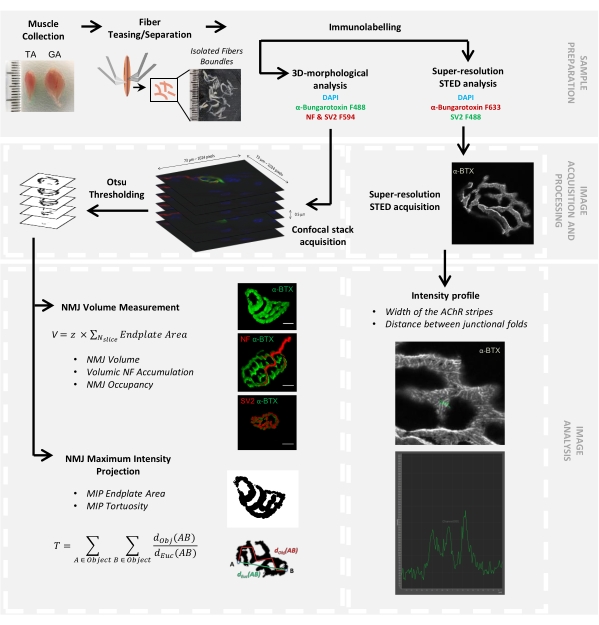
図1:共焦点顕微鏡およびSTED顕微鏡による3DマルチスケールNMJ特性評価のためのビデオプロトコルのフローチャート。 前脛骨筋(TA)および腓腹筋(GA)をマウスから採取し、筋線維をからかってから、α-ブンガロトキシン-F488またはα-ブンガロトキシン-F633、DAPI、ニューロフィラメントM(NF-M)およびシナプス小胞糖タンパク質2(SV2)に対する一次抗体、およびフルオロフォア(F488またはF594)結合二次抗体で標識しました。画像スタックを共焦点顕微鏡で取得し、シナプス後NMJ体積、シナプス前NF-M蓄積、NMJ軸索終末占有率、シナプス後最大強度投影(MIP)エンドプレート面積、および曲がり角を測定するために処理しました(d Obj(AB)は物体の周囲に沿ったAとBの間の距離(赤い線)ですが、dEuc(AB) はAとBの間のユークリッド距離(緑の線)です)。STED顕微鏡分析では、アセチルコリン受容体(AChR)ストライプの幅と接合部のひだ間の距離をα-BTX-F633染色の強度プロファイルから定量化しました。この図の拡大版を表示するには、ここをクリックしてください。
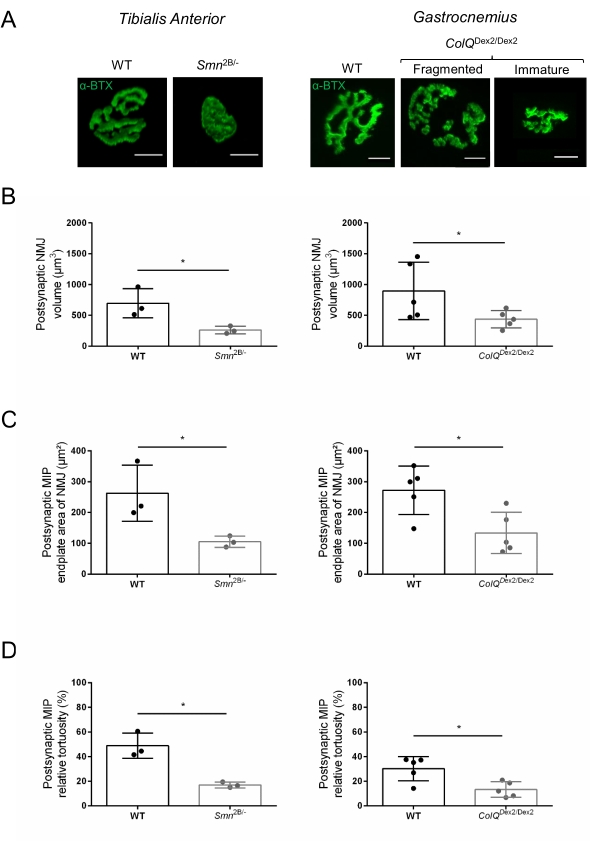
図2:脊髄性筋萎縮症(SMA)およびColQ関連先天性筋萎縮症候群(CMS)のマウスモデルにおけるマルチパラメーターシナプス後NMJの特性評価。 (A)α-ブンガロトキシン-F488(α-BTX)で標識されたTAおよびGA筋のシナプス後運動エンドプレートの代表的な画像。(B)NMJシナプス後終板体積の定量化、(C)最大強度投影(MIP)面積、および(D)3週齢の野生型(WT)およびSmn2B /-マウス(左のグラフ、遺伝子型ごとにN = 3匹の動物、それぞれn = 37およびn = 56 NMJ)および6週齢のWTおよびColQ Dex2 / Dex2のTAにおける相対的な曲がり角マウス(右のグラフ、遺伝子型あたりN=5匹のマウス、それぞれn=89およびn=97NMJ)。データは、SEM±マウス当たりの平均(dot)として表す。 群間の差は、マン・ホイットニー検定により解析した(*p<0.05)。スケールバーは10μmです。 この図の拡大版を表示するには、ここをクリックしてください。
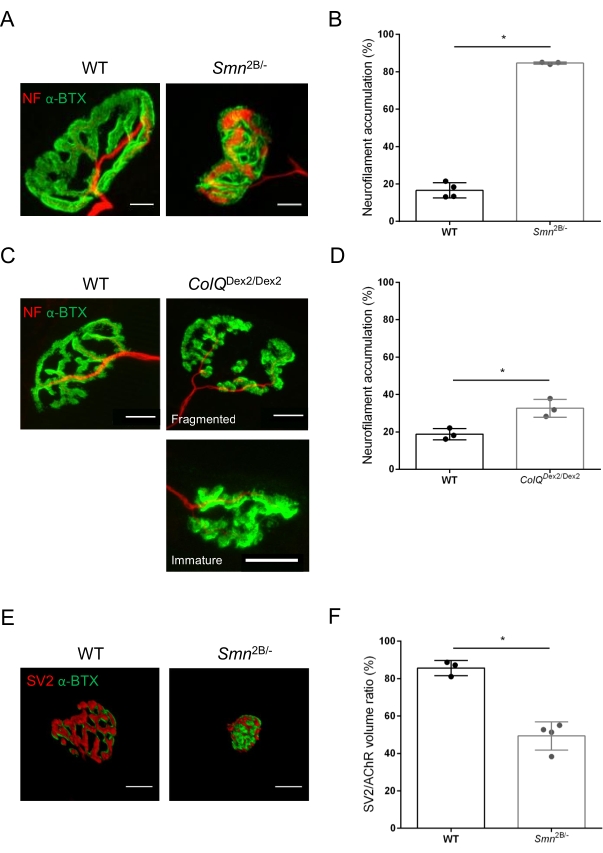
図3:WTおよび変異マウスの筋肉におけるシナプス前軸索終末分布の形態測定解析。野生型、SMAおよびColQ関連CMSマウスの前脛骨筋(TA)および腓腹筋(GA)におけるNMJ神経支配パターン。(A、B)ニューロフィラメントM(NF-M、赤)およびα-ブンガロトキシン-F488(α-BTX、緑)に対する抗体で標識された21日齢のWTおよびSmn2B /-マウスのTAからの代表的な神経筋接合部(A)、およびニューロフィラメント蓄積の定量分析の結果(B);(C, D)ニューロフィラメントM(NF-M、赤)およびα-ブンガロトキシン-F488(α-BTX、緑)に対する抗体で標識された6週齢WTおよびColQ Dex2/Dex2マウスのGAからの代表的な神経筋接合部、断片化された未熟なシナプス後エンドプレート(C)、および2群の動物におけるニューロフィラメント蓄積の結果(D)。N=4(n = 34NMJs)(B)およびN = 3(n = 54NMJs)(D)WT動物、ならびにN=3(n = 36NMJs)Smn2B/-およびN = 3(n = 55NMJs)ColQ Dex2/Dex2マウスを実験(B、D)で分析した。(E, F)シナプス小胞糖タンパク質2(SV2、赤)およびα-ブンガロトキシン-F488(α-BTX、緑)に対する抗体で標識した3週齢のWTおよびSmn2B/-マウスのTA由来のNMJにおける軸索終末占有率の代表的な画像(E)、およびNMJ占有率(SV2/AChR体積比)の結果(F)。野生型のN = 3(n = 50 NMJs)およびN = 4(n = 62 NMJs)Smn2B/-マウスの筋肉を分析した。データはSEM±マウス当たりの平均値(dot)で表す。 群間の差はマン・ホイットニー検定により解析した(*p<0.05)。スケールバーは20μmです。 この図の拡大版を表示するには、ここをクリックしてください。
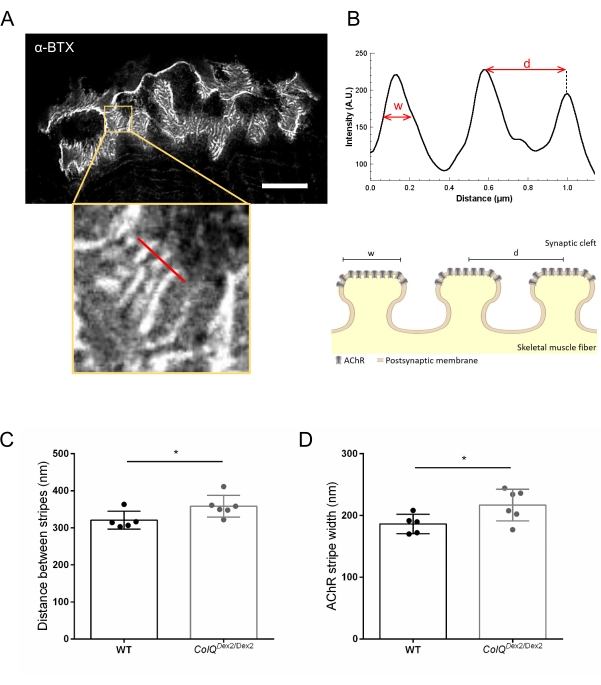
図4:NMJシナプス後エンドプレートのSTEDイメージング。 (A)接合後AChRストライプを示す6週齢野生型マウスの腓腹筋由来のα-ブンガロトキシン-F633(α-BTX)で標識したNMJの代表的なSTED画像(スケールバーは5μm)。(B)強度プロファイルの生成に使用されたAChRストライプのある領域(下のパネル)の高倍率。AChRストライプの幅(w)とこの領域の2つの隣接するストライプ間の距離(d)を定量化し、棒グラフに表示しました。AChRストライプ幅(w)および距離(d)を説明するためのシナプス後終板の概略図。これらのパラメータ、(C)AChRストライプ距離および(D)幅は、6週齢のColQ Dex2/Dex2マウスおよび対照同腹仔において測定された。5 WT(合計n = 29 NMJ)および6 ColQ Dex2/Dex2(合計n = 43 NMJ)の動物からのNMJを盲目的に分析しました。データは、マウス当たりの平均(ドット)±SEMとして表す。 群間の統計学的差は、マン・ホイットニー検定(*p<0.05)を用いて解析した。この図の拡大版を表示するには、ここをクリックしてください。
補足図1:LAS Xソフトウェアと共焦点取得用のパラメータの発売。 共焦点画像を取得するためのさまざまな手順は、プロトコルのセクション3.1.2から3.1.7で説明されています。NMJスタック取得ごとに、プロジェクトが開かれ(ステップ3.1.4)、画像サイズ、取得速度、X、Y、Z軸のパラメータが選択され(ステップ3.1.7)、各シーケンシャルスキャンが示されます(Seq.1、DAPIのレーザー405;シーケンス2、α-BTX-F488用のレーザー488。Seq.3、F594結合二次抗体用のレーザー552)。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:LAS XソフトウェアとSTED取得用のパラメータの発売。 STED画像を取得する手順は、プロトコルのセクション3.2.2から3.2.8で説明されています。顕微鏡がコンフィギュレーションモードSTED ONで起動され(ステップ3.2.2)、プロジェクトが開きます(ステップ3.2.3)。各シーケンシャルスキャンで画像取得(ステップ3.2.7)のパラメータ(画像サイズ、取得速度、ズーム係数、X軸)が示されます(α-BTX-F633の場合はSeq.1;F488結合二次抗体についてはSeq.2)。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:STED顕微鏡で得られたα-BTX染色された接合部のひだの画像。 正しい焦点(左)または誤った焦点(右)のいずれかで取得された6週齢の野生型マウスからのα-BTX-F633で標識されたシナプス後エンドプレートの画像例。 このファイルをダウンロードするには、ここをクリックしてください。
補足図 4: カスタム ImageJ マクロによって取得された入力データと出力データを説明する Windows ポップアップ。 NMJ画像の入力データ例(.tifファイルと.lifファイル)を左の列に示します。マクロからの出力データ (右側の列) は、ジャンクション (.tif) のイメージと結果を含むデータシート (.csv ファイル) を含むフォルダー (Save_Volume、Save_Accu) に保存されます。 このファイルをダウンロードするには、ここをクリックしてください。
補足図5:LAS Xソフトウェアを使用したSTED取得からのAChRストライプ距離と幅の解析。 NMJ STED画像を解析する手順は、プロトコルのセクション5で説明されています。 A)AChRストライプを含む標識されたシナプス後エンドプレート領域の画像。ストライプ解析の対象領域は、垂線 (緑の線、ストライプ距離) または垂直な四角形 (紫色の四角形、ストライプ幅) を描画することによって選択されます。(B, C)選択された領域の強度プロファイルおよびAChRストライプ(B)とAChRストライプ幅(C)との間の距離を計算するための測定値が示される。 このファイルをダウンロードするには、ここをクリックしてください。
補足コーディング ファイル 1: Macro_NMJ_VOL_Marinelloetal. NMJパラメータ測定値(NMJボリューム、MIPエンドプレート面積、NMJ曲がり角度)を抽出するためのImageJカスタムマクロ。 このファイルをダウンロードするには、ここをクリックしてください。
補足コーディング ファイル 2: Macro_NMJ_ACCU_Marinelloetal.NF-M蓄積とSV2染色を抽出するためのImageJカスタムマクロ。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
記載されたビデオプロトコルは、シナプス前およびシナプス後レベルで病理学的変化を特徴付けるために使用できる共焦点顕微鏡およびSTED顕微鏡を組み合わせることによって、神経筋接合部の3D構造を定量化する詳細な方法を提供する。高解像度のSTED顕微鏡により、従来の共焦点イメージングでは識別できないナノ構造の視覚化と形態測定分析が可能になります。この手順により、SMAおよびColQ関連のCMSマウスの2つの虫垂筋( 前脛骨筋 と 腓腹筋)におけるNMJの構造変化を測定することができました。
この技術で信頼できる結果を得るには、筋肉を取り巻く筋膜と筋肉束を分離するための適用された強度に特に注意を払いながら、筋肉を適切に解剖していじめることが重要です。そうしないと、神経支配パターンが混乱し、シナプス前NMJの適切な評価が妨げられる可能性があります。TAおよびGAからのNMJを分析するための詳細な情報が提供されていますが、原則として、このプロトコルは、横隔膜や 腹横筋37など、からかいステップを必要としない扁平筋を含む他の筋肉に適応させることができます。組織固定は、高品質の染色を確実にするためにも重要です。したがって、適切な量(筋肉の15〜20倍)で高品質のPFAを使用することをお勧めします。さらに、固定液への暴露時間は、収縮や凝集などのアーチファクトが過剰固定によって現れ、NMJ機能に影響を与える可能性があるため、重要なステップです。サンプルのサイズと組織38へのパラホルムアルデヒド溶液の浸透速度を考えると、このタイプの筋肉には18〜24時間の固定時間が推奨されます。組織採取後1週間以上染色工程が計画されている場合は、細菌の増殖を防ぐために、アジ化ナトリウムを添加したPBS中のPFA固定筋肉を4°Cに保つことをお勧めします。
このプロトコルは、共焦点にα-BTX-F488を使用し、STEDイメージングにα-BTX-F633を使用するアプローチを提示します。これらの蛍光色素は、記載された実験デザインに適合するように選択されましたが、利用可能な機器や材料に応じて変更することができます。たとえば、画像の取得と定量にSTED CW 592 nmレーザーを使用する場合、α-BTX F488標識を選択できます。しかし、本研究で適用された構成(パルス励起ゲートSTED、775nmの枯渇)は、連続波STED39などの他のアプローチよりも高い性能と優れた分解能を示し、現在のアプリケーションにより適しているようです。また、特にSTED(励起と空乏の両方)の場合、強度プロファイルの特性は飽和状態の場合には測定できず、NMJ画像内の飽和信号は分析全体を危険にさらす可能性があるため、レーザー出力設定を慎重に選択することも重要です。
顕微鏡ソフトウェアとImageJマクロを使用した画像取得と分析を含むこの詳細なワークフローは、単一の筋肉からの共焦点およびSTED顕微鏡による自律的なNMJ形態測定分析を容易にするために開発されました。NMJモルフ2 やNMJアナライザー14など、NMJ共焦点分析のワークフローは、NMJの形態素解析と比較研究を容易にする半自動法の設計への道を開いた。NMJ-morph(およびその更新版aNMJ-morph15)は、最大強度投影を使用して21の形態学的特徴を測定する無料のImageJベースのプラットフォームであり、NMJ-Analyzerは、3D NMJ構造全体から29の関連パラメータを生成するPythonで開発されたスクリプトを使用します。手動閾値は、ユーザー分析を必要とするこれら2つの方法の画像処理中の唯一のステップです。この統合プロトコルは、組織調製、3D共焦点画像取得、および骨格筋全体からのNMJのImageJベースの処理の手順を詳述し、シナプス後(体積、最大投影面積、および曲がり角)およびシナプス前(軸索終末占有率およびニューロフィラメント蓄積)エンドプレートの5つの重要なパラメーターの簡単な概要を提供します。生物学的関連性の追加パラメータであるシナプス後接合襞のAChR組織パターンは、超解像STED顕微鏡(分解能20-30 nm)によるナノスケールレベルでの形態測定分析のために組み込まれました40。興味深いことに、STEDイメージングのための組織調製は、従来の透過型電子顕微鏡(TEM)9などのNMJ微細構造研究に使用される他の方法よりも単純であり、適切な筋肉領域の超薄切片を得るために熟練したマニピュレータを必要とするかなり複雑で時間のかかる手順です。さらに、STED関連ソフトウェアを使用して、複数の接合折り目からの定量データを自動的に取得できます。
このプロトコルは、SMNおよびColQ欠損筋における以前に知られているNMJの欠陥を説明するために適用されました20、36、41、42。共焦点顕微鏡検査によって、シナプス後終板体積、MIP面積、相対的な屈曲率の減少、ニューロフィラメント蓄積の増加など、2つのマウスモデルに共通の変化が見られましたが、いくつかのより具体的な所見(NMJ占有率の低下)は、小胞輸送障害の指標としてSMAマウスでのみ観察されました36。最後に、TEM20で以前に観察されたように、シナプス後接合襞の超微細構造欠陥の兆候であるSTED分析によってColQ-KOでAChRストライプの距離と幅の増加が検出されました。重要なことに、このプロトコルは、発生中、維持中、およびさまざまな病理学的条件下での神経筋接合部のより詳細な形態学的特徴付けに役立つ可能性があります。
開示事項
著者は、この作業に関連する利益相反を宣言しません。
謝辞
Genethonの「イメージングおよびサイトメトリーコアファシリティ」と、イルドフランス地域、コンセイユジェネラルドレソンヌ、エブリーのジェノポールルシェルシュ、エブリーヴァルデソンヌ大学、フランスのINSERMからの機器資金によって部分的にサポートされている組織学サービスに感謝します。また、Smn 2B/2Bマウスラインを提供してくださったRashmi Kothary博士(カナダ、オタワ大学)とColQDex2/+マウスラインを提供してくださったEric Krejci博士(未発表、パリ大学、フランス)にも感謝しています。統計分析におけるギヨーム・コレの支援に感謝します。2H3(Jessel, T.M.およびDodd, J.によって開発された)およびSV2(Buckley, K.M.によって開発された)モノクローナル抗体は、NIHのNICHDによって作成され、アイオワ大学生物学部、アイオワシティ、IA 52242で維持されているDevelopmental Studies Hybridoma Bank(DSHB)から入手した。この研究は、フランセーズ・コントレ・レ・ミオパシー協会(AFM-Telethon)、INSERM、エヴリー・ヴァル・デソンヌ大学の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
参考文献
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304(2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671(2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677(2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220(2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251(2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128(2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- ImageJ. , Available from: http://imagej.nih.gov/ij (2021).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Bio-Formats. , Available from: http://www.openmicroscopy.org/bio-formats/downloads/ (2021).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, Supplement C 253-261 (2013).
- ImageJ documentation. , Available from: http://imagejdocu.tudor.lu/plugin/analysis/geodesic_distances/start (2021).
- GitHUb. , Available from: https://github.com/Genethon/ImCy (2021).
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162(2014).
- Baker, J. R. Principles of biological microtechnique; a study of fixation and dyeing. , Wiley. London Methuen; New York. at http://archive.org/details/principlesofbiol01bake (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421(2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644(2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605(2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved