Method Article
Farelerde Nöromüsküler Kavşakların Kombine Konfokal ve Süper Redüksiyonlu Mikroskopi ile Karakterizasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, SMA ve ColQ ile ilişkili CMS'nin fare modellerindeki patolojik değişiklikleri ölçmek için kullanılan kombine konfokal ve STED mikroskopisi ile nöromüsküler kavşakların morfometrik analizi için bir yöntemi açıklamaktadır.
Özet
Nöromüsküler kavşaklar (NMJ'ler), moleküllerin sinir sisteminden gönüllü kaslara iletilmesinde önemli bir rol oynayan ve kasılmaya yol açan alt motor nöronlar ve iskelet kası lifleri arasındaki oldukça uzmanlaşmış sinapslardır. Duchenne musküler distrofisi (DMD), konjenital miyastenik sendromlar (CMS), spinal müsküler atrofi (SMA) ve amiyotrofik lateral skleroz (ALS) gibi kalıtsal nöromüsküler bozukluklar dahil olmak üzere birçok insan hastalığında etkilenirler. Bu nedenle, nöromüsküler kavşakların morfolojisinin ve hastalık fare modellerindeki değişikliklerinin izlenmesi, patolojik çalışmalar ve terapötik yaklaşımların klinik öncesi değerlendirmesi için değerli bir araçtır. Burada, murin ile alay edilen kas liflerinden motor uç plakalarının ön ve postsinaptik kısımlarının üç boyutlu (3D) morfolojisini etiketleme ve analiz etme yöntemleri açıklanmaktadır. Konfokal görüntüleme ile numune hazırlama ve NMJ hacmi, alanı, kıvrımlılığı ve akson terminal morfolojisi/doluluğunu ölçme prosedürleri ve süper çözünürlüklü uyarılmış emisyon tükenmesi (STED) mikroskobu ile postsinaptik bileşke kıvrımları ile asetilkolin reseptörü (AChR) şerit genişliği arasındaki mesafe detaylandırılmıştır. Bu NMJ parametrelerindeki değişiklikler, SMA ve CMS'den etkilenen mutant farelerde gösterilmiştir.
Giriş
Nöromüsküler bileşke (NMJ), bir motor akson terminali, bir perisinaptik Schwann hücresi ve kimyasal bilginin iletilmesinde ve alt motor nöron aktivitesinin kas kasılmasına bağlanmasında rol oynayan iskeletsel bir miyofiber kısmından oluşan karmaşık bir yapıdır. Memelilerde, nöromüsküler kavşağın morfolojisi gelişim sırasında değişir, olgunlaşmadan sonra tipik bir simit benzeri şekil benimser, türler arasında şekil ve karmaşıklık farklılıkları vardır ve egzersiz veya yaşlanma gibi fizyolojik süreçlere yanıt olarak bir dereceye kadar plastisite gösterir 1,2,3,4 . Postsinaptik motor uç plakası, asetilkolin reseptörleri (AChR) içeren üst kısmın presinaptik terminal akson dal5 ile yakın temas halinde olduğu bileşke kıvrımları adı verilen membran invaginasyonları oluşturur.
Nöromüsküler kavşaklardaki morfolojik ve fonksiyonel değişiklikler, spinal müsküler atrofi (SMA) ve amiyotrofik lateral skleroz (ALS), Duchenne musküler distrofisi (DMD), konjenital miyastenik sendromlar (CMS), myastenia gravis (MG) ve sentronükleer miyopatiler (CNM) gibi çeşitli nörodejeneratif hastalıkların patofizyolojisine katkıda bulunur ve yaşlanmaya bağlı sarkopeni 3,6,7,8,9, 10,11,12. Bu hastalıklarda son plaka parçalanması, postsinaptik bileşke kıvrım boyutunda azalma ve/veya denervasyon gibi NMJ yapısal değişiklikleri gözlenir. NMJ'lerin patolojisi, hastalığın ilerlemesi sırasında birincil veya erken bir olay olabilir veya klinik bulgulara katkıda bulunan ikincil bir olay olarak daha geç ortaya çıkabilir. Her durumda, bu hastalıkların hayvan modellerinde NMJ'lerin morfolojisinin izlenmesi, patolojik değişiklikleri incelemek ve potansiyel tedavilerin etkinliğini değerlendirmek için değerli bir parametreyi temsil eder.
Nöromüsküler kavşakların morfolojisi genellikle konfokal mikroskopi 2,13,14,15 veya elektron mikroskobu 5,16 kullanılarak tekniklerle, sırasıyla çözünürlük veya teknik zorluklar gibi doğal sınırlamalarıyla analiz edilir. Daha yakın zamanlarda, süper-çözünürlüklü mikroskopi, elektron mikroskobu ile ultrayapısal analize alternatif veya tamamlayıcı bir yaklaşım olarak, presinaptik aktif bölgeler veya postsinaptik membran16,17,18 üzerindeki AChR dağılımı gibi NMJ'nin belirli bölgelerini görselleştirmek için de kullanılmıştır.
Bu protokol, floresan konfokal ve uyarılmış emisyon tükenmesi (STED) mikroskopisini birleştirerek NMJ morfolojik parametrelerini değerlendirmek için ayrıntılı ve tekrarlanabilir bir yöntem sağlamayı amaçlamaktadır. Presinaptik ve postsinaptik uç plakaların hacim, alan, göreceli kıvrımlılık, AChR şerit genişliği ve fare gastroknemius ve tibialis anteriorunun innerve alaylı kas liflerindeki akson terminal dağılımı gibi önemli özellikleri normal ve hastalıklı durumlar bağlamında ölçüldü. Özellikle, NMJ defektleri, SMN1 geni 11,19'daki mutasyonların neden olduğu motor nöron dejenerasyonu olan bir nöromüsküler hastalık olan spinal müsküler atrofinin Smn2B / - fare modelinde ve konjenital miyastenik sendrom20'nin bir modeli olarak asimetrik asetilkolinesteraz nakavtının (ColQ Dex2 / Dex2 veya ColQ-KO) kollajen benzeri bir kuyruk alt biriminde örneklendirilmiştir. 21,22.
Protokol
Farelerin bakımı ve manipülasyonu, hayvan deneyleri ile ilgili ulusal ve Avrupa mevzuatına göre gerçekleştirilmiş ve kurumsal etik kurul tarafından onaylanmıştır. Çalışmada sırasıyla 3 ve 6 haftalıkken Smn2B / - (C57Bl / 6J arka plan) ve ColQDex2 / Dex2 (B6D2F1 / J arka plan) farelerinin erkek ve dişileri kullanılmıştır.
1. Farelerin ötenazisi ve kasların diseksiyonu: tibialis anterior ve gastroknemius
- Servikal çıkık ile ötenazi öncesi ketamin (87.5 mg / kg) / ksilazin (12.5 mg / kg) karışık çözeltisinin (0.1 mL / 20 g vücut ağırlığı) intraperitoneal enjeksiyonu ile fare anestezisine devam edin.
NOT: SMA ve ColQ-CMS bireyleri cinsiyetlerinden bağımsız olarak etkilediğinden, mevcut protokolde erkek ve dişi fareler kullanılmıştır. - Küçük bir elektrikli tıraş makinesi kullanarak arka bacaklardaki tüyleri çıkarın ve bacakları% 70 etanol ile durulayın.
NOT: Diseksiyon prosedürü her kas için farklı olacaktır. Tibialis anterior (TA) diseksiyonu için 1.2.1-1.2.3 adımlarını izleyin ve gastroknemius (GA) (medial ve lateral parçalar) için 1.2.4-1.2.6 adımlarını izleyin. Doku hasarını önlemek ve diseksiyon sırasında ezmek veya germek için kasları nazikçe tutun.- Fareyi sırtüstü konuma getirin.
- Kasları açığa çıkarmak için tibiaya paralel olarak, distal arka bacağın antero-dış kısmı boyunca keskin-künt makasla 5 mm'lik bir cilt kesisi yapın. Fasyayı çıkarmak için ekstra ince makas kullanın.
- Önce distal tendonu (pençeye yakın) ve sonra proksimal tendonu (dize yakın) ekstra ince makas ve kavisli ince forseps kullanarak kesin. Miyoliflere ve sinirlere zarar vermemek için kası dikkatlice kullanın.
NOT: Proksimal tendon, tüm kası toplamak için kemiğe mümkün olduğunca yakın kesilmelidir. - Fareyi yüzüstü pozisyona getirin, distal arka bacak arka bölmesinin üst kısmından pençeye kadar bir cilt kesisi yapmak için keskin künt makas kullanın ve cildi çıkarın.
- Aşil tendonunu orta tırtıklı forsepslerle kavrayın, ekstra ince bir makasla kesin ve GA'yı çevreleyen dokudan proksimal yerleştirilmesine kadar yavaşça ayırın.
- Proksimal tarafta, orta tırtıklı forsepsleri biseps femoris (BF) ve GA arasında oluşan cebe yerleştirin.
- Doku fiksasyonu için, her kası fosfat tampon salininde (Ca 2 + Mg 2+ olmadan PBS) seyreltilmiş 1 mL% 4 w / v paraformaldehit (PFA) çözeltisi içeren2 mL'lik bir mikrosantrifüj tüpüne yerleştirin ve 18-24 saat boyunca 4 ° C'de tutun.
DİKKAT: Paraformaldehit ve formaldehit toksiktir ve yeterli koruyucu ekipmana sahip kimyasal bir duman başlığında kullanılmalıdır. - Ertesi gün, kimyasal bir duman davlumbazının içinde oda sıcaklığında (RT) hafifçe sallayarak sabit kasları 12 delikli plakalarda PBS ile 5 dakika boyunca 3 kat yıkayın.
NOT: Protokol bu adımda durdurulabilir ve bir ay içinde devam ettirilebilir. Bu durumda, numuneleri 4 ° C'de saklamak için% 0.01 sodyum azid takviyeli PBS ekleyin. - Her kası, iki ince tırtıklı forseps kullanarak yaklaşık 1 mm genişliğinde küçük lif demetleri halinde kızdırın.
NOT: Alay sırasında doku hasarını önlemek için forseps ile kasları aşırı kuvvet olmadan çok nazikçe manipüle etmek çok önemlidir.- TA kasını büyüklüğüne bağlı olarak 3 veya 4 demet halinde ayırın.
- GA için, kasın medial ve lateral kısımlarını ayırın ve daha sonra her bir parçayı boyutlarına bağlı olarak 4-5 demet halinde ayırın.
2. İmmün boyama
- Kas lifi geçirgenliği ile devam edin: Kas demetlerini PBS'de% 1 (v / v) Triton X-100 içeren 24 delikli plakalara aktarın ve RT'de 1 saat veya 4 ° C'de 5 saat boyunca hafif ajitasyon (50 rpm) altında tutun.
NOT: Ayrı immün boyamalara devam etmek ve antikor karışıklığı riskini en aza indirmek için kas demetlerini iki plaka arasında bölün. Onları ikiden fazla kuyucuğa bölmeyin (1 kuyu / plaka); aksi takdirde, analiz edilen kastaki genel durumlarını temsil eden NMJ'lerin sayısı (N) yetersiz olabilir. - Numuneleri RT'de PBS ile 5 dakika boyunca 3 kat yıkayın ve PBS / Triton X-100'de% 4 sığır serum albümininden (BSA) oluşan bir blokaj çözeltisi ile 4 ° C'de 4 saat boyunca% 1, nazik karıştırma (50 rpm) altında inkübe edin.
NOT: Yıkama adımları sırasında aspirasyon pompası kullanmayın, bunun yerine çözeltiyi 200 μL'lik bir pipet ve küçük boyutlu uçlarla manuel olarak aspire edin (referans Malzeme Tablosunda belirtilmiştir). - Presinaptik akson terminallerini veya aktif bölgeleri etiketlemek için sırasıyla nörofilament M (NF-M, 2H3, seyreltme 1/200) veya sinaptik vezikül glikoprotein 2'ye (SV2, seyreltme 1/200) karşı birincil monoklonal antikorlar içeren adım 2.2'de belirtilen blokaj çözeltisi ile numuneleri yumuşak ajitasyon (50 rpm) altında 4 ° C'de gece boyunca (O / N) inkübe edin.
- Ertesi gün, kas demetlerini ajitasyon altında PBS'de 5 dakika boyunca 3x yıkayın (50 rpm).
- Konfokal görüntüleme için: Kas demetlerini, kırmızı yayan bir florofor (F594) (seyreltme 1/500) ile konjuge edilmiş ikincil anti-fare antikorları ve yeşil yayan bir florofor (α-BTX-F488) (seyreltme 1/1000) ile konjuge edilmiş α-bungarotoksin ile PBS'de ajitasyon altında RT'de (50 rpm) 2 saat boyunca inkübe edin.
- STED görüntüleme için: Kas demetlerini, yeşil yayan bir florofor (F488) (seyreltme 1/500) ile konjuge edilmiş ikincil anti-fare antikorları ve ajitasyon altında RT'de (50 rpm) RT'de 2 saat boyunca yüksek fotostabilite (α-BTX-F633) (seyreltme 1/1000) ile karakterize edilen çok kırmızı yayan bir florofor ile konjuge edilmiş α-bungarotoksin ile inkübe edin.
NOT: Fotobeyazlatmayı önlemek için inkübasyon sırasında numuneleri ışığa maruz bırakmayın.
- Etiketli kas demetlerini ajitasyon altında PBS ile 5 dakika boyunca 3 kat yıkayın (50 rpm) ve montaj ortamına sahip bir slayta yerleştirin.
NOT: Sızdırmazlığa izin vermek için slayt başına en fazla 4 ila 5 kas demeti yerleştirin. - Üstüne bir sınıf #1.5 (veya #1.5H) cam kapak kayması (0.17 mm kalınlığında) ekleyin ve basınç uygulamak ve kasları düzleştirmek için kızağın her iki tarafına silindirik mıknatıslar yerleştirin.
- Slaytları 4°C'de hafif O/N'den koruyun. Slaytları oje ile kalıcı olarak kapatın.
3. Görüntü toplama
- Konfokal mikroskopla edinimler
NOT: Görüntüler, 63x büyüklüğünde bir yağ daldırma hedefi (HCX Plan Apo CS, 1.4 sayısal diyafram açıklığı (NA)) kullanılarak ters lazer taramalı konfokal mikroskopla toplanmıştır.- Kör analiz için, analize dahil olmayan bir kişinin her slaytı belirli bir sayı ile kodlamasına izin verin. Tüm örnekler için NMJ parametrelerinin nicelleştirilmesi tamamlanana kadar deney gruplarına kör kalın.
- Mikroskop yazılımını machine.xlhw > Yapılandırma Modunda başlatın (Ek Şekil 1).
- Slaytı mikroskop aşamasına yerleştirin ve DAPI filtre seti ile DAPI geniş alan floresan aydınlatmasının altına bakarak numune içindeki gözlem düzlemini bulun.
- Proje > Yeni Projeleri Aç'a tıklayın ve görüntü alımlarını depolamak için bir klasör oluşturun (Ek Şekil 1).
NOT: klasör boyutunu sınırlamak ve bilgisayar belleği sorunlarını önlemek için her NMJ için yeni bir proje oluşturun. - Alma parametrelerini yönetmek için, Alma sekmesi penceresine tıklayın ve görüntü alınması gereken uç plakada 488 nm lazer kullanarak yeşil / F488 (α-BTX) floresan için kazanç ve ofset seviyelerini optimize etmek üzere konfokal iğne deliğini 1.0 Havadar ünite ve lazer gücüne ayarlayın (Canlı mod AÇIK).
- Ardından, F594 gözlemine uyarlanmış bir lazer kullanarak kırmızı/F594 (NF-M veya SV2) floresan alımını optimize edin. Bu çalışmada 552 nm lazer kullanıldı (Live mode ON). Her lazer için aşağıdaki aralıklarla boya emisyonu spektrumunu ayarlayın: 414 ila 483 nm arasında lazer 405 (DAPI), 506-531 nm arasında lazer 488 (F488-α-BTX) ve 622-650 nm arasında lazer 552 (NF-M/SV2).
- Her deney grubundaki nöromüsküler kavşakların görüntü yığınlarını aynı ayarlarla toplayın: 400 Hz örnekleme hızında görüntü boyutu 1024 x 1024 piksel (73,7 x 73,7 μm), Çift Yönlü X AÇIK, Yakınlaştırma faktörü 2,5, Z-Geniş modda Z-adım boyutu 0,5 μm.
NOT: Her NMJ için, dilim sayısı tüm kavşağı alacak şekilde ayarlanır. Yukarıda açıklanan edinim ayarları Nyquist-Shanon örnekleme teoremini yerine getirmektedir. Bununla birlikte, kullanıcı, piksel boyutunun ve Z-adımının ideal Nyquist örnekleme hızını karşıladığından emin olmak için tüm yeni konfokal işletim yazılımlarında bulunan Formatı Optimize Et düğmesine tıklayabilir. Bu işlem, fazla veya az örneklenmiş görüntüleri önleyecek ve bu da hacim ölçümlerinde doğruluk kaybına neden olacaktır. - Orijinal dosyayı (.lif) veya Z-yığını görüntülerini (.tif) slaytın kod adını, boyama türünü ve bitiş plakası numarasını içeren bir ada sahip bir klasöre kaydedin.
NOT: F488 floresansının F594 kanalına çapraz geçişini önlemek için 488 nm ve 552 nm lazerleri (F488 ve F594) kullanarak taramaları sırayla (aynı anda değil) toplayın ve bunun tersi de geçerlidir (kanama). Not: Işın yolu, mikroskop yazılımındaki Boya Yardımcısı ile yapılandırılabilir. - Sonraki kodlanmış slayda geçin ve her NMJ için 3.1.3-3.1.8 arasındaki adımları yineleyin.
- Oturumun sonunda, 3B Görüntüleyicide Aç'a tıklayın ve 3B etiketlemeyi görselleştirmek için bir deney grubunun NMJ temsilcisini seçin.
NOT: Bu görünüm modu, edinme parametrelerinin doğru olduğunu doğrulamaya yardımcı olur. - Mikroskop yazılımını kapatın, hedefleri lens dokularıyla temizleyin ve ardından sistemi kapatın.
- STED mikroskopisi ile edinimler
NOT: Görüntüler, 100x yağ daldırma hedefi (HC PL APO CS2 1.4 NA) kullanılarak 775 nm'de Kapılı STED ile donatılmış ters lazer taramalı konfokal mikroskopla toplanmıştır.- Kör analiz için, analize dahil olmayan bir kişinin her slaytı belirli bir sayı ile kodlamasına izin verin. Tüm örnekler için NMJ parametrelerinin nicelleştirilmesi tamamlanana kadar deney gruplarına kör kalın.
- Mikroskop yazılımını machine.xlhw ve STED ON > Yapılandırma Modunda başlatın (Ek Şekil 2).
- Görüntü alımlarını depolamak üzere bir klasör oluşturmak için Proje > Yeni Projeleri Aç'a tıklayın.
NOT: Klasör boyutunu sınırlamak ve bilgisayar belleği sorunlarını önlemek için her slayt için yeni bir klasör oluşturun. - Slaytı mikroskop sahnesine yerleştirin ve numune içindeki gözlem düzlemini bulmak için 488 nm lazeri kullanarak geniş alan floresan aydınlatması altında görüntüleyin.
- 506-531 nm spektral algılamalı 488 nm lazeri kullanarak nörofilament M (NF-M) veya SV2 boyamaları ile etiketlenmiş bir NMJ arayın.
- Bir NMJ tanımlandığında, STED'i Etkinleştir'e tıklayın ve 640-750 nm spektral algılamaya sahip 635 nm lazeri kullanarak birkaç birleşim kıvrımı içeren bir bölgede görüntüler almaya başlayın (Ek Şekil 3).
NOT: Görüntü yakalama sırasında doygunluk arama tablosuna dikkat edin ve aşırı pozlamayı önlemek için Hızlı LUT düğmesini tıklatın (gri değerler >255; 8 bit için). - Her deney grubunun görüntülerini aynı ayarlarla toplayın: 400 Hz örnekleme hızında görüntü boyutu 2048 x 2048 piksel (38,75 x 38,75 μm).
NOT: Tükenme lazer (STED) gücü %65 olarak ayarlanmıştır. - Görüntüleri, slaydın kodunu içeren bir dosya adıyla kaydedin.
NOT: STED görüntüleme ile en iyi alma ayarını elde etmek için Optimize Edilmiş XY Formatı: Formatı Ayarla'ya tıklamak mümkündür. - Sonraki kodlanmış slayda geçin ve 3.2.3-3.2.8 arasındaki adımları yineleyin. Bu yordamı tüm slaytlar için yineleyin.
- STED mikroskopi oturumunun sonunda, görüntü dosyalarını başka bir bilgisayara aktarın ve orijinal dosyaları kaydedin (. lif) harici bir sürücüde veya sunucuda.
- Mikroskop yazılımını kapatın, hedefleri lens dokularıyla temizleyin ve ardından sistemi kapatın.
4. Görüntü analizi - konfokal mikroskopi
NOT: Tüm görüntüler Microsoft Windows 10 Professional işletim sistemi kullanan bilgisayarlarla işlenmiştir.
- Postsinaptik NMJ uç plakası hacmini, Maksimum Yoğunluk Projeksiyonu (MIP) alanını ve göreli kıvrımlılığı hesaplamak için ImageJ'yi ve özel makroyu başlatın.
- NMJ parametre ölçümlerini elde etmek için NIH ImageJ freeware23, iGeodesic eklentisi ve özel makroyu kullanarak NMJ görüntü yığınlarını işleyin. ImageJ yazılımını başlatın.
NOT: ImageJ'nin en son sürümü ücretsiz olarak kullanılabilir ve24 indirilebilir. Özel dosya formatlarını açmak için, Bio-Formats Package25 eklentisinin indirilmesi gerekir26 . Bu adım, operatörün Fiji kullanması durumunda gerekli değildir, çünkü eklenti yazılımda zaten yüklüdür. Kıvrımlılığı hesaplamak için iGeodesic eklentisi27 çevrimiçi olarak da mevcuttur28; Bu eklentinin kullanılabilirliğini kullanılacak ImageJ / Fiji sürümünde doğrulayın. Özel yapım Makrolar çevrimiçi olarak da mevcuttur29. - Macro_NMJ_VOL_Marinelloetal.ijm dosyasını (özel yapım, Ek Kodlama Dosyası 1) sürükleyip ImageJ penceresine bırakın; makro ikinci bir pencerede açılır. Bu yeni pencerede, Makrolar > Makroyu Çalıştır'ı tıklatın.
Not: makro hem özel hem de TIFF dosyalarını işleyebilir. Dosyalar aşağıdaki kriterleri karşılamalıdır: özel dosya biçimleri için, bir klasörde sıralanan dosya başına yalnızca bir birleşim noktası (yani, görüntü yığını) kaydedin; TIFF görüntüleri için dosyalar, her biri belirli bir birleşimin (RGB TIFF) görüntü yığınlarıyla birlikte JunctionX (X bir NMJ numarasına karşılık gelir) adlı alt klasörler içeren bir klasöre kaydedilmelidir (Ek Şekil 4). - Analiz edilmesi gereken Junction alt klasörlerini içeren yerel klasörü seçin ve Seç'e tıklayın.
- Klasörü Kaydetme adlı yeni açılır menüde, depolama klasörünü seçin ve Seç'e tıklayın.
- Görüntü Türü adlı yeni açılır menüde, Z-yığını alımlarının biçimini seçin.
- İlgilenilen lekelenmeye karşılık gelen RGB kanalını seçin ve XY piksel boyutunu ve Z-adımını (z) belirtin. Makro analizi otomatik olarak gerçekleştirir.
NOT: Özel dosya formatlarının seçilmesi durumunda, makro doğrudan piksel boyutunu ve Z-adımını (z) okur. Ancak, kullanıcının yine de ilgilendiği kanalı (C1, C2 veya C3) belirtmesi gerekir. Makro, kaydetme klasöründeki her bağlantı parametresi (uç plaka hacmi, MIP alanı ve kıvrımlılık) için bir Veri Sayfası (.csv) sağlar. Makro ayrıca üç . α-BTX boyama Drawing_MaxprojX.tif, DrawingJunctionX.tif ve MIP MaxprojX.tif çevresine karşılık gelen TIF dosyaları. Bu TIFF dosyaları, alımların kalitesini doğrulamak ve görüntü işlemenin doğru şekilde gerçekleştirildiğinden emin olmak için oluşturulur.
Postsinaptik NMJ hacmi (V): Makro, görüntüleri tek bir NMJ'den ayırır ve postsinaptik uç plakaya karşılık gelen α-bungarotoksin F488 kanalını tutar. Yığın, yığının ara diliminde Otsu eşiği30 kullanılarak bölümlere ayrılır. Elde edilen ikili görüntü 1 piksel genişletilir ve Parçacıkları Analiz Et özelliği, algılanan her nesnenin uç plaka alanını ölçmek için kullanılır. Postsinaptik NMJ hacmini elde etmek için, makro yığının ölçülen tüm uç plaka alanlarını toplar ve μm cinsinden Z-adım değeri (z) ile çarpar.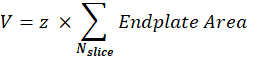
Maksimum yoğunluk projeksiyonu (MIP) uç plaka alanı: Yığın eşik haline getirildikten sonra, Z-project ImageJ özelliği kullanılarak maksimum yoğunluk projeksiyonu (MIP) elde edilir. Parçacıkları analiz et özelliği daha sonra MIP uç plaka alanını ölçmek için kullanılır.
NMJ MIP kıvrımlılığı (T): Kıvrımlar ve delikler31 dahil olmak üzere postsinaptik motor uç plakasının karmaşıklık derecesini yansıtan NMJ kıvrımlılığı, aşağıdaki formül kullanılarak her MIP'ye göre hesaplanır; burada d Obj (AB), nesnenin çevresi boyunca A ve B arasındaki mesafedir ve dEuc (AB), A ile B arasındaki Öklid mesafesidir (düz çizgi).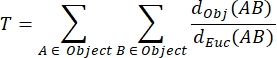
- Her deneysel koşulun vahşi tip grubundaki en yüksek kıvrılma değerini %100'e ayarlayın ve göreli NMJ kıvrımlılığını elde etmek için deneysel koşulun diğer tüm değerlerini bu değere normalleştirin.
- NMJ parametre ölçümlerini elde etmek için NIH ImageJ freeware23, iGeodesic eklentisi ve özel makroyu kullanarak NMJ görüntü yığınlarını işleyin. ImageJ yazılımını başlatın.
- Presinaptik nörofilament birikimini ve sinaptik vezikül glikoprotein 2 boyamasını ölçmek için ImageJ ve özel makroyu başlatın.
NOT: Nörofilament birikimi (burada, NF-M) ve/veya sinaptik veziküllerin değişmiş dağılımı (burada, SV2) anormal aksonal transportun ve/veya bozulmuş vezikül kaçakçılığının belirteçleridir ve daha önce çeşitli SMA fare modellerinin NMJ'lerinde gözlenmiştir 32,33,34.- Macro_NMJ_ACCU_Marinelloetal.ijm dosyasını (özel yapım, Ek Kodlama Dosyası 2) sürükleyip ImageJ penceresine bırakın; makro ikinci bir pencerede açılır. Bu yeni pencerede, Makrolar > Makroyu Çalıştır'ı tıklatın.
Not: makro hem özel dosya biçimlerini hem de TIFF dosyalarını işleyebilir. Dosyalar, adım 4.1.2'nin altındaki NOT'ta belirtilen kriterleri karşılamalıdır. - Analiz edilmesi gereken Junction alt klasörlerini içeren yerel klasörü seçin ve Seç'e tıklayın.
- Klasörü Kaydetme adlı yeni açılır menüde, depolama klasörünü seçin ve Seç'e tıklayın.
- Görüntü Türü adlı yeni açılır menüde, Z-yığını alımlarının biçimini seçin.
- Boyama Bilgileri açılır penceresinde, presinaptik ve postsinaptik etiketi ve rengi belirtin ve Tamam'a tıklayın. Örneğin, Presinaptik etiket: SV2 veya NF, Presinaptik renk: R, Postsinaptik etiket: BTX, Postsinaptik renk: G.
NOT: Özel dosya biçimleri için etiketler ve ilgili kanallar (C1, C2 veya C3) belirtilmelidir. - Piksel Boyutu açılır penceresinde, XY piksel boyutu 0,072 μm ve Z adımı 0,5 μm (z) simgesini gösterin ve Tamam'a tıklayın. Makro analizi otomatik olarak gerçekleştirir.
NOT: Bu parametre, konfokal mikroskop alımlarından önce seçilen 1024 x 1024 piksel (73,7 x 73,7 μm) görüntü boyutuna karşılık gelir ve objektif ve yakınlaştırma ayarlarıyla ilişkilidir. Özel dosya biçimleri seçilirse, makro doğrudan piksel boyutunu ve Z-adımını (z) okur. Makro, kaydetme klasöründe, presinaptik ve postsinaptik birimlerden oluşan bir Veri Sayfası (.csv), her (sinaptik öncesi ve sonrası) etiketleme için geçerli algılamanın çok sayfalı bir TIFF görüntüsünü depolar. Yukarıda belirtildiği gibi, bu TIFF dosyaları, alımların kalitesini kontrol etmek ve görüntü işlemenin doğru şekilde yapıldığından emin olmak için oluşturulur.
Makro, α-bungarotoksin-F488 etiketlemesi ile kolokalize olan NF-M-F594 kanalından aksonal nörofilament M boyama hacmini (NF hacmi) ve α-BTX-F488 etiketleme ile birlikte lokalize olan SV2-F594 kanalından NMJ sinaptik vezikül glikoprotein 2 boyama hacmini (SV2 hacmi) hesaplar. NF-M birikimi, aşağıda gösterildiği gibi NF hacmi ile postsinaptik uç plaka (α-BTX) hacmi ve NMJ akson terminal doluluğu arasındaki oranın, SV2 ve α-BTX hacimlerinin oranı ile hesaplanmasıyla ölçülür.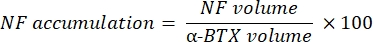
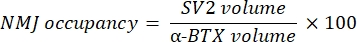
- Macro_NMJ_ACCU_Marinelloetal.ijm dosyasını (özel yapım, Ek Kodlama Dosyası 2) sürükleyip ImageJ penceresine bırakın; makro ikinci bir pencerede açılır. Bu yeni pencerede, Makrolar > Makroyu Çalıştır'ı tıklatın.
5. Görüntü analizi - STED mikroskopisi
NOT: Görüntü işleme, STED mikroskop üreticisinin çevrimdışı yazılımı ile gerçekleştirilmiştir.
- Mikroskop yazılımını başlatın.
- Proje Aç düğmesine tıklayarak projeyi açın. Proje dosyasını (.lif) seçin ve açın. Görüntüler ekranda adlarıyla birlikte görüntülenir.
- İşlem penceresinde: Gürültü Azaltma > Median'a tıklayın. Orta pencerenin alt kısmında, Yarıçap'ı 5.00 ve Yineleme'yi 1.00 olarak ayarlayın ve 3B Filtreleme'nin işaretini kaldırın.
- Ardından pencerenin sol üst köşesindeki Projeleri Aç sekmesini seçin ve bir görüntü seçin.
- Parametreleri doğrulamak için Uygula'ya tıklayın. "nameofimage_median001" adlı yeni bir görüntü oluşturulur.
NOT: Görüntü kontrastını artıracak ve niceleme için kullanılan çizgi profillerini düzgünleştirecek medyan filtrenin etkisini izlemek için Uygula'dan önce Önizleme'ye tıklamak mümkündür. - Filtreyi 5.4-5.5 adımlarında belirtildiği gibi tüm görüntülere uygulayın.
- Projeleri Aç sekmelerinde, yeni oluşturulan filtrelenmiş görüntüler de dahil olmak üzere tüm projeleri kaydetmek için disket sürücü simgesine tıklayın.
NOT: Bir sonraki adım, "nameofimage_median001" adlı filtrelenmiş görüntü kullanılarak gerçekleştirilecektir. - AChR çizgileri arasındaki mesafeyi hesaplayın
NOT: Postjunctional kıvrımların morfolojisindeki değişiklikler sıklıkla nöromüsküler bozukluklarda NMJ patolojisinin bir işareti olarak görülür (olgunlaşmamışlık veya dejenerasyon). α-bungarotoksin boyama ile tespit edilen AChR şeritleri arasındaki mesafe (d), yoğunluk profilleri üretilerek ve bir çizgi profili çizilerek her maksimum yoğunluk zirvesi arasındaki mesafenin ölçülmesiyle hesaplanır (Ek Şekil 5).- Mikroskop yazılımını kullanarak, merkezi pencerenin üstündeki Quantify menüsünü seçin.
- Sol üstteki Araçlar sekmesine tıklayın. Sol üst panelde Yoğunluk'u seçin ve Çizgi profili simgesine tıklayın. Aşırı örneklemeyi 1 olarak ayarlayın ve Kanalları Sırala'yı işaretleyin.
- Projeleri Aç sekmelerine tıklayın ve analiz edilecek filtrelenmiş görüntüyü seçin.
NOT: Bilgisayar faresiyle kaydırarak görüntüyü yakınlaştırmak mümkündür. Görüntünün dinamik aralığı, görüntülenen görüntünün yanındaki sol taraftaki çubuk kullanılarak değiştirilebilir ve bu da çizgilerin görselleştirilmesini kolaylaştırır. - Ardından, sağ pencerenin üst menüsündeki Çizgi Çiz simgesine tıklayın ve dikey olarak birkaç çizgili / birleşimsel kıvrımları geçen bir çizgiyi izleyin.
NOT: Yoğunluk profili orta pencerede görüntülenir. - İlk tepe noktasının üstüne tıklayın ve bir sonraki maksimum tepe noktasına ulaşılana kadar farenin sol düğmesini basılı tutarken fare işaretçisini hareket ettirin.
NOT: Bilgiler yoğunluk profilinde gösterilirken, iki tepe noktası arasındaki mesafe grafiğin altında "dx" değeriyle görüntülenir. - Sağ pencerenin görüntüsündeyken farenin sağ üzerine tıklayın ve YG'leri Kaydet'i seçin. YG'leri Yükle'ye tıklayarak kaydedilen YG'leri (İlgi Çekici Bölgeler) açın.
- Sağ pencerenin sol üst köşesindeki ok simgesine tıklayın, YG'ye tıklayın ve bin simgesine tıklayarak silin.
- Analiz edilen kastaki küresel değeri temsil edecek tahmini AChR şerit mesafesi sayısını elde etmek için bu işlemi farklı yoğunluk profillerinden gerektiği kadar tekrarlayın.
NOT: En uygun N değeri, gruplar arasındaki tahmini farka, α riskine, gücüne ve bir veya iki kuyruklu teste dayanarak önceden hesaplanabilir. Mevcut deneysel tasarımda, tek kuyruklu bir Mann-Whitney testi (α risk =% 10; güç =% 80) uygulanmış ve iki hayvan grubunu karşılaştırmak için N değerinin NMJ başına en az beş AChR şerit mesafesi olduğu tahmin edilmiştir.
- AChR şerit genişliği
NOT: Şerit genişliği (w), α-BTX sinyal floresan değerinin maksimum yoğunluğunun yarısı olduğu noktalar arasındaki mesafe olan yoğunluk profilinin tam genişlikteki yarı maksimumuna (FWHM) karşılık gelir (Ek Şekil 5).- Mikroskop yazılımını kullanarak, orta penceredeki Quantify menüsünü seçin.
- Sol üst taraftaki Araçlar sekmesine tıklayın. Sol üst panelde Yoğunluk'u seçin ve FWHM'yi Belirle simgesine tıklayın. Kanalları Sırala'yı işaretleyin.
NOT: Yazılım tarafından tepe algılamasını optimize etmek için, Set Threshold ve Width sırasıyla 50 ve 3 olarak ayarlanmıştır. Bu değerleri her deney için uyarlayın ve deneyimli bir görüntüleme bilimcisinden tavsiye isteyin. - Projeleri aç sekmelerine tıklayın ve analiz edilecek filtrelenmiş görüntüyü seçin.
NOT: Bilgisayar faresiyle kaydırarak sağ pencerede görüntülenen görüntüyü yakınlaştırmak mümkündür. Yukarıda belirtildiği gibi (5.8.3 adımını takip eden NOT), görüntünün dinamik aralığı optimum şerit görselleştirme için değiştirilebilir. - Ardından, sağ pencerenin üst menüsündeki Dikdörtgen Çiz simgesine tıklayın. Yatay veya dikey bir şerit seçin ve şeride dik olarak bir dikdörtgen çizin. Orta pencerede bir profil görünür.
- Sol panelde bulunan Ortalama Projeksiyon menüsünün Dikey veya Yatay yönüne tıklayın, şerit yönünün dikey veya yatay olmasına bağlı olarak.
- Orta penceredeki İstatistikler'e tıklayın ve FWHM değerini okuyun.
- Sağ pencerede görüntülenen resmin üzerine bilgisayar faresiyle sağ tıklayın ve YG'leri Kaydet'i seçin.
NOT: YG'leri Yükle'ye tıklayarak kaydedilen YG'leri açın. - Sağ pencerenin sol üst köşesindeki ok simgesine tıklayın, YG'ye tıklayın ve bin simgesine tıklayarak silin.
- Analiz edilen kastaki küresel değeri temsil edecek olan tahmin edilen AChR şerit genişliği sayısını elde edene kadar bu işlemi farklı dikdörtgen yatırım getirilerinden gerektiği kadar tekrarlayın.
6. Deneysel tasarım ve istatistiksel testler
- Belirli bir yazılım kullanarak istatistiksel analizler gerçekleştirin.
NOT: Veriler, her deney grubunda, konfokal mikroskop görüntüleme için genotip başına N ≥ 3 biyolojik replikasyon ve genotip başına en az 20 NMJ'den ve STED görüntüleme için genotip başına N ≥ 5 biyolojik replikasyon ve N = 5 NMJ'den toplanmıştır. Anlamlılık, eşleşmemiş Mann-Whitney testi (parametrik olmayan) ile değerlendirildi ve p-değerleri ilgili şekil göstergelerinde belirtildi.
Sonuçlar
Nöromüsküler kavşakların pre- ve postsinaptik düzeyde morfolojik analizini tekrarlanabilir bir şekilde kolaylaştırmak için, mikroskop yazılımı ve ImageJ özel makroları kullanılarak kas hasadından görüntüleme ve nicelemeye kadar bir iş akışı geliştirilmiştir (Şekil 1). Bu protokolün yararlılığını örneklemek için, sırasıyla spinal müsküler atrofi (SMA) ve konjenital miyastenik sendrom (CMS) formundan etkilenen Smn2B / - ve ColQDex2 / Dex2 fareleri genetik bozuklukların iki fare modelinde NMJ'lerin morfolojisi değerlendirildi ve veriler yaşa uygun kontrol çöp arkadaşlarıyla karşılaştırıldı.
NMJ yapısı, bu hayvanlarda hastalık belirtileri zaten mevcut olduğunda, sırasıyla 3 ve 6 haftalık Smn2B / - (C57Bl / 6 arka plan) ve ColQDex2 / Dex2 (B6D2F1 / J arka plan) farelerinin tibialis anterior ve gastroknemius kaslarından değerlendirildi. 3 haftalıkken, Smn2B / - fareleri, NMJ atrofisi ve kaybı35,36 gibi gecikmiş iskelet kası gelişimi ve denervasyon belirtileri gösterir. CMS fareleri, NMJ'lerde birincil bir patolojiye sahiptir ve yaşamın ilk haftasından itibaren vücut ağırlığında bir azalma ve belirgin kas zayıflığı20 (veriler gösterilmemiştir) gösterir. Şekil 2A'da gösterildiği gibi, floresan α-bungarotoksin ile etiketlenmiş postsinaptik motor uç plakası, konfokal mikroskopi ile iki fare çizgisinin mutantlarında daha küçük ve / veya parçalanmış olarak ortaya çıkmıştır. Bu özelleştirilmiş ImageJ makroları kullanılarak NMJ Z-yığınlarının nicelleştirilmesi, NMJ olgunlaşma kusurlarının belirtileri olarak kontrollere kıyasla hem SMA hem de CMS farelerinde uç plaka hacminde, maksimum yoğunluk projeksiyonunda (MIP) ve göreceli kıvrımda belirgin düşüşler olduğunu ortaya koymuştur32 (Şekil 2B-D). Postsinaptik uç plaka hacmi ve MIP, hastalıklı hayvanlarda azalmıştır (sırasıyla Smn2B / - ve ColQDex2 / Dex2 farelerde hacim için 2.7 ve 2.0 ve MIP için 2.5 ve 2.0'lık katlama değişimi). Göreceli kıvrımlılık SMN ve ColQ eksikliği olan kaslarda WT'den daha küçüktü (SMA'da% 16.97 ±% 1.33, % 48.84 ±% 5.90 WT fareleri ve% 13.29 ±% 2.79 CMS'de% 30.20 ±% 4.44 kontrol faresi). Ek olarak, ImageJ özel makrosu kullanılarak presinaptik akson terminal dallarının dağılımının nicelleştirilmesi, iki hayvan modelinde nörofilament M dağılımında değişmiş bir model ortaya koymuştur ve immünoetiketleme artmıştır (sırasıyla kontrollere kıyasla Smn2B / - ve ColQDex2 / Dex2 farelerinde% 16.57'ye% 84.65 ±% 0.32 ve% 23.64 ±% 2.78'e karşı% 18.77 ±% 18.77 ±% 1.73) (Şekil 3A-D ). SV2 boyama ile, doluluk oranında% 43'lük bir azalma, yani bitişik sinir terminali aktif bölgelerine sahip AChR içeren bölgelerin yüzdesi, Smn2B / - farelerde de gözlenmiştir (SMA'da% 49.36 ±% 3.76, % 85.69 ±% 2.34 WT fareleri) (Şekil 3E, F). Bu NMJ parametresi ColQDex2 / Dex2 mutantlarının GA'sında da hesaplanmıştır, ancak kontrol çöp arkadaşlarına kıyasla istatistiksel olarak anlamlı bir fark bulunmamıştır (veriler gösterilmemiştir).
Ayrıca, birleşme kıvrımları arasındaki mesafeyi ve bu kıvrımların tepesinde bulunan AChR çizgilerinin genişliğini, süper çözünürlüklü uyarılmış emisyon tükenmesi (STED) mikroskobu kullanarak ColQ eksikliği olan kaslarda ölçerek postsinaptik membran özelliklerini analiz ettik. Şekil 4'te gösterildiği gibi, bu yapıların yönü floresan α-bungarotoksin etiketleme ve yoğunluk profili analizi ile açıkça görselleştirilebilir. Bu NMJ parametrelerini değerlendirdik ve mutantların gastroknemius kasında AChR çizgilerinin birleşim kıvrım mesafesi (d) ve genişliğinde (w) bir artış bulduk (358.3 nm ± 11.97 nm ve 320.8 nm ± mesafe için 10.90 nm ve 216.9 nm ± 10.51 nm ve 186.3 nm ± 7.015 nm, ColQDex2 / Dex2'de vahşi tip farelere kıyasla, sırasıyla, p < 0.05) (Şekil 4C,D).
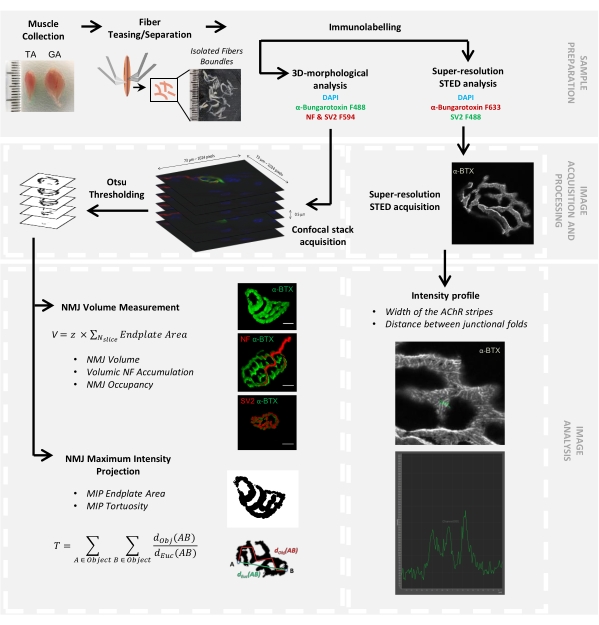
Şekil 1: Konfokal ve STED mikroskopi ile 3D çok ölçekli NMJ karakterizasyonu için video protokolünün akış şeması. Tibialis anterior (TA) ve gastroknemius (GA) kasları farelerden toplandı ve kas lifleri, α-bungarotoksin-F488 veya α-bungarotoksin-F633, DAPI, nörofilament M (NF-M) ve sinaptik vezikül glikoprotein 2 (SV2) ve florofor (F488 veya F594) konjuge sekonjuge sekonjene antikorlara karşı yönlendirilen primer antikorlarla etiketlenmeden önce alay edildi. Görüntü yığınları konfokal mikroskopi ile elde edildi ve postsinaptik NMJ hacmini, presinaptik NF-M birikimini, NMJ akson terminal doluluğunu, postsinaptik maksimum yoğunluk projeksiyonu (MIP) uç plaka alanını ve kıvrımlılığı ölçmek için işlendi (dObj (AB), nesnenin çevresi boyunca A ve B arasındaki mesafedir (kırmızı çizgi), dEuc (AB) A ve B arasındaki Öklid uzaklığıdır (yeşil çizgi)). STED mikroskopi analizi için, asetilkolin reseptörü (AChR) çizgilerinin genişliği ve birleşim kıvrımları arasındaki mesafe, α-BTX-F633 boyamasının yoğunluk profillerinden ölçülmüştür. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
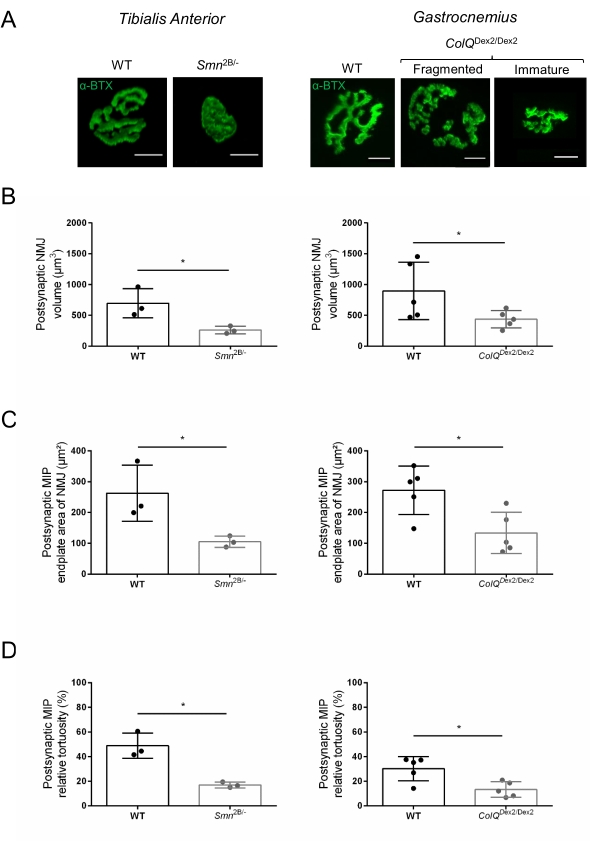
Şekil 2: Spinal müsküler atrofi (SMA) ve ColQ ile ilişkili konjenital miyastenik sendromun (CMS) fare modellerinde çok parametreli postsinaptik NMJ karakterizasyonu. (A) α-bungarotoksin-F488 (α-BTX) ile etiketlenmiş TA ve GA kaslarından postsinaptik motor uç plakaların temsili görüntüleri. (B) NMJ postsinaptik uç plaka hacminin miktarı, (C) maksimum yoğunluk projeksiyonu (MIP) alanı ve (D) 3 haftalık vahşi tip (WT) ve Smn2B/- farelerin TA'daki nispi kıvrımlılığı (sol grafikler, genotip başına N = 3 hayvan, sırasıyla n = 37 ve n = 56 NMJ) ve 6 haftalık WT ve ColQ Dex2 / Dex2 fareler (sağ grafikler, genotip başına N = 5 fare, sırasıyla n = 89 ve n = 97 NMJ). Veriler fare (nokta) başına ortalama SEM ± olarak ifade edilmiştir. Gruplar arasındaki farklılıklar Mann-Whitney testi ile analiz edilmiştir (* p < 0.05). Ölçek çubuğu 10 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
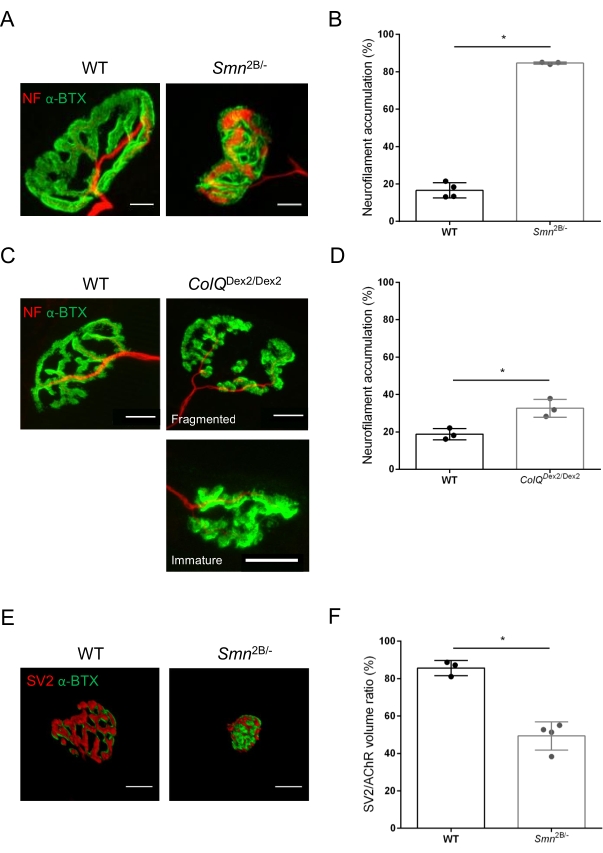
Şekil 3: WT ve mutant farelerin kaslarında presinaptik akson terminal dağılımının morfometrik analizi. Vahşi tip, SMA ve ColQ ile ilişkili CMS farelerin tibialis anterior (TA) ve gastroknemius (GA) kaslarında NMJ innervasyon paterni. (A, B) Nörofilament M (NF-M, kırmızı) ve α-bungarotoksin-F488 (α-BTX, yeşil) (A) karşı antikorlarla etiketlenmiş 21 günlük WT ve Smn2B / - farelerin TA'sından temsili nöromüsküler kavşaklar ve nörofilament birikiminin kantitatif analizinden elde edilen sonuçlar (B); (C, D) Nörofilament M (NF-M, kırmızı) ve α-bungarotoksin-F488'e (α-BTX, yeşil) karşı antikorlarla etiketlenmiş 6 haftalık WT ve ColQDex2 / Dex2 farelerinin GA'sından temsili nöromüsküler kavşaklar, parçalanmış ve olgunlaşmamış postsinaptik uç plakaları (C) ve iki hayvan grubunda nörofilament birikiminin sonuçlarını (D) göstermektedir. Deneylerde N=4 (n=34 NMJ) (B) ve N = 3 (n = 54 NMJ) (D) WT hayvanları ve N = 3 (n = 36 NMJ) Smn2B / - ve N = 3 (n = 55 NMJ) ColQ Dex2 / Dex2 fareleri analiz edildi (B, D). (E, F) Sinaptik vezikül glikoprotein 2 (SV2, kırmızı) ve α-bungarotoksin-F488 (α-BTX, yeşil) (E) karşı antikorlarla etiketlenmiş 3 haftalık WT ve Smn2B / - farelerin TA'sından NMJ'lerde akson terminal doluluğunun temsili görüntüleri ve NMJ doluluk sonuçları (SV2 / AChR hacim oranı) (F). N = 3 (n = 50 NMJ) vahşi tip ve N = 4 (n = 62 NMJ) Smn2B / - farelerden gelen kaslar analiz edildi. Veriler fare (nokta) başına ortalama değer SEM ± olarak ifade edilmiştir. Gruplar arasındaki farklar Mann-Whitney testi ile analiz edilmiştir (* p < 0.05). Ölçek çubukları 20 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
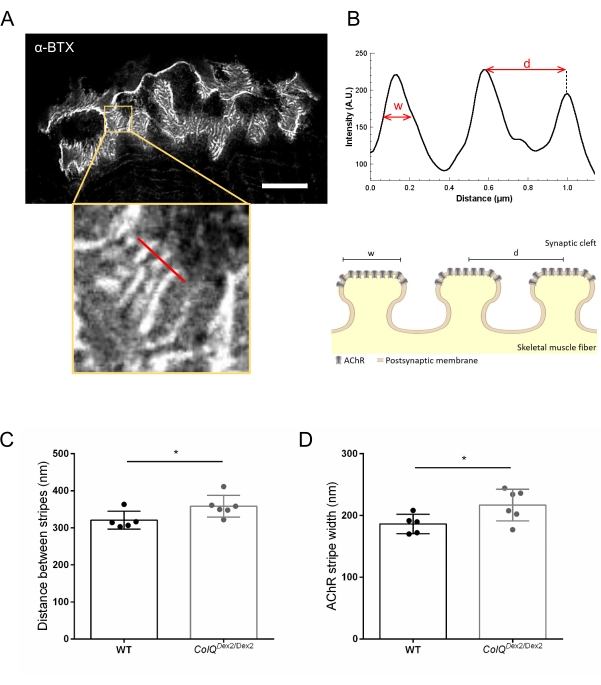
Şekil 4: NMJ postsinaptik uç plakalarının STED görüntülemesi. (A) Postjunctional AChR çizgilerini gösteren 6 haftalık vahşi tip bir farenin gastroknemisinden α-bungarotoksin-F633 (α-BTX) ile etiketlenmiş bir NMJ'nin temsili STED görüntüsü (ölçek çubuğu 5 μm'dir). (B) Yoğunluk profilini oluşturmak için kullanılan AChR çizgili (alt panel) bir bölgenin daha yüksek büyütülmesi. AChR çizgilerinin genişliği (w) ve bu bölgenin iki bitişik şeridi (d) arasındaki mesafe ölçülmüş ve çubuk grafikte sunulmuştur. AChR şerit genişliğini (w) ve mesafeyi (d) göstermek için postsinaptik uç plakanın şematik gösterimi. Bu parametreler, (C) AChR şerit mesafesi ve (D) genişliği, ColQDex2 / Dex2 farelerinde ölçüldü ve 6 haftalıkken çöp arkadaşlarını kontrol etti. 5 WT (toplam n = 29 NMJ) ve 6 ColQDex2 / Dex2 (toplam n = 43 NMJ) hayvanından NMJ'ler körü körüne analiz edildi. Veriler fare başına ortalama (nokta) ± SEM olarak ifade edilmiştir. Gruplar arasındaki istatistiksel farklılıklar Mann-Whitney testi kullanılarak analiz edilmiştir (* p < 0.05). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: LAS X yazılımının ve konfokal edinimler için parametrelerin piyasaya sürülmesi. Konfokal görüntüler elde etmek için çeşitli adımlar, protokolün 3.1.2 ila 3.1.7 bölümlerinde açıklanmıştır. Her NMJ yığın alımı için bir proje açılır (adım 3.1.4) ve görüntü boyutu, alma hızı, X, Y ve Z eksenleri parametreleri seçilir (adım 3.1.7), her sıralı tarama belirtilir (SEQ.1, DAPI için lazer 405; Seq.2, α-BTX-F488 için lazer 488; ve Seq.3, F594 konjuge sekonjuge sekonder antikorlar için lazer 552). Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: LAS X yazılımının lansmanı ve STED alımları için parametreler. STED görüntülerini edinme adımları, protokolün 3.2.2 ila 3.2.8 bölümlerinde açıklanmıştır. Mikroskop STED ON yapılandırma modunda başlatılır (adım 3.2.2) ve bir proje açılır (adım 3.2.3). Her sıralı taramada görüntü alma parametreleri (adım 3.2.7) (görüntü boyutu, yakalama hızı, Yakınlaştırma faktörü, X ekseni) belirtilir (α-BTX-F633 için Seq.1; F488 konjuge sekonjuge sekonder antikorlar için Seq.2). Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 3: STED mikroskobu ile elde edilen α-BTX boyalı bileşke kıvrımlarının görüntüleri. Doğru (sol) veya yanlış bir odaklanma (sağ) ile edinilen 6 haftalık vahşi tip bir fareden α-BTX-F633 ile etiketlenmiş bir postsinaptik uç plakanın görüntü örnekleri. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 4: Özel ImageJ makroları tarafından elde edilen giriş ve çıkış verilerini açıklayan Windows açılır pencereleri. NMJ görüntülerinin giriş verisi örnekleri (.tif ve .lif dosyaları) sol sütunda gösterilir. Makrolardan (sağ sütun) alınan çıktı verileri, birleşim resimlerini (Save_Volume) içeren klasörlere (Save_Accu, .tif) ve sonuçları içeren veri sayfalarına (.csv dosyaları) kaydedilir. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 5: LAS X yazılımı kullanılarak STED alımından AChR şerit mesafesi ve genişliği analizi. NMJ STED görüntülerini analiz etme adımları protokolün 5. bölümünde açıklanmıştır. A) AChR çizgileri içeren etiketli bir postsinaptik uç plaka bölgesinin görüntüsü. Şerit analizi için ilgi alanı, dikey bir çizgi (şerit mesafesi için yeşil çizgi) veya dikey bir dikdörtgen (şerit genişliği için mor dikdörtgen) çizilerek seçilir. (B, C) AChR şeritleri (B) ile AChR şerit genişliği (C) arasındaki mesafeyi hesaplamak için seçilen bölgelerin yoğunluk profilleri ve ölçümleri gösterilir. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Kodlama Dosyası 1: Macro_NMJ_VOL_Marinelloetal. NMJ parametre ölçümlerini (NMJ hacmi, MIP uç plaka alanı ve NMJ kıvrımlılığı) ayıklamak için ImageJ özel makrosu. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Kodlama Dosyası 2: Macro_NMJ_ACCU_Marinelloetal. NF-M birikimini ve SV2 boyamasını ayıklamak için ImageJ özel makrosu. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Açıklanan video protokolü, sinaptik öncesi ve sonrası seviyelerde patolojik değişiklikleri karakterize etmek için kullanılabilecek konfokal ve STED mikroskopiyi birleştirerek nöromüsküler kavşakların 3D yapısını ölçmek için ayrıntılı bir yöntem sağlar. STED mikroskobunun yüksek çözünürlüğü, geleneksel konfokal görüntüleme ile tanımlanamayan nanoyapıların görselleştirilmesine ve morfometrik analizine izin verir. Bu prosedür, SMA ve ColQ ile ilişkili CMS farelerinin tibialis anterior ve gastroknemius olmak üzere iki apandiküler kastaki NMJ'lerin yapısal değişikliklerini ölçmemizi sağladı.
Bu teknikle güvenilir sonuçlar elde etmek için, kasları düzgün bir şekilde parçalamak ve kızdırmak, kası çevreleyen fasyaya ve kas demetlerini ayırmak için uygulanan güce özellikle dikkat etmek çok önemlidir; Aksi takdirde, innervasyon paterni bozulabilir ve uygun presinaptik NMJ değerlendirmesini engelleyebilir. NMJ'leri TA ve GA'dan analiz etmek için ayrıntılı bilgi sağlanmasına rağmen, prensip olarak, bu protokol, diyafram veya enine abdominis37 gibi düz kaslar da dahil olmak üzere diğer kaslara uyarlanabilir. Doku fiksasyonu, kaliteli boyama sağlamak için de çok önemlidir; bu nedenle, uygun bir hacimde (kasın 15-20 katı) yüksek kaliteli PFA kullanılması önerilir. Ek olarak, fiksatif maruz kalma süresi önemli bir adımdır, çünkü büzülme ve kümelenme gibi artefaktlar aşırı fiksasyon nedeniyle ortaya çıkabilir ve NMJ özelliklerini etkileyebilir. Numunelerin büyüklüğü ve paraformaldehit çözeltisinin dokulardaki penetrasyon hızı38 göz önüne alındığında, bu tip kas için 18-24 saatlik bir fiksasyon süresi önerilir. Boyama adımının doku hasadından bir haftadan fazla bir süre sonra planlanması durumunda, bakteriyel çoğalmayı önlemek için PBS'de PFA ile sabitlenmiş kasların sodyum azid ile desteklenmiş 4 ° C'de tutulması önerilir.
Bu protokol, konfokal için α-BTX-F488 ve STED görüntüleme için α-BTX-F633 kullanan bir yaklaşım sunar. Bu floroforlar, tarif edilen deneysel tasarıma uyacak şekilde seçilmiştir, ancak mevcut ekipman ve malzemelere göre değiştirilebilir. Örneğin, görüntü alma ve niceleme için STED CW 592 nm lazer kullanılırken α-BTX F488 etiketleme seçilebilir. Bununla birlikte, bu çalışmada uygulanan konfigürasyonun (darbeli uyarma kapılı STED, 775 nm tükenme) sürekli dalga STED39 gibi diğer yaklaşımlardan daha yüksek performans ve daha iyi çözünürlük sergilediği ve mevcut uygulama için daha uygun hale getirdiği görülmektedir. Özellikle STED (hem uyarma hem de tükenme) için lazer güç ayarlarının dikkatlice seçilmesi de önemlidir, çünkü bir yoğunluk profilinin özellikleri doygunluk durumunda ölçülemez ve bu nedenle bir NMJ görüntüsündeki herhangi bir doymuş sinyal tüm analizi tehlikeye atabilir.
Mikroskop yazılımı ve ImageJ makroları kullanılarak görüntü yakalama ve analiz dahil olmak üzere bu ayrıntılı iş akışı, tek bir kastan konfokal ve STED mikroskobu ile otonom NMJ morfometrik analizini kolaylaştırmak için geliştirilmiştir. NMJ-morph2 veya NMJ-Analyser14 gibi NMJ konfokal analizi için daha önce tanımlanmış iş akışları, NMJ'lerin morfolojik analizini ve karşılaştırmalı çalışmaları kolaylaştıran yarı otomatik yöntemlerin tasarımının yolunu açtı. NMJ-morph (ve güncellenmiş sürümü aNMJ-morph15), 21 morfolojik özelliği ölçmek için maksimum yoğunluk projeksiyonunu kullanan ücretsiz bir ImageJ tabanlı platformdur ve NMJ-Analyser, Python'da geliştirilen ve tüm 3D NMJ yapısından 29 ilgili parametre üreten bir komut dosyası kullanır. El ile eşikleme, kullanıcı analizi gerektiren bu iki yöntemde görüntü işleme sırasında tek adımdır. Bu entegre protokol, doku hazırlama, 3D konfokal görüntü alımları ve tüm iskelet kaslarından NMJ'lerin ImageJ tabanlı işlenmesi için adımları detaylandırır ve postsinaptik (hacim, maksimum projeksiyon alanı ve kıvrımlılık) ve presinaptik (akson terminal doluluk ve nörofilament birikimi) uç plakalarının beş önemli parametresine basitleştirilmiş bir genel bakış sağlar. Ek bir biyolojik alaka parametresi olan postsinaptik bileşke kıvrımlarının AChR organizasyon paterni, süper çözünürlüklü STED mikroskopisi (çözünürlük 20-30 nm)40 ile nano ölçekte morfometrik analiz için dahil edilmiştir. İlginçtir ki, STED görüntüleme için doku hazırlığı, NMJ ultrastrüktürel çalışmaları için kullanılan geleneksel transmisyon elektron mikroskobu (TEM)9 gibi diğer yöntemlerden daha basittir; bu, uygun kas bölgesinin ultra ince kesitlerini elde etmek için yetenekli bir manipülatör gerektiren oldukça karmaşık ve zaman alıcı bir prosedürdür. Ek olarak, çoklu bağlantı kıvrımlarından elde edilen nicel veriler, STED ile ilişkili yazılım kullanılarak otomatik olarak elde edilebilir.
Bu protokol, SMN ve ColQ eksikliği olan kaslarda20,36,41,42 daha önce bilinen NMJ defektlerini göstermek için uygulandı. İki fare modelinde konfokal mikroskopi ile postsinaptik uç plaka hacminin azalması, MIP alanı ve göreceli kıvrımlılık ve artmış nörofilament birikimi gibi yaygın değişiklikler bulunurken, bazı daha spesifik bulgular (azalmış NMJ doluluğu), bozulmuş vezikül kaçakçılığının bir göstergesi olarak sadece SMA farelerde gözlenmiştir36. Son olarak, daha önce TEM20 tarafından gözlemlendiği gibi, postsinaptik bileşke kıvrımlarındaki ultrayapısal kusurların belirtileri olan STED analizi ile ColQ-KO'da AChR şerit mesafesi ve genişliğinde bir artış tespit edildi. Önemli olarak, bu protokol gelişim, bakım sırasında ve çeşitli patolojik koşullar altında nöromüsküler kavşakların daha derinlemesine morfolojik karakterizasyonuna yardımcı olabilir.
Açıklamalar
Yazarlar bu çalışma ile ilgili herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Genethon'un "Görüntüleme ve Sitometri Çekirdek Tesisi" nin yanı sıra kısmen Ile-de-France Bölgesi, Conseil General de l'Essonne, Evry Genopole Recherche, Evry Val d'Essonne Üniversitesi ve INSERM, Fransa'dan ekipman fonları tarafından desteklenen histoloji servisine teşekkür ederiz. Ayrıca Smn 2B/2B fare hattını (Ottawa Üniversitesi, Kanada) sağladığı için Dr. Rashmi Kothary'ye ve ColQDex2/+ fare çizgisi için Dr. Eric Krejci'ye (yayınlanmamış, Paris Üniversitesi, Fransa) minnettarız. Guillaume Corre'a istatistiksel analizdeki desteği için teşekkür ederiz. 2H3 (Jessel, TM ve Dodd, J. tarafından geliştirilmiştir) ve SV2 (Buckley, K.M. tarafından geliştirilmiştir) monoklonal antikorları, NIH'nin NICHD'si tarafından oluşturulan ve Iowa Üniversitesi, Biyoloji Bölümü, Iowa City, IA 52242'de sürdürülen Gelişimsel Çalışmalar Hibridoma Bankası'ndan (DSHB) elde edilmiştir. Bu çalışma Association Française contre les Myopathies (AFM-Telethon), INSERM ve Evry Val d'Essonne Üniversitesi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
Referanslar
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304(2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671(2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677(2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220(2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251(2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128(2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- ImageJ. , Available from: http://imagej.nih.gov/ij (2021).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Bio-Formats. , Available from: http://www.openmicroscopy.org/bio-formats/downloads/ (2021).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, Supplement C 253-261 (2013).
- ImageJ documentation. , Available from: http://imagejdocu.tudor.lu/plugin/analysis/geodesic_distances/start (2021).
- GitHUb. , Available from: https://github.com/Genethon/ImCy (2021).
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162(2014).
- Baker, J. R. Principles of biological microtechnique; a study of fixation and dyeing. , Wiley. London Methuen; New York. at http://archive.org/details/principlesofbiol01bake (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421(2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644(2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605(2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır