Method Article
결합된 공초점 및 초분해능 현미경에 의한 마우스의 신경근 접합부 특성 분석
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 SMA 및 ColQ 관련 CMS의 마우스 모델에서 병리학 적 변화를 정량화하는 데 사용되는 컨 포칼 및 STED 현미경을 결합하여 신경근 접합부의 형태 측정 분석 방법을 설명합니다.
초록
신경근 접합부(NMJ)는 하부 운동 뉴런과 골격근 섬유 사이의 고도로 전문화된 시냅스로, 신경계에서 자발적인 근육으로 분자를 전달하여 수축을 유도하는 데 필수적인 역할을 합니다. 그들은 Duchenne 근이영양증 (DMD), 선천성 중증 증후군 (CMS), 척수성 근육 위축 (SMA) 및 근 위축성 측삭 경화증 (ALS)과 같은 유전성 신경근 질환을 포함한 많은 인간 질병의 영향을받습니다. 따라서 신경근 접합부의 형태와 질병 마우스 모델의 변화를 모니터링하는 것은 병리학 적 연구 및 치료 접근법의 전임상 평가에 유용한 도구입니다. 여기에서는 쥐 놀림받은 근육 섬유로부터 모터 종판의 시냅스 전 및 시냅스 후 부분의 3차원(3D) 형태를 라벨링하고 분석하는 방법을 설명합니다. 샘플을 준비하고 컨포칼 이미징으로 NMJ 부피, 면적, 비틀림 및 축삭 말단 형태/점유를 측정하는 절차와 초고해상도 유도 방출 고갈(STED) 현미경으로 시냅스 후 접합 주름과 아세틸콜린 수용체(AChR) 스트라이프 너비 사이의 거리가 자세히 설명되어 있습니다. 이러한 NMJ 파라미터의 변화는 SMA 및 CMS의 영향을 받는 돌연변이 마우스에서 예시된다.
서문
신경근 접합부 (NMJ)는 운동 축삭 말단, 시냅스 슈반 세포 및 화학 정보의 전달 및 하부 운동 뉴런 활동의 근육 수축에 관여하는 골격 근섬유 부분으로 구성된 복잡한 구조입니다. 포유류에서 신경근 접합부의 형태는 발달 중에 변화하여 성숙 후 전형적인 프레즐과 같은 모양을 채택하고 종마다 모양과 복잡성이 다르며 운동이나 노화와 같은 생리적 과정에 반응하여 어느 정도의 가소성을 보입니다 1,2,3,4 . 시냅스 후 모터 종판은 접합 주름이라는 막 침입을 형성하며, 여기서 아세틸 콜린 수용체 (AChR)를 포함하는 상부는 시냅스 전 말단 축삭 가지5와 밀접하게 접촉합니다.
신경근 접합부의 형태학적 및 기능적 변화는 척수성 근위축증(SMA) 및 근위축성 측삭 경화증(ALS)과 같은 여러 신경퇴행성 장애, 뒤셴 근이영양증(DMD)과 같은 근병증, 선천성 근무력증 증후군(CMS), 중증 근무력증(MG) 및 중핵 근병증(CNM), 및 노화 관련 근감소증 3,6,7,8,9, 10,11,12. 이러한 질병에서 종판 단편화, 감소된 시냅스 후 접합 접힘 크기 및/또는 탈신경과 같은 NMJ 구조적 변화가 관찰됩니다. NMJ의 병리학은 질병 진행 중 1 차 또는 초기 사건이거나 최근에는 임상 증상에 기여하는 2 차 사건으로 나타날 수 있습니다. 어쨌든 이러한 질병의 동물 모델에서 NMJ의 형태를 모니터링하는 것은 병리학 적 변화를 연구하고 잠재적 인 치료의 효능을 평가하는 데 중요한 매개 변수입니다.
신경근 접합부의 형태는 일반적으로 공초점 현미경 2,13,14,15 또는 전자 현미경 5,16을 사용하는 기술로 분석되며 각각 분해능 또는 기술적 어려움과 같은 고유 한 한계가 있습니다. 보다 최근에는 전자 현미경에 의한 미세 구조 분석에 대한 대안 또는 보완적인 접근 방식으로 시냅스 전 활성 영역 또는 시냅스 후 막16,17,18의 AChR 분포와 같은 NMJ의 특정 영역을 시각화하는 데 초 고해상도 현미경도 사용되었습니다.
이 프로토콜은 형광 공초점 및 유도 방출 고갈(STED) 현미경을 결합하여 NMJ 형태학적 매개변수를 평가하는 상세하고 재현 가능한 방법을 제공하는 것을 목표로 합니다. 마우스 비복근 및 전방 경골의 신경분포된 괴로운 근육 섬유의 부피, 면적, 상대 비틀림, AChR 스트라이프 너비 및 축삭 말단 분포와 같은 시냅스 전 및 시냅스 후 말단판의 중요한 특징은 정상 및 질병 상태의 맥락에서 정량화되었습니다. 특히, NMJ 결함은 SMN1 유전자 11,19의 돌연변이에 의해 유발되는 운동 뉴런 변성을 갖는 신경근 질환인 척수성 근위축증의 Smn 2B/- 마우스 모델에서 예시되었으며, 비대칭 아세틸콜린에스테라아제 녹아웃(ColQ Dex2/Dex2 또는 ColQ-KO) 마우스의 콜라겐 유사 꼬리 서브유닛에서, 선천성 근무력증증후군 20의 모델로서 , 21,22.
프로토콜
마우스의 관리 및 조작은 동물 실험에 관한 국가 및 유럽 법률에 따라 수행되었으며 기관 윤리위원회의 승인을 받았습니다. 각각 3주령 및 6주령의 Smn2B/- (C57Bl/6J 배경) 및 ColQDex2/Dex2 (B6D2F1/J 배경) 마우스의 수컷 및 암컷을 연구에 사용하였다.
1. 생쥐의 안락사와 근육의 해부 : 전방 경골 및 비복근
- 자궁 경부 탈구에 의한 안락사 전에 케타민 (87.5 mg / kg) / 자일라진 (12.5 mg / kg) 혼합 용액 (0.1 mL / 체중 20 g)을 복강 주사하여 마우스 마취를 진행하십시오.
참고: SMA 및 ColQ-CMS는 성별과 독립적으로 개인에게 영향을 미치기 때문에 현재 프로토콜에서 수컷 및 암컷 마우스를 사용했습니다. - 작은 전기 면도기를 사용하여 뒷다리 털을 제거하고 70 % 에탄올로 다리를 헹굽니다.
알림: 해부 절차는 근육마다 다릅니다. 전방 경골 (TA)의 해부는 1.2.1-1.2.3 단계를 따르고 비복근 (GA) (내측 및 측면 부분)의 경우 1.2.4-1.2.6 단계를 따르십시오. 근육을 부드럽게 다루어 조직 손상을 방지하고 해부 중에 근육을 부수거나 늘리십시오.- 마우스를 앙와위 자세로 놓습니다.
- 근육을 노출시키기 위해 경골과 평행 한 원위 뒷다리의 앞쪽 외부 부분을 따라 날카로운 무딘 가위로 5mm의 피부 절개를하십시오. 초박형 가위를 사용하여 근막을 제거하십시오.
- 초박형 가위와 구부러진 얇은 집게를 사용하여 원위 힘줄 (발 가까이)을 먼저 자른 다음 근위 힘줄 (무릎 가까이)을 자릅니다. 근섬유와 신경의 손상을 피하기 위해 근육을 조심스럽게 다루십시오.
알림: 근위 힘줄은 전체 근육을 수확하기 위해 가능한 한 뼈에 가깝게 절단되어야 합니다. - 마우스를 엎드린 자세로 놓고 날카로운 무딘 가위를 사용하여 원위 뒷다리 뒤쪽 구획의 윗부분에서 발까지 피부 절개를하고 피부를 제거하십시오.
- 중간 톱니 모양의 집게로 아킬레스 건을 잡고 초박형 가위로 자르고 GA를 주변 조직에서 근위 삽입으로 부드럽게 분리합니다.
- 근위부에서 중간 톱니 모양의 집게를 대퇴 이두근(BF)과 GA 사이에 형성된 주머니에 삽입합니다. 두 근육을 분리하여 가늘어진 가위로 뼈 삽입에 최대한 가깝게 GA 힘줄을 자릅니다.
- 조직 고정을 위해 각 근육을 인산염 완충 식염수(Ca 2+Mg 2+가 없는 PBS)에 희석한 4% w/v 파라포름알데히드(PFA) 용액 1mL가 들어 있는 2mL 미세 원심분리 튜브에 넣고 4°C에서18-24시간 동안 유지합니다.
주의 : 파라 포름 알데히드 및 포름 알데히드는 독성이 있으므로 적절한 보호 장비가있는 화학 흄 후드에서 취급해야합니다. - 다음날, 화학 흄 후드 내부의 실온(RT)에서 부드럽게 흔들어 12웰 플레이트에서 PBS로 고정된 근육을 3회 5분 동안 씻습니다.
참고: 이 단계에서 프로토콜을 중지하고 한 달 이내에 계속할 수 있습니다. 이 경우 0.01% 아지드화나트륨이 보충된 PBS를 첨가하여 샘플을 4°C에서 보관합니다. - 두 개의 미세한 톱니 모양의 집게를 사용하여 약 1mm 너비의 작은 섬유 다발로 각 근육을 애타게합니다.
알림: 놀리는 동안 조직 손상을 방지하기 위해 과도한 힘없이 집게로 근육을 매우 부드럽게 조작하는 것이 중요합니다.- TA 근육을 크기에 따라 3 개 또는 4 개의 묶음으로 분리하십시오.
- GA의 경우 근육의 내측 및 외측 부분을 분리 한 다음 각 부분을 크기에 따라 4-5 묶음으로 분리하십시오.
2. 면역염색
- 근육 섬유 투과화 진행: 근육 다발을 PBS에 1%(v/v) Triton X-100이 포함된 24웰 플레이트로 옮기고 RT에서 1시간 또는 4°C에서 5시간 동안 부드러운 교반(50rpm) 상태로 유지합니다.
참고: 근육 다발을 두 개의 플레이트로 나누어 별도의 면역 염색을 진행하고 항체 혼동의 위험을 최소화합니다. 두 개 이상의 우물 (1 웰 / 플레이트)로 나누지 마십시오. 그렇지 않으면 분석 된 근육에서 일반적인 상태를 나타내는 NMJ의 수 (N)가 충분하지 않을 수 있습니다. - 샘플을 RT에서 PBS로 5 분 동안 3 회 세척하고 PBS / Triton X-100 1 %의 4 % 소 혈청 알부민 (BSA)으로 구성된 차단 용액으로 4 ° C에서 4 시간 동안 부드러운 교반 (50rpm)하에 배양합니다.
알림: 세척 단계에서 흡인 펌프를 사용하지 말고 200μL 피펫과 작은 팁으로 용액을 수동으로 흡입하십시오(참조는 재료 표에 표시됨). - 뉴로필라멘트 M(NF-M, 2H3, 희석 1/200) 또는 시냅스 소포 당단백질 2(SV2, 희석 1/200)에 대한 1차 단클론 항체를 포함하는 단계 2.2에 표시된 차단 용액으로 4°C에서 밤새(O/N) 배양하여 각각 시냅스 전 축삭 말단 또는 활성 영역을 표지합니다.
- 다음날, 근육 다발을 교반 (50 rpm) 하에서 PBS에서 5 분 동안 3 회 세척한다.
- 컨포칼 이미징의 경우: 적색 방출 형광단(F594)(희석 1/500) 및 녹색 방출 형광단(α-BTX-F488)(희석 1/1000)과 접합된 α-붕가로톡신과 접합된 2차 항-마우스 항체와 근육 다발을 교반(50rpm) 하에 RT에서 2시간 동안 PBS에서 배양합니다.
- STED 영상의 경우: 녹색 방출 형광단(F488)(희석 1/500) 및 높은 광안정성을 특징으로 하는 원적색 방출 형광단과 접합된 α-붕가로톡신(α-BTX-F633)(희석 1/1000)과 접합된 2차 항-마우스 항체와 근육 다발을 교반(50rpm) 하에 RT에서 2시간 동안 PBS에서 배양합니다.
알림: 광표백을 방지하기 위해 배양 중에 샘플을 빛에 노출시키지 마십시오.
- 라벨이 붙은 근육 다발을 교반 (3rpm) 하에서 PBS로 5 분 동안 50 회 세척하고 장착 매체가있는 슬라이드에 놓습니다.
알림: 밀봉을 허용하기 위해 슬라이드 당 최대 4-5 개의 근육 다발을 놓습니다. - 상단에 #1.5(또는 #1.5H) 등급 유리 커버슬립(두께 0.17mm)을 추가하고 슬라이드 양쪽에 원통형 자석을 놓아 압력을 가하고 근육을 평평하게 합니다.
- 슬라이드를 4°C에서 O/N의 빛으로부터 보호하십시오. 매니큐어로 슬라이드를 영구적으로 밀봉하십시오.
3. 이미지 획득
- 컨포칼 현미경을 통한 획득
참고: 이미지는 63x 크기 오일 이멀젼 대물렌즈(HCX Plan Apo CS, 1.4 개구수(NA))를 사용하여 도립 레이저 스캐닝 컨포칼 현미경으로 수집되었습니다.- 맹검 분석의 경우 분석에 관여하지 않은 사람이 주어진 번호로 각 슬라이드를 코딩하도록하십시오. 모든 샘플에 대해 NMJ 파라미터의 정량화가 완료될 때까지 실험 그룹에 대해 블라인드 상태를 유지합니다.
- machine.xlhw> 구성 모드에서 현미경 소프트웨어를 실행합니다(보충 그림 1).
- 슬라이드를 현미경 스테이지에 놓고 DAPI 필터 세트를 사용하여 DAPI 광시야 형광 조명 아래를 확인하여 샘플 내에서 관찰 평면을 찾습니다.
- 새 프로젝트 열기> 클릭하고 이미지 획득을 저장할 폴더를 만듭니다(보충 그림 1).
참고: 각 NMJ에 대해 새 프로젝트를 만들어 폴더 크기를 제한하고 컴퓨터 메모리 문제를 방지합니다. - 획득 파라미터를 관리하려면 획득 탭 창을 클릭하고 컨포칼 핀홀을 1.0 Airy 유닛으로 설정하고 레이저 파워를 설정하여 이미징해야 하는 엔드플레이트에서 488nm 레이저를 사용하여 그린/F488(α-BTX) 형광의 게인 및 오프셋 레벨을 최적화합니다(라이브 모드 켜짐).
- 다음으로, F594 관찰에 적합한 레이저를 사용하여 적색/F594(NF-M 또는 SV2) 형광 획득을 최적화합니다. 이 연구에서는 552nm 레이저를 사용했습니다 (라이브 모드 ON). 각 레이저에 대해 다음 범위로 염료 방출 스펙트럼을 설정하십시오 : 레이저 405 (DAPI) 414에서 483 nm, 레이저 488 (F488-α-BTX) 506-531 nm, 레이저 552 (NF-M / SV2) 622-650 nm.
- 400Hz 샘플링 속도에서 이미지 크기 1024 x 1024픽셀(73.7 x 73.7μm), 양방향 X ON, 줌 계수 2.5, Z-와이드 모드에서 Z-스텝 크기 0.5μm와 같은 설정으로 각 실험 그룹에서 신경근 접합부의 이미지 스택을 수집합니다.
참고: 각 NMJ에 대해 슬라이스 수는 전체 접합을 획득하도록 설정됩니다. 위에서 설명한 획득 설정은 나이퀴스트-샤논 샘플링 정리를 충족합니다. 그러나 사용자는 모든 최신 공초점 운영 소프트웨어에 있는 형식 최적화 버튼을 클릭하여 픽셀 크기와 Z 단계가 이상적인 나이퀴스트 샘플링 속도를 충족하는지 확인할 수 있습니다. 이렇게 하면 과대 샘플링되거나 과소 샘플링된 이미지를 방지하여 볼륨 측정의 정확도가 손실됩니다. - 원본 파일(.lif) 또는 Z 스택 이미지(.tif)를 슬라이드의 코드 이름, 염색 유형 및 종판 번호가 포함된 이름의 폴더에 저장합니다.
참고: F488 및 552nm 레이저(F488 및 F594)를 사용하여 순차적으로(동시에가 아님) 스캔을 수집하여 F488 형광이 F594 채널로 또는 그 반대로(블리드 스루) 혼선을 방지합니다. 주의: 빔 경로는 현미경 소프트웨어에서 염료 보조제로 구성할 수 있습니다. - 코딩된 다음 슬라이드로 변경하고 각 NMJ에 대해 3.1.3-3.1.8단계를 반복합니다.
- 세션이 끝나면 3D 뷰어에서 열기 를 클릭하고 실험 그룹의 NMJ 대표를 선택하여 3D 라벨링을 시각화합니다.
참고: 이 보기 모드는 획득 매개변수가 올바른지 확인하는 데 도움이 됩니다. - 현미경 소프트웨어를 닫고 렌즈 티슈로 대물렌즈를 청소한 다음 시스템을 끕니다.
- STED 현미경을 통한 획득
참고: 이미지는 100x 오일 이멀젼 대물렌즈(HC PL APO CS2 1.4 NA)를 사용하여 775nm에서 Gated STED가 장착된 도립 레이저 스캐닝 컨포칼 현미경으로 수집되었습니다.- 맹검 분석의 경우 분석에 관여하지 않은 사람이 주어진 번호로 각 슬라이드를 코딩하도록하십시오. 모든 샘플에 대해 NMJ 파라미터의 정량화가 완료될 때까지 실험 그룹에 대해 블라인드 상태를 유지합니다.
- machine.xlhw 및 STED ON> 구성 모드에서 현미경 소프트웨어를 실행합니다(보조 그림 2).
- 프로젝트 > 새 프로젝트 열기 를 클릭하여 이미지 획득을 저장할 폴더를 만듭니다.
참고: 각 슬라이드에 대해 새 폴더를 생성하여 폴더 크기를 제한하고 컴퓨터 메모리 문제를 방지합니다. - 슬라이드를 현미경 스테이지에 놓고 488nm 레이저를 사용하여 광시야 형광 조명 아래에서 보고 샘플 내에서 관찰 평면을 찾습니다.
- 506-531 nm의 스펙트럼 검출과 함께 488 nm 레이저를 사용하여 신경 섬유 M (NF-M) 또는 SV2 염색으로 표지 된 NMJ를 검색하십시오.
- NMJ가 식별되면 STED 활성화 를 클릭하고 640-750nm의 스펙트럼 검출이 있는 635nm 레이저를 사용하여 여러 접합 주름(보충 그림 3)이 포함된 영역에서 이미지 수집을 시작합니다.
참고: 이미지 획득 중에 채도 조회 테이블에 주의하고 빠른 LUT 버튼을 클릭하여 과다 노출을 방지합니다(회색 값 >255, 8비트의 경우). - 400Hz 샘플링 속도에서 이미지 크기 2048 x 2048픽셀(38.75 x 38.75μm)과 같은 설정으로 각 실험 그룹의 이미지를 수집합니다.
참고: 공핍 레이저(STED) 전력은 65%로 설정되어 있습니다. - 슬라이드 코드가 포함된 파일 이름으로 이미지를 저장합니다.
참고: 최적화된 XY 형식: 형식 설정을 클릭하여 STED 이미징에서 최상의 획득 설정을 얻을 수 있습니다. - 코딩된 다음 슬라이드로 변경하고 3.2.3-3.2.8단계를 반복합니다. 모든 슬라이드에 대해 이 절차를 반복합니다.
- STED 현미경 세션이 끝나면 이미지 파일을 다른 컴퓨터로 전송하고 원본 파일을 저장합니다(. LIF)를 외장 드라이브 또는 서버에 저장합니다.
- 현미경 소프트웨어를 끄고 렌즈 티슈로 대물렌즈를 청소한 다음 시스템을 끕니다.
4. 이미지 분석 - 컨포칼 현미경
참고 : 모든 이미지는 Microsoft Windows 10 전문 운영 체제를 사용하는 컴퓨터에서 처리되었습니다.
- ImageJ 및 사용자 지정 매크로를 실행하여 시냅스 후 NMJ 엔드플레이트 부피, 최대 강도 투영(MIP) 영역 및 상대 비틀림을 계산합니다.
- NIH ImageJ 프리웨어23, iGeodesic 플러그인 및 사용자 지정 매크로를 사용하여 NMJ 이미지 스택을 처리하여 NMJ 매개 변수 측정을 얻습니다. ImageJ 소프트웨어를 실행합니다.
참고: 최신 버전의 ImageJ는 무료로 사용할 수 있으며24를 다운로드할 수 있습니다. 독점 파일 형식을 열려면 Bio-Formats 패키지25 플러그인을 다운로드해야합니다26 . 플러그인이 이미 소프트웨어에 설치되어 있기 때문에 운영자가 피지를 사용하는 경우에는 이 단계가 필요하지 않습니다. 비틀림을 계산하기 위한 iGeodesic 플러그인(27 )은 또한 온라인(28)에서 이용가능하다; 사용할 ImageJ/피지 버전에서 이 플러그인의 가용성을 확인합니다. 맞춤형 매크로는 온라인에서도 사용할 수 있습니다29. - Macro_NMJ_VOL_Marinelloetal.ijm (사용자 정의, 보충 코딩 파일 1)을 ImageJ 창으로 끌어다 놓습니다. 매크로가 두 번째 창에서 열립니다. 이 새 창에서 매크로 > 매크로 실행을 클릭합니다.
참고: 매크로는 독점 및 TIFF 파일을 모두 처리할 수 있습니다. 파일은 다음 기준을 충족해야합니다 : 독점 파일 형식의 경우 폴더에 정렬 된 파일 당 하나의 접합 (즉, 이미지 스택) 만 저장하십시오. TIFF 이미지의 경우 파일은 지정된 접합(RGB TIFF)의 이미지 스택과 함께 각각 이름이 JunctionX (X는 NMJ 번호에 해당)인 하위 폴더가 포함된 폴더에 저장해야 합니다(추가 그림 4). - 분석해야 하는 Junction 하위 폴더가 포함된 기본 폴더를 선택하고 선택을 클릭합니다.
- 폴더 저장이라는 새 팝업 메뉴에서 저장 폴더를 선택하고 선택을 클릭합니다.
- 이미지 유형이라는 새로운 팝업 메뉴에서 Z 스택 획득의 형식을 선택합니다.
- 관심 염색에 해당하는 RGB 채널을 선택하고 XY 픽셀 크기와 Z 단계 (z)를 표시합니다. 매크로가 자동으로 분석을 수행합니다.
참고: 독점 파일 형식을 선택한 경우 매크로는 픽셀 크기와 Z 단계(z)를 직접 읽습니다. 그러나 사용자는 여전히 관심 채널(C1, C2 또는 C3)을 표시해야 합니다. 매크로는 저장 폴더의 각 접합 매개변수(엔드플레이트 볼륨, MIP 영역 및 비틀림)에 대한 데이터시트(.csv)를 제공합니다. 매크로는 또한 세 개의 . TIF 파일은 α-BTX 염색 Drawing_MaxprojX.tif, DrawingJunctionX.tif 및 MIP MaxprojX.tif의 경계에 해당합니다. 이러한 TIFF 파일은 획득의 품질을 확인하고 이미지 처리가 올바르게 수행되었는지 확인하기 위해 생성됩니다.
시냅스 후 NMJ 볼륨 (V) : 매크로는 단일 NMJ에서 이미지를 분리하고 시냅스 후 엔드 플레이트에 해당하는 α- 붕가 로톡신 F488 채널을 유지합니다. 스택은 스택의 중간 슬라이스에서 Otsu 임계값30 을 사용하여 세그먼트화됩니다. 결과 이진 이미지는 1픽셀 확장되며 입자 분석 기능은 감지된 각 개체의 엔드플레이트 영역을 측정하는 데 사용됩니다. 시냅스 후 NMJ 부피를 얻기 위해 매크로는 스택의 모든 측정 된 엔드 플레이트 영역을 합산하고 μm 단위의 Z 단계 값 (z)을 곱합니다.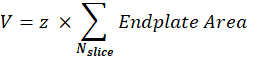
최대 강도 투영(MIP) 엔드플레이트 영역: 스택이 임계값이 지정된 후 Z-프로젝트 ImageJ 기능을 사용하여 최대 강도 투영(MIP)을 얻습니다. 그런 다음 입자 분석 기능을 사용하여 MIP 엔드플레이트 영역을 정량화합니다.
NMJ MIP 비틀림 (T) : 접힘 및 천공 (31)을 포함하는 시냅스 후 모터 엔드 플레이트의 복잡성 정도를 반영하는 NMJ 비틀림은 다음 공식을 사용하여 각 MIP를 기반으로 계산되며, 여기서 d Obj (AB)는 물체의 둘레를 따라 A와 B 사이의 거리이고 dEuc (AB )는 A와 B 사이의 유클리드 거리 (직선)입니다.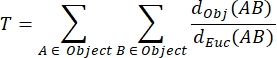
- 상대적인 NMJ 비틀림을 구하기 위해 각 실험 조건의 야생형 그룹에서 가장 높은 비틀림 값을 100%로 설정하고 실험 조건의 다른 모든 값을 이 값으로 정규화한다.
- NIH ImageJ 프리웨어23, iGeodesic 플러그인 및 사용자 지정 매크로를 사용하여 NMJ 이미지 스택을 처리하여 NMJ 매개 변수 측정을 얻습니다. ImageJ 소프트웨어를 실행합니다.
- ImageJ 및 사용자 지정 매크로를 실행하여 시냅스 전 신경섬유 축적 및 시냅스 소포 당단백질 2 염색을 정량화합니다.
참고: 신경섬유 축적(여기서, NF-M) 및/또는 시냅스 소포의 변경된 분포(여기서, SV2)는 비정상적인 축삭 수송 및/또는 손상된 소포 트래피킹의 마커이며, 이전에 다양한 SMA 마우스 모델32,33,34의 NMJ에서 관찰되었다.- Macro_NMJ_ACCU_Marinelloetal.ijm (사용자 정의, 보충 코딩 파일 2)을 ImageJ 창으로 끌어다 놓습니다. 매크로가 두 번째 창에서 열립니다. 이 새 창에서 매크로 > 매크로 실행을 클릭합니다.
참고: 매크로는 독점 파일 형식과 TIFF 파일을 모두 처리할 수 있습니다. 파일은 4.1.2단계 아래의 참고에 표시된 기준을 충족해야 합니다. - 분석해야 하는 Junction 하위 폴더가 포함된 기본 폴더를 선택하고 선택을 클릭합니다.
- 폴더 저장이라는 새 팝업 메뉴에서 저장 폴더를 선택하고 선택을 클릭합니다.
- 이미지 유형이라는 새로운 팝업 메뉴에서 Z 스택 획득의 형식을 선택합니다.
- 염색 정보 팝업에서 시냅스 전 및 시냅스 후 레이블과 색상을 표시하고 확인을 클릭합니다. 예를 들어, 시냅스 전 레이블: SV2 또는 NF, 시냅스 전 색상: R, 시냅스 후 레이블: BTX, 시냅스 후 색상: G.
참고: 독점 파일 형식의 경우 레이블과 해당 채널(C1, C2 또는 C3)을 표시해야 합니다. - 픽셀 크기 팝업에서 XY 픽셀 크기 0.072μm 및 Z 단계 0.5μm(z)를 표시하고 확인을 클릭합니다. 매크로가 자동으로 분석을 수행합니다.
참고: 이 매개변수는 컨포칼 현미경 획득 전에 선택한 이미지 크기 1024 x 1024픽셀(73.7 x 73.7μm)에 해당하며 대물렌즈 및 줌 설정과 상관 관계가 있습니다. 독점 파일 형식을 선택한 경우 매크로는 픽셀 크기와 Z 단계(z)를 직접 읽습니다. 매크로는 저장 폴더에 시냅스 전 및 시냅스 후 볼륨의 데이터시트(.csv)를 저장하며, 각각(시냅스 전 및 시냅스 후) 라벨링에 대한 현재 검출의 다중 페이지 TIFF 이미지를 저장합니다. 위에서 설명한 것처럼 이러한 TIFF 파일은 획득 품질을 확인하고 이미지 처리가 올바르게 수행되었는지 확인하기 위해 생성됩니다.
매크로는 α-bungarotoxin-F488 표지와 공동 국소화되는 NF-M-F594 채널의 축삭 신경 섬유 M 염색 (NF 부피)의 부피와 α-BTX-F488 표지와 공동 국소화되는 SV2-F594 채널에서 NMJ 시냅스 소포 당 단백질 2 염색 (SV2 부피)의 부피를 계산합니다. NF-M 축적은 아래와 같이 SV2와 α-BTX 부피의 비율로 NF 부피와 시냅스 후 종판 (α-BTX) 부피 및 NMJ 축삭 말단 점유 사이의 비율을 계산하여 정량화됩니다.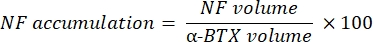
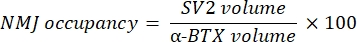
- Macro_NMJ_ACCU_Marinelloetal.ijm (사용자 정의, 보충 코딩 파일 2)을 ImageJ 창으로 끌어다 놓습니다. 매크로가 두 번째 창에서 열립니다. 이 새 창에서 매크로 > 매크로 실행을 클릭합니다.
5. 이미지 분석 - STED 현미경
참고: 이미지 처리는 STED 현미경 제조업체의 오프라인 소프트웨어로 수행되었습니다.
- 현미경 소프트웨어를 실행합니다.
- 프로젝트 열기 버튼을 클릭하여 프로젝트를 엽니다. 프로젝트 파일(.lif)을 선택하고 엽니다. 이미지가 이름과 함께 화면에 표시됩니다.
- 프로세스 창에서: 노이즈 감소 > 중앙값을 클릭합니다. 중간 창 하단에서 반경을 5.00으로, 반복을 1.00으로 설정하고 3D 필터링을 선택 취소합니다.
- 그런 다음 창의 왼쪽 위에 있는 프로젝트 열기 탭을 선택하고 이미지를 선택합니다.
- Apply( 적용 )를 클릭하여 매개 변수의 유효성을 검사합니다. "nameofimage_median001"라는 새 이미지가 만들어집니다.
참고: 적용 전 미리보기를 클릭하여 중앙값 필터의 효과를 모니터링할 수 있으며, 이는 이미지 대비를 향상시키고 정량화에 사용되는 선 프로파일을 부드럽게 합니다. - 5.4-5.5단계에 표시된 대로 모든 이미지에 필터를 적용합니다.
- Open Projects 탭에서 플로피 드라이브 아이콘을 클릭하여 새로 만든 필터링된 이미지를 포함하여 모든 프로젝트를 저장합니다.
참고: 다음 단계는 "nameofimage_median001"라는 필터링된 이미지를 사용하여 수행됩니다. - AChR 스트라이프 사이의 거리 계산
참고 : 접합 후 주름의 형태 변화는 NMJ 병리 (미성숙 또는 퇴행)의 징후로 신경근 장애에서 종종 관찰됩니다. α-bungarotoxin 염색으로 검출되는 AChR 스트라이프 사이의 거리(d)는 강도 프로파일을 생성하고 라인 프로파일을 그려 각 최대 강도 피크 사이의 거리를 정량화하여 계산됩니다(보충 그림 5).- 현미경 소프트웨어를 사용하여 중앙 창 상단의 정량화 메뉴를 선택합니다.
- 왼쪽 상단의 도구 탭을 클릭합니다. 왼쪽 상단 패널에서 강도를 선택하고 라인 프로필 아이콘을 클릭합니다. 오버샘플링 을 1로 설정하고 채널 정렬을 선택합니다.
- 프로젝트 열기 탭을 클릭하고 분석할 필터링된 이미지를 선택합니다.
참고: 컴퓨터 마우스로 스크롤하여 이미지를 확대할 수 있습니다. 이미지의 동적 범위는 표시된 이미지 옆의 왼쪽에있는 막대를 사용하여 수정할 수 있으므로 줄무늬를 쉽게 시각화 할 수 있습니다. - 그런 다음 오른쪽 창의 상단 메뉴에서 선 그리기 아이콘을 클릭하고 수직으로 여러 줄무늬/접합 접힘을 교차하는 선을 추적합니다.
알림: 강도 프로파일이 중앙 창에 표시됩니다. - 첫 번째 피크의 상단을 클릭하고 다음 최대 피크에 도달할 때까지 마우스 왼쪽 버튼을 누른 상태에서 마우스 포인터를 이동합니다.
참고: 정보는 강도 프로파일에 표시되고 두 피크 사이의 거리는 차트 아래에 "dx" 액면가로 표시됩니다. - 오른쪽 창의 이미지에있는 동안 마우스 오른쪽을 클릭하고 ROI 저장을 선택합니다. ROI 로드를 클릭하여 저장된 ROI(관심 영역)를 엽니다.
- 오른쪽 창의 왼쪽 상단에있는 화살표 아이콘을 클릭하고 ROI를 클릭 한 다음 빈 아이콘을 클릭하여 삭제하십시오.
- 분석된 근육의 전역 값을 나타내는 예측된 AChR 스트라이프 거리 수를 얻기 위해 다양한 강도 프로파일에서 필요한 만큼 이 작업을 반복합니다.
참고: 최적의 N 값은 그룹 간의 예상 차이, α 위험, 검정력 및 단측 또는 양측 검정을 기반으로 미리 계산할 수 있습니다. 현재의 실험 설계에서는 단측 Mann-Whitney 테스트 (α 위험 = 10 %; 전력 = 80 %)가 적용되었으며, N 값은 두 동물 그룹을 비교하기 위해 NMJ 당 최소 5 개의 AChR 스트라이프 거리로 추정되었습니다.
- AChR 스트라이프 폭
참고: 스트라이프 폭(w)은 α-BTX 신호 형광 값이 최대 강도의 절반인 지점 사이의 거리인 강도 프로파일의 전폭 반최대값(FWHM)에 해당합니다(보충 그림 5).- 현미경 소프트웨어를 사용하여 중앙 창에서 정량화 메뉴를 선택합니다.
- 왼쪽 상단의 도구 탭을 클릭합니다. 왼쪽 상단 패널에서 강도를 선택하고 FWHM 결정 아이콘을 클릭합니다. 틱 채널 정렬.
참고: 소프트웨어에서 피크 감지를 최적화하기 위해 Set Threshold(임계값 설정 )와 너비(Set Threshold) 를 각각 50과 3으로 설정했습니다. 각 실험에 대해 이러한 값을 조정하고 숙련된 이미징 과학자에게 조언을 구하십시오. - 프로젝트 열기 탭을 클릭하고 분석할 필터링된 이미지를 선택합니다.
참고: 컴퓨터 마우스로 스크롤하여 오른쪽 창에 표시된 이미지를 확대할 수 있습니다. 위에 표시된 대로(참고 5.8.3단계 다음) 최적의 스트라이프 시각화를 위해 이미지의 동적 범위를 수정할 수 있습니다. - 그런 다음 오른쪽 창의 상단 메뉴에서 사각형 그리기 아이콘을 클릭합니다. 가로 또는 세로인 줄무늬를 선택하고 줄무늬에 수직으로 사각형을 그립니다. 중앙 창에 프로파일이 나타납니다.
- 왼쪽 패널에 있는 평균 투영 메뉴의 수직 또는 수평을 클릭합니다., 스트라이프 방향이 수직인지 수평인지에 따라.
- 중앙 창에서 통계 를 클릭하고 FWHM 값을 읽습니다.
- 오른쪽 창에 표시된 이미지를 컴퓨터 마우스로 마우스 오른쪽 버튼으로 클릭하고 ROI 저장을 선택합니다.
참고: ROI 로드를 클릭하여 저장된 ROI를 엽니다. - 오른쪽 창의 왼쪽 상단에있는 화살표 아이콘을 클릭하고 ROI를 클릭 한 다음 빈 아이콘을 클릭하여 삭제하십시오.
- 분석된 근육의 전역 값을 나타내는 AChR 스트라이프 너비의 예측 수를 얻을 때까지 다른 직사각형 ROI에서 필요한 만큼 이 작업을 반복합니다.
6. 실험 설계 및 통계 테스트
- 특정 소프트웨어를 사용하여 통계 분석을 수행합니다.
참고: 데이터는 컨포칼 현미경 이미징의 경우 N≥ 3개의 생물학적 복제물과 유전자형당 최소 20개의 NMJ에서, STED 이미징의 경우 N≥5개의 생물학적 복제물 및 유전자형당 N=5NMJ에서 수집되었습니다. 유의성은 쌍을 이루지 않은 Mann-Whitney 검정(비모수적)으로 평가되었으며 p-값은 해당 그림 범례에 표시됩니다.
결과
재현 가능한 방식으로 시냅스 전후 수준에서 신경근 접합부의 형태학적 분석을 용이하게 하기 위해 현미경 소프트웨어와 ImageJ 맞춤형 매크로를 사용하여 근육 적출에서 이미징 및 정량화에 이르는 워크플로가 개발되었습니다(그림 1). 이 프로토콜의 유용성을 예시하기 위해, 척수성 근위축증(SMA) 및 선천성 근무력증(CMS) 형태에 의해 각각 영향을 받은 유전 질환의 두 마우스 모델인 Smn2B/- 및 ColQ Dex2/Dex2 마우스에서 NMJ의 형태를 평가하고 데이터를 연령 일치 대조군 리터메이트와 비교했습니다.
NMJ 구조는 3주 및 6주령 Smn2B/-(C57Bl/6 배경) 및 ColQ Dex2/Dex2(B6D2F1/J 배경) 마우스의 경골 전방 및 비복근에서 각각 평가되었습니다. 3주령에 Smn2B/- 마우스는 NMJ 위축 및 손실35,36과 같은 골격근 발달 지연 및 탈신경의 징후를 보입니다. CMS 마우스는 NMJ에서 1 차 병리를 가지며 생후 첫 주부터 체중이 감소하고 근육 약화가 현저합니다20 (데이터는 표시되지 않음). 도 2A에 도시된 바와 같이, 형광 α-붕가로톡신으로 표지된 시냅스후 모터 말단판은 공초점 현미경에 의해 2개의 마우스 라인의 돌연변이체에서 더 작거나 단편화된 것으로 나타났다. 이 맞춤형 ImageJ 매크로를 사용한 NMJ Z-스택의 정량화는 NMJ성숙 결함의 징후로 대조군에 비해 SMA 및 CMS 마우스 모두에서 종판 부피, 최대 강도 투영(MIP) 및 상대 비틀림의 현저한 감소를 나타냈습니다(그림 2B-D). 시냅스 후 말단 부피 및 MIP는 병든 동물에서 감소하였다 (각각 Smn2B /- 및 ColQ Dex2 / Dex2 마우스에서 부피에 대해 2.7 및 2.0, MIP에 대해 2.5 및 2.0의 배-변화). 상대 비틀림은 또한 WT보다 SMN 및 ColQ 결핍 근육에서 더 작았습니다 (SMA에서 16.97 % ± 1.33 % 대 WT 마우스±에서 48.84 %, CMS에서 13.29 % 대 CMS에서 2.79 % ± 4.44 % 대조군 마우스 13.2±9 %). 또한, ImageJ 맞춤형 매크로를 사용하여 시냅스 전 축삭 말단 가지의 분포를 정량화한 결과, 면역표지가 증가한 두 동물 모델에서 신경섬유 M 분포의 변경된 패턴이 나타났으며±±(대조군에 비해 각각 대조군에 비해 Smn2B/- 및 ColQDex2/Dex2 마우스에서 각각 2.03% 및 23.64% ± 2.78% 대 18.77% ± 1.73%)(그림 3A-D ). SV2 염색에 의해, 점유 비율의 43% 감소, 즉 인접한 신경 말단 활성 영역을 갖는 AChR-함유 영역의 퍼센트가 또한 Smn2B/- 마우스에서 관찰되었다(SMA에서 49.36% ± 3.76% 대 WT 마우스±에서 85.69% 대 2.34% WT 마우스) (그림 3E,F). 이 NMJ 파라미터는 ColQ Dex2/Dex2 돌연변이체의 GA에서도 계산되었지만, 대조군 새끼와 비교하여 통계적으로 유의한 차이는 발견되지 않았다(데이터는 나타내지 않음).
우리는 초고해상도 유도 방출 고갈(STED) 현미경을 사용하여 ColQ 결핍 근육에서 접합 주름 사이의 거리와 이러한 주름의 꼭대기에 위치한 AChR 줄무늬의 너비를 정량화하여 시냅스 후 막 특성을 추가로 분석했습니다. 도 4에 도시된 바와 같이, 이들 구조의 양상은 형광 α-붕가로톡신 표지 및 강도 프로파일 분석에 의해 명확하게 시각화될 수 있다. 우리는 이러한 NMJ 매개 변수를 평가하고 돌연변이 체의 비복근에서 AChR 줄무늬의 접합 접힘 거리 (d) 및 폭 (w)의 증가를 발견했습니다 (358.3 nm ± 11.97 nm 및 320.8 nm ± 10.90 nm±, 야생형 마우스와 비교하여 ColQ Dex2 / Dex2에서 너비에 대해 10.51 nm 및 186.3 nm ± 7.015 nm, 각각, p < 0.05) (그림 4C, D).
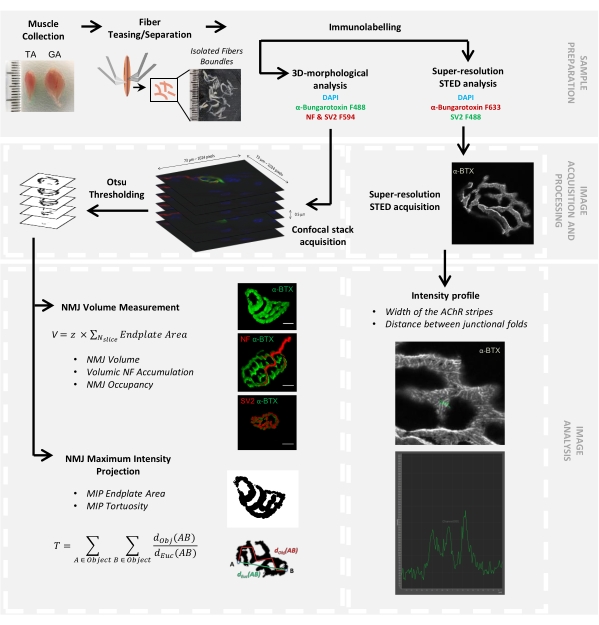
그림 1: 컨포칼 및 STED 현미경을 이용한 3D 멀티스케일 NMJ 특성 분석을 위한 비디오 프로토콜의 순서도. 마우스로부터 전경골(TA) 및 비복근(GA) 근육을 수집하고, 근육 섬유를 놀리기 전에 α-붕가로톡신-F488 또는 α-붕가로톡신-F633, DAPI, 신경섬유 M(NF-M) 및 시냅스 소포 당단백질 2(SV2) 및 형광단(F488 또는 F594)-접합된 2차 항체에 대한 1차 항체로 표지했습니다. 이미지 스택은 컨포칼 현미경으로 획득하고 시냅스 후 NMJ 부피, 시냅스 전 NF-M 축적, NMJ 축삭 말단 점유, 시냅스 후 최대 강도 투영(MIP) 종판 면적 및 비틀림(d Obj(AB)은 물체의 둘레를 따라 A와 B 사이의 거리(빨간색 선)인 반면 dEuc(AB) 는 A와 B 사이의 유클리드 거리(녹색 선)입니다. STED 현미경 분석을 위해, 아세틸콜린 수용체(AChR) 줄무늬의 폭 및 접합 주름 사이의 거리를 α-BTX-F633 염색의 강도 프로파일로부터 정량화하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
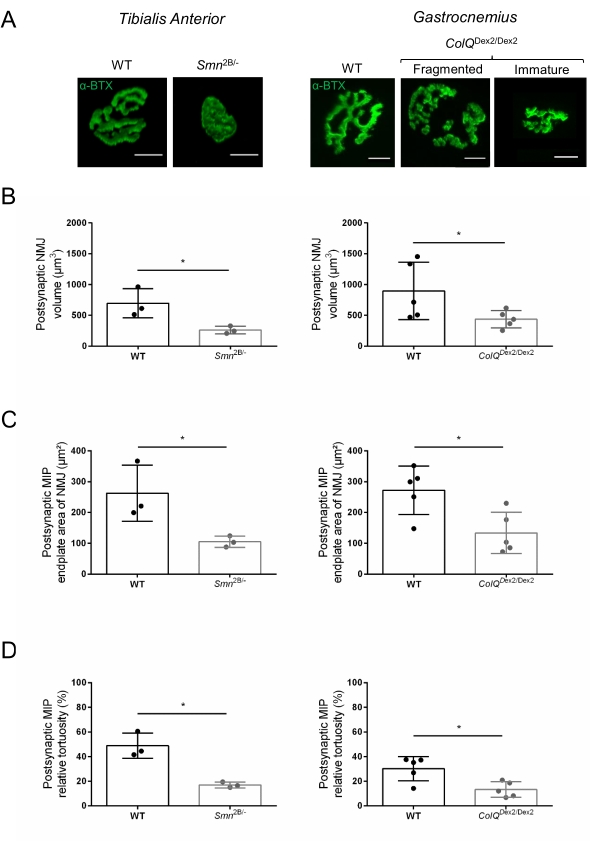
그림 2: 척수성 근위축증(SMA) 및 ColQ 관련 선천성 근무력증 증후군(CMS)의 마우스 모델에서 다중 매개변수 시냅스 후 NMJ 특성화. (A) α-bungarotoxin-F488 (α-BTX)로 표지 된 TA 및 GA 근육의 시냅스 후 운동 엔드 플레이트의 대표 이미지. (B) NMJ 시냅스 후 말판 부피, (C) 최대 강도 투영 (MIP) 면적 및 (D) 3 주령 야생형 (WT) 및 Smn2B / - 마우스의 TA에서의 상대 비틀림 (왼쪽 그래프, 유전자형 당 N = 3 동물, n = 37 및 n = 56 NMJs) 및 6 주령 WT 및 ColQ Dex2 / Dex2 의 정량화 마우스 (오른쪽 그래프, 유전자형 당 N = 5 마우스, n = 89 및 n = 97 NMJs). 데이터는 SEM± 마우스당 평균(dot)으로 표현된다. 군간의 차이는 만-휘트니 검정(*p < 0.05)에 의해 분석하였다. 스케일 바는 10 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
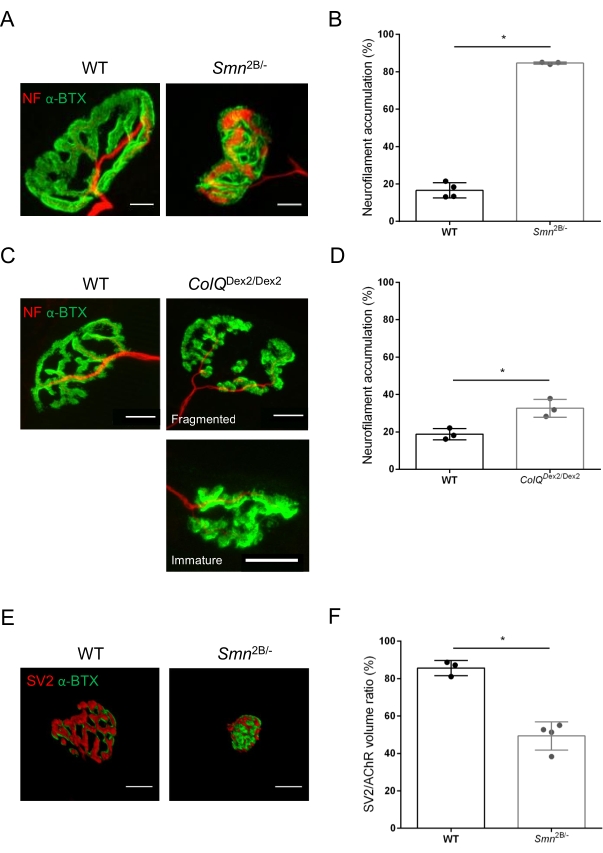
그림 3 : WT 및 돌연변이 마우스의 근육에서 시냅스 전 축삭 말단 분포의 형태 측정 분석. 야생형, SMA 및 ColQ 관련 CMS 마우스의 전경골(TA) 및 비복근(GA) 근육의 NMJ 신경 분포 패턴. (ᄀ, ᄂ) 뉴로필라멘트 M (NF-M, 적색) 및 α-붕가로톡신-F488 (α-BTX, 녹색)에 대한 항체로 표지된 21일령의 WT 및 Smn2B/- 마우스의 TA로부터의 대표적인 신경근 접합부 (A), 및 뉴로필라멘트 축적의 정량적 분석으로부터의 결과(B); (다, 디) 뉴로필라멘트 M (NF-M, 빨간색) 및 α-붕가로톡신-F488(α-BTX, 녹색)에 대한 항체로 표지된 6주령 WT 및 ColQ Dex2/Dex2 마우스의 GA로부터의 대표적인 신경근 접합부, 단편화되고 미성숙 시냅스 후 말판(C) 및 두 그룹의 동물에서 뉴로필라멘트 축적 결과(D). N=4 (n=34 NMJs) (B) 및 N=3 (n=54 NMJs) (D) WT 동물, 및 N=3 (n=36 NMJs) Smn2B/- 및 N=3 (n=55 NMJs) ColQ Dex2/Dex2 마우스 (B, D)를 실험에서 분석하였다. (E, F) 시냅스 소포 당단백질 2 (SV2, 빨간색) 및 α-붕가로톡신-F488 (α-BTX, 녹색)에 대한 항체로 표지된 3주령 WT 및 Smn2B/- 마우스의 TA로부터의 NMJ에서 축삭 말단 점유의 대표적인 이미지(E) 및 NMJ 점유 결과(SV2/AChR 부피비)(F). N=3(n=50 NMJs) 야생형 및 N=4(n=62 NMJs) Smn2B/-마우스로부터의 근육을 분석하였다. 데이터는 SEM± 마우스(dot) 당 평균값으로 나타내었다. 군간의 차이는 만-휘트니 검정(*p < 0.05)에 의해 분석하였다. 스케일 바는 20μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
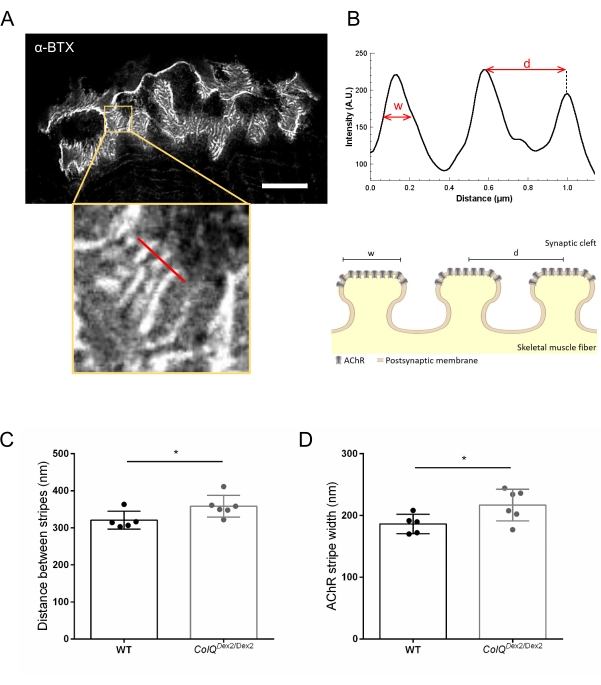
그림 4: NMJ 시냅스 후 말단판의 STED 이미징. (A) 접합 후 AChR 줄무늬를 보이는 6주령 야생형 마우스의 비복근에서 α-붕가로톡신-F633(α-BTX)으로 표지된 NMJ의 대표적인 STED 이미지(스케일 바는 5μm). (B) 강도 프로파일을 생성하는 데 사용된 AChR 줄무늬(하단 패널)가 있는 영역의 더 높은 배율. AChR 스트라이프의 폭(w)과 이 영역의 인접한 두 스트라이프 사이의 거리(d)를 정량화하여 막대 그래프에 표시하였다. AChR 스트라이프 너비(w)와 거리(d)를 설명하기 위한 시냅스 후 종판의 개략적인 표현. 이러한 매개 변수 (C) AChR 스트라이프 거리 및 (D) 너비는 6 주령에 ColQ Dex2 / Dex2 마우스 및 대조군 새끼에서 측정되었습니다. 5 WT(총 n = 29 NMJ) 및 6 ColQ Dex2/Dex2(총 n = 43 NMJ) 동물로부터의 NMJ를 맹목적으로 분석하였다. 데이터는 SEM± 마우스당 평균(dot)으로 나타내었다. 그룹 간의 통계적 차이는 Mann-Whitney 검정(*p < 0.05)을 사용하여 분석하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: LAS X 소프트웨어 출시 및 컨포칼 획득을 위한 매개변수. 컨포칼 이미지를 획득하는 다양한 단계는 프로토콜의 섹션 3.1.2에서 3.1.7에 설명되어 있습니다. 각 NMJ 스택 획득에 대해 프로젝트가 열리고 (단계 3.1.4) 이미지 크기, 획득 속도, X, Y 및 Z 축의 매개 변수가 선택되고 (단계 3.1.7), 각 순차 스캔이 표시됩니다 (Seq.1, DAPI 용 레이저 405; Seq.2, α-BTX-F488용 레이저 488; 및 Seq.3, F594 접합된 2차 항체를 위한 레이저 552). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: STED 획득을 위한 LAS X 소프트웨어 및 매개변수 출시. STED 이미지를 획득하는 단계는 프로토콜의 섹션 3.2.2에서 3.2.8에 설명되어 있습니다. 현미경이 STED ON 구성 모드로 시작되고(단계 3.2.2) 프로젝트가 열립니다(단계 3.2.3). 이미지 획득(단계 3.2.7)을 위한 매개변수(이미지 크기, 획득 속도, 줌 팩터, X축)가 각 순차 스캔과 함께 표시됩니다(α-BTX-F633의 경우 Seq.1; F488 접합된 2차 항체에 대한 Seq.2). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: STED 현미경으로 얻은 α-BTX 염색 접합부 주름의 이미지. 올바른 초점(왼쪽) 또는 잘못된 초점(오른쪽)으로 획득한 6주 된 야생형 마우스의 α-BTX-F633으로 표지된 시냅스 후 종판의 이미지 예. 이 파일을 다운로드하려면 여기를 클릭하십시오.
추가 그림 4: 사용자 지정 ImageJ 매크로로 얻은 입력 및 출력 데이터를 설명하는 Windows 팝업. NMJ 이미지의 입력 데이터 예(.tif 및 .lif 파일)가 왼쪽 열에 표시됩니다. 매크로(오른쪽 열)의 출력 데이터는 교차점(.tif)의 이미지가 포함된 폴더(Save_Volume, Save_Accu)와 결과가 포함된 데이터시트(.csv 파일)에 저장됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 5: LAS X 소프트웨어를 사용한 STED 획득의 AChR 스트라이프 거리 및 폭 분석. NMJ STED 이미지를 분석하는 단계는 프로토콜의 섹션 5에 설명되어 있습니다. A) AChR 줄무늬를 포함하는 표지된 시냅스 후 종판 영역의 이미지. 스트라이프 분석의 관심 영역은 수직선(녹색 선, 스트라이프 거리) 또는 수직 직사각형(자주색 사각형, 스트라이프 너비)을 그려 선택합니다. (ᄂ, ᄃ) 선택한 영역의 강도 프로파일과 AChR 스트라이프(B)와 AChR 스트라이프 너비(C) 사이의 거리를 계산하기 위한 측정값이 표시됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 1: Macro_NMJ_VOL_Marinelloetal. NMJ 매개변수 측정값(NMJ 볼륨, MIP 엔드플레이트 영역 및 NMJ 비틀림)을 추출하는 ImageJ 사용자 지정 매크로입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 2: Macro_NMJ_ACCU_Marinelloetal. ImageJ 사용자 지정 매크로는 NF-M 축적 및 SV2 염색을 추출합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
설명된 비디오 프로토콜은 시냅스 전후 수준에서 병리학적 변화를 특성화하는 데 사용할 수 있는 컨포칼 및 STED 현미경을 결합하여 신경근 접합부의 3D 구조를 정량화하는 상세한 방법을 제공합니다. STED 현미경의 고분해능은 기존의 컨포칼 이미징으로는 식별할 수 없는 나노 구조의 시각화 및 형태 측정 분석을 가능하게 합니다. 이 절차를 통해 SMA 및 ColQ 관련 CMS 마우스의 두 충수 근육, 전방 경골 및 비복근에서 NMJ의 구조적 변화를 측정할 수 있었습니다.
이 기술로 신뢰할 수 있는 결과를 얻으려면 근육을 적절하게 해부하고 애타게 하는 것이 중요하며, 근육을 둘러싼 근막과 근육 다발을 분리하기 위해 적용된 강도에 특히 주의를 기울이십시오. 그렇지 않으면 신경 분포 패턴이 중단되어 적절한 시냅스 전 NMJ 평가를 방해 할 수 있습니다. TA 및 GA로부터의 NMJ를 분석하기 위해 상세한 정보가 제공되지만, 원칙적으로, 이 프로토콜은 놀리는 단계를 필요로 하지 않는 횡격막 또는 횡복부(37)와 같은 편평한 근육을 포함하는 다른 근육에 적용될 수 있다. 조직 고정은 또한 양질의 염색을 보장하는 데 중요합니다. 따라서 고품질 PFA를 적절한 양 (근육의 15-20 배)으로 사용하는 것이 좋습니다. 또한, 정착액에 대한 노출 시간은 수축 및 응집과 같은 인공물이 과도한 고정으로 인해 나타날 수 있고 NMJ 기능에 영향을 미치기 때문에 중요한 단계입니다. 샘플의 크기 및 조직(38)에서의 파라 포름 알데히드 용액의 침투 속도를 감안할 때,이 유형의 근육에는 18-24 시간의 고정 시간이 권장된다. 염색 단계가 조직 수확 후 일주일 이상 계획되는 경우 박테리아 증식을 방지하기 위해 4 ° C에서 아 지드 화 나트륨이 보충 된 PBS에 PFA 고정 근육을 유지하는 것이 좋습니다.
이 프로토콜은 컨포칼에 α-BTX-F488을 사용하고 STED 이미징에 α-BTX-F633을 사용하는 접근 방식을 제시합니다. 이러한 형광단은 설명된 실험 설계에 적합하도록 선택되었지만 사용 가능한 장비 및 재료에 따라 수정할 수 있습니다. 예를 들어, 이미지 획득 및 정량화를 위해 STED CW 592nm 레이저를 사용할 때 α-BTX F488 라벨링을 선택할 수 있습니다. 그러나 본 연구에서 적용된 구성(펄스 여기 게이트 STED, 775nm 공핍)은 연속파 STED39와 같은 다른 접근 방식보다 더 높은 성능과 더 나은 분해능을 나타내어 현재 응용 분야에 더 적합한 것으로 보입니다. 또한 특히 STED(여기 및 고갈 모두)의 경우 레이저 출력 설정을 신중하게 선택하는 것이 중요한데, 이는 포화 시 강도 프로파일의 특성을 측정할 수 없으므로 NMJ 이미지의 포화 신호가 전체 분석을 위태롭게 할 수 있기 때문입니다.
현미경 소프트웨어 및 ImageJ 매크로를 사용한 이미지 획득 및 분석을 포함한 이 상세한 워크플로우는 단일 근육에서 컨포칼 및 STED 현미경으로 자율 NMJ 형태 분석을 용이하게 하기 위해 개발되었습니다. NMJ-morph2 또는 NMJ-Analyzerr14와 같은 NMJ 컨포칼 분석을 위한 이전에 설명한 워크플로우는 NMJ의 형태학적 분석 및 비교 연구를 용이하게 하는 반자동 분석법 설계를 위한 길을 열었습니다. NMJ-morph (및 업데이트 된 버전 aNMJ-morph15)는 최대 강도 투영을 사용하여 21 개의 형태 학적 특징을 측정하는 무료 ImageJ 기반 플랫폼이며 NMJ-Analyzerr는 전체 3D NMJ 구조에서 29 개의 관련 매개 변수를 생성하는 Python으로 개발 된 스크립트를 사용합니다. 수동 임계값은 사용자 분석이 필요한 이 두 가지 방법에서 이미지 처리 중 유일한 단계입니다. 이 통합 프로토콜은 조직 준비, 3D 컨포칼 이미지 획득 및 전체 골격근에서 NMJ의 ImageJ 기반 처리를 위한 단계를 자세히 설명하고 시냅스 후(부피, 최대 투영 영역 및 비틀림) 및 시냅스 전(축삭 말단 점유 및 뉴로필라멘트 축적) 말판의 5가지 중요한 매개변수에 대한 단순화된 개요를 제공합니다. 생물학적 관련성의 추가 매개 변수 인 시냅스 후 접합 주름의 AChR 조직 패턴은 초 분해능 STED 현미경 (분해능 20-30 nm)40에 의해 나노 스케일 수준에서 형태 측정 분석을 위해 통합되었습니다. 흥미롭게도 STED 이미징을 위한 조직 준비는 기존의 투과 전자 현미경(TEM)9과 같은 NMJ 미세 구조 연구에 사용되는 다른 방법보다 간단하며, 이는 적절한 근육 영역의 초박형 섹션을 얻기 위해 숙련된 조작자가 필요한 다소 복잡하고 시간 소모적인 절차입니다. 또한 STED 관련 소프트웨어를 사용하여 다중 접합 폴드의 정량적 데이터를 자동으로 얻을 수 있습니다.
이 프로토콜은 SMN 및 ColQ 결핍 근육 20,36,41,42에서 이전에 알려진 NMJ 결함을 설명하기 위해 적용되었습니다. 시냅스 후 종판 부피, MIP 면적 및 상대 비틀림 감소와 같은 컨포칼 현미경에 의한 두 마우스 모델에서 공통된 변화가 발견되었으며, 신경 섬유 축적 증가와 같은 반면, 일부 보다 구체적인 소견(NMJ 점유 감소)은 손상된 소포 트래피킹의 지표로서 SMA 마우스에서만 관찰되었습니다36. 마지막으로, STED 분석에 의해 ColQ-KO에서 AChR 스트라이프 거리와 폭의 증가가 감지되었으며, 이는 TEM20에 의해 이전에 관찰된 바와 같이 시냅스 후 접합 주름의 초구조적 결함의 징후입니다. 중요하게도, 이 프로토콜은 발달, 유지 및 다양한 병리학적 조건 하에서 신경근 접합부의 보다 심층적인 형태학적 특성화에 도움이 될 수 있습니다.
공개
저자는이 작업과 관련된 이해 상충이 없음을 선언합니다.
감사의 말
우리는 Genethon의 "이미징 및 세포분석 핵심 시설"뿐만 아니라 Ile-de-France 지역, Conseil General de l' Essonne, Evry의 Genopole Recherche, University of Evry Val d' Essonne 및 INSERM의 장비 기금으로 부분적으로 지원되는 조직학 서비스에 감사드립니다. 또한 Smn 2B/2B 마우스 라인(캐나다 오타와 대학교)을 제공한 Rashmi Kothary 박사와 ColQDex2/+ 마우스 라인(미공개, 프랑스 파리 대학교)을 제공한 Eric Krejci 박사에게도 감사드립니다. 통계 분석에 대한 그의 지원에 대해 기욤 코레 (Guillaume Corre)에게 감사드립니다. 2H3 (Jessel, T.M. 및 Dodd, J.) 및 SV2 (Buckley, K.M.에 의해 개발됨) 모노클로날 항체는 NIH의 NICHD에 의해 생성되고 아이오와 대학교 생물학과, 아이오와 시티, IA 52242에서 유지되는 Developmental Studies Hybridoma Bank (DSHB)로부터 수득하였다. 이 작업은 Française contre les Myopathies (AFM-Telethon), INSERM 및 University of Evry Val d' Essonne의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
참고문헌
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304(2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671(2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677(2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220(2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251(2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128(2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- ImageJ. , Available from: http://imagej.nih.gov/ij (2021).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Bio-Formats. , Available from: http://www.openmicroscopy.org/bio-formats/downloads/ (2021).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, Supplement C 253-261 (2013).
- ImageJ documentation. , Available from: http://imagejdocu.tudor.lu/plugin/analysis/geodesic_distances/start (2021).
- GitHUb. , Available from: https://github.com/Genethon/ImCy (2021).
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162(2014).
- Baker, J. R. Principles of biological microtechnique; a study of fixation and dyeing. , Wiley. London Methuen; New York. at http://archive.org/details/principlesofbiol01bake (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421(2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644(2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605(2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유