Method Article
Характеристика нервно-мышечных соединений у мышей с помощью комбинированной конфокальной микроскопии и микроскопии сверхвысокого разрешения
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает метод морфометрического анализа нервно-мышечных соединений с помощью комбинированной конфокальной и STED-микроскопии, который используется для количественной оценки патологических изменений в мышиных моделях СМА и CMS, связанных с ColQ.
Аннотация
Нервно-мышечные соединения (NMJ) представляют собой узкоспециализированные синапсы между низшими двигательными нейронами и волокнами скелетных мышц, которые играют важную роль в передаче молекул от нервной системы к произвольным мышцам, что приводит к сокращению. Они поражаются при многих заболеваниях человека, включая наследственные нервно-мышечные расстройства, такие как мышечная дистрофия Дюшенна (МДД), врожденные миастенические синдромы (CMS), спинальная мышечная атрофия (SMA) и боковой амиотрофический склероз (ALS). Поэтому мониторинг морфологии нервно-мышечных соединений и их изменений в моделях заболеваний мышей представляет собой ценный инструмент для патологических исследований и доклинической оценки терапевтических подходов. Здесь описаны методы маркировки и анализа трехмерной (3D) морфологии пре- и постсинаптических частей моторных концевых пластин из мышиных дразнящих мышечных волокон. Подробно описаны процедуры подготовки образцов и измерения объема NMJ, площади, извилистости и терминальной морфологии/занятости аксонов с помощью конфокальной визуализации, а также расстояния между постсинаптическими переходными складками и шириной полосы ацетилхолинового рецептора (AChR) с помощью микроскопии со стимулированным истощением выбросов сверхвысокого разрешения (STED). Изменения в этих параметрах NMJ проиллюстрированы на мутантных мышах, пораженных СМА и CMS.
Введение
Нервно-мышечное соединение (NMJ) представляет собой сложную структуру, состоящую из терминала моторного аксона, перисинаптической шванновской клетки и скелетной части миофибры, участвующей в передаче химической информации и связи более низкой активности двигательных нейронов с сокращением мышц. У млекопитающих морфология нервно-мышечного соединения изменяется во время развития, принимая типичную форму кренделя после созревания, с различиями в форме и сложности между видами, и показывает некоторую степень пластичности в ответ на физиологические процессы, такие как физические упражнения или старение 1,2,3,4 . Постсинаптическая моторная концевая пластина образует мембранные инвагинации, называемые соединительными складками, где верхняя часть, содержащая ацетилхолиновые рецепторы (AChR), находится в тесном контакте с пресинаптической концевой аксонной ветвью5.
Морфологические и функциональные изменения в нервно-мышечных соединениях способствуют патофизиологии нескольких нейродегенеративных расстройств, таких как спинальная мышечная атрофия (СМА) и боковой амиотрофический склероз (БАС), миопатии, такие как мышечная дистрофия Дюшенна (МДД), врожденные миастенические синдромы (CMS), миастения (MG) и центроядерные миопатии (CNM), а также связанная со старением саркопения 3,6,7,8,9, 10,11,12. При этих заболеваниях наблюдаются структурные изменения NMJ, такие как фрагментация концевой пластины, уменьшение размера постсинаптической соединительной складки и / или денервация. Патология НМЖ может быть первичным или ранним событием во время прогрессирования заболевания или проявляться более позднее как вторичное событие, способствующее клиническим проявлениям. В любом случае, мониторинг морфологии НМЖ на животных моделях этих заболеваний представляет собой ценный параметр для изучения патологических изменений и оценки эффективности потенциальных методов лечения.
Морфология нервно-мышечных соединений обычно анализируется методами с использованием конфокальной микроскопии 2,13,14,15 или электронной микроскопии 5,16, с присущими им ограничениями, такими как разрешение или технические трудности, соответственно. Совсем недавно микроскопия со сверхвысоким разрешением также использовалась для визуализации определенных областей NMJ, таких как пресинаптические активные зоны или распределение AChR на постсинаптической мембране 16,17,18, в качестве альтернативного или дополнительного подхода к ультраструктурному анализу с помощью электронной микроскопии.
Этот протокол направлен на предоставление подробного и воспроизводимого метода оценки морфологических параметров NMJ путем объединения флуоресцентной конфокальной и стимулированной микроскопии истощения выбросов (STED). Важные особенности пресинаптических и постсинаптических концевых пластин, такие как объем, площадь, относительная извилистость, ширина полосы AChR и терминальное распределение аксонов в иннервированных дразнящих мышечных волокнах икроножной и большеберцовой кости передней части, были количественно определены в контексте нормальных и больных состояний. В частности, дефекты NMJ были проиллюстрированы в модели Smn2B/- мышиной спинальной мышечной атрофии, нервно-мышечного заболевания с дегенерацией двигательных нейронов, вызванной мутациями в гене SMN1 11,19, и в коллагеноподобной хвостовой субъединице асимметричного нокаута ацетилхолинэстеразы (ColQDex2/Dex2 или ColQ-KO) мышей, как модель врожденного миастенического синдрома 20, 21,22.
протокол
Уход и манипуляции с мышами проводились в соответствии с национальным и европейским законодательством об экспериментах на животных и были одобрены институциональным этическим комитетом. В исследовании использовались самцы и самки мышей Smn2B/- (фон C57Bl/6J) и ColQDex2/Dex2 (фон B6D2F1/J) в возрасте 3 и 6 недель соответственно.
1. Эвтаназия мышей и рассечение мышц: передней большеберцовой кости и икроножной
- Приступают к мышиной анестезии путем внутрибрюшинной инъекции кетамина (87,5 мг/кг)/ксилазина (12,5 мг/кг) смешанного раствора (0,1 мл/20 г массы тела) перед эвтаназией при вывихе шейки матки.
ПРИМЕЧАНИЕ: Поскольку SMA и ColQ-CMS влияют на людей независимо от их пола, в настоящем протоколе использовались самцы и самки мышей. - Удалите задние конечности с помощью небольшой электробритвы и промойте ноги 70% этанолом.
ПРИМЕЧАНИЕ: Процедура рассечения будет отличаться для каждой мышцы. Для рассечения передней большеберцовой кости (ТА) выполните шаги 1.2.1-1.2.3, а для икроножной мышцы (ГА) (медиальная и боковая части) выполните шаги 1.2.4-1.2.6. Осторожно обрабатывайте мышцы, чтобы предотвратить повреждение тканей и раздавливание или растяжение их во время рассечения.- Поместите мышь в положение лежа на спине.
- Сделайте разрез кожи 5 мм острыми тупыми ножницами вдоль передне-наружной части дистальной задней конечности, параллельно голени, чтобы обнажить мышцу. Используйте очень тонкие ножницы для удаления фасции.
- Сначала отрежьте дистальное сухожилие (близко к лапе), а затем проксимальное сухожилие (близко к колену) с помощью очень тонких ножниц и изогнутых тонких щипцов. Осторожно обрабатывайте мышцы, чтобы избежать повреждения миофибров и нервов.
ПРИМЕЧАНИЕ: Проксимальное сухожилие должно быть разрезано как можно ближе к кости, чтобы собрать всю мышцу. - Поместите мышь в положение лежа, используйте острые тупые ножницы, чтобы сделать разрез кожи от верхней части дистального заднего отсека задней конечности вниз к лапе, и удалите кожу.
- Схватите ахиллово сухожилие средними зазубренными щипцами, разрежьте его очень тонкими ножницами и аккуратно отделите ГА от окружающих тканей обратно к его проксимальному введению.
- На проксимальной стороне вставьте средние зазубренные щипцы в карман, образованный между бицепсом бедра (BF) и GA. Разделите две мышцы, чтобы разрезать сухожилие GA как можно ближе к костному введению с помощью очень тонких ножниц.
- Для фиксации ткани поместите каждую мышцу в микроцентрифужную трубку объемом 2 мл, содержащую 1 мл 4% мас./об.раствора параформальдегида (PFA), разбавленную в фосфатном буферном физиологическом растворе (PBS без Ca2+Mg2+) и держите при 4 °C в течение 18-24 ч.
ВНИМАНИЕ: Параформальдегид и формальдегид токсичны и должны обрабатываться в химическом вытяжном шкафу с соответствующим защитным оборудованием. - На следующий день промыть неподвижные мышцы 3 раза в течение 5 минут с PBS в 12-луночных пластинах, осторожно встряхнув при комнатной температуре (RT) внутри химического вытяжного шкафа.
ПРИМЕЧАНИЕ: Протокол может быть остановлен на этом этапе и продолжен в течение месяца. В этом случае добавляют PBS, дополненный 0,01% азидом натрия для хранения образцов при 4 °C. - Дразните каждую мышцу небольшими пучками волокон шириной около 1 мм, используя два тонких зубчатых щипца.
ПРИМЕЧАНИЕ: Крайне важно очень мягко манипулировать мышцами щипцами, без чрезмерной силы, чтобы предотвратить повреждение тканей во время поддразнивания.- Диссоциируют мышцу ТА на 3 или 4 пучка в зависимости от ее размера.
- Для ГА разделите медиальную и боковую части мышцы, а затем диссоциируют каждую часть на 4-5 пучков в зависимости от их размера.
2. Иммуноокрашивание
- Приступайте к пермеабилизации мышечных волокон: переведите мышечные пучки в 24-луночные пластины, содержащие 1% (v/v) Triton X-100 в PBS, и держите их под мягким перемешиванием (50 об/мин) в течение 1 ч при RT или 5 ч при 4 °C.
ПРИМЕЧАНИЕ: Разделите мышечные пучки между двумя пластинами, чтобы продолжить с отдельными иммуноокрашиваниями и свести к минимуму риск путаницы антител. Не разбивайте их более чем на две скважины (1 скважина/плита); в противном случае количество (N) НМЖ, которые являются репрезентативными для их общего состояния в анализируемой мышце, может быть недостаточным. - Промыть образцы 3x в течение 5 мин PBS при RT и инкубировать их блокирующим раствором, состоящим из 4% бычьего сывороточного альбумина (BSA) в PBS/Triton X-100 1% в течение 4 ч при 4 °C, при мягком перемешивании (50 об/мин).
ПРИМЕЧАНИЕ: Не используйте аспирационный насос на этапах промывки, а скорее аспирируйте раствор вручную с помощью пипетки 200 мкл и наконечников небольшого размера (ссылка указана в Таблице материалов). - Инкубировать образцы в течение ночи (O/N) при 4 °C при мягком перемешивании (50 об/мин) блокирующим раствором, указанным на стадии 2.2, содержащим первичные моноклональные антитела против нейрофиламента M (NF-M, 2H3, разбавление 1/200) или синаптического везикул гликопротеина 2 (SV2, разбавление 1/200) для маркировки пресинаптических терминалей аксона или активных зон соответственно.
- На следующий день промыть мышечные пучки 3 раза в течение 5 мин в PBS при перемешивании (50 об/мин).
- Для конфокальной визуализации: Инкубируют мышечные пучки вторичными антимышечными антителами, конъюгированными с красным флуорофором (F594) (разведение 1/500) и α-бунгаротоксином, конъюгированным с зеленым флуорофором (α-BTX-F488) (разведение 1/1000) в PBS в течение 2 ч при РТ при перемешивании (50 об/мин).
- Для визуализации ЗППП: Инкубируют мышечные пучки вторичными антимышечными антителами, конъюгированными с зеленым флуорофором (F488) (разведение 1/500) и α-бунгаротоксином, конъюгированным с фар-красным флуорофором, характеризующимся высокой фотостабильностью (α-BTX-F633) (разведение 1/1000) в PBS в течение 2 ч при РТ при перемешивании (50 об/мин).
ПРИМЕЧАНИЕ: Не подвергайте образцы воздействию света во время инкубации, чтобы избежать фотоотбеливания.
- Промыть меченые мышечные пучки 3x в течение 5 мин с PBS при перемешивании (50 об/мин) и поместить их на слайд с монтажной средой.
ПРИМЕЧАНИЕ: Поместите максимум от 4 до 5 мышечных пучков на слайд, чтобы обеспечить уплотнение. - Добавьте стеклянную крышку класса No 1,5 (или No 1,5Н) (толщиной 0,17 мм) сверху и поместите цилиндрические магниты с обеих сторон слайда, чтобы оказать давление и сплющить мышцы.
- Держите слайды защищенными от света O/N при 4°C. Запечатайте горки навсегда лаком для ногтей.
3. Получение изображений
- Приобретения с помощью конфокального микроскопа
ПРИМЕЧАНИЕ: Изображения были собраны с помощью инвертированного лазерно-сканирующего конфокального микроскопа с использованием 63-кратного масляного погружного объектива (HCX Plan Apo CS, числовая апертура 1,4 (NA)).- Для слепого анализа пусть человек, не участвующий в анализе, кодирует каждый слайд с заданным номером. Оставайтесь слепыми к экспериментальным группам до тех пор, пока не будет завершена количественная оценка параметров NMJ для всех образцов.
- Запустите программное обеспечение микроскопа в режиме конфигурации > machine.xlhw (дополнительный рисунок 1).
- Поместите затвор на ступень микроскопа и найдите плоскость наблюдения внутри образца, посмотрев под широкоугольную флуоресцентную подсветку DAPI с набором фильтров DAPI.
- Нажмите «Открыть проект» > «Новые проекты» и создайте папку для хранения приобретений изображений (дополнительный рисунок 1).
ПРИМЕЧАНИЕ: Создайте новый проект для каждого NMJ, чтобы ограничить размер папки и предотвратить проблемы с памятью компьютера. - Чтобы управлять параметрами сбора, нажмите на окно вкладки Acquisition и установите конфокальное точечное отверстие на блок 1.0 Airy и мощность лазера, чтобы оптимизировать уровни усиления и смещения для флуоресценции green/F488 (α-BTX) с помощью лазера 488 нм на концевой пластине, который должен быть визуализирован (Live mode ON).
- Затем оптимизируйте получение флуоресценции red/F594 (NF-M или SV2) с помощью лазера, адаптированного для наблюдения F594. В этом исследовании использовался лазер 552 нм (Live mode ON). Для каждого лазера установлен спектр красильного излучения со следующими диапазонами: лазер 405 (DAPI) от 414 до 483 нм, лазер 488 (F488-α-BTX) от 506-531 нм и лазер 552 (NF-M/SV2) от 622-650 нм.
- Соберите стеки изображений нервно-мышечных соединений в каждой экспериментальной группе с одинаковыми настройками: размер изображения 1024 x 1024 пикселей (73,7 x 73,7 мкм) при частоте дискретизации 400 Гц, двунаправленный X ON, коэффициент масштабирования 2,5, размер Z-шага 0,5 мкм в режиме Z-Wide.
ПРИМЕЧАНИЕ: Для каждого NMJ количество срезов задается для получения всего соединения. Описанные выше параметры приобретения соответствуют теореме Найквиста-Шанона о выборке. Тем не менее, пользователь может нажать кнопку «Оптимизировать формат», присутствующую во всем новейшем конфокальном операционном программном обеспечении, чтобы размер пикселя и Z-шаг соответствовали идеальной частоте дискретизации Найквиста. Это действие позволит избежать чрезмерного или недостаточного отбора проб изображений, что приведет к потере точности измерений объема. - Сохраните исходные изображения файла (.lif) или Z-стека (.tif) в папке с именем, включающим кодовое имя слайда, тип окрашивания и номер концевой пластины.
ПРИМЕЧАНИЕ: Собирайте последовательно (не одновременно) сканы с помощью лазеров 488 нм и 552 нм (F488 и F594), чтобы избежать перекрестных помех флуоресценции F488 в канал F594 и наоборот (сквозной). NB: траектория луча может быть настроена с помощью Dye Assistant в программном обеспечении микроскопа. - Перейдите к следующему закодированному слайду и повторите шаги 3.1.3-3.1.8 для каждого NMJ.
- В конце сеанса нажмите « Открыть в 3D Viewer» и выберите представителя NMJ экспериментальной группы для визуализации 3D-маркировки.
ПРИМЕЧАНИЕ: Этот режим просмотра поможет проверить правильность параметров получения. - Закройте программное обеспечение микроскопа, очистите объективы салфетками, а затем выключите систему.
- Приобретения с помощью микроскопии STED
ПРИМЕЧАНИЕ: Изображения были собраны с помощью инвертированного лазерно-сканирующего конфокального микроскопа, оснащенного закрытым STED на 775 нм с использованием 100-кратного масляного погружного объектива (HC PL APO CS2 1.4 NA).- Для слепого анализа пусть человек, не участвующий в анализе, кодирует каждый слайд с заданным номером. Оставайтесь слепыми к экспериментальным группам до тех пор, пока не будет завершена количественная оценка параметров NMJ для всех образцов.
- Запустите программное обеспечение микроскопа в режиме конфигурации > machine.xlhw и STED ON (дополнительный рисунок 2).
- Щелкните Открыть проект > Новые проекты, чтобы создать папку для хранения приобретений изображений.
ПРИМЕЧАНИЕ: Создайте новую папку для каждого слайда, чтобы ограничить размер папки и предотвратить проблемы с памятью компьютера. - Поместите слайд на ступень микроскопа и просмотрите его под широкоугольным флуоресцентным освещением с помощью лазера 488 нм, чтобы найти плоскость наблюдения внутри образца.
- Поиск NMJ, помеченного окрашиванием нейрофиламента M (NF-M) или SV2, с помощью лазера 488 нм со спектральным обнаружением от 506-531 нм.
- Когда NMJ будет идентифицирован, нажмите Активировать STED и начните получать изображения в области, которая содержит несколько соединительных складок (дополнительный рисунок 3), используя лазер 635 нм со спектральным обнаружением от 640-750 нм.
ПРИМЕЧАНИЕ: Будьте осторожны с таблицей поиска насыщенности во время получения изображения и нажмите кнопку Quick LUT , чтобы избежать передержки (серые значения >255; для 8 бит). - Соберите изображения каждой экспериментальной группы с одинаковыми настройками: размер изображения 2048 x 2048 пикселей (38,75 x 38,75 мкм) при частоте дискретизации 400 Гц.
ПРИМЕЧАНИЕ: Мощность лазера истощения (STED) установлена на 65%. - Сохраните изображения с именем файла, содержащим код слайда.
ПРИМЕЧАНИЕ: Можно щелкнуть Оптимизированный формат XY: Установить формат, чтобы получить наилучшую настройку сбора данных с помощью stED-образов. - Перейдите к следующему закодированному слайду и повторите шаги 3.2.3-3.2.8. Повторите эту процедуру для всех слайдов.
- В конце сеанса микроскопии STED перенесите файлы изображений на другой компьютер и сохраните исходные файлы (. lif) на внешнем диске или сервере.
- Выключите программное обеспечение микроскопа, очистите объективы салфетками линз, а затем выключите систему.
4. Анализ изображений - конфокальная микроскопия
ПРИМЕЧАНИЕ: Все изображения были обработаны на компьютерах, использующих профессиональную операционную систему Microsoft Windows 10.
- Запустите ImageJ и пользовательский макрос для вычисления объема концевой пластины NMJ, области проекции максимальной интенсивности (MIP) и относительной извилистости.
- Обрабатывайте стеки изображений NMJ с помощью бесплатного программного обеспечения NIH ImageJ23, плагина iGeodesic и пользовательского макроса для получения измерений параметров NMJ. Запустите программное обеспечение ImageJ.
ПРИМЕЧАНИЕ: Последняя версия ImageJ находится в свободном доступе и может быть загружена24. Для того, чтобы открыть проприетарные форматы файлов, плагин Bio-Formats Package25 должен быть загружен26 . Этот шаг не является необходимым в случае, если оператор использует Fiji, потому что плагин уже установлен в программном обеспечении. Плагин iGeodesic27 для вычисления извилистости также доступен онлайн28; проверьте доступность этого плагина в версии ImageJ/Fiji, которая будет использоваться. Пользовательские макросы также доступны онлайн29. - Перетащите Macro_NMJ_VOL_Marinelloetal.ijm (на заказ, файл дополнительного кодирования 1) в окно ImageJ; макрос будет открыт во втором окне. В этом новом окне щелкните Макросы > Запустить макрос.
ПРИМЕЧАНИЕ: Макрос может обрабатывать как проприетарные, так и TIFF-файлы. Файлы должны соответствовать следующим критериям: для проприетарных форматов файлов сохранять только одно соединение (т.е. стопку изображений) на файл, упорядоченный в папке; для изображений TIFF файлы должны быть сохранены в папке, содержащей вложенные папки, каждая из которых называется JunctionX (X соответствует номеру NMJ) со стеками изображений данного соединения (RGB TIFF) (дополнительный рисунок 4). - Выберите собственную папку, содержащую вложенные папки Junction , которые необходимо проанализировать, и нажмите кнопку Выбрать.
- В новом всплывающем меню под названием «Папка сохранения» выберите папку хранения и нажмите « Выбрать».
- В новом всплывающем меню под названием «Тип изображения» выберите формат приобретений Z-стека.
- Выберите RGB-канал, соответствующий интересующему окрашиванию, и укажите размер пикселя XY и Z-шаг (z). Макрос автоматически выполнит анализ.
ПРИМЕЧАНИЕ: В случае выбора проприетарных форматов файлов макрос напрямую считывает размер пикселя и Z-шаг (z). Тем не менее, пользователь все равно должен указать интересующий канал (C1, C2 или C3). Макрос предоставляет dataSheet (.csv) для каждого параметра соединения (том концевой пластины, область MIP и извилистость) в папке сохранения. Макрос также генерирует три . Файлы TIF , соответствующие периметру Drawing_MaxprojX.tif окрашивания α-BTX, DrawingJunctionX.tif и MIP MaxprojX.tif. Эти файлы TIFF генерируются для проверки качества приобретений и обеспечения правильной обработки изображений.
Постсинаптический объем NMJ (V): макрос будет отделять изображения от одного NMJ и сохранять канал α-бунгаротоксина F488, соответствующий постсинаптической концевой пластине. Стек сегментируется с использованием порога Otsu30 на промежуточном срезе стека. Полученное двоичное изображение расширяется на 1 пиксель, а функция «Анализировать частицы » используется для измерения области концевой пластины каждого обнаруженного объекта. Чтобы получить постсинаптический объем NMJ, макрос суммирует все измеренные области концевой пластины стека и умножает их на значение Z-шага (z) в мкм.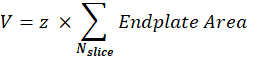
Область концевой пластины проекции максимальной интенсивности (MIP): после порогового значения стека с помощью функции ImageJ Z-проекта получается проекция максимальной интенсивности (MIP). Затем функция Анализа частиц используется для количественной оценки области концевой пластины MIP.
ИЗВИЛИСТОСТЬ NMJ MIP (T): Извилистость NMJ, которая отражает степень сложности концевой пластины постсинаптического двигателя, включая складки и перфорации31, рассчитывается на основе каждого MIP с использованием следующей формулы, где dObj(AB) - расстояние между A и B по периметру объекта, а dEuc(AB) - евклидово расстояние между A и B (прямая линия).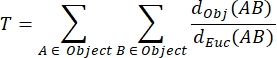
- Установите наибольшее значение извилистости в группе дикого типа каждого экспериментального условия равным 100% и нормализуйте все остальные значения экспериментального условия до этого значения, чтобы получить относительную извилистость NMJ.
- Обрабатывайте стеки изображений NMJ с помощью бесплатного программного обеспечения NIH ImageJ23, плагина iGeodesic и пользовательского макроса для получения измерений параметров NMJ. Запустите программное обеспечение ImageJ.
- Запустите ImageJ и пользовательский макрос для количественной оценки накопления пресинаптического нейрофиламента и окрашивания гликопротеина 2 синаптических пузырьков.
ПРИМЕЧАНИЕ: Накопление нейрофиламента (здесь, NF-M) и/или измененное распределение синаптических пузырьков (здесь SV2) являются маркерами аномального аксонального транспорта и/или нарушения трафика пузырьков и ранее наблюдались в NMJ различных моделей мышей СМА 32,33,34.- Перетащите Macro_NMJ_ACCU_Marinelloetal.ijm (пользовательский, файл дополнительного кодирования 2) в окно ImageJ; макрос откроется во втором окне. В этом новом окне щелкните Макросы > Запустить макрос.
ПРИМЕЧАНИЕ: Макрос может обрабатывать как проприетарные форматы файлов, так и файлы TIFF. Файлы должны соответствовать критериям, указанным в ПРИМЕЧАНИИ ниже шага 4.1.2. - Выберите собственную папку, содержащую вложенные папки Junction , которые необходимо проанализировать, и нажмите кнопку Выбрать.
- В новом всплывающем меню под названием «Папка сохранения» выберите папку хранения и нажмите « Выбрать».
- В новом всплывающем меню под названием «Тип изображения» выберите формат приобретений Z-стека.
- Во всплывающем окне «Информация о окрашивании» укажите пресинаптическую и постсинаптическую метку и цвет и нажмите «ОК». Например, пресинаптическая метка: SV2 или NF, пресинаптический цвет: R, постсинаптическая метка: BTX, постсинаптический цвет: G.
ПРИМЕЧАНИЕ: Для проприетарных форматов файлов должны быть указаны метки и соответствующие каналы (C1, C2 или C3). - Во всплывающем окне «Размер пикселя » укажите размер пикселя XY 0,072 мкм и шаг Z 0,5 мкм (z) и нажмите ok. Макрос автоматически выполнит анализ.
ПРИМЕЧАНИЕ: Этот параметр соответствует размеру изображения 1024 x 1024 пикселей (73,7 x 73,7 мкм), выбранному перед получением конфокального микроскопа, и он коррелирует с настройками объектива и масштаба. Если выбраны проприетарные форматы файлов, макрос напрямую считывает размер пикселя и Z-шаг (z). Макрос сохранит в папке сохранения DataSheet (.csv) пресинаптических и постсинаптических томов, многостраничное TIFF-изображение текущего обнаружения для каждой (пред- и постсинатической) маркировки. Как указано выше, эти файлы TIFF генерируются для проверки качества полученных данных и обеспечения правильной обработки изображений.
Макро вычисляет объем окрашивания аксонального нейрофиламента M (объем NF) из канала NF-M-F594, который колокализуется с маркировкой α-бунгаротоксина-F488, и объем окрашивания NMJ синаптического гликопротеина 2 (объем SV2) из канала SV2-F594, который колокализуется с маркировкой α-BTX-F488. Накопление NF-M количественно определяется путем расчета соотношения между объемом NF и объемом постсинаптической концевой пластины (α-BTX) и заполняемостью терминала АКСОНА NMJ по соотношению объемов SV2 и α-BTX, как показано ниже.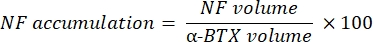
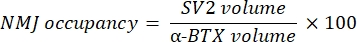
- Перетащите Macro_NMJ_ACCU_Marinelloetal.ijm (пользовательский, файл дополнительного кодирования 2) в окно ImageJ; макрос откроется во втором окне. В этом новом окне щелкните Макросы > Запустить макрос.
5. Анализ изображений - STED микроскопия
ПРИМЕЧАНИЕ: Обработка изображений выполнялась с помощью автономного программного обеспечения производителя микроскопов STED.
- Запустите программное обеспечение микроскопа.
- Откройте проект, нажав на кнопку Открыть проект . Выберите файл проекта (.lif) и откройте его. Изображения отображаются на экране вместе с их именами.
- В окне Процесс : нажмите на Шумоподавление > Медиана. В нижней части среднего окна установите для параметра Радиус значение 5,00 и для параметра Итерация значение 1,00 и снимите флажок 3D-фильтрация.
- Затем выберите вкладку Открыть проекты в левом верхнем углу окна и выберите изображение.
- Нажмите кнопку Применить , чтобы проверить параметры. Создается новое изображение под названием «nameofimage_median001».
ПРИМЕЧАНИЕ: Можно нажать на Предварительный просмотр перед применением , чтобы отслеживать эффект медианного фильтра, который повысит контрастность изображения и сгладит профили линий, используемые для количественной оценки. - Примените фильтр ко всем изображениям, как указано в шагах 5.4-5.5.
- На вкладках Открыть проекты щелкните значок дисковода гибких дисков, чтобы сохранить все проекты, включая вновь созданные отфильтрованные изображения.
ПРИМЕЧАНИЕ: Следующий шаг будет выполнен с использованием отфильтрованного изображения с именем «nameofimage_median001». - Расчет расстояния между полосами AChR
ПРИМЕЧАНИЕ: Изменения морфологии постпереходных складок часто наблюдаются при нервно-мышечных расстройствах как признак патологии NMJ (незрелость или дегенерация). Расстояние (d) между полосами AChR, которые обнаруживаются путем окрашивания α-бунгаротоксином, рассчитывается путем создания профилей интенсивности и количественной оценки расстояния между каждым пиком максимальной интенсивности путем рисования профиля линии (дополнительный рисунок 5).- С помощью программного обеспечения микроскопа выберите меню Количественная оценка в верхней части центрального окна.
- Нажмите на вкладку Инструменты в левом верхнем углу. Выберите «Интенсивность» на левой верхней панели и нажмите на значок профиля «Линия ». Установите для параметра Oversampling значение 1 и установите флажок Сортировать каналы.
- Перейдите на вкладки Открыть проекты и выберите отфильтрованное изображение для анализа.
ПРИМЕЧАНИЕ: Можно увеличить изображение, прокручивая с помощью компьютерной мыши. Динамический диапазон изображения можно модифицировать с помощью полосы с левой стороны рядом с отображаемым изображением, что облегчает визуализацию полос. - Затем нажмите на значок Draw Line в верхнем меню правого окна и проследите линию, пересекающую перпендикулярно несколько полос / соединительных складок.
ПРИМЕЧАНИЕ: Профиль интенсивности отображается в центральном окне. - Щелкните верхнюю часть первого пика и переместите указатель мыши, удерживая левую кнопку мыши нажатой до тех пор, пока не будет достигнут следующий максимальный пик.
ПРИМЕЧАНИЕ: Информация отображается в профиле интенсивности, в то время как расстояние между двумя пиками отображается под графиком с номиналом "dx". - Щелкните правой кнопкой мыши, находясь на изображении правого окна, и выберите Сохранить ROI. Откройте сохраненные ROI (области интереса), щелкнув Загрузить ROI.
- Нажмите на значок стрелки в левом верхнем углу правого окна, нажмите на ROI и удалите его, нажав на значок корзины.
- Повторите эту операцию столько раз, сколько потребуется, из разных профилей интенсивности, чтобы получить прогнозируемое количество расстояний полосы AChR, которые будут представлять глобальное значение в анализируемой мышце.
ПРИМЕЧАНИЕ: Оптимальное значение N может быть рассчитано заранее на основе оценочной разницы между группами, α риск, мощность и одно- или двуххвостый тест. В текущем экспериментальном проекте был применен однохвостый тест Манна-Уитни (α риск = 10%; мощность = 80%), и значение N оценивалось как минимум в пять расстояний полосы AChR на NMJ для сравнения двух групп животных.
- Ширина полосы AChR
ПРИМЕЧАНИЕ: Ширина полосы (w) соответствует полумаксимальному (FWHM) профиля силы света, который представляет собой расстояние между точками, где значение флуоресценции сигнала α-BTX составляет половину его максимальной интенсивности (дополнительный рисунок 5).- С помощью программного обеспечения микроскопа выберите меню Количественная оценка в центральном окне.
- Нажмите на вкладку Инструменты в левом верхнем углу. Выберите Интенсивность в верхней левой панели и нажмите на значок Определить FWHM . Тик Сортировать каналы.
ПРИМЕЧАНИЕ: Чтобы оптимизировать обнаружение пиков программным обеспечением, Set Threshold и Width были установлены на 50 и 3 соответственно. Адаптируйте эти значения для каждого эксперимента и обратитесь за советом к опытному специалисту по визуализации. - Перейдите на вкладку Открыть проекты и выберите отфильтрованное изображение для анализа.
ПРИМЕЧАНИЕ: Можно увеличить отображаемое изображение в правом окне, прокрутив компьютерную мышь. Как указано выше (ПРИМЕЧАНИЕ после шага 5.8.3), динамический диапазон изображения может быть изменен для оптимальной визуализации полос. - Затем нажмите на значок Нарисовать прямоугольник в верхнем меню правого окна. Выберите горизонтальную или вертикальную полосу и нарисуйте прямоугольник перпендикулярно полосе. В центральном окне появится профиль.
- Нажмите на вертикальную или горизонтальную часть меню «Средняя проекция », расположенного на левой панели, в зависимости от того, является ли ориентация полосы вертикальной или горизонтальной.
- Нажмите на Статистика в центральном окне и прочитайте значение FWHM.
- Щелкните правой кнопкой мыши на изображении, отображаемом в правом окне, и выберите Сохранить рентабельность инвестиций.
ПРИМЕЧАНИЕ: Откройте сохраненные ROI, щелкнув Загрузить ROI. - Нажмите на значок стрелки в левом верхнем углу правого окна, нажмите на ROI и удалите его, нажав на значок корзины.
- Повторяйте эту операцию столько раз, сколько необходимо, из разных прямоугольных ROI до получения прогнозируемого количества ширин полос AChR, которое будет репрезентативным для глобального значения в анализируемой мышце.
6. Экспериментальное проектирование и статистические испытания
- Выполняйте статистический анализ с помощью специального программного обеспечения.
ПРИМЕЧАНИЕ: Данные были собраны из N ≥ 3 биологических реплик и не менее 20 NMJ на генотип для визуализации конфокального микроскопа и N ≥ 5 биологических реплик и N = 5 NMJ на генотип для визуализации STED в каждой экспериментальной группе. Значимость оценивалась по непарному тесту Манна-Уитни (непараметрическому), а p-значения указываются в соответствующих условных обозначениях рисунков.
Результаты
Чтобы облегчить морфологический анализ нервно-мышечных соединений на пред- и постсинаптическом уровне воспроизводимым образом, был разработан рабочий процесс от сбора мышечной массы до визуализации и количественной оценки с использованием программного обеспечения микроскопа и пользовательских макросов ImageJ (рисунок 1). Чтобы проиллюстрировать полезность этого протокола, была оценена морфология NMJ в двух мышиных моделях генетических нарушений, Smn2B / - и ColQDex2 / Dex2 , пораженных спинальной мышечной атрофией (СМА) и формой врожденного миастенического синдрома (CMS), соответственно, и данные сравнивались с соответствующими по возрасту контрольными однопометниками.
Структуру NMJ оценивали по передней и икроножной мышцам большеберцовой кости 3- и 6-недельных мышей Smn2B/- (фон C57Bl/6) и ColQDex2/Dex2 (фон B6D2F1/J) соответственно, когда признаки заболевания уже присутствуют у этих животных. В возрасте 3 недель мыши Smn2B/- демонстрируют признаки замедленного развития скелетных мышц и денервации, такие как атрофия NMJ и потеря35,36. Мыши CMS имеют первичную патологию у NMJ и проявляют снижение массы тела с первой недели жизни и выраженную мышечную слабость20 (данные не показаны). Как показано на рисунке 2А, постсинаптическая моторная концевая пластина, помеченная флуоресцентным α-бунгаротоксином, оказалась меньше и/или фрагментирована у мутантов двух линий мыши с помощью конфокальной микроскопии. Количественная оценка Z-стеков NMJ с использованием этого настраиваемого макроса ImageJ выявила заметное уменьшение объема концевой пластины, проекции максимальной интенсивности (MIP) и относительной извилистости как у мышей SMA, так и у CMS по сравнению с контрольной группой, как признаки дефектов созревания NMJ32 (рисунок 2B-D). Постсинаптический объем концевой пластины и MIP были уменьшены у больных животных (изменение складки на 2,7 и 2,0 для объема и 2,5 и 2,0 для MIP у мышей Smn2B / - и ColQDex2 / Dex2 соответственно). Относительная изношенность также была меньше у мышц с дефицитом SMN и ColQ, чем у мышей с дефицитом WT (16,97% ± 1,33% у СМА по сравнению с 48,84% ± 5,90% мышей с WT и 13,29% ± 2,79% у CMS против 30,20% ± 4,44% контрольных мышей). Кроме того, количественная оценка распределения пресинаптических концевых ветвей аксона с использованием пользовательского макроса ImageJ выявила измененную картину распределения нейрофиламента M в двух животных моделях с повышенной иммуномаркацией (84,65% ± 0,32% против 16,57% ± 2,03% и 23,64% ± 2,78% против 18,77% ± 1,73% у мышей Smn2B/- и ColQDex2/Dex2 по сравнению с контрольной группой, соответственно) (Рисунок 3A-D ). При окрашивании SV2 снижение коэффициента занятости на 43%, т.е. процента AChR-содержащих областей с прилегающими активными зонами нервных окончаний, также наблюдалось у мышей Smn2B/- (49,36% ± 3,76% в СМА по сравнению с 85,69% ± 2,34% WT мышей) (Рисунок 3E, F). Этот параметр NMJ также был рассчитан в GA мутантов ColQDex2 /Dex2, но статистически значимой разницы по сравнению с контрольными однопометниками не было обнаружено (данные не показаны).
Далее мы проанализировали характеристики постсинаптической мембраны, количественно определив расстояние между переходными складками и ширину полос AChR, которые расположены на гребне этих складок, в ColQ-дефицитной мышце с использованием микроскопии со стимулированным эмиссионным истощением сверхвысокого разрешения (STED). Как показано на рисунке 4, аспект этих структур может быть четко визуализирован с помощью флуоресцентной маркировки α-бунгаротоксина и анализа профиля интенсивности. Мы оценили эти параметры NMJ и обнаружили увеличение расстояния перехода (d) и ширины (w) полос AChR в икроножной мышце мутантов (358,3 нм ± 11,97 нм и 320,8 нм ± 10,90 нм для расстояния и 216,9 нм ± 10,51 нм и 186,3 нм ± 7,015 нм для ширины, в ColQDex2 / Dex2 по сравнению с мышами дикого типа, соответственно, p < 0,05) (рисунок 4C,D).
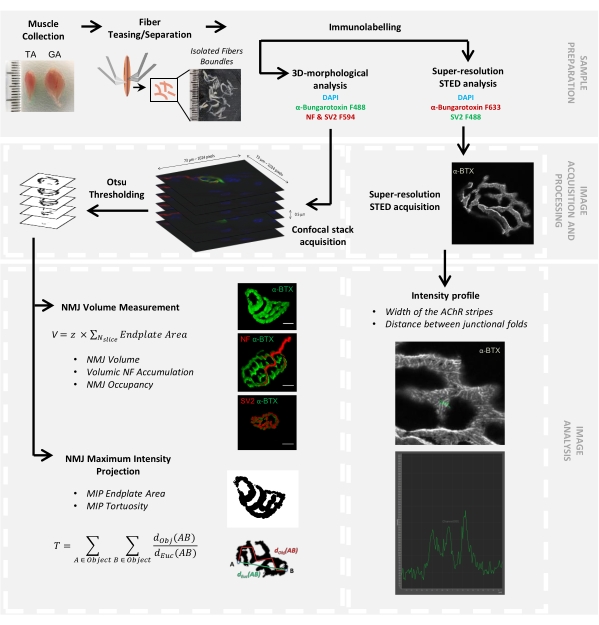
Рисунок 1: Блок-схема видеопротокола для 3D многомасштабной характеристики NMJ с помощью конфокальной и STED-микроскопии. Передние (TA) и икроножные мышцы были собраны у мышей, а мышечные волокна дразнили перед маркировкой α-бунгаротоксином-F488 или α-бунгаротоксином-F633, DAPI, первичными антителами, направленными против нейрофиламента M (NF-M) и синаптического гликопротеина 2 (SV2), и фторофорными (F488 или F594)-конъюгированными вторичными антителами. Стеки изображений были получены с помощью конфокальной микроскопии и обработаны для измерения постсинаптического объема NMJ, пресинаптического накопления NF-M, заполнения терминала аксона NMJ, площади концевой пластины постсинаптической проекции максимальной интенсивности (MIP) и извилистости (dObj(AB) - расстояние между A и B по периметру объекта (красная линия), тогда как dEuc(AB) — евклидово расстояние между A и B (зеленая линия)). Для микроскопического анализа ЗППП ширина полос ацетилхолиновых рецепторов (AChR) и расстояние между соединительными складками были количественно определены из профилей интенсивности окрашивания α-BTX-F633. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
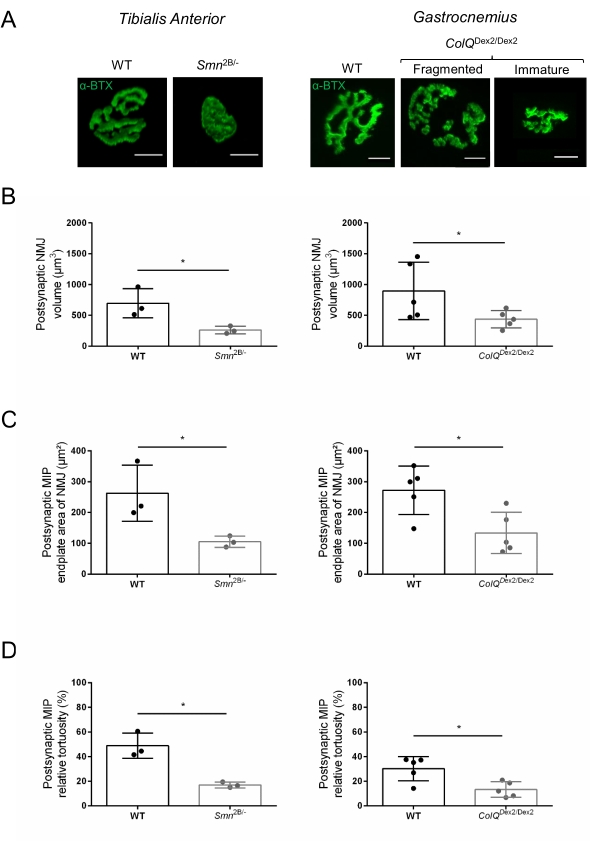
Рисунок 2: Многопараметрическая постсинаптическая характеристика NMJ в мышиных моделях спинальной мышечной атрофии (СМА) и врожденного миастенического синдрома, связанного с ColQ. (CMS). (A) Репрезентативные изображения постсинаптических моторных концевых пластин из мышц TA и GA, помеченных α-бунгаротоксином-F488 (α-BTX). (B) Количественная оценка объема постсинаптической концевой пластины NMJ, (C) области проекции максимальной интенсивности (MIP) и (D) относительной извилистости у TA 3-недельных мышей дикого типа (WT) и Smn2B/- (левые графики, N = 3 животных на генотип, n = 37 и n = 56 NMJ, соответственно) и 6-недельных WT и ColQDex2/Dex2 мыши (правые графики, N = 5 мышей на генотип, n = 89 и n = 97 NMJ соответственно). Данные выражаются в виде среднего значения на мышь (точку) ± SEM. Различия между группами были проанализированы с помощью теста Манна-Уитни (* p < 0,05). Шкала составляет 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
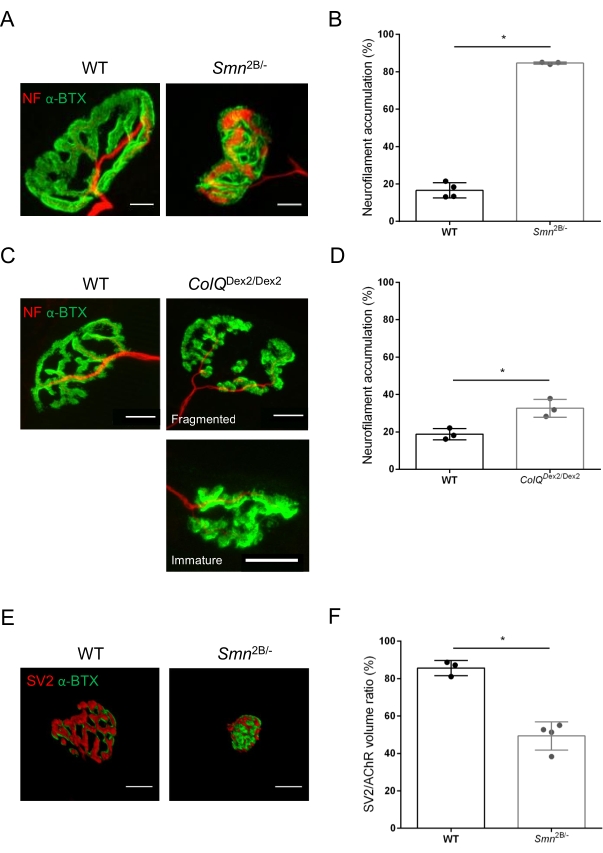
Рисунок 3: Морфометрический анализ терминального распределения пресинаптического аксона в мышцах WT и мутантных мышей. Картина иннервации NMJ у передних (TA) и икроножных мышц (GA) мышей дикого типа, SMA и CmS, связанных с ColQ. (А, Б) Репрезентативные нервно-мышечные соединения от ТА мышей WT и Smn2B/- в возрасте 21 дня, помеченные антителами против нейрофиламента M (NF-M, красный) и α-бунгаротоксина-F488 (α-BTX, зеленый) (A), и результаты количественного анализа накопления нейрофиламента (B); (С, Г) Репрезентативные нервно-мышечные соединения из GA 6-недельных мышей WT и ColQDex2/Dex2 , помеченные антителами против нейрофиламента M (NF-M, красный) и α-бунгаротоксина-F488 (α-BTX, зеленый), показывающие фрагментированные и незрелые постсинаптические концевые пластинки (C) и результаты накопления нейрофиламента в двух группах животных (D). N= 4 (n = 34 NMJ) (B) и N = 3 (n = 54 NMJ) (D) WT животных, и N= 3 (n = 36 NMJ) Smn2B/- и N = 3 (n = 55 NMJs) ColQDex2/Dex2 мышей были проанализированы в экспериментах (B, D). (Е, Ф) Репрезентативные изображения терминальной занятости аксонов в NMJ от TA 3-недельных мышей WT и Smn2B/- мышей, помеченных антителами против синаптического везикулярного гликопротеина 2 (SV2, красный) и α-бунгаротоксина-F488 (α-BTX, зеленый) (E), и результаты занятости NMJ (sv2/AChR объемное соотношение) (F). Были проанализированы мышцы из N = 3 (n = 50 NMJ) дикого типа и N = 4 (n = 62 NMJ) Smn2B/- мышей. Данные выражаются в виде среднего значения на мышь (точку) ± SEM. Различия между группами были проанализированы с помощью теста Манна-Уитни (* p < 0,05). Шкала 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
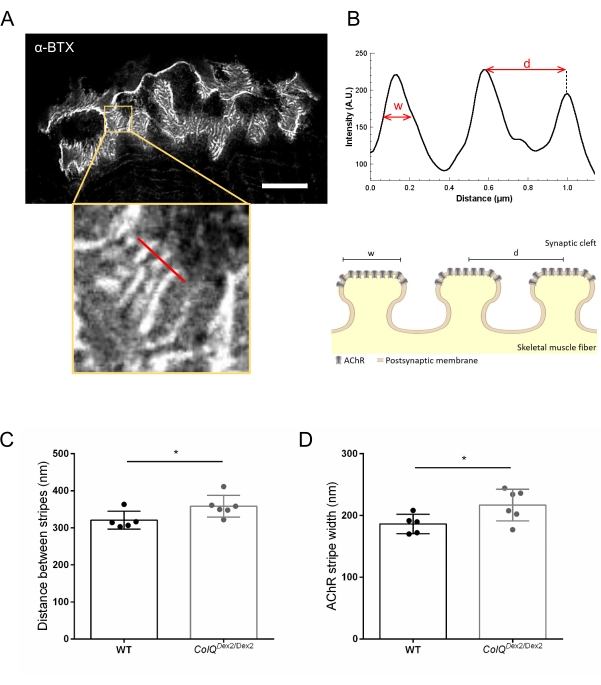
Рисунок 4: Визуализация ЗППП постсинаптических концевых пластин NMJ. (A) Репрезентативное изображение ЗППП NMJ, помеченное α-бунгаротоксином-F633 (α-BTX) от икроножной мышцы 6-недельной мыши дикого типа, показывающей полосы AChR послеперехода (шкала составляет 5 мкм). (B) Более высокое увеличение области с полосами AChR (нижняя панель), которая использовалась для создания профиля интенсивности. Ширина (w) полос AChR и расстояние между двумя соседними полосами (d) этой области были количественно определены и представлены в гистограмме. Схематическое представление постинаптической концевой пластины для иллюстрации ширины полосы AChR (w) и расстояния (d). Эти параметры, (C) расстояние полосы AChR и (D) ширина, были измерены у мышей ColQDex2 / Dex2 и контрольных однопометников в возрасте 6 недель. NMJ из 5 WT (общее n = 29 NMJ) и 6 ColQDex2/Dex2 (общее n = 43 NMJ) животных были проанализированы вслепую. Данные выражаются в виде среднего значения на мышь (точку) ± SEM. Статистические различия между группами анализировались с помощью теста Манна-Уитни (* p < 0,05). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Запуск программного обеспечения LAS X и параметры для конфокальных приобретений. Различные этапы получения конфокальных изображений описаны в разделах 3.1.2-3.1.7 протокола. Для каждого захвата стека NMJ открывается проект (шаг 3.1.4) и выбираются параметры размера изображения, скорости захвата, осей X, Y и Z (шаг 3.1.7), при этом указывается каждое последовательное сканирование (Seq.1, лазер 405 для DAPI; Seq.2, лазер 488 для α-BTX-F488; и Seq.3, лазер 552 для F594 конъюгированных вторичных антител). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Запуск программного обеспечения LAS X и параметры для приобретения STED. Этапы получения изображений STED описаны в разделах 3.2.2-3.2.8 протокола. Микроскоп запускается в конфигурационном режиме STED ON (шаг 3.2.2), и открывается проект (шаг 3.2.3). Указываются параметры получения изображения (шаг 3.2.7) (размер изображения, скорость захвата, коэффициент масштабирования, ось X) при каждом последовательном сканировании (Seq.1 для α-BTX-F633; Seq.2 для F488 конъюгированных вторичных антител). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Изображения α-BTX-окрашенных соединительных складок, полученных с помощью микроскопии STED. Примеры изображений постсинаптической концевой пластины, помеченной α-BTX-F633 от 6-недельной мыши дикого типа, которые были получены с правильным (слева) или неправильным фокусом (справа). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 4: Всплывающие окна Windows для описания входных и выходных данных, полученных пользовательскими макросами ImageJ. Примеры входных данных (.tif и .lif файлов) изображений NMJ показаны в левом столбце. Выходные данные макросов (правый столбец) сохраняются в папках (Save_Volume, Save_Accu), содержащих изображения соединения (.tif) и таблицы, содержащие результаты (.csv файлы). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 5: Анализ расстояния и ширины полос AChR при получении STED с использованием программного обеспечения LAS X. Этапы анализа изображений NMJ STED описаны в разделе 5 протокола. A) Изображение помеченной постсинаптической области концевой пластины, содержащей полосы AChR. Область, представляющая интерес для анализа полос, выбирается путем рисования перпендикулярной линии (зеленая линия, для расстояния полосы) или перпендикулярного прямоугольника (фиолетовый прямоугольник, для ширины полосы). (В, С) Показаны профили интенсивности выбранных областей и измерения для расчета расстояния между полосами AChR (B) и шириной полосы AChR (C). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный кодовый файл 1: Macro_NMJ_VOL_Marinelloetal. Пользовательский макрос ImageJ для извлечения измерений параметров NMJ (объем NMJ, область концевой пластины MIP и извилистость NMJ). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный кодовый файл 2: Macro_NMJ_ACCU_Marinelloetal. Пользовательский макрос ImageJ для извлечения накопления NF-M и окрашивания SV2. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Описанный видеопротокол предоставляет подробный метод количественной оценки 3D-структуры нервно-мышечных соединений путем объединения конфокальной и ЗППП микроскопии, которая может быть использована для характеристики патологических изменений на пред- и постсинаптическом уровнях. Высокое разрешение микроскопии STED позволяет визуализировать и морфометрически анализировать наноструктуры, которые не идентифицируются с помощью обычной конфокальной визуализации. Эта процедура позволила нам измерить структурные изменения NMJ в двух аппендикулярных мышцах, большеберцовой передней и икроножной, у мышей, связанных с SMA и CmS, связанных с ColQ.
Для получения достоверных результатов с помощью этой методики крайне важно правильно рассекать и дразнить мышцы, уделяя особое внимание фасциям, окружающим мышцу, и приложенной силе к отдельным мышечным пучкам; в противном случае паттерн иннервации может быть нарушен, препятствуя надлежащей пресинаптической оценке НМЮ. Хотя подробная информация предоставляется для анализа NMJ из TA и GA, в принципе, этот протокол может быть адаптирован к другим мышцам, включая плоские мышцы, такие как диафрагма или поперечный живот37, которые не требуют этапа дразнения. Фиксация тканей также имеет решающее значение для обеспечения хорошего качества окрашивания; поэтому рекомендуется использовать качественную ПФА при соответствующем объеме (в 15-20 раз больше, чем у мышцы). Кроме того, время воздействия фиксатора является важным этапом, поскольку артефакты, такие как усадка и слипание, могут появляться из-за чрезмерной фиксации и влияния на особенности NMJ. Учитывая размер образцов и скорость проникновения раствора параформальдегида в ткани38, для этого типа мышц рекомендуется время фиксации 18-24 ч. В случае, если этап окрашивания планируется более чем через неделю после сбора ткани, рекомендуется сохранять фиксированные мышцы PFA в PBS, дополненные азидом натрия при 4 ° C, чтобы предотвратить бактериальную пролиферацию.
Этот протокол представляет собой подход, использующий α-BTX-F488 для конфокальной и α-BTX-F633 для визуализации STED. Эти флуорофоры были выбраны в соответствии с описанной экспериментальной конструкцией, но могут быть модифицированы в соответствии с имеющимся оборудованием и материалами. Например, маркировка α-BTX F488 может быть выбрана при использовании лазера STED CW 592 нм для получения и количественной оценки изображений. Однако представляется, что конфигурация, которая была применена в настоящем исследовании (импульсное возбуждение с затвором STED, истощение 775 нм), демонстрирует более высокую производительность и лучшее разрешение, чем другие подходы, такие как непрерывная волна STED39, что делает ее более подходящей для текущего применения. Также важно тщательно выбирать настройки мощности лазера, особенно для STED (как возбуждения, так и истощения), поскольку характеристики профиля интенсивности не могут быть измерены в случае насыщения, и поэтому любой насыщенный сигнал в изображении NMJ может поставить под угрозу весь анализ.
Этот подробный рабочий процесс, включая получение и анализ изображений с использованием программного обеспечения микроскопа и макросов ImageJ, был разработан для облегчения автономного морфометрического анализа NMJ с помощью конфокальной и STED-микроскопии из одной мышцы. Ранее описанные рабочие процессы для конфокального анализа NMJ, такие как NMJ-morph2 или NMJ-Analyser14, проложили путь для разработки полуавтоматических методов, облегчающих морфологический анализ NMJ и сравнительные исследования. NMJ-morph (и его обновленная версия aNMJ-morph15) - это бесплатная платформа на основе ImageJ, которая использует проекцию максимальной интенсивности для измерения 21 морфологического признака, а NMJ-Analyser использует скрипт, разработанный на Python, который генерирует 29 релевантных параметров из всей структуры 3D NMJ. Ручное пороговое значение является единственным шагом во время обработки изображений в этих двух методах, требующих пользовательского анализа. Этот интегрированный протокол детализирует этапы подготовки тканей, получения 3D-конфокальных изображений и обработки NMJ из целых скелетных мышц на основе ImageJ и обеспечивает упрощенный обзор пяти важных параметров постсинаптических (объем, максимальная площадь проекции и извилистость) и пресинаптических (терминальная занятость аксонов и накопление нейрофиламента) концевых пластин. Дополнительный параметр биологической значимости , схема организации AChR постсинаптических соединительных складок , была включена для морфометрического анализа на наноуровневом уровне методом микроскопии STED сверхвысокого разрешения (разрешение 20-30 нм)40. Интересно, что подготовка тканей к визуализации ЗППП проще, чем другие методы, используемые для ультраструктурных исследований NMJ, такие как обычная просвечивающая электронная микроскопия (ТЭМ)9, которая является довольно сложной и трудоемкой процедурой, требующей квалифицированного манипулятора для получения ультратонких участков соответствующей мышечной области. Кроме того, количественные данные из нескольких соединительных складок могут быть получены автоматически с помощью программного обеспечения, связанного с STED.
Этот протокол был применен для иллюстрации ранее известных дефектов NMJ в SMN и ColQ дефицитныхмышцах 20,36,41,42. Общие изменения были обнаружены в двух моделях мышей с помощью конфокальной микроскопии, такие как уменьшение объема постсинаптической концевой пластины, области MIP и относительной извилистости, а также увеличение накопления нейрофиламента, тогда как некоторые более конкретные результаты (снижение занятости NMJ) наблюдались только у мышей с СМА, как показатель нарушения трафика везикул36. Наконец, увеличение расстояния и ширины полос aChR было обнаружено в ColQ-KO с помощью анализа STED, которые являются признаками ультраструктурных дефектов в постсинаптических соединительных складках, как ранее наблюдалось TEM20. Важно отметить, что этот протокол может помочь в более глубокой морфологической характеристике нервно-мышечных соединений во время развития, поддержания и при различных патологических состояниях.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов, связанного с данной работой.
Благодарности
Мы благодарим «Центр визуализации и цитометрии ядра» Genethon, а также гистологическую службу, которая частично поддерживается фондами оборудования из региона Иль-де-Франс, Генерального совета Эссона, Генопольского решерша Эври, Университета Эври Валь д'Эссон и INSERM, Франция. Мы также благодарны доктору Рашми Котари за предоставление линии мышей Smn2B/2B (Университет Оттавы, Канада) и доктору Эрику Крейчи за линию мышей ColQDex2/+ (не опубликовано, Парижский университет, Франция). Мы благодарим Гийома Корре за его поддержку в статистическом анализе. Моноклональные антитела 2H3 (разработанные Jessel, T.M. и Dodd, J.) и SV2 (разработанные Buckley, K.M.) были получены из Банка исследований развития Hybridoma Bank (DSHB), созданного NICHD NIH и поддерживаемого в Университете Айовы, Департамент биологии, Айова-Сити, IA 52242. Эта работа была поддержана Французской ассоциацией по борьбе с миопатиями (AFM-Telethon), INSERM и Университетом Эври Валь д'Эссон.
Материалы
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
Ссылки
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304(2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671(2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677(2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220(2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251(2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128(2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- ImageJ. , Available from: http://imagej.nih.gov/ij (2021).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Bio-Formats. , Available from: http://www.openmicroscopy.org/bio-formats/downloads/ (2021).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, Supplement C 253-261 (2013).
- ImageJ documentation. , Available from: http://imagejdocu.tudor.lu/plugin/analysis/geodesic_distances/start (2021).
- GitHUb. , Available from: https://github.com/Genethon/ImCy (2021).
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162(2014).
- Baker, J. R. Principles of biological microtechnique; a study of fixation and dyeing. , Wiley. London Methuen; New York. at http://archive.org/details/principlesofbiol01bake (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421(2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644(2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605(2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены