A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير الحي لحالة الميتوكوندريا الجلوتاثيون ريدوكسي في الخلايا العصبية الأولية باستخدام مؤشر قياس النسب
In This Article
Summary
توضح هذه المقالة بروتوكول لتحديد الاختلافات في حالة الأكسدة القاعدية واستجابات الأكسدة الحمراء للاضطرابات الحادة في الخلايا العصبية الأولية فرس النهر والقشرية باستخدام المجهر الحي confocal. يمكن تطبيق البروتوكول على أنواع الخلايا الأخرى والمجاهر مع الحد الأدنى من التعديلات.
Abstract
الميتوكوندريا الأكسدة التوازن مهم البقاء العصبية وظيفة. على الرغم من أن الميتوكوندريا تحتوي على العديد من أنظمة الأكسدة، يعتبر الجلوتاثيون العازلة للثيول-ديسول-ديسولفيد الوفيرة جدا لاعبا مركزيا في الدفاعات المضادة للأكسدة. ولذلك، قياس إمكانات أكسدة الجلوتاثيون الميتوكوندريا يوفر معلومات مفيدة حول حالة الأكسدة الميتوكوندريا والإجهاد التأكسدي. Glutaredoxin1-roGFP2 (Grx1-roGFP2) هو مؤشر نسبي مشفر وراثيا والأخضر الفلوري (GFP) لإمكانات أكسدة الجلوتاثيون التي لديها قمتين للإثارة حساسة للأكسدة عند 400 نانومتر و490 نانومتر مع ذروة انبعاث واحدة عند 510 نانومتر. توضح هذه المقالة كيفية إجراء المجهر الحي confocal من الميتوكوندريا المستهدفة Grx1-roGFP2 في الخلايا العصبية فرس النهر والقشرية الأولية. وهو يصف كيفية تقييم حالة ثابتة الميتوكوندريا الجلوتاثيون أكسدة المحتملة (على سبيل المثال، لمقارنة حالات المرض أو العلاجات على المدى الطويل) وكيفية قياس التغيرات الأكسدة على العلاجات الحادة (باستخدام المخدرات excitotoxic N-ميثيل-D-الأسبارتات (NMDA) كمثال). بالإضافة إلى ذلك ، يعرض المقال التصوير المشترك ل Grx1-roGFP2 ومؤشر إمكانات غشاء الميتوكوندريا ، tetramethylrhodamine ، استر الإيثيل (TMRE) ، لإظهار كيف يمكن مضاعفة Grx1-roGPF2 مع مؤشرات إضافية للتحليلات متعددة البارامترية. يوفر هذا البروتوكول وصفا مفصلا لكيفية (1) تحسين إعدادات مجهر المسح بالليزر البؤري ، (2) تطبيق الأدوية للتحفيز تليها معايرة الاستشعار مع دياميد وديثيوثيريتول ، و (3) تحليل البيانات مع ImageJ / FIJI.
Introduction
العديد من الإنزيمات الميتوكوندريا الهامة وجزيئات الإشارات تخضع لتنظيم أكسدة الثيول1. وعلاوة على ذلك، الميتوكوندريا هي مصدر خلوي رئيسي لأنواع الأكسجين التفاعلية وعرضة بشكل انتقائي للتلف التأكسدي2. وبناء على ذلك، فإن إمكانات أكسدة الميتوكوندريا تؤثر بشكل مباشر على الجيوجيات الحيوية، وإشارات الخلايا، ووظيفة الميتوكوندريا، وفي نهاية المطاف صلاحية الخلية3،4. مصفوفة الميتوكوندريا يحتوي على كميات عالية (1-15 mM) من الغلوتاثيون العازلة أكسدة الثيول-ديسوليد (GSH) للحفاظ على التوازن الأكسدة وجبل الدفاعات المضادة للأكسدة5,6. يمكن ربط GSH بشكل مشترك بالبروتينات المستهدفة (S-glutathionylation) للتحكم في حالة الأكسدة ونشاطها ويستخدم من قبل مجموعة من الإنزيمات مزيلة للسموم التي تقلل من البروتينات المؤأكسدة. ولذلك، فإن إمكانات أكسدة الجلوتاثيون الميتوكوندريا هي معلمة غنية بالمعلومات للغاية عند دراسة وظيفة الميتوكوندريا والفيزيولوجيا المرضية.
roGFP2 هو البديل من GFP التي جعلت من حساسية الأكسدة بإضافة اثنين من السيستينات السطحية المكشوفة التي تشكل ثنائي ثنائي هذاول-ديبريتيد الاصطناعية 7,8. لديها ذروة انبعاث واحد في ~ 510 نانومتر وقممتين الإثارة في ~ 400 نانومتر و 490 نانومتر. الأهم من ذلك ، فإن السعة النسبية للقممتين الإثارة تعتمد على حالة الأكسدة من roGFP2 (الشكل 1) ، مما يجعل هذا البروتين جهاز استشعار نسبة. في مستشعر Grx1-roGFP2، تم دمج الجلوتاريدوشين-1 البشري (Grx1) في N-terminus من roGFP29,10. المرفق التكافؤي لانزيم Grx1 إلى roGFP2 يتيح اثنين من التحسينات الرئيسية للاستشعار: فهو يجعل استجابة الاستشعار محددة لزوج GSH / GSSG الجلوتاثيون أكسدة (الشكل 1)، وأنه يسرع التوازن بين GSSG وroGFP2 بعامل لا يقل عن 100،0009. لذلك ، يتيح Grx1-roGFP2 تصويرا محددا وديناميكيا لإمكانات أكسدة الجلوتاثيون الخلوية.
يمكن إجراء التصوير Grx1-roGFP2 على مجموعة واسعة من المجاهر، بما في ذلك المجاهر الفلورية واسعة النطاق، والمجاهر confocal القرص الغزل، والمجاهر confocal المسح بالليزر. يمكن تحقيق التعبير عن المستشعر في الخلايا العصبية الأولية بطرق مختلفة تشمل شفط الدهون11 ، الحمض النووي / الكالسيوم فوسفات coprecipitation12 ، نقل الجينات بوساطة الفيروس ، أو استخدام الحيوانات المعدلة وراثيا كمصدر للخلية (الشكل 2). الزائفة المؤتلفة الفيروسات المرتبطة أدينو (rAAV) التي تحتوي على نسبة 1:1 من AAV1 وAAV2 capsid البروتينات 13,14 استخدمت للتجارب في هذه المقالة. مع هذا المتجه ، عادة ما يتم الوصول إلى أقصى تعبير استشعار بعد 4-5 أيام من العدوى ويبقى مستقرا لمدة أسبوعين على الأقل. لقد استخدمنا بنجاح Grx1-roGFP2 في الخلايا العصبية فرس النهر والقشرية الأولية من الفئران والجرذان.
في هذه المقالة، يتم استخدام التعبير بوساطة rAAV من الميتوكوندريا المستهدفة Grx1-roGFP2 في فرس النهر الفئران الأولية والخلايا العصبية القشرية لتقييم حالة أكسدة الجلوتاثيون الميتوكوندريا القاعدية واضطراباتها الحادة. يتم توفير بروتوكول للتصوير الحي confocal مع تعليمات مفصلة حول كيفية (1) تحسين إعدادات المجهر confocal المسح بالليزر ، (2) تشغيل تجربة التصوير الحي ، و (3) تحليل البيانات مع فيجي.
Protocol
وتتوافق جميع التجارب على الحيوانات مع المبادئ التوجيهية الوطنية والمؤسسية، بما في ذلك توجيه المجلس 2010/63/EU للبرلمان الأوروبي، وكانت لها موافقة أخلاقية كاملة من وزارة الداخلية (مكتب رعاية الحيوان بجامعة هايدلبرغ وريجيرونغسبرايسيديوم كارلسروه، رخصا T14/21 و T13/21). تم إعداد الخلايا العصبية الأولية فرس النهر والقشرية من الفئران حديثي الولادة أو الجراء الفئران وفقا للإجراءات القياسية والحفاظ عليها لمدة 12-14 يوما كما هو موضح سابقا13.
1. إعداد الحلول
- حلول المخزون للتخزين المؤقت للتصوير
- إعداد كل حل الأسهم وفقا للجدول 1 والاحتفاظ بها في 4 درجة مئوية. للتخزين على المدى الطويل (>3 أشهر)، والحفاظ على aliquots في -20 درجة مئوية.
| مكون | ميغاواط | التركيز (M) | المبلغ (ز) | وحدة التخزين (مل) |
| ناكل | 58.44 | 5 | 14.61 | 50 |
| KCl | 74.55 | 3 | 1.12 | 5 |
| MgCl2 · 6H2O | 203.3 | 1.9 | 2 | 5 |
| كاكلين2·2H2O | 147.01 | 1 | 1.47 | 10 |
| غليسين | 75.07 | 0.1 | 0.375 | 50 |
| سكروز | 342.3 | 1.5 | 25.67 | 50 |
| بيروفات الصوديوم | 110.04 | 0.1 | 0.55 | 50 |
| هيبس | 238.3 | 1 | 11.9 | 50 |
| الجلوكوز | 180.15 | 2.5 | 45 | 100 |
الجدول 1: حلول المخزون الخاصة بالتخزين المؤقت للتصوير.
- الأسهم حلول المخدرات والأصباغ
- حل دياميد (DA؛ يستخدم لمعايرة نسبة 405:488 القصوى) في الماء للحصول على محلول مخزون 0.5 M (على سبيل المثال، 1 غرام في 11.615 مل من الماء). Aliquot وتخزينها في -20 درجة مئوية.
- حل dithiothreitol (DTT؛ تستخدم لمعايرة الحد الأدنى من نسبة 405:488) في الماء للحصول على محلول الأسهم 1 M (على سبيل المثال، 5 غرام في 32.425 مل من الماء). عليكوت وتخزينها في -20 درجة مئوية لمدة أقصاها 3 أشهر.
- حل N-ميثيل-D-الأسبارتات (NMDA; تستخدم للحث على السمية والميتوكوندريا) في الماء للحصول على محلول مخزون 10 mM (على سبيل المثال, 25 ملغ في 16.991 مل من الماء). تخزين الاقتباسات في -20 درجة مئوية. للتخزين على المدى الطويل (>6 أشهر)، والحفاظ على aliquots في -80 درجة مئوية.
- تتراميتيل هودامين إيثيل استر بيركلورات (TMRE؛ مؤشر جزيء صغير من إمكانات غشاء الميتوكوندريا)
- حل مسحوق TMRE في الميثانول للحصول على مخزون 20 مليون متر (على سبيل المثال، 25 ملغ في 2.427 مل من الميثانول).
- تمييع مخزون 20 mM 1:1,000 في الميثانول للحصول على مخزون 20 ميكرومتر.
- Aliquot حلول الأسهم 20 mM و 20 ميكرومتر، ختم مع parafilm، وتخزين محمية من الضوء في -20 درجة مئوية.
ملاحظة: كلا المخازن حلول مستقرة لعدة سنوات. استخدم حل المخزون 1000x (20 ميكرومتر) للتجارب.
- المخزن المؤقت للتصوير
- إعداد 100 مل من العازلة التصوير عن طريق إضافة جميع المكونات من الجدول 2 إلى 80 مل من الماء العقيم في اسطوانة قياس. رفع مستوى الصوت يصل إلى 100 مل مع الماء العقيم. مزيج عن طريق هز بعناية اسطوانة قياس حتى يبدو الحل متجانسة.
ملاحظة: من المستحسن استخدام مقياس التناضح للتحقق من osmolarity المخزن المؤقت. وينبغي أن تكون أقرب ما يمكن إلى متوسط النمو من الخلايا. هنا، وهذا هو 315 mOsmol / L. زيادة أو تقليل تركيز السكروز حسب الحاجة لتتناسب مع osmolarity من العازلة التصوير ومتوسط النمو. - ضبط درجة الحموضة إلى 7.4. جعل aliquots والاحتفاظ بها في 4 درجة مئوية لمدة تصل إلى أسبوعين. للتخزين على المدى الطويل، والحفاظ على aliquots في -20 درجة مئوية. دع المخزن المؤقت للتصوير يصل إلى درجة حرارة الغرفة قبل الاستخدام.
- إعداد 100 مل من العازلة التصوير عن طريق إضافة جميع المكونات من الجدول 2 إلى 80 مل من الماء العقيم في اسطوانة قياس. رفع مستوى الصوت يصل إلى 100 مل مع الماء العقيم. مزيج عن طريق هز بعناية اسطوانة قياس حتى يبدو الحل متجانسة.
| مكون | حل المخزون (M) | التركيز النهائي (mM) | وحدة التخزين (مل) |
| ناكل | 5 | 114 | 2.3 |
| KCl | 3 | 5.29 | 0.176 |
| MgCl2 | 1.9 | 1 | 0.053 |
| كاكلين2 | 1 | 2 | 0.2 |
| غليسين | 0.1 | 0.005 | 0.005 |
| سكروز | 1.5 | 52 | 3.5 |
| بيروفات الصوديوم | 0.1 | 0.5 | 0.5 |
| هيبس | 1 | 10 | 1 |
| الجلوكوز | 2.5 | 5 | 0.2 |
الجدول 2: تكوين المخزن المؤقت للتصوير. وتستخدم وحدات التخزين المشار إليها لإعداد 100 مل من المخزن المؤقت للتصوير.
- حلول للتحفيز والمعايرة
ملاحظة: قم بإعداد حلول التحفيز الجديدة دائما عن طريق إضافة حلول مخزون الأدوية المشار إليها إلى المخزن المؤقت للتصوير قبل التجربة مباشرة. سيتم إضافة حلول التحفيز والمعايرة إلى غرفة التصوير بالتتابع أثناء التجربة (انظر الأقسام 3-5). اعتمادا على نوع التجربة، مطلوب حلول مختلفة للوصول إلى نفس التركيز النهائي في الحجم النهائي المعني في غرفة التصوير.- إعداد محلول NMDA 3x (90 ميكرومتر؛ التركيز النهائي في الغرفة: 30 ميكرومتر) عن طريق إضافة 63 ميكرولتر من مخزون NMDA سعة 10 أمتار إلى 6.937 مل من المخزن المؤقت للتصوير. إضافة 500 ميكرولتر من الحل الناتج إلى الغرفة (الحجم النهائي: 1.5 مل).
- إعداد حل DA 2x للخطوات 3 و 4 (1 mM؛ التركيز النهائي في الغرفة: 0.5 mM) عن طريق إضافة 14 ميكرولتر من مخزون DA 0.5 M إلى 6.986 مل من المخزن المؤقت للتصوير. أضف 1 مل إلى الغرفة (المجلد النهائي: 2 مل).
- إعداد حل DA 4x للخطوة 5 (2 mM؛ التركيز النهائي في الغرفة: 0.5 mM) عن طريق إضافة 28 ميكرولتر من مخزون DA 0.5 M إلى 6.972 مل من المخزن المؤقت للتصوير. أضف 500 ميكرولتر إلى الغرفة (الحجم النهائي: 2 مل).
- إعداد محلول DTT 1x (5 mM؛ التركيز النهائي في الغرفة: 5 mM) عن طريق إضافة 45 ميكرولتر من مخزون DTT M 1 إلى 8955 ميكرولتر من المخزن المؤقت للتصوير. أضف 1 مل من هذا الحل إلى الغرفة بعد قرصنة المخزن المؤقت للتصوير (الحجم النهائي: 1 مل).
2. تحميل الخلايا مع TMRE
ملاحظة: في هذا البروتوكول، TMRE يستخدم في mode15 غير quench بتركيز نهائي من 20 nM. بشكل عام، ينبغي استخدام أقل تركيز ممكن من TMRE التي لا تزال توفر كثافة إشارة كافية على المجهر من اختيار. بسبب التبخر غير المتكافئ ، يمكن أن يختلف حجم المتوسط في الآبار المختلفة في الثقافات الأولية على المدى الطويل. لضمان تركيز TMRE ثابت في جميع الآبار، لا تقم بإضافة TMRE مباشرة إلى الآبار. بدلا من ذلك، استبدل الوسيطة في كل بئر بنفس الكمية من الوسيط المحتوي على TMRE. تم تصميم البروتوكول أدناه للخلايا العصبية الأولية في لوحات 24 بئرا تحتوي على ~ 1 مل من المتوسط لكل بئر.
- العمل في غطاء محرك السيارة تدفق صفح زراعة الأنسجة، وجمع 500 ميكروغرام من المتوسطة من كل بئر في أنبوب مخروطي واحد.
- لكل بئر، أضف 0.5 ميكرولتر من مخزون TMRE 20 ميكرومتر في الأنبوب المخروطي (على سبيل المثال، 12 ميكرولتر ل 24 بئرا).
- استنشق الوسط المتبقي بعناية من البئر الأول واستبدله ب 500 ميكرولتر من المتوسط المحتوي على TMRE. تابع، بشكل جيد، مع الآبار المتبقية.
ملاحظة: الحرص على عدم السماح للخلايا تجف وعدم إزعاج الخلايا. - إعادة الخلايا إلى الحاضنة وانتظر ما لا يقل عن 60 دقيقة لصبغ التوازن.
ملاحظة: يمكن تمديد وقت التحميل لعدة ساعات دون آثار ضارة. - لضمان تركيزات TMRE متسقة والازواية في جميع أنحاء تجربة التصوير، تأكد من تضمين تركيز نهائي من 20 NM TMRE في المخزن المؤقت للتصوير وجميع حلول التحفيز.
3. التحسين من المسح الضوئي إعدادات المجهر confocal
ملاحظة: تهدف هذه الخطوة إلى إيجاد أفضل حل وسط بين جودة الصورة وقابلية الخلية للحياة أثناء التصوير المباشر. يصف هذا القسم تحسين إعدادات التصوير roGFP. إذا تم إجراء التصوير متعدد البارامترات، يجب إجراء تحسين مماثل، بما في ذلك التحقق من وجود خط أساس مستقر دون علامات التبييض أو السمية الضوئية، للمؤشرات الإضافية.
- بدء المجهر confocal وتحميل الإعدادات القياسية للتصوير GFP (488 نانومتر الإثارة، 505 - 550 نانومتر الانبعاثات).
- تعيين الكاشف إلى 12 بت أو 16 بت.
ملاحظة: عادة، 8 بتات غير كافية للتصوير الكمي. - تنشيط وضع المسح المتتابع وإضافة تسلسل / مسار ثاني (405 نانومتر إثارة، 505 - 550 نانومتر انبعاث).
- لكلا القناتين، حدد جدول بحث زائف اللون يشير إلى وحدات بكسل فوق وتحت عرض (على سبيل المثال، GLOW OU).
- حدد هدفا مناسبا للهدف محل الاهتمام.
ملاحظة: 10x-40x مناسبة لتحليل خلية واحدة، 63x-100x هي مناسبة لتحليل ميتوشوندريون واحد. - قم بتركيب غطاء مع خلايا في غرفة التصوير، وأضف 1 مل من المخزن المؤقت للتصوير، وضع الحجرة على المجهر.
- استخدام العدسة والضوء المنقول لتركيز الخلايا.
ملاحظة: لا تستخدم ضوء الفلورة لتحديد موقع الخلايا وتركيزها. حتى في انخفاض الطاقة، وهذا سوف يؤثر سلبا على الخلايا. - تسجيل الصور بتنسيقات بكسل مختلفة. استنادا إلى هذه الصور، حدد أقل عدد بكسل يعطي دقة مقبولة لهيكل الاهتمام.
ملاحظة: عادة، تعمل 512 × 512 بكسل بشكل جيد للتصوير أحادي الخلية مع أهداف 20x و 40x، و 1024 × 1024 أو 2048 x2048 بكسل تعمل بشكل جيد للتصوير أحادي الميتوشوندريون بهدف 63x. - تسجيل الصور مع أحجام الثقب مختلفة. استنادا إلى هذه الصور، حدد أكبر حجم الثقب الذي يعطي دقة مقبولة من هيكل الفائدة.
ملاحظة: عادة، 3-7 وحدات متجدد الهواء تعمل بشكل جيد. - تسجيل الصور مع كثافة الليزر المختلفة.
- ضبط كسب الكاشف والعتبة وفقا لذلك. وبناء على هذه الصور، حدد أقل كثافة ليزرية تمنح شدة إشارة مقبولة ونسبة الإشارة إلى الخلفية.
- لتحديد نسبة الإشارة إلى الخلفية، قم بقياس كثافة الإشارة في منطقة الاهتمام (ROI) التي تحتوي على خلايا أو الميتوكوندريا (ROI1) وفي عائد الاستثمار بدون خلايا أو الميتوكوندريا (ROI2). ثم، تقسيم شدة ROI1 على كثافة ROI2.
ملاحظة: تهدف إلى نسبة إشارة إلى الخلفية من >3 وكثافة إشارة من ROIs الفردية من 200-1،000 ل405 نانومتر الإثارة مع 1-3٪ قوة الليزر وكثافة من ROIs الفردية من 300-1،500 ل488 نانومتر الإثارة مع 1٪ قوة الليزر.
- لتحديد نسبة الإشارة إلى الخلفية، قم بقياس كثافة الإشارة في منطقة الاهتمام (ROI) التي تحتوي على خلايا أو الميتوكوندريا (ROI1) وفي عائد الاستثمار بدون خلايا أو الميتوكوندريا (ROI2). ثم، تقسيم شدة ROI1 على كثافة ROI2.
- ضبط كسب الكاشف والعتبة وفقا لذلك. وبناء على هذه الصور، حدد أقل كثافة ليزرية تمنح شدة إشارة مقبولة ونسبة الإشارة إلى الخلفية.
- تسجيل الصور بسرعات مسح ضوئي مختلفة وعدد متوسطات الإطارات. سجل 4-5 صور لكل مجموعة من الإعدادات. استنادا إلى سلسلة الصور هذه، حدد أعلى سرعة وأقل متوسط للإعدادات التي تعطي ضوضاء صورة مقبولة وتقلب الصورة إلى الصورة.
ملاحظة: تعمل سرعة المسح الضوئي 600 هرتز و 1-2 إطارات لمرحلة متوسطة بشكل جيد في معظم الحالات. - باستخدام غطاء جديد، سجل سلسلة الفاصل الزمني مع الإعدادات المحسنة.
ملاحظة: يجب أن تشبه مدة السلسلة وفترة الصورة مدة السلسلة وفترة التجارب المخطط لها. - في نهاية سلسلة الفاصل الزمني، أضف 1 مل من حل DA 2x إلى غرفة التسجيل. صورة لمدة دقيقتين إضافيين.
- يستنشق المخزن المؤقت للتصوير باستخدام مضخة عمودية أو ماصة محمولة باليد. إضافة 1 مل من حل DTT 1x. صورة لمدة 5 دقائق إضافية.
- تحليل تجربة الفاصل الزمني (انظر القسم 5).
- تحقق من أن أي من القناتين يحصل على أكثر أو تحت يتعرض أثناء DA- و DTT-العلاج مع الإعدادات المحسنة.
- ضمان عدم تعرض أي من القناتين تبييضا كبيرا أثناء التسجيل الزمني؛ تهدف إلى فقدان <2٪ من كثافة بين الصور الأولى والأخيرة.
- تحقق من أن نسبة 405:488 لا تتغير بشكل كبير أثناء التصوير.
- كرر الإجراء بأكمله بطريقة تكرارية، باستخدام عدة أغطية، حتى يتم تعريف الإعدادات التي توفر نتائج مقبولة باستمرار.
4. تقييم حالة الأكسدة القاعدية
- بدء تشغيل المجهر وتحميل الإعدادات الأمثل من القسم 3.
- تعيين متوسط الإطار إلى 3-5.
- قم بتركيب غطاء مع خلايا في غرفة التصوير، وأضف 1 مل من المخزن المؤقت للتصوير، وضع الحجرة على المجهر.
- استخدام العدسة والضوء المنقول لتركيز الخلايا.
ملاحظة: لا تستخدم ضوء الفلورة لتحديد موقع الخلايا وتركيزها. حتى في انخفاض الطاقة، وهذا سوف يؤثر سلبا على الخلايا. - التبديل إلى وضع المسح الضوئي واستخدام قناة 488 نانومتر في عرض حي للتركيز وتحديد موقع الخلايا للتصوير.
- استخدم الدالة متعددة النقاط لتحديد حقول العرض 3-5 على غطاء.
- تسجيل صورة أساس.
- إضافة 1 مل من 2x DA حل للغرفة.
- بعد 1 و2 و3 دقائق، استخدم طريقة العرض المباشر لتأكيد/ضبط التركيز ثم تسجيل صورة.
ملاحظة: عادة ما تتأكسد الخلايا بالكامل بعد دقيقتين. - استبدل المخزن المؤقت في غرفة التصوير بمحلول 1 مل من 1x DTT.
- بعد 3 و 5 دقائق، استخدم العرض المباشر لتأكيد/ضبط التركيز ثم تسجيل صورة.
ملاحظة: عادة ما يتم تقليل الخلايا بالكامل بعد 4-5 دقائق.
5. التصوير الحي للعلاجات الحادة
ملاحظة: يصف البروتوكول أدناه تصوير استجابة الأكسدة الميتوكوندريا لعلاج NMDA. قد تحتاج فترات الصورة ومدة التجربة إلى تعديلها للعلاجات الأخرى.
- بدء تشغيل المجهر وتحميل الإعدادات الأمثل من القسم 3.
- تعيين الفاصل الزمني الفاصل الزمني إلى 30 ثانية والمدة إلى 25 دقيقة.
- قم بتركيب غطاء مع خلايا في غرفة التصوير، وأضف 1 مل من المخزن المؤقت للتصوير، وضع الحجرة على المجهر.
ملاحظة: لتجنب انجراف التركيز الحراري، اترك الخلايا على مرحلة المجهر لمدة 10-15 دقيقة قبل بدء التصوير الفاصل الزمني. - استخدام العدسة والضوء المنقول لتركيز الخلايا.
ملاحظة: لا تستخدم ضوء الفلورة لتحديد موقع الخلايا وتركيزها. حتى في انخفاض الطاقة، وهذا سوف يؤثر سلبا على الخلايا. - قم بالتبديل إلى وضع المسح الضوئي واستخدم قناة 488 نانومتر في طريقة العرض المباشر للتركيز وتحديد موقع الخلايا للتصوير.
- اختياري: لزيادة عدد الخلايا المسجلة لكل تشغيل، استخدم الدالة متعددة النقاط لصورة 2-3 حقول العرض لكل غطاء.
- بدء اقتناء الفاصل الزمني وتسجيل 5 صور وتسجيل خط الأساس 2 دقيقة.
- إضافة 500 ميكرولتر من محلول NMDA 3x إلى الغرفة (التركيز النهائي 30 ميكرومتر) وتسجيل 20 صورة إضافية كاستجابة NMDA 10 دقيقة.
ملاحظة: الخلايا العصبية حساسة جدا للتغيرات في osmolarity. لذلك، تأكد من تقليل تبخر المخزن المؤقت للتصوير. لعلاجات أطول، يجب تغطية غرفة التصوير بغطاء. - أضف 500 ميكرولتر من محلول DA 4x إلى الغرفة وسجل 6 صور أخرى (معايرة قصوى 3 دقائق).
- يستنشق المخزن المؤقت من غرفة التصوير واستبداله بمحلول 1 مل من 1x DTT. سجل 10 صور أخرى (معايرة الحد الأدنى 5 دقائق).
- إنهاء التسجيل وحفظ سلسلة الصور.
6. تحليل البيانات
- استيراد البيانات ومعالجة الصور مسبقا في فيجي
- استخدم مستورد التنسيقات الحيوية لفتح مجموعة من الصور من الخطوة 4 أو ملف صورة من الخطوة 5. انقر على الإضافات | | التنسيقات الحيوية المستورد تنسيقات الحيوية. في مربع الحوار، استخدم View stack مع: Hyperstack، وضع اللون: افتراضي، حدد Autoscale، ولا تنقسم إلى إطارات منفصلة.
ملاحظة: تحسين Autoscale عرض البيانات على شاشة الكمبيوتر. لا يغير كثافة البكسل. - إذا تم فتح صور فردية من الخطوة 4، انقر على صورة | | المكدسات أدوات | قم بدمجها في مكدس صورة واحدة.
- إذا كان هناك XY الانجراف خلال سلسلة الصور، انقر على الإضافات | StackReg لتسجيل الصور. في مربع الحوار ، حدد النص الصلب أو الترجمة.
- تغيير تنسيق الصورة إلى 32 بت بالنقر على صورة | اكتب | 32 بت.
- تقسيم قنوات اللون إلى نوافذ منفصلة عن طريق النقر على صورة | | اللون تقسيم القنوات.
- حدد القناة 1 (405 نانومتر) وضبط العتبة لتحديد الميتوكوندريا للتحليل عن طريق النقر على صورة | ضبط | عتبة. في مربع الحوار، حدد الافتراضي والأحمر والخلفية الداكنة والمكدس التكراري وانتظر حتى تظهر البيكسلات المحددة باللون الأحمر. انقر فوق تطبيق. حدد تعيين وحدات بكسل الخلفية إلى NaN و معالجة كافة الصور.
ملاحظة: لتجنب التحيز المراقب المحتملة، يجب استخدام تحديد العتبة التلقائي. تقدم FIJI عدة أساليب تلقائية (مثل الافتراضي، هوانغ، Intermodes، Otsu) التي يمكن تحديدها من القائمة المنسدلة في مربع الحوار عتبة. عادة ما يعطي الأسلوب الافتراضي نتيجة جيدة. يوصى بمقارنة عدة طرق خلال التحليل الأول للعثور على أفضل طريقة عتبة لمجموعة معينة من الصور. بمجرد اختيار طريقة ، يجب تطبيقها على جميع الصور. - كرر الخطوة 6.1.6 للقناة 2 (488 نانومتر).
- إنشاء صورة نسبة لتصور نسبة 405:488 نانومتر عن طريق النقر على عملية | حاسبة الصورة. في مربع الحوار، حدد Image 1: القناة 1، العملية: تقسيم، الصورة 2: القناة 2، إنشاء نافذة جديدة، معالجة كافة الصور.
- تغيير جدول البحث عن صورة النسبة إلى اللون الزائف. على سبيل المثال، لتغيير إلى النار، انقر على صورة | | جداول البحث أطلق النار.
- استخدم مستورد التنسيقات الحيوية لفتح مجموعة من الصور من الخطوة 4 أو ملف صورة من الخطوة 5. انقر على الإضافات | | التنسيقات الحيوية المستورد تنسيقات الحيوية. في مربع الحوار، استخدم View stack مع: Hyperstack، وضع اللون: افتراضي، حدد Autoscale، ولا تنقسم إلى إطارات منفصلة.
- تحليل الصور
- على صورة النسبة، ارسم ROIs حول الخلايا الفردية أو الميتوكوندريا. بعد رسم كل عائد استثمار، أضفه إلى مدير عائد الاستثمار. تحليل | أدوات | مدير عائد الاستثمار | إضافة. (اختصار لوحة المفاتيح: 'T') حدد إظهار الكل.
ملاحظة: لأنه تم تعيين وحدات البكسل الخلفية إلى 'ليس رقما' (NaN) في الخطوتين 6.1.6 و 6.1.7، فإنها لن تؤثر على نتيجة القياس. لذلك، من المقبول تضمين بعض وحدات البكسل الخلفية في ROI. - قياس نسب 405:488 من الخلايا الفردية عن طريق النقر على مدير عائد الاستثمار | ctrl + A لتحديد جميع ROIs | المزيد من | قياس متعدد. في مربع الحوار ، حدد قياس كافة الشرائح و صف واحد لكل شريحة.
- تصدير القياسات إلى برنامج جدول البيانات.
- حدد الصورة 405 نانومتر. قياس كثافة جميع ROIs كما هو الحال في الخطوة 6.2.2. استخدام ROIs المخزنة في إدارة عائد الاستثمار.
- تصدير القياسات إلى برنامج جدول البيانات.
- حدد الصورة 488 نانومتر. قياس كثافة جميع العائد على الاستثمار كما هو الحال في الخطوة 6.2.2. استخدام ROIs المخزنة في إدارة عائد الاستثمار.
- تصدير القياسات إلى برنامج جدول البيانات.
- حفظ ROIs للرجوع إليها في المستقبل عن طريق النقر على مدير عائد الاستثمار | ctrl + A لتحديد جميع ROIs | المزيد من | حفظ.
- الموصى بها: توليد كثافة مقابل الوقت المؤامرات من آثار 405 و 488 نانومتر. تحقق من عدم وجود تبييض ملحوظ في أي من القناتين (يجب أن تكون كثافة الإشارة في نهاية سلسلة التصوير ≥98٪ من الصورة الأولى) وأن التتبعين ينتقلان إلى اتجاهين متعاكسين أثناء استجابات الاستشعار (على سبيل المثال ، يجب أن يزيد تتبع 405 نانومتر أثناء الأكسدة بينما يجب أن ينخفض تتبع 488 نانومتر).
- على صورة النسبة، ارسم ROIs حول الخلايا الفردية أو الميتوكوندريا. بعد رسم كل عائد استثمار، أضفه إلى مدير عائد الاستثمار. تحليل | أدوات | مدير عائد الاستثمار | إضافة. (اختصار لوحة المفاتيح: 'T') حدد إظهار الكل.
- تطبيع البيانات
- لكل عائد استثمار من صورة النسبة، حدد القيمة القصوى أثناء علاج DA (Rmax) والقيمة الدنيا أثناء علاج DTT (Rmin).
- حساب نسبة تسويتها كما يلي:
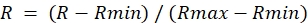
ملاحظة: هذا سيتم تعيين الحد الأقصى للنسبة إلى 1.0 والحد الأدنى للنسبة إلى 0.
- تحليل مورفولوجيا الميتوكوندريا
- للحصول على قياسات مورفولوجيا الميتوكوندريا بالتوازي مع كثافة roGFP في الخطوة 6.2.6 ، انتقل إلى تحليل | تعيين القياسات والتحقق من واصفات الشكل واحتواء القطع الناقص.
ملاحظة: بالإضافة إلى متوسط الكثافة، ستشمل القياسات في نافذة النتائج طول المحور الرئيسي (Major)، وطول المحور الثانوي (الصغرى)، ونسبة العرض إلى الارتفاع (AR؛ والمحور الرئيسي مقسوما على محور ثانوي؛ والميتوكوندريا المستديرة لها AR ~ 1، والميتوكوندريا الممدودة لها AR أكبر)، بالإضافة إلى قياسات التعميم (Circ.) والتقريب (الجولة).
- للحصول على قياسات مورفولوجيا الميتوكوندريا بالتوازي مع كثافة roGFP في الخطوة 6.2.6 ، انتقل إلى تحليل | تعيين القياسات والتحقق من واصفات الشكل واحتواء القطع الناقص.
النتائج
القياس الكمي للاختلافات في حالة الأكسدة الميتوكوندريا الثابتة بعد انسحاب عامل النمو
لإثبات كمية الاختلافات في الحالة الثابتة في حالة الأكسدة الميتوكوندريا ، تمت مقارنة الخلايا العصبية الأولية التي تزرع في الوسط القياسي بالخلايا العصبية المستزرعة دون عوامل نمو لمدة 48 ساعة قب...
Discussion
توفر القياسات الكمية والديناميكية لحالة أكسدة الميتوكوندريا معلومات مهمة حول الميتوكوندريا وعلم وظائف الأعضاء الخلوي. تتوفر العديد من المسابير الكيميائية الفلورية التي تكشف عن أنواع الأكسجين التفاعلية أو "إجهاد الأكسدة" أو "الإجهاد التأكسدي". غير أن المصطلحات الأخيرة ليست محددة تحديدا ...
Disclosures
ويعلن صاحبا البلاغ أنه ليس بينهما تضارب في المصالح.
Acknowledgements
وقد دعم هذا العمل دويتشه فرانشونجسجيمينشافت (BA 3679/5-1؛ 1؛ 1. ل 2289: BA 3679/4-2). يتم دعم A.K. من خلال زمالة ERASMUS+ . نشكر إيريس بونسلي-إهريت وريتا روزنر وأندريا شليكسوب على إعداد الخلايا العصبية الأولية. نشكر الدكتور توبياس ديك على توفير pLPCX-mito-Grx1-roGFP2. أجريت التجارب المبينة في الشكل 4 في مركز نيكون للتصوير، جامعة هايدلبرغ. وقد أعد الشكل 2 BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| reagents | |||
| Calcium chloride (CaCl2·2H2O) | Sigma-Aldrich | C3306 | |
| Diamide (DA) | Sigma-Aldrich | D3648 | |
| Dithiothreitol (DTT) | Carl Roth GmbH | 6908.1 | |
| Glucose (2.5 M stock solution) | Sigma-Aldrich | G8769 | |
| Glucose | Sigma-Aldrich | G7528 | |
| Glycine | neoFroxx GmbH | LC-4522.2 | |
| HEPES (1 M stock solution) | Sigma-Aldrich | 15630-080 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Magnesium chloride (MgCl2·6H2O) | Sigma-Aldrich | 442611-M | |
| N-methyl-D-aspartate (NMDA) | Sigma-Aldrich | M3262 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P3911 | |
| Sodium chloride (NaCl) | neoFroxx GmbH | LC-5932.1 | |
| Sodium pyruvate (0.1 M stock solution) | Sigma-Aldrich | S8636 | |
| Sodium pyruvate | Sigma-Aldrich | P8574 | |
| Sucrose | Carl Roth GmbH | 4621.1 | |
| Tetramethylrhodamine ethyl ester perchlorate (TMRE) | Sigma-Aldrich | 87917 | |
| equipment | |||
| imaging chamber | Life Imaging Services (Basel, Switzerland) | 10920 | Ludin Chamber Type 3 for Ø12mm coverslips |
| laser scanning confocal microscope, microscope | Leica | DMI6000 | |
| laser scanning confocal microscope, scanning unit | Leica | SP8 | |
| peristaltic pump | VWR | PP1080 181-4001 | |
| spinning disc confocal microscope, camera | Hamamatsu | C9100-02 EMCCD | |
| spinning disc confocal microscope, incubationsystem | TokaiHit | INU-ZILCF-F1 | |
| spinning disc confocal microscope, microscope | Nikon | Ti microscope | |
| spinning disc confocal microscope, scanning unit | Yokagawa | CSU-X1 | |
| software | |||
| FIJI | https://fiji.sc | ||
| StackReg plugin | https://github.com/fiji-BIG/StackReg/blob/master/src/main/java/StackReg_.java | ||
| TurboReg plugin | https://github.com/fiji-BIG/TurboReg/blob/master/src/main/java/TurboReg_.java |
References
- Roede, J. R., Go, Y. M., Jones, D. P. Redox equivalents and mitochondrial bioenergetics. Methods in Molecular Biology. 810, 249-280 (2012).
- Turrens, J. F. Mitochondrial formation of reactive oxygen species. Journal of Physiology. 552, 335-344 (2003).
- Lin, M. T., Beal, M. F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 443 (7113), 787-795 (2006).
- Manfredi, G., Beal, M. F. The role of mitochondria in the pathogenesis of neurodegenerative diseases. Brain Pathology. 10 (3), 462-472 (2000).
- Mari, M., Morales, A., Colell, A., Garcia-Ruiz, C., Fernandez-Checa, J. C. Mitochondrial glutathione, a key survival antioxidant. Antioxidants & Redox Signaling. 11 (11), 2685-2700 (2009).
- Murphy, M. P. Mitochondrial thiols in antioxidant protection and redox signaling: distinct roles for glutathionylation and other thiol modifications. Antioxidants & Redox Signaling. 16 (6), 476-495 (2012).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Hanson, G. T., et al. Investigating mitochondrial redox potential with redox-sensitive green fluorescent protein indicators. Journal of Biological Chemistry. 279 (13), 13044-13053 (2004).
- Gutscher, M., et al. Real-time imaging of the intracellular glutathione redox potential. Nature Methods. 5 (6), 553-559 (2008).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring E(GSH) and H2O2 with roGFP2-based redox probes. Free Radical Biology & Medicine. 51 (11), 1943-1951 (2011).
- Marwick, K. F. M., Hardingham, G. E. Transfection in primary cultured neuronal cells. Methods in Molecular Biology. 1677, 137-144 (2017).
- Kohrmann, M., et al. convenient, and effective method to transiently transfect primary hippocampal neurons. Journal of Neuroscience Research. 58 (6), 831-835 (1999).
- Depp, C., Bas-Orth, C., Schroeder, L., Hellwig, A., Bading, H. Synaptic activity protects neurons against calcium-mediated oxidation and contraction of mitochondria during excitotoxicity. Antioxidants & Redox Signaling. 29 (12), 1109-1124 (2018).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Molecular Therapy. 7 (3), 419-425 (2003).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Zhang, S. J., et al. Nuclear calcium signaling controls expression of a large gene pool: identification of a gene program for acquired neuroprotection induced by synaptic activity. PLoS Genetics. 5 (8), 1000604 (2009).
- Winterbourn, C. C. The challenges of using fluorescent probes to detect and quantify specific reactive oxygen species in living cells. Biochimica et Biophysica Acta. 1840 (2), 730-738 (2014).
- Sies, H. Oxidative stress: a concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Lukyanov, K. A., Belousov, V. V. Genetically encoded fluorescent redox sensors. Biochimica et Biophysica Acta. 1840 (2), 745-756 (2014).
- Nietzel, T., et al. Redox-mediated kick-start of mitochondrial energy metabolism drives resource-efficient seed germination. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 741-751 (2020).
- Albrecht, S. C., et al. Redesign of genetically encoded biosensors for monitoring mitochondrial redox status in a broad range of model eukaryotes. Journal of Biomolecular Screening. 19 (3), 379-386 (2014).
- Albrecht, S. C., Barata, A. G., Grosshans, J., Teleman, A. A., Dick, T. P. In vivo mapping of hydrogen peroxide and oxidized glutathione reveals chemical and regional specificity of redox homeostasis. Cell Metabolism. 14 (6), 819-829 (2011).
- Breckwoldt, M. O., et al. Multiparametric optical analysis of mitochondrial redox signals during neuronal physiology and pathology in vivo. Nature Medicine. 20 (5), 555-560 (2014).
- Ricke, K. M., et al. Mitochondrial dysfunction combined with high calcium load leads to impaired antioxidant defense underlying the selective loss of nigral dopaminergic neurons. Journal of Neuroscience. 40 (9), 1975-1986 (2020).
- Bjornberg, O., Ostergaard, H., Winther, J. R. Mechanistic insight provided by glutaredoxin within a fusion to redox-sensitive yellow fluorescent protein. Biochemistry. 45 (7), 2362-2371 (2006).
- Shokhina, A. G., et al. Red fluorescent redox-sensitive biosensor Grx1-roCherry. Redox Biology. 21, 101071 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved