JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
비율 표시기를 사용하여 1 차 신경에 있는 미토콘드리아 글루타티온 Redox 상태의 살아있는 화상 진찰
요약
이 문서는 공초점 살아있는 현미경 검사를 사용하여 1 차해 및 피질 뉴런에 있는 급성 동요에 기초 redox 상태 및 redox 반응에 있는 다름을 결정하는 프로토콜을 기술합니다. 프로토콜은 최소한의 수정으로 다른 세포 유형 및 현미경에 적용 될 수 있습니다.
초록
미토콘드리아 레독스 항상성은 신경 생존력과 기능에 중요합니다. 미토콘드리아는 여러 레독스 시스템을 포함하고 있지만, 매우 풍부한 티올-디설파이드 레독스 버퍼 글루타티온은 항산화 방어의 핵심 선수로 간주됩니다. 따라서 미토콘드리아 글루타티온 레독스 전위를 측정하면 미토콘드리아 레독스 상태 및 산화 스트레스에 대한 유용한 정보를 제공한다. 글루타레독신1-roGFP2(Grx1-roGFP2)는 510m에서 단일 방출 피크를 가진 400nm및 490nm에서 2개의 레독스 상태 민감성 난초 피크를 가진 글루타티온 레독스 전위(GFP)-기반 의 유전자 인코딩된 녹색 형광 단백질(GFP)기반 의 비율 지표이다. 이 문서는 1 차해 및 피질 뉴런에서 미토콘드리아 표적 Grx1-roGFP2의 공초점 살아있는 현미경 검사를 수행하는 방법을 설명합니다. 그것은 정상 상태 미토콘드리아 글루타티온 redox 잠재력을 평가하는 방법을 설명 (예를 들어, 질병 상태 또는 장기 치료를 비교) 급성 치료에 레독스 변화를 측정하는 방법 (엑시토 독성 약물 N-메틸-D-아스파르타트 (NMDA를 사용하여) 예를 들어). 또한, 이 기사는 Grx1-roGFP2 및 미토콘드리아 막 전위 지표인 테트라메틸lr호다민, 에틸 에스테르(TMRE)의 공동 이미징을 제시하여 Grx1-roGPF2가 다중 파라메트릭 분석을 위한 추가 지표로 어떻게 멀티플렉스화될 수 있는지를 보여줍니다. 이 프로토콜은 (i) 공초점 레이저 스캐닝 현미경 설정을 최적화하는 방법에 대한 자세한 설명을 제공하고, (ii) 디아미드및 디티오스레이톨로 센서 교정을 거쳐 자극을 위한 약물을 적용하고, (iii) ImageJ/FIJI로 데이터를 분석한다.
서문
몇몇 중요한 미토콘드리아 효소 및 신호 분자는 티올 레독스 규정1의 적용을 받습니다. 더욱이, 미토콘드리아는 반응성 산소 종의 주요 세포 공급원이며 산화 손상에 선택적으로 취약하다2. 따라서, 미토콘드리아 레독스 전위는 생체 에너지, 세포 신호, 미토콘드리아 기능 및 궁극적으로 세포 생존가능성에 직접적인 영향을 미친다3,4. 미토콘드리아 매트릭스는 레독스 항상성을 유지하고 항산화 방어를 탑재하기 위해 티올-디설파이드 레독스 완충글루타티온(GSH)의 고량(1-15 mMM)을 함유하고 있다. GSH는 표적 단백질(S-글루타티온분해)에 공유하여 레독스 상태와 활성을 조절할 수 있으며 산화 단백질을 감소시키는 다양한 해독 효소에 의해 사용됩니다. 따라서 미토콘드리아 글루타티온 레독스 전위는 미토콘드리아 기능 및 병리생리학을 연구할 때 매우 유익한 매개 변수입니다.
roGFP2는 인공 디티올-이설화 쌍을 형성하는 두 개의 표면 노출 시스테인을 첨가하여 레독스에 민감하게 만들어진 GFP의 변종이다7,8. ~510nm에서 단일 방출 피크와 ~400 nm 및 490 nm에서 두 개의 여기 봉우리가 있습니다. 중요한 것은, 두 개의 여기 피크의 상대진폭은 roGFP2(도 1)의 레독스 상태에 따라 달라지며, 이 단백질을 비율 센서로 만듭니다. Grx1-roGFP2 센서에서 인간 글루타레독신-1(Grx1)이 roGFP29,10의 N-종자에 융합되었습니다. roGFP2에 대한 Grx1 효소의 공유 부착은 센서의 두 가지 주요 개선을 제공합니다: GSH/GSSG 글루타티온 레독스 쌍(그림 1)에 대한 센서 반응을 특정하게 만들고, GSSG와 roGFP2 간의 평형을 최소 100,0009배 이상의 비율로 가속화합니다. 따라서 Grx1-roGFP2는 세포 글루타티온 레독스 전위의 특이적이고 역동적인 이미징을 가능하게 합니다.
Grx1-roGFP2 이미징은 넓은 범위의 현미경으로 수행될 수 있으며, 여기에는 넓은 필드 형광 현미경, 회전 디스크 공초점 현미경 및 레이저 스캐닝 공초점 현미경이 포함됩니다. 1차 뉴런에서 센서의 발현은 lipofection11, DNA/칼슘-인산염 인산염 인계 연수량, 바이러스 매개 유전자 전달, 또는 형질전환 동물의 세포를 세포 공급원으로 사용하는 등 다양한 방법에 의해 달성될 수 있다(그림 2). AAV1 및 AAV2 캡시드 단백질 13,14의 1:1 비율을 포함하는 의사형 재조합 아데노 관련 바이러스(rAAV)가 이 문서에서 실험을 위해 사용되었다. 이 벡터를 사용하면 최대 센서 발현은 일반적으로 감염 후 4-5 일에 도달하고 적어도 2 주 동안 안정적으로 유지됩니다. 우리는 성공적으로 마우스와 쥐에서 1 차해 및 피질 뉴런에서 Grx1-roGFP2를 사용했습니다.
이 문서에서는, 1차 쥐 해마 및 피질 뉴런에서 미토콘드리아 표적 Grx1-roGFP2의 rAAV 매개 발현은 기저 미토콘드리아 글루타티온 레독스 상태와 급성 변투를 평가하는 데 사용된다. (i) 레이저 스캐닝 공초점 현미경 설정을 최적화하는 방법에 대한 자세한 지침과 함께 공초점 라이브 이미징을 위한 프로토콜이 제공되며, (ii) 라이브 이미징 실험을 실행하고 (iii) FIJI와 데이터를 분석한다.
프로토콜
모든 동물 실험은 유럽 의회의 이사회 지침 2010/63/EU를 포함하여 국가 및 제도적 지침에 부합하고, 전체 홈 오피스 윤리 승인을했다 (하이델베르크 동물 복지 사무소와 레지에룽스프라에시듐 카를스루에 대학, 라이센스 T14/21 및 T13/21). 1차 해마 및 피질 뉴런은 표준 절차에 따라 신생아 마우스 또는 쥐 새끼로부터 제조되었으며, 이전에 설명된 바와 같이 12-14일 동안 유지되었다.
1. 솔루션 준비
- 이미징 버퍼용 스톡 솔루션
- 표 1에 따라 각 스톡 솔루션을 준비하고 4 °C에서 보관하십시오. 장기 저장(>3개월)의 경우 알리코를 -20°C로 유지하십시오.
| 구성 요소 | MW | 농도 (M) | 양(g) | 볼륨(mL) |
| 나Cl | 58.44 | 5 | 14.61 | 50 |
| KCl | 74.55 | 3 | 1.12 | 5 |
| MgCl2, 6H2O | 203.3 | 1.9 | 2 | 5 |
| 카Cl2·2H2O | 147.01 | 1 | 1.47 | 10 |
| 글리신 | 75.07 | 0.1 | 0.375 | 50 |
| 자당 | 342.3 | 1.5 | 25.67 | 50 |
| 피루바테 나트륨 | 110.04 | 0.1 | 0.55 | 50 |
| 헤페스 | 238.3 | 1 | 11.9 | 50 |
| 포도당 | 180.15 | 2.5 | 45 | 100 |
표 1: 이미징 버퍼용 스톡 솔루션입니다.
- 약물 및 염료의 재고 솔루션
- 용해 디아미드(DA; 최대 405:488 비율의 보정에 사용) 0.5M 스톡 용액을 얻기 위해 (예를 들어, 물 11.615 mL에서 1g). 알리쿼트와 -20°C에 보관하십시오.
- 1M 스톡 용액(예: 물 32.425mL에서 5g)을 얻기 위해 물에 최소 405:488 의 교정에 사용되는 디티오스레이톨(DTT; 최소 405:488 비율)을 용해하십시오. 알리쿼트와 -20°C에서 최대 3개월 동안 보관하십시오.
- 10mM 스톡 용액(예를 들어, 16.991mL의 물)을 얻기 위해 물에 N-메틸-D-아스파르타트(NMDA; 절제독성 및 미토콘드리아 산화를 유도하는 데 사용)를 용해한다. 알리쿼트를 -20°C에 저장합니다. 장기 저장(>6개월)의 경우 알리쿼트를 -80°C로 유지하십시오.
- 테트라메틸lrhodamine 에틸 에스테르 과염소산염 (TMRE; 미토콘드리아 막 전위의 소분자 지표)
- 메탄올에 TMRE 분말을 용해하여 20mM 스톡(예: 메탄올 2.427mL에서 25 mg)을 얻습니다.
- 메탄올에 20mM 스톡 1:1,000을 희석하여 20 μM 스톡을 얻습니다.
- Aliquot는 20mM 및 20 μM 스톡 솔루션, 파라필름으로 밀봉하고 -20°C의 빛으로부터 보호되는 저장을 제공합니다.
참고: 두 주식 솔루션 모두 몇 년 동안 안정적입니다. 실험에 1,000배 스톡 솔루션(20 μM)을 사용합니다.
- 이미징 버퍼
- 측정 실린더에 멸균 수의 표 2 ~ 80 mL의 모든 구성 요소를 추가하여 이미징 버퍼 100mL를 준비합니다. 멸균물로 최대 100mL의 부피를 가져와보세요. 용액이 균일하게 나타날 때까지 측정 실린더를 조심스럽게 흔들어 섞는다.
참고: 진동계를 사용하여 버퍼의 진동을 확인하는 것이 좋습니다. 그것은 세포의 성장 매체에 가능한 한 가깝어야합니다. 여기서, 이것은 315 mOsmol/L. 화상 진찰 완충제 및 성장 매체의 진동과 일치하기 위하여 필요에 따라 자당 농도를 증가 또는 감소시입니다. - pH를 7.4로 조정합니다. 알리쿼트를 만들고 최대 2주 동안 4°C로 보관하십시오. 장기 보관을 위해 알리쿼트를 -20°C로 유지하십시오. 이미징 버퍼가 사용하기 전에 실온에 도달하도록 합니다.
- 측정 실린더에 멸균 수의 표 2 ~ 80 mL의 모든 구성 요소를 추가하여 이미징 버퍼 100mL를 준비합니다. 멸균물로 최대 100mL의 부피를 가져와보세요. 용액이 균일하게 나타날 때까지 측정 실린더를 조심스럽게 흔들어 섞는다.
| 구성 요소 | 스톡 솔루션(M) | 최종 농도(mM) | 볼륨(mL) |
| 나Cl | 5 | 114 | 2.3 |
| KCl | 3 | 5.29 | 0.176 |
| MgCl2 | 1.9 | 1 | 0.053 |
| 카Cl2 | 1 | 2 | 0.2 |
| 글리신 | 0.1 | 0.005 | 0.005 |
| 자당 | 1.5 | 52 | 3.5 |
| 피루바테 나트륨 | 0.1 | 0.5 | 0.5 |
| 헤페스 | 1 | 10 | 1 |
| 포도당 | 2.5 | 5 | 0.2 |
표 2: 이미징 버퍼의 구성. 표시된 볼륨은 이미징 버퍼의 100mL의 제조를 위해 사용됩니다.
- 자극 및 교정용 솔루션
참고: 실험 직전에 표시된 약물의 스톡 솔루션을 이미징 버퍼에 추가하여 항상 신선한 자극 솔루션을 준비합니다. 자극 및 교정용 솔루션은 실험 중에 이미징 챔버에 순차적으로 추가됩니다(섹션 3-5 참조). 실험의 유형에 따라, 다른 솔루션은 이미징 챔버에서 각각의 최종 부피에서 동일한 최종 농도에 도달하는 데 필요합니다.- 이미징 버퍼의 6.937mL에 10mM NMDA 재고의 63 μL을 추가하여 3배 NMDA 용액(90 μM; 챔버내 최종 농도: 30 μM)을 준비한다. 결과 용액의 500 μL을 챔버에 추가합니다(최종 부피: 1.5mL).
- 이미징 버퍼의 6.986 mL에 0.5 M DA 스톡의 14 μL을 추가하여 3 단계 및 4 (1 mM; 챔버내 최종 농도 : 0.5 mMM)에 대한 2 배 DA 솔루션을 준비합니다. 챔버에 1mL를 추가합니다(최종 부피: 2mL).
- 이미징 버퍼의 6.972 mL에 0.5 M DA 주식의 28 μL을 추가하여 단계 5 (2 mM; 챔버내 최종 농도 : 0.5 mMM)에 대한 4 배 DA 솔루션을 준비합니다. 챔버에 500 μL을 추가합니다(최종 부피: 2mL).
- 이미징 버퍼의 8955 μL에 1M DTT 스톡의 45 μL을 추가하여 1x DTT 용액(5mM; 챔버의 최종 농도: 5mM)을 준비합니다. 이미징 버퍼(최종 부피: 1mL)를 흡입한 후 이 솔루션의 1mL을 챔버에 추가합니다.
2. TMRE를 가진 셀로드
참고: 이 프로토콜에서 TMRE는 20nM의 최종 농도에서 비담금전 모드15 에 사용됩니다. 일반적으로, 선택의 현미경에 충분한 신호 강도를 제공하는 TMRE의 가장 낮은 가능한 농도가 사용되어야한다. 고르지 않은 증발로 인해, 다른 우물에서 매체의 양은 장기 기본 문화권에서 다를 수 있습니다. 모든 우물에서 일관된 TMRE 농도를 보장하기 위해 우물에 TMRE를 직접 추가하지 마십시오. 대신 각 우물의 배지를 동일한 양의 TMRE 함유 매체로 교체합니다. 아래 프로토콜은 잘 당 중간의 ~ 1 mL를 포함하는 24 웰 플레이트에서 기본 뉴런을 위해 설계되었습니다.
- 조직 배양 라미나르 흐름 후드에서 작업, 하나의 원문 튜브로 각 우물에서 배지의 500 μL을 수집합니다.
- 우물당, 원적 관에 20 μM TMRE 재고의 0.5 μL을 추가합니다(예: 24개의 우물에 대한 12 μL).
- 조심스럽게 첫 번째 우물에서 나머지 매체를 흡인하고 TMRE 함유 매체의 500 μL로 대체합니다. 나머지 우물과 잘, 잘 계속.
참고: 세포가 건조시키지 않고 세포를 방해하지 않도록 주의하십시오. - 세포를 인큐베이터로 되돌리고 염료 평형을 위해 적어도 60분 이상 기다립니다.
참고: 로딩 시간은 부작용 없이 몇 시간으로 연장할 수 있습니다. - 이미징 실험 전반에 걸쳐 일관된 TMRE 농도와 평형을 보장하기 위해 이미징 버퍼 및 모든 자극 솔루션에 20nM TMRE의 최종 농도를 포함해야 합니다.
3. 공초점 현미경 설정 스캐닝 최적화
참고: 이 단계는 라이브 이미징 중에 이미지 품질과 세포 생존 가능성 사이의 최상의 절충안을 찾는 것을 목표로 합니다. 이 섹션에서는 roGFP 이미징에 대한 설정 최적화에 대해 설명합니다. 다단계 이미징이 수행되는 경우 표백 또는 광독성의 징후가없는 안정적인 기준선 검사를 포함하여 유사한 최적화가 추가 지표에 대해 수행되어야합니다.
- GFP 이미징(488nm 난사, 505 -550 nm 방출)에 대한 공초점 현미경 및 로드 표준 설정을 시작합니다.
- 검출기를 12비트 또는 16비트로 설정합니다.
참고: 일반적으로 8비트는 정량적 이미징에 충분하지 않습니다. - 순차적 스캔 모드를 활성화하고 두 번째 시퀀스 / 트랙 (405 nm 흥분, 505 - 550 nm 방출)을 추가합니다.
- 두 채널의 경우 오버노출 픽셀과 노출이 부족한 픽셀(예: GLOW OU)을 나타내는 의사 색상 조회 테이블을 선택합니다.
- 관심 있는 대상에 적합한 목표를 선택합니다.
참고: 10x-40x는 단세포 분석에 적합하며, 63x-100x는 단일 미토콘드리온 분석에 적합합니다. - 이미징 챔버에 세포가 있는 커버슬립을 장착하고, 이미징 버퍼 1mL를 추가하고, 현미경에 챔버를 놓습니다.
- 접안렌즈와 전염된 빛을 사용하여 세포에 초점을 맞춥니다.
참고: 세포를 찾고 초점을 맞추기 위해 피성 광을 사용하지 마십시오. 저전력에서도 이것은 세포에 부정적인 영향을 미칩니다. - 픽셀 형식이 다른 이미지를 기록합니다. 이러한 이미지를 기반으로 관심 구조의 허용 가능한 해상도를 제공하는 가장 낮은 픽셀 번호를 선택합니다.
참고: 일반적으로 512 x 512 픽셀은 20배 및 40x 목표를 가진 단일 세포 이미징에 적합하며, 1024 x 1024 또는 2048 x2048 픽셀은 일반적으로 63배 의 목표를 가진 단일 미토콘드리온 이미징에 적합합니다. - 핀홀 크기가 다른 이미지를 기록합니다. 이러한 이미지를 기반으로 관심 구조의 허용 가능한 해상도를 제공하는 가장 큰 핀홀 크기를 선택합니다.
참고 : 일반적으로 3-7 개의 통풍이 잘되는 유닛이 잘 작동합니다. - 다른 레이저 강도와 이미지를 기록합니다.
- 그에 따라 검출기 게인 및 임계값을 조정합니다. 이러한 이미지에 따라 허용 가능한 신호 강도와 신호 대 배경 비율을 제공하는 가장 낮은 레이저 강도를 선택합니다.
- 신호 대 배경 비율을 결정하기 위해, 세포 또는 미토콘드리아(ROI1)를 포함하는 관심 영역(ROI)과 세포 또는 미토콘드리아(ROI2)가 없는 ROI에서 신호 강도를 측정한다. 그런 다음 ROI1의 강도를 ROI2의 강도로 나눕니다.
참고: > 1-3% 레이저 출력을 가진 488nm 암분 암분에 대해 300-1,500의 개별 ROI의 1-3%의 레이저 출력과 강도가 있는 405nm 암분에 대해 200-1,000의 개별 ROI의 신호 대 배경 비율 및 신호 강도에 대한 목표.
- 신호 대 배경 비율을 결정하기 위해, 세포 또는 미토콘드리아(ROI1)를 포함하는 관심 영역(ROI)과 세포 또는 미토콘드리아(ROI2)가 없는 ROI에서 신호 강도를 측정한다. 그런 다음 ROI1의 강도를 ROI2의 강도로 나눕니다.
- 그에 따라 검출기 게인 및 임계값을 조정합니다. 이러한 이미지에 따라 허용 가능한 신호 강도와 신호 대 배경 비율을 제공하는 가장 낮은 레이저 강도를 선택합니다.
- 스캔 속도와 프레임 평균 수가 다른 이미지를 기록합니다. 설정의 각 조합에 대해 4-5 개의 이미지를 기록합니다. 이러한 이미지 계열을 기반으로 허용되는 이미지 노이즈와 이미지 대 이미지 가변성을 제공하는 가장 높은 속도와 최저 평균 설정을 선택합니다.
참고: 대부분의 경우 평균 작동을 위한 600Hz 및 1-2 프레임의 스캔 속도. - 새로운 커버슬립을 사용하여 최적화된 설정으로 타임랩스 시리즈를 기록합니다.
참고: 시리즈의 지속 시간 및 이미지 간격은 계획된 실험의 간격과 유사해야 합니다. - 타임랩스 시리즈가 끝나면 레코딩 챔버에 2x DA 솔루션 1mL을 추가합니다. 추가 2 분 동안 이미지.
- 연동 펌프 또는 핸드헬드 파이펫을 사용하여 이미징 버퍼를 흡인합니다. 1x DTT 솔루션 1mL을 추가합니다. 추가 5 분 동안 이미지.
- 시간 경과 실험을 분석합니다(섹션 5 참조).
- 최적화된 설정으로 DA 및 DTT 처리 중에 두 채널 중 어느 채널도 과도하게 또는 노출되지 않는지 확인합니다.
- 두 채널 중 어느 것도 타임랩스 녹화 중에 상당한 표백을 표시하지 않도록 하십시오. 첫 번째 이미지와 마지막 이미지 사이의 강도 <2%의 손실을 목표로 합니다.
- 405:488 비율이 이미징 중에 상당히 변하지 않는지 확인하십시오.
- 허용 가능한 결과를 일관되게 제공하는 설정이 정의될 때까지 여러 커버립을 사용하여 전체 절차를 반복적으로 반복적으로 반복합니다.
4. 기초 레독스 상태 평가
- 현미경을 시작하고 섹션 3에서 최적화 된 설정을로드합니다.
- 프레임 평균을 3-5로 설정합니다.
- 이미징 챔버에 세포가 있는 커버슬립을 장착하고, 이미징 버퍼 1mL를 추가하고, 현미경에 챔버를 놓습니다.
- 접안렌즈와 전염된 빛을 사용하여 세포에 초점을 맞춥니다.
참고: 세포를 찾고 초점을 맞추기 위해 피성 광을 사용하지 마십시오. 저전력에서도 이것은 세포에 부정적인 영향을 미칩니다. - 스캐닝 모드로 전환하고 라이브 뷰에서 488 nm 채널을 사용하여 이미징을 위한 셀에 초점을 맞추고 찾습니다.
- 다중점 함수를 사용하여 커버슬립에서 3-5개의 뷰 필드를 선택합니다.
- 기준선을 기록합니다.
- 챔버에 2x DA 용액 1mL를 추가합니다.
- 1, 2, 3분 후 라이브 뷰 를 사용하여 포커스를 확인/조정한 다음 이미지를 기록합니다.
참고: 세포는 일반적으로 2 분 후에 완전히 산화됩니다. - 이미징 챔버의 버퍼를 1mL의 1x DTT 용액으로 교체합니다.
- 3분과 5분 후에 는 라이브 뷰 를 사용하여 포커스를 확인/조정한 다음 이미지를 기록합니다.
참고: 세포는 일반적으로 4-5분 후에 완전히 감소됩니다.
5. 급성 치료의 라이브 이미징
참고: 아래 프로토콜은 NMDA 치료에 미토콘드리아 레독스 반응의 이미징을 설명합니다. 다른 치료법에 맞게 이미지 간격과 실험 기간을 조정해야 할 수도 있습니다.
- 현미경을 시작하고 섹션 3에서 최적화 된 설정을로드합니다.
- 시간 경과 간격을 30초로 설정하고 지속 시간을 25분으로 설정합니다.
- 이미징 챔버에 세포가 있는 커버슬립을 장착하고, 이미징 버퍼 1mL를 추가하고, 현미경에 챔버를 놓습니다.
참고: 열 초점 드리프트를 피하기 위해 시간 경과 이미징을 시작하기 전에 10-15 분 동안 현미경 단계에 세포를 둡니다. - 접안렌즈와 전염된 빛을 사용하여 세포에 초점을 맞춥니다.
참고: 세포를 찾고 초점을 맞추기 위해 피성 광을 사용하지 마십시오. 저전력에서도 이것은 세포에 부정적인 영향을 미칩니다. - 스캐닝 모드로 전환하고 라이브 뷰에서 488 nm 채널을 사용하여 이미징을 위한 셀에 초점을 맞추고 찾습니다.
- 선택 사항: 실행당 기록된 셀 수를 늘리려면 다중점 함수 를 사용하여 커버슬립당 2-3뷰 필드를 이미지합니다.
- 시간 경과 획득을 시작하고 5개의 이미지를 2분 기준 기록으로 기록합니다.
- 챔버(최종 농도 30 μM)에 3x NMDA 용액500 μL을 추가하고 10분 NMDA 응답으로 20개의 이미지를 추가로 기록합니다.
참고: 뉴런은 삼투압의 변화에 매우 민감합니다. 따라서 이미징 버퍼의 증발을 최소화해야 합니다. 더 긴 치료를 위해, 화상 진찰실은 뚜껑으로 덮여야 합니다. - 챔버에 4x DA 용액 500 μL을 추가하고 6개의 이미지(최대 교정 3분)를 더 기록합니다.
- 이미징 챔버에서 버퍼를 흡인하고 1x DTT 용액의 1mL로 대체하십시오. 10개의 이미지(최소 보정 5분)를 기록합니다.
- 레코딩을 종료하고 이미지 시리즈를 저장합니다.
6. 데이터 분석
- 피지의 데이터 가져오기 및 이미지 전처리
- Bio-Formats 가져오기를 사용하여 4단계에서 이미지 그룹을 열거나 5단계에서 이미지 파일을 엽니다. 플러그인 | 클릭 바이오 포맷 | 바이오 형식 가져오기. 대화 상자에서 하이퍼 스택, 색상 모드 설정: 기본값, 자동 배율 선택 및 별도의 창으로 분할하지 않는 뷰 스택을 사용합니다.
참고: 자동 배율 는 컴퓨터 화면에 데이터 표시를 최적화합니다. 픽셀 강도를 변경하지 않습니다. - 4단계의 개별 이미지가 열려 있으면 이미지 | 스택 | 도구 | 결합 하여 단일 이미지 스택으로 병합합니다.
- 이미지 시리즈 중에 XY 드리프트가 있는 경우 플러그인 | 클릭하십시오. StackReg 는 이미지를 등록합니다. 대화 상자에서 강체 또는 번역을 선택합니다.
- 이미지 | 클릭하여 이미지 형식을 32비트로 변경 합니다. | 유형 32 비트.
- 이미지 | 클릭하여 색상 채널을 별도의 창으로 분할 합니다. 색상 | 분할 채널.
- 채널 1(405 nm)을 선택하고 임계값을 조정하여 이미지를 클릭하여 분석을 위해 미토콘드리아를 선택합니다| | 조정 임계값입니다. 대화 상자에서 기본값, 빨간색, 어두운 배경 및 스택 히스토그램을 선택하고 선택한 픽셀이 빨간색으로 표시될 때까지 기다립니다. 적용을 클릭합니다. 배경 픽셀 을 NaN으로 선택하고 모든 이미지를 처리합니다.
참고: 잠재적인 관찰자 편향을 방지하려면 자동화된 임계값 결정을 사용해야 합니다. FIJI는 임계값 대화 상자의 드롭다운 메뉴에서 선택할 수 있는 몇 가지 자동화된 방법(예: 기본, 황, 인터모드, 오츠)을 제공합니다. 일반적으로 기본 메서드는 좋은 결과를 제공합니다. 첫 번째 분석 중에 여러 메서드를 비교하여 지정된 이미지 집합에 가장 적합한 임계값 을 찾는 것이 좋습니다. 메서드를 선택한 후에는 모든 이미지에 적용해야 합니다. - 채널 2 (488 nm)에 대해 6.1.6 단계를 반복합니다.
- 프로세스 | 클릭하여 405:488 nm 비율을 시각화하는 비율 이미지를 만듭니다. 이미지 계산기. 대화 상자에서 이미지 1: 채널 1, 작업: 분할, 이미지 2: 채널 2, 새 창 만들기, 모든 이미지 처리
- 비율 이미지의 조회 테이블을 의사 색상으로 변경합니다. 예를 들어 화재로 변경하려면 이미지 | 클릭합니다. 조회 테이블 | 화재.
- Bio-Formats 가져오기를 사용하여 4단계에서 이미지 그룹을 열거나 5단계에서 이미지 파일을 엽니다. 플러그인 | 클릭 바이오 포맷 | 바이오 형식 가져오기. 대화 상자에서 하이퍼 스택, 색상 모드 설정: 기본값, 자동 배율 선택 및 별도의 창으로 분할하지 않는 뷰 스택을 사용합니다.
- 이미지 분석
- 비율 이미지에서, 개별 세포 또는 미토콘드리아 주위에 ROI를 그립니다. 각 ROI를 그린 후 ROI 관리자에 추가합니다. | 분석 도구 | ROI 매니저 | 추가합니다. (키보드 바로 가기: 'T') 모두 표시를 선택합니다.
참고: 배경 픽셀이 6.1.6 및 6.1.7 단계에서 '숫자가 아님'(NaN)으로 설정되어 있으므로 측정 결과에 영향을 주지 않습니다. 따라서 ROI에 일부 배경 픽셀을 포함하는 것이 허용됩니다. - ROI 관리자 | ctrl+A를 클릭하여 개별 셀의 405:488 비율을 측정하여 모든 ROI | 선택합니다. 더 많은 | 멀티 측정값. 대화 상자에서 슬라이스당 모든 슬라이스와 행 1개를 측정합니다.
- 측정값을 스프레드시트 소프트웨어로 내보냅니다.
- 405nm 이미지를 선택합니다. 6.2.2 단계에서와 같이 모든 ROI의 강도를 측정합니다. ROI 관리자에 저장된 ROI를 사용합니다.
- 측정값을 스프레드시트 소프트웨어로 내보냅니다.
- 488nm 이미지를 선택합니다. 6.2.2 단계와 같이 모든 ROI의 강도를 측정합니다. ROI 관리자에 저장된 ROI를 사용합니다.
- 측정값을 스프레드시트 소프트웨어로 내보냅니다.
- ROI 관리자 | ctrl+A를 클릭하여 모든 ROI | 선택하여 향후 참조를 위해 ROI를 저장합니다. 더 많은 | 저장합니다.
- 권장 사항: 405 및 488nm 추적의 강도 대 시간 플롯을 생성합니다. 채널 중 하나에 표시된 표백이 없는지 확인합니다(이미징 시리즈의 끝에 있는 신호 강도는 첫 번째 이미지의 ≥98%여야 함)과 센서 응답 중에 두 개의 흔적이 반대 방향으로 이동해야 하는지 확인합니다(예: 488nm 추적은 감소해야 하는 동안 산화 시 405 nm 추적이 증가해야 함).
- 비율 이미지에서, 개별 세포 또는 미토콘드리아 주위에 ROI를 그립니다. 각 ROI를 그린 후 ROI 관리자에 추가합니다. | 분석 도구 | ROI 매니저 | 추가합니다. (키보드 바로 가기: 'T') 모두 표시를 선택합니다.
- 데이터 정규화
- 비율 이미지에서 각 ROI에 대해, DA 처리(Rmax) 동안 최대 값과 DTT 처리(Rmin) 동안 최소 값을 결정한다.
- 다음과 같이 정규화된 비율을 계산합니다.
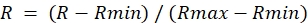
참고: 최대 비율을 1.0이고 최소 비율을 0으로 설정합니다.
- 미토콘드리아 형태 분석
- 6.2.6 단계에서 roGFP 강도에 병행하여 미토콘드리아 형태 측정을 얻으려면 | 분석하십시오. 측정값을 설정하고 셰이프 설명자와 타원을 맞춥니다.
참고: 평균 강도 외에도 , 결과 창의 측정에는 주요 축(Major), 작은 축의 길이(Minor), 종횡비(AR; 미토콘드리아)가 AR ~1, 길쭉한 미토콘드리아는 AR~1, 길쭉한 미토콘드리아는 더 큰 AR을 가지며 원형(Circ.) 및 둥글림(원형)의 측정을 포함합니다.
- 6.2.6 단계에서 roGFP 강도에 병행하여 미토콘드리아 형태 측정을 얻으려면 | 분석하십시오. 측정값을 설정하고 셰이프 설명자와 타원을 맞춥니다.
결과
성장 인자 철수 후 정상 상태 미토콘드리아 레독스 상태의 차이의 정량화
미토콘드리아 레독스 상태에서 정상 상태 차이의 정량화를 입증하기 위해, 표준 배지에서 자란 1차 뉴런은 이미징 전에 48h의 성장 인자 없이 배양된 뉴런과 비교하였다. 성장 인자 철수 결과 후 세포 세포 죽음 72 h16. 세포는 이것이 미토콘드리아 레독스 상태의 변화에 선행되는 경우에 시험?...
토론
미토콘드리아 레독스 상태의 정량적이고 역동적인 측정은 미토콘드리아 및 세포 생리학에 대한 중요한 정보를 제공합니다. 반응성 산소 종, "레독스 스트레스" 또는 "산화 스트레스"를 감지하는 여러 불소 화학 프로브를 사용할 수 있습니다. 그러나 후자의 용어는 잘 정의되지 않으며 종종 특이성이 부족합니다9,17,18. 화학 염?...
공개
저자는 이해 상충이 없다고 선언합니다.
감사의 말
이 작품은 도이치 포르충스게마인샤프트(BA 3679/5-1)에 의해 지원되었다. 2289: BA 3679/4-2). A.K.는 ERASMUS+ 펠로우십의 지원을 받고 있습니다. 아이리스 뷔즈리-에레트, 리타 로스너, 안드레아 슐릭섭에게 1차 뉴런을 준비해 주셔서 감사합니다. 우리는 pLPCX- 미토 - Grx1-roGFP2를 제공 토비아스 딕 박사에게 감사드립니다. 그림 4 에 나타난 실험은 하이델베르크 대학의 니콘 이미징 센터에서 수행되었다. 도 2 는 BioRender.com 준비하였다.
자료
| Name | Company | Catalog Number | Comments |
| reagents | |||
| Calcium chloride (CaCl2·2H2O) | Sigma-Aldrich | C3306 | |
| Diamide (DA) | Sigma-Aldrich | D3648 | |
| Dithiothreitol (DTT) | Carl Roth GmbH | 6908.1 | |
| Glucose (2.5 M stock solution) | Sigma-Aldrich | G8769 | |
| Glucose | Sigma-Aldrich | G7528 | |
| Glycine | neoFroxx GmbH | LC-4522.2 | |
| HEPES (1 M stock solution) | Sigma-Aldrich | 15630-080 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Magnesium chloride (MgCl2·6H2O) | Sigma-Aldrich | 442611-M | |
| N-methyl-D-aspartate (NMDA) | Sigma-Aldrich | M3262 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P3911 | |
| Sodium chloride (NaCl) | neoFroxx GmbH | LC-5932.1 | |
| Sodium pyruvate (0.1 M stock solution) | Sigma-Aldrich | S8636 | |
| Sodium pyruvate | Sigma-Aldrich | P8574 | |
| Sucrose | Carl Roth GmbH | 4621.1 | |
| Tetramethylrhodamine ethyl ester perchlorate (TMRE) | Sigma-Aldrich | 87917 | |
| equipment | |||
| imaging chamber | Life Imaging Services (Basel, Switzerland) | 10920 | Ludin Chamber Type 3 for Ø12mm coverslips |
| laser scanning confocal microscope, microscope | Leica | DMI6000 | |
| laser scanning confocal microscope, scanning unit | Leica | SP8 | |
| peristaltic pump | VWR | PP1080 181-4001 | |
| spinning disc confocal microscope, camera | Hamamatsu | C9100-02 EMCCD | |
| spinning disc confocal microscope, incubationsystem | TokaiHit | INU-ZILCF-F1 | |
| spinning disc confocal microscope, microscope | Nikon | Ti microscope | |
| spinning disc confocal microscope, scanning unit | Yokagawa | CSU-X1 | |
| software | |||
| FIJI | https://fiji.sc | ||
| StackReg plugin | https://github.com/fiji-BIG/StackReg/blob/master/src/main/java/StackReg_.java | ||
| TurboReg plugin | https://github.com/fiji-BIG/TurboReg/blob/master/src/main/java/TurboReg_.java |
참고문헌
- Roede, J. R., Go, Y. M., Jones, D. P. Redox equivalents and mitochondrial bioenergetics. Methods in Molecular Biology. 810, 249-280 (2012).
- Turrens, J. F. Mitochondrial formation of reactive oxygen species. Journal of Physiology. 552, 335-344 (2003).
- Lin, M. T., Beal, M. F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 443 (7113), 787-795 (2006).
- Manfredi, G., Beal, M. F. The role of mitochondria in the pathogenesis of neurodegenerative diseases. Brain Pathology. 10 (3), 462-472 (2000).
- Mari, M., Morales, A., Colell, A., Garcia-Ruiz, C., Fernandez-Checa, J. C. Mitochondrial glutathione, a key survival antioxidant. Antioxidants & Redox Signaling. 11 (11), 2685-2700 (2009).
- Murphy, M. P. Mitochondrial thiols in antioxidant protection and redox signaling: distinct roles for glutathionylation and other thiol modifications. Antioxidants & Redox Signaling. 16 (6), 476-495 (2012).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Hanson, G. T., et al. Investigating mitochondrial redox potential with redox-sensitive green fluorescent protein indicators. Journal of Biological Chemistry. 279 (13), 13044-13053 (2004).
- Gutscher, M., et al. Real-time imaging of the intracellular glutathione redox potential. Nature Methods. 5 (6), 553-559 (2008).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring E(GSH) and H2O2 with roGFP2-based redox probes. Free Radical Biology & Medicine. 51 (11), 1943-1951 (2011).
- Marwick, K. F. M., Hardingham, G. E. Transfection in primary cultured neuronal cells. Methods in Molecular Biology. 1677, 137-144 (2017).
- Kohrmann, M., et al. convenient, and effective method to transiently transfect primary hippocampal neurons. Journal of Neuroscience Research. 58 (6), 831-835 (1999).
- Depp, C., Bas-Orth, C., Schroeder, L., Hellwig, A., Bading, H. Synaptic activity protects neurons against calcium-mediated oxidation and contraction of mitochondria during excitotoxicity. Antioxidants & Redox Signaling. 29 (12), 1109-1124 (2018).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Molecular Therapy. 7 (3), 419-425 (2003).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Zhang, S. J., et al. Nuclear calcium signaling controls expression of a large gene pool: identification of a gene program for acquired neuroprotection induced by synaptic activity. PLoS Genetics. 5 (8), 1000604 (2009).
- Winterbourn, C. C. The challenges of using fluorescent probes to detect and quantify specific reactive oxygen species in living cells. Biochimica et Biophysica Acta. 1840 (2), 730-738 (2014).
- Sies, H. Oxidative stress: a concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Lukyanov, K. A., Belousov, V. V. Genetically encoded fluorescent redox sensors. Biochimica et Biophysica Acta. 1840 (2), 745-756 (2014).
- Nietzel, T., et al. Redox-mediated kick-start of mitochondrial energy metabolism drives resource-efficient seed germination. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 741-751 (2020).
- Albrecht, S. C., et al. Redesign of genetically encoded biosensors for monitoring mitochondrial redox status in a broad range of model eukaryotes. Journal of Biomolecular Screening. 19 (3), 379-386 (2014).
- Albrecht, S. C., Barata, A. G., Grosshans, J., Teleman, A. A., Dick, T. P. In vivo mapping of hydrogen peroxide and oxidized glutathione reveals chemical and regional specificity of redox homeostasis. Cell Metabolism. 14 (6), 819-829 (2011).
- Breckwoldt, M. O., et al. Multiparametric optical analysis of mitochondrial redox signals during neuronal physiology and pathology in vivo. Nature Medicine. 20 (5), 555-560 (2014).
- Ricke, K. M., et al. Mitochondrial dysfunction combined with high calcium load leads to impaired antioxidant defense underlying the selective loss of nigral dopaminergic neurons. Journal of Neuroscience. 40 (9), 1975-1986 (2020).
- Bjornberg, O., Ostergaard, H., Winther, J. R. Mechanistic insight provided by glutaredoxin within a fusion to redox-sensitive yellow fluorescent protein. Biochemistry. 45 (7), 2362-2371 (2006).
- Shokhina, A. G., et al. Red fluorescent redox-sensitive biosensor Grx1-roCherry. Redox Biology. 21, 101071 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유