É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem ao vivo do Estado De Glutathione Mitocondrial Redox em Neurônios Primários usando um Indicador Ratiométrico
Neste Artigo
Resumo
Este artigo descreve um protocolo para determinar diferenças no estado basal redox e respostas redox a perturbações agudas em neurônios hipocampais primários e corticais usando microscopia viva confocal. O protocolo pode ser aplicado a outros tipos de células e microscópios com modificações mínimas.
Resumo
A homeostase mitocondrial redox é importante para a viabilidade e a função neuronais. Embora as mitocôndrias contenham vários sistemas redox, a glutothione tampão de tiool-dissulfeto altamente abundante é considerada um jogador central em defesas antioxidantes. Portanto, medir o potencial mitocondrial glutatione redox fornece informações úteis sobre o status de redox mitocondrial e estresse oxidativo. Glutaredoxin1-roGFP2 (Grx1-roGFP2) é um indicador proporção de proporção geneticamente codificado e verde (GFP) do potencial de glutathione redox que tem dois picos de excitação sensíveis ao estado-redox a 400 nm e 490 nm com um único pico de emissão de 510 nm. Este artigo descreve como realizar microscopia ao vivo confocal de Grx1-roGFP2 com destino a mitocôndrias em neurônios hipocampais e corticais primários. Descreve como avaliar o potencial de glutationo mitocondrial de estado estável (por exemplo, comparar estados da doença ou tratamentos de longo prazo) e como medir as alterações de redox em tratamentos agudos (usando a droga excitotóxica N-metil-D-aspartate (NMDA) como exemplo). Além disso, o artigo apresenta co-imagem de Grx1-roGFP2 e o indicador potencial da membrana mitocondrial, tetrametilrhodamina, éster etílico (TMRE), para demonstrar como o Grx1-roGPF2 pode ser multiplexado com indicadores adicionais para análises multiparamétricas. Este protocolo fornece uma descrição detalhada de como (i) otimizar as configurações do microscópio de varredura a laser confocal, (ii) aplicar medicamentos para estimulação seguido de calibração de sensores com diamide e dithiothreitol, e (iii) analisar dados com ImageJ/FIJI.
Introdução
Várias enzimas mitocondriais importantes e moléculas de sinalização estão sujeitas à regulação de thiol redox1. Além disso, as mitocôndrias são uma grande fonte celular de espécies reativas de oxigênio e são seletivamente vulneráveis a danos oxidativos2. Assim, o potencial mitocondrial redox afeta diretamente bioenergésicos, sinalização celular, função mitocondrial e, finalmente, viabilidade celular3,4. A matriz mitocondrial contém altas quantidades (1-15 mM) da glutationa tampão de tampo de tiol-dissulfeto (GSH) para manter a homeostase redox e montar defesas antioxidantes5,6. O GSH pode ser covalentemente ligado a proteínas-alvo (S-glutathionylation) para controlar seu status e atividade redox e é usado por uma gama de enzimas desintoxificantes que reduzem proteínas oxidadas. Portanto, o potencial mitocondrial glutathione redox é um parâmetro altamente informativo ao estudar a função mitocondrial e a fisiopatologia.
roGFP2 é uma variante de GFP que foi tornada sensível ao redox pela adição de dois cisteínas expostas à superfície que formam um par de dithiol-dissulfeto artificial7,8. Tem um único pico de emissão em ~510 nm e dois picos de excitação em ~400 nm e 490 nm. É importante ressaltar que as amplitudes relativas dos dois picos de excitação dependem do estado redox do roGFP2 (Figura 1), tornando esta proteína um sensor ratiométrico. No sensor Grx1-roGFP2, a glutaredoxina humana-1 (Grx1) foi fundida ao N-terminus de roGFP29,10. O acessório covalent da enzima Grx1 ao roGFP2 proporciona duas grandes melhorias do sensor: torna a resposta do sensor específica para o par de glutationa redox GSH/GSSG (Figura 1), e acelera o equilíbrio entre GSSG e roGFP2 por um fator de pelo menos 100.0009. Portanto, o Grx1-roGFP2 permite imagens específicas e dinâmicas do potencial de glutationa celular redox.
As imagens grx1-roGFP2 podem ser realizadas em uma ampla gama de microscópios, incluindo microscópios de fluorescência de campo largo, microscópios confocal de disco giratório e microscópios confocal de varredura a laser. A expressão do sensor nos neurônios primários pode ser alcançada por vários métodos que incluem lipofecção11, coprecipitação de DNA/cálcio-fosfato12, transferência genética mediada por vírus ou uso de animais transgênicos como fonte celular (Figura 2). Vírus adeno associados a adeninantes pseudotipados (rAAV) contendo uma razão de 1:1 de proteínas capsidas AAV1 e AAV2 13,14 foram utilizados para os experimentos neste artigo. Com este vetor, a expressão do sensor máximo é tipicamente atingida de 4 a 5 dias após a infecção e permanece estável por pelo menos duas semanas. Usamos com sucesso Grx1-roGFP2 em neurônios hipocampais e corticais primários de ratos e ratos.
Neste artigo, a expressão mediada por rAAV de Grx1-roGFP2 com metas de mitocôndrias em neurônios hipocampais e corticais de ratos primários é usada para avaliar o estado de glutationa mitocondrial basal e sua perturbação aguda. Um protocolo é fornecido para imagens ao vivo confocal com instruções detalhadas sobre como (i) otimizar as configurações do microscópio confocal de varredura a laser, (ii) executar um experimento de imagem ao vivo e (iii) analisar dados com FIJI.
Protocolo
Todos os experimentos em animais se conformaram com as diretrizes nacionais e institucionais, incluindo a Diretiva do Conselho 2010/63/UE do Parlamento Europeu, e tiveram aprovação ética plena do Home Office (Escritório de Bem-Estar Animal da Universidade de Heidelberg e Regierungspraesidium Karlsruhe, licenças T14/21 e T13/21). Os neurônios hipocampais primários e corticais foram preparados a partir de filhotes de camundongos recém-nascidos ou ratos de acordo com os procedimentos padrão e foram mantidos por 12-14 dias como descrito anteriormente13.
1. Preparação de soluções
- Soluções de estoque para buffer de imagem
- Prepare cada solução de estoque de acordo com a Tabela 1 e mantenha-as a 4 °C. Para armazenamento a longo prazo (>3 meses), mantenha as alíquotas a -20 °C.
| Componente | MW | Concentração (M) | Quantidade (g) | Volume (mL) |
| NaCl | 58.44 | 5 | 14.61 | 50 |
| Kcl | 74.55 | 3 | 1.12 | 5 |
| MgCl2· 6H2O | 203.3 | 1.9 | 2 | 5 |
| CaCl2·2H2O | 147.01 | 1 | 1.47 | 10 |
| Glicina | 75.07 | 0.1 | 0.375 | 50 |
| Sacarose | 342.3 | 1.5 | 25.67 | 50 |
| Piruvato de sódio | 110.04 | 0.1 | 0.55 | 50 |
| HEPES | 238.3 | 1 | 11.9 | 50 |
| Glicose | 180.15 | 2.5 | 45 | 100 |
Tabela 1: Soluções de estoque para tampão de imagem.
- Soluções de estoque de drogas e corantes
- Dissolver diamide (DA; utilizado para calibração da proporção máxima de 405:488) na água para obter uma solução de estoque de 0,5 M (por exemplo, 1 g em 11.615 mL de água). Aliquot e armazenar a -20 °C.
- Dissolver dithiothreitol (DTT; usado para calibração de proporção mínima de 405:488) na água para obter uma solução de estoque de 1 M (por exemplo, 5 g em 32.425 mL de água). Aliquot e armazenar a -20 °C por uma máxima de 3 meses.
- Dissolver n-metil-d-aspartato (NMDA; usado para induzir excitotoxicidade e oxidação mitocondrial) na água para obter uma solução de estoque de 10 mM (por exemplo, 25 mgs em 16.991 mL de água). Armazene as alíquotas a -20 °C. Para armazenamento a longo prazo (>6 meses), mantenha as alíquotas em -80 °C.
- Tetrametilrhodamina e ester ester (TMRE; um indicador de pequena molécula do potencial da membrana mitocondrial)
- Dissolver o pó TMRE em metanol para obter um estoque de 20 mM (por exemplo, 25 mgs em 2,427 mL de metanol).
- Diluir as ações de 20 mM 1:1.000 em metanol para obter um estoque de 20 μM.
- Aliquot as soluções de estoque de 20 mM e 20 μM, vedação com parafilm e armazene protegido contra luz a -20 °C.
NOTA: Ambas as soluções de estoque estão estáveis por vários anos. Use a solução de estoque de 1.000x (20 μM) para experimentos.
- Tampão de imagem
- Prepare 100 mL de tampão de imagem adicionando todos os componentes da Tabela 2 a 80 mL de água estéril em um cilindro de medição. Leve o volume até 100 mL com água estéril. Misture sacudindo cuidadosamente o cilindro de medição até que a solução pareça homogênea.
NOTA: Recomenda-se usar um osmômetro para verificar a osmolaridade do buffer. Deve ser o mais próximo possível do meio de crescimento das células. Aqui, este é 315 mOsmol/L. Aumente ou diminua a concentração de sacarose conforme necessário para corresponder à osmolaridade do tampão de imagem e meio de crescimento. - Ajuste o pH para 7,4. Faça alíquotas e mantenha-as a 4 °C por até duas semanas. Para armazenamento a longo prazo, mantenha as alíquotas a -20 °C. Deixe o tampão de imagem atingir a temperatura ambiente antes de usar.
- Prepare 100 mL de tampão de imagem adicionando todos os componentes da Tabela 2 a 80 mL de água estéril em um cilindro de medição. Leve o volume até 100 mL com água estéril. Misture sacudindo cuidadosamente o cilindro de medição até que a solução pareça homogênea.
| Componente | Solução de estoque (M) | Concentração final (mM) | Volume (mL) |
| NaCl | 5 | 114 | 2.3 |
| Kcl | 3 | 5.29 | 0.176 |
| MgCl2 | 1.9 | 1 | 0.053 |
| CaCl2 | 1 | 2 | 0.2 |
| Glicina | 0.1 | 0.005 | 0.005 |
| Sacarose | 1.5 | 52 | 3.5 |
| Piruvato de sódio | 0.1 | 0.5 | 0.5 |
| HEPES | 1 | 10 | 1 |
| Glicose | 2.5 | 5 | 0.2 |
Tabela 2: Composição do tampão de imagem. Os volumes indicados são utilizados para a preparação de 100 mL de tampão de imagem.
- Soluções para estimulação e calibração
NOTA: Prepare sempre soluções de estimulação frescas adicionando soluções de estoque de medicamentos indicados ao buffer de imagem pouco antes do experimento. As soluções para estimulação e calibração serão adicionadas à câmara de imagem sequencialmente durante um experimento (ver seções 3-5). Dependendo do tipo de experimento, diferentes soluções são necessárias para atingir a mesma concentração final no respectivo volume final na câmara de imagem.- Prepare a solução 3x NMDA (90 μM; concentração final na câmara: 30 μM) adicionando 63 μL de um estoque NMDA de 10 mM a 6.937 mL de tampão de imagem. Adicione 500 μL da solução resultante à câmara (volume final: 1,5 mL).
- Prepare a solução 2x DA para as etapas 3 e 4 (1 mM; concentração final na câmara: 0,5 mM) adicionando 14 μL de um estoque de 0,5 M DA a 6,986 mL de tampão de imagem. Adicione 1 mL à câmara (volume final: 2 mL).
- Prepare a solução 4x DA para a etapa 5 (2 mM; concentração final na câmara: 0,5 mM) adicionando 28 μL de um estoque da DA de 0,5 M a 6,972 mL de tampão de imagem. Adicione 500 μL à câmara (volume final: 2 mL).
- Prepare a solução 1x DTT (5 mM; concentração final na câmara: 5 mM) adicionando 45 μL de 1 M DTT de estoque a 8955 μL de tampão de imagem. Adicione 1 mL desta solução à câmara após aspirar o tampão de imagem (volume final: 1 mL).
2. Carregamento de células com TMRE
NOTA: Neste protocolo, o TMRE é usado no modo não-saciar15 a uma concentração final de 20 nM. Em geral, deve ser utilizada a menor concentração possível de TMRE que ainda forneça intensidade de sinal suficiente no microscópio de escolha. Devido à evaporação desigual, o volume de médios em diferentes poços pode diferir em culturas primárias de longo prazo. Para garantir uma concentração de TMRE consistente em todos os poços, não adicione TMRE diretamente aos poços. Em vez disso, substitua o meio em cada poço com a mesma quantidade de meio contendo TMRE. O protocolo abaixo é projetado para neurônios primários em placas de 24 poços contendo ~1 mL de médio por poço.
- Trabalhando em uma cultura de tecido laminar flow hood, coletar 500 μL de meio de cada poço em um único tubo cônico.
- Por bem, adicione 0,5 μL de 20 μM de estoque de TMRE no tubo cônico (por exemplo, 12 μL para 24 poços).
- Aspire cuidadosamente o meio restante do primeiro poço e substitua-o por 500 μL de meio contendo TMRE. Continue, bem por bem, com os poços restantes.
NOTA: Tome cuidado para não deixar as células secarem e não perturbar as células. - Devolva as células à incubadora e espere pelo menos 60 min para o equilíbrio do corante.
NOTA: O tempo de carregamento pode ser estendido para várias horas sem efeitos adversos. - Para garantir concentrações e equilíbrio consistentes de TMRE durante todo o experimento de imagem, certifique-se de incluir uma concentração final de 20 nM TMRE no buffer de imagem e todas as soluções de estimulação.
3. Otimização das configurações do microscópio confocal de digitalização
NOTA: Esta etapa visa encontrar o melhor compromisso entre a qualidade da imagem e a viabilidade celular durante a imagem ao vivo. Esta seção descreve a otimização das configurações para imagens roGFP. Se for realizada uma imagem multiparamétrica, uma otimização semelhante, incluindo a verificação de uma linha de base estável sem sinais de branqueamento ou fototoxicidade, precisa ser realizada para os indicadores adicionais.
- Inicie o microscópio confocal e as configurações padrão de carga para imagens GFP (excitação de 488 nm, emissão de 505 - 550 nm).
- Coloque o detector em 12 bits ou 16 bits.
NOTA: Normalmente, 8 bits não são suficientes para imagens quantitativas. - Ative o modo de varredura sequencial e adicione segunda sequência/faixa (excitação de 405 nm, emissão de 505 a 550 nm).
- Para ambos os canais, selecione uma tabela de pesquisa pseudocolorida que indique pixels sobre e abaixo expostos (por exemplo, GLOW OU).
- Selecione um objetivo adequado para o objeto de interesse.
NOTA: 10x-40x são adequados para análise unicelular, 63x-100x são adequados para análise de mitocôndria única. - Monte uma mancha de cobertura com células na câmara de imagem, adicione 1 mL de tampão de imagem e coloque a câmara no microscópio.
- Use a ocular e a luz transmitida para concentrar as células.
NOTA: Não use luz de epifluorescência para localizar e concentrar células. Mesmo com baixa potência, isso afetará negativamente as células. - Grave imagens com diferentes formatos de pixels. Com base nessas imagens, selecione o menor número de pixels que dá uma resolução aceitável da estrutura de interesse.
NOTA: Normalmente, 512 x 512 pixels funcionam bem para imagens unicelulares com objetivos de 20x e 40x, e 1024 x 1024 ou 2048 x2048 pixels normalmente funcionam bem para imagens de mitoconddrion único com um objetivo de 63x. - Grave imagens com diferentes tamanhos de pinhole. Com base nessas imagens, selecione o maior tamanho do pinhole que dá uma resolução aceitável da estrutura de interesse.
NOTA: Normalmente, 3-7 unidades arejadas funcionam bem. - Grave imagens com diferentes intensidades de laser.
- Ajuste o ganho do detector e o limiar em conformidade. Com base nessas imagens, selecione a menor intensidade de laser que dá intensidade de sinal aceitável e relação sinal-fundo.
- Para determinar a relação sinal-fundo, meça a intensidade do sinal em uma região de interesse (ROI) que contenha células ou mitocôndrias (ROI1) e em um ROI sem células ou mitocôndrias (ROI2). Em seguida, divida a intensidade do ROI1 pela intensidade do ROI2.
NOTA: Aponte para uma relação sinal-fundo de >3 e intensidades de sinal de ROIs individuais de 200-1.000 para excitação de 405 nm com 1-3% de potência laser e intensidades de ROIs individuais de 300-1.500 para excitação de 488 nm com 1% de potência laser.
- Para determinar a relação sinal-fundo, meça a intensidade do sinal em uma região de interesse (ROI) que contenha células ou mitocôndrias (ROI1) e em um ROI sem células ou mitocôndrias (ROI2). Em seguida, divida a intensidade do ROI1 pela intensidade do ROI2.
- Ajuste o ganho do detector e o limiar em conformidade. Com base nessas imagens, selecione a menor intensidade de laser que dá intensidade de sinal aceitável e relação sinal-fundo.
- Registo imagens com diferentes velocidades de varredura e número de médias de quadros. Grave 4-5 imagens para cada combinação de configurações. Com base nessas séries de imagens, selecione as configurações médias mais altas e mais baixas que dão ruído de imagem aceitável e variabilidade imagem-a-imagem.
NOTA: Uma velocidade de varredura de 600 Hz e 1-2 quadros para o trabalho médio na maioria dos casos. - Usando um novo coverlip, registo de tempo com as configurações otimizadas.
NOTA: O intervalo de duração e imagem da série deve se assemelhar aos dos experimentos planejados. - No final da série time-lapse, adicione 1 mL de solução 2x DA à câmara de gravação. Imagem para mais 2 min.
- Aspire o tampão de imagem usando uma bomba peristáltica ou pipeta portátil. Adicione 1 mL de solução DTT 1x. Imagem para adicional de 5 min.
- Analise o experimento time-lapse (ver seção 5).
- Verifique se nenhum dos dois canais fica exposto demais ou sub-exposto durante o tratamento de DA e DTT com as configurações otimizadas.
- Certifique-se de que nenhum dos dois canais mostra branqueamento considerável durante a gravação de lapso de tempo; visam <2% de perda de intensidade entre a primeira e a última imagem.
- Verifique se a razão 405:488 não muda consideravelmente durante a imagem.
- Repita todo o procedimento de forma iterativa, utilizando várias tampas, até que sejam definidas configurações que forneçam resultados aceitáveis consistentemente.
4. Avaliação do estado basal do redox
- Inicie o microscópio e carregue as configurações otimizadas da seção 3.
- Definir a média do quadro para 3-5.
- Monte uma mancha de cobertura com células na câmara de imagem, adicione 1 mL de tampão de imagem e coloque a câmara no microscópio.
- Use a ocular e a luz transmitida para concentrar as células.
NOTA: Não use luz de epifluorescência para localizar e concentrar células. Mesmo com baixa potência, isso afetará negativamente as células. - Mude para o modo de digitalização e use o canal de 488 nm em exibição ao vivo para focar e localizar células para imagens.
- Use a função de vários pontos para selecionar 3-5 campos de exibição no deslizamento de cobertura.
- Grave uma imagem de linha de base.
- Adicione 1 mL de solução 2x DA à câmara.
- Depois de 1, 2 e 3 min, use a visualização ao vivo para confirmar/ajustar o foco e, em seguida, gravar uma imagem.
NOTA: As células são tipicamente totalmente oxidadas após 2 minutos. - Substitua o tampão na câmara de imagem por 1 mL de solução DTT 1x.
- Depois de 3 e 5 minutos, use a visualização ao vivo para confirmar/ajustar o foco e, em seguida, gravar uma imagem.
NOTA: As células são tipicamente totalmente reduzidas após 4-5 min.
5. Imagem ao vivo de tratamentos agudos
NOTA: O protocolo abaixo descreve a imagem da resposta mitocondrial redox ao tratamento NMDA. Os intervalos de imagem e a duração do experimento podem precisar ser ajustados para outros tratamentos.
- Inicie o microscópio e carregue as configurações otimizadas da seção 3.
- Defina o intervalo de lapso de tempo para 30 s e a duração para 25 min.
- Monte uma mancha de cobertura com células na câmara de imagem, adicione 1 mL de tampão de imagem e coloque a câmara no microscópio.
NOTA: Para evitar a deriva do foco térmico, deixe as células no estágio do microscópio por 10-15 minutos antes de iniciar a imagem de lapso de tempo. - Use a ocular e a luz transmitida para concentrar as células.
NOTA: Não use luz de epifluorescência para localizar e concentrar células. Mesmo com baixa potência, isso afetará negativamente as células. - Mude para o modo de digitalização e use o canal de 488 nm em exibição ao vivo para focar e localizar células para imagens.
- Opcional: Para aumentar o número de células gravadas por execução, use a função de vários pontos para exibir 2-3 campos de visualização por deslizamento de cobertura.
- Inicie a aquisição do lapso de tempo e grave 5 imagens como gravação de 2 min da linha de base.
- Adicione 500 μL de solução NMDA 3x à câmara (concentração final de 30 μM) e grave 20 imagens adicionais como uma resposta NMDA de 10 minutos.
NOTA: Os neurônios são muito sensíveis a alterações na osmolaridade. Portanto, certifique-se de minimizar a evaporação do tampão de imagem. Para tratamentos mais longos, a câmara de imagem deve ser coberta com uma tampa. - Adicione 500 μL de solução 4x DA à câmara e grave mais 6 imagens (calibração máxima de 3 min).
- Aspire o buffer da câmara de imagem e substitua-o por 1 mL de solução DTT 1x. Registo mais 10 imagens (calibração mínima de 5 min).
- Termine a gravação e salve a série de imagens.
6. Análise de dados
- Importação de dados e pré-processamento de imagens em FIJI
- Use o Bio-Formats Importer para abrir um grupo de imagens da etapa 4 ou um arquivo de imagem a partir da etapa 5. Clique em Plugins | Bioformiagens | Importador de Bioformiagens. Na caixa de diálogo, use a pilha de exibição com: Hyperstack, defina o modo de cor: padrão, selecione Autoescala e não se divida em janelas separadas.
NOTA: A escala automática otimiza a exibição dos dados na tela do computador. Não muda a intensidade dos pixels. - Se as imagens individuais do passo 4 forem abertas, clique em Imagem | Pilhas | Ferramentas | Concatenar para mesclá-los em uma pilha de imagem única.
- Se houver xy-drift durante a série de imagens, clique em Plugins | StackReg para registrar as imagens. Na caixa de diálogo, selecione Corpo Rígido ou Tradução.
- Altere o formato da imagem para 32 bits clicando em Imagem | Tipo | 32 bits.
- Divida os canais de cores em janelas separadas clicando em Imagem | | de cor Canais divididos.
- Selecione o canal 1 (405 nm) e ajuste o limiar para selecionar as mitocôndrias para análise clicando em Imagem | Ajuste | O limiar. Na caixa de diálogo, selecione Padrão, Fundo Vermelho, Escuro e Empilhar histograma e aguarde que os pixels selecionados apareçam vermelhos. Clique em Aplicar. Selecione Definir Pixels de fundo para NaN e Processar todas as imagens.
NOTA: Para evitar viés potencial de observador, deve-se usar a determinação automatizada do limiar. O FIJI oferece vários métodos automatizados (como Default, Huang, Intermodes, Otsu) que podem ser selecionados a partir de um menu suspenso na caixa de diálogo limiar. Normalmente, o método Padrão dá um bom resultado. Recomenda-se comparar vários métodos durante a primeira análise para encontrar o melhor método de limiar para o determinado conjunto de imagens. Uma vez que um método tenha sido escolhido, ele precisa ser aplicado a todas as imagens. - Repita a etapa 6.1.6 para o canal 2 (488 nm).
- Crie uma imagem de proporção para visualizar a proporção de 405.488 nm clicando em Process | Calculadora de imagens. Na caixa de diálogo, selecione Imagem 1: canal 1, Operação: Dividir, Imagem 2: canal 2, Criar nova janela, Processar todas as imagens.
- Altere a tabela de procuração da imagem de proporção para pseudocolorida. Por exemplo, para alterar para Fogo, clique em Imagem | Tabelas de procura | Fogo, fogo.
- Use o Bio-Formats Importer para abrir um grupo de imagens da etapa 4 ou um arquivo de imagem a partir da etapa 5. Clique em Plugins | Bioformiagens | Importador de Bioformiagens. Na caixa de diálogo, use a pilha de exibição com: Hyperstack, defina o modo de cor: padrão, selecione Autoescala e não se divida em janelas separadas.
- Análise de imagem
- Na imagem de proporção, desenhe ROIs em torno de células individuais ou mitocôndrias. Depois de desenhar cada ROI, adicione-o ao GERENCIADOr de ROI. Analise | Ferramentas | Gerente de ROI | Adicione. (atalho do teclado: 'T') Selecione Mostrar tudo.
NOTA: Como os pixels de fundo foram definidos como 'não um número' (NaN) nas etapas 6.1.6 e 6.1.7, eles não afetarão o resultado da medição. Portanto, é aceitável incluir alguns pixels de fundo no ROI. - Meça as proporções de 405:488 de células individuais clicando no GERENCIADOr de ROI | ctrl+A para selecionar todos os ROIs | Mais | Multi Medida. Na caixa de diálogo, selecione Medir todas as fatias e uma linha por fatia.
- Exporte as medidas para o software de planilha.
- Selecione a imagem de 405 nm. Meça a intensidade de todos os ROIs como na etapa 6.2.2. usando os ROIs que são armazenados no gerenciador de ROI.
- Exporte as medidas para o software de planilha.
- Selecione a imagem de 488 nm. Medir intensidades de todos os ROIs como na etapa 6.2.2. usando os ROIs que são armazenados no gerenciador de ROI.
- Exporte as medidas para o software de planilha.
- Salve ROIs para referência futura clicando no GERENCIADOr de ROI | ctrl+A para selecionar todos os ROIs | Mais | Salve.
- Recomendado: Gerar intensidade versus tempo de parcelas dos traços de 405 e 488 nm. Verifique se não há branqueamento marcado em nenhum dos canais (a intensidade do sinal no final da série de imagens deve ser ≥98% da primeira imagem) e que os dois traços se movem em direções opostas durante as respostas dos sensores (por exemplo, o traço de 405 nm deve aumentar durante a oxidação enquanto o traço de 488 nm deve diminuir).
- Na imagem de proporção, desenhe ROIs em torno de células individuais ou mitocôndrias. Depois de desenhar cada ROI, adicione-o ao GERENCIADOr de ROI. Analise | Ferramentas | Gerente de ROI | Adicione. (atalho do teclado: 'T') Selecione Mostrar tudo.
- Normalização de dados
- Para cada ROI da imagem da razão, determine o valor máximo durante o tratamento da DA (Rmax) e o valor mínimo durante o tratamento DTT (Rmin).
- Calcule a razão normalizada da seguinte forma:
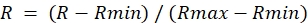
NOTA: Isso definirá a razão máxima para 1,0 e a razão mínima para 0.
- Análise da morfologia mitocondrial
- Para obter medidas de morfologia mitocondrial em paralelo às intensidades roGFP na etapa 6.2.6, vá para Analisar | Defina medidas e verifique descritores de forma e elipse de ajuste.
NOTA: Além da intensidade média, as medidas na janela de resultados incluirão o comprimento do eixo principal (Major), o comprimento do eixo menor (Menor), a proporção (AR; eixo principal dividido por eixo menor; mitocôndrias redondas têm um AR ~1, mitocôndrias alongadas têm ar maior), bem como medidas de circularidade (Circ.) e arredondamento (Round).
- Para obter medidas de morfologia mitocondrial em paralelo às intensidades roGFP na etapa 6.2.6, vá para Analisar | Defina medidas e verifique descritores de forma e elipse de ajuste.
Resultados
Quantificação das diferenças no estado vermelho mitocondrial de estado estável após a retirada do fator de crescimento
Para demonstrar a quantificação das diferenças de estado estável no estado redox mitocondrial, os neurônios primários cultivados no meio padrão foram comparados aos neurônios cultivados sem fatores de crescimento por 48 horas antes da imagem. A retirada do fator de crescimento resulta em morte celular neuronal apoptóltica após 72 h16. As células...
Discussão
Medições quantitativas e dinâmicas do estado mitocondrial redox fornecem informações importantes sobre fisiologia mitocondrial e celular. Várias sondas químicas fluorogênicas estão disponíveis que detectam espécies reativas de oxigênio, "estresse redox" ou "estresse oxidativo". No entanto, os últimos termos não são bem definidos e muitas vezes carecem de especificidade9,17,18. Em comparação com os corantes quím...
Divulgações
Os autores declaram que não têm conflito de interesses.
Agradecimentos
Este trabalho foi apoiado pela Deutsche Forschungsgemeinschaft (BA 3679/5-1; PARA 2289: BA 3679/4-2). A.K. é apoiada por uma bolsa ERASMUS+. Agradecemos a Iris Bünzli-Ehret, Rita Rosner e Andrea Schlicksupp pela preparação dos neurônios primários. Agradecemos ao Dr. Tobias Dick por fornecer pLPCX-mito-Grx1-roGFP2. Experimentos mostrados na Figura 4 foram realizados no Nikon Imaging Center, Universidade de Heidelberg. A Figura 2 foi preparada com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| reagents | |||
| Calcium chloride (CaCl2·2H2O) | Sigma-Aldrich | C3306 | |
| Diamide (DA) | Sigma-Aldrich | D3648 | |
| Dithiothreitol (DTT) | Carl Roth GmbH | 6908.1 | |
| Glucose (2.5 M stock solution) | Sigma-Aldrich | G8769 | |
| Glucose | Sigma-Aldrich | G7528 | |
| Glycine | neoFroxx GmbH | LC-4522.2 | |
| HEPES (1 M stock solution) | Sigma-Aldrich | 15630-080 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Magnesium chloride (MgCl2·6H2O) | Sigma-Aldrich | 442611-M | |
| N-methyl-D-aspartate (NMDA) | Sigma-Aldrich | M3262 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P3911 | |
| Sodium chloride (NaCl) | neoFroxx GmbH | LC-5932.1 | |
| Sodium pyruvate (0.1 M stock solution) | Sigma-Aldrich | S8636 | |
| Sodium pyruvate | Sigma-Aldrich | P8574 | |
| Sucrose | Carl Roth GmbH | 4621.1 | |
| Tetramethylrhodamine ethyl ester perchlorate (TMRE) | Sigma-Aldrich | 87917 | |
| equipment | |||
| imaging chamber | Life Imaging Services (Basel, Switzerland) | 10920 | Ludin Chamber Type 3 for Ø12mm coverslips |
| laser scanning confocal microscope, microscope | Leica | DMI6000 | |
| laser scanning confocal microscope, scanning unit | Leica | SP8 | |
| peristaltic pump | VWR | PP1080 181-4001 | |
| spinning disc confocal microscope, camera | Hamamatsu | C9100-02 EMCCD | |
| spinning disc confocal microscope, incubationsystem | TokaiHit | INU-ZILCF-F1 | |
| spinning disc confocal microscope, microscope | Nikon | Ti microscope | |
| spinning disc confocal microscope, scanning unit | Yokagawa | CSU-X1 | |
| software | |||
| FIJI | https://fiji.sc | ||
| StackReg plugin | https://github.com/fiji-BIG/StackReg/blob/master/src/main/java/StackReg_.java | ||
| TurboReg plugin | https://github.com/fiji-BIG/TurboReg/blob/master/src/main/java/TurboReg_.java |
Referências
- Roede, J. R., Go, Y. M., Jones, D. P. Redox equivalents and mitochondrial bioenergetics. Methods in Molecular Biology. 810, 249-280 (2012).
- Turrens, J. F. Mitochondrial formation of reactive oxygen species. Journal of Physiology. 552, 335-344 (2003).
- Lin, M. T., Beal, M. F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 443 (7113), 787-795 (2006).
- Manfredi, G., Beal, M. F. The role of mitochondria in the pathogenesis of neurodegenerative diseases. Brain Pathology. 10 (3), 462-472 (2000).
- Mari, M., Morales, A., Colell, A., Garcia-Ruiz, C., Fernandez-Checa, J. C. Mitochondrial glutathione, a key survival antioxidant. Antioxidants & Redox Signaling. 11 (11), 2685-2700 (2009).
- Murphy, M. P. Mitochondrial thiols in antioxidant protection and redox signaling: distinct roles for glutathionylation and other thiol modifications. Antioxidants & Redox Signaling. 16 (6), 476-495 (2012).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Hanson, G. T., et al. Investigating mitochondrial redox potential with redox-sensitive green fluorescent protein indicators. Journal of Biological Chemistry. 279 (13), 13044-13053 (2004).
- Gutscher, M., et al. Real-time imaging of the intracellular glutathione redox potential. Nature Methods. 5 (6), 553-559 (2008).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring E(GSH) and H2O2 with roGFP2-based redox probes. Free Radical Biology & Medicine. 51 (11), 1943-1951 (2011).
- Marwick, K. F. M., Hardingham, G. E. Transfection in primary cultured neuronal cells. Methods in Molecular Biology. 1677, 137-144 (2017).
- Kohrmann, M., et al. convenient, and effective method to transiently transfect primary hippocampal neurons. Journal of Neuroscience Research. 58 (6), 831-835 (1999).
- Depp, C., Bas-Orth, C., Schroeder, L., Hellwig, A., Bading, H. Synaptic activity protects neurons against calcium-mediated oxidation and contraction of mitochondria during excitotoxicity. Antioxidants & Redox Signaling. 29 (12), 1109-1124 (2018).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Molecular Therapy. 7 (3), 419-425 (2003).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Zhang, S. J., et al. Nuclear calcium signaling controls expression of a large gene pool: identification of a gene program for acquired neuroprotection induced by synaptic activity. PLoS Genetics. 5 (8), 1000604 (2009).
- Winterbourn, C. C. The challenges of using fluorescent probes to detect and quantify specific reactive oxygen species in living cells. Biochimica et Biophysica Acta. 1840 (2), 730-738 (2014).
- Sies, H. Oxidative stress: a concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Lukyanov, K. A., Belousov, V. V. Genetically encoded fluorescent redox sensors. Biochimica et Biophysica Acta. 1840 (2), 745-756 (2014).
- Nietzel, T., et al. Redox-mediated kick-start of mitochondrial energy metabolism drives resource-efficient seed germination. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 741-751 (2020).
- Albrecht, S. C., et al. Redesign of genetically encoded biosensors for monitoring mitochondrial redox status in a broad range of model eukaryotes. Journal of Biomolecular Screening. 19 (3), 379-386 (2014).
- Albrecht, S. C., Barata, A. G., Grosshans, J., Teleman, A. A., Dick, T. P. In vivo mapping of hydrogen peroxide and oxidized glutathione reveals chemical and regional specificity of redox homeostasis. Cell Metabolism. 14 (6), 819-829 (2011).
- Breckwoldt, M. O., et al. Multiparametric optical analysis of mitochondrial redox signals during neuronal physiology and pathology in vivo. Nature Medicine. 20 (5), 555-560 (2014).
- Ricke, K. M., et al. Mitochondrial dysfunction combined with high calcium load leads to impaired antioxidant defense underlying the selective loss of nigral dopaminergic neurons. Journal of Neuroscience. 40 (9), 1975-1986 (2020).
- Bjornberg, O., Ostergaard, H., Winther, J. R. Mechanistic insight provided by glutaredoxin within a fusion to redox-sensitive yellow fluorescent protein. Biochemistry. 45 (7), 2362-2371 (2006).
- Shokhina, A. G., et al. Red fluorescent redox-sensitive biosensor Grx1-roCherry. Redox Biology. 21, 101071 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados