Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Primer Nöronlarda Mitokondriyal Glutatyon Redoksu Durumunun Oranmetrik Gösterge Kullanılarak Canlı Görüntülenmesi
Bu Makalede
Özet
Bu makalede, konfokal canlı mikroskopi kullanılarak primer hipokampal ve kortikal nöronlarda bazal redoks durumundaki farklılıkları ve akut pertürbasyonlara redoks yanıtlarını belirlemek için bir protokol açıklanmaktadır. Protokol, diğer hücre tiplerine ve mikroskoplara minimum değişiklikle uygulanabilir.
Özet
Mitokondriyal redoks homeostaz nöronal canlılık ve fonksiyon için önemlidir. Mitokondri birkaç redoks sistemi içermese de, oldukça bol miktarda tiyol-disülfid redoks tampon glutatyon antioksidan savunmada merkezi bir oyuncu olarak kabul edilir. Bu nedenle, mitokondriyal glutatyon redoks potansiyelinin ölçülmesi mitokondriyal redoks durumu ve oksidatif stres hakkında yararlı bilgiler sağlar. Glutaredoxin1-roGFP2 (Grx1-roGFP2), 400 nm ve 490 nm'de tek emisyon zirvesi olan iki redoks durumuna duyarlı uyarlama zirvesine sahip glutatyon redoks potansiyelinin genetik olarak kodlanmış, yeşil floresan protein (GFP) bazlı bir oransal göstergesidir. Bu makalede primer hipokampal ve kortikal nöronlarda mitokondri hedefli Grx1-roGFP2 konfokal canlı mikroskopinin nasıl gerçekleştirilği açıklanmaktadır. Sabit durum mitokondriyal glutatyon redoks potansiyelinin (örneğin, hastalık durumlarını veya uzun süreli tedavileri karşılaştırmak için) nasıl değerlendirileceğini ve akut tedavilerde redoks değişikliklerinin nasıl ölçüleceğini (örnek olarak ekssostoksik ilaç N-metil-D-aspartat (NMDA) kullanılarak) açıklar. Buna ek olarak, makale Grx1-roGFP2 ve mitokondriyal membran potansiyel göstergesi, tetrametrikrhodamin, etil ester (TMRE), Grx1-roGPF2'nin çok boyutlu analizler için ek göstergelerle nasıl çok sayıdan olabileceğini göstermek için ortak görüntüleme sunar. Bu protokol, (i) konfokal lazer tarama mikroskop ayarlarının nasıl optimize edilmesi, (ii) uyarılma için ilaçların nasıl uygulanacağı ve ardından diamid ve dithiothreitol ile sensör kalibrasyonunun nasıl uygulanacağı ve (iii) ImageJ/FIJI ile verilerin nasıl analiz edilmesi gerektiği hakkında ayrıntılı bir açıklama sağlar.
Giriş
Birkaç önemli mitokondriyal enzim ve sinyal molekülü tiol redoks regülasyonuna tabidir1. Ayrıca, mitokondri reaktif oksijen türlerinin önemli bir hücresel kaynağıdır ve oksidatif hasara karşı seçici olarak savunmasızdır2. Buna göre, mitokondriyal redoks potansiyeli biyoenergetikleri, hücre sinyallerini, mitokondriyal fonksiyonu ve nihayetinde hücre canlılığını doğrudan etkiler3,4. Mitokondriyal matris, redoks homeostazını korumak ve antioksidan savunmaları monte etmek için yüksek miktarlarda (1-15 mM) tiyol-disülfid redoks tampon glutatyon (GSH) içerir5,6. GSH, redoks durumlarını ve aktivitelerini kontrol etmek için hedef proteinlere (S-glutatyonilasyon) birlikte bağlanabilir ve oksitlenmiş proteinleri azaltan bir dizi detoksifiye edici enzim tarafından kullanılır. Bu nedenle, mitokondriyal glutatyon redoks potansiyeli, mitokondriyal fonksiyon ve patofizyoloji incelerken oldukça bilgilendirici bir parametredir.
roGFP2, yapay bir dithiol-disülfid çifti oluşturan yüzeye maruz kalan iki sisteinin eklenmesiyle redoks duyarlı hale getirilmiş bir GFP çeşididir7,8. ~510 nm'de tek bir emisyon zirvesine ve ~400 nm ve 490 nm'de iki heyecan zirvesine sahiptir. Daha da önemlisi, iki ekscitasyon zirvesinin bağıl genlikleri roGFP2'nin redoks durumuna bağlıdır (Şekil 1), bu proteini oranmetrik bir sensör haline getirir. Grx1-roGFP2 sensöründe, insan glutaredoxin-1 (Grx1) roGFP29,10'un N-terminusu ile kaynaşmıştır. Grx1 enziminin roGFP2'ye katan bağlanması sensörün iki önemli iyileştirmesini sağlar: sensör yanıtını GSH/GSSG glutatyon redoks çiftine özgü hale getirir (Şekil 1) ve GSSG ile roGFP2 arasındaki dengeyi en az 100.0009 kat hızlandırır. Bu nedenle, Grx1-roGFP2 hücresel glutatyon redoks potansiyelinin spesifik ve dinamik görüntülenmesini sağlar.
GRX1-roGFP2 görüntüleme, geniş alan floresan mikroskopları, dönen disk konfokal mikroskopları ve lazer tarama konfokal mikroskopları dahil olmak üzere çok çeşitli mikroskoplarda yapılabilir. Birincil nöronlarda sensörün ekspresyonu lipofeksiyon11, DNA/kalsiyum-fosfat koprecipitation12, virüs aracılı gen transferi veya transgenik hayvanların hücre kaynağı olarak kullanılması gibi çeşitli yöntemlerle elde edilebilir (Şekil 2). Bu makaledeki deneyler için 1:1 AAV1 oranı ve AAV2 kapsid proteinleri 13,14 içeren sözde rekombinant adeno ilişkili virüsler (rAAV) kullanılmıştır. Bu vektör ile maksimal sensör ekspresyonuna genellikle enfeksiyondan 4-5 gün sonra ulaşılır ve en az iki hafta stabil kalır. Grx1-roGFP2'yi fare ve sıçanlardan birincil hipokampal ve kortikal nöronlarda başarıyla kullandık.
Bu makalede, primer sıçan hipokampal ve kortikal nöronlarda mitokondri hedefli Grx1-roGFP2'nin rAAV aracılı ekspresyonu bazal mitokondriyal glutatyon redoks durumunu ve akut pertürbasyonunu değerlendirmek için kullanılır. (i) lazer tarama konfokal mikroskop ayarlarının nasıl optimizeılacağı, (ii) canlı görüntüleme deneyinin nasıl çalıştırılacağı ve (iii) FIJI ile verilerin nasıl analizılacağına ilişkin ayrıntılı talimatlar içeren konfokal canlı görüntüleme için bir protokol sağlanır.
Protokol
Avrupa Parlamentosu'nun 2010/63/AB Konsey Direktifi de dahil olmak üzere ulusal ve kurumsal yönergelere uygun olan ve tam İçişleri Bakanlığı etik onayına sahip olan tüm hayvan deneyleri (Heidelberg Üniversitesi Hayvan Refahı Ofisi ve Regierungspraesidium Karlsruhe, T14/21 ve T13/21 lisansları). Primer hipokampal ve kortikal nöronlar yenidoğan fare veya sıçan yavrularından standart prosedürlere göre hazırlandı ve daha önce tanımlandığı gibi 12-14 gün boyunca muhafaza edildi13.
1. Çözümlerin hazırlanması
- Görüntüleme tamponu için stok çözümleri
- Her stok çözeltisini Tablo 1'e göre hazırlayın ve 4 °C'de tutun. Uzun süreli depolama için (>3 ay), aliquots 'u -20 °C'de tutun.
| Parça | MW | Konsantrasyon (M) | Tutar (g) | Birim (mL) |
| NaCl | 58.44 | 5 | 14.61 | 50 |
| Kartal | 74.55 | 3 | 1.12 | 5 |
| MgCl2· 6H2O | 203.3 | 1.9 | 2 | 5 |
| CaCl2·2H2O | 147.01 | 1 | 1.47 | 10 |
| Glisin | 75.07 | 0.1 | 0.375 | 50 |
| Sakaroz | 342.3 | 1.5 | 25.67 | 50 |
| Sodyum piruvat | 110.04 | 0.1 | 0.55 | 50 |
| HEPES | 238.3 | 1 | 11.9 | 50 |
| Glikoz | 180.15 | 2.5 | 45 | 100 |
Tablo 1: Görüntüleme tamponu için stok çözümleri.
- İlaç ve boyaların stok çözümleri
- 0,5 M stok çözeltisi (örneğin, 11.615 mL su içinde 1 g) elde etmek için suda diamid (DA; maksimum 405:488 oranının kalibrasyonu için kullanılır) çözün. Aliquot ve -20 °C'de saklayın.
- 1 M stok çözeltisi (örneğin, 32.425 mL su içinde 5 g) elde etmek için suda dithiothreitol (DTT; minimum 405:488 oranının kalibrasyonu için kullanılır) çözün. Aliquot ve -20 °C'de en fazla 3 ay saklayın.
- 10 mM stok çözeltisi (örneğin, 16.991 mL suda 25 mg) elde etmek için N-metil-D-aspartatını (NMDA; eksotoksisite ve mitokondriyal oksidasyona neden olmak için kullanılır) suda çözün. Aliquotları -20 °C'de saklayın. Uzun süreli depolama için (>6 ay), aliquotları -80 °C'de tutun.
- Tetrametrinhodamin etil ester perklorat (TMRE; mitokondriyal membran potansiyelinin küçük moleküllü bir göstergesi)
- 20 mM stok elde etmek için TMRE tozunu metanolde çözün (örneğin, 2.427 mL metanolde 25 mg).
- 20 μM stok elde etmek için 20 mM stoku 1:1.000 metanolde seyreltin.
- 20 mM ve 20 μM stok çözeltilerini aliquot, parafilm ile mühürleyin ve -20 °C'de ışıktan korunan depolayın.
NOT: Her iki stok çözümü de birkaç yıldır istikrarlıdır. Deneyler için 1.000x stok çözeltisini (20 μM) kullanın.
- Görüntüleme arabelleği
- Tablo 2'den 80 mL'ye kadar tüm bileşenleri bir ölçüm silindirine ekleyerek 100 mL görüntüleme tamponu hazırlayın. Hacmi steril suyla 100 mL'ye kadar getirin. Çözelti homojen görünene kadar ölçüm silindirini dikkatlice sallayarak karıştırın.
NOT: Tamponun omomolaritesini kontrol etmek için bir kilometre sayacı kullanılması önerilir. Hücrelerin büyüme ortamına mümkün olduğunca yakın olmalıdır. Burada, bu 315 mOsmol / L. Görüntüleme tamponunun ve büyüme ortamının ozmolaritesine uyacak şekilde sakkaroz konsantrasyonunun gerektiği gibi arttırın veya azaltın. - pH'ı 7,4'e ayarlayın. Aliquots yapın ve iki haftaya kadar 4 °C'de tutun. Uzun süreli depolama için aliquotları -20 °C'de tutun. Kullanmadan önce görüntüleme tamponu oda sıcaklığına ulaşsın.
- Tablo 2'den 80 mL'ye kadar tüm bileşenleri bir ölçüm silindirine ekleyerek 100 mL görüntüleme tamponu hazırlayın. Hacmi steril suyla 100 mL'ye kadar getirin. Çözelti homojen görünene kadar ölçüm silindirini dikkatlice sallayarak karıştırın.
| Parça | Stok çözümü (M) | Son konsantrasyon (mM) | Birim (mL) |
| NaCl | 5 | 114 | 2.3 |
| Kartal | 3 | 5.29 | 0.176 |
| MgCl2 | 1.9 | 1 | 0.053 |
| CaCl2 | 1 | 2 | 0.2 |
| Glisin | 0.1 | 0.005 | 0.005 |
| Sakaroz | 1.5 | 52 | 3.5 |
| Sodyum piruvat | 0.1 | 0.5 | 0.5 |
| HEPES | 1 | 10 | 1 |
| Glikoz | 2.5 | 5 | 0.2 |
Tablo 2: Görüntüleme tamponunun bileşimi. Belirtilen birimler 100 mL görüntüleme tamponunun hazırlanması için kullanılır.
- Stimülasyon ve kalibrasyon çözümleri
NOT: Deneyden hemen önce görüntüleme tamponu içine belirtilen ilaçların stok çözeltilerini ekleyerek her zaman taze stimülasyon çözümleri hazırlayın. Stimülasyon ve kalibrasyon çözümleri bir deney sırasında görüntüleme odasına ardışık olarak eklenecektir (bkz. bölümler 3-5). Deney türüne bağlı olarak, görüntüleme odasındaki ilgili son hacimde aynı uç konsantrasyona ulaşmak için farklı çözümler gereklidir.- 6.937 mL görüntüleme tamponuna 10 mM NMDA stoğunun 63 μL'sini ekleyerek 3x NMDA çözeltisi (90 μM; haznede son konsantrasyon: 30 μM) hazırlayın. Elde eden çözeltinin 500 μL'lik kısmını odaya ekleyin (son hacim: 1,5 mL).
- 6.986 mL görüntüleme tamponuna 0,5 M DA stoğunun 14 μL'si ekleyerek 3 ve 4 adım (1 mM; haznedeki son konsantrasyon: 0,5 mM) için 2x DA çözeltisi hazırlayın. Hazneye 1 mL ekleyin (son hacim: 2 mL).
- 6.972 mL görüntüleme tamponuna 0,5 M DA stoğunun 28 μL'si ekleyerek 4x DA çözeltisini 5. Odaya 500 μL ekleyin (son hacim: 2 mL).
- 8955 μL görüntüleme tamponuna 45 μL 1 M DTT stok ekleyerek 1x DTT çözeltisi (5 mM; haznede son konsantrasyon: 5 mM) hazırlayın. Görüntüleme tamponu (son hacim: 1 mL) aspirasyondan sonra bu çözeltinin 1 mL'lik kısmını odaya ekleyin.
2. Hücrelerin TMRE ile yüklenmesi
NOT: Bu protokolde, TMRE söndürme olmayan mod15'te 20 nM'lik son konsantrasyonda kullanılır. Genel olarak, tercih ettiği mikroskopta hala yeterli sinyal yoğunluğu sağlayan mümkün olan en düşük TMRE konsantrasyonu kullanılmalıdır. Düzensiz buharlaşma nedeniyle, farklı kuyulardaki ortamın hacmi uzun vadeli birincil kültürlerde farklılık gösterebilir. Tüm kuyularda tutarlı bir TMRE konsantrasyonu sağlamak için TMRE'yi doğrudan kuyulara eklemeyin. Bunun yerine, her kuyudaki ortamı aynı miktarda TMRE içeren ortamla değiştirin. Aşağıdaki protokol, kuyu başına ~1 mL orta içeren 24 kuyulu plakalardaki birincil nöronlar için tasarlanmıştır.
- Bir doku kültürü laminar akış davlumbazında çalışarak, her kuyudan tek bir konik tüpe 500 μL orta toplayın.
- Kuyu başına, konik boruya 0,5 μL 20 μM TMRE stoğu ekleyin (örneğin, 24 kuyu için 12 μL).
- Kalan ortamı ilk kuyudan dikkatlice emiş ve 500 μL TMRE içeren ortamla değiştirin. Kalan kuyularla devam edin.
NOT: Hücrelerin kurumasına ve hücreleri rahatsız etmemeye dikkat edin. - Hücreleri inkübatöre geri verin ve boya denge için en az 60 dakika bekleyin.
NOT: Yükleme süresi olumsuz etkileri olmadan birkaç saate kadar uzatılabilir. - Görüntüleme deneyi boyunca tutarlı TMRE konsantrasyonları ve denge sağlamak için, görüntüleme tamponuna ve tüm stimülasyon çözeltilerine 20 nM TMRE'lik son bir konsantrasyon eklenin.
3. Tarama konfokal mikroskop ayarlarının optimizasyonu
NOT: Bu adım, canlı görüntüleme sırasında görüntü kalitesi ve hücre canlılığı arasında en iyi uzlaşmayı bulmayı amaçlamaktadır. Bu bölümde roGFP görüntüleme ayarlarının en iyi duruma getirilmesi açıklanmaktadır. Çokparametrik görüntüleme yapılırsa, ek göstergeler için ağartma veya fototoksiklik belirtisi olmadan kararlı bir taban çizgisi kontrolü de dahil olmak üzere benzer optimizasyonun yapılması gerekir.
- Konfokal mikroskobu başlatın ve GFP görüntüleme için standart ayarları yükleyin (488 nm heyecan, 505 - 550 nm emisyon).
- Dedektörü 12 bit veya 16 bit olarak ayarlayın.
NOT: Genellikle nicel görüntüleme için 8 bit yeterli değildir. - Sıralı tarama modunu etkinleştirin ve ikinci sırayı / parçayı ekleyin (405 nm heyecan, 505 - 550 nm emisyon).
- Her iki kanal için de aşırı ve az maruz kalan pikselleri (örneğin GLOW OU) gösteren bir sahte renk arama tablosu seçin.
- İlgi çekici nesneye uygun bir hedef seçin.
NOT: 10x-40x tek hücreli analiz için, 63x-100x tek mitokondrion analizi için uygundur. - Görüntüleme odasına hücrelerle bir kapak kapağı takın, 1 mL görüntüleme tamponu ekleyin ve odayı mikroskop üzerine yerleştirin.
- Hücreleri odaklamak için göz merceği ve iletilen ışığı kullanın.
NOT: Hücreleri bulmak ve odaklamak için epifluoresans ışığı kullanmayın. Düşük güçte bile, bu hücreleri olumsuz yönde etkileyecektir. - Görüntüleri farklı piksel formatlarıyla kaydedin. Bu görüntülere dayanarak, ilgi çekici yapının kabul edilebilir bir çözünürlüğünü veren en düşük piksel numarasını seçin.
NOT: Genellikle, 512 x 512 piksel 20x ve 40x hedefleri olan tek hücreli görüntüleme için iyi çalışır ve 1024 x 1024 veya 2048 x2048 pikselleri genellikle 63x hedefli tek mitokondrion görüntüleme için iyi çalışır. - Farklı iğne deliği boyutlarıyla görüntüleri kaydedin. Bu görüntülere dayanarak, ilgi çekici yapının kabul edilebilir bir çözünürlüğünü veren en büyük iğne deliği boyutunu seçin.
NOT: Tipik olarak, 3-7 havadar ünite iyi çalışır. - Farklı lazer yoğunluklarıyla görüntüleri kaydedin.
- Dedektör kazancını ve eşiğini buna göre ayarlayın. Bu görüntülere dayanarak, kabul edilebilir sinyal yoğunluğu ve sinyal-arka plan oranı sağlayan en düşük lazer yoğunluğunu seçin.
- Sinyal-arka plan oranını belirlemek için, hücre veya mitokondri (ROI1) içeren ilgi çekici bir bölgedeki (ROI) ve hücreleri veya mitokondrilerin (ROI2) olmadığı bir yatırım getirisinde sinyal yoğunluğunu ölçün. Ardından, ROI1'in yoğunluğunu ROI2'nin yoğunluğuna bölün.
NOT: > %1-3 lazer gücü ile 405 nm heyecan için 200-1.000 200-1.000 bireysel 100-1.000 1 ve 300-1.500 bireysel RBI'lerin yoğunlukları için 488 nm'lik bir sinyal-arka plan oranı ve %1 lazer gücü ile 488 nm'lik bir ekscitasyon hedefleyin.
- Sinyal-arka plan oranını belirlemek için, hücre veya mitokondri (ROI1) içeren ilgi çekici bir bölgedeki (ROI) ve hücreleri veya mitokondrilerin (ROI2) olmadığı bir yatırım getirisinde sinyal yoğunluğunu ölçün. Ardından, ROI1'in yoğunluğunu ROI2'nin yoğunluğuna bölün.
- Dedektör kazancını ve eşiğini buna göre ayarlayın. Bu görüntülere dayanarak, kabul edilebilir sinyal yoğunluğu ve sinyal-arka plan oranı sağlayan en düşük lazer yoğunluğunu seçin.
- Görüntüleri farklı tarama hızları ve kare ortalamalarının sayısıyla kaydedin. Ayarların her birleşimi için 4-5 görüntü kaydedin. Bu görüntü serilerine bağlı olarak, kabul edilebilir görüntü paraziti ve görüntüden görüntüye değişkenlik sağlayan en yüksek hızı ve en düşük ortalama ayarları seçin.
NOT: Ortalama için 600 Hz ve 1-2 kare tarama hızı çoğu durumda iyi çalışır. - Yeni bir kapak kılıfı kullanarak, optimize edilmiş ayarlarla bir zaman atlamalı seri kaydedin.
NOT: Serinin süresi ve görüntü aralığı planlanan deneylere benzemelidir. - Hızlandırılmış serinin sonunda, kayıt odasına 1 mL 2x DA çözeltisi ekleyin. Ek 2 dakika için görüntü.
- Görüntüleme tamponu peristaltik bir pompa veya el pipeti kullanarak epire edin. 1 mL 1x DTT çözümü ekleyin. Ek 5 dakika için görüntü.
- Zaman atlamalı denemeyi analiz edin (bkz. bölüm 5).
- Optimize edilmiş ayarlarla DA ve DTT tedavisi sırasında iki kanaldan hiçbirinin aşırı veya az maruz kalmadığını doğrulayın.
- Zaman atlamalı kayıt sırasında iki kanaldan hiçbirinin önemli ölçüde ağartma olmadığından emin olun; ilk ve son görüntüler arasında %<2 yoğunluk kaybı hedeflenmektedir.
- Görüntüleme sırasında 405:488 oranının önemli ölçüde değişmediğini doğrulayın.
- Sürekli olarak kabul edilebilir sonuçlar sağlayan ayarlar tanımlanana kadar, birkaç kapak kılıfı kullanarak tüm yordamı yinelemeli bir şekilde tekrarlayın.
4. Bazal redoks durumunun değerlendirilmesi
- Mikroskobu başlatın ve optimize edilmiş ayarları bölüm 3'ten yükleyin.
- Çerçeve ortalamasını 3-5 olarak ayarlayın.
- Görüntüleme odasına hücrelerle bir kapak kapağı takın, 1 mL görüntüleme tamponu ekleyin ve odayı mikroskop üzerine yerleştirin.
- Hücreleri odaklamak için göz merceği ve iletilen ışığı kullanın.
NOT: Hücreleri bulmak ve odaklamak için epifluoresans ışığı kullanmayın. Düşük güçte bile, bu hücreleri olumsuz yönde etkileyecektir. - Tarama moduna geçin ve görüntüleme için hücreleri odaklamak ve bulmak için canlı görünümde 488 nm kanalını kullanın.
- Kapak arasında 3-5 görüş alanı seçmek için çok noktalı işlevi kullanın.
- Temel görüntü kaydedin.
- Odaya 1 mL 2x DA çözeltisi ekleyin.
- 1, 2 ve 3 dakika sonra, odağı onaylamak /ayarlamak ve ardından bir görüntü kaydetmek için canlı görünümü kullanın.
NOT: Hücreler genellikle 2 dakika sonra tamamen oksitlenir. - Görüntüleme odasındaki tamponu 1 mL 1x DTT çözelti ile değiştirin.
- 3 ve 5 dakika sonra, odağı onaylamak / ayarlamak ve ardından bir görüntü kaydetmek için canlı görünümü kullanın.
NOT: Hücreler genellikle 4-5 dakika sonra tamamen azalır.
5. Akut tedavilerin canlı görüntülenmesi
NOT: Aşağıdaki protokolde NMDA tedavisine mitokondriyal redoks yanıtının görüntülenmesi açıklanmaktadır. Diğer tedaviler için görüntü aralıklarının ve deneme süresinin ayarlanması gerekebilir.
- Mikroskobu başlatın ve optimize edilmiş ayarları bölüm 3'ten yükleyin.
- Zaman atlama aralığını 30 s'ye ve süreyi 25 dakikaya ayarlayın.
- Görüntüleme odasına hücrelerle bir kapak kapağı takın, 1 mL görüntüleme tamponu ekleyin ve odayı mikroskop üzerine yerleştirin.
NOT: Termal odak sürüklenmesini önlemek için, zaman atlamalı görüntülemeye başlamadan önce hücreleri mikroskop aşamasında 10-15 dakika bekletin. - Hücreleri odaklamak için göz merceği ve iletilen ışığı kullanın.
NOT: Hücreleri bulmak ve odaklamak için epifluoresans ışığı kullanmayın. Düşük güçte bile, bu hücreleri olumsuz yönde etkileyecektir. - Tarama moduna geçin ve görüntüleme için hücreleri odaklamak ve bulmak için canlı görünümde 488 nm kanalını kullanın.
- İsteğe bağlı: Çalışma başına kaydedilen hücre sayısını artırmak için, kapak altlığı başına 2-3 görüş alanını görüntülemek için çok noktalı işlevi kullanın.
- Zaman atlamalı alıma başlayın ve 5 görüntü 2 dakikalık temel kayıt olarak kaydedin.
- Odaya 500 μL 3x NMDA çözeltisi ekleyin (son konsantrasyon 30 μM) ve 10 dakikalık NMDA yanıtı olarak ek 20 görüntü kaydedin.
NOT: Nöronlar ozmolaritedeki değişikliklere karşı çok hassastır. Bu nedenle, görüntüleme arabelleği buharlaşmasını en aza indirdiğinizi unutmayın. Daha uzun tedaviler için görüntüleme odası bir kapakla kaplanmalıdır. - Hazneye 500 μL 4x DA çözeltisi ekleyin ve 6 görüntü daha kaydedin (3 dakika maksimum kalibrasyon).
- Tamponu görüntüleme odasından epire edin ve 1 mL 1x DTT çözelti ile değiştirin. 10 görüntü daha kaydedin (5 dakika minimum kalibrasyon).
- Kaydı sonlandırın ve görüntü serisini kaydedin.
6. Veri analizi
- FIJI'de veri alma ve görüntü ön işleme
- 4. adımdan bir görüntü grubunu veya 5. Eklentiler | tıklayın Biyo-Formatlar | Biyo-Format İthalatçısı. iletişim kutusunda Yığını görüntüle'yi kullanın: Hyperstack, Renk modunu ayarla: varsayılan, Otomatik Ölçeklendir'i seçin ve ayrı pencerelere bölmeyin.
NOT: Otomatik ölçeklendirme , verilerin bilgisayar ekranında görüntülenmesini en iyi duruma getirmektedir. Piksel yoğunluklarını değiştirmez. - 4. adımdaki tek tek görüntüler açıldıysa, Resim | Yığınlar | Araçlar | Bunları tek bir görüntü yığınında birleştirmek için birleştirin.
- Görüntü serisi sırasında XY-drift varsa, Eklentiler | Görüntüleri kaydetmek için StackReg . iletişim kutusunda Sert Gövde veya Çeviri'yi seçin.
- Resim | tıklayarak görüntü biçimini 32 bit olarak değiştirme | yazın 32-bit.
- Görüntü |'na tıklayarak renk kanallarını ayrı pencerelere bölme Renk | Kanalları Böl.
- Kanal 1'i (405 nm) seçin ve Görüntü | tıklayarak analiz için mitokondriyi seçmek için eşiği ayarlayın | ayarlama Eşik. iletişim kutusunda Varsayılan, Kırmızı, Koyu arka plan ve Yığın histogramı'nı seçin ve seçili piksellerin kırmızı görünmesini bekleyin. Uygula'yı tıklatın. Arka Plan Piksellerini NaN Olarak Ayarla'yı seçin ve Tüm görüntüleri işleyin.
NOT: Olası gözlemci önyargısını önlemek için otomatik eşik belirleme kullanılmalıdır. FIJI, eşik iletişim kutusundaki bir açılır menüden seçilebilen çeşitli otomatik yöntemler (Varsayılan, Huang, Intermodes, Otsu gibi) sunar. Genellikle, Default yöntemi iyi bir sonuç verir. Verilen görüntü kümesi için en iyi eşik yöntemini bulmak için ilk analiz sırasında birkaç yöntemi karşılaştırmanız önerilir. Bir yöntem seçildikten sonra, tüm görüntülere uygulanması gerekir. - Kanal 2 (488 nm) için 6.1.6 adımlarını yineleyin.
- İşlem | tıklayarak 405:488 nm oranını görselleştirmek için bir oran görüntüsü oluşturun Görüntü hesaplayıcısı. İletişim kutusunda Görüntü 1: kanal 1, İşlem: Bölme, Görüntü 2: kanal 2, Yeni pencere oluştur, Tüm görüntüleri işle'yi seçin.
- Oran görüntüsünün arama tablosunu sahte renkle değiştirin. Örneğin, Ateş olarak değiştirmek için Resim | Arama Tabloları | Ateş, ateş.
- 4. adımdan bir görüntü grubunu veya 5. Eklentiler | tıklayın Biyo-Formatlar | Biyo-Format İthalatçısı. iletişim kutusunda Yığını görüntüle'yi kullanın: Hyperstack, Renk modunu ayarla: varsayılan, Otomatik Ölçeklendir'i seçin ve ayrı pencerelere bölmeyin.
- Görüntü analizi
- Oran görüntüsünde, ROI'leri tek tek hücrelerin veya mitokondrilerin etrafına çizin. Her yatırım getirisini çizdikten sonra yatırım getirisi yöneticisine ekleyin. | Çözümle Araçlar | Yatırım Getirisi Yöneticisi | Ekle. (klavye kısayol: 'T') Tümlerini Göster'i seçin.
NOT: Arka plan pikselleri 6.1.6 ve 6.1.7 adımlarında 'sayı değil' (NaN) olarak ayarlandığı için ölçüm sonucunu etkilemez. Bu nedenle, yatırım getirisine bazı arka plan pikselleri dahil etmek kabul edilebilir. - Tüm ROI'leri seçmek için Yatırım Getirisi Yöneticisi | ctrl+A tuşlarına tıklayarak tek tek hücrelerin 405:488 oranlarını ölçün| Daha fazla | Çok Ölçülü. iletişim kutusunda Tüm dilimleri ölç ve Dilim başına bir satır'ı seçin.
- Ölçümleri elektronik tablo yazılımına dışa aktarın.
- 405 nm görüntüyü seçin. Adım 6.2.2'de olduğu gibi tüm ROI'lerin yoğunluklarını ölçün. yatırım getirisi yöneticisinde depolanan ROI'leri kullanarak.
- Ölçümleri elektronik tablo yazılımına dışa aktarın.
- 488 nm görüntüyü seçin. Adım 6.2.2'de olduğu gibi tüm ROI'lerin yoğunluklarını ölçün. yatırım getirisi yöneticisinde depolanan ROI'leri kullanarak.
- Ölçümleri elektronik tablo yazılımına dışa aktarın.
- Tüm ROI'leri seçmek için YATıRıM Getirisi Yöneticisi | ctrl+A tuşlarına tıklayarak ROI'leri ileride başvurmak üzere kaydedin| Daha fazla | Kaydet.
- Önerilen: 405 ve 488 nm izlemelerinin zaman çizi çizilerine göre yoğunluk oluşturun. Her iki kanalda da belirgin bir ağartma olmadığını doğrulayın (görüntüleme serisinin sonundaki sinyal yoğunluğu ≥1 ilk görüntünün % 98'i olmalıdır) ve sensör yanıtları sırasında iki izin zıt yönlere doğru hareket ettiğini doğrulayın (örneğin, 488 nm iz azalırken oksidasyon sırasında 405 nm iz artmalıdır).
- Oran görüntüsünde, ROI'leri tek tek hücrelerin veya mitokondrilerin etrafına çizin. Her yatırım getirisini çizdikten sonra yatırım getirisi yöneticisine ekleyin. | Çözümle Araçlar | Yatırım Getirisi Yöneticisi | Ekle. (klavye kısayol: 'T') Tümlerini Göster'i seçin.
- Veri normalleştirme
- Oran görüntüsünden her yatırım getirisi için, DA tedavisi (Rmax) sırasında maksimum değeri ve DTT tedavisi (Rmin) sırasında minimum değeri belirleyin.
- Normalleştirilmiş oranı aşağıdaki gibi hesaplayın:
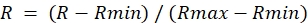
NOT: Bu, maksimum oranı 1,0'a ve minimum oranı 0 olarak ayarlar.
- Mitokondriyal morfolojinin analizi
- 6.2.6 adımındaki roGFP yoğunluklarına paralel olarak mitokondriyal morfoloji ölçümleri elde etmek için Analiz | Ölçümleri ayarlayın ve Şekil tanımlayıcılarını ve Elips sığdır'ı kontrol edin.
NOT: Ortalama yoğunluğa ek olarak, sonuçlar penceresindeki ölçümler ana eksenin uzunluğunu (Majör), küçük eksenin uzunluğunu (Minör), en boy oranını (AR; küçük eksene bölünmüş ana ekseni; yuvarlak mitokondri bir AR ~1'e, uzun mitokondriler daha büyük bir AR'ye sahiptir) ve dairesellik (Circ.) ve yuvarlaklık (Yuvarlak) ölçümlerini içerecektir.
- 6.2.6 adımındaki roGFP yoğunluklarına paralel olarak mitokondriyal morfoloji ölçümleri elde etmek için Analiz | Ölçümleri ayarlayın ve Şekil tanımlayıcılarını ve Elips sığdır'ı kontrol edin.
Sonuçlar
Büyüme faktörü geri çekilmesinden sonra sabit durum mitokondriyal redoks durumundaki farklılıkların ölçülmesi
Mitokondriyal redoks durumundaki sabit durum farklılıklarının nicelliğini göstermek için, standart ortamda yetişen primer nöronlar, görüntülemeden önce 48 saat boyunca büyüme faktörü olmadan kültürlenen nöronlarla karşılaştırıldı. Büyüme faktörü çekilmesi 72 h16'dan sonra apoptotik nöronal hücre ölümü ile sonuçlanır. Hüc...
Tartışmalar
Mitokondriyal redoks durumunun nicel ve dinamik ölçümleri mitokondriyal ve hücresel fizyoloji hakkında önemli bilgiler sağlar. Reaktif oksijen türlerini, "redoks stres" veya "oksidatif stresi" tespit eden çeşitli florojenik kimyasal problar mevcuttur. Bununla birlikte, ikinci terimler iyi tanımlanmamıştır ve genellikle özgüllüklerden yoksundur9,17,18. Kimyasal boyalarla karşılaştırıldığında, Grx1-roGFP2 ...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma Deutsche Forschungsgemeinschaft (BA 3679/5-1; 2289 İÇİN: BA 3679/4-2). A.K. ERASMUS+ bursu ile desteklenmektedir. Birincil nöronların hazırlanması için Iris Bünzli-Ehret, Rita Rosner ve Andrea Schlicksupp'a teşekkür ederiz. PLPCX-mito-Grx1-roGFP2 sağladığı için Dr. Tobias Dick'e teşekkür ederiz. Şekil 4'te gösterilen deneyler Heidelberg Üniversitesi Nikon Görüntüleme Merkezi'nde gerçekleştirildi. Şekil 2 BioRender.com ile hazırlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| reagents | |||
| Calcium chloride (CaCl2·2H2O) | Sigma-Aldrich | C3306 | |
| Diamide (DA) | Sigma-Aldrich | D3648 | |
| Dithiothreitol (DTT) | Carl Roth GmbH | 6908.1 | |
| Glucose (2.5 M stock solution) | Sigma-Aldrich | G8769 | |
| Glucose | Sigma-Aldrich | G7528 | |
| Glycine | neoFroxx GmbH | LC-4522.2 | |
| HEPES (1 M stock solution) | Sigma-Aldrich | 15630-080 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Magnesium chloride (MgCl2·6H2O) | Sigma-Aldrich | 442611-M | |
| N-methyl-D-aspartate (NMDA) | Sigma-Aldrich | M3262 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P3911 | |
| Sodium chloride (NaCl) | neoFroxx GmbH | LC-5932.1 | |
| Sodium pyruvate (0.1 M stock solution) | Sigma-Aldrich | S8636 | |
| Sodium pyruvate | Sigma-Aldrich | P8574 | |
| Sucrose | Carl Roth GmbH | 4621.1 | |
| Tetramethylrhodamine ethyl ester perchlorate (TMRE) | Sigma-Aldrich | 87917 | |
| equipment | |||
| imaging chamber | Life Imaging Services (Basel, Switzerland) | 10920 | Ludin Chamber Type 3 for Ø12mm coverslips |
| laser scanning confocal microscope, microscope | Leica | DMI6000 | |
| laser scanning confocal microscope, scanning unit | Leica | SP8 | |
| peristaltic pump | VWR | PP1080 181-4001 | |
| spinning disc confocal microscope, camera | Hamamatsu | C9100-02 EMCCD | |
| spinning disc confocal microscope, incubationsystem | TokaiHit | INU-ZILCF-F1 | |
| spinning disc confocal microscope, microscope | Nikon | Ti microscope | |
| spinning disc confocal microscope, scanning unit | Yokagawa | CSU-X1 | |
| software | |||
| FIJI | https://fiji.sc | ||
| StackReg plugin | https://github.com/fiji-BIG/StackReg/blob/master/src/main/java/StackReg_.java | ||
| TurboReg plugin | https://github.com/fiji-BIG/TurboReg/blob/master/src/main/java/TurboReg_.java |
Referanslar
- Roede, J. R., Go, Y. M., Jones, D. P. Redox equivalents and mitochondrial bioenergetics. Methods in Molecular Biology. 810, 249-280 (2012).
- Turrens, J. F. Mitochondrial formation of reactive oxygen species. Journal of Physiology. 552, 335-344 (2003).
- Lin, M. T., Beal, M. F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 443 (7113), 787-795 (2006).
- Manfredi, G., Beal, M. F. The role of mitochondria in the pathogenesis of neurodegenerative diseases. Brain Pathology. 10 (3), 462-472 (2000).
- Mari, M., Morales, A., Colell, A., Garcia-Ruiz, C., Fernandez-Checa, J. C. Mitochondrial glutathione, a key survival antioxidant. Antioxidants & Redox Signaling. 11 (11), 2685-2700 (2009).
- Murphy, M. P. Mitochondrial thiols in antioxidant protection and redox signaling: distinct roles for glutathionylation and other thiol modifications. Antioxidants & Redox Signaling. 16 (6), 476-495 (2012).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Hanson, G. T., et al. Investigating mitochondrial redox potential with redox-sensitive green fluorescent protein indicators. Journal of Biological Chemistry. 279 (13), 13044-13053 (2004).
- Gutscher, M., et al. Real-time imaging of the intracellular glutathione redox potential. Nature Methods. 5 (6), 553-559 (2008).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring E(GSH) and H2O2 with roGFP2-based redox probes. Free Radical Biology & Medicine. 51 (11), 1943-1951 (2011).
- Marwick, K. F. M., Hardingham, G. E. Transfection in primary cultured neuronal cells. Methods in Molecular Biology. 1677, 137-144 (2017).
- Kohrmann, M., et al. convenient, and effective method to transiently transfect primary hippocampal neurons. Journal of Neuroscience Research. 58 (6), 831-835 (1999).
- Depp, C., Bas-Orth, C., Schroeder, L., Hellwig, A., Bading, H. Synaptic activity protects neurons against calcium-mediated oxidation and contraction of mitochondria during excitotoxicity. Antioxidants & Redox Signaling. 29 (12), 1109-1124 (2018).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Molecular Therapy. 7 (3), 419-425 (2003).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Zhang, S. J., et al. Nuclear calcium signaling controls expression of a large gene pool: identification of a gene program for acquired neuroprotection induced by synaptic activity. PLoS Genetics. 5 (8), 1000604 (2009).
- Winterbourn, C. C. The challenges of using fluorescent probes to detect and quantify specific reactive oxygen species in living cells. Biochimica et Biophysica Acta. 1840 (2), 730-738 (2014).
- Sies, H. Oxidative stress: a concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Lukyanov, K. A., Belousov, V. V. Genetically encoded fluorescent redox sensors. Biochimica et Biophysica Acta. 1840 (2), 745-756 (2014).
- Nietzel, T., et al. Redox-mediated kick-start of mitochondrial energy metabolism drives resource-efficient seed germination. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 741-751 (2020).
- Albrecht, S. C., et al. Redesign of genetically encoded biosensors for monitoring mitochondrial redox status in a broad range of model eukaryotes. Journal of Biomolecular Screening. 19 (3), 379-386 (2014).
- Albrecht, S. C., Barata, A. G., Grosshans, J., Teleman, A. A., Dick, T. P. In vivo mapping of hydrogen peroxide and oxidized glutathione reveals chemical and regional specificity of redox homeostasis. Cell Metabolism. 14 (6), 819-829 (2011).
- Breckwoldt, M. O., et al. Multiparametric optical analysis of mitochondrial redox signals during neuronal physiology and pathology in vivo. Nature Medicine. 20 (5), 555-560 (2014).
- Ricke, K. M., et al. Mitochondrial dysfunction combined with high calcium load leads to impaired antioxidant defense underlying the selective loss of nigral dopaminergic neurons. Journal of Neuroscience. 40 (9), 1975-1986 (2020).
- Bjornberg, O., Ostergaard, H., Winther, J. R. Mechanistic insight provided by glutaredoxin within a fusion to redox-sensitive yellow fluorescent protein. Biochemistry. 45 (7), 2362-2371 (2006).
- Shokhina, A. G., et al. Red fluorescent redox-sensitive biosensor Grx1-roCherry. Redox Biology. 21, 101071 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır