Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Живая визуализация окислительно-восстановительного состояния митохондриального глутатиона в первичных нейронах с использованием ратиометрического индикатора
В этой статье
Резюме
В этой статье описывается протокол для определения различий в базальном окислительно-восстановительном состоянии и окислительно-восстановительных реакциях на острые возмущения в первичных нейронах гиппокампа и коры с помощью конфокальной живой микроскопии. Протокол может быть применен к другим типам клеток и микроскопам с минимальными модификациями.
Аннотация
Митохондриальный окислительно-восстановительный гомеостаз важен для жизнеспособности и функции нейронов. Хотя митохондрии содержат несколько окислительно-восстановительных систем, тиолдисульфидный окислительно-восстановительный буферный глутатион считается центральным игроком в антиоксидантной защите. Таким образом, измерение окислительно-восстановительного потенциала митохондрий глутатиона дает полезную информацию о митохондриальном окислительно-восстановительном статусе и окислительном стрессе. Glutaredoxin1-roGFP2 (Grx1-roGFP2) представляет собой генетически закодированный, основанный на зеленом флуоресцентном белке (GFP) ратиометрический индикатор окислительно-восстановительного потенциала глутатиона, который имеет два пика возбуждения, чувствительных к окислительно-восстановительному состоянию, при 400 нм и 490 нм с одним пиком излучения при 510 нм. В этой статье описывается, как выполнить конфокальную живую микроскопию митохондрий, нацеленных на Grx1-roGFP2 в первичных нейронах гиппокампа и коры. В нем описывается, как оценить устойчивый окислительно-восстановительный потенциал митохондриального глутатиона (например, для сравнения болезненных состояний или длительного лечения) и как измерить окислительно-восстановительные изменения при остром лечении (используя экситотоксический препарат N-метил-D-аспартат (NMDA) в качестве примера). Кроме того, в статье представлена совместная визуализация Grx1-roGFP2 и индикатора потенциала митохондриальной мембраны, тетраметилродамина, этилового эфира (TMRE), чтобы продемонстрировать, как Grx1-roGPF2 может быть мультиплексирован с дополнительными показателями для многопараметрического анализа. Этот протокол предоставляет подробное описание того, как (i) оптимизировать настройки конфокального лазерного сканирующего микроскопа, (ii) применять препараты для стимуляции с последующей калибровкой датчиков с диамидом и дитиотрейтолом и (iii) анализировать данные с помощью ImageJ / FIJI.
Введение
Несколько важных митохондриальных ферментов и сигнальных молекул подвержены окислительно-восстановительной регуляции тиола1. Кроме того, митохондрии являются основным клеточным источником активных форм кислорода и избирательно уязвимы к окислительному повреждению2. Соответственно, митохондриальный окислительно-восстановительный потенциал напрямую влияет на биоэнергетику, клеточную сигнализацию, митохондриальную функцию и, в конечном счете, жизнеспособность клеток3,4. Митохондриальный матрикс содержит большое количество (1-15 мМ) тиолдисульфидного окислительно-восстановительного буфера глутатиона (GSH) для поддержания окислительно-восстановительного гомеостаза и повышения антиоксидантной защиты5,6. GSH может быть ковалентно присоединен к целевым белкам (S-глутатионилирование) для контроля их окислительно-восстановительного статуса и активности и используется рядом детоксикационных ферментов, которые уменьшают окисленные белки. Поэтому окислительно-восстановительный потенциал митохондрийного глутатиона является высокоинформативным параметром при изучении митохондриальной функции и патофизиологии.
roGFP2 является вариантом GFP, который был сделан окислительно-чувствительным путем добавления двух поверхностно-открытых цистеинов, которые образуют искусственную пару дитиол-дисульфид7,8. Он имеет один пик излучения при ~ 510 нм и два пика возбуждения при ~ 400 нм и 490 нм. Важно отметить, что относительные амплитуды двух пиков возбуждения зависят от окислительно-восстановительного состояния roGFP2 (рисунок 1), что делает этот белок ратиометрическим датчиком. В датчике Grx1-roGFP2 человеческий глутаредоксин-1 (Grx1) был сплавлен с N-концом roGFP29,10. Ковалентное присоединение фермента Grx1 к roGFP2 обеспечивает два основных улучшения датчика: он делает отклик датчика специфичным для окислительно-восстановительной пары глутатиона GSH / GSSG (рисунок 1) и ускоряет эквивалентность между GSSG и roGFP2 в 100 0009 раз. Таким образом, Grx1-roGFP2 обеспечивает специфическую и динамическую визуализацию окислительно-восстановительного потенциала клеточного глутатиона.
Визуализация Grx1-roGFP2 может быть выполнена на широком спектре микроскопов, включая широкоугольные флуоресцентные микроскопы, вращающиеся дисковые конфокальные микроскопы и лазерные сканирующие конфокальные микроскопы. Экспрессия датчика в первичных нейронах может быть достигнута различными методами, которые включают липофекцию11, сопреципитацию ДНК/кальций-фосфат12, опосредованный вирусом перенос генов или использование трансгенных животных в качестве источника клеток (рисунок 2). Псевдотипизированные рекомбинантные аденоассоциированные вирусы (rAAV), содержащие соотношение 1:1 AAV1 и AAV2 капсидных белков 13,14, были использованы для экспериментов в этой статье. При этом векторе максимальная экспрессия датчиков обычно достигается через 4-5 дней после заражения и остается стабильной в течение не менее двух недель. Мы успешно использовали Grx1-roGFP2 в первичных нейронах гиппокампа и коры мышей и крыс.
В этой статье rAAV-опосредованная экспрессия митохондрий-таргетного Grx1-roGFP2 в первичных нейронах гиппокампа и коры крыс используется для оценки базального митохондриального окислительно-восстановительного состояния глутатиона и его острого возмущения. Для конфокальной визуализации в реальном времени предоставляется протокол с подробными инструкциями о том, как (i) оптимизировать настройки лазерного сканирования конфокального микроскопа, (ii) провести эксперимент по визуализации в реальном времени и (iii) проанализировать данные с помощью FIJI.
протокол
Все эксперименты на животных соответствовали национальным и институциональным руководящим принципам, включая Директиву Совета 2010/63/ЕС Европейского парламента, и имели полное этическое одобрение Министерства внутренних дел (Управление по защите животных Гейдельбергского университета и Regierungspraesidium Karlsruhe, лицензии T14/21 и T13/21). Первичные нейроны гиппокампа и коры были получены из новорожденных детенышей мышей или крыс в соответствии со стандартными процедурами и поддерживались в течение 12-14 дней, как описано ранее13.
1. Приготовление растворов
- Стандартные решения для буфера изображений
- Подготовьте каждый запасной раствор в соответствии с таблицей 1 и держите их при температуре 4 °C. Для длительного хранения (>3 месяца) хранить аликвоты при -20 °C.
| Компонент | МВТ | Концентрация (М) | Количество (г) | Объем (мл) |
| НаКл | 58.44 | 5 | 14.61 | 50 |
| ККл | 74.55 | 3 | 1.12 | 5 |
| МгCl2· 6Н2О | 203.3 | 1.9 | 2 | 5 |
| CaCl2·2H2O | 147.01 | 1 | 1.47 | 10 |
| Глицин | 75.07 | 0.1 | 0.375 | 50 |
| Сахароза | 342.3 | 1.5 | 25.67 | 50 |
| Пируват натрия | 110.04 | 0.1 | 0.55 | 50 |
| ХЕПЕС | 238.3 | 1 | 11.9 | 50 |
| Глюкоза | 180.15 | 2.5 | 45 | 100 |
Таблица 1: Стандартные решения для буфера изображений.
- Стандартные растворы лекарственных средств и красителей
- Растворить диамид (DA; используется для калибровки максимального соотношения 405:488) в воде для получения запасного раствора 0,5 М (например, 1 г в 11,615 мл воды). Аликвотировать и хранить при -20 °C.
- Растворить дитиотрейтол (DTT; используется для калибровки минимального соотношения 405:488) в воде для получения 1 M запасного раствора (например, 5 г в 32,425 мл воды). Aliquot и хранить при -20 °C в течение максимум 3 месяцев.
- Растворите N-метил-D-аспартат (NMDA; используется для индуцирования экситотоксичности и митохондриального окисления) в воде для получения 10 мМ раствора (например, 25 мг в 16,991 мл воды). Храните аликвоты при -20 °C. Для длительного хранения (>6 месяцев) хранить аликвоты при -80 °C.
- Тетраметилродамина этиловый эфир перхлорат (TMRE; низкомолекулярный индикатор мембранного потенциала митохондрий)
- Растворите порошок TMRE в метаноле для получения запаса 20 мМ (например, 25 мг в 2,427 мл метанола).
- Разбавьте запас 20 мМ 1:1000 в метаноле для получения запаса 20 мкМ.
- Aliquot 20 мМ и 20 мкМ стоковые растворы, герметизируются парапленкой и хранятся защищенными от света при -20 °C.
ПРИМЕЧАНИЕ: Оба фондовых решения стабильны в течение нескольких лет. Используйте 1000-кратный стоковый раствор (20 мкМ) для экспериментов.
- Буфер изображений
- Подготовьте 100 мл буфера визуализации, добавив все компоненты от Таблицы 2 до 80 мл стерильной воды в измерительный цилиндр. Доведите объем до 100 мл стерильной водой. Перемешайте, тщательно встряхнув измерительный цилиндр, пока раствор не станет однородным.
ПРИМЕЧАНИЕ: Рекомендуется использовать осмометр для проверки осмолярности буфера. Она должна находиться как можно ближе к среде роста клеток. Здесь это 315 мОсмол/л. Увеличивайте или уменьшайте концентрацию сахарозы по мере необходимости, чтобы соответствовать осмолярности буфера визуализации и питательной среды. - Отрегулируйте pH до 7,4. Сделайте аликвоты и держите их при 4 °C до двух недель. Для длительного хранения аликвоты храните при -20 °C. Перед использованием буфер изображения дайте буферу изображений достичь комнатной температуры.
- Подготовьте 100 мл буфера визуализации, добавив все компоненты от Таблицы 2 до 80 мл стерильной воды в измерительный цилиндр. Доведите объем до 100 мл стерильной водой. Перемешайте, тщательно встряхнув измерительный цилиндр, пока раствор не станет однородным.
| Компонент | Складское решение (M) | Конечная концентрация (мМ) | Объем (мл) |
| НаКл | 5 | 114 | 2.3 |
| ККл | 3 | 5.29 | 0.176 |
| МгCl2 | 1.9 | 1 | 0.053 |
| КаCl2 | 1 | 2 | 0.2 |
| Глицин | 0.1 | 0.005 | 0.005 |
| Сахароза | 1.5 | 52 | 3.5 |
| Пируват натрия | 0.1 | 0.5 | 0.5 |
| ХЕПЕС | 1 | 10 | 1 |
| Глюкоза | 2.5 | 5 | 0.2 |
Таблица 2: Состав буфера визуализации. Указанные объемы используются для приготовления 100 мл буфера визуализации.
- Решения для стимуляции и калибровки
ПРИМЕЧАНИЕ: Всегда готовьте свежие стимулирующие растворы, добавляя стандартные растворы указанных препаратов в буфер визуализации непосредственно перед экспериментом. Растворы для стимуляции и калибровки будут добавляться в камеру визуализации последовательно во время эксперимента (см. разделы 3-5). В зависимости от типа эксперимента для достижения одинаковой конечной концентрации в соответствующем конечном объеме в камере визуализации требуются различные растворы.- Готовят 3 раствора NMDA (90 мкМ; конечная концентрация в камере: 30 мкМ), добавляя 63 мкл запаса NMDA 10 мМ к 6,937 мл буфера визуализации. Добавьте в камеру 500 мкл полученного раствора (конечный объем: 1,5 мл).
- Приготовьте 2-кратный раствор DA для этапов 3 и 4 (1 мМ; конечная концентрация в камере: 0,5 мМ), добавив 14 мкл запаса 0,5 М DA к 6,986 мл буфера визуализации. Добавить в камеру 1 мл (конечный объем: 2 мл).
- Приготовьте 4-кратный раствор DA для стадии 5 (2 мМ; конечная концентрация в камере: 0,5 мМ), добавив 28 мкл запаса 0,5 М DA к 6,972 мл буфера визуализации. Добавить в камеру 500 мкл (конечный объем: 2 мл).
- Готовят 1 раствор DTT (5 мМ; конечная концентрация в камере: 5 мМ), добавляя 45 мкл 1 M DTT к 8955 мкл буфера визуализации. Добавьте 1 мл этого раствора в камеру после аспирации буфера визуализации (конечный объем: 1 мл).
2. Загрузка ячеек TMRE
ПРИМЕЧАНИЕ: В этом протоколе TMRE используется в режиме без закалки15 при конечной концентрации 20 нМ. В общем, следует использовать минимально возможную концентрацию TMRE, которая по-прежнему обеспечивает достаточную интенсивность сигнала на микроскопе по выбору. Из-за неравномерного испарения объем среды в разных скважинах может отличаться в многолетних первичных культурах. Чтобы обеспечить стабильную концентрацию TMRE во всех скважинах, не добавляйте TMRE непосредственно в скважины. Вместо этого замените среду в каждой скважине таким же количеством среды, содержащей TMRE. Приведенный ниже протокол предназначен для первичных нейронов в 24-луночных пластинах, содержащих ~1 мл среды на лунку.
- Работая в тканевой культуре ламинарной проточной вытяжки, соберите 500 мкл среды из каждой скважины в единую коническую трубку.
- На каждую лунку добавьте в коническую трубу 0,5 мкл запаса TMRE 20 мкМ (например, 12 мкл для 24 скважин).
- Осторожно аспирировать оставшуюся среду из первой скважины и заменить ее 500 мкл TMRE-содержащей среды. Продолжайте, хорошо за колодцем, с оставшимися скважинами.
ПРИМЕЧАНИЕ: Позаботьтесь о том, чтобы не дать клеткам высохнуть и не потревожить клетки. - Верните клетки в инкубатор и подождите не менее 60 минут для выравнивания красителя.
ПРИМЕЧАНИЕ: Время загрузки может быть увеличено до нескольких часов без побочных эффектов. - Чтобы обеспечить постоянную концентрацию TMRE и равновесие на протяжении всего эксперимента по визуализации, обязательно включите конечную концентрацию 20 нМ TMRE в буфер визуализации и все стимулирующие растворы.
3. Оптимизация настроек сканирующего конфокального микроскопа
ПРИМЕЧАНИЕ: Этот шаг направлен на поиск наилучшего компромисса между качеством изображения и жизнеспособностью клеток во время живой визуализации. В этом разделе описывается оптимизация параметров для создания образов roGFP. При проведении многопараметрической визуализации для дополнительных показателей необходимо выполнить аналогичную оптимизацию, включая проверку стабильного исходного уровня без признаков отбеливания или фототоксичности.
- Запустите конфокальный микроскоп и нагрузите стандартные настройки для визуализации GFP (возбуждение 488 нм, эмиссия 505 - 550 нм).
- Установите детектор на 12 бит или 16 бит.
ПРИМЕЧАНИЕ: Обычно 8 бит недостаточно для количественной визуализации. - Активируйте режим последовательного сканирования и добавьте вторую последовательность/трек (возбуждение 405 нм, излучение 505 - 550 нм).
- Для обоих каналов выберите таблицу псевдоцветной подстановки , которая показывает пиксели с избыточным и недостаточным экспонированием (например, GLOW OU).
- Выберите цель, подходящую для интересующего объекта.
ПРИМЕЧАНИЕ: 10x-40x подходят для одноклеточного анализа, 63x-100x подходят для анализа с одной митохондрией. - Установите крышку с клетками в камеру визуализации, добавьте 1 мл буфера визуализации и поместите камеру на микроскоп.
- Используйте окуляр и пропускаемый свет, чтобы сфокусировать клетки.
ПРИМЕЧАНИЕ: Не используйте эпифлуоресцентный свет для обнаружения и фокусировки клеток. Даже при малой мощности это негативно скажется на клетках. - Записывайте изображения с различными форматами пикселей. На основе этих изображений выберите наименьшее число пикселей, которое дает приемлемое разрешение интересующей структуры.
ПРИМЕЧАНИЕ: Как правило, 512 x 512 пикселей хорошо работают для одноклеточной визуализации с объективами 20x и 40x, а пиксели 1024 x 1024 или 2048 x2048 обычно хорошо работают для одномитохондрийной визуализации с объективом 63x. - Записывайте изображения с различными размерами отверстий. На основе этих изображений выберите наибольший размер точечного отверстия, который дает приемлемое разрешение интересующей структуры.
ПРИМЕЧАНИЕ: Как правило, 3-7 воздушных блоков работают хорошо. - Записывайте изображения с различной интенсивностью лазера.
- Отрегулируйте коэффициент усиления и порог детектора соответствующим образом. На основе этих изображений выберите самую низкую интенсивность лазера, которая дает приемлемую интенсивность сигнала и отношение сигнала к фону.
- Чтобы определить отношение сигнала к фону, измерьте интенсивность сигнала в интересующей области (ROI), которая содержит клетки или митохондрии (ROI1), и в ROI без клеток или митохондрий (ROI2). Затем разделите интенсивность ROI1 на интенсивность ROI2.
ПРИМЕЧАНИЕ: Стремитесь к соотношению сигнал/фон >3 и интенсивности сигнала отдельных ROI 200-1000 для возбуждения 405 нм при мощности лазера 1-3% и интенсивности отдельных ROI 300-1 500 для возбуждения 488 нм с мощностью лазера 1%.
- Чтобы определить отношение сигнала к фону, измерьте интенсивность сигнала в интересующей области (ROI), которая содержит клетки или митохондрии (ROI1), и в ROI без клеток или митохондрий (ROI2). Затем разделите интенсивность ROI1 на интенсивность ROI2.
- Отрегулируйте коэффициент усиления и порог детектора соответствующим образом. На основе этих изображений выберите самую низкую интенсивность лазера, которая дает приемлемую интенсивность сигнала и отношение сигнала к фону.
- Записывайте изображения с различной скоростью сканирования и средним количеством кадров. Запишите 4-5 изображений для каждой комбинации настроек. На основе этих серий изображений выберите самые высокие скорости и самые низкие средние настройки, которые обеспечивают приемлемый шум изображения и изменчивость изображения к изображению.
ПРИМЕЧАНИЕ: Скорость сканирования 600 Гц и 1-2 кадра для усреднения работают хорошо в большинстве случаев. - Используя новый облицовочный лист, запишите покадровую серию с оптимизированными настройками.
ПРИМЕЧАНИЕ: Продолжительность и интервал изображения серии должны напоминать интервал запланированных экспериментов. - В конце покадровой серии добавьте в камеру записи 1 мл 2-кратного раствора DA. Изображение для дополнительных 2 мин.
- Аспирируйте буфер визуализации с помощью перистальтического насоса или ручной пипетки. Добавьте 1 мл 1x раствора DTT. Изображение за дополнительные 5 мин.
- Проанализируйте покадровый эксперимент (см. раздел 5).
- Убедитесь, что ни один из двух каналов не подвергается чрезмерному или недостаточному воздействию во время обработки DA и DTT с оптимизированными настройками.
- Убедитесь, что ни один из двух каналов не показывает значительного обесцвечивания во время покадровой записи; стремитесь к потере интенсивности между первым и последним изображениями <2%.
- Убедитесь, что соотношение 405:488 не изменяется значительно во время визуализации.
- Повторяйте всю процедуру итеративным образом, используя несколько обложек, пока не будут определены параметры, которые последовательно обеспечивают приемлемые результаты.
4. Оценка базального окислительно-восстановительного статуса
- Запустите микроскоп и загрузите оптимизированные настройки из раздела 3.
- Установите среднее значение кадра равным 3-5.
- Установите крышку с клетками в камеру визуализации, добавьте 1 мл буфера визуализации и поместите камеру на микроскоп.
- Используйте окуляр и пропускаемый свет, чтобы сфокусировать клетки.
ПРИМЕЧАНИЕ: Не используйте эпифлуоресцентный свет для обнаружения и фокусировки клеток. Даже при малой мощности это негативно скажется на клетках. - Переключитесь в режим сканирования и используйте канал 488 нм в режиме реального времени , чтобы сфокусировать и найти ячейки для визуализации.
- Используйте многоточечную функцию для выбора 3-5 полей зрения на обложке.
- Запишите базовое изображение.
- Добавьте в камеру 1 мл 2-кратного раствора DA.
- Через 1, 2 и 3 минуты используйте интерактивный просмотр для подтверждения/настройки фокуса, а затем запишите изображение.
ПРИМЕЧАНИЕ: Клетки обычно полностью окисляются через 2 мин. - Замените буфер в камере визуализации 1 мл 1 раствора DTT.
- Через 3 и 5 минут используйте режим интерактивного просмотра для подтверждения/настройки фокуса, а затем запишите изображение.
ПРИМЕЧАНИЕ: Клетки обычно полностью уменьшаются через 4-5 мин.
5. Живая визуализация острых методов лечения
ПРИМЕЧАНИЕ: Протокол ниже описывает визуализацию митохондриального окислительно-восстановительного ответа на лечение NMDA. Интервалы изображения и продолжительность эксперимента, возможно, потребуется скорректировать для других методов лечения.
- Запустите микроскоп и загрузите оптимизированные настройки из раздела 3.
- Установите интервал интервала торасовой интервал на 30 с и продолжительность на 25 мин.
- Установите крышку с клетками в камеру визуализации, добавьте 1 мл буфера визуализации и поместите камеру на микроскоп.
ПРИМЕЧАНИЕ: Чтобы избежать дрейфа теплового фокуса, оставьте клетки на ступени микроскопа на 10-15 минут перед началом покадровой визуализации. - Используйте окуляр и пропускаемый свет, чтобы сфокусировать клетки.
ПРИМЕЧАНИЕ: Не используйте эпифлуоресцентный свет для обнаружения и фокусировки клеток. Даже при малой мощности это негативно скажется на клетках. - Переключитесь в режим сканирования и используйте канал 488 нм в режиме реального времени , чтобы сфокусировать и найти ячейки для визуализации.
- Необязательно: чтобы увеличить количество записываемых ячеек за прогон, используйте многоточечную функцию для отображения 2-3 полей зрения на обложку.
- Начните покадровое получение и запишите 5 изображений в качестве базовой записи за 2 минуты.
- Добавьте в камеру 500 мкл 3-кратного раствора NMDA (конечная концентрация 30 мкМ) и запишите дополнительные 20 изображений в качестве 10-минутного NMDA-ответа.
ПРИМЕЧАНИЕ: Нейроны очень чувствительны к изменениям осмолярности. Поэтому убедитесь, что вы минимизируете испарение буфера изображения. Для более длительных процедур камера визуализации должна быть покрыта крышкой. - Добавьте 500 мкл 4-кратного раствора DA в камеру и запишите еще 6 изображений (максимальная калибровка 3 мин).
- Аспирируйте буфер из камеры визуализации и замените его 1 мл 1x раствора DTT. Запишите еще 10 изображений (минимальная калибровка 5 минут).
- Завершите запись и сохраните серию изображений.
6. Анализ данных
- Импорт данных и предварительная обработка изображений в FIJI
- Используйте средство импорта биоформатов , чтобы открыть группу изображений из шага 4 или файл изображения из шага 5. Нажмите на плагины | Биоформаты | Импортер биоформатов. В диалоговом окне используйте стек представлений с: Hyperstack, установите цветовой режим: по умолчанию, выберите Автомасштабирование и не разделяйте отдельные окна.
ПРИМЕЧАНИЕ: Автомасштабирование оптимизирует отображение данных на экране компьютера. Он не изменяет интенсивность пикселей. - Если были открыты отдельные изображения из шага 4, нажмите на Image | Стеки | Инструменты | Объединяйте , чтобы объединить их в стек с одним изображением.
- Если во время серии изображений есть XY-дрейф, нажмите на Плагины | StackReg для регистрации изображений. В диалоговом окне выберите Твердое тело или Перевод.
- Измените формат изображения на 32 бита, нажав на Image | Тип | 32-бит.
- Разделите цветовые каналы на отдельные окна, нажав на Image | Цвет | Разделенные каналы.
- Выберите канал 1 (405 нм) и отрегулируйте пороговое значение, чтобы выбрать митохондрии для анализа, нажав на Image | Отрегулируйте | Порог. В диалоговом окне выберите Гистограмма по умолчанию, Красный, Темный фон и Стек и подождите, пока выбранные пикселы не отобразятся красным цветом. Нажмите кнопку Применить. Выберите Установить для фоновых пикселей значение NaN и Обработать все изображения.
ПРИМЕЧАНИЕ: Во избежание потенциальной смещения наблюдателя следует использовать автоматизированное определение пороговых значений. FIJI предлагает несколько автоматизированных методов (таких как Default, Huang, Intermodes, Otsu), которые можно выбрать из раскрывающегося меню в диалоговом окне порога. Как правило, метод Default дает хороший результат. Рекомендуется сравнить несколько методов во время первого анализа, чтобы найти лучший метод порогового значения для данного набора изображений. После того, как метод был выбран, его необходимо применить ко всем изображениям. - Повторите шаг 6.1.6 для канала 2 (488 нм).
- Создайте изображение соотношения для визуализации соотношения 405:488 нм, щелкнув Процесс | Калькулятор изображений. В диалоговом окне выберите Изображение 1: канал 1, Операция: Разделить, Изображение 2: канал 2, Создать новое окно, Обработать все изображения.
- Измените таблицу подстановки изображения с соотношением на псевдоцвет. Например, чтобы перейти на Fire, нажмите на Image | таблицы подстановки | Огонь.
- Используйте средство импорта биоформатов , чтобы открыть группу изображений из шага 4 или файл изображения из шага 5. Нажмите на плагины | Биоформаты | Импортер биоформатов. В диалоговом окне используйте стек представлений с: Hyperstack, установите цветовой режим: по умолчанию, выберите Автомасштабирование и не разделяйте отдельные окна.
- Анализ изображений
- На изображении соотношения нарисуйте ROI вокруг отдельных клеток или митохондрий. После рисования каждого ROI добавьте его в менеджер ROI. Анализ | Инструменты | | менеджера по окупаемости инвестиций Добавьте. (сочетание клавиш: 'T') Выберите Показать все.
ПРИМЕЧАНИЕ: Поскольку на шагах 6.1.6 и 6.1.7 для фоновых пикселей установлено значение "не число" (NaN), они не повлияют на результат измерения. Поэтому допустимо включать некоторые фоновые пиксели в ROI. - Измерьте соотношение 405:488 отдельных ячеек, щелкнув менеджер ROI | ctrl + A, чтобы выбрать все ROI | Другие | Мультимера. В диалоговом окне выберите Измерить все фрагменты и Одна строка на фрагмент.
- Экспортируйте измерения в программное обеспечение для работы с электронными таблицами.
- Выберите изображение 405 нм. Измерьте интенсивность всех ROI, как показано на этапе 6.2.2. используя окупаемость инвестиций, хранящуюся в диспетчере ROI.
- Экспортируйте измерения в программное обеспечение для работы с электронными таблицами.
- Выберите изображение 488 нм. Измерьте интенсивность всех ROI, как показано на этапе 6.2.2. используя окупаемость инвестиций, хранящуюся в диспетчере ROI.
- Экспортируйте измерения в программное обеспечение для работы с электронными таблицами.
- Сохраните РЕНТАБЕЛЬНОСТЬ инвестиций для дальнейшего использования, щелкнув менеджер ROI | ctrl + A, чтобы выбрать все ROI | Другие | Сохранить.
- Рекомендуется: Генерация графиков интенсивности и времени трасс 405 и 488 нм. Убедитесь, что ни в одном из каналов нет заметного отбеливания (интенсивность сигнала в конце серии изображений должна быть ≥98% первого изображения) и что два следа движутся в противоположных направлениях во время откликов датчика (например, след 405 нм должен увеличиваться во время окисления, в то время как след 488 нм должен уменьшаться).
- На изображении соотношения нарисуйте ROI вокруг отдельных клеток или митохондрий. После рисования каждого ROI добавьте его в менеджер ROI. Анализ | Инструменты | | менеджера по окупаемости инвестиций Добавьте. (сочетание клавиш: 'T') Выберите Показать все.
- Нормализация данных
- Для каждого ROI из изображения соотношения определите максимальное значение во время лечения DA (Rmax) и минимальное значение во время лечения DTT (Rmin).
- Рассчитайте нормализованное соотношение следующим образом:
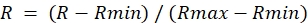
ПРИМЕЧАНИЕ: При этом максимальное соотношение будет установлено равным 1,0, а минимальное соотношение равным 0.
- Анализ морфологии митохондрий
- Чтобы получить измерения морфологии митохондрий параллельно интенсивности roGFP на шаге 6.2.6, перейдите к разделу Анализ | Задайте измерения и проверьте Дескрипторы фигур и Подпишите эллипс.
ПРИМЕЧАНИЕ: Помимо средней интенсивности, измерения в окне результатов будут включать длину большой оси (Major), длину малой оси (Minor), соотношение сторон (AR; большая ось, разделенная на минорную ось; круглые митохондрии имеют AR ~ 1, удлиненные митохондрии имеют большую AR), а также измерения окружности (Circ.) и округлости (Round).
- Чтобы получить измерения морфологии митохондрий параллельно интенсивности roGFP на шаге 6.2.6, перейдите к разделу Анализ | Задайте измерения и проверьте Дескрипторы фигур и Подпишите эллипс.
Результаты
Количественная оценка различий в стационарном окислительно-восстановительном состоянии митохондрий после отмены фактора роста
Чтобы продемонстрировать количественную оценку стационарных различий в митохондриальном окислительно-восстановительном состоянии, первичные ...
Обсуждение
Количественные и динамические измерения окислительно-восстановительного состояния митохондрий дают важную информацию о митохондриальной и клеточной физиологии. Доступно несколько фторогенных химических зондов, которые обнаруживают активные формы кислорода, «окислительно-восстан...
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Эта работа была поддержана Deutsche Forschungsgemeinschaft (BA 3679/5-1; ДЛЯ 2289: БА 3679/4-2). A.K. поддерживается стипендией ERASMUS+. Мы благодарим Айрис Бюнцли-Эрет, Риту Рознер и Андреа Шликсупп за подготовку первичных нейронов. Мы благодарим д-ра Тобиаса Дика за предоставление pLPCX-mito-Grx1-roGFP2. Эксперименты, показанные на рисунке 4 , были проведены в Центре визуализации Nikon Гейдельбергского университета. Рисунок 2 был подготовлен вместе с BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| reagents | |||
| Calcium chloride (CaCl2·2H2O) | Sigma-Aldrich | C3306 | |
| Diamide (DA) | Sigma-Aldrich | D3648 | |
| Dithiothreitol (DTT) | Carl Roth GmbH | 6908.1 | |
| Glucose (2.5 M stock solution) | Sigma-Aldrich | G8769 | |
| Glucose | Sigma-Aldrich | G7528 | |
| Glycine | neoFroxx GmbH | LC-4522.2 | |
| HEPES (1 M stock solution) | Sigma-Aldrich | 15630-080 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Magnesium chloride (MgCl2·6H2O) | Sigma-Aldrich | 442611-M | |
| N-methyl-D-aspartate (NMDA) | Sigma-Aldrich | M3262 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P3911 | |
| Sodium chloride (NaCl) | neoFroxx GmbH | LC-5932.1 | |
| Sodium pyruvate (0.1 M stock solution) | Sigma-Aldrich | S8636 | |
| Sodium pyruvate | Sigma-Aldrich | P8574 | |
| Sucrose | Carl Roth GmbH | 4621.1 | |
| Tetramethylrhodamine ethyl ester perchlorate (TMRE) | Sigma-Aldrich | 87917 | |
| equipment | |||
| imaging chamber | Life Imaging Services (Basel, Switzerland) | 10920 | Ludin Chamber Type 3 for Ø12mm coverslips |
| laser scanning confocal microscope, microscope | Leica | DMI6000 | |
| laser scanning confocal microscope, scanning unit | Leica | SP8 | |
| peristaltic pump | VWR | PP1080 181-4001 | |
| spinning disc confocal microscope, camera | Hamamatsu | C9100-02 EMCCD | |
| spinning disc confocal microscope, incubationsystem | TokaiHit | INU-ZILCF-F1 | |
| spinning disc confocal microscope, microscope | Nikon | Ti microscope | |
| spinning disc confocal microscope, scanning unit | Yokagawa | CSU-X1 | |
| software | |||
| FIJI | https://fiji.sc | ||
| StackReg plugin | https://github.com/fiji-BIG/StackReg/blob/master/src/main/java/StackReg_.java | ||
| TurboReg plugin | https://github.com/fiji-BIG/TurboReg/blob/master/src/main/java/TurboReg_.java |
Ссылки
- Roede, J. R., Go, Y. M., Jones, D. P. Redox equivalents and mitochondrial bioenergetics. Methods in Molecular Biology. 810, 249-280 (2012).
- Turrens, J. F. Mitochondrial formation of reactive oxygen species. Journal of Physiology. 552, 335-344 (2003).
- Lin, M. T., Beal, M. F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 443 (7113), 787-795 (2006).
- Manfredi, G., Beal, M. F. The role of mitochondria in the pathogenesis of neurodegenerative diseases. Brain Pathology. 10 (3), 462-472 (2000).
- Mari, M., Morales, A., Colell, A., Garcia-Ruiz, C., Fernandez-Checa, J. C. Mitochondrial glutathione, a key survival antioxidant. Antioxidants & Redox Signaling. 11 (11), 2685-2700 (2009).
- Murphy, M. P. Mitochondrial thiols in antioxidant protection and redox signaling: distinct roles for glutathionylation and other thiol modifications. Antioxidants & Redox Signaling. 16 (6), 476-495 (2012).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Hanson, G. T., et al. Investigating mitochondrial redox potential with redox-sensitive green fluorescent protein indicators. Journal of Biological Chemistry. 279 (13), 13044-13053 (2004).
- Gutscher, M., et al. Real-time imaging of the intracellular glutathione redox potential. Nature Methods. 5 (6), 553-559 (2008).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring E(GSH) and H2O2 with roGFP2-based redox probes. Free Radical Biology & Medicine. 51 (11), 1943-1951 (2011).
- Marwick, K. F. M., Hardingham, G. E. Transfection in primary cultured neuronal cells. Methods in Molecular Biology. 1677, 137-144 (2017).
- Kohrmann, M., et al. convenient, and effective method to transiently transfect primary hippocampal neurons. Journal of Neuroscience Research. 58 (6), 831-835 (1999).
- Depp, C., Bas-Orth, C., Schroeder, L., Hellwig, A., Bading, H. Synaptic activity protects neurons against calcium-mediated oxidation and contraction of mitochondria during excitotoxicity. Antioxidants & Redox Signaling. 29 (12), 1109-1124 (2018).
- Hauck, B., Chen, L., Xiao, W. Generation and characterization of chimeric recombinant AAV vectors. Molecular Therapy. 7 (3), 419-425 (2003).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Zhang, S. J., et al. Nuclear calcium signaling controls expression of a large gene pool: identification of a gene program for acquired neuroprotection induced by synaptic activity. PLoS Genetics. 5 (8), 1000604 (2009).
- Winterbourn, C. C. The challenges of using fluorescent probes to detect and quantify specific reactive oxygen species in living cells. Biochimica et Biophysica Acta. 1840 (2), 730-738 (2014).
- Sies, H. Oxidative stress: a concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Lukyanov, K. A., Belousov, V. V. Genetically encoded fluorescent redox sensors. Biochimica et Biophysica Acta. 1840 (2), 745-756 (2014).
- Nietzel, T., et al. Redox-mediated kick-start of mitochondrial energy metabolism drives resource-efficient seed germination. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 741-751 (2020).
- Albrecht, S. C., et al. Redesign of genetically encoded biosensors for monitoring mitochondrial redox status in a broad range of model eukaryotes. Journal of Biomolecular Screening. 19 (3), 379-386 (2014).
- Albrecht, S. C., Barata, A. G., Grosshans, J., Teleman, A. A., Dick, T. P. In vivo mapping of hydrogen peroxide and oxidized glutathione reveals chemical and regional specificity of redox homeostasis. Cell Metabolism. 14 (6), 819-829 (2011).
- Breckwoldt, M. O., et al. Multiparametric optical analysis of mitochondrial redox signals during neuronal physiology and pathology in vivo. Nature Medicine. 20 (5), 555-560 (2014).
- Ricke, K. M., et al. Mitochondrial dysfunction combined with high calcium load leads to impaired antioxidant defense underlying the selective loss of nigral dopaminergic neurons. Journal of Neuroscience. 40 (9), 1975-1986 (2020).
- Bjornberg, O., Ostergaard, H., Winther, J. R. Mechanistic insight provided by glutaredoxin within a fusion to redox-sensitive yellow fluorescent protein. Biochemistry. 45 (7), 2362-2371 (2006).
- Shokhina, A. G., et al. Red fluorescent redox-sensitive biosensor Grx1-roCherry. Redox Biology. 21, 101071 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены