A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جمع وتوسيع وتمايز نماذج الخلايا الظهارية الأنفية البشرية الأولية لتحديد تردد ضربات الأهداب
In This Article
Summary
يصف هذا البروتوكول جمع الخلايا الظهارية الأنفية وتوسيعها وتمايزها إلى نماذج الخلايا الظهارية لمجرى الهواء العضوي والقياس الكمي لتردد ضربات الأهداب عبر تصوير الخلايا الحية والبرامج النصية المصممة خصيصا.
Abstract
تم إنشاء قياسات وظيفة الأهداب (تردد النبض ، النمط) كأدوات تشخيصية لأمراض الجهاز التنفسي مثل خلل الحركة الهدبي الأولي. ومع ذلك ، فإن التطبيق الأوسع لهذه التقنيات محدود بسبب القابلية الشديدة للوظيفة الهدبية للتغيرات في العوامل البيئية مثل درجة الحرارة والرطوبة ودرجة الحموضة. في مجرى الهواء للمرضى الذين يعانون من التليف الكيسي (CF) ، يعيق تراكم المخاط ضرب الأهداب. تم التحقيق في وظيفة الأهداب في نماذج خلايا مجرى الهواء الأولية كمؤشر لنشاط قناة منظم التوصيل عبر الغشاء CF (CFTR). ومع ذلك ، فقد تم العثور على تباين كبير من مريض إلى آخر في تواتر ضرب الأهداب استجابة للأدوية المعدلة CFTR ، حتى بالنسبة للمرضى الذين يعانون من نفس طفرات CFTR . علاوة على ذلك ، فإن تأثير إفراز الكلوريد المختل وظيفيا الذي ينظمه CFTR على الوظيفة الهدبية غير مفهوم بشكل جيد. لا يوجد حاليا بروتوكول شامل يوضح تحضير عينة من نماذج مجرى الهواء في المختبر ، والحصول على الصور ، وتحليل تردد ضربات الأهداب (CBF). ومن شأن ظروف الاستزراع الموحدة والحصول على الصور التي يتم إجراؤها في حالة خاضعة للرقابة البيئية أن تمكن من إجراء تقدير كمي متسق وقابل للتكرار ل CBF بين الأفراد واستجابة للعقاقير المعدلة CFTR. يصف هذا البروتوكول القياس الكمي ل CBF في ثلاثة أنظمة مختلفة لنماذج الخلايا الظهارية في مجرى الهواء: 1) الصفائح الظهارية الأصلية ، 2) نماذج واجهة الهواء السائل المصورة على إدخالات دعم قابلة للاختراق ، و 3) عضويات ثلاثية الأبعاد مدمجة خارج الخلية. يتكاثر الأخيران في فسيولوجيا الرئة في الجسم الحي ، مع ضرب الأهداب وإنتاج المخاط. يتم التقاط الوظيفة الهدبية باستخدام كاميرا فيديو عالية السرعة في غرفة يتم التحكم فيها بالبيئة. يتم استخدام البرامج النصية المصممة خصيصا لتحليل CBF. من المتصور أن تكون ترجمة قياسات CBF إلى العيادة أداة سريرية مهمة للتنبؤ بالاستجابة للأدوية المعدلة CFTR على أساس كل مريض.
Introduction
تم إنشاء قياسات تردد ضربات الأهداب (CBF) ونمطها كأدوات تشخيصية لأمراض الجهاز التنفسي مثل خلل الحركة الهدبي الأولي (PCD)1. في التليف الكيسي (CF) ، يؤدي خلل في قناة كلوريد منظم التوصيل عبر الغشاء CF (CFTR) إلى جفاف سائل سطح مجرى الهواء وضعف إزالة الغشاء المخاطيالهدبي 2. تم التحقيق في الوظيفة الهدبية في المختبر في نماذج خلايا مجرى الهواء الأولية كمؤشر لنشاط قناة CFTR3. ومع ذلك ، يوجد تباين كبير من مريض إلى آخر في CBF استجابة للأدوية المعدلة CFTR ، حتى بالنسبة للمرضى الذين يعانون من نفس طفرات CFTR 3. علاوة على ذلك ، فإن تأثير إفراز الكلوريد المختل وظيفيا الذي ينظمه CFTR على الوظيفة الهدبية غير مفهوم بشكل جيد. لا يوجد حاليا بروتوكول شامل يوضح تحضير عينة من نماذج مجرى الهواء في المختبر ، والحصول على الصور ، وتحليل CBF.
تستخدم الأوراق الظهارية الأنفية المعزولة من فرش الغشاء المخاطي للأنف مباشرة لقياس الوظيفة الهدبية لتشخيص PCD4. ومع ذلك ، في حين لا توجد سيطرة على حجم أو جودة الأوراق الظهارية الأنفية التي تم الحصول عليها ، يختلف CBF اعتمادا على ما إذا كان يتم قياسه على خلايا مفردة أو صفائح خلية وعلى حواف مهدبة للصفائح الظهارية التي تعطلت أو لم تتعطل5. على هذا النحو ، قد يؤثر خلل الحركة الثانوي الناجم عن تلف الخلايا أثناء جمع تنظيف الغشاء المخاطي للأنف على CBF. تؤدي زراعة الخلايا الأولية للخلايا الظهارية الأنفية وتمايزها في واجهة الهواء السائل (ALI) أو في مصفوفة الغشاء القاعدي ثلاثي الأبعاد إلى عضويات ظهارية مجرى الهواء الهدبية إلى ظهور أهداب خالية من خلل الحركة الثانوي4،6،7،8. تم اعتبار الخلايا الظهارية في مجرى الهواء المتمايزة في ALI (من الآن فصاعدا تسمى نماذج ALI) مساعدة تشخيصية ثانوية مهمة تكرر أنماط النبض الهدبية وتكرار تنظيف الغشاء المخاطي للأنف خارج الجسم الحي 6 وتمكن من تحليل البنية الفائقة الهدبية ونمط النبض وتردد النبض مع الاحتفاظ بالعيوب الخاصة بالمريض9 . ومع ذلك ، توجد تناقضات في المنهجيات المستخدمة لإنشاء نماذج الخلايا المتمايزة المخاطية الكاذبة الهدبية. يمكن أن تؤدي بروتوكولات التوسع أو التمايز المختلفة للثقافة إلى أنماط ظاهرية ظهارية متميزة (مهدبة أو إفرازية)10 وتؤدي إلى اختلافات كبيرة في CBF11. تم قياس CBF في الفرشاة الظهارية الأنفية 4،6،12،13،14،15،16 ، والمواد العضوية الظهارية في مجرى الهواء 14،17،18 ونماذج ALI3،4،6،13،19،20 ، 21. ومع ذلك ، من بين هذه البروتوكولات ، هناك اختلافات كبيرة ، وغالبا ما لا يتم التحكم في العديد من المعلمات. على سبيل المثال ، في بعض الدراسات ، يتم تصوير CBF في الموقع بينما تظل خلايا نموذج ALI على ملحق الدعم القابل للاختراق3،19،20،21 ، بينما يقوم البعض الآخر بكشط الخلايا من إدراج الدعم القابل للاختراق وتصويرها معلقة في الوسائط4،6،13.
علاوة على ذلك ، فإن التطبيق الأوسع للتقنيات التي تقيس الوظيفة الهدبية محدود بسبب القابلية الشديدة للوظيفة الهدبية للتغيرات في العوامل البيئية. تؤثر العوامل البيئية مثل درجة الحرارة22 والرطوبة 23,24 ودرجة الحموضة 25,26 على الوظيفة الهدبية ويجب تنظيمها لتحديد CBF بدقة. تمت مراجعة المعلمات الفسيولوجية المختلفة المستخدمة في المختبرات المختلفة وكيفية تأثيرها على CBF سابقا27.
تم الإبلاغ عن تقنيات ونهج التصوير المختلفة لقياسات CBF في الأدبيات. لتشخيص PCD ، يتم استخدام الفحص المجهري بالفيديو لقياس الوظيفة الهدبية28,29. في الآونة الأخيرة ، تم استخدام خوارزمية تحليل الفيديو القائمة على الفحص المجهري الديناميكي التفاضلي لتحديد كل من تنسيق CBF والأهداب في نماذج ALI للخلايا الظهارية في مجرى الهواء 3,30. تتيح هذه الطريقة توصيف الضرب الهدبي في الخلايا الظهارية في مجرى الهواء بطريقة سريعة ومؤتمتة بالكامل ، دون الحاجة إلى تقسيم أو تحديد المناطق. قد تضيف طرق مختلفة لتصوير وقياس CBF إلى الاختلافات المبلغ عنها في CBF في الأدبيات (الملف التكميلي 1).
ومن شأن بروتوكول من الاستزراع إلى القياس الكمي لتبسيط الأساليب القائمة، وتوحيد ظروف الاستزراع، والحصول على الصور، الذي يتم في ظروف صارمة خاضعة للرقابة البيئية، أن يمكن من إجراء تقدير كمي متسق وقابل للتكرار لنموذج بناء القدرات داخل الأفراد وفيما بينهم.
يوفر هذا البروتوكول وصفا كاملا لمجموعة الخلايا الظهارية ، وظروف ثقافة التمدد والتمايز ، والقياس الكمي ل CBF في ثلاثة أنظمة مختلفة لنموذج الخلايا الظهارية في مجرى الهواء من أصل أنفي: 1) صفائح ظهارية أصلية ، 2) نماذج ALI مصورة على إدخالات دعم قابلة للاختراق و 3) عضويات ثلاثية الأبعاد مدمجة خارج الخلية (ECM) (الشكل 1 ). تستخدم الخلايا الظهارية الأنفية التي تم الحصول عليها من فرش القرينات الأنفية السفلية كممثلين لظهارة مجرى الهواء لأنها بديل فعال للخلايا الظهارية القصبية31 أثناء التغلب على الإجراء الغازي المرتبط بجمع فرش الشعب الهوائية. تستخدم طريقة خلية إعادة البرمجة الشرطية (CRC) لتوسيع الخلايا الظهارية الأولية لمجرى الهواء لإنشاء نماذج ALI والمواد العضوية ثلاثية الأبعاد. تحدث إعادة البرمجة الشرطية للخلايا الظهارية في مجرى الهواء إلى حالة تشبه الخلايا الجذعية عن طريق الزراعة المشتركة مع نظام الخلايا المغذية للخلايا الليفية المحتجزة للنمو ومثبط كيناز (ROCK) المرتبط ب Rho32. الأهم من ذلك ، أن طريقة CRC تزيد من تضاعف عدد السكان في الخلايا الظهارية في مجرى الهواء مع الاحتفاظ بإمكانية التمايز الخاصة بالأنسجة33,34. في جميع نماذج الخلايا الظهارية في مجرى الهواء ، يتم التقاط الوظيفة الهدبية في غرفة يتم التحكم في درجة حرارتها باستخدام كاميرا فيديو عالية السرعة مع إعدادات موحدة للحصول على الصور. يتم استخدام البرامج النصية المصممة خصيصا للقياس الكمي ل CBF.

الشكل 1: رسم تخطيطي لسير العمل. بعد تنظيف القرينات الأنفية السفلية للمشاركين ، يتم استخدام الخلايا الظهارية في مجرى الهواء بإحدى طريقتين. إما أن يتم عزل الصفائح الظهارية في مجرى الهواء ، ويتم تصوير تردد نبض الأهداب على الفور ، أو يتم توسيع الخلايا الظهارية في مجرى الهواء عبر طريقة خلية إعادة البرمجة الشرطية. يتم تمييز الخلايا الظهارية لمجرى الهواء الموسع CRC لإنشاء خلايا ظهارية في مجرى الهواء في واجهة الهواء السائل أو الثقافات العضوية الظهارية في مجرى الهواء. يتم الحصول على تصوير تردد النبض الهدبي باستخدام مجهر تصوير الخلايا الحية مع غرفة بيئية للتدفئة والرطوبة وكاميرا علمية بمعدل إطارات سريع (>100 هرتز). يتم إجراء تحليل البيانات باستخدام البرامج النصية المصممة خصيصا. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
ووردت الموافقة على الدراسة من مجلس استعراض أخلاقيات شبكة مستشفيات الأطفال في سيدني (HREC/16/SCHN/120). تم الحصول على موافقة خطية من جميع المشاركين (أو أولياء أمور المشاركين) قبل جمع العينات البيولوجية.
1. الاستعدادات لإنشاء نماذج الخلايا الظهارية في مجرى الهواء
- تحضير وسائط جمع الخلايا الأنفية من خلال الجمع بين 80٪ من وسط النسر المعدل من Dulbecco و 20٪ من مصل الأبقار الجنينية. تكملة مع 1 ميكرولتر / مل من البنسلين / الستربتومايسين. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى 3 أشهر.
- قم بتغطية القوارير أو إدخالات الدعم القابلة للنفاذ بمحلول الكولاجين على أساس كل حاجة باتباع الخطوات 1.2.1-1.2.4. لا تقم بتخزين الأوعية المطلية بالكولاجين على المدى الطويل.
- قم بعمل تخفيف 1: 100 من محلول الكولاجين من النوع الأول (3 مجم / مل من المرق) مع محلول ملحي مخزن بالفوسفات (PBS) إلى تركيز نهائي يبلغ 0.03 مجم / مل. تخلط جيدا.
- قم بتغطية قوارير زراعة الخلايا (القسم 4) ب 160 ميكرولتر / سم 2 (أي 4 مل لكل دورق T25) وإدخالات دعم قابلة للنفاذ (القسم 5) ب 455 ميكرولتر / سم2 (أي 150 ميكرولتر لكل 6.5 مم) من محلول الكولاجين المحضر.
- احتضان عند 37 درجة مئوية لمدة 2-24 ساعة.
- قم بإزالة محلول الكولاجين بواسطة ماصة أو شفاط فراغ قبل بذر الخلايا. لا تغسل الوعاء قبل بذر الخلايا.
- قم بإعداد وسائط خلية إعادة البرمجة الشرطية (CRC) من خلال دمج المكونات32 المدرجة في الجدول 1. قم بتعقيم الفلتر باستخدام نظام مرشح فراغ أعلى الزجاجة. يحفظ في درجة حرارة 4 درجة مئوية لمدة تصل إلى 2 أشهر.
- في يوم الاستخدام، يضاف عامل نمو البشرة البشري ومثبط ROCK والمضادات الحيوية كما هو موضح في الجدول 1.
| مكون | حجم |
| DMEM ، ارتفاع الجلوكوز | 156.7 مل |
| DMEM / F-12 ، HEPES | 313.3 مل |
| الهيدروكورتيزون | 55.6 ميكرولتر |
| إنسولين | 1.25 مل |
| سم الكوليرا | 21 ميكرولتر |
| الادنين | 1.2 مل |
| هاي بي بي اس | 25 مل |
| البنسلين ستربتومايسين | 5 مل |
| عامل نمو البشرة البشري | 1 ميكرولتر / مل |
| مثبطات الصخور | 1 ميكرولتر / مل |
| فطريات زون | 2 ميكرولتر / مل |
| توبراميسين | 2 ميكرولتر / مل |
| سيفتازيديم هيدرات | 4 ميكرولتر / مل |
| محلول جنتاميسين | 1 ميكرولتر / مل |
الجدول 1: مكونات 500 مل من وسائط خلايا إعادة البرمجة الشرطية
2. مجموعة من الفرشاة القرينية السفلية للأنف
ملاحظة: يتطلب هذا القسم من البروتوكول أنبوب تجميع (50 مل) مع وسائط جمع الخلايا الأنفية وفرش علم الخلايا والأنسجة ومعدات الحماية الشخصية المناسبة. تجنب تنظيف الأسنان بالفرشاة أثناء عدوى الجهاز التنفسي العلوي. هناك خطر صغير من النزيف ، والذي يزداد في حالة وجود التهاب. إذا كان الغرض من التنظيف بالفرشاة هو الحصول على صفائح ظهارية مجرى الهواء لقياسات CBF خارج الجسم الحي ، فيجب أن يحدث التنظيف بالفرشاة بعد 6 أسابيع على الأقل من أي عدوى في الجهاز التنفسي العلوي ؛ من الناحية المثالية ، أكثر من 10 أسابيع بعد الإصابة35.
- تحضير وسائط جمع الخلايا الأنفية (القسم 1) والحفاظ على الأنبوب على الثلج.
- صف الإجراء للمشارك بأنه غير مريح. اشرح أن الإحساس الكامل يشعر به في فتحة الأنف أثناء تنظيف الأسنان بالفرشاة ، على غرار القفز في المحيط / المسبح والماء المندفع إلى الممر الأنفي. انصح المشاركين بأن الإجراء سوف يحفز إنتاج الدموع كرد فعل.
- قم بتقييم الموضع المناسب للمشارك. ضع المشارك في وضع الاستلقاء إذا كانت أريكة الفحص متاحة لأن وضع الاستلقاء يمنع حركة رأس المشارك بعيدا عن الفرشاة أثناء الإجراء. بدلا من ذلك ، اجلس المشارك بجوار الحائط ، والذي يمكنه الضغط على رأسه للخلف.
- افحص الممر الأنفي. لاحظ انحراف الحاجز ، والأورام الحميدة ، وأي تشوهات تشريحية أخرى قد تؤثر على مرور الفرشاة في الممر الأنفي وتزيد من خطر النزيف.
- نظف الأنف من المخاط الزائد عن طريق مطالبة المشاركين بنفخ أنوفهم في منديل.
- اطلب من المشارك التنفس من خلال فمه. خذ فرشاة علم الخلايا في اليد المهيمنة. أثناء وضع الرقم الخامس على ذقن المشارك لتثبيت اليد ، أدخل فرشاة علم الخلايا في الممر الأنفي للمشارك (الشكل 2). أدخل الفرشاة عند ~ 45 درجة على وجه المشارك لتمر عبر الصماخ الأنفي.
- قم بتدوير الفرشاة في وضع مستقيم بحيث تكون عمودية على وجه المشارك. حرك الفرشاة برفق ولكن بحزم على الجدار الجانبي للأنف أسفل القرينات السفلية حتى تصبح في منتصف إلى الجزء الخلفي من القرينات السفلية.
ملاحظة: تجنب الإفراط في الإدراج. إذا شعرت بانخفاض مفاجئ في المقاومة ، فقد تم إدخال البلعوم الأنفي ، ويجب سحب الفرشاة حتى يشعر الإجرائي بالمقاومة مرة أخرى. - قم بتدوير الفرشاة 360 درجة حتى ثلاث مرات. قم بإزالة الفرشاة برفق في عكس مناورة الإدخال ، حتى لا يتم إزاحة الخلايا من الفرشاة.
- ضع الفرشاة في أنبوب التجميع المجهز بوسائط جمع الخلايا الأنفية. ضع أنبوب التجميع على الثلج.
- كرر تنظيف الأسنان بالفرشاة في فتحة الأنف الثانية إذا كان المشارك مقبولا / يلزم وجود عدد كبير من الخلايا (على سبيل المثال ، لبدء زراعة الخلايا).
ملاحظة: يمكن تنظيف نفس فتحة الأنف مرة أخرى إذا لم تكن هناك خلايا دم مرئية على الفرشاة ، مع ملاحظة أن خطر النزيف يزداد قليلا مع تنظيف الأسنان بالفرشاة مرة أخرى في نفس فتحة الأنف.
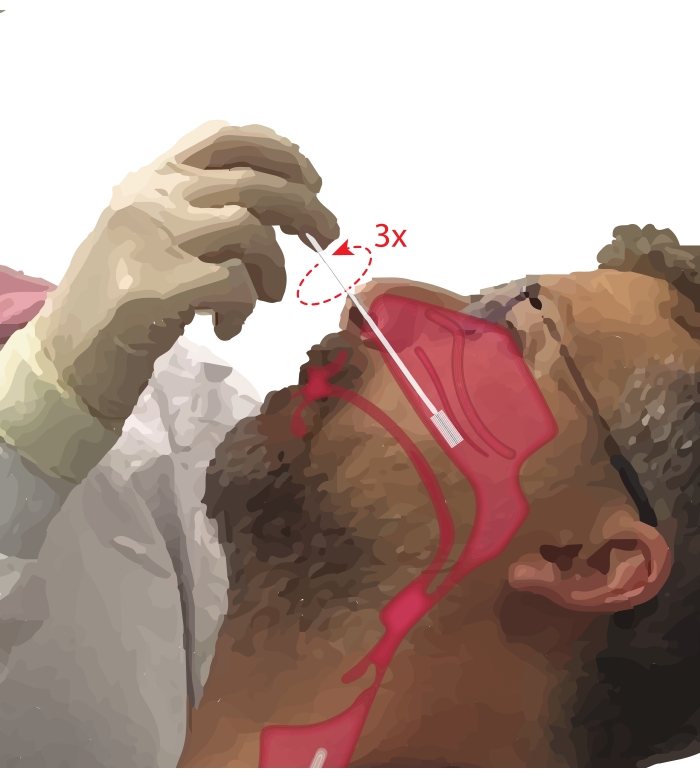
الشكل 2: مجموعة الخلايا الطلائية الأنفية. رسم توضيحي لموقع فرشاة علم الخلايا في الجزء الأوسط إلى الخلفي من القرينات السفلية. يتم الوصول إلى هذا الموضع عن طريق إدخال الفرشاة من خلال النوار ، وتدوير الفرشاة إلى زاوية 90 درجة على الوجه وتوجيه الفرشاة على طول الممر الأنفي أسفل القرينات السفلية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
3. إعداد صفائح مجرى الهواء الظهارية
ملاحظة: يتطلب هذا القسم من البروتوكول أنبوب تجميع (فرشاة (فرشات) علم الخلايا + 1 مل من وسائط جمع الخلايا الأنفية) (القسم 2) ولوحة مسطحة القاع 96 بئرا. في حالة جمع فرش القرينات الأنفية لغرض تصوير الأوراق الظهارية لمجرى الهواء ، استخدم فقط 1 مل من وسائط جمع الخلايا الأنفية الخالية من المضادات الحيوية ؛ خلاف ذلك ، سوف تكون الأوراق الظهارية مشتتة للغاية للتصوير.
- حرك أنبوب التجميع الذي يحتوي على فرشاة (فرشات) علم الخلايا برفق لإزاحة الصفائح الظهارية لمجرى الهواء من الفرشاة (الفرشاة).
- اجمع كل الوسائط والخلايا باستخدام ماصة P1000. قم بتوزيع 5-6 قطرات في بئر من صفيحة مسطحة القاع مكونة من 96 بئرا. كرر لحوالي سبعة آبار.
- انقل اللوحة إلى المجهر وفقا للخطوة 7.1.4 واتبع ما تبقى من القسم 7 لتصوير تردد ضربات الأهداب.
- صورة الصفائح الظهارية (الشكل 1) وليس الخلايا المفردة غير المرتبطة حيث ثبت أن الوظيفة الهدبية تختلف بين الصفائح الظهارية والخلايا المفردة غير المرتبطة5.
4. توسيع الخلايا الظهارية في مجرى الهواء وصيانتها
- ثقافة توسيع الخلايا الشرطية الظهارية لمجرى الهواء
ملاحظة: الوعاء المطلي بمحلول الكولاجين (القسم 1) ، خلايا التغذية الجنينية للفأر المشع (NIH-3T3) ، وسائط خلية إعادة البرمجة الشرطية (CRC) (القسم 1) ، فرشاة (فرشات) علم الخلايا في وسائط جمع الخلايا الأنفية (القسم 2).- خلايا تغذية مشععة في وعاء (أوعية) زراعة مغلفة بمحلول الكولاجين المحضرة بكثافة بذر تبلغ 8000 خلية / سم 2 على الأقل2 ساعة ولا تزيد عن 72 ساعة قبل الاستزراع المشترك مع الخلايا الظهارية في مجرى الهواء (انظر36 لزراعة الخلايا المغذية والتشعيع).
- انقل الخلايا المصقولة في أنبوب التجميع (فرشاة (فرشات) علم الخلايا + وسائط جمع الخلايا الأنفية) إلى الدوامة على الجليد. على سرعة منخفضة ، أنبوب دوامة 10 ثوان ، 10 ثوان (احتفظ بالجليد بينهما) لإزاحة الخلايا من الفرشاة (الفرشاة). قد تقلل الدوامة القوية من صلاحية الخلية. افحص الفرشاة (الفرشاة) للتحقق مما إذا كان المخاط لا يزال ملتصقا. إذا كان الأمر كذلك ، كرر الدوامة.
- انقل الأنبوب (الأنابيب) الموجودة على الثلج مرة أخرى إلى خزانة السلامة البيولوجية. استخدم ماصة مصلية لنقل الوسائط من أنبوب التجميع إلى أنبوب جديد (الأنبوب B) ، تاركا وراءه فرش علم الخلايا. أنبوب الطرد المركزي B عند 300 × جم لمدة 7 دقائق عند 4 درجات مئوية.
- قم بإزالة الأنبوب B من جهاز الطرد المركزي ، وتخلص من المادة الطافية. إذا كان المخاط مرئيا ، اغسل الحبيبات ب 5 مل أخرى من وسائط جمع الخلايا الأنفية وأجهزة الطرد المركزي مرة أخرى.
- أضف 1 مل من وسائط CRC لإعادة تعليق حبيبات الخلية في الأنبوب B. باستخدام ماصة مصلية سعة 5 مل ، مرر الخلايا عبر غربال خلية موضوعة فوق أنبوب سعة 50 مل (الأنبوب C) بحركة دائرية.
- كرر عدة مرات لتشكيل تعليق خلية واحدة. اجمع الوسائط المتبقية من أسفل الغربال وادمجها مع الوسائط. تجاهل غربال الخلية.
- باستخدام ماصة مصلية سعة 5 مل ، خذ 1 مل من الوسائط من الأنبوب C وانقلها إلى أنبوب طرد مركزي دقيق.
- خذ 10 ميكرولتر من معلق الخلية هذا وأضفه إلى أنبوب الطرد المركزي الدقيق المقتبس مسبقا مع 10 ميكرولتر تريبان أزرق. امزج جيدا واستخدم على الفور عداد خلايا آلي لتسجيل عدد الخلايا وصلاحيتها.
- بذر الخلايا الظهارية في مجرى الهواء في دورق T25 المصنف مسبقا بخلايا التغذية المشععة.
- صيانة الخلايا الظهارية في مجرى الهواء وتفككها
ملاحظة: يجب تسخين وسائط CRC إلى 37 درجة مئوية عن طريق وضعها في حمام مائي مختبري يتم التحكم في درجة حرارته أو جهاز حمام بالخرز قبل إضافته إلى الخلايا.- افحص الخلايا تحت مجهر زراعة الخلايا (4× عدسة موضوعية) بانتظام بحثا عن التعلق والتلوث والتشكل والتلاقي.
- قم بتغيير وسائط CRC كل يومين. عند ملاحظة الخلايا المعاد برمجتها (الشكل 1) وعدم وجود تلوث ، قم بتقليل أو سحب المضادات الحيوية.
- عندما تصل الخلايا إلى التقاء 90٪ ، استخدم طريقة التربسين المزدوجة32 لفصل الخلايا وإجراء عدد الخلايا كما هو موضح في الخطوة 4.1.8 (راجع الملف التكميلي 2 لتفكك الخلايا وتجميدها).
5. بذر وتمايز الخلايا الظهارية في مجرى الهواء وصيانة نماذج ALI المتمايزة
- بذر الخلايا الظهارية في مجرى الهواء إلى إدخالات دعم قابلة للاختراق
- انقل إدخالات الدعم القابلة للنفاذ المطلية بمحلول الكولاجين (القسم 1) من حاضنة CO2 إلى خزانة السلامة البيولوجية. نضح محلول الكولاجين وتخلص. أضف وسط تمدد 750 ميكرولتر (خال من المضادات الحيوية) إلى المقصورة القاعدية لإدخالات الدعم القابلة للاختراق.
- نقل الخلايا المنفصلة أو الخلايا المذابة على الجليد إلى خزانة السلامة البيولوجية. أضف حجم وسط التمدد اللازم لزرع 200000-250000 خلية في 150 ميكرولتر إلى المقصورة القمية لكل ملحق دعم قابل للاختراق.
- الحرص على عدم إنشاء فقاعات. تخلط جيدا للتأكد من أن الخلايا متجانسة وفي التعليق. أضف 150 ميكرولتر من تعليق الخلية إلى الجانب القمي لكل ملحق دعم قابل للاختراق.
- أعد تعليق الخلايا بعد بذر كل ثلاث إدخالات دعم قابلة للنفاذ للحفاظ على تعليق خلية متجانس.
- كل يومين حتى يتم تشكيل طبقة أحادية الخلية المتقاربة (عادة بحلول اليوم 4 بعد البذر) ، تخلص من الوسائط وأضف وسط تمدد جديد دافئ إلى درجة حرارة الغرفة (RT ، 15-25 درجة مئوية).
- تمايز الخلايا الظهارية في مجرى الهواء عند واجهة الهواء والسائل
- قم بتسخين وسائط ALI (خالية من المضادات الحيوية) إلى RT (15-25 درجة مئوية).
- قم بإزالة وسيط التمدد وقم بالتغيير إلى وسائط التمايز (ALI) على كل من المقصورات القمية والقاعدية.
- بعد 2 أيام من الثقافة في وسائل الإعلام ALI المغمورة ، استنشاق وتجاهل وسائل الإعلام.
- أضف 750 ميكرولتر من وسائط ALI إلى المقصورة القاعدية فقط لإنشاء واجهة هواء سائل.
ملاحظة: إذا بعد 1 أسبوع من الثقافة، والطبقة الأحادية ليست متقاربة ولا تزال الثقوب لوحظ، قد لا يكون للخلايا القدرة على التوسع في المناطق الفارغة، والنظر في التخلص من الخلايا الظهارية مجرى الهواء.
- الحفاظ على نموذج ALI المتمايز وإزالة المخاط
- قم بتغيير الوسائط القمية والقاعدية كل يومين حتى التمايز الكامل (اليوم 21-25 بعد إنشاء واجهة الهواء والسائل).
- مرة واحدة في الأسبوع ، اغسل المخاط من الجانب القمي باتباع الخطوات 5.3.3-5.3.4.
- برنامج تلفزيوني دافئ إلى RT (15-25 درجة مئوية).
- أضف 200 ميكرولتر من PBS إلى المقصورة القمية. احتضان في حاضنة CO2 لمدة 10 دقائق. استخدم جهاز شفط أو ماصة لإزالة PBS.
6. عضويات ظهارية ثلاثية الأبعاد لمجرى الهواء
- الاستعدادات للثقافة العضوية الظهارية مجرى الهواء
- ضع 24 صفيحة (صفائح) بئر في حاضنة CO2 للتدفئة إلى 37 درجة مئوية طوال الليل.
- قم بإذابة قارورة سعة 10 مل من ECM (جدول المواد) على الثلج وفقا لتعليمات الشركة المصنعة. قم بإعداد 500 ميكرولتر من القسمة (الاستخدام لمرة واحدة) لتقليل عدد دورات التجميد والذوبان.
ملاحظة: يوصى باستخدام ECM مع تركيز البروتين >10.5 مجم / مل للحصول على أفضل نتائج الثقافة. سيؤدي التركيز المنخفض إلى تسريع تفكك قبة ECM وزيادة حدوث الكائنات العضوية المواجهة للقمي. - استخدم مجموعة Airway Organoid Kit (جدول المواد) لإعداد وسائط البذر العضوي لمجرى الهواء (AOSM) ووسائط التمايز (AODM) وفقا لتعليمات الشركة المصنعة.
- تحضير الوسائط القاعدية العضوية في مجرى الهواء كما هو موضح في الجدول 2.
| مكون | حجم |
| DMEM / F-12 المتقدمة | 500 مل |
| هيبس | 5 مل |
| ألانيل-جلوتامين | 5 مل |
| البنسلين ستربتومايسين | 5 مل |
الجدول 2: مكونات الأوساط القاعدية العضوية في مجرى الهواء
- استخدم عدد الخلايا الظهارية الحية في مجرى الهواء المنفصلة في القسم 4.2 لحساب عدد الآبار التي يمكن بذرها بكثافة بذر تبلغ 10000 خلية (انظر الجدول 3).
- احسب الحجم الإجمالي ل ECM و AOSM اللازمين لإنشاء 1 × 50 ميكرولتر من قبة ECM بنسبة 90٪ (45 ميكرولتر من ECM و 5 ميكرولتر من AOSM) لكل بئر.
ملاحظة: كثافة البذر الموصى بها البالغة 10000 خلية لكل بئر هي للخلايا الظهارية الأنفية الموسعة CRC عند الممر 1. قد تتطلب خلايا المرور اللاحقة كثافة بذر أعلى لتحقيق تكوين نفس العدد من الكائنات العضوية.
| عدد الآبار | عدد الخلايا | عدد القباب | مجلد ماتريجل ECM | مجلد AOSM |
| 1 | 10000 خلية | 1 | 45 ميكرولتر × 1.1 | 5 ميكرولتر × 1.1 |
| 2 | 20000 خلية | 2 | 90 ميكرولتر × 1.1 | 10 ميكرولتر × 1.1 |
| 5 | 50000 خلية | 5 | 225 ميكرولتر × 1.1 | 25 ميكرولتر × 1.1 |
| ......... | ......... خلايا | ......... | .........μL x 1.1 | .........μL x 1.1 |
الجدول 3: حسابات بذر الخلايا الظهارية في مجرى الهواء في قباب ECM
- بذر الخلايا الظهارية في مجرى الهواء في قباب ECM
ملاحظة: احتفظ ب ECM على الجليد في جميع الأوقات وقم بتنفيذ جميع الخطوات التي تتضمن ECM على الجليد ، حيث سيبدأ ECM في التصلب عند درجات حرارة >10 درجة مئوية.- إعادة تعليق الخلايا الظهارية في مجرى الهواء المنفصلة في القسم 4.2 مع الحجم المحسوب 90٪ ECM كما في الجدول 3.
- أمسك الماصة بزاوية 90 درجة (عموديا) بالقرب من قاع البئر قدر الإمكان ، وزع 50 ميكرولتر (إلى المحطة الأولى لتجنب تكوين فقاعات) من تعليق خلية ECM إلى مركز البئر. تجنب لمس جدار البئر.
- احتضن اللوحة على حرارة 37 درجة مئوية لمدة 20 دقيقة حتى تصلب ECM. أثناء تصلب ECM ، قم بتسخين AOSM إلى RT (15-25 درجة مئوية) لمنعه من التسبب في إعادة تسييل وتفكك قبة ECM عند الإضافة.
- أضف 500 ميكرولتر من AOSM الدافئ إلى كل بئر عن طريق الاستغناء عن جدار البئر. لا تقم بسحب وسائط الماصة مباشرة على قبة ECM.
- تغيير وسائل الإعلام كل 2 أيام لمدة 4-7 أيام. لشفط الوسائط ، قم بإمالة اللوحة بزاوية 45 درجة وشفط من الحافة السفلية للبئر بعيدا عن قبة ECM.
- بعد 4-7 أيام ، ابدأ التمايز العضوي بإضافة 500 ميكرولتر من AODM (15-25 درجة مئوية) إلى كل بئر وتغيير الوسائط كل يومين لمدة 7 أيام.
- إعادة طلاء المواد العضوية الظهارية في مجرى الهواء في اليوم 7 من التمايز
ملاحظة: إعادة طلاء المواد العضوية الظهارية في مجرى الهواء أمر ضروري لأن حافة قباب ECM تتفكك تدريجيا خلال فترة الاستزراع لمدة 2 أسبوع. قد تضيع الكائنات العضوية الظهارية في مجرى الهواء على حافة القبة (تزيح في الوسائط) أو يكون لها اتجاه قمي مواجه للخارج عندما لا تكون مضمنة بالكامل في ECM. تعمل خطوة إعادة الطلاء أيضا على "تنظيف" قبة ECM عن طريق إزالة الخلايا / الحطام الذي لا يشكل عضويات بنجاح.- استنشاق وسائل الإعلام من كل بئر. أضف 500 ميكرولتر من الوسائط القاعدية العضوية في مجرى الهواء البارد (من الآن فصاعدا تسمى الوسائط القاعدية) إلى كل بئر.
- استخدم ماصة P1000 لأن طرف الماصة هذا يحتوي على أكبر فتحة وسيقلل من احتمالية انفجار المواد العضوية أثناء سحب العينات. اضبط الماصة على 350 ميكرولتر لتجنب تكوين فقاعات ، ثم ماصة لأعلى ولأسفل برفق لتعطيل قبة ECM في كل بئر. اجمع كل وسائط ECM / القاعدية في أنبوب طرد مركزي سعة 15 مل.
- شطف كل بئر مع 500 ميكرولتر من وسائل الإعلام القاعدية الباردة. اجمع الوسائط القاعدية التي تحتوي على أي ECM وعضويات متبقية في نفس أنبوب الطرد المركزي سعة 15 مل على النحو الوارد أعلاه.
- جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. من بين الطبقات الثلاث المرئية بعد الطرد المركزي - (1) طافي ، (2) ECM يحتوي على حطام خلوي (رقيق) و (3) حبيبات تحتوي على مواد عضوية - تخلص من طبقة الطافية وطبقة ECM وحافظ على الحبيبات العضوية.
- أضف 1 مل من الوسائط القاعدية الباردة إلى الحبيبات العضوية والماصة لأعلى ولأسفل برفق لفصل أي ECM متبقية. أضف 6 مل من الوسائط القاعدية الباردة إلى الأنبوب واخلطها برفق.
- جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية.
- إذا كان ECM الزائد لا يزال مرئيا ، كرر الخطوات 6.3.5- 6.3.6 لإجراء غسل آخر.
- أعد تعليق الحبيبات العضوية بحجم مناسب من 90٪ ECM (استخدم AODM بدلا من AOSM) إلى لوحة ~ 30 عضويا لكل 50 ميكرولتر من القبة.
- تحقق من كثافة المواد العضوية تحت مجهر ثقافة الخلية (عدسة موضوعية 4x) بعد طلاء القبة الأولى. إذا كانت كثيفة جدا ، أضف 90٪ ECM إضافية لتحقيق الكثافة المطلوبة من ~ 30 عضوية.
- اتبع الخطوات 6.2.3- 6.2.4 لتصلب ECM وتغذية الخلايا كل يومين ب 500 ميكرولتر من AODM الدافئ لكل بئر لمدة 14 يوما أخرى حتى تصل إلى مرحلة النضج (بعد 21 يوما من التمايز) مع تكوين تجويف محاط بظهارة كاذبة مواجهة للداخل تحتوي على خلايا قاعدية وخلايا مهدبة وخلايا كأسية.
ملاحظة: الكائنات العضوية الظهارية في مجرى الهواء الموصوفة هنا متباينة بشكل نهائي ولا يمكن مرورها أو حفظها بالتبريد.
7. التصوير أهداب فوز التردد
ملاحظة: يتطلب هذا القسم من البروتوكول مجهر تصوير بالخلايا الحية مع غرفة بيئية للتدفئة والرطوبة ، وكاميرا علمية بمعدل إطارات سريع (>100 هرتز) ، وهدف مسافة عمل طويلة 20x ، وبرنامج تصوير (راجع جدول المواد للمعدات الموصى بها المستخدمة في هذا البروتوكول).
- إعداد المجهر
- تأكد من تشغيل نظام تسخين المجهر وتوازنه إلى 37 درجة مئوية. قم بتشغيل المجهر. اضبط الغاز على 5٪ CO 2 عبر خلاط غاز CO2 / الهواء.
- قم بتعبئة زجاجة وحدة الرطوبة التي يمر بها CO2 بالماء النقي. اضبط الرطوبة النسبية على 85٪ عبر وحدة التحكم العلوية في المسرح بحيث يتم تسخين الماء وتزويد الخلايا بالهواء المرطب. موازنة الغرفة لمدة 30 دقيقة.
- ضع إدخال لوحة المجهر في حامل المجهر.
- نقل نماذج الخلايا الظهارية في مجرى الهواء من الحاضنة إلى المجهر على كتلة حرارية أو حبات حرارية متوازنة إلى 37 درجة مئوية للحفاظ على العينة عند درجة حرارة فسيولوجية.
- ضع لوحة الاستزراع التي تحتوي على نماذج الخلايا الظهارية في مجرى الهواء في ملحق لوحة المجهر. أغلق غرفة البيئة المجهرية.
- اسمح للعينة بالتوازن في غرفة المجهر المملوءة مسبقا ب 37 درجة مئوية ، 5٪ CO2 لمدة 30 دقيقة.
ملاحظة: قد يكون وقت التوازن الأقصر كافيا. يمكن تحديد ذلك عن طريق إجراء تجربة لتحديد الوقت اللازم لتثبيت CBF (راجع الشكل 3).
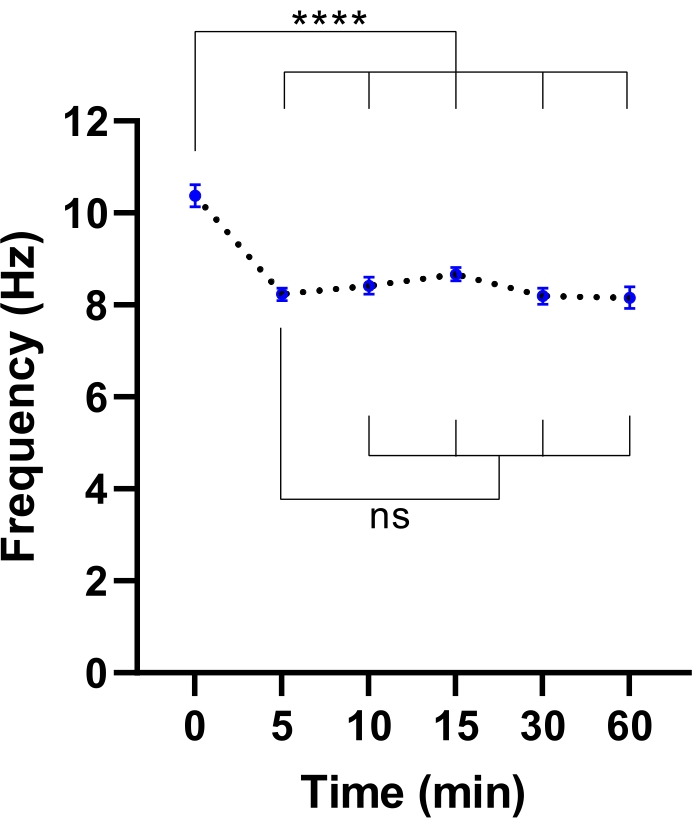
الشكل 3: تثبيت تردد النبض الهدبي في مجهر تصوير الخلايا الحية. مخططات نقطية لمتوسط تردد ضربات الأهداب (CBF) في الخلايا الظهارية في مجرى الهواء في واجهة الهواء السائل (نماذج ALI) بعد نقلها إلى مجهر تصوير الخلايا الحية مع غرفة بيئية. تمت موازنة الغرفة والحفاظ عليها عند 37 درجة مئوية ، 5٪ CO2 والرطوبة النسبية بنسبة 85٪ لمدة 30 دقيقة قبل فتح باب الغرفة ووضع لوحة الثقافة في إدخال لوحة المجهر. تم تصوير نماذج الخلايا لمدة 60 دقيقة على فترات زمنية محددة. تم اشتقاق نماذج ALI من اثنين من المشاركين مع CF. تم الحصول على ست صور مجال الرؤية (FOV) لكل نموذج ALI. تمثل كل نقطة (زرقاء) متوسط CBF في صور 12-36 FOV. يتم تمثيل البيانات كمتوسط ± SEM ، مع متوسط متصل بخط منقط. تم استخدام تحليل التباين أحادي الاتجاه (ANOVA) لتحديد الاختلافات الإحصائية. P < 0.0001 ، ns: لا أهمية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
- خلال فترة التوازن ، على الكمبيوتر ، افتح برنامج الاستحواذ. حدد العدسة الموضوعية لمسافة العمل الطويلة 20x.
- عند عدسة المجهر ، ركز على نموذج الخلية (~ Z = 8000 ميكرومتر).
- تأكد من إعداد المجهر لإضاءة كوهلر بحيث لا تركز خيوط لمبة مصدر ضوء الإرسال على مستوى العينة ، وتجنب القطع الأثرية في التصوير. لهذا اتبع الخطوات 7.1.10-7.1.13
- أغلق تماما الحجاب الحاجز القزحية الحقل فوق المكثف. افتح غشاء قزحية الحقل ببطء وحرك المكثف لأعلى / لأسفل حتى يظهر شكل مثمن.
- إذا لم يتم محاذاة غشاء قزحية الحقل (على سبيل المثال ، المثمن ليس في مركز مجال الرؤية (FOV)) ، فقم بمحاذاته مع المركز باستخدام مفاتيح ألين.
- بمجرد محاذاة الحجاب الحاجز القزحية الحقلية ، اضبط تركيز المكثف لجلب المثمن إلى التركيز البؤري الحاد.
- افتح الحقل الحجاب الحاجز القزحية حتى لا يمكن رؤيته داخل مجال الرؤية.
- باستخدام برنامج الاستحواذ ، انقر فوق L100 لتبديل مسار الضوء إلى المنفذ حيث يتم تركيب الكاميرا. انقر فوق زر التشغيل الأخضر (تشغيل) لتصور المجهر FOV عبر البرنامج. تأكد من أن الأهداب في بؤرة التركيز واضبطها إذا لزم الأمر.
- باستخدام برنامج الاستحواذ ، قم بإعداد المجهر بالإعدادات التالية: المرشحات: فارغة ؛ المكثف: فارغ. الشكل: لا binning. وقت التعرض: 0.003 ثانية ؛ وضع القراءة: مصراع المتداول. عائد الاستثمار: 512 × 512 بكسل.
ملاحظة: يعتمد وقت التعرض على أعلى تردد يجب قياسه لأن 1 / وقت التعرض يجب أن يكون ضعف هذا التردد على الأقل. على سبيل المثال ، إذا كان الحد الأقصى للنطاق الفسيولوجي لضرب الأهداب = 30 هرتز ، فإن 1 / وقت التعرض = 60 ، ويجب أن يكون وقت التعرض ≤ 0.016 ثانية. يعتمد عائد الاستثمار على مواصفات معدل إطارات الكاميرا. حدد عائد استثمار يلتقط معدلات الإطارات >100 هرتز.
- الحصول على الصور
- للحصول على صور الفاصل الزمني من القائمة ، انقر فوق اكتساب ثم انقر فوق Fast Time Lapse. في النافذة المنبثقة، حدد موقع حفظ واسم ملف. الحصول على 1000 لقطة.
- انقر فوق تطبيق. انقر فوق زر التشغيل الأخضر (تشغيل) لمعاينة الأهداب في المجهر FOV وضبط تركيز Z إذا لزم الأمر. انقر فوق تشغيل الآن لالتقاط الفاصل الزمني السريع.
- بمجرد التقاط الفاصل الزمني السريع ، انقر فوق زر التشغيل الأخضر (تشغيل) لتصور المجهر FOV. باستخدام عصا التحكم المجهرية ، تحرك على طول المحور X / Y إلى مجال رؤية آخر.
- اضبط التركيز Z لجلب الأهداب إلى التركيز. انقر فوق تشغيل الآن لالتقاط فاصل زمني سريع آخر.
- كرر الخطوات 7.2.3-7.2.4. بالنسبة لنماذج ALI وعضويات مجرى الهواء ، فإن الصورة 6x FOV في كل من العينات 3x تكرر. بالنسبة للصفائح الظهارية لمجرى الهواء ، قم بتصوير ما لا يقل عن 4x لتكرار الصور لكل مشارك.
8. تحليل البيانات والقياس الكمي ل CBF
- الاستعدادات لتحليل البيانات
ملاحظة: يتطلب هذا القسم من البروتوكول برامج نصية مخصصة للتحليل (الملف التكميلي 3) وملفات صور أولية (تم الحصول عليها في القسم 7.2) وبرنامج حوسبة وبرنامج تحليل.- قم بتثبيت برنامج الحوسبة ، ويفضل أن يكون أحدث إصدار ، على كمبيوتر التحليل. تأكد من تثبيت صناديق أدوات برامج الحوسبة القياسية (elmat و ops و datafun و uitools و datatypes و iofun و iotools و audiovideo) وصناديق أدوات معالجة الصور والإشارة.
- انسخ البرامج النصية المخصصة للتحليل "BeatingCiliaBatchOMEfiles_JOVE.m" و "LoadRawDataExportFilteredMovies_JOVE.m" ومجلد "البرامج النصية للدعم" إلى محرك الأقراص المحلي للكمبيوتر.
- في برنامج الحوسبة ، انقر فوق علامة التبويب الصفحة الرئيسية. ثم انقر فوق تعيين المسار (الشكل 4 أ - ب).
- في النافذة المنبثقة ، انقر فوق إضافة مع المجلدات الفرعية (الشكل 4C). ضمن "مسار بحث MATLAB" ، حدد المجلدات الموضحة في الشكل 4D ، ثم انقر فوق حفظ وإغلاق (الشكل 4E-F).
- تأكد من أن البرامج النصية للتحليل مرتبطة ببرنامج الحوسبة عن طريق التحقق من ظهورها في اللوحة اليسرى (الشكل 4G).
- انقل ملفات الصور الأولية (تنسيق بيئة الفحص المجهري المفتوح (OME)) التي تم الحصول عليها في القسم 7.2 إلى محرك الأقراص المحلي للكمبيوتر.
ملاحظة: يمكن الوصول إلى أمثلة ملفات الصور الأولية على: https://doi.org/10.6084/m9.figshare.16649878.v1.
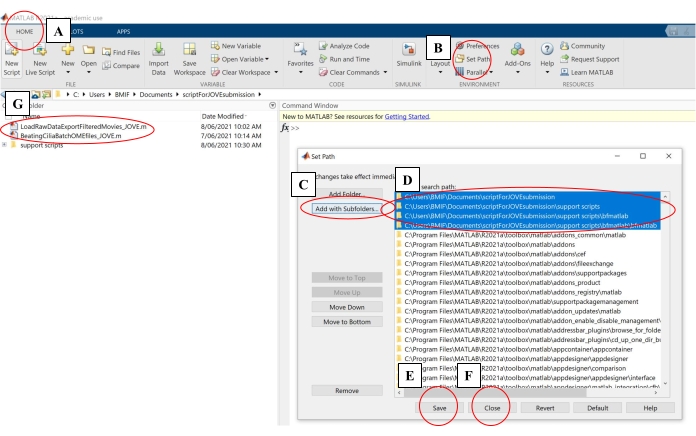
الشكل 4: إعداد برنامج حوسبة لتحليل البيانات. (أ) افتح علامة التبويب الصفحة الرئيسية . (ب) حدد تعيين المسار. (ج) حدد إضافة مع المجلدات الفرعية. (د) حدد المجلدات التي تحتوي على البرامج النصية للتحليل. (ه) حدد حفظ. (و) حدد إغلاق. (ز) ستظهر نصوص التحليل في اللوحة اليمنى. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
- القياس الكمي ل CBF عن طريق الكشف عن ذروة طيف شدة وحدات البكسل المفردة
- افتح برنامج الحوسبة. انقر فوق ملف البرنامج النصي للتحليل "BeatingCiliaBatchOMEfiles_JOVE.m" (الشكل 5 أ).
- انقر فوق علامة التبويب محرر ، ثم انقر فوق زر التشغيل الأخضر (تشغيل) لتشغيل البرنامج النصي (الشكل 5B-C). في نافذة المطالبة ، حدد ملفات الصور الأولية المراد تحليلها (الشكل 5D).
- أدخل وقت التعرض من الخطوة 7.1.15 في نافذة المطالبة لوقت الاستحواذ لكل إطار ، ثم انقر فوق موافق (الشكل 5E).
- انتظر ~ 15 دقيقة لكل ملف بينما يقوم البرنامج النصي بحساب وإخراج CBF في ملف "AveSpectrum" (الملف التكميلي 4) ، والذي يتم حفظه تلقائيا في نفس المجلد مثل ملفات الصور الأولية. تصور التقدم عبر شريط التقدم (الشكل 5F).
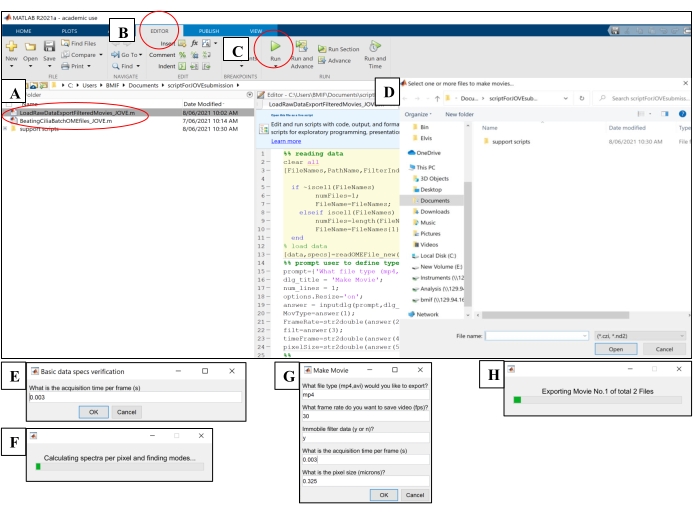
الشكل 5: تشغيل البرامج النصية للتحليل باستخدام برامج الحوسبة . (أ) افتح البرنامج النصي لتحليل CBF ('BeatingCiliaBatchOMEfiles_JOVE.m') أو إنشاء فيلم ضرب الأهداب ('LoadRawDataExportFilteredMovies_JOVE.m'). (ب) افتح علامة التبويب المحرر . (ج) حدد زر التشغيل الأخضر (تشغيل) لتشغيل البرنامج النصي للتحليل. (د) ستتطلب نافذة المطالبة اختيار الملفات للتحليل أو إنشاء فيلم. (ه) أثناء تشغيل البرنامج النصي "BeatingCiliaBatchOMEfiles_JOVE.m" ، ستظهر مطالبة لإدخال وقت الاكتساب يدويا لكل إطار (إطارات) في حالة عدم قراءة البرنامج النصي لقراءة الملفات للبيانات الوصفية بشكل صحيح. (F) شريط تقدم يشير إلى حساب تردد نبض الأهداب. (G) أثناء تشغيل البرنامج النصي "LoadRawDataExportFilteredMovies_JOVE.m" ، ستظهر مطالبة لإدخال نوع الفيلم المراد إخراجه يدويا (mp4 أو avi) ، ومعدل إطارات الفيلم (fps) ، وما إذا كان المكون غير المتحرك قد تمت إزالته من بيانات الفيلم ('y' أو 'n') ، ووقت (أوقات) الإطار ، وحجم البكسل (ميكرون) للبيانات المصدرة إلى الفيلم. يوصى باستخدام "y" للتصفية غير المتحركة لأنها ستزيل المخاط أو أي طبقات أخرى تعيق الحركة في البيانات. (H) شريط التقدم للإشارة إلى الفيلم الذي يتم تصديره. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
- قم بتشغيل البرنامج النصي 'GetFirstAmplitude.m' على المجلد الذي يحتوي على ملفات 'AveSpectrum' باستخدام العملية في الخطوات 8.2.1-8.2.2. انتظر حتى يقوم البرنامج النصي بإخراج ملف "FirstAmplitudeStacked.xlsx" ، والذي يحتوي على التردد الذي يحتوي على أعلى سعة ويقع ضمن النطاق الفسيولوجي لضربات أهداب ظهارة مجرى الهواء ، ≥3 و <30 هرتز.
- انسخ قيم التردد من ملف "FirstAmplitudeStacked.xlsx" وقم بالتخطيط باستخدام برنامج تحليل علمي.
ملاحظة: يتم توفير شرح لكيفية قيام البرنامج النصي للتحليل المخصص بقياس CBF في الملف التكميلي 5. يمكن الوصول إلى أمثلة مجموعات البيانات التي تم تحليلها على: https://doi.org/10.6084/m9.figshare.16649815.
- تصدير فيديو لضرب الأهداب
- افتح برنامج الحوسبة. انقر فوق ملف البرنامج النصي "LoadRawDataExportFilteredMovies_JOVE.m" (الشكل 5 أ) لتحميل البرنامج النصي.
- انقر فوق علامة التبويب محرر ، ثم انقر فوق زر التشغيل الأخضر (تشغيل) لتشغيل البرنامج النصي (الشكل 5C). في نافذة المطالبة ، حدد ملفات الصور الأولية المراد تصديرها إلى ملفات الأفلام (الشكل 5D).
- أدخل الإعدادات المفصلة في الجدول 4 في النافذة المنبثقة "صنع فيلم" (الشكل 5G).
- انتظر ~ 8 دقائق لكل ملف بينما يقوم البرنامج النصي بإنشاء ملفات الفيلم وإخراجها إلى موقع ملفات الصور الأولية. تصور التقدم عبر شريط التقدم (الشكل 5H).
| مدخلات الفيلم | وصف |
| نوع الملف | أدخل نوع الملف الذي ترغب في تصديره (mp4 أو avi). |
| معدل الإطارات | أدخل معدل الإطارات الذي يجب تصدير الفيلم به. إذا كان لديك ~ 1000 إطار لكل سلسلة زمنية مكتسبة ، فمن المستحسن تعيين معدل الإطارات ~ 30 إطارا في الثانية. |
| تصفية غير متحركة | الخيارات هي "y" أو "n". الافتراضي هو "y" ، ويزيل البرنامج النصي لتصفية الوقت ، باستخدام مساحة فورييه ، أي مكونات غير متحركة من بيانات الفيلم. عادة ، ستساهم أي طبقات من الخلايا تحت الأهداب أو المخاط غير المتحرك بمكون إزاحة التردد الصفري أو مكون ثابت الوقت في الإشارة التي يمكن تصفيتها. |
| وقت الاستحواذ لكل إطار | وقت الاستحواذ لكل إطار من البيانات المكتسبة. يتم استخدامه لعرض طابع زمني في الفيلم في ثوان. |
| حجم بكسل | يتم استخدام حجم البكسل بالميكرومتر لعرض شريط مقياس في الفيلم بالميكرومتر. |
الجدول 4: إعدادات الإدخال لإنشاء الفيلم
النتائج
لإثبات كفاءة هذا البروتوكول في تحديد CBF ، يتم تقديم نتائج CBF المقاسة في نماذج ALI للخلايا الظهارية في مجرى الهواء المشتقة من ثلاثة مشاركين مصابين بالتليف الكيسي وثلاثة مشاركين في التحكم الأصحاء. في اليوم 14 من التمايز الثقافي ، كانت الأهداب الضاربة موجودة (الشكل 6). من اليوم 14 ?...
Discussion
هناك العديد من العوامل التي يمكن أن تحجب القياس الكمي ل CBF في الأوراق الظهارية الأنفية. يجب تصوير الأوراق الظهارية في غضون 3-9 ساعات من جمع العينات لأن الوظيفة الهدبية تكون أكثر استقرارا خلال هذا الوقت37. تعد خلايا الدم الحمراء والحطام الأقل مثالية للتصوير لأنها تتداخل مع الحصو?...
Disclosures
يعلن المؤلفون أنه ليس لديهم ما يكشفون عنه.
Acknowledgements
نشكر المشاركين في الدراسة وعائلاتهم على مساهماتهم. نحن نقدر المساعدة المقدمة من قسم الجهاز التنفسي في راندويك في مستشفيات سيدني للأطفال (SCH) في تنظيم وجمع العينات الحيوية للمرضى - شكر خاص للدكتور جون ويدجر والدكتورة إيفون بيليسيس وليان بلاش وأماندا طومسون وروندا بيل. نعترف بمساعدة إيفيتا سلابيتوفا ورينيه وان من مرفق كاثرينا غاوس للفحص المجهري الضوئي داخل مركز مارك وينرايت التحليلي في جامعة نيو ساوث ويلز في سيدني. يتم دعم هذا العمل من قبل المجلس الوطني للصحة والبحوث الطبية (NHMRC) أستراليا (GNT1188987) ، ومؤسسة CF أستراليا ، ومؤسسة مستشفى سيدني للأطفال. يود المؤلفون أن يعربوا عن تقديرهم لتحالف Luminesce - الابتكار من أجل صحة الأطفال لمساهمته ودعمه. Luminesce Alliance - Innovation for Children's Health هو مشروع تعاوني مشترك غير هادف للربح بين شبكة مستشفيات الأطفال في سيدني ومعهد البحوث الطبية للأطفال ومعهد سرطان الأطفال. تم تأسيسها بدعم من حكومة نيو ساوث ويلز لتنسيق ودمج أبحاث طب الأطفال. ينتمي Luminesce Alliance أيضا إلى جامعة سيدني وجامعة نيو ساوث ويلز سيدني. يتم دعم KMA من خلال منحة برنامج التدريب البحثي للحكومة الأسترالية. يتم دعم LKF من قبل نادي الروتاري في سيدني كوف / مؤسسة مستشفى سيدني للأطفال ومنح جامعة نيو ساوث ويلز للدراسات العليا.
Materials
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O'Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O'Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved