A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
איסוף, הרחבה והתמיינות של מודלים ראשוניים של תאי אפיתל באף אנושי לכימות תדירות פעימות הריסונים
In This Article
Summary
פרוטוקול זה מתאר איסוף, הרחבה והתמיינות של תאי אפיתל באף למודלים של תאי אפיתל אורגנוטיפיים של דרכי הנשימה וכימות של תדירות פעימות הריסונים באמצעות הדמיה של תאים חיים וסקריפטים שנבנו בהתאמה אישית.
Abstract
מדידות של תפקוד הריסונים (תדירות פעימה, דפוס) נקבעו ככלי אבחון למחלות בדרכי הנשימה כגון דיסקינזיה ציליארית ראשונית. עם זאת, היישום הרחב יותר של טכניקות אלה מוגבל על ידי הרגישות הקיצונית של תפקוד ציליארי לשינויים בגורמים סביבתיים כגון טמפרטורה, לחות ו- pH. בדרכי הנשימה של חולים עם סיסטיק פיברוזיס (CF), הצטברות ריר מעכבת את הכאת הריסונים. פונקציית הריסונים נחקרה במודלים ראשוניים של תאי דרכי הנשימה כאינדיקטור לפעילות ערוץ מווסת מוליכות טרנסממברנה CF (CFTR). עם זאת, נמצאה שונות ניכרת בין מטופל לחולה בתדירות הכאת הריסונים בתגובה לתרופות המווסתות CFTR, אפילו עבור חולים עם אותן מוטציות של CFTR . יתר על כן, ההשפעה של הפרשת כלוריד מווסתת CFTR לא מתפקדת על תפקוד הריסיון אינה מובנת כהלכה. אין כיום פרוטוקול מקיף המדגים הכנת דגימות של מודלים של נתיבי אוויר במבחנה , רכישת תמונות וניתוח של Cilia Beat Frequency (CBF). תנאי תרבית סטנדרטיים ורכישת תמונות המבוצעים במצב מבוקר סביבתית יאפשרו כימות עקבי וניתן לשחזור של CBF בין אנשים ובתגובה לתרופות המווסתות CFTR. פרוטוקול זה מתאר את הכימות של CBF בשלוש מערכות מודל שונות של תאי אפיתל בדרכי הנשימה: 1) יריעות אפיתל מקוריות, 2) מודלים של ממשק אוויר-נוזל המצולמים על תוספות תמיכה חדירות, ו-3) אורגנואידים תלת-ממדיים מוטמעים במטריצה חוץ-תאית. שני האחרונים משכפלים את הפיזיולוגיה של הריאות in vivo , עם ריסונים מכים וייצור של ריר. הפונקציה הציליארית נלכדת באמצעות מצלמת וידאו במהירות גבוהה בתא הנשלט על ידי הסביבה. סקריפטים שנבנו בהתאמה אישית משמשים לניתוח CBF. תרגום מדידות CBF למרפאה צפוי להיות כלי קליני חשוב לניבוי תגובה לתרופות מווסתות CFTR על בסיס פר מטופל.
Introduction
מדידות של תדירות פעימת ריסונים (CBF) ודפוס נקבעו ככלי אבחון למחלות בדרכי הנשימה כגון דיסקינזיה ריסיאלית ראשונית (PCD)1. בסיסטיק פיברוזיס (CF), תפקוד לקוי של תעלת הכלוריד של מווסת מוליכות טרנסממברנה CF (CFTR) גורם להתייבשות של נוזל פני השטח של דרכי הנשימה ולפגיעה בפינוי ליחה2. פונקציה ציליארית נחקרה במבחנה במודלים ראשוניים של תאי דרכי הנשימה כאינדיקטור לפעילות ערוץ CFTR3. עם זאת, קיימת שונות ניכרת בין חולה לחולה ב-CBF בתגובה לתרופות המווסתות CFTR, אפילו עבור חולים עם אותן מוטציות CFTR 3. יתר על כן, ההשפעה של הפרשת כלוריד מווסתת CFTR לא מתפקדת על תפקוד הריסיון אינה מובנת כהלכה. אין כיום פרוטוקול מקיף המדגים הכנת דגימות של מודלים של נתיבי אוויר במבחנה , רכישת תמונות וניתוח של CBF.
יריעות אפיתל לאף המבודדות ממברשות רירית האף משמשות ישירות למדידות של תפקוד ציליארי לאבחון PCD4. עם זאת, בעוד שאין שליטה על הגודל או האיכות של יריעות אפיתל האף המתקבלות, CBF משתנה בהתאם לשאלה אם הוא נמדד על תאים בודדים או יריעות תאים ועל קצוות יריעות אפיתל משובשות או ללא הפרעה5. ככזה, דיסקינזיות משניות הנגרמות על ידי נזק לתאים במהלך איסוף של מברשות רירית האף עשויות להשפיע על CBF. תרבית תאים ראשונית של תאי אפיתל באף והתמיינותם בממשק אוויר-נוזל (ALI) או במטריצת קרום מרתף תלת-ממדית לאורגנואידים אפיתליאליים של דרכי הנשימה יוצרים ריסונים נקיים מדיסקינזיות משניות 4,6,7,8. תאי אפיתל של דרכי הנשימה המתמיינים ב- ALI (המכונים מעתה מודלים ALI) נחשבו לכלי אבחון משני חשוב המשכפל את דפוסי הפעימה והתדירות של צחצוח רירית האף ex vivo 6 ומאפשר ניתוח של אולטרה-מבנה ציליארי, תבנית פעימה ותדירות פעימה תוך שמירה על פגמים ספציפיים למטופל9 . עם זאת, קיימים פערים במתודולוגיות המשמשות ליצירת מודלים של תאים ממוינים מדומים, ליחה. פרוטוקולי הרחבה או הבחנה שונים של תרביות יכולים לגרום לפנוטיפים אפיתליאליים מובחנים (ciliated או secretory)10 ולגרום להבדלים משמעותיים ב-CBF11. CBF כומתה במברשות אפיתל לאף 4,6,12,13,14,15,16, אורגנואידים אפיתל של דרכי הנשימה 14,17,18 ודגמי ALI 3,4,6,13,19,20, 21. עם זאת, בין פרוטוקולים אלה, יש שונות גדולה, ולעתים קרובות פרמטרים רבים אינם מבוקרים. לדוגמה, במחקרים מסוימים, CBF מצולם באתרו בעוד שהתאים של מודל ALI נשארים על תוספת התמיכה החדירה 3,19,20,21, אך אחרים מגרדים את התאים מתוספת התמיכה החדירה ומדמיינים אותם תלויים במדיה 4,6,13.
יתר על כן, היישום הרחב יותר של טכניקות המודדות את הפונקציה הציליארית מוגבל על ידי הרגישות הקיצונית של הפונקציה הציליארית לשינויים בגורמים סביבתיים. גורמים סביבתיים כגון טמפרטורה22, לחות 23,24 ו- pH 25,26 משפיעים על תפקוד הציליארי ויש לווסת אותם כדי לכמת CBF במדויק. הפרמטרים הפיזיולוגיים השונים המשמשים במעבדות שונות וכיצד הם משפיעים על CBF נבדקו בעבר27.
בספרות מדווחות טכנולוגיות הדמיה וגישות שונות למדידות CBF. עבור אבחון PCD, מיקרוסקופיית וידאו משמשת למדידת תפקוד ציליארי28,29. לאחרונה, נעשה שימוש באלגוריתם ניתוח וידאו המבוסס על מיקרוסקופיה דינמית דיפרנציאלית כדי לכמת הן CBF והן תיאום ריסונים במודלים של תאי אפיתל ALI של דרכי הנשימה 3,30. שיטה זו מאפשרת אפיון של הכאה ציליארית בתאי אפיתל דרכי הנשימה באופן מהיר ואוטומטי לחלוטין, ללא צורך בפילוח או בחירת אזורים. שיטות שונות להדמיה וכימות של CBF עשויות להוסיף להבדלים המדווחים ב-CBF בספרות (קובץ משלים 1).
פרוטוקול מתרבות לכימות לייעול השיטות הקיימות, סטנדרטיזציה של תנאי התרבות ורכישת תמונות, המבוצעות בתנאים קפדניים מבוקרים סביבתית, יאפשרו כימות עקבי וניתן לשחזור של CBF בתוך ובין פרטים.
פרוטוקול זה מספק תיאור מלא של אוסף תאי אפיתל, תנאי תרבית התפשטות והתמיינות, וכימות של CBF בשלוש מערכות מודל שונות של תאי אפיתל בדרכי הנשימה ממקור האף: 1) יריעות אפיתל מקוריות, 2) מודלים של ALI המצולמים על תוספות תמיכה חדירות ו-3) אורגנואידים תלת-ממדיים מוטמעים על-ידי מטריצה חוץ-תאית (ECM) (איור 1) ). תאי אפיתל באף המתקבלים ממברשות טורבינאט נחותות באף משמשים כנציגים של אפיתל דרכי הנשימה מכיוון שהם פונדקאית יעילה לתאי אפיתל הסימפונות31 תוך התגברות על ההליך הפולשני הקשור לאיסוף מברשות הסימפונות. שיטת תא התכנות מחדש המותנה (CRC) משמשת להרחבת תאי אפיתל ראשוניים של דרכי הנשימה ליצירת מודלים של ALI ואורגנואידים תלת-ממדיים. תכנות מחדש מותנה של תאי אפיתל דרכי הנשימה למצב דמוי תאי גזע מושרה על ידי תרבית משותפת עם מערכת תאי הזנה פיברובלסטים שנעצרה בגדילה ומעכב קינאז הקשור ל-Rho (ROCK)32. חשוב לציין ששיטת CRC מגדילה את הכפלת האוכלוסייה בתאי אפיתל בדרכי הנשימה תוך שמירה על פוטנציאל ההתמיינות הספציפי לרקמות שלהם33,34. בכל דגמי תאי האפיתל של דרכי הנשימה, הפונקציה הציליארית נלכדת בתא מבוקר טמפרטורה באמצעות מצלמת וידאו במהירות גבוהה עם הגדרות סטנדרטיות לקליטת תמונה. סקריפטים שנבנו בהתאמה אישית משמשים לכימות של CBF.

איור 1: סכימה של זרימת עבודה. לאחר צחצוח הטורבינציה הנחותה באף של המשתתפים, תאי אפיתל דרכי הנשימה מנוצלים באחת משתי דרכים. או יריעות אפיתל של דרכי הנשימה מבודדות, ותדר פעימות הריסונים מצולם מיד, או שתאי אפיתל של דרכי הנשימה מורחבים באמצעות שיטת התכנות מחדש המותנית של התא. תאי אפיתל של דרכי הנשימה המורחבים על-ידי CRC מתמיינים כדי ליצור תאי אפיתל של דרכי הנשימה בממשק אוויר-נוזל או בתרביות אפיתל אורגנואידיות של דרכי הנשימה. הדמיה של תדר פעימה ציליארית נרכשת באמצעות מיקרוסקופ הדמיה של תאים חיים עם תא סביבתי של חימום ולחות ומצלמה מדעית בקצב פריימים מהיר (>100 הרץ). ניתוח הנתונים מתבצע באמצעות סקריפטים שנבנו בהתאמה אישית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
אישור המחקר התקבל מהוועדה לבדיקת אתיקה של רשת בתי החולים לילדים בסידני (HREC/16/SCHN/120). הסכמה בכתב התקבלה מכל המשתתפים (או האפוטרופוס של המשתתפים) לפני איסוף הביופסימנים.
1. תכשירים להקמת מודלים של תאי אפיתל בדרכי הנשימה
- הכינו את מדיית איסוף תאי האף על ידי שילוב של 80% סרום נשר מתוקן של דולבקו ו-20% סרום בקר עוברי. תוסף עם 1 μL/מ"ל של פניצילין/סטרפטומיצין. יש לאחסן בטמפרטורה של 4°C למשך עד 3 חודשים.
- מצפים את הצלוחיות או את תוספות התמיכה החדירות בתמיסת קולגן על בסיס לפי הצורך בהתאם לשלבים 1.2.1-1.2.4. אין לאחסן כלי קולגן לטווח ארוך.
- בצע דילול של 1:100 של תמיסת קולגן מסוג I (מלאי של 3 מ"ג/מ"ל) עם תמיסת מלח עם מאגר פוספטים (PBS) לריכוז סופי של 0.03 מ"ג/מ"ל. מערבבים היטב.
- מצפים את צלוחיות תרבית התאים (סעיף 4) ב-160 μL/cm 2 (כלומר, 4 מ"ל לכל בקבוקון T25) ותוספות תמיכה חדירות (סעיף 5) עם 455 μL/cm2 (כלומר, 150 μL לכל תוספת של 6.5 מ"מ) של תמיסת הקולגן המוכנה.
- דגירה ב-37 מעלות צלזיוס למשך 2-24 שעות.
- הסר את תמיסת הקולגן על ידי פיפטה או שואב אבק לפני זריעת התאים. אין לשטוף את הכלי לפני זריעת התאים.
- הכנת מדיית תא תכנות מחדש מותנה (CRC) על-ידי שילוב רכיבים32 המפורטים בטבלה 1. יש לסנן את העיקור באמצעות מערכת מסנני ואקום על גבי בקבוק. יש לאחסן בטמפרטורה של 4°C למשך עד חודשיים.
- ביום השימוש, יש להוסיף גורם גדילה אפידרמלי אנושי, מעכב ROCK ואנטיביוטיקה כפי שמצוין בטבלה 1.
| רכיב | נפח |
| DMEM, גלוקוז גבוה | 156.7 מ"ל |
| DMEM/F-12, האפס | 313.3 מ"ל |
| הידרוקורטיזון | 55.6 מיקרון |
| אינסולין | 1.25 מ"ל |
| רעלן כולרה | 21 מיקרוגרם |
| אדנין | 1.2 מ"ל |
| היי-FBS | 25 מ"ל |
| פניצילין-סטרפטומיצין | 5 מ"ל |
| גורם גדילה אפידרמלי אנושי | 1 מיקרו-ליטר/מ"ל |
| מעכב רוק | 1 מיקרו-ליטר/מ"ל |
| פטריות | 2 מיקרו-ליטר/מ"ל |
| טוברמיצין | 2 מיקרו-ליטר/מ"ל |
| Ceftazidime hydrate | 4 מיקרו-ליטר/מ"ל |
| תמיסת גנטמיצין | 1 מיקרו-ליטר/מ"ל |
טבלה 1: רכיבים עבור 500 מ"ל של מדיית תא מותנית לתכנות מחדש
2. אוסף של מברשות טורבינאט נחותות באף
הערה: סעיף זה של הפרוטוקול דורש צינור איסוף (50 מ"ל) עם מדיה לאיסוף תאי אף, מברשות ציטולוגיה, רקמות וציוד מגן אישי מתאים. יש להימנע מצחצוח במהלך זיהום בדרכי הנשימה העליונות. קיים סיכון קטן לדימום, אשר גדל אם קיימת דלקת. אם מטרת הצחצוח היא להשיג יריעות אפיתל בדרכי הנשימה למדידות ex vivo CBF צחצוח צריך להתרחש מינימום של 6 שבועות לאחר כל זיהום בדרכי הנשימה העליונות; באופן אידיאלי, יותר מ -10 שבועות לאחר ההדבקה35.
- הכינו את מדיית איסוף תאי האף (סעיף 1) ושמרו את הצינור על הקרח.
- תאר את ההליך למשתתף כלא נוח. הסבירו כי תחושה מלאה מורגשת בנחיר במהלך הצחצוח, בדומה לקפיצה לים/בריכה ומים הממהרים לתוך מעבר האף. לייעץ למשתתפים כי ההליך יגרום לייצור של דמעות כמו רפלקס.
- הערך איזה מיקום מתאים למשתתף. השכיבו את המשתתף בתנוחת שכיבה אם יש ספת בדיקה זמינה מכיוון שתנוחת שכיבה מונעת את הזזת ראשו של המשתתף הרחק מהמברשת במהלך ההליך. לחלופין, הושיבו את המשתתף ליד קיר, שעליו הוא יכול ללחוץ את ראשו לאחור.
- בדוק את מעבר האף. שימו לב לסטיית מחיצה, פוליפים וכל חריגה אנטומית אחרת שעלולה להשפיע על מעבר המברשת במעבר האף ולהגביר את הסיכון לדימום.
- נקו את האף מעודף ריר על ידי בקשה מהמשתתפים לפוצץ את האף שלהם לתוך רקמה.
- בקשו מהמשתתפים לנשום דרך הפה. קח מברשת ציטולוגיה ביד הדומיננטית. בזמן הנחת הספרה החמישית על סנטרו של המשתתף כדי לעגן את היד, הכנס את המברשת הציטולוגיה למעבר האף של המשתתף (איור 2). הכניסו את המברשת בטמפרטורה של ~45° לפנים של המשתתף כדי לעבור דרך בשר האף.
- סובבו את המברשת זקופה כך שתהיה בניצב לפנים של המשתתף. מקדמים את המברשת בעדינות אך בחוזקה כנגד הדופן הצדדית של האף מתחת לטורבינציה התחתונה עד שהיא נמצאת בחלק האמצעי עד האחורי של הטורבינציה הנחותה.
הערה: הימנע מהכנסת יתר; אם הורגשה ירידה פתאומית בהתנגדות, הלוע באף הוזן, ויש לסגת מהמברשת עד שההתנגדות תורגש שוב על ידי הפרוצדורליסט. - סובבו את המברשת ב-360° עד שלוש פעמים. הסירו את המברשת בעדינות בהיפוך תמרון ההחדרה, כך שהתאים לא ינותקו מהמברשת.
- הכניסו את המברשת לצינור האיסוף המוכן עם מדיית איסוף תאי האף. מניחים את צינור האיסוף על קרח.
- חזור על הצחצוח בנחיר השני אם המשתתף נעים / נדרש מספר רב של תאים (למשל, כדי ליזום תרבית תאים).
הערה: ניתן להבריש שוב את אותו נחיר אם לא היו תאי דם נראים לעין על המברשת, עם זאת, וציין כי הסיכון לדימום גדל מעט עם הברשה שנייה באותו נחיר.
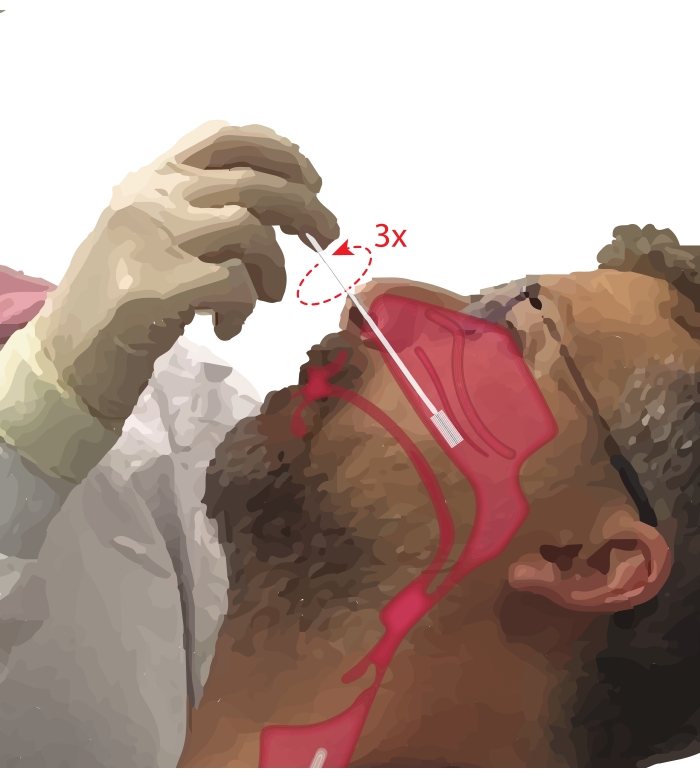
איור 2: אוסף של תאי אפיתל באף. איור של מיקום המברשת הציטולוגיה בחלק האמצעי עד האחורי של הטורבינציה הנחותה. למיקום זה מגיעים על ידי החדרת המברשת דרך הנארס, סיבוב המברשת לזווית של 90° לפנים והנחיית המברשת לאורך מעבר האף מתחת לטורבינציה הנחותה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
3. הכנת יריעות אפיתל דרכי הנשימה
הערה: חלק זה של הפרוטוקול דורש צינור איסוף (מברשות ציטולוגיה + 1 מ"ל של מדיית איסוף תאי אף) (סעיף 2) ולוח בעל תחתית שטוחה 96 היטב. אם אוספים מברשות טורבינות לאף לצורך הדמיה של יריעות אפיתל בדרכי הנשימה, השתמשו רק ב-1 מ"ל של מדיה לאיסוף תאי אף נטולי אנטיביוטיקה; אחרת, יריעות אפיתל יהיו מפוזרות מדי להדמיה.
- סובבו בעדינות את צינור האיסוף המכיל את המברשות הציטולוגיה כדי לנתק את יריעות האפיתל של דרכי הנשימה מהמברשות.
- אסוף את כל המדיה והתאים באמצעות פיפטה P1000. יש לחלק 5-6 טיפות לתוך באר של צלחת בעלת תחתית שטוחה של 96 בארות. חזור על הפעולה במשך כשבע בארות.
- העבירו את הלוחית למיקרוסקופ לפי שלב 7.1.4 ועקבו אחר שארית סעיף 7 כדי לדמות את תדירות הקצב של cilia.
- יריעות אפיתל בתמונה (איור 1) ולא תאים בודדים שאינם מחוברים מאחר שהוכח שתפקוד האפיתל שונה בין יריעות אפיתל לבין תאים בודדים שאינם מחוברים5.
4. הרחבה ותחזוקה של תאי אפיתל בדרכי הנשימה
- אפיתל אווירי מותנה בתכנות מחדש של תרבית התפשטות תאים
הערה: כלי מצופה תמיסת קולגן (סעיף 1), תאי הזנה עובריים של עכברים מוקרנים (NIH-3T3), מדיה של תא תכנות מחדש מותנה (CRC) (סעיף 1), מברשות ציטולוגיה במדיה לאיסוף תאי אף (סעיף 2).- תאי הזנה מוקרנים בצלחת לתוך כלי תרבית מצופים תמיסת קולגן מוכנה בצפיפות זריעה של 8,000 תאים/ס"מ2 לפחות שעתיים ולא יותר מ-72 שעות לפני תרבית משותפת עם תאי אפיתל של דרכי הנשימה (ראו36 עבור תרבית תאי הזנה והקרנה).
- העבירו את התאים המוברשים בצינור האיסוף (מברשות ציטולוגיה + מצע איסוף תאי האף) למערבולת שעל הקרח. במהירות נמוכה, צינור מערבולת 10 שניות דולק, 10 שניות כבוי (שמור על קרח בין לבין) כדי לעקור תאים מהמברשת(ות). מערבולת נמרצת עלולה לפגוע בחיוניות התאים. בדוק את המברשות כדי לבדוק אם הריר עדיין דבוק. אם כן, חזור על המערבולת.
- העבירו את הצינור(ים) שעל הקרח בחזרה לארון הבטיחות הביולוגית. השתמש בפיפטה סרולוגית כדי להעביר את המדיה מצינור האיסוף לצינור חדש (צינור B), ולהשאיר מאחור את מברשות הציטולוגיות. צנטריפוגה צינור B ב 300 × גרם במשך 7 דקות ב 4 מעלות צלזיוס.
- הסר את צינור B מהצנטריפוגה, השליך את הסופר-נטנט. אם הריר גלוי, לשטוף את הכדור עם עוד 5 מ"ל של מדיה איסוף תאי האף צנטריפוגה שוב.
- הוסף 1 מ"ל של מדיית CRC כדי להשעות את כדור התא בצינור B. באמצעות פיפטה סרולוגית של 5 מ"ל, מעבירים תאים דרך מסננת תא הממוקמת על גבי צינור 50 מ"ל (צינור C) בתנועה מעגלית.
- חזור על הפעולה מספר פעמים כדי ליצור השעיה של תא בודד. אסוף את שאריות המדיה מתחתית המסננת ושלב אותה עם המדיה. השליכו את מסננת התא.
- באמצעות פיפטה סרולוגית של 5 מ"ל, קח 1 מ"ל של מדיה מצינור C והעבר אותה לצינור מיקרוצנטריפוגה.
- קח 10 μL של מתלה תא זה והוסף אותו לצינור microcentrifuge מראש aliquoted עם 10 μL טריפן כחול. ערבבו היטב והשתמשו מיד במונה תאים אוטומטי כדי לתעד את ספירת התאים ואת הכדאיות.
- זרעו את תאי האפיתל של דרכי הנשימה לתוך בקבוק T25 שנזרע מראש עם תאי הזנה מוקרנים.
- תחזוקת תאי אפיתל בדרכי הנשימה ודיסוציאציה
הערה: יש לחמם את מדיית CRC ל-37 מעלות צלזיוס על-ידי הצבתה באמבט מים מעבדתי עם בקרת טמפרטורה או במכשיר לאמבטיית חרוזים לפני הוספתה לתאים.- בדוק תאים מתחת למיקרוסקופ תרבית התאים (4× עדשה אובייקטיבית) באופן קבוע עבור התקשרות, זיהום, מורפולוגיה ומפגש.
- שנה את מדיית ה-CRC כל יומיים. כאשר נצפים תאים מתוכנתים מחדש (איור 1) ואין זיהום נוכח, הפחיתו או משכו אנטיביוטיקה.
- כאשר תאים מגיעים למפגש של 90%, השתמש בשיטת טריפסין כפולה32 כדי לנתק את התאים ולבצע ספירת תאים כמתואר בשלב 4.1.8 (עיין בקובץ משלים 2 עבור דיסוציאציה והקפאה של תאים).
5. זריעה והתמיינות של תאי אפיתל בדרכי הנשימה ותחזוקה של מודלים מובחנים של ALI
- זריעת תאי אפיתל בדרכי הנשימה לתוספות תמיכה חדירות
- העבירו את תוספות התמיכה החדירות המצופות בתמיסת קולגן (סעיף 1) מחממת CO2 לארון הבטיחות הביולוגית. שאפו את תמיסת הקולגן והשליכו. הוסף מדיום הרחבה של 750 μL (ללא אנטיביוטיקה) לתא הבסיסי של תוספות התמיכה החדירות.
- מעבירים את התאים המנותקים או התאים המופשרים על הקרח לארון הבטיחות הביולוגית. הוסף את נפח מדיום ההרחבה הדרוש כדי לזרוע 200,000-250,000 תאים ב-150 μL לתא האפיקלי של כל תוסף תמיכה חדיר.
- נזהר לא ליצור בועות; מערבבים היטב כדי להבטיח שהתאים הומוגניים ובהשעיה. הוסף 150 μL של מתלה התא לצד האפיקלי של כל תוספת תמיכה חדירה.
- יש להשעות את התאים לאחר זריעת כל שלוש תוספות תמיכה חדירות כדי לשמור על תרחיף תאים הומוגני.
- כל יום שני עד שנוצר מונולאייר של תא מפגש (בדרך כלל ביום 4 לאחר הזריעה), יש להשליך את המדיה ולהוסיף אמצעי התפשטות טרי שחומם לטמפרטורת החדר (RT, 15-25 מעלות צלזיוס).
- התמיינות של תאי אפיתל דרכי הנשימה בממשק אוויר-נוזל
- מדיית ALI חמה (ללא אנטיביוטיקה) ל-RT (15-25 מעלות צלזיוס).
- הסר את מדיום ההרחבה והחלף למדיית בידול (ALI) הן בתאים apical והן בתאים הבסיסיים.
- לאחר יומיים של תרבות בתקשורת ALI שקועה, שאפו והשליכו את התקשורת.
- הוסף 750 μL של מדיית ALI לתא הבסיסי רק כדי ליצור ממשק אוויר-נוזל.
הערה: אם לאחר שבוע אחד של תרבית, המונולאייר אינו מתמזג ועדיין נצפים חורים, ייתכן שלתאים כבר אין את היכולת להתרחב לאזורים הריקים, שקול להשליך את תאי האפיתל של דרכי הנשימה.
- תחזוקה של מודל ALI מובחן והסרת ריר
- שנה את המדיה האפיקלית והבסיסית כל יום שני עד לבידול מלא (יום 21-25 לאחר הקמת ממשק אוויר-נוזל).
- פעם בשבוע, יש לשטוף את הליחה מהצד האפיקלי לאחר שלבים 5.3.3-5.3.4.
- חמם PBS ל-RT (15-25 מעלות צלזיוס).
- הוסף 200 μL של PBS לתא apical. דגירה בחממת CO2 למשך 10 דקות. השתמש במכשיר שאיפה או פיפטה כדי להסיר את PBS.
6. אורגנואידים אפיתל תלת מימדיים של דרכי הנשימה
- הכנות לתרבית אפיתל אורגנואידית של דרכי הנשימה
- הניחו פלטות 24 באר באינקובטור CO2 כדי להתחמם ל-37°C למשך הלילה.
- הפשרת בקבוקון של 10 מ"ל של ECM (טבלת חומרים) על קרח בהתאם להוראות היצרן. יש להכין אליקוטים של 500 μL (שימוש חד פעמי) כדי למזער את מספר מחזורי ההפשרה בהקפאה.
הערה: יש להשתמש ב-ECM עם ריכוז חלבון >10.5 מ"ג/מ"ל לקבלת תוצאות התרבית הטובות ביותר. ריכוז נמוך יותר יאיץ את התפוררות כיפת ה- ECM ויגדיל את התרחשותם של אורגנואידים הפונים כלפי חוץ. - השתמש בערכת Airway Organoid (טבלת חומרים) כדי להכין מדיית זריעה אורגנואידית של נתיבי אוויר (AOSM) ומדיית בידול (AODM) בהתאם להוראות היצרן.
- הכינו את המדיה הבסיסית האורגנואידית של דרכי הנשימה לפי טבלה 2.
| רכיב | נפח |
| DMEM/F-12 מתקדם | 500 מ"ל |
| האפס | 5 מ"ל |
| אלניל-גלוטמין | 5 מ"ל |
| פניצילין-סטרפטומיצין | 5 מ"ל |
טבלה 2: מרכיבי המדיה הבסיסית האורגנואידית של דרכי הנשימה
- השתמש במספר תאי האפיתל החיים של דרכי הנשימה שנותקו בסעיף 4.2 כדי לחשב כמה בארות ניתן לזרוע בצפיפות זריעה של 10,000 תאים (ראו טבלה 3).
- חשב את הנפח הכולל של ECM ו- AOSM הדרושים ליצירת 1 x 50 μL של כיפת ECM של 90% (45 μL של ECM ו- 5 μL של AOSM) לכל באר.
הערה: צפיפות הזריעה המומלצת של 10,000 תאים לבאר היא עבור תאי אפיתל אף מורחבים של CRC במעבר 1. תאי מעבר מאוחרים יותר עשויים לדרוש צפיפות זריעה גבוהה יותר כדי להשיג היווצרות של אותו מספר של אורגנואידים.
| מספר בארות | מספר התאים | מספר כיפות | כרך של מטריגל ECM | כרך של AOSM |
| 1 | 10,000 תאים | 1 | 45 מיקרו-אורך x 1.1 | 5 מיקרו-אורך x 1.1 |
| 2 | 20,000 תאים | 2 | 90 מיקרו-ל' x 1.1 | 10 מיקרו-ליטר x 1.1 |
| 5 | 50,000 תאים | 5 | 225 מיקרו-ליטר x 1.1 | 25 מיקרו-ליטר x 1.1 |
| ......... | ......... תאים | ......... | .........μL x 1.1 | .........μL x 1.1 |
טבלה 3: חישובים לזריעת תאי אפיתל בדרכי הנשימה בכיפות ECM
- זריעת תאי אפיתל בדרכי הנשימה בכיפות ECM
הערה: שמור ECM על קרח בכל עת ובצע את כל השלבים הכוללים ECM על קרח, מכיוון ש- ECM יתחיל להתמצק בטמפרטורות של >10 מעלות צלזיוס.- יש לתלות מחדש את תאי האפיתל של דרכי הנשימה המנותקים בסעיף 4.2 בנפח המחושב של 90% ECM לפי טבלה 3.
- החזקת הפיפטה בזווית של 90° (אנכית) קרוב ככל האפשר לתחתית הבאר, יש לחלק 50 μL (לתחנה הראשונה כדי למנוע יצירת בועות) של תרחיף תא ה-ECM למרכז הבאר. יש להימנע מלגעת בדופן הבאר.
- צלחת דגירה ב 37 מעלות צלזיוס במשך 20 דקות עד ECM מתמצק. בזמן שה-ECM מתמצק, יש לחמם את ה-AOSM ל-RT (15-25 מעלות צלזיוס) כדי למנוע ממנו לגרום לנזילות מחדש ולהתפוררות של כיפת ה-ECM עם ההוספה.
- הוסף 500 μL של AOSM מחומם לכל באר על ידי חלוקה לאורך קיר הבאר. אין להקפיץ את המדיה ישירות על כיפת ה-ECM.
- החלף מדיה כל יומיים למשך 4-7 ימים. כדי לשאוף מדיה, הטה את הלוח בזווית של 45° ושאף מהקצה התחתון של הבאר הרחק מכיפת ה- ECM.
- לאחר 4-7 ימים, התחל הבחנה אורגנואידית על ידי הוספת 500 μL של AODM (15-25 מעלות צלזיוס) לכל באר ושנה מדיה כל יומיים במשך 7 ימים.
- ציפוי מחדש של אורגנואידים אפיתל דרכי הנשימה ביום 7 של הבחנה
הערה: יש צורך בציפוי מחדש של אורגנואידים אפיתליאליים של דרכי הנשימה מכיוון שקצות כיפות ה- ECM מתפוררות בהדרגה במהלך תקופת התרבית בת השבועיים. אורגנואידים אפיתליאליים של דרכי הנשימה בקצה הכיפה עלולים ללכת לאיבוד (להתנתק לתוך המדיה) או להיות בעלי אוריינטציה אפיקלית-פונה-החוצה, כאשר אינם מוטמעים במלואם ב-ECM. שלב הציפוי מחדש גם "מנקה" את כיפת ה-ECM על ידי הסרת תאים/פסולת שאינם יוצרים בהצלחה אורגנואידים.- שאפו את התקשורת מכל באר. הוסף 500 μL של מדיה בסיסית אורגנואידית קרה של דרכי הנשימה (המכונה מעתה מדיה בסיסית) לכל באר.
- השתמש פיפטה P1000 מאז קצה פיפטה זה יש את הפתח הגדול ביותר והוא יקטין את הסבירות של אורגנואידים להתפוצץ במהלך pipetting. כוונן את הפיפטה ל-350 μL כדי למנוע יצירת בועות, ולאחר מכן פיפטה למעלה ולמטה בעדינות כדי לשבש את כיפת ה-ECM בכל באר. אסוף את כל המדיה ECM/Basal לתוך צינור צנטריפוגה של 15 מ"ל.
- יש לשטוף כל באר עם 500 μL של מדיה בסיסית קרה. אסוף את המדיה הבסיסית המכילה את כל ה- ECM והאורגנואידים הנותרים לתוך אותה שפופרת צנטריפוגה של 15 מ"ל כמו לעיל.
- צנטריפוגה ב 300 x גרם במשך 5 דקות ב 4 מעלות צלזיוס. מבין שלוש השכבות הנראות לאחר צנטריפוגה - (1) סופרנטנט, (2) ECM המכיל פסולת תאית (רכה) ו-(3) גלולה המכילה אורגנואידים - יש להשליך את שכבת הסופר-נאטנט וה-ECM ולשמר את הגלולה האורגנואידית.
- יש להוסיף 1 מ"ל של מדיה בסיסית קרה לכדור האורגנואידי ולפיפטה מעלה ומטה בעדינות כדי להפריד את כל ה-ECM הנותר. מוסיפים 6 מ"ל של חומר בסיסי קר לצינור ומערבבים בעדינות.
- צנטריפוגה ב 300 × גרם במשך 5 דקות ב 4 מעלות צלזיוס. השליכו את הסופר-נטנט.
- אם עודף ECM עדיין גלוי, חזור על שלבים 6.3.5- 6.3.6 כדי לבצע שטיפה נוספת.
- השהה את הכדור האורגנואידי בנפח מתאים של 90% ECM (השתמש ב- AODM במקום ב- AOSM) כדי לצלחת ~ 30 אורגנואידים לכל 50 μL של הכיפה.
- בדוק את צפיפות האורגנואידים מתחת למיקרוסקופ תרבית התאים (עדשה אובייקטיבית פי 4) לאחר ציפוי הכיפה הראשונה. אם צפוף מדי, הוסף עוד 90% ECM כדי להשיג את הצפיפות הרצויה של ~ 30 אורגנואידים.
- בצע את השלבים 6.2.3- 6.2.4 כדי לחזק את ECM ולהזין תאים כל יום שני עם 500 μL של AODM מחומם לכל באר במשך 14 ימים נוספים עד שהם מגיעים לבגרות (לאחר 21 ימים של התמיינות) עם היווצרות לומן מוקף אפיתל פסאודו-סטרטטיבי הפונה פנימה המכיל תאי בסיס, תאים סיליאטים ותאי גביע.
הערה: האורגנואידים האפיתליאליים של דרכי הנשימה המתוארים כאן נבדלים זה מזה באופן סופני ואינם ניתנים להעברה או להקפאה.
7. הדמיית תדר פעימות ריסונים
הערה: חלק זה של הפרוטוקול דורש מיקרוסקופ הדמיה של תאים חיים עם תא סביבתי של חימום ולחות, מצלמה מדעית בקצב פריימים מהיר (>100 הרץ), מטרה למרחק עבודה ארוך פי 20 ותוכנת הדמיה (עיין בטבלת החומרים עבור הציוד המומלץ המשמש בפרוטוקול זה).
- הגדרת מיקרוסקופ
- ודא שמערכת החימום במיקרוסקופ מופעלת ומאוזנת ל-37 מעלות צלזיוס. הפעל את המיקרוסקופ. התאם את הגז ל-5% CO 2 באמצעות מערבל גז CO2/אוויר.
- טען את בקבוק מודול הלחות שה- CO2 עובר דרכו במים מטוהרים. הגדר את הלחות היחסית ל-85% באמצעות בקר הבמה העליון, כך שהמים מחוממים והתאים מסופקים עם אוויר לח. משווים את התא למשך 30 דקות.
- הכניסו את צלחת המיקרוסקופ לתוך מחזיק המיקרוסקופ.
- העבירו את מודלי תאי האפיתל של דרכי הנשימה מהאינקובטור למיקרוסקופ על בלוק חום או חרוזים תרמיים בשיווי משקל ל-37 מעלות צלזיוס כדי לשמור על הדגימה בטמפרטורה פיזיולוגית.
- הכניסו את לוחית התרבית המכילה את דגמי תאי האפיתל של דרכי הנשימה לתוך צלחת המיקרוסקופ. סגור את התא הסביבתי של המיקרוסקופ.
- אפשרו לדגימה להתאזן בתא המיקרוסקופ המחומם מראש בטמפרטורה של 37 מעלות צלזיוס, 5% COמלא 2 למשך 30 דקות.
הערה: זמן שיווי משקל קצר יותר עשוי להספיק. ניתן לקבוע זאת על ידי ביצוע ניסוי כדי לזהות את הזמן הדרוש לייצוב CBF (עיין איור 3).
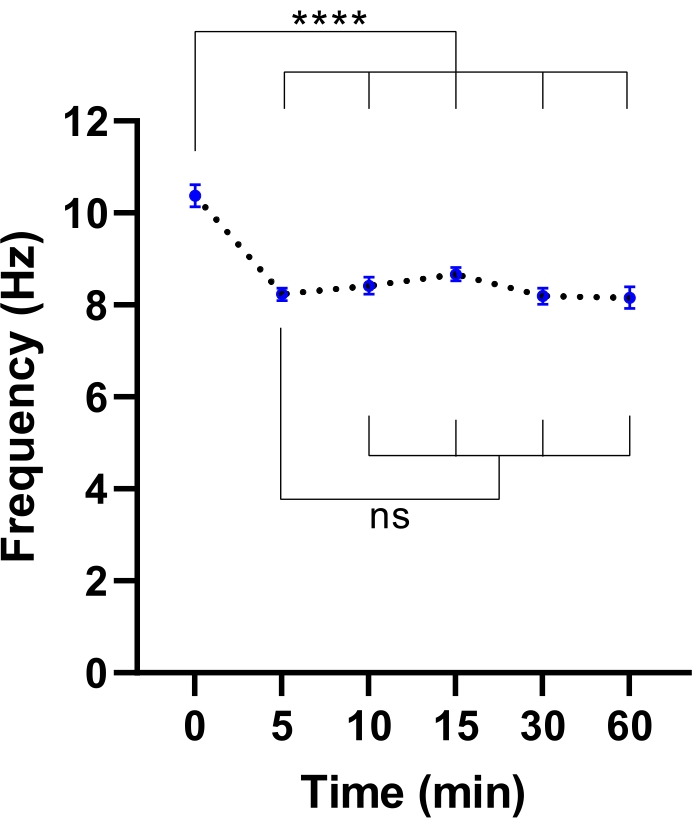
איור 3: ייצוב תדירות פעימות ציליאריות במיקרוסקופ הדמיה של תאים חיים. תארי נקודה של תדר פעימת ריסונים ממוצע (CBF) בתאי אפיתל דרכי הנשימה בממשק אוויר-נוזל (מודלים ALI) לאחר העברה למיקרוסקופ הדמיה של תאים חיים עם תא סביבתי. התא היה מאוזן ונשמר ב 37 מעלות צלזיוס, 5% CO2 ולחות יחסית של 85% במשך 30 דקות לפני פתיחת דלת התא והכנסת צלחת התרבית לתוך צלחת המיקרוסקופ. מודלים של תאים צולמו במשך 60 דקות במרווחי זמן שצוינו. מודלים של ALI נגזרו משני משתתפים עם CF. שש תמונות שדה ראייה (FOV) נרכשו לפי מודל ALI. כל נקודה (כחולה) מייצגת את ה-CBF הממוצע ב-12-36 תמונות FOV. הנתונים מיוצגים כממוצע ± SEM, כאשר הממוצע מחובר בקו מקווקו. ניתוח חד-כיווני של שונות (ANOVA) שימש לקביעת הבדלים סטטיסטיים. P < 0.0001, ns: אין משמעות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- במהלך תקופת שיווי המשקל, במחשב, פתח את תוכנת הרכישה. בחר את עדשת המטרה של מרחק עבודה ארוך פי 20.
- בעינית המיקרוסקופ, התמקדו בדגם התא (~Z = 8000 מיקרומטר).
- ודא שהמיקרוסקופ מוגדר לתאורת קולר כך שחוטי נורות מקור אור ההולכה לא יתמקדו במישור הדגימה, תוך הימנעות מממצאים בהדמיה. לשם כך בצע את השלבים 7.1.10-7.1.13
- סגור לחלוטין את דיאפרגמת קשתית השדה מעל המעבה. פתחו באיטיות את דיאפרגמת קשתית השדה והזיזו את המעבה למעלה/למטה עד להופעת צורת מתומן.
- אם דיאפרגמה קשתית השדה אינה מיושרת (כלומר, המתומן אינו נמצא במרכז שדה הראייה (FOV)), יישר אותו למרכז באמצעות מקשי Allen.
- לאחר יישור דיאפרגמה קשתית השדה, כוונן את מיקוד המעבה כדי להביא את המתומן למיקוד חד.
- פתח את דיאפרגמת קשתית השדה עד שלא ניתן עוד לראות אותה בתוך ה- FOV.
- באמצעות תוכנת הרכישה, לחץ על L100 כדי להעביר את נתיב האור ליציאה שבה המצלמה מותקנת. לחץ על כפתור ההפעלה הירוק (הפעלה) כדי לדמיין את המיקרוסקופ FOV באמצעות התוכנה. בדקו שהריסונים נמצאים בפוקוס והתאימו במידת הצורך.
- באמצעות תוכנת הרכישה, הגדר את המיקרוסקופ עם ההגדרות הבאות: מסננים: ריק; מעבה: ריק; פורמט: ללא כריכה; זמן חשיפה: 0.003 שניות; מצב קריאה: תריס גלילה; ROI: 512 × 512 פיקסלים.
הערה: זמן החשיפה מבוסס על התדר הגבוה ביותר שיש למדוד מכיוון שזמן חשיפה 1/חייב להיות לפחות כפול מתדירות זו. לדוגמה, אם הטווח הפיזיולוגי המרבי של מכות ריסונים = 30 הרץ, אז 1/זמן חשיפה = 60, וזמן החשיפה חייב להיות ≤ 0.016 שניות. בחר החזר על ההשקעה שלוכד קצב פריימים >100 הרץ.
- רכישת תמונות
- כדי להשיג תמונות קיטועי זמן מהתפריט, לחץ על רכוש ולאחר מכן לחץ על קיטועי זמן מהירים. בחלון המוקפץ, בחר מיקום שמירה ושם קובץ. רכוש 1000 מסגרות.
- לחץ על החל. לחץ על כפתור ההפעלה הירוק (הפעלה) כדי להציג תצוגה מקדימה של הריסונים במיקרוסקופ FOV ולהתאים את מוקד Z במידת הצורך. לחץ על הפעל עכשיו כדי ללכוד את קיטועי הזמן המהירים.
- לאחר לכידת קיטועי הזמן המהירים, לחץ על כפתור ההפעלה הירוק (הפעלה) כדי לדמיין את המיקרוסקופ FOV. באמצעות הג'ויסטיק של המיקרוסקופ, עברו לאורך ציר X/Y ל-FOV אחר.
- כוונן את מיקוד Z כדי להפוך את הריסונים למיקוד. לחץ על הפעל עכשיו כדי ללכוד עוד קיטועי זמן מהירים.
- חזור על שלבים 7.2.3-7.2.4. עבור מודלים ALI ואורגנואידים של דרכי הנשימה, תמונה 6x FOV בכל אחת מדגימות שכפול 3x. עבור יריעות אפיתל של דרכי הנשימה, דמיינו לפחות 4x תמונות משוכפלות לכל משתתף.
8. ניתוח וכימות נתונים של CBF
- הכנות לניתוח נתונים
הערה: חלק זה של הפרוטוקול דורש סקריפטי ניתוח מותאמים אישית (קובץ משלים 3), קבצי תמונה גולמיים (שנרכשו בסעיף 7.2), תוכנת מחשוב ותוכנת ניתוח.- התקן את תוכנת המחשוב, רצוי את הגרסה העדכנית ביותר, במחשב הניתוח. ודא כי ארגזי כלים סטנדרטיים של תוכנות מחשוב (elmat, ops, datafun, uitools, datatypes, iofun, iotools, audiovideo) וארגזי כלים לעיבוד תמונות ואותות מותקנים.
- העתק את סקריפטי הניתוח המותאמים אישית 'BeatingCiliaBatchOMEfiles_JOVE.m' ו- 'LoadRawDataExportFilteredMovies_JOVE.m' ותיקיית 'סקריפטים של תמיכה' לכונן המקומי של המחשב.
- בתוכנת המחשוב, לחץ על הכרטיסייה בית. לאחר מכן לחץ על הגדר נתיב (איור 4A-B).
- בחלון המוקפץ, לחץ על הוסף עם תיקיות משנה (איור 4C). תחת 'נתיב חיפוש MATLAB', בחרו את התיקיות המוצגות באיור 4D, ולאחר מכן לחצו על 'שמור וסגור' (איור 4E-F).
- ודא שסקריפטי הניתוח מקושרים לתוכנת המחשוב על-ידי בדיקה שהם מופיעים בלוח השמאלי (איור 4G).
- העבר את קבצי התמונה הגולמיים (תבנית סביבת מיקרוסקופיה פתוחה (OME) שנרכשו בסעיף 7.2 לכונן המקומי של המחשב.
הערה: ניתן לגשת לקובצי תמונה גולמיים לדוגמה בכתובת: https://doi.org/10.6084/m9.figshare.16649878.v1.
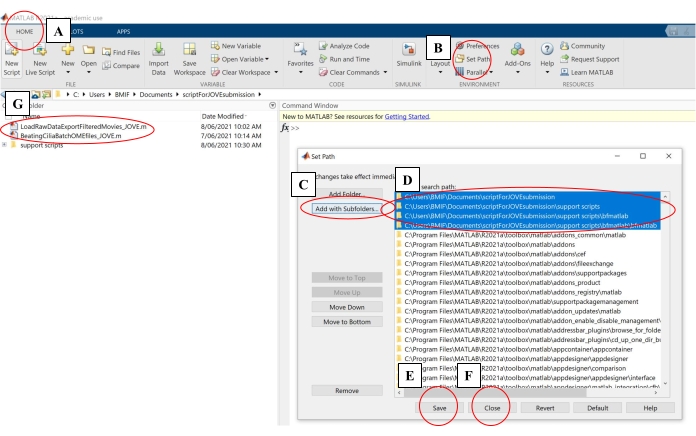
איור 4: הגדרת תוכנת מחשוב לניתוח נתונים. (A) פתח את הכרטיסייה בית . (B) בחר קבע נתיב. (C) בחר הוסף עם תיקיות משנה. (D) בחר תיקיות המכילות את סקריפטי הניתוח. (E) בחר שמור. (F) בחר סגור. (G) תסריטי הניתוח יופיעו בחלונית השמאלית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- כימות CBF על ידי זיהוי שיא של ספקטרום העוצמה של פיקסלים בודדים
- פתח את תוכנת המחשוב. לחץ על קובץ סקריפט הניתוח 'BeatingCiliaBatchOMEfiles_JOVE.m' (איור 5A).
- לחץ על הכרטיסייה עורך ולאחר מכן לחץ על כפתור ההפעלה הירוק (הפעלה) כדי להפעיל את הסקריפט (איור 5B-C). בחלון ההנחיה, בחר את קובצי התמונה הגולמיים לניתוח (איור 5D).
- הזן את זמן החשיפה משלב 7.1.15 בחלון הבקשה לזמן רכישה לכל מסגרת, ולאחר מכן לחץ על אישור (איור 5E).
- המתן ~ 15 דקות לכל קובץ בזמן שהסקריפט מחשב ומפיק פלט של ה- CBF בקובץ 'AveSpectrum' (קובץ משלים 4), שנשמר באופן אוטומטי באותה תיקייה כמו קבצי התמונה הגולמיים. הצג את ההתקדמות באופן חזותי דרך מד ההתקדמות (איור 5F).
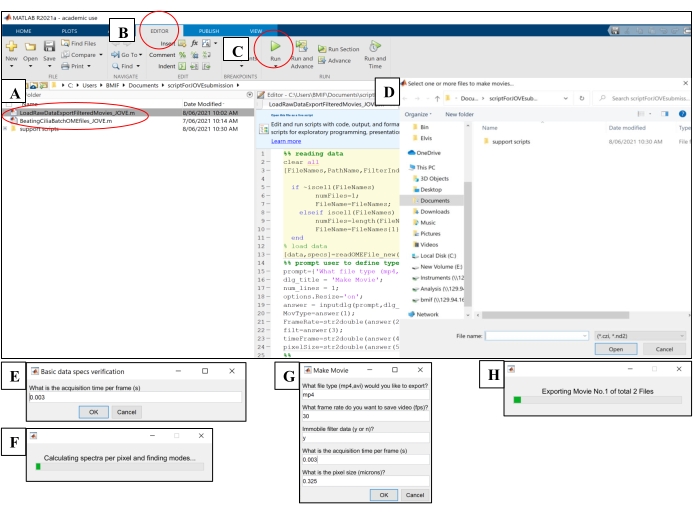
איור 5: הרצת סקריפטי ניתוח באמצעות תוכנת מחשוב . (A) פתח את התסריט לניתוח CBF ('BeatingCiliaBatchOMEfiles_JOVE.m') או ליצירת סרט מכות ריסונים ('LoadRawDataExportFilteredMovies_JOVE.m'). (B) פתח את הכרטיסייה עורך . (C) בחר בלחצן ההפעלה (הפעלה) הירוק כדי להפעיל את סקריפט הניתוח. (D) חלון הנחיה ידרוש בחירה של קבצים לצורך ניתוח או יצירת סרטים. (E) בעת הפעלת הסקריפט 'BeatingCiliaBatchOMEfiles_JOVE.m', תופיע הנחיה להזין ידנית את זמן הרכישה לכל מסגרת (ים) למקרה שהסקריפט לקריאת קבצים אינו קורא את המטא-נתונים כראוי. (F) מד התקדמות המציין את תדירות פעימות הריסונים המחושבת. (G) בעת הפעלת הסקריפט 'LoadRawDataExportFilteredMovies_JOVE.m', תופיע הנחיה להזין באופן ידני את סוג הסרט שיופק (mp4 או avi), קצב הפריימים של הסרט (FPS), אם הרכיב ללא תנועה יוסר מנתוני הסרט ('y' או 'n'), זמן המסגרת (ים) וגודל הפיקסלים (מיקרונים) של הנתונים המיוצאים לסרט. מומלץ להשתמש ב-'y' לסינון ללא תנועה מכיוון שהוא יסיר ריר או כל שכבה חסרת תנועה חוסמת אחרת בנתונים. (H) מד התקדמות לציון סרט מיוצא. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- הפעל את הסקריפט 'GetFirstAmplitude.m' בתיקייה המכילה את קבצי 'AveSpectrum' באמצעות התהליך בשלבים 8.2.1-8.2.2. המתן עד שהסקריפט יפיק את הקובץ 'FirstAmplitudeStacked.xlsx', המכיל את התדר בעל המשרעת הגבוהה ביותר ונמצא בטווח הפיזיולוגי של מכות אפיתל בדרכי הנשימה, ≥3 ו- <30 הרץ.
- העתק את ערכי התדירות מהקובץ והעלילה 'FirstAmplitudeStacked.xlsx' באמצעות תוכנת ניתוח מדעית.
הערה: הסבר על האופן שבו סקריפט הניתוח המותאם אישית מכמת את CBF מסופק בקובץ משלים 5. ניתן לגשת לערכות נתונים מנותחות לדוגמה בכתובת: https://doi.org/10.6084/m9.figshare.16649815.
- ייצוא סרטון של הכאת ריסונים
- פתח את תוכנת המחשוב. לחץ על קובץ הסקריפט 'LoadRawDataExportFilteredMovies_JOVE.m' (איור 5A) כדי לטעון את הסקריפט.
- לחץ על הכרטיסייה עורך ולאחר מכן לחץ על כפתור ההפעלה הירוק (הפעלה) כדי להפעיל את הסקריפט (איור 5C). בחלון ההנחיה, בחרו בקובצי התמונה הגולמיים לייצוא לקובצי סרטים (איור 5D).
- הזן את ההגדרות המפורטות בטבלה 4 בחלון המוקפץ 'צור סרט' (איור 5G).
- המתן ~ 8 דקות לכל קובץ בזמן שהסקריפט יוצר את קובצי הסרט ומפיק אותם למיקום של קובצי התמונה הגולמיים. הצג את ההתקדמות באופן חזותי דרך מד ההתקדמות (איור 5H).
| קלט סרטים | תיאור: __________ |
| סוג הקובץ | הזן את סוג הקובץ שברצונך לייצא (mp4 או avi). |
| קצב פריימים | הזן את קצב הפריימים שבו יש לייצא את הסרט. אם יש לך ~ 1000 מסגרות לכל סדרה זמן שנרכשה, מומלץ להגדיר קצב פריימים ~ 30 fps. |
| סינון ללא תנועה | האפשרויות הן 'y' או 'n'. ברירת המחדל היא 'y', וסקריפט סינון הזמן מסיר, באמצעות שטח פורייה, כל רכיב חסר תנועה מנתוני הסרט. בדרך כלל, כל שכבות התאים תחת ריסונים או ריר ללא תנועה יתרמו רכיב היסט בתדר אפס או רכיב אינווריאנט זמן באות שניתן לסנן החוצה. |
| זמן רכישה לכל פריים | זמן הרכישה לכל מסגרת של נתונים שנרכשו. הוא משמש להצגת חותמת זמן בסרט תוך שניות. |
| גודל פיקסל | גודל הפיקסלים במיקרומטרים משמש להצגת סרגל קנה מידה בסרט במיקרומטרים. |
טבלה 4: הגדרות קלט ליצירת סרטים
תוצאות
כדי להדגים את היעילות של פרוטוקול זה בכימות CBF, מוצגות התוצאות של CBF שנמדדו במודלים של תאי אפיתל ALI של דרכי הנשימה שמקורם בשלושה משתתפים עם CF ושלושה משתתפי בקרה בריאים. ביום ה-14 של ההבחנה התרבית, הריסונים המנצחים היו נוכחים (איור 6). מיום 14 עד 21 של בידול תרביות, נצפתה עלייה מובה?...
Discussion
ישנם גורמים רבים שיכולים לטשטש את הכימות של CBF ביריעות אפיתל האף. יש לדמות יריעות אפיתל תוך 3-9 שעות מאיסוף הדגימה מכיוון שהפונקציה הציליארית יציבה ביותר בתקופה זו37. פחות תאי דם אדומים ופסולת הם האופטימליים ביותר להדמיה, שכן אלה מפריעים לאיסוף הנתונים. בעת בחירת ROI להדמיה, חשוב ?...
Disclosures
המחברים מצהירים כי אין להם מה לחשוף.
Acknowledgements
אנו מודים למשתתפי המחקר ולמשפחותיהם על תרומתם. אנו מעריכים את הסיוע של בתי החולים לילדים בסידני (SCH) מחלקת הנשימה של רנדוויק בארגון ואיסוף של ביופסימנים של חולים - תודה מיוחדת לד"ר ג'ון וידג'ר, ד"ר איבון בלסיס, ליאן פלוס, אמנדה תומפסון ורונדה בל. אנו מודים על עזרתם של איווטה סלפסטובה ורנה וון ממתקן המיקרוסקופיה הקלה של קתרינה גאוס במרכז האנליטי ע"ש מארק ויינרייט ב- UNSW Sydney. עבודה זו נתמכת על ידי המועצה הלאומית לבריאות ומחקר רפואי (NHMRC) אוסטרליה (GNT1188987), קרן CF אוסטרליה וקרן בית החולים לילדים בסידני. המחברים רוצים להודות לברית Luminesce - חדשנות לבריאות ילדים על תרומתה ותמיכתה. Luminesce Alliance - חדשנות לבריאות ילדים הוא מיזם משותף ללא מטרות רווח בין רשת בתי החולים לילדים בסידני, מכון המחקר הרפואי לילדים והמכון לסרטן ילדים. הוא הוקם בתמיכת ממשלת NSW כדי לתאם ולשלב מחקר ילדים. Luminesce Alliance מסונפת גם לאוניברסיטת סידני ולאוניברסיטת ניו סאות' ויילס סידני. KMA נתמך על ידי מלגת תוכנית הכשרה למחקר של ממשלת אוסטרליה. LKF נתמך על ידי מועדון רוטרי של קרן בית החולים לילדים סידני קוב / סידני ומלגות לתואר שני של אוניברסיטת UNSW.
Materials
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O'Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O'Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved