Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Collecte, expansion et différenciation de modèles de cellules épithéliales nasales nasales humaines primaires pour la quantification de la fréquence des battements de cils
Dans cet article
Résumé
Ce protocole décrit la collecte, l’expansion et la différenciation des cellules épithéliales nasales en modèles organotypiques de cellules épithéliales des voies respiratoires et la quantification de la fréquence des battements de cils via l’imagerie de cellules vivantes et des scripts personnalisés.
Résumé
Les mesures de la fonction des cils (fréquence des battements, modèle) ont été établies comme outils de diagnostic pour les maladies respiratoires telles que la dyskinésie ciliaire primitive. Cependant, l’application plus large de ces techniques est limitée par l’extrême susceptibilité de la fonction ciliaire aux changements de facteurs environnementaux, par exemple la température, l’humidité et le pH. Dans les voies respiratoires des patients atteints de mucoviscidose (FK), l’accumulation de mucus empêche les cils battants. La fonction des cils a été étudiée dans des modèles de cellules des voies respiratoires primaires en tant qu’indicateur de l’activité du canal CFTR (Transmembrane Conductance Regulator) de la FC. Cependant, une variabilité considérable d’un patient à l’autre dans la fréquence des battements de cils a été observée en réponse aux médicaments modulateurs du CFTR, même pour les patients présentant les mêmes mutations CFTR . De plus, l’impact de la sécrétion de chlorure régulée par le CFTR sur la fonction ciliaire est mal compris. Il n’existe actuellement aucun protocole complet démontrant la préparation d’échantillons de modèles de voies respiratoires in vitro , l’acquisition d’images et l’analyse de la fréquence de battement des cils (CBF). Des conditions de culture normalisées et l’acquisition d’images effectuées dans des conditions environnementales contrôlées permettraient une quantification cohérente et reproductible du FBC entre les individus et en réponse aux médicaments modulateurs du CFTR. Ce protocole décrit la quantification du CBF dans trois systèmes différents de modèles de cellules épithéliales des voies respiratoires : 1) les feuilles épithéliales natives, 2) les modèles d’interface air-liquide imagés sur des inserts de support perméables et 3) les organoïdes tridimensionnels intégrés dans la matrice extracellulaire. Les deux derniers reproduisent la physiologie pulmonaire in vivo , avec des cils battants et la production de mucus. La fonction ciliaire est capturée à l’aide d’une caméra vidéo haute vitesse dans une chambre contrôlée par l’environnement. Des scripts personnalisés sont utilisés pour l’analyse des CBF. L’application des mesures de la FBC à la clinique est envisagée comme un outil clinique important pour prédire la réponse aux médicaments modulateurs du CFTR par patient.
Introduction
Les mesures de la fréquence et du profil des battements des cils (CBF) ont été établies comme outils de diagnostic pour les maladies respiratoires telles que la dyskinésie ciliaire primitive (DCP)1. Dans la mucoviscidose (FK), le dysfonctionnement du canal chlorure du régulateur de conductance transmembranaire (CFTR) de la mucoviscidose provoque une déshydratation du liquide de surface des voies respiratoires et une altération de la clairance mucociliaire2. La fonction ciliaire a été étudiée in vitro dans des modèles de cellules des voies respiratoires primaires en tant qu’indicateur de l’activité des canaux CFTR3. Cependant, il existe une variabilité considérable d’un patient à l’autre dans la FBC en réponse aux médicaments modulateurs du CFTR, même pour les patients présentant les mêmes mutations CFTR 3. De plus, l’impact de la sécrétion de chlorure régulée par le CFTR sur la fonction ciliaire est mal compris. Il n’existe actuellement aucun protocole complet démontrant la préparation d’échantillons de modèles in vitro des voies respiratoires, l’acquisition d’images et l’analyse du CBF.
Les feuilles épithéliales nasales isolées des brossages de la muqueuse nasale sont directement utilisées pour les mesures de la fonction ciliaire pour le diagnostic de la DCP4. Pourtant, bien qu’il n’y ait aucun contrôle sur la taille ou la qualité des feuillets épithéliaux nasaux obtenus, le FBC varie selon qu’il est mesuré sur des cellules individuelles ou des feuillets cellulaires et sur des bords ciliés de la feuille épithéliale qui sont perturbés ou nonperturbés 5. En tant que telles, les dyskinésies secondaires causées par des dommages aux cellules lors du prélèvement des brossages de la muqueuse nasale peuvent influencer le CBF. La culture cellulaire primaire de cellules épithéliales nasales et leur différenciation à l’interface air-liquide (ALI) ou dans la matrice tridimensionnelle de la membrane basale en organoïdes épithéliaux ciliés des voies respiratoires donnent naissance à des cils exempts de dyskinésies secondaires 4,6,7,8. Les cellules épithéliales des voies respiratoires différenciées à l’ALI (ci-après appelées modèles ALI) ont été considérées comme une aide diagnostique secondaire importante qui reproduit les modèles de battements ciliaires et la fréquence des brossages ex vivo de la muqueuse nasale6 et permet l’analyse de l’ultrastructure ciliaire, du diagramme des battements et de la fréquence des battements tout en conservant les défauts spécifiques au patient9 . Pourtant, des divergences existent dans les méthodologies utilisées pour créer ces modèles cellulaires différenciés mucociliaires pseudostratifiés. Différents protocoles d’expansion ou de différenciation de la culture pourraient induire des phénotypes épithéliaux distincts (ciliés ou sécrétoires)10 et entraîner des différences significatives dans le CBF11. Le FBC a été quantifié dans les brossages épithéliaux nasaux 4,6,12,13,14,15,16, les organoïdes épithéliaux des voies respiratoires 14,17,18 et les modèles ALI 3,4,6,13,19,20, 21. Pourtant, parmi ces protocoles, il existe de grandes variabilités, et souvent de nombreux paramètres ne sont pas contrôlés. Par exemple, dans certaines études, le CBF est imagé in situ alors que les cellules du modèle ALI restent sur l’insert de support perméable 3,19,20,21, encore d’autres grattent les cellules de l’insert de support perméable et les imagent en suspension dans les milieux 4,6,13.
En outre, l’application plus large des techniques de mesure de la fonction ciliaire est limitée par l’extrême susceptibilité de la fonction ciliaire aux changements dans les facteurs environnementaux. Des facteurs environnementaux tels que la température 22, l’humidité 23,24 et le pH 25,26 influencent la fonction ciliaire et doivent être régulés pour quantifier le CBF avec précision. Les différents paramètres physiologiques utilisés dans différents laboratoires et leur influence sur le FBC ont été examinés précédemment27.
Diverses technologies d’imagerie et approches de mesure CBF sont rapportées dans la littérature. Pour le diagnostic PCD, la microscopie vidéo est utilisée pour mesurer la fonction ciliaire28,29. Récemment, un algorithme d’analyse vidéo basé sur la microscopie dynamique différentielle a été utilisé pour quantifier la coordination CBF et des cils dans les modèles ALI des cellules épithélialesdes voies respiratoires 3,30. Cette méthode permet de caractériser les battements ciliaires dans les cellules épithéliales des voies respiratoires de manière rapide et entièrement automatisée, sans qu’il soit nécessaire de segmenter ou de sélectionner des régions. Diverses méthodes d’imagerie et de quantification du FBC peuvent s’ajouter aux différences signalées dans le FLC dans la littérature (dossier supplémentaire 1).
Un protocole allant de la culture à la quantification pour rationaliser les méthodes existantes, la normalisation des conditions de culture et l’acquisition d’images, effectué dans des conditions environnementales strictes contrôlées, permettrait une quantification cohérente et reproductible du FBC au sein des individus et entre eux.
Ce protocole fournit une description complète de la collecte de cellules épithéliales, des conditions de culture d’expansion et de différenciation et de la quantification du CBF dans trois systèmes différents de modèles de cellules épithéliales des voies respiratoires d’origine nasale : 1) des feuilles épithéliales natives, 2) des modèles ALI imagés sur des inserts de support perméables et 3) des organoïdes tridimensionnels intégrés à la matrice extracellulaire (ECM) (Figure 1 ). Les cellules épithéliales nasales obtenues à partir de brossages de cornets nasaux inférieurs sont utilisées comme représentants de l’épithélium des voies respiratoires, car elles constituent un substitut efficace pour les cellules épithéliales bronchiques31 tout en surmontant la procédure invasive associée à la collecte des brossages bronchiques. La méthode de cellule de reprogrammation conditionnelle (CRC) est utilisée pour développer les cellules épithéliales primaires des voies respiratoires pour la création de modèles ALI et d’organoïdes tridimensionnels. La reprogrammation conditionnelle des cellules épithéliales des voies respiratoires à un état semblable à celui des cellules souches est induite par co-culture avec le système de cellules nourricières de fibroblastes arrêté par croissance et l’inhibiteur de la kinase associée à Rho (ROCK)32. Il est important de noter que la méthode du CCR augmente le doublement de la population dans les cellules épithéliales des voies respiratoires tout en conservant leur potentiel de différenciation tissulairespécifique 33,34. Dans tous les modèles de cellules épithéliales des voies respiratoires, la fonction ciliaire est capturée dans une chambre à température contrôlée à l’aide d’une caméra vidéo haute vitesse avec des paramètres d’acquisition d’image standardisés. Des scripts personnalisés sont utilisés pour la quantification du CBF.

Figure 1 : Schéma du flux de travail. Après le brossage du turbiné inférieur nasal des participants, les cellules épithéliales des voies respiratoires sont utilisées de deux façons. Soit les feuilles épithéliales des voies respiratoires sont isolées et la fréquence des battements de cils est imagée immédiatement, soit les cellules épithéliales des voies respiratoires sont étendues via la méthode des cellules de reprogrammation conditionnelle. Les cellules épithéliales des voies respiratoires élargies par le CRC sont différenciées pour établir des cellules épithéliales des voies respiratoires à une interface air-liquide ou des cultures organoïdes épithéliales des voies respiratoires. L’imagerie de la fréquence des battements ciliaires est acquise à l’aide d’un microscope d’imagerie à cellules vivantes avec une chambre environnementale de chauffage et d’humidité et une caméra scientifique à fréquence d’images rapide (>100 Hz). L’analyse des données est effectuée à l’aide de scripts personnalisés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
L’étude a été approuvée par le Sydney Children’s Hospital Network Ethics Review Board (HREC/16/SCHN/120). Le consentement écrit de tous les participants (ou de leur tuteur) a été obtenu avant le prélèvement des échantillons biologiques.
1. Préparations pour l’établissement de modèles de cellules épithéliales des voies respiratoires
- Préparer le milieu de prélèvement des cellules nasales en combinant 80 % de milieu aigle modifié de Dulbecco et 20 % de sérum bovin fœtal. Compléter avec 1 μL/mL de pénicilline/streptomycine. Conserver à 4 °C jusqu’à 3 mois.
- Enduisez les flacons ou les inserts de support perméables de solution de collagène par besoin en suivant les étapes 1.2.1-1.2.4. Ne stockez pas les vaisseaux recouverts de collagène à long terme.
- Faire une dilution de 1:100 de la solution de collagène de type I (3 mg/mL de stock) avec une solution saline tamponnée au phosphate (PBS) jusqu’à une concentration finale de 0,03 mg/mL. Bien mélanger.
- Enduire les flacons de culture cellulaire (section 4) de 160 μL/cm2 (c.-à-d. 4 mL par fiole T25) et les inserts de support perméables (section 5) de 455 μL/cm2 (c.-à-d. 150 μL par insert de 6,5 mm) de la solution de collagène préparée.
- Incuber à 37 °C pendant 2-24 h.
- Retirer la solution de collagène à l’aide d’une pipette ou d’un aspirateur sous vide avant d’ensemencer les cellules. Ne pas laver le récipient avant d’ensemencer les cellules.
- Préparez les supports CRC (Conditional Reprogramming Cell) en combinant les composants32 répertoriés dans le Tableau 1. Stériliser le filtre à l’aide d’un système de filtre sous vide à bouchon de bouteille. Conserver à 4 °C jusqu’à 2 mois.
- Le jour de l’utilisation, ajouter le facteur de croissance épidermique humain, l’inhibiteur de ROCK et les antibiotiques comme indiqué dans le tableau 1.
| Composant | Volume |
| DMEM, glycémie élevée | 156,7 mL |
| DMEM/F-12, HEPES | 313,3 mL |
| Hydrocortisone | 55,6 μL |
| Insuline | 1,25 mL |
| Toxine cholérique | 21 μL |
| Adénine | 1,2 mL |
| HI-FBS | 25 mL |
| Pénicilline-streptomycine | 5 mL |
| Facteur de croissance épidermique humain | 1 μL/mL |
| Inhibiteur de ROCK | 1 μL/mL |
| Fonfonzone | 2 μl/ml |
| Tobramycine | 2 μL/mL |
| Hydrate de ceftazidime | 4 μL/mL |
| Solution de gentamicine | 1 μL/mL |
Tableau 1 : Composants pour 500 mL de milieu cellulaire de reprogrammation conditionnelle
2. Collecte de brossages de cornets nasaux inférieurs
REMARQUE : Cette section du protocole exige un tube de prélèvement (50 mL) muni d’un milieu de prélèvement de cellules nasales, de brosses de cytologie, de mouchoirs en papier et d’un équipement de protection individuelle approprié. Évitez de vous brosser les dents lors d’une infection des voies respiratoires supérieures. Il y a un petit risque de saignement, qui est augmenté si l’inflammation est présente. Si le but du brossage est d’obtenir des feuilles épithéliales des voies respiratoires pour des mesures ex vivo du FBC, le brossage doit avoir lieu au moins 6 semaines après toute infection des voies respiratoires supérieures; Idéalement, plus de 10 semaines après l’infection35.
- Préparez le milieu de prélèvement nasal (section 1) et gardez le tube sur de la glace.
- Décrivez la procédure au participant comme inconfortable. Expliquez qu’une sensation complète est ressentie dans la narine pendant le brossage, semblable à sauter dans l’océan / piscine et l’eau se précipiter dans le passage nasal. Informez les participants que la procédure induira la production de larmes par réflexe.
- Évaluez quel positionnement convient au participant. Posez le participant en décubitus dorsal si un divan d’examen est disponible, car le placement couché sur le dos empêche le mouvement de la tête du participant loin de la brosse pendant la procédure. Sinon, asseyez le participant à côté d’un mur, contre lequel il peut appuyer sa tête en arrière.
- Inspectez le passage nasal. Notez la déviation septale, les polypes et toute autre anomalie anatomique pouvant affecter le passage de la brosse dans le passage nasal et augmenter le risque de saignement.
- Nettoyez le nez de l’excès de mucus en demandant aux participants de se moucher dans un mouchoir.
- Demandez au participant de respirer par la bouche. Prenez un pinceau cytologique dans la main dominante. Tout en posant le cinquième doigt sur le menton du participant pour ancrer la main, insérez la brosse cytologique dans le passage nasal du participant (Figure 2). Insérez la brosse à ~45° sur le visage du participant pour passer à travers le méat nasal.
- Faites pivoter le pinceau vers le haut de manière à ce qu’il soit perpendiculaire au visage du participant. Avancer doucement mais fermement la brosse contre la paroi latérale du nez sous le cornet inférieur jusqu’à ce qu’il soit à la partie moyenne à postérieure du cornet inférieur.
REMARQUE: Éviter la sur-insertion; Si une baisse soudaine de la résistance est ressentie, le pharynx nasal a été pénétré et la brosse doit être rétractée jusqu’à ce que la résistance soit à nouveau ressentie par le procéduraliste. - Faites pivoter la brosse de 360° jusqu’à trois fois. Retirez doucement la brosse à l’inverse de la manœuvre d’insertion, afin que les cellules ne soient pas délogées de la brosse.
- Placez la brosse dans le tube de collecte préparé avec le milieu de collecte de cellules nasales. Placez le tube de collecte sur de la glace.
- Répétez le brossage dans la deuxième narine si le participant est d’accord ou si un grand nombre de cellules sont nécessaires (par exemple, pour initier la culture cellulaire).
REMARQUE: La même narine peut être brossée à nouveau s’il n’y avait pas de cellules sanguines visibles sur la brosse, notant, cependant, que le risque de saignement est légèrement augmenté avec un deuxième brossage dans la même narine.
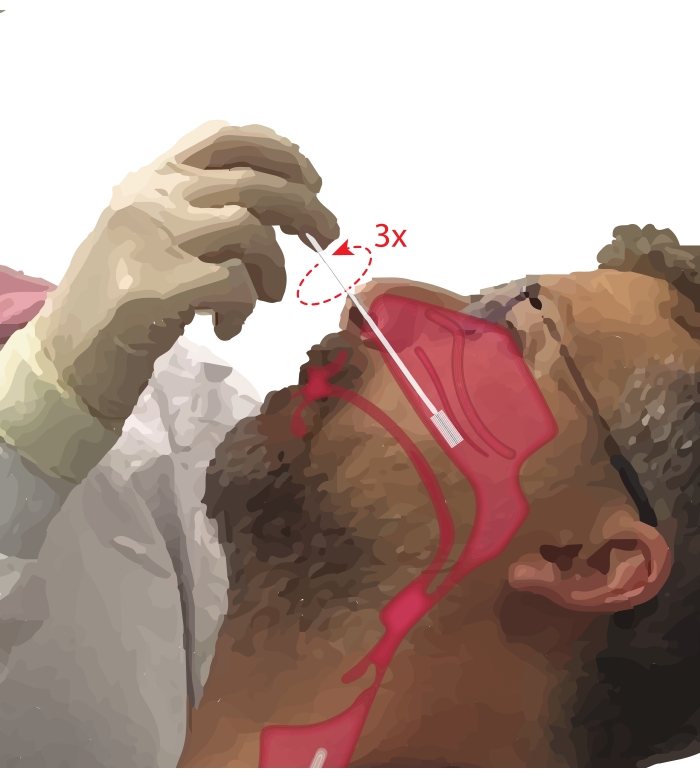
Figure 2 : Collecte de cellules épithéliales nasales. Illustration de l’emplacement du pinceau cytologique dans la partie moyenne à postérieure du turbiné inférieur. Cette position est atteinte en insérant la brosse à travers les narines, en faisant pivoter la brosse à un angle de 90° par rapport au visage et en guidant la brosse le long du passage nasal sous le turbiné inférieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparation des feuillets épithéliaux des voies respiratoires
REMARQUE : Cette section du protocole exige un tube de prélèvement (brosse(s) cytologique + 1 mL de milieu de prélèvement de cellules nasales) (section 2) et une plaque à fond plat à 96 puits. Si vous prélevez des brossages de cornets nasaux dans le but d’imager des feuilles épithéliales des voies respiratoires, n’utilisez que 1 mL de milieu de prélèvement de cellules nasales sans antibiotiques; Sinon, les feuilles épithéliales seront trop dispersées pour l’imagerie.
- Remuez doucement le tube de prélèvement contenant la ou les brosses cytologiques pour déloger les feuilles épithéliales des voies respiratoires de la ou des brosses.
- Rassemblez tous les supports et cellules à l’aide d’une pipette P1000. Distribuer 5-6 gouttes dans un puits d’une assiette à fond plat de 96 puits. Répéter pour environ sept puits.
- Transférer la plaque au microscope conformément à l’étape 7.1.4 et suivre le reste de la section 7 pour imager la fréquence de battement des cils.
- Images de feuillets épithéliaux (Figure 1) et non de cellules isolées puisqu’il a été démontré que la fonction ciliaire diffère entre les feuillets épithéliaux et les cellules simples non attachées5.
4. Expansion et entretien des cellules épithéliales des voies respiratoires
- Culture d’expansion cellulaire conditionnelle de reprogrammation conditionnelle des voies respiratoires
REMARQUE : Récipient recouvert d’une solution de collagène (section 1), cellules embryonnaires de souris irradiées (NIH-3T3), milieu des cellules de reprogrammation conditionnelle (CRC) (section 1), brosse(s) cytologique dans les milieux de collecte de cellules nasales (section 2).- Plaquer des cellules nourricières irradiées dans un ou plusieurs récipients de culture enrobés de solution de collagène préparée à une densité d’ensemencement de 8 000 cellules/cm2 au moins 2 h et pas plus de72 heures avant la co-culture avec des cellules épithéliales des voies respiratoires (voir36 pour la culture de cellules nourricières et l’irradiation).
- Transférer les cellules brossées dans le tube de prélèvement (brosse(s) cytologique + milieu de collecte de cellules nasales) dans le vortex sur la glace. À basse vitesse, tube vortex allumé, 10 s éteint (garder sur la glace entre les deux) pour déloger les cellules de la ou des brosses. Un vortex vigoureux peut diminuer la viabilité cellulaire. Inspectez la ou les brosses pour vérifier si le mucus est toujours adhérent. Si c’est le cas, répétez le vortex.
- Transférez le(s) tube(s) sur la glace dans l’enceinte de biosécurité. Utilisez une pipette sérologique pour transférer le média du tube collecteur vers un nouveau tube (tube B), en laissant derrière lui les brosses cytologiques. Tube à centrifuger B à 300 × g pendant 7 min à 4 °C.
- Retirez le tube B de la centrifugeuse, jetez le surnageant. Si le mucus est visible, laver la pastille avec un autre 5 ml de milieu de collecte de cellules nasales et centrifuger à nouveau.
- Ajouter 1 mL de milieu CRC pour remettre en suspension la pastille cellulaire dans le tube B. À l’aide d’une pipette sérologique de 5 mL, faire passer les cellules à travers un tamis cellulaire placé sur un tube de 50 ml (tube C) dans un mouvement circulaire.
- Répétez plusieurs fois pour former une suspension unicellulaire. Recueillir le média résiduel du fond du tamis et l’incorporer au média. Jetez le tamis cellulaire.
- À l’aide d’une pipette sérologique de 5 mL, prélever 1 mL de média du tube C et le transférer dans un tube microcentrifugeux.
- Prenez 10 μL de cette suspension cellulaire et ajoutez-la au tube microcentrifuge pré-aliquote avec 10 μL de bleu trypan. Bien mélanger et utiliser immédiatement un compteur de cellules automatisé pour enregistrer le nombre de cellules et la viabilité.
- Ensemencer les cellules épithéliales des voies respiratoires dans le ballon T25 pré-ensemencé avec des cellules nourricières irradiées.
- Entretien et dissociation des cellules épithéliales des voies respiratoires
REMARQUE : Le média CRC doit être chauffé à 37 °C en le plaçant dans un bain-marie de laboratoire à température contrôlée ou un bain de billes avant d’être ajouté aux cellules.- Vérifiez régulièrement les cellules sous le microscope à culture cellulaire (4 × lentille objective) pour détecter la fixation, la contamination, la morphologie et la confluence.
- Changez de support CRC tous les deux jours. Lorsque des cellules reprogrammées sont observées (Figure 1) et qu’il n’y a pas de contamination, réduire ou retirer les antibiotiques.
- Lorsque les cellules atteignent une confluence de 90 %, utiliser une méthode de double trypsine32 pour dissocier les cellules et effectuer un comptage cellulaire tel que décrit à l’étape 4.1.8 (voir le dossier supplémentaire 2 pour la dissociation cellulaire et la congélation).
5. Ensemencement et différenciation des cellules épithéliales des voies respiratoires et maintien de modèles d’ALI différenciés
- Ensemencement des cellules épithéliales des voies respiratoires vers des inserts de support perméables
- Transférer les inserts de support perméables revêtus de solution de collagène (section 1) de l’incubateur de CO2 à l’armoire de biosécurité. Aspirer la solution de collagène et jeter. Ajouter 750 μL de milieu d’expansion (sans antibiotiques) dans le compartiment basal des inserts de support perméables.
- Transférer les cellules dissociées ou décongelées sur la glace dans l’enceinte de biosécurité. Ajouter le volume de milieu d’expansion nécessaire pour ensemencer 200 000 à 250 000 cellules dans 150 μL dans le compartiment apical de chaque insert de support perméable.
- Attention à ne pas créer de bulles; Bien mélanger pour s’assurer que les cellules sont homogènes et en suspension. Ajouter 150 μL de la suspension cellulaire à la face apicale de chaque insert de support perméable.
- Remettez les cellules en suspension après l’ensemencement tous les trois inserts de support perméables pour maintenir une suspension cellulaire homogène.
- Tous les deux jours, jusqu’à ce qu’une monocouche de cellules confluentes soit formée (généralement au jour 4 après l’ensemencement), jeter le milieu et ajouter un nouveau milieu d’expansion chauffé à température ambiante (RT, 15-25 °C).
- Différenciation des cellules épithéliales des voies respiratoires à l’interface air-liquide
- Chauffer les milieux ALI (sans antibiotiques) à TA (15-25 °C).
- Retirez le milieu d’expansion et passez au milieu de différenciation (ALI) sur les compartiments apical et basal.
- Après 2 jours de culture dans des milieux ALI submergés, aspirez et jetez les médias.
- Ajouter 750 μL de média ALI dans le compartiment basal uniquement pour créer une interface air-liquide.
REMARQUE: Si après 1 semaine de culture, la monocouche n’est pas confluente et que des trous sont encore observés, les cellules peuvent ne plus avoir la capacité de se dilater dans les régions vides, envisagez de jeter les cellules épithéliales des voies respiratoires.
- Maintien du modèle d’ALI différencié et élimination du mucus
- Changez les milieux apical et basal tous les deux jours jusqu’à différenciation complète (jour 21-25 après établissement de l’interface air-liquide).
- Une fois par semaine, lavez le mucus du côté apical en suivant les étapes 5.3.3-5.3.4.
- Réchauffer PBS à RT (15-25 °C).
- Ajouter 200 μL de PBS dans le compartiment apical. Incuber dans l’incubateur CO2 pendant 10 min. Utilisez un dispositif d’aspiration ou une pipette pour retirer le PBS.
6. Organoïdes épithéliaux tridimensionnels des voies respiratoires
- Préparations pour la culture d’organoïdes épithéliaux des voies respiratoires
- Placer des plaques de 24 puits dans un incubateur de CO2 pour les réchauffer à 37 °C pendant la nuit.
- Décongeler un flacon de 10 ml d’ECM (Table of Materials) sur de la glace conformément aux instructions du fabricant. Préparer des aliquotes de 500 μL (à usage unique) pour minimiser le nombre de cycles de gel-dégel.
REMARQUE: Utilisez ECM avec une concentration de protéines de >10,5 mg / mL pour les meilleurs résultats de culture est recommandé. Une concentration plus faible accélérera la désintégration du dôme ECM et augmentera l’apparition d’organoïdes orientés vers l’apical. - Utilisez la trousse organoïde des voies respiratoires (table des matières) pour préparer les milieux d’ensemencement organoïdes des voies respiratoires (MSA) et les milieux de différenciation (AODM) conformément aux instructions du fabricant.
- Préparer les milieux organoïdes basaux des voies respiratoires conformément au tableau 2.
| Composant | Volume |
| DMEM/F-12 avancé | 500 mL |
| HEPES | 5 mL |
| Alanyl-glutamine | 5 mL |
| Pénicilline-streptomycine | 5 mL |
Tableau 2 : Composantes des milieux organoïdes basaux des voies respiratoires
- Utilisez le nombre de cellules épithéliales vivantes des voies respiratoires dissociées à la section 4.2 pour calculer combien de puits peuvent être ensemencés à une densité d’ensemencement de 10 000 cellules (voir le tableau 3).
- Calculer le volume total d’ECM et d’AOSM nécessaire pour créer 1 x 50 μL de dôme ECM à 90 % (45 μL d’ECM et 5 μL d’AOSM) par puits.
REMARQUE : La densité d’ensemencement recommandée de 10 000 cellules par puits concerne les cellules épithéliales nasales expansées par CCR au passage 1. Les cellules de passage ultérieur peuvent nécessiter une densité d’ensemencement plus élevée pour obtenir la formation du même nombre d’organoïdes.
| Nombre de puits | Nombre de cellules | Nombre de dômes | Vol de Matrigel ECM | Vol de l’AOSM |
| 1 | 10 000 cellules | 1 | 45 μL x 1,1 | 5 μL x 1,1 |
| 2 | 20 000 cellules | 2 | 90 μL x 1,1 | 10 μL x 1,1 |
| 5 | 50 000 cellules | 5 | 225 μL x 1,1 | 25 μL x 1,1 |
| ......... | ......... Cellules | ......... | .........μL x 1,1 | .........μL x 1,1 |
Tableau 3 : Calculs pour l’ensemencement des cellules épithéliales des voies respiratoires dans les dômes ECM
- Ensemencement de cellules épithéliales des voies respiratoires dans des dômes ECM
REMARQUE : Gardez l’ECM sur la glace en tout temps et effectuez toutes les étapes impliquant l’ECM sur la glace, car l’ECM commencera à se solidifier à des températures de >10 °C.- Resuspendre les cellules épithéliales des voies respiratoires dissociées à la rubrique 4.2 avec le volume calculé de 90 % ECM selon le tableau 3.
- En tenant la pipette à un angle de 90° (vertical) le plus près possible du fond du puits, distribuer 50 μL (jusqu’au premier arrêt pour éviter de créer des bulles) de la suspension de cellules ECM au centre du puits. Évitez de toucher le mur du puits.
- Incuber la plaque à 37 °C pendant 20 min jusqu’à ce que l’ECM se solidifie. Pendant que l’ECM se solidifie, chauffer l’AOSM à RT (15-25 °C) pour l’empêcher de provoquer une reliquéfaction et une désintégration du dôme ECM lors de l’addition.
- Ajouter 500 μL d’AOSM chauffés à chaque puits en distribuant le long de la paroi du puits. Ne pipette pas le média directement sur le dôme ECM.
- Changez de support tous les 2 jours pendant 4 à 7 jours. Pour aspirer le milieu, inclinez la plaque à un angle de 45° et aspirez à partir du bord inférieur du puits, loin du dôme ECM.
- Après 4-7 jours, initier la différenciation organoïde en ajoutant 500 μL d’AODM (15-25 °C) à chaque puits et changer de milieu tous les 2 jours pendant 7 jours.
- Replating des organoïdes épithéliaux des voies respiratoires au jour 7 de différenciation
REMARQUE: Le replacage des organoïdes épithéliaux des voies respiratoires est nécessaire car le bord des dômes ECM se désintègre progressivement au cours de la période de culture de 2 semaines. Les organoïdes épithéliaux des voies respiratoires au bord du dôme peuvent être perdus (se déloger dans le milieu) ou avoir une orientation vers l’extérieur orientée vers l’apicale lorsqu’ils ne sont pas entièrement intégrés dans l’ECM. L’étape de replacage « nettoie » également le dôme ECM en éliminant les cellules/débris qui ne forment pas avec succès des organoïdes.- Aspirez les médias de chaque puits. Ajouter 500 μL de milieux organoïdes basaux des voies respiratoires froides (ci-après appelés milieux basaux) à chaque puits.
- Utilisez la pipette P1000 car cette pointe de pipette a le plus grand orifice et réduira le risque d’éclatement des organoïdes pendant le pipetage. Ajustez la pipette à 350 μL pour éviter de créer des bulles, puis montez et descendez doucement pour perturber le dôme ECM dans chaque puits. Recueillir tous les milieux ECM/basaux dans un tube à centrifuger de 15 mL.
- Rincer chaque puits avec 500 μL de milieu basal froid. Recueillir les milieux basaux contenant les MCE et organoïdes restants dans le même tube à centrifuger de 15 mL que ci-dessus.
- Centrifuger à 300 x g pendant 5 min à 4 °C. Sur les trois couches visibles après centrifugation - (1) surnageant, (2) ECM contenant des débris cellulaires (duveteux) et (3) pastille contenant des organoïdes - jeter le surnageant et la couche ECM et conserver la pastille organoïde.
- Ajouter 1 mL de milieu basal froid à la pastille organoïde et pipeter doucement de haut en bas pour séparer tout ECM restant. Ajouter 6 ml de milieu basal froid dans le tube et mélanger délicatement.
- Centrifuger à 300 × g pendant 5 min à 4 °C. Jetez le surnageant.
- Si l’excès d’ECM est toujours visible, répétez les étapes 6.3.5 à 6.3.6 pour effectuer un autre lavage.
- Resuspendre la pastille organoïde avec un volume approprié de 90% ECM (utiliser AODM au lieu d’AOSM) pour plaquer ~30 organoïdes par 50 μL du dôme.
- Vérifiez la densité des organoïdes sous le microscope de culture cellulaire (objectif 4x) après avoir plaqué le premier dôme. Si trop dense, ajoutez 90% d’ECM supplémentaires pour atteindre la densité souhaitée de ~30 organoïdes.
- Suivez les étapes 6.2.3 à 6.2.4 pour solidifier la MEC et nourrir les cellules tous les deux jours avec 500 μL d’AODM chauffé dans chaque puits pendant 14 jours supplémentaires jusqu’à ce qu’elles atteignent la maturité (après 21 jours de différenciation) avec formation de lumière entourée d’épithélium pseudostratifié orienté vers l’intérieur contenant des cellules basales, des cellules ciliées et des cellules caliciformes.
NOTE: Les organoïdes épithéliaux des voies respiratoires décrits ici sont différenciés en phase terminale et ne peuvent pas être traversés ou cryoconservés.
7. Imagerie de la fréquence des battements de cils
REMARQUE : Cette section du protocole nécessite un microscope d’imagerie à cellules vivantes avec une chambre environnementale de chauffage et d’humidité, une caméra scientifique à fréquence d’images rapide (>100 Hz), un objectif à longue distance de travail 20x et un logiciel d’imagerie (voir le tableau des matériaux pour l’équipement recommandé utilisé dans ce protocole).
- Configuration du microscope
- Assurez-vous que le système de chauffage du microscope est allumé et équilibré à 37 °C. Allumez le microscope. Réglez le gaz à 5% CO 2 via le mélangeur de gaz CO2/air.
- Remplissez la bouteille du module d’humidité que le CO2 traverse avec de l’eau purifiée. Réglez l’humidité relative à 85% via le contrôleur supérieur de la scène afin que l’eau soit chauffée et que les cellules soient alimentées en air humidifié. Équilibrer la chambre pendant 30 min.
- Placez l’insert de plaque de microscope dans le support de microscope.
- Transférer les modèles de cellules épithéliales des voies respiratoires de l’incubateur au microscope sur un bloc thermique ou des billes thermiques équilibrées à 37 °C pour maintenir l’échantillon à une température physiologique.
- Placez la plaque de culture contenant les modèles de cellules épithéliales des voies respiratoires dans l’insert de la plaque de microscope. Fermez la chambre environnementale du microscope.
- Laisser l’échantillon s’équilibrer dans la chambre de microscope préchauffée à 37 °C, remplie de CO2 à 5 % pendant 30 min.
NOTE: Un temps d’équilibrage plus court peut suffire. Cela peut être déterminé en effectuant une expérience pour identifier le temps nécessaire à la stabilisation du CBF (voir la figure 3).
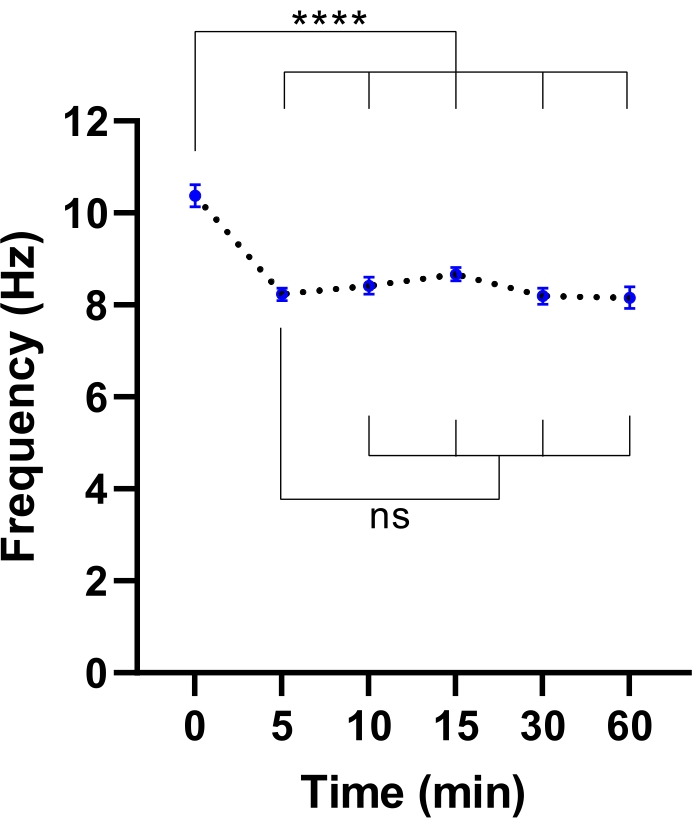
Figure 3 : Stabilisation de la fréquence des battements ciliaires au microscope imageur à cellules vivantes. Diagrammes de points de la fréquence moyenne des battements de cils (CBF) dans les cellules épithéliales des voies respiratoires à l’interface air-liquide (modèles ALI) après transfert dans un microscope imageur à cellules vivantes avec une chambre environnementale. La chambre a été équilibrée et maintenue à 37 °C, 5 % de CO2 et une humidité relative de 85 % pendant 30 minutes avant d’ouvrir la porte de la chambre et de placer la plaque de culture dans l’insert de la plaque de microscope. Les modèles cellulaires ont été imagés pendant 60 minutes aux intervalles indiqués. Les modèles d’ALI ont été dérivés de deux participants atteints de FK. Six images par champ de vision (FOV) ont été acquises par modèle ALI. Chaque point (bleu) représente le FBC moyen dans 12-36 images de champ de vision. Les données sont représentées sous forme de moyenne ± SEM, la moyenne étant reliée par une ligne pointillée. L’analyse unidirectionnelle de la variance (ANOVA) a été utilisée pour déterminer les différences statistiques. P < 0,0001, ns: pas de signification. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Pendant la période d’équilibration, à l’ordinateur, ouvrez le logiciel d’acquisition. Sélectionnez l’objectif longue distance de travail 20x.
- Au niveau de l’oculaire du microscope, concentrez-vous sur le modèle cellulaire (~Z = 8000 μm).
- Assurez-vous que le microscope est configuré pour l’éclairage Kohler de manière à ce que les filaments d’ampoule de source lumineuse de transmission ne soient pas focalisés sur le plan d’échantillonnage, évitant ainsi les artefacts dans l’imagerie. Pour cela, suivez les étapes 7.1.10-7.1.13
- Fermez complètement le diaphragme d’iris de champ au-dessus du condenseur. Ouvrez lentement le diaphragme du diaphragme du champ iris et déplacez le condensateur vers le haut / vers le bas jusqu’à ce qu’une forme octogonale apparaisse.
- Si le diaphragme du diaphragme du champ iris n’est pas aligné (c’est-à-dire que l’octogone n’est pas au centre du champ de vision (FOV)), alignez-le au centre à l’aide des touches Allen.
- Une fois que le diaphragme du diaphragme du diaphragme du champ est aligné, ajustez la mise au point du condensateur pour mettre l’octogone au point.
- Ouvrez le diaphragme de l’iris du champ jusqu’à ce qu’il ne puisse plus être vu dans le FOV.
- À l’aide du logiciel d’acquisition, cliquez sur L100 pour basculer le trajet lumineux vers le port où la caméra est montée. Cliquez sur le bouton vert play (Run) pour visualiser le champ de vision du microscope via le logiciel. Vérifiez que les cils sont au point et ajustez-les si nécessaire.
- À l’aide du logiciel d’acquisition, configurez le microscope avec les paramètres suivants: Filtres: vide; Condenseur: vide; Format : pas de regroupement ; Temps d’exposition: 0.003 s; Mode de lecture: volet roulant; ROI: 512 × 512 pixels.
REMARQUE: Le temps d’exposition est basé sur la fréquence la plus élevée qui doit être mesurée puisque 1/temps d’exposition doit être au moins deux fois cette fréquence. Par exemple, si la plage physiologique maximale de battement des cils = 30 Hz, alors 1/temps d’exposition = 60, et le temps d’exposition doit être ≤ 0,016 s. Le retour sur investissement dépend des spécifications de fréquence d’images de la caméra. Sélectionnez un retour sur investissement qui capture des fréquences d’images > 100 Hz.
- Acquisition d’images
- Pour acquérir des images time-lapse à partir du menu, cliquez sur Acquérir puis sur Fast Time Lapse. Dans la fenêtre contextuelle, sélectionnez un emplacement d’enregistrement et un nom de fichier. Acquérir 1000 cadres.
- Cliquez sur Appliquer. Cliquez sur le bouton vert de lecture (Exécuter) pour prévisualiser les cils dans le champ de vision du microscope et ajuster la mise au point Z si nécessaire. Cliquez sur Exécuter maintenant pour capturer le time-lapse rapide.
- Une fois le time-lapse rapide capturé, cliquez sur le bouton vert play (Run) pour visualiser le champ de vision du microscope. À l’aide du joystick du microscope, déplacez-vous le long de l’axe X/Y jusqu’à un autre champ de vision.
- Ajustez la mise au point Z pour mettre les cils au point. Cliquez sur Exécuter maintenant pour capturer un autre time-lapse rapide.
- Répétez les étapes 7.2.3 à 7.2.4. Pour les modèles ALI et les organoïdes des voies respiratoires, imagez 6x FOV dans chacun des 3x échantillons répliqués. Pour les feuilles épithéliales des voies respiratoires, imagez au moins 4 images répliquées par participant.
8. Analyse des données et quantification des FLC
- Préparation à l’analyse des données
Remarque : Cette section du protocole nécessite des scripts d’analyse personnalisés (fichier supplémentaire 3), des fichiers image brutes (acquis dans la section 7.2), un logiciel informatique et un logiciel d’analyse.- Installez le logiciel informatique, de préférence la dernière version, sur l’ordinateur d’analyse. Assurez-vous que les boîtes à outils logicielles informatiques standard (elmat, ops, datafun, uitools, datatypes, iofun, iotools, audiovideo) et les boîtes à outils de traitement d’images et de signaux sont installées.
- Copiez les scripts d’analyse personnalisés 'BeatingCiliaBatchOMEfiles_JOVE.m’et 'LoadRawDataExportFilteredMovies_JOVE.m’et le dossier 'scripts de support' sur le lecteur local de l’ordinateur.
- Sur le logiciel informatique, cliquez sur l’onglet Accueil. Cliquez ensuite sur Set Path (Définir le chemin (Figure 4A-B).
- Dans la fenêtre contextuelle, cliquez sur Ajouter avec des sous-dossiers (Figure 4C). Sous « Chemin de recherche MATLAB », sélectionnez les dossiers illustrés à la Figure 4D, puis cliquez sur Enregistrer et fermer (Figure 4E-F).
- Vérifiez que les scripts d’analyse sont liés au logiciel de calcul en vérifiant qu’ils apparaissent dans le panneau de gauche (Figure 4G).
- Transférez les fichiers image bruts (format OME (Open Microscopy Environment)) acquis dans la section 7.2 sur le lecteur local de l’ordinateur.
REMARQUE : des exemples de fichiers image brutes sont accessibles à l’adresse suivante : https://doi.org/10.6084/m9.figshare.16649878.v1.
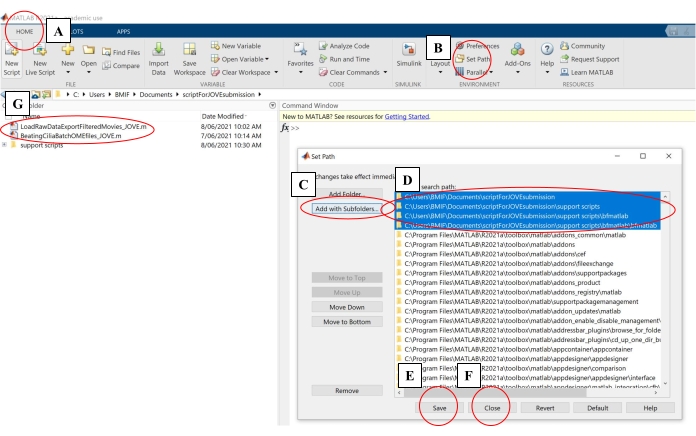
Figure 4 : Configuration d’un logiciel informatique pour l’analyse des données. (A) Ouvrez l’onglet Accueil. (B) Sélectionnez Définir le chemin. (C) Sélectionnez Ajouter avec des sous-dossiers. (D) Sélectionnez les dossiers contenant les scripts d’analyse. (E) Sélectionnez Enregistrer. (F) Sélectionnez Fermer. (G) Les scripts d’analyse apparaîtront dans le panneau de gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Quantification du CBF par détection de crête du spectre d’intensité des pixels individuels
- Ouvrez le logiciel informatique. Cliquez sur le fichier de script d’analyse 'BeatingCiliaBatchOMEfiles_JOVE.m'(Figure 5A).
- Cliquez sur l’onglet Éditeur, puis cliquez sur le bouton vert de lecture (Exécuter) pour exécuter le script (Figure 5B-C). Dans la fenêtre d’invite, sélectionnez les fichiers image bruts à analyser (Figure 5D).
- Entrez le temps d’exposition de l’étape 7.1.15 dans la fenêtre d’invite pour le temps d’acquisition par image, puis cliquez sur OK (Figure 5E).
- Attendez ~15 minutes par fichier pendant que le script calcule et sort le CBF dans le fichier 'AveSpectrum' (fichier supplémentaire 4), qui est automatiquement enregistré dans le même dossier que les fichiers image bruts. Visualisez la progression via la barre de progression (Figure 5F).
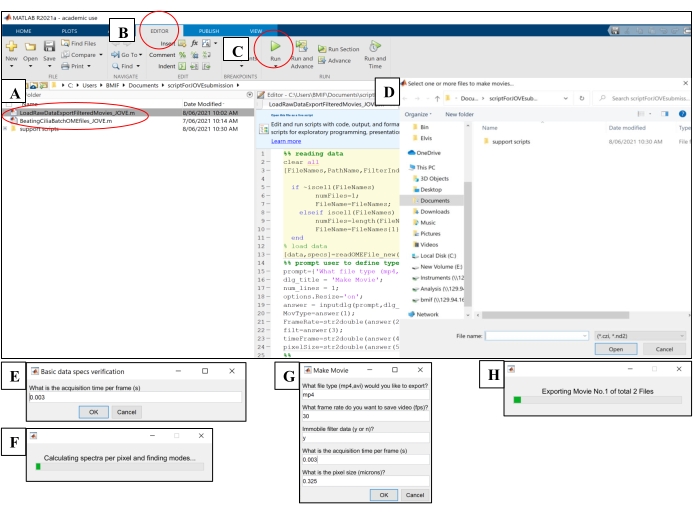
Figure 5 : Exécution de scripts d’analyse à l’aide d’un logiciel informatique. (A) Ouvrez le script pour l’analyse du CBF ('BeatingCiliaBatchOMEfiles_JOVE.m') ou la création d’un film de battement de cils ('LoadRawDataExportFilteredMovies_JOVE.m'). (B) Ouvrez l’onglet Éditeur. (C) Sélectionnez le bouton vert de lecture (Exécuter) pour exécuter le script d’analyse. (D) Une fenêtre d’invite nécessitera la sélection de fichiers pour l’analyse ou la création de films. (E) Lors de l’exécution du script 'BeatingCiliaBatchOMEfiles_JOVE.m', une invite apparaîtra pour entrer manuellement le temps d’acquisition par image (s) au cas où le script de lecture de fichiers ne lirait pas correctement les métadonnées. (F) Barre de progression indiquant la fréquence de battement des cils en cours de calcul. (G) Lors de l’exécution du script 'LoadRawDataExportFilteredMovies_JOVE.m', une invite apparaîtra pour entrer manuellement le type de film à sortir (mp4 ou avi), la fréquence d’images du film (fps), si le composant immobile est supprimé des données du film ('y' ou 'n'), le temps d’image (s) et la taille de pixel (microns) des données exportées dans le film. Il est recommandé d’utiliser « y » pour le filtrage immobile car il éliminera le mucus ou toute autre couche immobile obstruante dans les données. (H) Barre de progression pour indiquer le film en cours d’exportation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Exécutez le script 'GetFirstAmplitude.m’sur le dossier qui contient les fichiers 'AveSpectrum' en utilisant le processus des étapes 8.2.1-8.2.2. Attendez que le script génère le fichier 'FirstAmplitudeStacked.xlsx', qui contient la fréquence qui a la plus grande amplitude et se situe dans la plage physiologique des battements de cils de l’épithélium des voies respiratoires, ≥3 et <30 Hz.
- Copiez les valeurs de fréquence du fichier 'FirstAmplitudeStacked.xlsx' et tracez à l’aide d’un logiciel d’analyse scientifique.
REMARQUE : Une explication de la façon dont le script d’analyse personnalisé quantifie le FBC est fournie dans le fichier supplémentaire 5. Des exemples d’ensembles de données analysés peuvent être consultés à l’adresse suivante : https://doi.org/10.6084/m9.figshare.16649815.
- Exporter une vidéo de battement de cils
- Ouvrez le logiciel informatique. Cliquez sur le fichier de script 'LoadRawDataExportFilteredMovies_JOVE.m'(Figure 5A) pour charger le script.
- Cliquez sur l’onglet Éditeur , puis cliquez sur le bouton vert de lecture (Exécuter) pour exécuter le script (Figure 5C). Dans la fenêtre d’invite, sélectionnez les fichiers image bruts à exporter vers des fichiers vidéo (Figure 5D).
- Saisissez les paramètres détaillés dans le Tableau 4 dans la fenêtre contextuelle « Créer un film » (Figure 5G).
- Attendez ~8 minutes par fichier pendant que le script crée les fichiers vidéo et les affiche à l’emplacement des fichiers image bruts. Visualisez la progression via la barre de progression (Figure 5H).
| Entrées vidéo | Description |
| Type de fichier | Entrez le type de fichier que vous souhaitez exporter (mp4 ou avi). |
| Fréquence d’images | Entrez la fréquence d’images à laquelle le film doit être exporté. Si vous avez ~1000 images par série chronologique acquise, il est recommandé de définir la fréquence d’images ~30 ips. |
| Filtrage immobile | Les options sont 'y' ou 'n'. La valeur par défaut est 'y', et le script de filtrage temporel supprime, à l’aide de l’espace de Fourier, tous les composants immobiles des données vidéo. En règle générale, toutes les couches de cellules sous les cils ou le mucus immobile contribueront à une composante décalée de fréquence nulle ou à une composante invariante dans le temps dans le signal qui peut être filtrée. |
| Temps d’acquisition par image | Temps d’acquisition par image des données acquises. Il est utilisé pour afficher un horodatage dans le film en quelques secondes. |
| Taille en pixels | La taille des pixels en micromètres est utilisée pour afficher une barre d’échelle dans le film en micromètres. |
Tableau 4 : paramètres d’entrée pour la création de films
Résultats
Pour démontrer l’efficacité de ce protocole dans la quantification de la FBC, les résultats de la FBC mesurée dans des modèles d’ALI sur les cellules épithéliales des voies respiratoires dérivés de trois participants atteints de mucoviscidose et de trois participants témoins sains sont présentés. Au jour 14 de la différenciation de la culture, des cils battants étaient présents (Figure 6). Du jour 14 au jour 21 de la différenciation par culture, une augmentation statistiq...
Discussion
Il existe de multiples facteurs qui pourraient obscurcir la quantification du CBF dans les feuillets épithéliaux nasaux. Les feuilles épithéliales doivent être imagées dans les 3 à 9 heures suivant le prélèvement de l’échantillon, car la fonction ciliaire est la plus stable pendant cette période37. Moins de globules rouges et de débris sont les plus optimaux pour l’imagerie, car ils interfèrent avec l’acquisition de données. Lors de la sélection d’un retour sur investissemen...
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont rien à divulguer.
Remerciements
Nous remercions les participants à l’étude et leurs familles pour leurs contributions. Nous apprécions l’aide du service respiratoire de Randwick des hôpitaux pour enfants de Sydney (SCH) dans l’organisation et la collecte des échantillons biologiques des patients - un merci spécial au Dr John Widger, à la Dre Yvonne Belessis, à Leanne Plush, à Amanda Thompson et à Rhonda Bell. Nous remercions Iveta Slapetova et Renee Whan de l’installation de microscopie optique Katharina Gaus du Centre d’analyse Mark Wainwright de l’UNSW Sydney. Ce travail est soutenu par le National Health and Medical Research Council (NHMRC) Australia (GNT1188987), la CF Foundation Australia et la Sydney Children’s Hospital Foundation. Les auteurs tiennent à remercier Luminesce Alliance - Innovation for Children’s Health pour sa contribution et son soutien. Luminesce Alliance - Innovation for Children’s Health est une coentreprise coopérative à but non lucratif entre le Sydney Children’s Hospitals Network, le Children’s Medical Research Institute et le Children’s Cancer Institute. Il a été créé avec le soutien du gouvernement de la Nouvelle-Galles du Sud pour coordonner et intégrer la recherche pédiatrique. Luminesce Alliance est également affiliée à l’Université de Sydney et à l’Université de Nouvelle-Galles du Sud à Sydney. KMA est soutenu par une bourse du programme de formation à la recherche du gouvernement australien. LKF est soutenu par le Rotary club de Sydney Cove/Sydney Children’s Hospital Foundation et des bourses d’études supérieures de l’Université UNSW.
matériels
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
Références
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O'Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O'Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon