このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
繊毛拍動頻度の定量化のための初代ヒト鼻上皮細胞モデルの収集、拡大、および分化
要約
このプロトコルでは、鼻上皮細胞の収集、拡張、器官型気道上皮細胞モデルへの分化、および生細胞イメージングとカスタムビルドスクリプトによる繊毛拍動頻度の定量化について説明します。
要約
繊毛機能(拍動頻度、パターン)の測定は、原発性毛様体ジスキネジアなどの呼吸器疾患の診断ツールとして確立されています。しかしながら、これらの技術のより広い適用は、温度、湿度、およびpHなどの環境要因の変化に対する繊毛機能の極端な感受性によって制限される。 嚢胞性線維症(CF)患者の気道では、粘液の蓄積が繊毛の拍動を妨げます。繊毛機能は、CF膜貫通コンダクタンスレギュレーター(CFTR)チャネル活性の指標として、一次気道細胞モデルで調査されています。しかし、繊毛拍動頻度のかなりの患者間変動は、同じ CFTR 変異を有する患者であっても、CFTR調節薬に応答して見出されている。さらに、機能不全のCFTR調節された塩化物分泌が毛様体機能に与える影響はよくわかっていません。現在、 in vitro 気道モデルのサンプル調製、画像取得、および繊毛拍動周波数(CBF)の分析を実証する包括的なプロトコルはありません。標準化された培養条件と環境制御された条件下で実行される画像取得により、個人間およびCFTR調節薬に応答したCBFの一貫した再現性のある定量が可能になります。このプロトコルは、3つの異なる気道上皮細胞モデルシステムにおけるCBFの定量について説明しています:1)ネイティブ上皮シート、2)透過性サポートインサート上に画像化された気液界面モデル、および3)細胞外マトリックス埋め込み3次元オルガノイド。後者の2つは、繊毛の拍動と粘液の産生を伴う in vivo 肺生理学を再現します。毛様体は、環境制御されたチャンバー内で高速ビデオカメラを使用してキャプチャされます。カスタムビルドのスクリプトは、CBFの分析に使用されます。CBF測定値の臨床への翻訳は、患者ごとにCFTR調節薬に対する反応を予測するための重要な臨床ツールであることが想定されています。
概要
繊毛拍動頻度(CBF)とパターンの測定は、原発性毛様体ジスキネジア(PCD)1などの呼吸器疾患の診断ツールとして確立されています。嚢胞性線維症(CF)では、CF膜貫通コンダクタンスレギュレーター(CFTR)塩化物チャネルの機能不全により、気道表面液の脱水と粘液繊毛クリアランスの障害を引き起こします2。繊毛機能は、CFTRチャネル活性の指標として一次気道細胞モデルで in vitro で調査されています3。しかし、CFTR調節薬に応答するCBFには、同じ CFTR 変異を有する患者であっても、かなりの患者間変動が存在する3。さらに、機能不全のCFTR調節された塩化物分泌が毛様体機能に与える影響はよくわかっていません。現在、 in vitro 気道モデルのサンプル調製、画像取得、およびCBFの分析を実証する包括的なプロトコルはありません。
鼻粘膜ブラッシングから分離された鼻上皮シートは、PCD診断の毛様体機能の測定に直接使用されます4。しかし、得られる鼻上皮シートのサイズや品質を制御することはできませんが、CBFは、単一細胞または細胞シート、および破壊された、または破壊されていない上皮シート繊毛縁で測定されるかどうかによって異なります5。そのため、鼻粘膜ブラッシングの収集中の細胞の損傷によって引き起こされる二次性ジスキネジアは、CBFに影響を与える可能性があります。鼻上皮細胞の初代細胞培養と、気液界面(ALI)または三次元基底膜マトリックスでの繊毛気道上皮オルガノイドへの分化は、二次ジスキネジアのない繊毛を生じさせます4,6,7,8。ALIで分化した気道上皮細胞(以下、ALIモデルと呼ぶ)は、毛様体拍動パターンとex vivo鼻粘膜ブラッシングの頻度を再現し、患者固有の欠陥を保持しながら毛様体微細構造、拍動パターン、および拍動頻度の分析を可能にする重要な二次診断補助と見なされています9。.しかし、これらの偽層状の粘液繊毛分化細胞モデルを作成するために使用される方法論には矛盾が存在します。異なる培養拡大または分化プロトコルは、明確な上皮表現型(繊毛または分泌)を誘導し10、CBF11に有意差をもたらす可能性があります。CBFは、鼻上皮ブラッシング4、6、12、13、14、15、16、気道上皮オルガノイド14、17、18およびALIモデル3、4、6、13、19、20において定量化されており、21.しかし、これらのプロトコルの中には大きなばらつきがあり、多くの場合、多くのパラメータが制御されていません。例えば、いくつかの研究では、ALIモデルの細胞が透過性支持体インサート3,19,20,21上に留まっている間にCBFがその場で画像化されるが、さらに他の研究は透過性支持体インサートから細胞を掻き取り、それらを培地4,6,13に懸濁して画像化する。
さらに、毛様体機能を測定する技術のより広い適用は、環境要因の変化に対する毛様体機能の極端な感受性によって制限されています。温度22、湿度23,24、pH25,26などの環境要因は毛様体機能に影響を与えるため、CBFを正確に定量化するには調整する必要があります。さまざまな実験室で使用されるさまざまな生理学的パラメーターと、それらがCBFにどのように影響するかは、以前にレビューされています27。
CBF測定に対する様々なイメージング技術およびアプローチが文献に報告されている。PCD診断では、ビデオ顕微鏡を使用して毛様体機能を測定します28,29。最近、示差動的顕微鏡に基づくビデオ分析アルゴリズムを使用して、気道上皮細胞ALIモデルにおけるCBFと繊毛の両方の協調を定量化しました3,30。この方法は、気道上皮細胞における毛様体拍動の特性評価を、領域をセグメント化または選択することなく、迅速かつ完全に自動化された方法で可能にする。CBFのイメージングおよび定量のための様々な方法は、文献中のCBFで報告されている違いに追加される可能性があります(補足ファイル1)。
既存のメソッドを合理化するための培養から定量、培養条件の標準化、および厳密な環境制御条件下で実行される画像取得までのプロトコルにより、個人内および個人間でのCBFの一貫した再現性のある定量が可能になります。
このプロトコルは、鼻起源の3つの異なる気道上皮細胞モデルシステムにおける上皮細胞の収集、増殖および分化培養条件、およびCBFの定量の完全な説明を提供します:1)ネイティブ上皮シート、2)透過性サポートインサートで画像化されたALIモデル、および3)細胞外マトリックス(ECM)埋め込み3次元オルガノイド(図1).鼻の下鼻甲介ブラッシングから得られた鼻上皮細胞は、気管支ブラッシングの収集に関連する侵襲的手順を克服しながら気管支上皮細胞31の有効な代理であるため、気道上皮の代表として使用される。条件付きリプログラミング細胞(CRC)法は、ALIモデルおよび3次元オルガノイドの作成のために初代気道上皮細胞を拡張するために使用されます。幹細胞様状態への気道上皮細胞の条件付きリプログラミングは、増殖停止線維芽細胞フィーダー細胞系およびRho関連キナーゼ(ROCK)阻害剤32との共培養によって誘導される。重要なことに、CRC法は、組織特異的な分化能を保持しながら、気道上皮細胞の集団倍増を増加させる33,34。すべての気道上皮細胞モデルにおいて、毛様体は、標準化された画像取得設定を備えた高速ビデオカメラを使用して、温度制御されたチャンバーでキャプチャされます。CBFの定量化には、カスタムビルドのスクリプトが使用されます。

図1:ワークフローの概略図。 参加者の鼻の下鼻甲介をブラッシングした後、気道上皮細胞は2つの方法のいずれかで利用されます。気道上皮シートを単離し、繊毛拍動頻度を直ちに画像化するか、または気道上皮細胞を条件付きリプログラミング細胞法で拡張します。CRC拡張気道上皮細胞は、気液界面または気道上皮オルガノイド培養で気道上皮細胞を確立するために分化されます。毛様体拍動周波数のイメージングは、加熱および湿度環境チャンバーと高速フレームレート(>100Hz)の科学用カメラを備えた生細胞イメージング顕微鏡を使用して取得されます。データ分析は、カスタムビルドのスクリプトを使用して実行されます。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
研究の承認は、シドニー小児病院ネットワーク倫理審査委員会(HREC/16/SCHN/120)から受けました。生物試料の収集前に、すべての参加者(または参加者の保護者)から書面による同意を得ました。
1. 気道上皮細胞モデル構築のための準備
- 80%ダルベッコ改変イーグル培地と20%ウシ胎児血清を組み合わせて、鼻細胞採取培地を準備します。1 μL/mLのペニシリン/ストレプトマイシンを補給します。4°Cで最大3ヶ月間保管してください。
- フラスコまたは透過性サポートインサートを、手順1.2.1〜1.2.4に従って、必要に応じてコラーゲン溶液でコーティングします。コラーゲンコーティングされた容器を長期間保管しないでください。
- I型コラーゲン溶液(3 mg/mLストック)をリン酸緩衝生理食塩水(PBS)で1:100に希釈し、最終濃度を0.03 mg/mLにします。よく混ぜる。
- 細胞培養フラスコ(セクション4)を160 μL/cm 2(T25フラスコあたり4 mL)および透過性サポートインサート(セクション5)で455 μL/cm2(すなわち、6.5 mmインサートあたり150 μL)でコーティングします。
- 37°Cで2〜24時間インキュベートします。
- 細胞を播種する前に、ピペットまたは真空アスピレーターでコラーゲン溶液を除去します。細胞を播種する前に容器を洗浄しないでください。
- 表1に列挙した成分32を組み合わせて条件付き再プログラミングセル(CRC)培地を調製する。フィルターは、ボトルトップ真空フィルターシステムを使用して滅菌します。4°Cで最大2ヶ月間保管してください。
- 使用当日に、 表1に示すようにヒト上皮成長因子、ROCK阻害剤および抗生物質を添加する。
| コンポーネント | 容積 |
| DMEM, 高グルコース | 156.7 ミリリットル |
| DMEM/F-12, HEPES | 313.3 ミリリットル |
| ヒドロコルチゾン | 55.6 μL |
| インスリン | 1.25ミリリットル |
| コレラ毒素 | 21 μL |
| アデニン | 1.2ミリリットル |
| ハイFBS | 25ミリリットル |
| ペニシリン-ストレプトマイシン | 5ミリリットル |
| ヒト上皮成長因子 | 1 μL/mL |
| ロック阻害剤 | 1 μL/mL |
| 菌類ゾーン | 2 μl/ml |
| トブラマイシン | 2 μL/mL |
| セフタジジム水和物 | 4 μL/mL |
| ゲンタマイシン溶液 | 1 μL/mL |
表1:500 mLの条件付きリプログラミング細胞培地の成分
2.鼻の下鼻甲介ブラッシングの収集
注:プロトコルのこのセクションでは、鼻細胞収集培地、細胞診ブラシ、組織、および適切な個人用保護具を備えた収集チューブ(50 mL)が必要です。上気道感染症中のブラッシングは避けてください。出血の危険性はわずかですが、炎症がある場合は増加します。ブラッシングの目的が ex vivoCBF 測定用の気道上皮シートを得ることである場合、ブラッシングは上気道感染の最低6週間後に行われるべきです。理想的には、感染後10週間以上35。
- 鼻細胞採取培地(セクション1)を準備し、チューブを氷の上に置きます。
- 参加者に手順を不快であると説明してください。ブラッシング中に鼻孔に完全な感覚が感じられることを説明します, 海/プールに飛び込んで水が鼻腔に突入するのと同じように.この手順が反射として涙の生成を誘発することを参加者に助言する。
- どのポジショニングが参加者に適しているかを評価します。仰臥位は、処置中に参加者の頭がブラシから離れるのを防ぐため、検査ソファが利用可能な場合は、参加者を仰臥位に置きます。または、参加者を壁の隣に座らせ、壁に頭を押し戻すことができます。
- 鼻腔を点検します。鼻中隔偏位、ポリープ、および鼻腔内のブラシの通過に影響を及ぼし、出血のリスクを高める可能性のあるその他の解剖学的異常に注意してください。
- 参加者に鼻をティッシュに吹き込むように依頼して、余分な粘液の鼻をきれいにします。
- 参加者に口から呼吸するように依頼します。利き手に細胞診ブラシを取ります。参加者のあごに5桁目を置き、手を固定しながら、細胞診ブラシを参加者の鼻腔に挿入します(図2)。ブラシを参加者の顔に~45°挿入して、鼻道を通過させます。
- 参加者の顔に垂直になるようにブラシを直立させます。ブラシを下鼻甲介の下の鼻の側壁に対して、下鼻甲介の中央部から後部になるまで、ゆっくりとしっかりと進めます。
注意: 過剰挿入は避けてください。抵抗の突然の低下が感じられた場合は、鼻咽頭が入り、手続き主義者が再び抵抗を感じるまでブラシを引っ込める必要があります。 - ブラシを360°まで3回回転させます。挿入操作の逆でブラシをそっと取り外して、細胞がブラシから外れないようにします。
- 鼻細胞採取培地で準備した採取チューブにブラシを置きます。収集チューブを氷の上に置きます。
- 参加者が同意できる場合/多数の細胞が必要な場合は、2番目の鼻孔でブラッシングを繰り返します(例:.、細胞培養を開始するため)。
注:ブラシに目に見える血球がない場合は、同じ鼻孔を再度ブラッシングできますが、同じ鼻孔で2回目のブラッシングを行うと出血のリスクがわずかに増加することに注意してください。
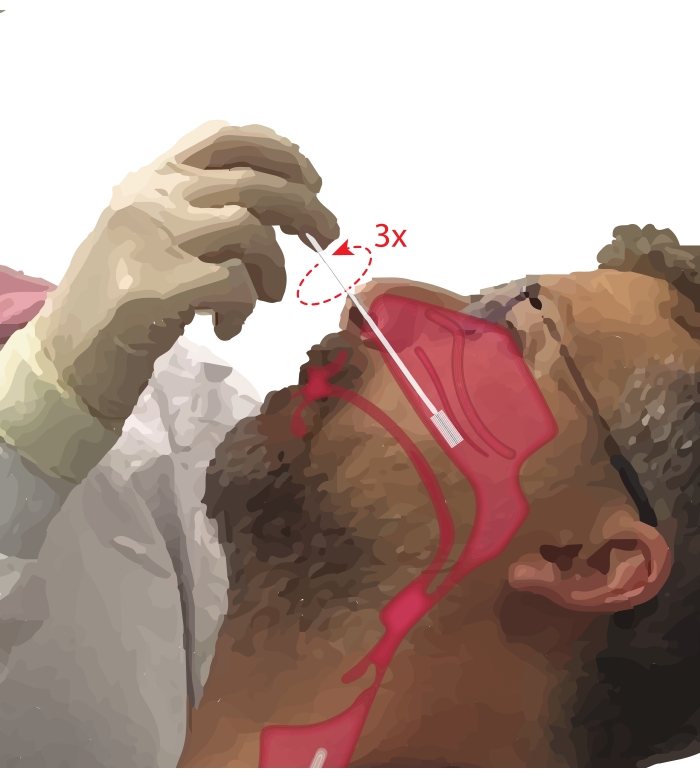
図2:鼻上皮細胞の収集。 下鼻甲介の中央部から後部の細胞診ブラシの位置の図。この位置に到達するには、ブラシを鼻腔に挿入し、ブラシを顔に対して90°の角度に回転させ、下鼻甲介の下の鼻腔に沿ってブラシをガイドします。 この図の拡大版を表示するには、ここをクリックしてください。
3.気道上皮シートの調製
注:プロトコルのこのセクションでは、収集チューブ(細胞診ブラシ+ 1 mLの鼻細胞収集培地)(セクション2)と96ウェル平底プレートが必要です。気道上皮シートを画像化する目的で鼻甲介ブラッシングを収集する場合は、抗生物質を含まない鼻細胞収集培地を1 mLのみ使用してください。そうしないと、上皮シートが分散しすぎてイメージングできなくなります。
- 細胞診ブラシを含む収集チューブをそっと回転させて、気道上皮シートをブラシから外します。
- P1000ピペットですべての培地と細胞を採取します。5〜6滴を96ウェル平底プレートのウェルに分注します。約7ウェル繰り返します。
- ステップ7.1.4に従ってプレートを顕微鏡に移し、セクション7の残りの部分に従って繊毛拍動周波数を画像化します。
- 画像は上皮シート(図1)と単一の非付着細胞ではないが、上皮シートと単一の非付着細胞との間で繊毛機能が異なることが実証されていることから5。
4.気道上皮細胞の拡張と維持
- 気道上皮条件付きリプログラミング細胞増殖培養
注:コラーゲン溶液コーティング容器(セクション1)、照射マウス胚フィーダー細胞(NIH-3T3)、条件付きリプログラミング細胞(CRC)培地(セクション1)、鼻細胞収集培地中の細胞診ブラシ(セクション2)。- プレートは、気道上皮細胞との共培養の少なくとも2時間前および72時間以内に、調製されたコラーゲン溶液コーティングされた培養容器に8,000細胞/cm2 の播種密度でフィーダー細胞を照射した(フィーダー細胞の培養および照射については36 を参照)。
- 採取チューブ(細胞診ブラシ+鼻細胞採取培地)内のブラシをかけた細胞を氷上の渦に移します。低速では、ボルテックスチューブを10秒オン、10秒オフ(間に氷の上に保つ)して、ブラシから細胞を取り除きます。激しいボルテックスは細胞の生存率を低下させる可能性があります。ブラシを調べて、粘液がまだ付着しているかどうかを確認します。その場合は、ボルテックスを繰り返します。
- 氷上のチューブをバイオセーフティキャビネットに戻します。血清学的ピペットを使用して、細胞診ブラシを残して、培地を収集チューブから新しいチューブ(チューブB)に移します。遠心分離管Bを300 × g で4°Cで7分間。
- チューブBを遠心分離機から取り出し、上清を廃棄する。粘液が見える場合は、ペレットをさらに5 mLの鼻細胞収集培地で洗浄し、再度遠心分離します。
- 1 mLのCRC培地を加えて、細胞ペレットをチューブBに再懸濁します。 5 mLの血清学的ピペットを使用して、50 mLチューブ(チューブC)の上に置かれた細胞ふるいに細胞を円を描くように通します。
- 複数回繰り返して、単一の細胞懸濁液を形成します。ふるいの底から残留培地を集め、培地に組み込みます。セルふるいを捨てます。
- 5 mLの血清学的ピペットを使用して、チューブCから1 mLの培地を取り出し、それをマイクロ遠心チューブに移します。
- この細胞懸濁液を10 μL取り、10 μLのトリパンブルーを事前に分注したマイクロ遠心チューブに追加します。よく混合し、すぐに自動セルカウンターを使用して細胞数と生存率を記録します。
- 照射されたフィーダー細胞を予め播種したT25フラスコに気道上皮細胞を播種する。
- 気道上皮細胞の維持と解離
注意: CRC培地は、細胞に加える前に、温度制御された実験室の水浴またはビーズ浴装置に入れて37°Cに温める必要があります。- 細胞培養顕微鏡(4×対物レンズ)で細胞に付着、汚染、形態、および合流がないか定期的にチェックします。
- CRCメディアは2日おきに交換してください。再プログラムされた細胞が観察され(図1)、汚染が存在しない場合は、抗生物質を減らすか回収します。
- 細胞が90%コンフルエントに達したら、ダブルトリプシン法32 を使用して細胞を解離し、ステップ4.1.8に記載されているように細胞カウントを実行します(細胞の解離および凍結については 補足ファイル2 を参照されたい)。
5. 気道上皮細胞の播種・分化と分化型ALIモデルの維持
- 気道上皮細胞を透過性支持体インサートに播種
- コラーゲン溶液でコーティングされた透過性サポートインサート(セクション1)をCO2 インキュベーターからバイオセーフティキャビネットに移します。コラーゲン溶液を吸引して廃棄します。750 μLの膨張培地(抗生物質フリー)を透過性サポートインサートの基底コンパートメントに追加します。
- 解離した細胞または氷上で解凍した細胞をバイオセーフティキャビネットに移します。150 μLで200,000〜250,000個の細胞を播種するために必要な量の膨張培地を、各透過性サポートインサートの頂端コンパートメントに追加します。
- 泡を作らないように注意してください。よく混ぜて、細胞が均質で懸濁状態であることを確認します。150 μLの細胞懸濁液を各透過性支持体インサートの先端側に加えます。
- 均一な細胞懸濁液を維持するために、3つの透過性支持体インサートごとに播種した後に細胞を再懸濁する。
- コンフルエントな細胞単層が形成されるまで(通常は播種後4日目までに)2日ごとに、培地を廃棄し、室温(RT、15〜25°C)に温めた新しい増殖培地を追加します。
- 気液界面における気道上皮細胞の分化
- ALI培地(抗生物質フリー)をRT(15〜25°C)に温めます。
- 拡張培地を取り出し、頂端コンパートメントと基底コンパートメントの両方で分化培地(ALI)に変更します。
- 水中ALI培地で2日間培養した後、培地を吸引して廃棄する。
- 750 μLのALI培地を基底コンパートメントに追加して、気液界面を作成します。
注:1週間の培養後、単層がコンフルエントではなく、穴がまだ観察される場合、細胞はもはや空隙領域に拡大する能力を持たない可能性があり、気道上皮細胞を廃棄することを検討してください。
- 分化ALIモデルの維持と粘液除去
- 完全に分化するまで、頂端および基底培地を2日ごとに交換します(気液界面確立後21〜25日目)。
- 週に一度、手順5.3.3〜5.3.4に従って、頂端側から粘液を洗います。
- PBSをRT(15〜25°C)に温めます。
- 200 μLのPBSを頂端コンパートメントに追加します。CO2 インキュベーターで10分間インキュベートします。吸引装置またはピペットを使用してPBSを取り外します。
6. 三次元気道上皮オルガノイド
- 気道上皮オルガノイド培養のための準備
- 24ウェルプレートをCO2 インキュベーターに入れ、一晩37°Cに温めます。
- 製造元の指示に従って、ECM(材料表)の10mLバイアルを氷上で解凍します。凍結融解サイクルの数を最小限に抑えるために、500 μLのアリコート(1回限りの使用)を準備します。
注:最良の培養結果を得るには、タンパク質濃度>10.5 mg/mLのECMを使用することをお勧めします。濃度が低いと、ECMドームの崩壊が加速し、頂端に面した外側のオルガノイドの発生が増加します。 - 気道オルガノイドキット(材料表)を使用して、製造元の指示に従って気道オルガノイド播種培地(AOSM)および分化培地(AODM)を準備します。
- 表2に従って気道オルガノイド基底培地を調製する。
| コンポーネント | 容積 |
| アドバンストDMEM/F-12 | 500ミリリットル |
| ヘペス | 5ミリリットル |
| アラニルグルタミン | 5ミリリットル |
| ペニシリン-ストレプトマイシン | 5ミリリットル |
表2:気道オルガノイド基底培地の成分
- セクション4.2で解離した生きた気道上皮細胞の数を使用して、10,000細胞の播種密度で播種できるウェルの数を計算します( 表3を参照)。
- ウェルあたり1 x 50 μLの90%ECMドーム(45 μLのECMと5 μLのAOSM)を作成するために必要なECMとAOSMの総容量を計算します。
注:ウェルあたり10,000細胞の推奨播種密度は、継代1のCRC拡張鼻上皮細胞用です。後の継代細胞は、同じ数のオルガノイドの形成を達成するために、より高い播種密度を必要とし得る。
| 井戸数 | セル数 | ドーム数 | マトリゲルECMの巻。 | AOSMの巻 |
| 1 | 10,000 セル | 1 | 45 μL x 1.1 | 5 μL x 1.1 |
| 2 | 20,000 セル | 2 | 90 μL x 1.1 | 10 μL x 1.1 |
| 5 | 50,000 セル | 5 | 225 μL x 1.1 | 25 μL x 1.1 |
| ......... | .........細胞 | ......... | μL x 1.1 | μL x 1.1 |
表3:ECMドームにおける気道上皮細胞の播種の計算
- ECMドームにおける気道上皮細胞の播種
注意: ECMは>10°Cの温度で固化し始めるため、ECMを常に氷上に保ち、ECMを含むすべての手順を氷上で実行してください。- セクション4.2で解離した気道上皮細胞を 、表3に従って90%ECMの計算体積で再懸濁します。.
- ピペットをウェルの底にできるだけ近づけて90°の角度(垂直)で保持し、ECM細胞懸濁液をウェルの中心に50 μL(気泡が発生しないように最初のストップまで)分注します。井戸の壁に触れないでください。
- ECMが固化するまでプレートを37°Cで20分間インキュベートします。ECMが固化している間、AOSMをRT(15〜25°C)に温めて、添加時にECMドームの再液化と崩壊を引き起こすのを防ぎます。
- ウェルの壁に分注することにより、500 μLの加温したAOSMを各ウェルに追加します。ECMドームに直接メディアをピペットで入れないでください。
- 4〜7日間、2日ごとにメディアを交換してください。媒体を吸引するには、プレートを45°の角度で傾け、ECMドームから離れたウェルの下端から吸引します。
- 4〜7日後、500 μLのAODM(15〜25°C)を各ウェルに追加してオルガノイド分化を開始し、2日ごとに7日間培地を交換します。
- 分化7日目の気道上皮オルガノイドの再メッキ
注:ECMドームの端は2週間の培養期間にわたって徐々に崩壊するため、気道上皮オルガノイドの再メッキが必要です。ドームの端にある気道上皮オルガノイドは、ECMに完全に埋め込まれていない場合、失われる(メディアに外れる)か、頂端を向いた外側の向きになる可能性があります。再メッキステップでは、オルガノイドの形成に成功しない細胞/破片を除去することにより、ECMドームを「クリーンアップ」します。- 各ウェルから培地を吸引します。500 μLの冷気道オルガノイド基礎培地(以下、基礎培地と呼びます)を各ウェルに追加します。
- P1000ピペットは、このピペットチップのオリフィスが最も大きく、ピペッティング中にオルガノイドが破裂する可能性を低減するため、ピペットを使用してください。ピペットを350 μLに調整して気泡が発生しないようにしてから、ピペットをゆっくりと上下させて各ウェルのECMドームを破壊します。すべてのECM/基礎培地を15 mLの遠心チューブに回収します。
- 各ウェルを500 μLの冷たい基礎培地ですすいでください。残りのECMとオルガノイドを含む基礎培地を上記と同じ15 mL遠沈管に集めます。
- 300 x g で4°Cで5分間遠心分離します。 遠心分離後に見える3つの層のうち、(1)上清、(2)細胞残渣(ふわふわ)を含むECM、および(3)オルガノイドを含むペレット-上清およびECM層を廃棄し、オルガノイドペレットを保存する。
- 1 mLの冷たい基礎培地をオルガノイドペレットに加え、ピペットでゆっくりと上下に動かして、残りのECMを分離します。6 mLの冷たい基礎培地をチューブに加え、穏やかに混合します。
- 300 × g で4°Cで5分間遠心分離します。 上澄み液を捨てる。
- 余分なECMがまだ見える場合は、手順6.3.5〜6.3.6を繰り返して、別の洗浄を実行します。
- オルガノイドペレットを適切な容量の90%ECM(AOSMの代わりにAODMを使用)で再懸濁して、ドーム50 μLあたり~30個のオルガノイドをプレートします。
- 最初のドームをめっきした後、細胞培養顕微鏡(4倍対物レンズ)でオルガノイドの密度を確認します。密度が高すぎる場合は、90%のECMを追加して、~30個のオルガノイドの所望の密度を達成します。
- 手順6.2.3〜6.2.4に従ってECMを固化し、500 μLの加温したAODMで細胞を各ウェルに2日おきに供給し、基底細胞、繊毛細胞、杯細胞を含む内向きの偽層状上皮に囲まれた内腔形成に達するまで(分化の21日後)、さらに14日間供給します。
注:ここに記載されている気道上皮オルガノイドは最終分化しており、継代または凍結保存することはできません。
7.繊毛拍動周波数のイメージング
注:プロトコルのこのセクションでは、加熱および湿度環境チャンバーを備えた生細胞イメージング顕微鏡、高速フレームレート(>100 Hz)の科学カメラ、20倍の作動距離対物レンズ、およびイメージングソフトウェアが必要です(このプロトコルで使用される推奨機器については、 材料の表 を参照してください)。
- 顕微鏡のセットアップ
- 顕微鏡加熱システムの電源が入っていて、37°Cに平衡化されていることを確認します。 顕微鏡の電源を入れます。CO2 /空気ガスミキサーを介してガスを5%CO2に調整します。
- CO2 が通過する湿度モジュールボトルに精製水を補充します。ステージトップコントローラーを介して相対湿度を85%に設定し、水が加熱され、セルに加湿された空気が供給されるようにします。チャンバーを30分間平衡化します。
- 顕微鏡プレートインサートを顕微鏡ホルダーに入れます。
- 気道上皮細胞モデルをインキュベーターから37°Cに平衡化したヒートブロックまたはサーマルビーズ上の顕微鏡に移し、サンプルを生理学的温度に維持します。
- 気道上皮細胞モデルを含む培養プレートを顕微鏡プレートインサートに配置します。顕微鏡環境室を閉じます。
- サンプルを予熱した37°C、5%CO2充填顕微鏡チャンバーで30分間平衡化させます。
注意: 平衡化時間は短いほど十分な場合があります。これは、CBFの安定化に必要な時間を特定する実験を行うことによって決定することができる( 図3参照)。
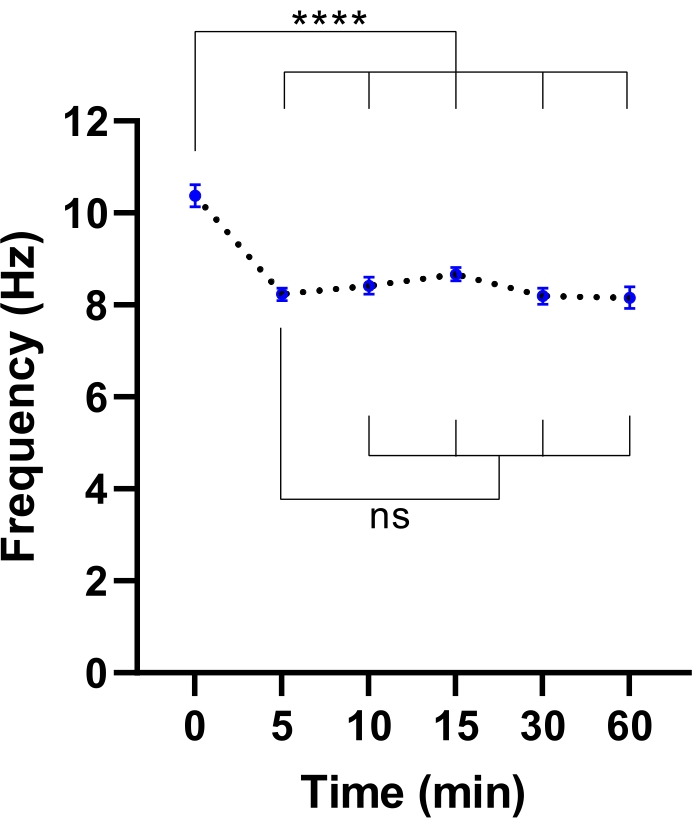
図3:生細胞イメージング顕微鏡における毛様体拍動周波数の安定化。 環境チャンバーを備えた生細胞イメージング顕微鏡に移した後の気道上皮細胞における気液界面(ALIモデル)の平均繊毛拍動頻度(CBF)のドットプロット。チャンバードアを開けて培養プレートを顕微鏡プレートインサートに入れる前に、チャンバーを平衡化し、37°C、5%CO2 および相対湿度85%で30分間維持した。細胞モデルを指示された間隔で60分間画像化した。ALIモデルは、CFの2人の参加者から導き出され、ALIモデルごとに6つの視野(FOV)画像が取得されました。各ドット(青)は、12〜36個のFOV画像における平均CBFを表す。データはSEM±平均値として表され、平均は点線で結ばれています。一元配置分散分析(ANOVA)を使用して、統計的差異を決定しました。P < 0.0001, ns: 有意性なし。 この図の拡大版を表示するには、ここをクリックしてください。
- 平衡期間中に、コンピューターで取得ソフトウェアを開きます。20倍の作動距離対物レンズを選択してください。
- 顕微鏡の接眼レンズで、細胞モデル(~Z = 8000 μm)に焦点を合わせます。
- 透過光源の電球フィラメントがサンプル面に焦点を合わせないように、顕微鏡がコーラー照明用にセットアップされていることを確認し、イメージングのアーティファクトを回避します。これを行うには、手順7.1.10〜7.1.13に従います
- コンデンサーの上にあるフィールドアイリスダイアフラムを完全に閉じます。フィールドアイリスダイアフラムをゆっくりと開き、八角形が現れるまでコンデンサーを上下に動かします。
- フィールドアイリスダイアフラムが整列していない場合(つまり、八角形が視野(FOV)の中心にない場合)、六角レンチを使用して中央に揃えます。
- フィールドアイリスダイアフラムが揃ったら、コンデンサーの焦点を調整して、八角形にシャープな焦点を合わせます。
- FOV内で見えなくなるまでフィールドアイリスダイアフラムを開きます。
- 取得ソフトウェアを使用して、 L100 をクリックして、カメラが取り付けられているポートへの光路を切り替えます。緑色の再生(実行)ボタンをクリックして、ソフトウェアを介して顕微鏡FOVを視覚化します。繊毛に焦点が合っていることを確認し、必要に応じて調整します。
- 取得ソフトウェアを使用して、次の設定で顕微鏡をセットアップします。 フィルター:空;コンデンサー:空;フォーマット:ビニングなし。暴露時間:0.003秒;読み出しモード:ローリングシャッター;ROI: 512 × 512 ピクセル。
注意: 露光時間は、1 /露光時間はこの周波数の少なくとも2倍でなければならないため、測定する必要のある最高周波数に基づいています。たとえば、繊毛拍動の最大生理学的範囲= 30 Hzの場合、1 /露光時間= 60、露光時間は0.016秒≤必要があります。 ROIはカメラのフレームレート仕様によって異なります。フレームレート>100HzをキャプチャするROIを選択します。
- 画像取得
- メニューからタイムラプス画像を取得するには、[ 取得 ]をクリックしてから[ 高速タイムラプス]をクリックします。ポップアップウィンドウで、保存場所とファイル名を選択します。1000フレームを取得します。
- [ 適用]をクリックします。緑色の再生(実行)ボタンをクリックして、顕微鏡FOVで繊毛をプレビューし、必要に応じてZフォーカスを調整します。[ 今すぐ実行 ]をクリックして、高速タイムラプスをキャプチャします。
- 高速タイムラプスがキャプチャされたら、緑色の再生(実行)ボタンをクリックして、顕微鏡のFOVを視覚化します。顕微鏡のジョイスティックを使用して、X / Y軸に沿って別のFOVに移動します。
- Zフォーカスを調整して、繊毛にピントを合わせます。[ 今すぐ実行 ]をクリックして、別の高速タイムラプスをキャプチャします。
- 手順 7.2.3-7.2.4 を繰り返します。ALIモデルと気道オルガノイドの場合、3倍の複製サンプルのそれぞれで6倍のFOVを画像化します。気道上皮シートの場合、参加者ごとに最低4倍の複製画像を画像化します。
8. CBFのデータ解析と定量化
- データ分析の準備
注:プロトコルのこのセクションには、カスタム分析スクリプト(補足ファイル3)、生の画像ファイル(セクション7.2で取得)、コンピューティングソフトウェア、および分析ソフトウェアが必要です。- コンピューティングソフトウェア、できれば最新バージョンを分析コンピューターにインストールします。標準のコンピューティングソフトウェアツールボックス(elmat、ops、datafun、uitools、datatypes、iofun、iotools、audiovideo)および画像および信号処理ツールボックスがインストールされていることを確認します。
- カスタム分析スクリプト 'BeatingCiliaBatchOMEfiles_JOVE.m' と 'LoadRawDataExportFilteredMovies_JOVE.m' および 'サポート スクリプト' フォルダーをコンピューターのローカル ドライブにコピーします。
- コンピューティングソフトウェアで、[ホーム]タブをクリックします。次に、[パスの設定]をクリックします(図4A-B)。
- ポップアップウィンドウで、[サブフォルダとともに追加]をクリックします(図4C)。「MATLAB検索パス」で、図4Dに示されているフォルダを選択し、保存して閉じるをクリックします(図4E-F)。
- 解析スクリプトが左側のパネルに表示されていることを確認して、解析スクリプトがコンピューティングソフトウェアにリンクされていることを確認します(図4G)。
- セクション7.2で取得した生の画像ファイル(オープン顕微鏡環境(OME)形式)をコンピューターのローカルドライブに転送します。
注:生の画像ファイルのサンプルには、次の場所からアクセスできます:https://doi.org/10.6084/m9.figshare.16649878.v1。
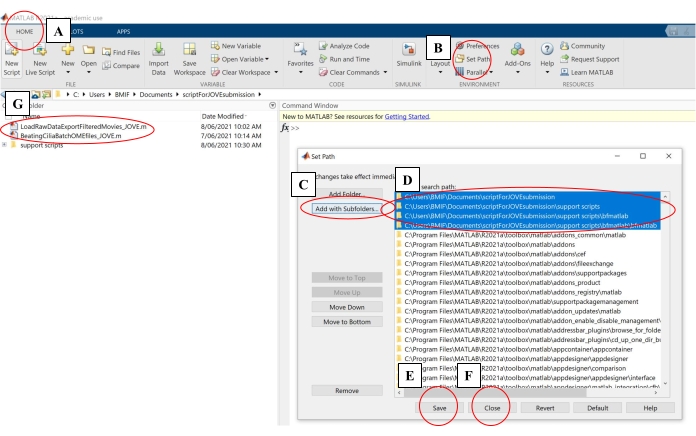
図4:データ分析用のコンピューティングソフトウェアのセットアップ。 (A) [ホーム ]タブを開きます。 (B) [パスの設定]を選択します。(c) [ サブフォルダとともに追加]を選択します。(D) 分析スクリプトを含むフォルダを選択します。(E) 保存を選択します。(F) [閉じる] を選択します。(G) 左側のパネルに解析スクリプトが表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
- 単一画素強度スペクトルのピーク検出によるCBFの定量化
- コンピューティングソフトウェアを開きます。「BeatingCiliaBatchOMEfiles_JOVE.m」解析スクリプトファイルをクリックします(図5A)。
- [エディター]タブをクリックし、緑色の再生(実行)ボタンをクリックしてスクリプトを実行します(図5B-C)。プロンプトウィンドウで、分析する生の画像ファイルを選択します(図5D)。
- ステップ7.1.15の露出時間をフレームごとの取得時間のプロンプトウィンドウに入力し、[ OK ]をクリックします(図5E)。
- スクリプトがCBFを計算して「AveSpectrum」ファイル(補足ファイル4)に出力し、生の画像ファイルと同じフォルダに自動的に保存されるまで、ファイルごとに~15分待ちます。進行状況バーを使用して進行状況を視覚化します (図 5F)。
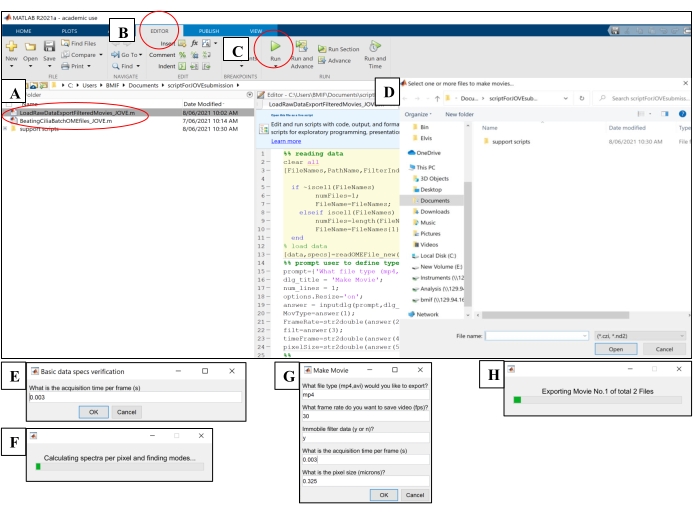
図5:コンピューティングソフトウェアを使用した分析スクリプトの実行 。 (A)CBF('BeatingCiliaBatchOMEfiles_JOVE.m')の分析または繊毛ビートムービーの作成('LoadRawDataExportFilteredMovies_JOVE.m')用のスクリプトを開きます。(B) [エディター ] タブを開きます。 (C) 緑色の再生 (実行) ボタンを選択して、分析スクリプトを実行します。(D)プロンプトウィンドウでは、分析またはムービー作成用のファイルを選択する必要があります。(E) 'BeatingCiliaBatchOMEfiles_JOVE.m' スクリプトの実行中に、ファイル読み取りスクリプトがメタデータを正しく読み取らない場合に備えて、フレームごとの取得時間を手動で入力するように求めるプロンプトが表示されます。(F)計算中の繊毛拍動周波数を示すプログレスバー。(G) 'LoadRawDataExportFilteredMovies_JOVE.m' スクリプトの実行中に、出力するムービーの種類 (mp4 または avi)、ムービーのフレームレート (fps)、不動コンポーネントをムービーデータから削除するかどうか ('y' または 'n')、フレーム時間 (s)、およびムービーにエクスポートされたデータのピクセルサイズ (ミクロン) を手動で入力するプロンプトが表示されます。データ内の粘液やその他の邪魔な不動の層を除去するため、不動のフィルタリングには「y」を使用することをお勧めします。(H) エクスポート中の動画を示すプログレスバー。 この図の拡大版を表示するには、ここをクリックしてください。
- 手順 8.2.1 から 8.2.2 のプロセスを使用して、'AveSpectrum' ファイルを含むフォルダーで 'GetFirstAmplitude.m' スクリプトを実行します。スクリプトが「FirstAmplitudeStacked.xlsx」ファイルを出力するのを待ちます。このファイルには、振幅が最も高く、気道上皮繊毛拍動の生理学的範囲内の周波数 ≥3 Hz と <30 Hz が含まれます。
- 「FirstAmplitudeStacked.xlsxファイルから周波数値をコピーし、科学分析ソフトウェアを使用してプロットします。
注: カスタム分析スクリプトが CBF を定量化する方法については、 補足ファイル 5 を参照してください。分析されたデータセットの例には、次の場所からアクセスできます。 https://doi.org/10.6084/m9.figshare.16649815.
- 繊毛殴打のビデオをエクスポートする
- コンピューティングソフトウェアを開きます。'LoadRawDataExportFilteredMovies_JOVE.m'スクリプトファイル(図5A)をクリックして、スクリプトをロードします。
- [ エディター ] タブをクリックし、緑色の再生 (実行) ボタンをクリックしてスクリプトを実行します (図 5C)。プロンプトウィンドウで、ムービーファイルにエクスポートする生の画像ファイルを選択します(図5D)。
- 表4に詳述されている設定を[ムービーの作成]ポップアップウィンドウに入力します(図5G)。
- スクリプトがムービーファイルを作成し、生の画像ファイルの場所に出力するまで、ファイルごとに~8分待ちます。進行状況バーを使用して進行状況を視覚化します (図 5H)。
| ムービー入力 | 形容 |
| ファイルの種類 | エクスポートするファイルタイプ(mp4またはavi)を入力します。 |
| フレームレート | ムービーをエクスポートするフレームレートを入力します。集録した時系列あたり~1000フレームがある場合は、フレームレート~30fpsを設定することをお勧めします。 |
| 不動フィルタリング | オプションは 'y' または 'n' です。デフォルトは「y」で、時間フィルタリングスクリプトはフーリエ空間を使用して、ムービーデータから不動のコンポーネントを削除します。典型的には、繊毛または不動粘液の下の細胞の任意の層は、除去することができる信号中のゼロ周波数オフセット成分または時間不変成分に寄与する。 |
| フレームあたりの取得時間 | 集録データのフレームあたりの集録時間。これは、ムービーのタイムスタンプを秒単位で表示するために使用されます。 |
| ピクセルサイズ | マイクロメートル単位のピクセルサイズは、ムービーのスケールバーをマイクロメートル単位で表示するために使用されます。 |
表4:動画作成時の入力設定
結果
CBFの定量におけるこのプロトコルの効率を実証するために、CFの3人の参加者と3人の健康な対照参加者に由来する気道上皮細胞ALIモデルで測定されたCBFの結果が提示されます。培養分化の14日目には、叩動繊毛が存在した(図6)。培養分化の14日目から21日目まで、CBFの統計的に有意な(P < 0.0345)増加が両方のコホート内で観察されました。培養分化の21日目に、健康な対照参?...
ディスカッション
鼻上皮シート中のCBFの定量を不明瞭にする可能性のある複数の要因があります。上皮シートは、毛様体機能がこの時間の間に最も安定しているため、サンプル収集から3〜9時間以内に画像化する必要があります37。赤血球や破片が少ないと、データ収集が妨げられるため、イメージングに最適です。イメージングのROIを選択する場合、これらの変数がCBF5に?...
開示事項
著者は、開示するものは何もないと宣言しています。
謝辞
研究参加者とその家族の貢献に感謝します。シドニー小児病院(SCH)ランドウィック呼吸器科からの患者の生体標本の整理と収集の支援に感謝します-ジョン・ウィジャー博士、イボンヌ・ベレッシス博士、リアン・プラッシュ、アマンダ・トンプソン、ロンダ・ベルに感謝します。私たちは、UNSWシドニーのマークウェインライト分析センター内のカタリーナガウス光学顕微鏡施設のイヴェタスラペトワとレニーワンの支援に感謝します。この作業は、オーストラリア国立保健医療研究評議会(NHMRC)(GNT1188987)、CF財団オーストラリア、シドニー小児病院財団の支援を受けています。著者らは、ルミネスアライアンス-子供の健康のためのイノベーションの貢献と支援に感謝したいと思います。Luminesce Alliance - Innovation for Children's Healthは、Sydney Children's Hospitals Network、Children's Medical Research Institute、Children's Cancer Instituteの非営利共同事業です。小児科研究を調整および統合するために、ニューサウスウェールズ州政府の支援を受けて設立されました。ルミネッセアライアンスは、シドニー大学とニューサウスウェールズ大学シドニー校とも提携しています。KMAは、オーストラリア政府の研究トレーニングプログラム奨学金によってサポートされています。LKFは、シドニーコーブ・ロータリークラブ/シドニー小児病院財団とUNSW大学大学院賞奨学金の支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
参考文献
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O'Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O'Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved