Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Recopilación, expansión y diferenciación de modelos primarios de células epiteliales nasales humanas para la cuantificación de la frecuencia de latido de los cilios
En este artículo
Resumen
Este protocolo describe la recolección, expansión y diferenciación de células epiteliales nasales a modelos organotípicos de células epiteliales de las vías respiratorias y la cuantificación de la frecuencia de latidos de los cilios a través de imágenes de células vivas y guiones personalizados.
Resumen
Las mediciones de la función de los cilios (frecuencia de latido, patrón) se han establecido como herramientas de diagnóstico para enfermedades respiratorias como la discinesia ciliar primaria. Sin embargo, la aplicación más amplia de estas técnicas está limitada por la extrema susceptibilidad de la función ciliar a los cambios en los factores ambientales, por ejemplo, temperatura, humedad y pH. En las vías respiratorias de los pacientes con fibrosis quística (FQ), la acumulación de moco impide el latido de los cilios. La función de los cilios se ha investigado en modelos de células primarias de las vías respiratorias como un indicador de la actividad del canal CF Transmembrane conductance Regulator (CFTR). Sin embargo, se ha encontrado una considerable variabilidad de paciente a paciente en la frecuencia de latidos de los cilios en respuesta a los fármacos moduladores de CFTR, incluso para pacientes con las mismas mutaciones de CFTR . Además, el impacto de la secreción disfuncional de cloruro regulada por CFTR en la función ciliar es poco conocido. Actualmente no existe un protocolo integral que demuestre la preparación de muestras de modelos de vías respiratorias in vitro , la adquisición de imágenes y el análisis de la frecuencia de latido de los cilios (CBF). Las condiciones de cultivo estandarizadas y la adquisición de imágenes realizadas en una condición ambientalmente controlada permitirían una cuantificación consistente y reproducible de CBF entre individuos y en respuesta a fármacos moduladores de CFTR. Este protocolo describe la cuantificación de CBF en tres sistemas diferentes de modelos de células epiteliales de las vías respiratorias: 1) láminas epiteliales nativas, 2) modelos de interfaz aire-líquido fotografiados en insertos de soporte permeables y 3) organoides tridimensionales incrustados en matriz extracelular. Los dos últimos replican la fisiología pulmonar in vivo , con cilios batidos y producción de moco. La función ciliar se captura utilizando una cámara de vídeo de alta velocidad en una cámara controlada por el entorno. Se utilizan scripts personalizados para el análisis de CBF. Se prevé que la traducción de las mediciones de CBF a la clínica sea una herramienta clínica importante para predecir la respuesta a los fármacos moduladores de CFTR por paciente.
Introducción
Las mediciones de la frecuencia de latido de los cilios (CBF) y el patrón se han establecido como herramientas de diagnóstico para enfermedades respiratorias como la discinesia ciliar primaria (PCD)1. En la fibrosis quística (FQ), la disfunción del canal de cloruro del regulador de conductancia transmembrana (CFTR) de la FQ causa deshidratación del líquido de la superficie de las vías respiratorias y alteración del aclaramiento mucociliar2. La función ciliar ha sido investigada in vitro en modelos de células primarias de la vía aérea como indicador de la actividad del canal CFTR3. Sin embargo, existe una considerable variabilidad paciente a paciente en la CBF en respuesta a los fármacos moduladores de CFTR, incluso para pacientes con las mismas mutaciones CFTR 3. Además, el impacto de la secreción disfuncional de cloruro regulada por CFTR en la función ciliar es poco conocido. Actualmente no existe un protocolo integral que demuestre la preparación de muestras de modelos de vías respiratorias in vitro , la adquisición de imágenes y el análisis de CBF.
Las láminas epiteliales nasales aisladas de cepillados de la mucosa nasal se utilizan directamente para la medición de la función ciliar para el diagnóstico de DCP4. Sin embargo, aunque no hay control sobre el tamaño o la calidad de las láminas epiteliales nasales obtenidas, el CBF varía dependiendo de si se mide en células individuales o láminas celulares y en bordes ciliados de láminas epiteliales que están interrumpidas o no interrumpidas5. Como tal, las discinesias secundarias causadas por el daño a las células durante la recolección de cepillados de la mucosa nasal pueden influir en la CBF. El cultivo celular primario de células epiteliales nasales y su diferenciación en la interfaz aire-líquido (LPA) o en la matriz tridimensional de la membrana basal en organoides epiteliales de las vías respiratorias ciliadas dan lugar a cilios libres de discinesias secundarias 4,6,7,8. Las células epiteliales de las vías respiratorias diferenciadas en ALI (en adelante denominadas modelos ALI) se han considerado una importante ayuda diagnóstica secundaria que replica los patrones de latido ciliar y la frecuencia de cepillados ex vivo de la mucosa nasal6 y permite el análisis de la ultraestructura ciliar, el patrón de latido y la frecuencia de latido, al tiempo que conserva defectos específicos del paciente9 . Sin embargo, existen discrepancias en las metodologías utilizadas para crear estos modelos celulares pseudoestratificados y mucociliares diferenciados. Diferentes protocolos de expansión o diferenciación del cultivo podrían inducir distintos fenotipos epiteliales (ciliados o secretores)10 y dar lugar a diferencias significativas en la CBF11. El CBF se ha cuantificado en cepillados epiteliales nasales 4,6,12,13,14,15,16, organoides epiteliales de la vía aérea 14,17,18 y modelos ALI 3,4,6,13,19,20, 21. Sin embargo, entre estos protocolos, existen grandes variabilidades, y a menudo muchos parámetros no están controlados. Por ejemplo, en algunos estudios, CBF se visualiza in situ mientras que las células del modelo ALI permanecen en el inserto de soporte permeable 3,19,20,21, y otros raspan las células del inserto de soporte permeable y las visualizan suspendidas en medios 4,6,13.
Además, la aplicación más amplia de técnicas que miden la función ciliar está limitada por la extrema susceptibilidad de la función ciliar a los cambios en los factores ambientales. Los factores ambientales como la temperatura 22, la humedad 23,24 y el pH 25,26 influyen en la función ciliar y deben regularse para cuantificar el CBF con precisión. Los diversos parámetros fisiológicos utilizados en diferentes laboratorios y cómo influyen en la CBF han sido revisados previamente27.
En la literatura se informan diversas tecnologías de imagen y enfoques para las mediciones de CBF. Para el diagnóstico de PCD, la microscopía de video se utiliza para medir la función ciliar28,29. Recientemente, se utilizó un algoritmo de análisis de video basado en microscopía dinámica diferencial para cuantificar la coordinación de CBF y cilios en modelos ALI de células epiteliales de las vías respiratorias 3,30. Este método permite caracterizar el latido ciliar en células epiteliales de la vía aérea de forma rápida y totalmente automatizada, sin necesidad de segmentar o seleccionar regiones. Varios métodos para la obtención de imágenes y la cuantificación del CBF pueden aumentar las diferencias reportadas en CBF en la literatura (Archivo complementario 1).
Un protocolo desde el cultivo hasta la cuantificación para racionalizar los métodos existentes, la estandarización de las condiciones de cultivo y la adquisición de imágenes, realizada en condiciones estrictamente controladas ambientalmente, permitiría una cuantificación consistente y reproducible de CBF dentro y entre individuos.
Este protocolo proporciona una descripción completa de la colección de células epiteliales, las condiciones de cultivo de expansión y diferenciación, y la cuantificación de CBF en tres sistemas diferentes de modelos de células epiteliales de las vías respiratorias de origen nasal: 1) láminas epiteliales nativas, 2) modelos ALI fotografiados en insertos de soporte permeables y 3) organoides tridimensionales incrustados en matriz extracelular (ECM) (Figura 1 ). Las células epiteliales nasales obtenidas de cepillados de cornetes nasales inferiores se utilizan como representantes del epitelio de la vía aérea, ya que son un sustituto eficaz de las células epiteliales bronquiales31 superando el procedimiento invasivo asociado a la recolección de cepillados bronquiales. El método de la célula de reprogramación condicional (CRC) se utiliza para expandir las células epiteliales primarias de las vías respiratorias para la creación de modelos ALI y organoides tridimensionales. La reprogramación condicional de las células epiteliales de las vías respiratorias a un estado similar al de las células madre es inducida por el cocultivo con el sistema de células alimentadoras de fibroblastos con detención del crecimiento y el inhibidor de la quinasa asociada a Rho (ROCK)32. Es importante destacar que el método del CCR aumenta la duplicación de la población en las células epiteliales de las vías respiratorias, al tiempo que conserva su potencial de diferenciación tisular específico33,34. En todos los modelos de células epiteliales de las vías respiratorias, la función ciliar se captura en una cámara de temperatura controlada utilizando una cámara de video de alta velocidad con ajustes estandarizados de adquisición de imágenes. Se emplean scripts personalizados para la cuantificación de CBF.

Figura 1: Esquema del flujo de trabajo. Después de cepillar el cornete nasal inferior de los participantes, las células epiteliales de las vías respiratorias se utilizan de una de dos maneras. O bien se aíslan las láminas epiteliales de las vías respiratorias y se obtiene una imagen inmediata de la frecuencia de latido de los cilios, o bien las células epiteliales de las vías respiratorias se expanden mediante el método de reprogramación condicional de las células. Las células epiteliales de las vías respiratorias expandidas por CCR se diferencian para establecer células epiteliales de las vías respiratorias en una interfaz aire-líquido o cultivos de organoides epiteliales de las vías respiratorias. Las imágenes de la frecuencia de latido ciliar se adquieren utilizando un microscopio de imagen de células vivas con una cámara ambiental de calentamiento y humedad y una cámara científica de velocidad de cuadro rápida (>100Hz). El análisis de datos se realiza utilizando scripts personalizados. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Se recibió la aprobación del estudio de la Junta de Revisión Ética de la Red del Hospital de Niños de Sydney (HREC/16/SCHN/120). Se obtuvo el consentimiento por escrito de todos los participantes (o del tutor de los participantes) antes de la recolección de muestras biológicas.
1. Preparativos para establecer modelos de células epiteliales de la vía aérea
- Prepare los medios de recolección de células nasales combinando 80% de medio de águila modificado de Dulbecco y 20% de suero bovino fetal. Suplemento con 1 μL/mL de Penicilina/Estreptomicina. Conservar a 4 °C durante un máximo de 3 meses.
- Cubra los matraces o insertos de soporte permeables con solución de colágeno según las necesidades siguiendo los pasos 1.2.1-1.2.4. No almacene vasos recubiertos de colágeno a largo plazo.
- Haga una dilución 1:100 de solución de colágeno tipo I (cepas de 3 mg/ml) con solución salina tamponada con fosfato (PBS) hasta una concentración final de 0,03 mg/ml. Mezclar bien.
- Cubrir los matraces de cultivo celular (sección 4) con 160 μL/cm2 (es decir, 4 ml por matraz T25) e insertos de soporte permeables (sección 5) con 455 μL/cm2 (es decir, 150 μL por inserto de 6,5 mm) de la solución de colágeno preparada.
- Incubar a 37 °C durante 2-24 h.
- Retire la solución de colágeno con pipeta o aspirador al vacío antes de sembrar las células. No lave el recipiente antes de sembrar las células.
- Prepare los medios de la celda de reprogramación condicional (CRC) combinando los componentes32 enumerados en la Tabla 1. Esterilice el filtro utilizando un sistema de filtro de vacío con tapa de botella. Conservar a 4 °C durante un máximo de 2 meses.
- El día de uso, añadir factor de crecimiento epidérmico humano, inhibidor de ROCK y antibióticos como se indica en la Tabla 1.
| Componente | Volumen |
| DMEM, glucosa alta | 156.7 ml |
| DMEM/F-12, HEPES | 313.3 ml |
| Hidrocortisona | 55,6 μL |
| Insulina | 1,25 ml |
| Toxina del cólera | 21 μL |
| Adenina | 1,2 ml |
| HI-FBS | 25 ml |
| Penicilina-estreptomicina | 5 ml |
| Factor de crecimiento epidérmico humano | 1 μL/ml |
| Inhibidor de ROCK | 1 μL/ml |
| Fungizone | 2 μl/ml |
| Tobramicina | 2 μL/ml |
| Hidrato de ceftazidima | 4 μL/ml |
| Solución de gentamicina | 1 μL/ml |
Tabla 1: Componentes para 500 mL de medios celulares de reprogramación condicional
2. Recogida de cepillados nasales inferiores de cornetes
NOTA: Esta sección del protocolo requiere un tubo de recolección (50 ml) con medios de recolección de células nasales, cepillos de citología, pañuelos desechables y equipo de protección personal apropiado. Evite cepillarse durante una infección del tracto respiratorio superior. Existe un pequeño riesgo de sangrado, que aumenta si hay inflamación. Si el propósito del cepillado es obtener láminas epiteliales de las vías respiratorias para mediciones ex vivo de CBF, el cepillado debe ocurrir un mínimo de 6 semanas después de cualquier infección de las vías respiratorias superiores; idealmente, más de 10 semanas después de la infección35.
- Prepare los medios de recolección de células nasales (sección 1) y mantenga el tubo en hielo.
- Describa el procedimiento al participante como incómodo. Explique que se siente una sensación completa en la fosa nasal durante el cepillado, similar a saltar al océano / piscina y el agua que se precipita hacia el conducto nasal. Informe a los participantes que el procedimiento inducirá la producción de lágrimas como reflejo.
- Evalúe qué posicionamiento es apropiado para el participante. Coloque al participante en posición supina si hay un sofá de examen disponible, ya que la posición supina evita el movimiento de la cabeza del participante lejos del cepillo durante el procedimiento. Alternativamente, siente al participante junto a una pared, contra la que pueden presionar su cabeza hacia atrás.
- Inspeccione el conducto nasal. Tenga en cuenta la desviación septal, pólipos y cualquier otra anomalía anatómica que pueda afectar el paso del cepillo en el pasaje nasal y aumentar el riesgo de sangrado.
- Limpie la nariz del exceso de moco pidiéndoles a los participantes que se suenen la nariz en un pañuelo desechable.
- Pídale al participante que respire por la boca. Tome un cepillo de citología en la mano dominante. Mientras apoya el quinto dígito en la barbilla del participante para anclar la mano, inserte el cepillo citológico en el pasaje nasal del participante (Figura 2). Inserte el cepillo a ~ 45 ° en la cara del participante para pasar a través del meato nasal.
- Pivote el cepillo hacia arriba para que quede perpendicular a la cara del participante. Avance el cepillo suave pero firmemente contra la pared lateral de la nariz debajo del cornete inferior hasta que esté en la parte media a posterior del cornete inferior.
NOTA: Evite la inserción excesiva; Si se siente una caída repentina en la resistencia, se ha ingresado la faringe nasal y el cepillo debe retraerse hasta que el proceduralista vuelva a sentir la resistencia. - Gire el pincel 360° hasta tres veces. Retire el cepillo suavemente en reversa de la maniobra de inserción, para que las células no se desprendan del cepillo.
- Coloque el cepillo en el tubo de recolección preparado con medios de recolección de células nasales. Coloque el tubo de recolección sobre hielo.
- Repita el cepillado en la segunda fosa nasal si el participante está de acuerdo / se requiere un gran número de células (por ejemplo, para iniciar el cultivo celular).
NOTA: La misma fosa nasal se puede cepillar nuevamente si no hay células sanguíneas visibles en el cepillo, notando, sin embargo, que el riesgo de sangrado aumenta ligeramente con un segundo cepillado en la misma fosa nasal.
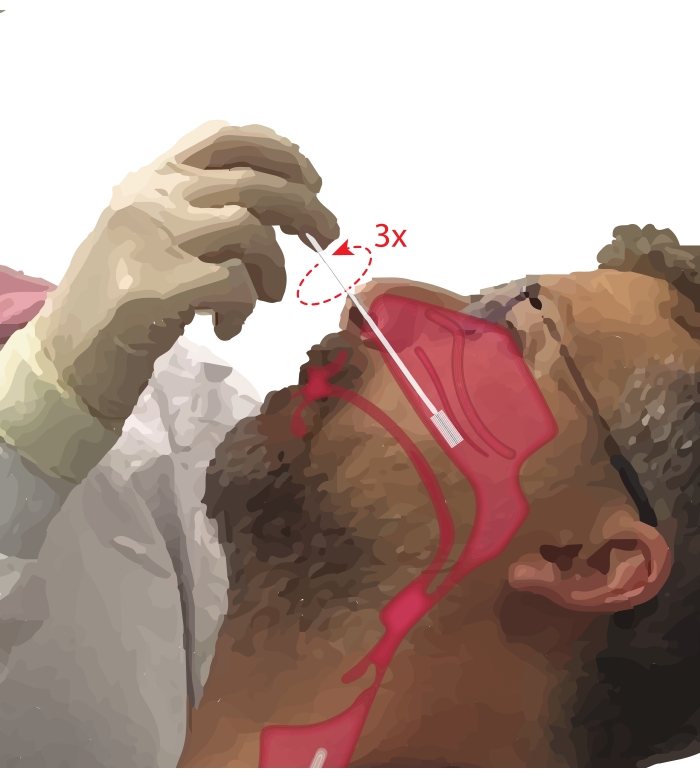
Figura 2: Colección de células epiteliales nasales. Ilustración de la ubicación del cepillo citológico en la parte media a posterior del cornete inferior. Esta posición se alcanza insertando el cepillo a través de las fosas nasales, girando el cepillo a un ángulo de 90 ° con respecto a la cara y guiando el cepillo a lo largo del pasaje nasal debajo del cornete inferior. Haga clic aquí para ver una versión más grande de esta figura.
3. Preparación de láminas epiteliales de la vía aérea
NOTA: Esta sección del protocolo requiere tubo de recolección (cepillo(s) de citología + 1 mL de medios de recolección de células nasales) (sección 2) y placa de fondo plano de 96 pocillos. Si recolecta cepillados de cornetes nasales con el propósito de obtener imágenes de las láminas epiteliales de las vías respiratorias, solo use 1 ml de medios de recolección de células nasales libres de antibióticos; De lo contrario, las hojas epiteliales estarán demasiado dispersas para obtener imágenes.
- Agite suavemente el tubo de recolección que contiene el(los) cepillo(s) citológico(s) para desalojar las láminas epiteliales de las vías respiratorias del cepillo(s).
- Recoja todos los medios y células con una pipeta P1000. Dispense 5-6 gotas en un pozo de un plato de fondo plano de 96 pocillos. Repita para aproximadamente siete pozos.
- Transfiera la placa al microscopio según el paso 7.1.4 y siga el resto de la sección 7 para obtener una imagen de la frecuencia de latido de los cilios.
- Imagen de láminas epiteliales (Figura 1) y no de células sueltas individuales, ya que se ha demostrado que la función ciliar difiere entre las láminas epiteliales y las células individuales no unidas5.
4. Expansión y mantenimiento de las células epiteliales de las vías respiratorias
- Cultivo de reprogramación celular condicional epitelial de las vías respiratorias
NOTA: Vaso recubierto de solución de colágeno (sección 1), Células alimentadoras embrionarias de ratón irradiadas (NIH-3T3), Medios de células de reprogramación condicional (CCR) (sección 1), cepillo(s) de citología en medios de recolección de células nasales (sección 2).- Células alimentadoras irradiadas en placa en recipientes de cultivo recubiertos con solución de colágeno preparados a una densidad de siembra de 8.000 células/cm2 al menos 2 h y no más de72 h antes del cocultivo con células epiteliales de las vías respiratorias (ver36 para cultivo de células alimentadoras e irradiación).
- Transfiera las células cepilladas en el tubo de recolección (cepillo citológico + medios de recolección de células nasales) al vórtice sobre hielo. A baja velocidad, tubo de vórtice 10 s encendido, 10 s apagado (mantener en hielo en el medio) para desalojar las células de los cepillos. El vórtice vigoroso puede disminuir la viabilidad celular. Inspeccione el(los) cepillo(s) para comprobar si el moco todavía está adherido. Si es así, repite el vórtice.
- Transfiera el(los) tubo(s) en hielo de nuevo al gabinete de bioseguridad. Utilice una pipeta serológica para transferir el medio del tubo de recolección a un nuevo tubo (tubo B), dejando atrás los cepillos citológicos. Tubo de centrífuga B a 300 × g durante 7 min a 4 °C.
- Retire el tubo B de la centrífuga, deseche el sobrenadante. Si el moco es visible, lave el gránulo con otros 5 ml de medios de recolección de células nasales y centrifugar nuevamente.
- Agregue 1 ml de medio CRC para resuspender el pellet celular en el tubo B. Usando una pipeta serológica de 5 ml, pase las células a través de un tamiz celular colocado sobre un tubo de 50 ml (tubo C) con un movimiento circular.
- Repita varias veces para formar una suspensión de una sola célula. Recoger los medios residuales de la parte inferior del tamiz e incorporarlos con el medio. Deseche el tamiz celular.
- Con una pipeta serológica de 5 ml, tomar 1 ml de medio del tubo C y transferirlo a un tubo de microcentrífuga.
- Tomar 10 μL de esta suspensión celular y añadirla al tubo de microcentrífuga prealícitado con 10 μL de azul de tripano. Mezcle bien e inmediatamente use un contador de células automatizado para registrar el recuento de células y la viabilidad.
- Sembrar las células epiteliales de las vías respiratorias en el matraz T25 presembrado con células alimentadoras irradiadas.
- Mantenimiento y disociación de las células epiteliales de las vías respiratorias
NOTA: Los medios CRC deben calentarse a 37 °C colocándolos en un baño de agua de laboratorio con temperatura controlada o en un dispositivo de baño de perlas antes de agregarlos a las celdas.- Revise las células bajo el microscopio de cultivo celular (lente objetivo de 4×) regularmente para determinar su fijación, contaminación, morfología y confluencia.
- Cambie los medios de comunicación de CRC cada dos días. Cuando se observen células reprogramadas (Figura 1) y no haya contaminación presente, reducir o retirar los antibióticos.
- Cuando las células alcancen el 90% de confluencia, utilice un método de tripsina doble32 para disociar las células y realizar un recuento de células como se describe en el paso 4.1.8 (consulte el Archivo complementario 2 para la disociación y congelación celular).
5. Siembra y diferenciación de células epiteliales de la vía aérea y mantenimiento de modelos diferenciados de ALI
- Siembra de células epiteliales de las vías respiratorias a insertos de soporte permeables
- Transfiera los insertos de soporte permeable recubiertos con solución de colágeno (sección 1) de la incubadora deCO2 al gabinete de bioseguridad. Aspirar la solución de colágeno y desechar. Añadir 750 μL de medio de expansión (libre de antibióticos) al compartimento basal de los insertos de soporte permeables.
- Transfiera las células disociadas o descongeladas en hielo al gabinete de bioseguridad. Agregue el volumen de medio de expansión necesario para sembrar 200,000-250,000 células en 150 μL al compartimiento apical de cada inserto de soporte permeable.
- Tener cuidado de no crear burbujas; Mezclar bien para asegurar que las células sean homogéneas y estén en suspensión. Agregue 150 μL de la suspensión celular al lado apical de cada inserto de soporte permeable.
- Resuspender las células después de sembrar cada tres insertos de soporte permeables para mantener una suspensión celular homogénea.
- Cada dos días hasta que se forme una monocapa celular confluente (generalmente para el día 4 después de la siembra), deseche el medio y agregue un medio de expansión fresco calentado a temperatura ambiente (RT, 15-25 ° C).
- Diferenciación de las células epiteliales de las vías respiratorias en la interfaz aire-líquido
- Medios ALI calientes (libres de antibióticos) a RT (15-25 °C).
- Retire el medio de expansión y cambie a medios de diferenciación (ALI) en los compartimentos apical y basal.
- Después de 2 días de cultivo en medios ALI sumergidos, aspirar y desechar los medios.
- Agregue 750 μL de medios ALI al compartimento basal solo para crear una interfaz aire-líquido.
NOTA: Si después de 1 semana de cultivo, la monocapa no es confluente y todavía se observan agujeros, las células ya no pueden tener la capacidad de expandirse en las regiones vacías, considere descartar las células epiteliales de las vías respiratorias.
- Mantenimiento del modelo diferenciado de ALI y eliminación de moco
- Cambiar los medios apicales y basales cada dos días hasta la diferenciación completa (día 21-25 post establecimiento de la interfaz aire-líquido).
- Una vez por semana, lave la mucosidad del lado apical siguiendo los pasos 5.3.3-5.3.4.
- PBS caliente a RT (15-25 °C).
- Agregue 200 μL de PBS al compartimiento apical. Incubar en la incubadora deCO2 durante 10 min. Use un dispositivo de aspiración o pipeta para extraer el PBS.
6. Organoides epiteliales tridimensionales de las vías respiratorias
- Preparaciones para el cultivo de organoides epiteliales de las vías respiratorias
- Coloque la(s) placa(s) de 24 pocillos en una incubadora deCO2 para calentar a 37 °C durante la noche.
- Descongele un vial de 10 ml de ECM (Tabla de materiales) en hielo según las instrucciones del fabricante. Prepare alícuotas de 500 μL (un solo uso) para minimizar el número de ciclos de congelación-descongelación.
NOTA: Se recomienda usar ECM con concentración de proteína >10.5 mg / ml para obtener los mejores resultados de cultivo. Una concentración más baja acelerará la desintegración de la cúpula ECM y aumentará la aparición de organoides apicales orientados hacia afuera. - Use el kit de organoides de las vías respiratorias (tabla de materiales) para preparar los medios de siembra de organoides de las vías respiratorias (AOSM) y los medios de diferenciación (AODM) según las instrucciones del fabricante.
- Preparar los medios basales organoides de las vías respiratorias según la Tabla 2.
| Componente | Volumen |
| DMEM/F-12 avanzado | 500 ml |
| HEPES | 5 ml |
| Alanil-glutamina | 5 ml |
| Penicilina-estreptomicina | 5 ml |
Tabla 2: Componentes de los medios basales organoides de las vías respiratorias
- Utilice el número de células epiteliales vivas de las vías respiratorias disociadas en la sección 4.2 para calcular cuántos pocillos se pueden sembrar con una densidad de siembra de 10.000 células (ver Tabla 3).
- Calcule el volumen total de ECM y AOSM necesario para crear 1 x 50 μL de domo ECM al 90% (45 μL de ECM y 5 μL de AOSM) por pocillo.
NOTA: La densidad de siembra recomendada de 10.000 células por pocillo es para las células epiteliales nasales expandidas por CCR en el pasaje 1. Las células de paso posterior pueden requerir una mayor densidad de siembra para lograr la formación del mismo número de organoides.
| Número de pozos | Número de celdas | Número de domos | Vol de Matrigel ECM | Vol de AOSM |
| 1 | 10.000 células | 1 | 45 μL x 1.1 | 5 μL x 1.1 |
| 2 | 20.000 células | 2 | 90 μL x 1.1 | 10 μL x 1.1 |
| 5 | 50.000 células | 5 | 225 μL x 1.1 | 25 μL x 1.1 |
| ......... | ......... células | ......... | .........μL x 1.1 | .........μL x 1.1 |
Tabla 3: Cálculos para sembrar células epiteliales de las vías respiratorias en domos ECM
- Siembra de células epiteliales de las vías respiratorias en domos ECM
NOTA: Mantenga ECM en hielo en todo momento y realice todos los pasos que involucren ECM en hielo, ya que ECM comenzará a solidificarse a temperaturas >10 ° C.- Resuspender las células epiteliales de la vía aérea disociadas en la sección 4.2 con el volumen calculado de 90% de MEC según la Tabla 3.
- Sosteniendo la pipeta en un ángulo de 90° (vertical) lo más cerca posible del fondo del pozo, dispense 50 μL (hasta la primera parada para evitar crear burbujas) de la suspensión de celda ECM al centro del pozo. Evite tocar la pared del pozo.
- Incubar la placa a 37 °C durante 20 min hasta que la ECM se solidifique. Mientras el ECM se solidifica, caliente el AOSM a RT (15-25 °C) para evitar que cause relicuación y desintegración del domo ECM al agregarlo.
- Agregue 500 μL de AOSM calentado a cada pocillo dispensando la pared del pozo. No pipetear los medios directamente sobre la cúpula ECM.
- Cambie los medios cada 2 días durante 4-7 días. Para aspirar medios, incline la placa en un ángulo de 45° y aspire desde el borde inferior del pozo lejos de la cúpula ECM.
- Después de 4-7 días, iniciar la diferenciación organoide añadiendo 500 μL de AODM (15-25 °C) a cada pocillo y cambiar de medio cada 2 días durante 7 días.
- Replacar organoides epiteliales de las vías respiratorias en el día 7 de diferenciación
NOTA: Es necesario replacar los organoides epiteliales de las vías respiratorias porque el borde de las cúpulas de ECM se desintegra gradualmente durante el período de cultivo de 2 semanas. Los organoides epiteliales de las vías respiratorias en el borde de la cúpula pueden perderse (desprenderse en el medio) o tener orientación apical-orientada hacia afuera cuando no están completamente incrustados en la ECM. El paso de rechapado también "limpia" la cúpula ECM mediante la eliminación de células / residuos que no forman organoides con éxito.- Aspirar los medios de cada pocillo. Añadir 500 μL de medios basales organoides fríos de las vías respiratorias (en adelante denominados medios basales) a cada pocillo.
- Utilice la pipeta P1000 ya que esta punta de pipeta tiene el orificio más grande y reducirá la probabilidad de que los organoides estallen durante el pipeteo. Ajuste la pipeta a 350 μL para evitar la creación de burbujas, luego pipete hacia arriba y hacia abajo suavemente para interrumpir la cúpula ECM en cada pocillo. Recoja todos los medios ECM/basales en un tubo de centrífuga de 15 ml.
- Enjuague cada pozo con 500 μL de medios basales fríos. Recoja los medios basales que contienen cualquier ECM y organoides restantes en el mismo tubo de centrífuga de 15 ml que el anterior.
- Centrifugar a 300 x g durante 5 min a 4 °C. De las tres capas visibles después de la centrifugación - (1) sobrenadante, (2) ECM que contiene restos celulares (esponjoso) y (3) pellets que contienen organoides - deseche el sobrenadante y la capa de ECM y conserve el pellet organoide.
- Agregue 1 ml de medio basal frío al pellet organoide y pipete hacia arriba y hacia abajo suavemente para separar cualquier ECM restante. Agregue 6 ml de medios basales fríos al tubo y mezcle suavemente.
- Centrifugar a 300 × g durante 5 min a 4 °C. Deseche el sobrenadante.
- Si el exceso de ECM sigue siendo visible, repita los pasos 6.3.5- 6.3.6 para realizar otro lavado.
- Resuspender el pellet organoide con un volumen apropiado de 90% ECM (use AODM en lugar de AOSM) para placar ~ 30 organoides por 50 μL de la cúpula.
- Compruebe la densidad de los organoides bajo el microscopio de cultivo celular (lente objetivo 4x) después de chapar la primera cúpula. Si es demasiado denso, agregue un 90% adicional de ECM para lograr la densidad deseada de ~ 30 organoides.
- Siga los pasos 6.2.3- 6.2.4 para solidificar la ECM y alimentar las células cada dos días con 500 μL de AODM calentada a cada pocillo durante otros 14 días hasta que alcancen la madurez (después de 21 días de diferenciación) con formación de lúmenes rodeados de epitelio pseudoestratificado orientado hacia adentro que contiene células basales, células ciliadas y células caliciformes.
NOTA: Los organoides epiteliales de las vías respiratorias descritos aquí están diferenciados terminalmente y no pueden ser pasados o criopreservados.
7. Frecuencia de latido de los cilios de imágenes
NOTA: Esta sección del protocolo requiere un microscopio de imagen de células vivas con una cámara ambiental de calentamiento y humedad, una cámara científica de velocidad de cuadro rápida (>100 Hz), un objetivo de distancia de trabajo de 20x y software de imágenes (consulte la Tabla de materiales para conocer el equipo recomendado utilizado en este protocolo).
- Configuración del microscopio
- Asegúrese de que el sistema de calentamiento del microscopio esté encendido y equilibrado a 37 °C. Encienda el microscopio. Ajuste el gas al 5% de CO2 a través del mezclador de gas deCO2/aire.
- Rellene la botella del módulo de humedad por la que pasa elCO2 con agua purificada. Ajuste la humedad relativa al 85% a través del controlador superior de la etapa para que el agua se caliente y las celdas reciban aire humidificado. Equilibrar la cámara durante 30 min.
- Coloque el inserto de la placa del microscopio en el soporte del microscopio.
- Transfiera los modelos de células epiteliales de las vías respiratorias de la incubadora al microscopio en un bloque de calor o perlas térmicas equilibradas a 37 °C para mantener la muestra a una temperatura fisiológica.
- Coloque la placa de cultivo que contiene los modelos de células epiteliales de las vías respiratorias en el inserto de la placa del microscopio. Cierre la cámara ambiental del microscopio.
- Deje que la muestra se equilibre en la cámara de microscopio precalentada a 37 °C, 5% deCO2 llena durante 30 min.
NOTA: Un tiempo de equilibrio más corto puede ser suficiente. Esto se puede determinar realizando un experimento para identificar el tiempo requerido para la estabilización de CBF (consulte la Figura 3).
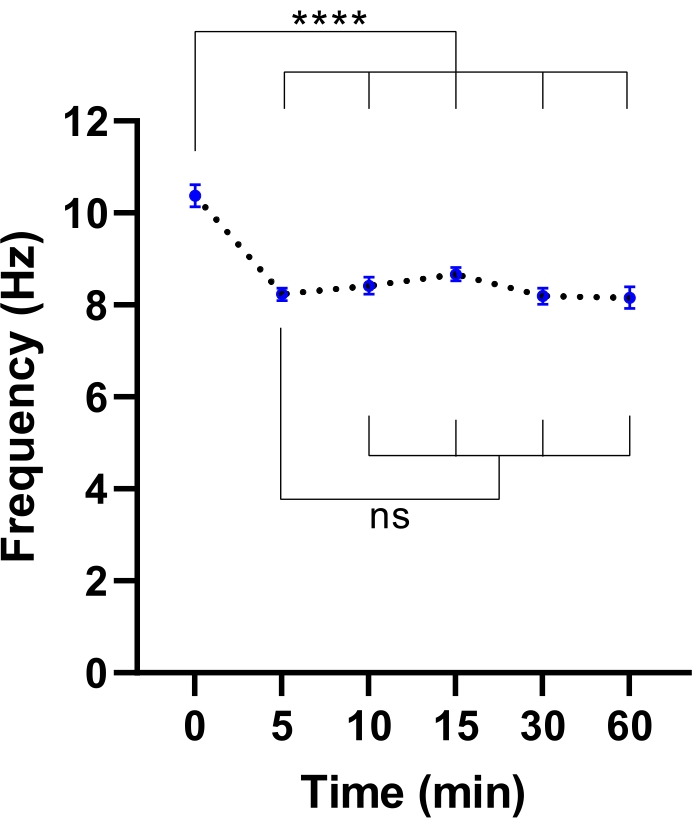
Figura 3: Estabilización de la frecuencia de latido ciliar en microscopio de imágenes de células vivas. Diagramas de puntos de la frecuencia media de latidos de los cilios (CBF) en células epiteliales de las vías respiratorias en la interfaz aire-líquido (modelos ALI) después de la transferencia a un microscopio de imágenes de células vivas con una cámara ambiental. La cámara se equilibró y se mantuvo a 37 °C, 5% deCO2 y humedad relativa del 85% durante 30 min antes de abrir la puerta de la cámara y colocar la placa de cultivo en el inserto de la placa del microscopio. Los modelos celulares fueron fotografiados durante 60 min a intervalos indicados. Los modelos de ALI se derivaron de dos participantes con FQ. Se adquirieron seis imágenes de campo de visión (FOV) por modelo de ALI. Cada punto (azul) representa la media del CBF en 12-36 imágenes FOV. Los datos se representan como media ± SEM, con media conectada por una línea punteada. Se utilizó el análisis unidireccional de varianza (ANOVA) para determinar las diferencias estadísticas. P < 0,0001, ns: sin significación. Haga clic aquí para ver una versión más grande de esta figura.
- Durante el período de equilibrio, en la computadora, abra el software de adquisición. Seleccione la lente objetivo de larga distancia de trabajo 20x.
- En el ocular del microscopio, concéntrese en el modelo celular (~Z = 8000 μm).
- Asegúrese de que el microscopio esté configurado para la iluminación de Kohler de modo que los filamentos de la bombilla de la fuente de luz de transmisión no se enfoquen en el plano de la muestra, evitando artefactos en la imagen. Para ello, siga los pasos 7.1.10-7.1.13
- Cierre completamente el diafragma de iris de campo por encima del condensador. Abra lentamente el diafragma del iris de campo y mueva el condensador hacia arriba / abajo hasta que aparezca una forma de octágono.
- Si el diafragma del iris del campo no está alineado (es decir, el octágono no está en el centro del campo de visión (FOV)), alinéelo al centro con las teclas Allen.
- Una vez que el diafragma del iris del campo esté alineado, ajuste el enfoque del condensador para enfocar el octágono con nitidez.
- Abra el diafragma del iris del campo hasta que ya no se pueda ver dentro del FOV.
- Con el software de adquisición, haga clic en L100 para cambiar la ruta de la luz al puerto donde está montada la cámara. Haga clic en el botón verde play (Ejecutar) para visualizar el campo de visión del microscopio a través del software. Verifique que los cilios estén enfocados y ajuste si es necesario.
- Utilizando el software de adquisición, configure el microscopio con los siguientes ajustes: Filtros: vacío; Condensador: vacío; Formato: sin binning; Tiempo de exposición: 0.003 s; Modo de lectura: rolling shutter; ROI: 512 × 512 píxeles.
NOTA: El tiempo de exposición se basa en la frecuencia más alta que debe medirse, ya que 1/tiempo de exposición debe ser al menos el doble de esta frecuencia. Por ejemplo, si el rango fisiológico máximo de latidos de cilios = 30 Hz, entonces 1/tiempo de exposición = 60, y el tiempo de exposición debe ser ≤ 0.016 s. El ROI depende de las especificaciones de la velocidad de fotogramas de la cámara. Seleccione un ROI que capture velocidades de fotogramas >100 Hz.
- Adquisición de imágenes
- Para adquirir imágenes de lapso de tiempo desde el menú, haga clic en Adquirir y luego haga clic en Lapso de tiempo rápido. En la ventana emergente, seleccione una ubicación para guardar y un nombre de archivo. Adquiere 1000 marcos.
- Haga clic en Aplicar. Haga clic en el botón verde play (Ejecutar) para obtener una vista previa de los cilios en el campo de visión del microscopio y ajustar el enfoque Z si es necesario. Haga clic en Ejecutar ahora para capturar el lapso de tiempo rápido.
- Una vez que se haya capturado el lapso de tiempo rápido, haga clic en el botón verde play (Ejecutar) para visualizar el FOV del microscopio. Con el joystick del microscopio, desplácese a lo largo del eje X/Y hasta otro FOV.
- Ajuste el enfoque Z para enfocar los cilios. Haga clic en Ejecutar ahora para capturar otro lapso de tiempo rápido.
- Repita los pasos 7.2.3-7.2.4. Para modelos ALI y organoides de las vías respiratorias, imagen 6x FOV en cada una de las muestras replicadas 3x. Para las hojas epiteliales de las vías respiratorias, la imagen de un mínimo de 4x replica las imágenes por participante.
8. Análisis de datos y cuantificación del CBF
- Preparativos para el análisis de datos
NOTA: Esta sección del protocolo requiere scripts de análisis personalizados (archivo complementario 3), archivos de imagen sin procesar (adquiridos en la sección 7.2), un software informático y software de análisis.- Instale el software informático, preferiblemente la última versión, en el equipo de análisis. Asegúrese de que las cajas de herramientas de software informático estándar (elmat, ops, datafun, uitools, datatypes, iofun, iotools, audiovideo) y las cajas de herramientas de procesamiento de imágenes y señales estén instaladas.
- Copie los scripts de análisis personalizados 'BeatingCiliaBatchOMEfiles_JOVE.m' y 'LoadRawDataExportFilteredMovies_JOVE.m' y la carpeta 'support scripts' en la unidad local de la computadora.
- En el software informático, haga clic en la pestaña Inicio. Luego haga clic en Establecer ruta (Figura 4A-B).
- En la ventana emergente, haga clic en Agregar con subcarpetas (Figura 4C). En 'Ruta de búsqueda de MATLAB', seleccione las carpetas que se muestran en la Figura 4D y, a continuación, haga clic en Guardar y cerrar (Figura 4E-F).
- Confirme que los scripts de análisis están vinculados al software informático comprobando que aparecen en el panel izquierdo (Figura 4G).
- Transfiera los archivos de imagen sin procesar (formato de entorno de microscopía abierta (OME)) adquiridos en la sección 7.2 a la unidad local del ordenador.
NOTA: Se puede acceder a archivos de imagen sin procesar de ejemplo en: https://doi.org/10.6084/m9.figshare.16649878.v1.
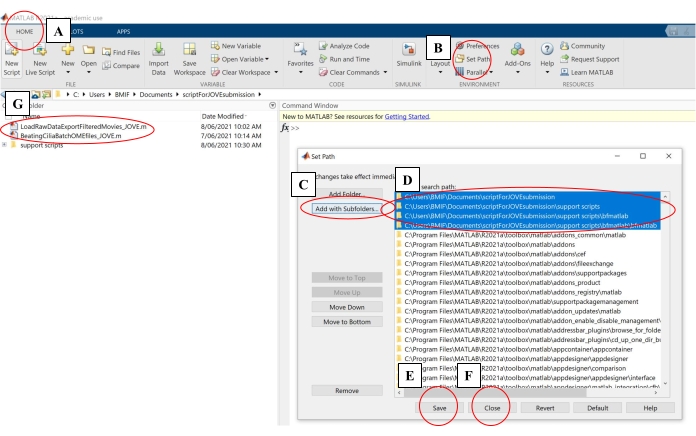
Figura 4: Configuración de software informático para el análisis de datos. (A) Abra la pestaña Inicio . (B) Seleccione Establecer ruta. (C) Seleccione Agregar con subcarpetas. (D) Seleccione carpetas que contengan los scripts de análisis. (e) Seleccione Guardar. (f) Seleccione Cerrar. (G) Los guiones de análisis aparecerán en el panel izquierdo. Haga clic aquí para ver una versión más grande de esta figura.
- Cuantificación de CBF por detección de picos del espectro de intensidad de píxeles individuales
- Abra el software informático. Haga clic en el archivo de script de análisis 'BeatingCiliaBatchOMEfiles_JOVE.m' (Figura 5A).
- Haga clic en la pestaña Editor y, a continuación, haga clic en el botón verde play (Ejecutar) para ejecutar el script (Figura 5B-C). En la ventana de solicitud, seleccione los archivos de imagen sin procesar que se analizarán (Figura 5D).
- Introduzca el tiempo de exposición del paso 7.1.15 en la ventana de solicitud para el tiempo de adquisición por fotograma, luego haga clic en Aceptar (Figura 5E).
- Espere ~ 15 minutos por archivo mientras el script calcula y genera el CBF en el archivo 'AveSpectrum' (Archivo complementario 4), que se guarda automáticamente en la misma carpeta que los archivos de imagen sin procesar. Visualice el progreso a través de la barra de progreso (Figura 5F).
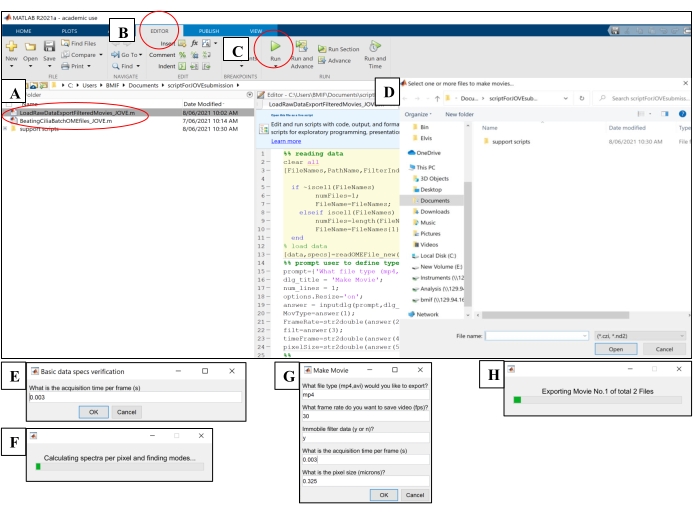
Figura 5: Ejecución de scripts de análisis utilizando software informático . (A) Abrir el guión para el análisis de CBF ('BeatingCiliaBatchOMEfiles_JOVE.m') o la creación de una película de batidos de cilios ('LoadRawDataExportFilteredMovies_JOVE.m'). (B) Abra la pestaña Editor . (C) Seleccione el botón verde play (Ejecutar) para ejecutar el script de análisis. (D) Una ventana de solicitud requerirá la selección de archivos para el análisis o la creación de películas. (E) Al ejecutar el script 'BeatingCiliaBatchOMEfiles_JOVE.m', aparecerá un mensaje para ingresar manualmente el tiempo de adquisición por fotograma (s) en caso de que el script de lectura de archivos no lea los metadatos correctamente. (F) Barra de progreso que indica la frecuencia de latido de los cilios que se está calculando. (G) Mientras se ejecuta el script 'LoadRawDataExportFilteredMovies_JOVE.m', aparecerá un mensaje para ingresar manualmente el tipo de película que se emitirá (mp4 o avi), la velocidad de fotogramas de la película (fps), si el componente inmóvil se elimina de los datos de la película ('y' o 'n'), el tiempo de fotograma (s) y el tamaño de píxel (micras) de los datos exportados a la película. Se recomienda usar 'y' para el filtrado inmóvil, ya que eliminará el moco o cualquier otra capa inmóvil que obstruya los datos. (H) Barra de progreso para indicar la película que se está exportando. Haga clic aquí para ver una versión más grande de esta figura.
- Ejecute el script 'GetFirstAmplitude.m' en la carpeta que contiene los archivos 'AveSpectrum' utilizando el proceso de los pasos 8.2.1-8.2.2. Espere a que el script genere el archivo 'FirstAmplitudeStacked.xlsx', que contiene la frecuencia que tiene la amplitud más alta y está dentro del rango fisiológico de latidos de cilios epitelios de las vías respiratorias, ≥3 y <30 Hz.
- Copie los valores de frecuencia del archivo 'FirstAmplitudeStacked.xlsx' y trace utilizando un software de análisis científico.
NOTA: En el archivo complementario 5 se proporciona una explicación de cómo el script de análisis personalizado cuantifica el CBF. Se puede acceder a los conjuntos de datos analizados de ejemplo en: https://doi.org/10.6084/m9.figshare.16649815.
- Exportación de un video de cilios batiendo
- Abra el software informático. Haga clic en el archivo de script 'LoadRawDataExportFilteredMovies_JOVE.m' (Figura 5A) para cargar el script.
- Haga clic en la pestaña Editor y, a continuación, haga clic en el botón verde play (Ejecutar) para ejecutar el script (Figura 5C). En la ventana del mensaje, seleccione los archivos de imagen sin procesar que se exportarán a los archivos de película (Figura 5D).
- Introduzca los ajustes detallados en la Tabla 4 en la ventana emergente 'Crear película' (Figura 5G).
- Espere ~ 8 minutos por archivo mientras el script crea los archivos de película y los envía a la ubicación de los archivos de imagen sin procesar. Visualice el progreso a través de la barra de progreso (Figura 5H).
| Entradas de película | Descripción |
| Tipo de archivo | Ingrese el tipo de archivo que desea exportar (mp4 o avi). |
| Velocidad de fotogramas | Introduzca la velocidad de fotogramas a la que se debe exportar la película. Si tiene ~ 1000 cuadros por serie temporal adquirida, se recomienda establecer la velocidad de fotogramas ~ 30 fps. |
| Filtrado inmóvil | Las opciones son 'y' o 'n'. El valor predeterminado es 'y', y el script de filtrado de tiempo elimina, utilizando el espacio de Fourier, cualquier componente inmóvil de los datos de la película. Por lo general, cualquier capa de células debajo de los cilios o moco inmóvil contribuirá con un componente de desplazamiento de frecuencia cero o un componente invariante de tiempo en la señal que se puede filtrar. |
| Tiempo de adquisición por fotograma | El tiempo de adquisición por fotograma de datos adquiridos. Se utiliza para mostrar una marca de tiempo en la película en segundos. |
| Tamaño de píxel | El tamaño de píxel en micrómetros se utiliza para mostrar una barra de escala en la película en micrómetros. |
Tabla 4: Configuración de entrada para la creación de películas
Resultados
Para demostrar la eficiencia de este protocolo en la cuantificación de CBF, se presentan los resultados de CBF medidos en modelos de ALI de células epiteliales de la vía aérea derivados de tres participantes con FQ y tres participantes control sanos. En el día 14 de diferenciación del cultivo, los cilios batidos estaban presentes (Figura 6). Del día 14 al 21 de diferenciación de cultivos, se observó un aumento estadísticamente significativo (P < 0,0345) en CBF dentro de ambas cohor...
Discusión
Existen múltiples factores que podrían oscurecer la cuantificación de CBF en láminas epiteliales nasales. Las hojas epiteliales deben ser fotografiadas dentro de las 3-9 horas de la recolección de la muestra, ya que la función ciliar es más estable durante este tiempo37. Menos glóbulos rojos y desechos son los más óptimos para obtener imágenes, ya que interfieren con la adquisición de datos. Al seleccionar un ROI para la obtención de imágenes, es importante seleccionar una hoja epite...
Divulgaciones
Los autores declaran que no tienen nada que revelar.
Agradecimientos
Agradecemos a los participantes del estudio y sus familias por sus contribuciones. Agradecemos la asistencia del departamento respiratorio de Randwick de Sydney Children's Hospitals (SCH) en la organización y recolección de muestras biológicas de pacientes, un agradecimiento especial al Dr. John Widger, la Dra. Yvonne Belessis, Leanne Plush, Amanda Thompson y Rhonda Bell. Reconocemos la asistencia de Iveta Slapetova y Renee Whan del Centro de Microscopía de Luz Katharina Gaus dentro del Centro Analítico Mark Wainwright en UNSW Sydney. Este trabajo cuenta con el apoyo del Consejo Nacional de Salud e Investigación Médica (NHMRC) Australia (GNT1188987), CF Foundation Australia y Sydney Children's Hospital Foundation. Los autores desean agradecer a Luminesce Alliance - Innovation for Children's Health por su contribución y apoyo. Luminesce Alliance - Innovation for Children's Health es una empresa conjunta cooperativa sin fines de lucro entre la Red de Hospitales Infantiles de Sídney, el Instituto de Investigación Médica Infantil y el Instituto de Cáncer Infantil. Se ha establecido con el apoyo del Gobierno de Nueva Gales del Sur para coordinar e integrar la investigación pediátrica. Luminesce Alliance también está afiliada a la Universidad de Sydney y la Universidad de Nueva Gales del Sur Sydney. KMA cuenta con el apoyo de una beca del Programa de Capacitación en Investigación del Gobierno de Australia. LKF cuenta con el apoyo del Club Rotario de Sydney Cove/Sydney Children's Hospital Foundation y becas de posgrado de la Universidad UNSW.
Materiales
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
Referencias
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O'Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O'Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados