Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Primer İnsan Nazal Epitel Hücre Modellerinin Silia Beat Sıklığının Ölçülmesi İçin Toplanması, Genleştirilmesi ve Farklılaştırılması
Bu Makalede
Özet
Bu protokol, nazal epitel hücresi toplanmasını, genişlemesini ve organotipik hava yolu epitel hücre modellerine farklılaşmasını ve canlı hücre görüntüleme ve özel yapım senaryolar yoluyla kirpik vuruş sıklığının nicelleştirilmesini açıklar.
Özet
Kirpik fonksiyonunun ölçümleri (atım sıklığı, patern) primer siliyer diskinezi gibi solunum yolu hastalıkları için tanı araçları olarak belirlenmiştir. Bununla birlikte, bu tekniklerin daha geniş bir şekilde uygulanması, siliyer fonksiyonun sıcaklık, nem ve pH gibi çevresel faktörlerdeki değişikliklere aşırı duyarlılığı ile sınırlıdır. Kistik Fibrozisli (KF) hastaların hava yolunda, mukus birikimi kirpiklerin dövülmesini engeller. Primer hava yolu hücre modellerinde CF Transmembran iletkenlik Regülatörü (CFTR) kanal aktivitesinin bir göstergesi olarak silia fonksiyonu araştırılmıştır. Bununla birlikte, aynı CFTR mutasyonlarına sahip hastalar için bile, CFTR modüle edici ilaçlara yanıt olarak, kirpik atma sıklığında hastadan hastaya önemli değişkenlik bulunmuştur. Ayrıca, işlevsiz CFTR regüle klorür sekresyonunun siliyer fonksiyon üzerindeki etkisi tam olarak anlaşılamamıştır. Şu anda in vitro hava yolu modellerinin numune hazırlanmasını, görüntü alımını ve Cilia Beat Frekansı'nın (CBF) analizini gösteren kapsamlı bir protokol yoktur. Standartlaştırılmış kültür koşulları ve çevre kontrollü bir durumda gerçekleştirilen görüntü elde etme, bireyler arasında ve CFTR modüle edici ilaçlara yanıt olarak CBF'nin tutarlı, tekrarlanabilir bir şekilde ölçülmesini sağlayacaktır. Bu protokol, CBF'nin üç farklı hava yolu epitel hücre modeli sisteminde nicelleştirilmesini açıklar: 1) doğal epitel tabakaları, 2) geçirgen destek uçlarında görüntülenen hava-sıvı arayüz modelleri ve 3) hücre dışı matrise gömülü üç boyutlu organoidler. Son ikisi, kirpiklerin dövülmesi ve mukus üretimi ile in vivo akciğer fizyolojisini çoğaltır. Siliyer fonksiyonu, ortam kontrollü bir odada yüksek hızlı bir video kamera kullanılarak yakalanır. CBF'nin analizi için özel olarak oluşturulmuş komut dosyaları kullanılır. CBF ölçümlerinin kliniğe çevrilmesinin, hasta bazında CFTR modüle edici ilaçlara yanıtı tahmin etmek için önemli bir klinik araç olması öngörülmektedir.
Giriş
Silia Beat Sıklığı (CBF) ve paterninin ölçümleri, Primer Siliyer Diskinezi (PCD)1 gibi solunum yolu hastalıkları için tanı araçları olarak belirlenmiştir. Kistik Fibrozis'te (KF), KF Transmembran İletkenlik Regülatörü (CFTR) klorür kanalının işlev bozukluğu, hava yolu yüzey sıvısının dehidrasyonuna ve mukosiliyer klirensin bozulmasına neden olur2. Siliyer fonksiyon, CFTR kanal aktivitesinin bir göstergesi olarak primer hava yolu hücre modellerinde in vitro olarak araştırılmıştır3. Bununla birlikte, CBF'de, aynı CFTR mutasyonlarına sahip hastalar için bile, CFTR modüle edici ilaçlara yanıt olarak önemli ölçüde hastadan hastaya değişkenlik vardır3. Ayrıca, işlevsiz CFTR regüle klorür sekresyonunun siliyer fonksiyon üzerindeki etkisi tam olarak anlaşılamamıştır. Şu anda in vitro hava yolu modellerinin numune hazırlanmasını, görüntü alımını ve CBF'nin analizini gösteren kapsamlı bir protokol yoktur.
Nazal mukozal fırçalamalardan izole edilen nazal epitel tabakaları, PCD tanısı için siliyer fonksiyon ölçümlerinde doğrudan kullanılır4. Bununla birlikte, elde edilen nazal epitel tabakalarının boyutu veya kalitesi üzerinde bir kontrol bulunmamakla birlikte, CBF, tek hücreler veya hücre tabakaları üzerinde ve bozulmuş veya bozulmamış epitel tabakası siliye kenarlarında ölçülüp ölçülmediğine bağlı olarak değişir5. Bu nedenle, burun mukozal fırçalamalarının toplanması sırasında hücrelere verilen hasarın neden olduğu ikincil diskineziler CBF'yi etkileyebilir. Nazal epitel hücrelerinin primer hücre kültürü ve Hava-Sıvı Arayüzünde (ALI) veya üç boyutlu bazal membran matriksinde siliyer hava yolu epitel organoidlerine farklılaşması, sekonder diskinezilerden arındırılmış kirpiklere yol açar 4,6,7,8. ALI'da farklılaşan hava yolu epitel hücreleri (bundan böyle ALI modelleri olarak adlandırılacaktır), siliyer atım paternlerini ve ex vivo nazal mukozal fırçalamaların sıklığını kopyalayan önemli bir ikincil tanı yardımcısı olarak kabul edilmiştir6 ve hastaya özgü kusurları korurken siliyer ultrayapı, vuruş paterni ve vuruş sıklığının analizini mümkün kılmaktadır9 . Bununla birlikte, bu psödostratifiye, mukosiliyer farklılaşmış hücre modellerini oluşturmak için kullanılan metodolojilerde tutarsızlıklar mevcuttur. Farklı kültür genişlemesi veya farklılaşma protokolleri, farklı epitel fenotiplerini (siliye veya sekretuar)10 indükleyebilir ve CBF11'de önemli farklılıklara neden olabilir. CBF, nazal epitel fırçalamalarında 4,6,12,13,14,15,16, hava yolu epitel organoidlerinde 14,17,18 ve ALI modellerinde 3,4,6,13,19,20, 21. Yine de, bu protokoller arasında büyük değişkenlikler vardır ve çoğu zaman birçok parametre kontrol edilmez. Örneğin, bazı çalışmalarda, ALI modelinin hücreleri geçirgen destek eki 3,19,20,21'de kalırken, CBF in situ olarak görüntülenirken, diğerleri hücreleri geçirgen destek ekinden kazır ve 4,6,13 numaralı medyada asılı olarak görüntüler.
Ayrıca, siliyer fonksiyonu ölçen tekniklerin daha geniş bir şekilde uygulanması, siliyer fonksiyonun çevresel faktörlerdeki değişikliklere aşırı duyarlılığı ile sınırlıdır. Sıcaklık 22, nem 23,24 ve pH 25,26 gibi çevresel faktörler siliyer fonksiyonu etkiler ve CBF'yi doğru bir şekilde ölçmek için düzenlenmelidir. Farklı laboratuvarlarda kullanılan çeşitli fizyolojik parametreler ve CBF'yi nasıl etkiledikleri daha önce gözden geçirilmiştir27.
Literatürde çeşitli görüntüleme teknolojileri ve CBF ölçümlerine yaklaşımlar bildirilmiştir. PCD teşhisi için, siliyer fonksiyon 28,29'u ölçmek için video mikroskopi kullanılır. Son zamanlarda, hava yolu epitel hücresi ALI modellerinde hem CBF hem de kirpik koordinasyonunu ölçmek için diferansiyel dinamik mikroskopiye dayalı bir video analiz algoritması kullanılmıştır 3,30. Bu yöntem, hava yolu epitel hücrelerinde siliyer atımın, bölgeleri segmentlere ayırmaya veya seçmeye gerek kalmadan hızlı ve tam otomatik bir şekilde karakterizasyonunu sağlar. CBF'nin görüntülenmesi ve nicelleştirilmesi için çeşitli yöntemler literatürde CBF'de bildirilen farklılıklara katkıda bulunabilir (Ek Dosya 1).
Mevcut yöntemleri düzene sokmak için kültürden nicelemeye, kültür koşullarının standardizasyonuna ve sıkı çevre kontrollü koşullarda gerçekleştirilen görüntü elde etmeye yönelik bir protokol, CBF'nin bireyler içinde ve arasında tutarlı, tekrarlanabilir bir şekilde nicelleştirilmesini sağlayacaktır.
Bu protokol, epitel hücrelerinin toplanmasının, genleşme ve farklılaşma kültürü koşullarının ve CBF'nin nazal kökenli üç farklı hava yolu epitel hücre modeli sisteminde nicelleştirilmesinin tam bir tanımını sağlar: 1) doğal epitel tabakaları, 2) geçirgen destek ekleri üzerinde görüntülenen ALI modelleri ve 3) Hücre Dışı Matriks (ECM) gömülü üç boyutlu organoidler (Şekil 1 ). Nazal inferior konka fırçalamalarından elde edilen nazal epitel hücreleri, bronşiyal epitel hücreleri için etkili bir vekil oldukları için hava yolu epitelinin temsilcileri olarak kullanılırlar31 bronşiyal fırçalamaların toplanmasıyla ilişkili invaziv prosedürün üstesinden gelirler. Koşullu Yeniden Programlama Hücresi (CRC) yöntemi, ALI modellerinin ve üç boyutlu organoidlerin oluşturulması için birincil hava yolu epitel hücrelerini genişletmek için kullanılır. Hava yolu epitel hücrelerinin kök hücre benzeri bir duruma koşullu olarak yeniden programlanması, büyüme durdurucu fibroblast besleyici hücre sistemi ve Rho ile ilişkili kinaz (ROCK) inhibitörü32 ile ortak kültür tarafından indüklenir. Önemli olarak, CRC yöntemi, hava yolu epitel hücrelerinde popülasyonun iki katına çıkmasını artırırken, dokuya özgü farklılaşma potansiyelini korur33,34. Tüm hava yolu epitel hücresi modellerinde, siliyer fonksiyon, standartlaştırılmış görüntü yakalama ayarlarına sahip yüksek hızlı bir video kamera kullanılarak sıcaklık kontrollü bir odada yakalanır. CBF'nin nicelleştirilmesi için özel olarak oluşturulmuş komut dosyaları kullanılır.

Şekil 1: İş akışının şeması. Katılımcıların nazal inferior konkasını fırçaladıktan sonra, hava yolu epitel hücreleri iki yoldan biriyle kullanılır. Ya hava yolu epitel tabakaları izole edilir ve kirpik vuruş frekansı hemen görüntülenir ya da hava yolu epitel hücreleri koşullu yeniden programlama hücre yöntemi ile genişletilir. CRC-genleşmiş hava yolu epitel hücreleri, bir hava-sıvı arayüzünde veya hava yolu epitel organoid kültürlerinde hava yolu epitel hücreleri oluşturmak için farklılaşır. Siliyer atış frekansının görüntülenmesi, ısıtma ve nem çevre odasına ve hızlı kare hızına (>100Hz) sahip bir bilimsel kameraya sahip canlı hücre görüntüleme mikroskobu kullanılarak elde edilir. Veri analizi, özel olarak oluşturulmuş komut dosyaları kullanılarak gerçekleştirilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Çalışma onayı Sydney Çocuk Hastanesi Ağı Etik İnceleme Kurulu'ndan (HREC/16/SCHN/120) alınmıştır. Biyoörneklerin toplanmasından önce tüm katılımcılardan (veya katılımcıların vasisi) yazılı onay alınmıştır.
1. Hava yolu epitel hücre modellerinin oluşturulması için hazırlıklar
- %80 Dulbecco'nun Modifiye Kartal Ortamı ve %20 Fetal Sığır Serumunu birleştirerek burun hücresi toplama ortamı hazırlayın. 1 μL / mL Penisilin / Streptomisin ile takviye edin. 4 °C'de 3 aya kadar saklayın.
- Şişeleri veya geçirgen destek eklerini, 1.2.1-1.2.4 adımlarını izleyerek ihtiyaç başına Kollajen çözeltisi ile kaplayın. Kollajen kaplı kapları uzun süre saklamayın.
- Tip I Kollajen çözeltisinin (3 mg / mL stok) fosfat tamponlu salin (PBS) ile 0.03 mg / mL'lik bir son konsantrasyona 1:100 seyreltilmesini sağlayın. İyice karıştırın.
- Hücre kültürü şişelerini (bölüm 4) hazırlanan Kollajen çözeltisinin 160 μL/cm2 (yani T25 şişe başına 4 mL) ve geçirgen destek uçlarını (bölüm 5) 455 μL/cm2 (yani 6,5 mm kesici uç başına 150 μL) ile kaplayın.
- 2-24 saat boyunca 37 °C'de inkübe edin.
- Kollajen çözeltisini, hücreleri tohumlamadan önce pipet veya vakum aspiratörü ile çıkarın. Tohumlama hücrelerinden önce kabı yıkamayın.
- Tablo 1'de listelenen32 numaralı bileşenleri birleştirerek Koşullu Yeniden Programlama Hücresi (CRC) ortamını hazırlayın. Şişe üstü vakum filtre sistemi kullanarak filtre sterilizasyonu. 4 °C'de 2 aya kadar saklayın.
- Kullanım gününde, Tablo 1'de belirtildiği gibi insan epidermal büyüme faktörü, ROCK inhibitörü ve antibiyotikleri ekleyin.
| Parça | Hacim |
| DMEM, yüksek glikoz | 156,7 milyon H |
| DMEM/F-12, HEPES | 313,3 milyon L |
| Hidrokortizon | 55,6 μL |
| Insülin | 1,25 mL |
| Kolera toksini | 21 μL |
| Arjantin | 1,2 mL |
| MERHABA-FBS | 25 mL |
| Penisilin-Streptomisin | 5 mL |
| İnsan epidermal büyüme faktörü | 1 μL/mL |
| ROCK inhibitörü | 1 μL/mL |
| Mantar bölgesi | 2 μl/ml |
| Tobramisin | 2 μL/mL |
| Seftazidim hidrat | 4 μL/mL |
| Gentamisin çözeltisi | 1 μL/mL |
Tablo 1: 500 mL koşullu yeniden programlama hücre ortamı için bileşenler
2. Nazal inferior konka fırçalamalarının toplanması
NOT: Protokolün bu bölümü, burun hücresi toplama ortamı, sitoloji fırçaları, dokular ve uygun Kişisel Koruyucu Ekipman içeren bir toplama tüpü (50 mL) gerektirir. Üst solunum yolu enfeksiyonu sırasında fırçalamaktan kaçının. Enflamasyon varsa artmış olan küçük bir kanama riski vardır. Fırçalamanın amacı ex vivo CBF ölçümleri için hava yolu epitel tabakaları elde etmekse, fırçalama herhangi bir üst solunum yolu enfeksiyonundan en az 6 hafta sonra gerçekleşmelidir; İdeal olarak, enfeksiyondan 10 haftadan fazla bir süre sonra35.
- Burun hücresi toplama ortamını hazırlayın (bölüm 1) ve tüpü buz üzerinde tutun.
- Prosedürü katılımcıya rahatsız edici olarak tanımlayın. Fırçalama sırasında burun deliğinde, okyanusa / havuza atlamaya ve burun pasajına akan suya benzer şekilde tam bir his hissedildiğini açıklayın. Katılımcılara, prosedürün bir refleks olarak gözyaşı üretimini indükleyeceğini söyleyin.
- Katılımcı için hangi konumlandırmanın uygun olduğunu değerlendirin. Sırtüstü pozisyon, işlem sırasında katılımcının başının fırçadan uzaklaşmasını önlediğinden, bir muayene kanepesi mevcutsa katılımcıyı sırtüstü pozisyonda yatırın. Alternatif olarak, katılımcıyı başını geriye doğru bastırabilecekleri bir duvarın yanına oturtun.
- Burun pasajını kontrol edin. Septal deviasyon, polipler ve fırçanın burun pasajındaki geçişini etkileyebilecek ve kanama riskini artırabilecek diğer anatomik anormalliklere dikkat edin.
- Katılımcılardan burunlarını bir dokuya üflemelerini isteyerek aşırı mukus burnunu temizleyin.
- Katılımcıdan ağzından nefes almasını isteyin. Baskın elinize bir sitoloji fırçası alın. Elini sabitlemek için beşinci basamağı katılımcının çenesine yaslarken, sitoloji fırçasını katılımcının burun pasajına yerleştirin (Şekil 2). Burun meatusundan geçmek için fırçayı ~ 45 ° C'de katılımcının yüzüne yerleştirin.
- Fırçayı katılımcının yüzüne dik olacak şekilde dik olarak döndürün. Fırçayı, inferior konkanın ortasından arka kısmına gelene kadar burnun lateral duvarına nazikçe ama sıkıca ilerletin.
NOT: Aşırı yerleştirmeyi önleyin; dirençte ani bir düşüş hissedilirse, burun farenksine girilmiştir ve prosedürcü tarafından direnç tekrar hissedilene kadar fırça geri çekilmelidir. - Fırçayı 360° üç defaya kadar döndürün. Fırçayı, yerleştirme manevrasının tersinden yavaşça çıkarın, böylece hücreler fırçadan çıkarılmaz.
- Fırçayı hazırlanan toplama tüpüne nazal hücre toplama ortamı ile yerleştirin. Toplama tüpünü buzun üzerine yerleştirin.
- Katılımcı kabul edilebilirse / çok sayıda hücre gerekiyorsa (örneğin, hücre kültürünü başlatmak için) ikinci burun deliğinde fırçalamayı tekrarlayın.
NOT: Fırça üzerinde görünür kan hücresi yoksa aynı burun deliği tekrar fırçalanabilir, ancak aynı burun deliğinde ikinci bir fırçalama ile kanama riskinin biraz arttığını unutmayın.
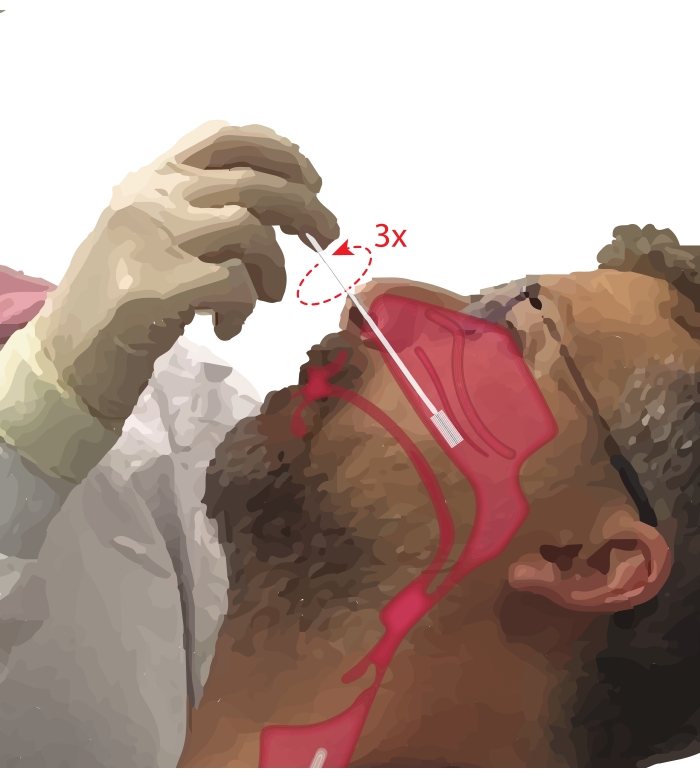
Şekil 2: Nazal epitel hücrelerinin toplanması. Sitoloji fırçasının inferior konkanın orta-arka kısmındaki yerinin çizimi. Bu pozisyona, fırçanın tırnaklardan sokulması, fırçanın yüze 90°'lik bir açıyla döndürülmesi ve fırçanın alt konkanın altındaki burun pasajı boyunca yönlendirilmesiyle ulaşılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Hava yolu epitel tabakalarının hazırlanması
NOT: Protokolün bu bölümü toplama tüpü (sitoloji fırçası/fırçaları) + 1 mL burun hücresi toplama ortamı) (bölüm 2) ve 96 kuyucuklu düz tabanlı plaka gerektirir. Hava yolu epitel tabakalarını görüntülemek amacıyla burun konka fırçaları topluyorsanız, sadece 1 mL antibiyotiksiz burun hücresi toplama ortamı kullanın; aksi takdirde, epitel tabakaları görüntüleme için çok dağınık olacaktır.
- Hava yolu epitel tabakalarını fırça(lar)dan çıkarmak için sitoloji fırçalarını içeren toplama tüpünü nazikçe döndürün.
- Tüm ortamları ve hücreleri P1000 pipetle toplayın. 5-6 damlayı 96 kuyucuklu düz tabanlı bir plakanın kuyusuna dağıtın. Yaklaşık yedi kuyucuk için tekrarlayın.
- Plakayı 7.1.4 adımına göre mikroskopa aktarın ve görüntü kirpikleri vuruş frekansına göre bölüm 7'nin geri kalanını takip edin.
- Görüntü epitel tabakaları (Şekil 1) ve siliyer fonksiyonun epitel tabakaları ile tek bağlanmamış hücreler arasında farklılık gösterdiği gösterildiğinden beri tek bir bağlanmamış hücredeğildir 5.
4. Hava yolu epitel hücresi genişlemesi ve bakımı
- Hava yolu epitelyal koşullu yeniden programlama hücre genişleme kültürü
NOT: Kollajen çözeltisi kaplı damar (bölüm 1), Işınlanmış fare embriyonik besleyici hücreleri (NIH-3T3), Koşullu Yeniden Programlama Hücresi (CRC) ortamı (bölüm 1), burun hücresi toplama ortamındaki sitoloji fırçaları (bölüm 2).- Hazırlanan Kollajen çözeltisi kaplı kültür kaplarına ışınlanmış çiplenmiş besleyici hücreler, hava yolu epitel hücreleri ile ortak kültürden en az 2 saat önce ve en fazla72 saat önce 8.000 hücre / cm2 tohumlama yoğunluğunda kaplanmıştır (besleyici hücre kültürü ve ışınlama için bkz.36 ).
- Toplama tüpündeki fırçalanmış hücreleri (sitoloji fırçaları + burun hücresi toplama ortamı) buz üzerindeki girdaba aktarın. Düşük hızda, vorteks tüpü 10 s açık, 10 s kapalı (aralarında buz üzerinde tutun) hücreleri fırça (lar) dan çıkarmak için. Güçlü vorteks, hücre canlılığını azaltabilir. Mukusun hala yapışıp yapışmadığını kontrol etmek için fırçaları kontrol edin. Eğer öyleyse, girdabı tekrarlayın.
- Buz üzerindeki tüpleri biyogüvenlik kabinine geri aktarın. Medyayı toplama tüpünden yeni bir tüpe (Tüp B) aktarmak için sitoloji fırçalarını geride bırakarak serolojik bir pipet kullanın. 4 °C'de 7 dakika boyunca 300 × g'de Santrifüj Tüp B.
- B Tüpünü santrifüjden çıkarın, süpernatanı atın. Mukus görülebiliyorsa, peleti başka bir 5 mL burun hücresi toplama ortamı ile yıkayın ve tekrar santrifüj yapın.
- Tüp B'deki hücre peletini yeniden askıya almak için 1 mL CRC ortamı ekleyin 5 mL'lik bir serolojik pipet kullanarak, hücreleri dairesel bir hareketle 50 mL'lik bir tüpün (Tüp C) üzerine yerleştirilmiş bir hücre eleğinden geçirin.
- Tek bir hücre süspansiyonu oluşturmak için birden çok kez tekrarlayın. Eleğin altından kalan medyayı toplayın ve ortamla birleştirin. Hücre eleğini atın.
- 5 mL'lik bir serolojik pipet kullanarak, C Tüpünden 1 mL ortam alın ve bir mikrosantrifüj tüpüne aktarın.
- Bu hücre süspansiyonunun 10 μL'sini alın ve 10 μL tripan mavisi ile önceden alıntılanmış mikrosantrifüj tüpüne ekleyin. İyice karıştırın ve hücre sayısını ve canlılığını kaydetmek için hemen otomatik bir hücre sayacı kullanın.
- Hava yolu epitel hücrelerini, ışınlanmış besleyici hücrelerle önceden tohumlanmış T25 şişesine tohumlayın.
- Hava yolu epitel hücre bakımı ve ayrışması
NOT: CRC ortamı, hücrelere eklenmeden önce sıcaklık kontrollü bir laboratuvar su banyosuna veya boncuk banyosu cihazına yerleştirilerek 37 °C'ye ısıtılmalıdır.- Hücre kültürü mikroskobu (4× objektif lens) altındaki hücreleri düzenli olarak bağlanma, kontaminasyon, morfoloji ve birleşme açısından kontrol edin.
- CRC medyasını her iki günde bir değiştirin. Yeniden programlanmış hücreler gözlendiğinde (Şekil 1) ve kontaminasyon olmadığında, antibiyotikleri azaltın veya geri çekin.
- Hücreler% 90 akıcılığa ulaştığında, hücreleri ayırmak ve adım 4.1.8'de açıklandığı gibi bir hücre sayımı gerçekleştirmek için çift tripsin yöntemi32'yi kullanın (hücre ayrışması ve donması için Ek Dosya 2'ye bakın).
5. Hava yolu epitel hücrelerinin tohumlanması ve farklılaştırılması ve farklılaştırılmış ALI modellerinin bakımı
- Hava yolu epitel hücrelerinin geçirgen destek uçlarına tohumlanması
- Kollajen çözeltisi kaplı geçirgen destek eklerini (bölüm 1) CO2 inkübatöründen biyogüvenlik kabinine aktarın. Kollajen çözeltisini aspire edin ve atın. Geçirgen destek uçlarının bazal bölmesine 750 μL genleşme ortamı (antibiyotiksiz) ekleyin.
- Ayrışmış hücreleri veya buz üzerindeki çözülmüş hücreleri biyogüvenlik kabinine aktarın. 200.000-250.000 hücreyi 150 μL'de tohumlamak için gereken genleşme ortamının hacmini, her geçirgen destek ekinin apikal bölmesine ekleyin.
- Kabarcık oluşturmamaya dikkat etmek; hücrelerin homojen ve süspansiyonda olmasını sağlamak için iyice karıştırın. Her geçirgen destek ekinin apikal tarafına hücre süspansiyonunun 150 μL'sini ekleyin.
- Homojen bir hücre süspansiyonunu korumak için her üç geçirgen destek ekini tohumladıktan sonra hücreleri yeniden askıya alın.
- Bir birleşik hücre monokatmanı oluşana kadar her iki günde bir (genellikle tohumlama sonrası 4. Gün), ortamı atın ve oda sıcaklığına (RT, 15-25 ° C) ısıtılmış taze genleşme ortamı ekleyin.
- Hava-sıvı arayüzünde hava yolu epitel hücrelerinin farklılaşması
- Sıcak ALI ortamı (antibiyotiksiz) RT'ye (15-25 °C) kadar.
- Genleşme ortamını çıkarın ve hem apikal hem de bazal bölmelerde farklılaşma ortamına (ALI) geçin.
- Batık ALI ortamında 2 günlük kültürden sonra, medyayı aspire edin ve atın.
- Sadece hava-sıvı arayüzü oluşturmak için bazal bölmeye 750 μL ALI ortamı ekleyin.
NOT: 1 haftalık kültürden sonra, tek katman akıcılık değilse ve delikler hala gözleniyorsa, hücreler artık boşluk bölgelerine genişleme kapasitesine sahip olmayabilir, hava yolu epitel hücrelerinin atılmasını düşünün.
- Farklılaştırılmış ALI modelinin bakımı ve mukus giderimi
- Apikal ve bazal medyayı tam farklılaşmaya kadar her iki günde bir değiştirin (21-25. gün hava-sıvı arayüz kurulumundan sonra).
- Haftada bir kez, 5.3.3-5.3.4 adımlarını izleyerek mukusları apikal taraftan yıkayın.
- PBS'den RT'ye (15-25 °C) sıcak basın.
- Apikal bölmeye 200 μL PBS ekleyin. CO2 inkübatöründe 10 dakika boyunca inkübe edin. PBS'yi çıkarmak için bir aspirasyon cihazı veya pipet kullanın.
6. Üç boyutlu hava yolu epitel organoidleri
- Hava yolu epitel organoid kültürü için preparatlar
- Gece boyunca 37 ° C'ye ısınmak için bir CO 2 inkübatörüne24 kuyucuklu plakalar yerleştirin.
- Üreticinin talimatlarına göre buz üzerinde 10 mL'lik bir ECM şişesini (Malzeme Tablosu) çözün. Donma-çözülme döngülerinin sayısını en aza indirmek için 500 μL alikot (tek seferlik kullanım) hazırlayın.
NOT: En iyi kültür sonuçları için ECM'yi protein konsantrasyonu >10.5 mg/mL ile birlikte kullanmanız önerilir. Düşük konsantrasyon, ECM kubbesinin parçalanmasını hızlandıracak ve apikal-dışa bakan organoidlerin oluşumunu artıracaktır. - Havayolu Organoid Tohumlama Ortamını (AOSM) ve Farklılaştırma Ortamını (AODM) üreticinin talimatlarına göre hazırlamak için Hava Yolu Organoid Kitini (Malzeme Tablosu) kullanın.
- Hava yolu organoid bazal ortamını Tablo 2'ye göre hazırlayın.
| Parça | Hacim |
| Gelişmiş DMEM/F-12 | 500 mL |
| HEPES | 5 mL |
| Alanil-glutamin | 5 mL |
| Penisilin-Streptomisin | 5 mL |
Tablo 2: Hava yolu organoid bazal ortamının bileşenleri
- Bölüm 4.2'de ayrışmış canlı hava yolu epitel hücrelerinin sayısını, 10.000 hücrelik bir tohumlama yoğunluğunda kaç kuyunun tohumlanabileceğini hesaplamak için kullanın (bkz. Tablo 3).
- Kuyu başına 1 x 50 μL %90 ECM kubbe (45 μL ECM ve 5 μL AOSM) oluşturmak için gereken toplam ECM ve AOSM hacmini hesaplayın.
NOT: Kuyucuk başına 10.000 hücrelik önerilen tohumlama yoğunluğu, geçiş 1'deki CRC genişlemiş burun epitel hücreleri içindir. Daha sonraki geçiş hücreleri, aynı sayıda organoidin oluşumunu sağlamak için daha yüksek tohumlama yoğunluğu gerektirebilir.
| Kuyu sayısı | Hücre sayısı | Kubbe sayısı | Vol of Matrigel ECM | AOSM'nin Vol |
| 1 | 10.000 hücre | 1 | 45 μL x 1,1 | 5 μL x 1,1 |
| 2 | 20.000 hücre | 2 | 90 μL x 1,1 | 10 μL x 1,1 |
| 5 | 50.000 hücre | 5 | 225 μL x 1,1 | 25 μL x 1,1 |
| ......... | ......... Hücre | ......... | .........μL x 1.1 | .........μL x 1.1 |
Tablo 3: ECM kubbelerinde hava yolu epitel hücrelerinin tohumlanması için hesaplamalar
- ECM kubbelerinde hava yolu epitel hücrelerinin tohumlanması
NOT: ECM'yi her zaman buz üzerinde tutun ve ECM buz üzerinde ECM ile ilgili tüm adımları gerçekleştirin, çünkü ECM >10 ° C sıcaklıklarda katılaşmaya başlayacaktır.- Bölüm 4.2'de ayrışmış hava yolu epitel hücrelerini, Tablo 3'e göre hesaplanan %90 ECM hacmi ile yeniden askıya alın.
- Pipetin kuyunun dibine mümkün olduğunca yakın 90° açıyla (dikey) tutularak, ECM hücresi süspansiyonunun 50 μL'sini (kabarcıklar oluşmaması için ilk durağa) kuyunun ortasına dağıtın. Kuyunun duvarına dokunmaktan kaçının.
- ECM katılaşana kadar plakayı 37 °C'de 20 dakika boyunca inkübe edin. ECM katılaşırken, ekleme üzerine ECM kubbesinin yeniden sıvılaşmasına ve parçalanmasına neden olmasını önlemek için AOSM'yi RT'ye (15-25 ° C) ısıtın.
- Kuyunun duvarını dağıtarak her bir kuyuya 500 μL ısıtılmış AOSM ekleyin. Pipetleri doğrudan ECM kubbesinin üzerine koymayın.
- Medyayı 4-7 gün boyunca her 2 günde bir değiştirin. Ortamları aspire etmek için, plakayı 45° açıyla eğin ve kuyunun alt kenarından ECM kubbesinden uzağa aspire edin.
- 4-7 gün sonra, her bir kuyucuğa 500 μL AODM (15-25 ° C) ekleyerek organoid farklılaşmayı başlatın ve 7 gün boyunca her 2 günde bir ortam değiştirin.
- Farklılaşmanın 7. Gününde hava yolu epitelyal organoidlerinin replatlanması
NOT: Hava yolu epitel organoidlerinin kaplanması gereklidir, çünkü ECM kubbelerinin kenarı 2 haftalık kültür süresi boyunca yavaş yavaş parçalanır. Kubbenin kenarındaki hava yolu epitel organoidleri kaybolabilir (ortama yerinden çıkabilir) veya ECM'ye tam olarak gömülmediğinde apikal görünümlü dışa doğru oryantasyona sahip olabilir. Yeniden kaplama adımı aynı zamanda organoidleri başarılı bir şekilde oluşturmayan hücreleri / kalıntıları temizleyerek ECM kubbesini "temizler".- Medyayı her kuyudan aspire edin. Her bir kuyucuğa 500 μL soğuk hava yolu organoid bazal ortamı (bundan böyle bazal medya olarak adlandırılacaktır) ekleyin.
- P1000 pipetini kullanın, çünkü bu pipet ucu en büyük deliğe sahiptir ve pipetleme sırasında organoidlerin patlama olasılığını azaltır. Kabarcıklar oluşmasını önlemek için pipeti 350 μL'ye ayarlayın, ardından her bir kuyucuktaki ECM kubbesini bozmak için hafifçe yukarı ve aşağı pipet uygulayın. Tüm ECM/bazal ortamları 15 mL'lik bir santrifüj tüpünde toplayın.
- Her bir oyuğa 500 μL soğuk bazal medya ile durulayın. Kalan ECM ve organoidleri içeren bazal ortamı, yukarıdaki gibi aynı 15 mL santrifüj tüpünde toplayın.
- 4 °C'de 5 dakika boyunca 300 x g'de santrifüj. Santrifüjlemeyi takiben görülebilen üç katmandan - (1) süpernatant, (2) hücresel enkaz içeren ECM (kabarık) ve (3) organoidler içeren pelet - süpernatant ve ECM tabakasını atın ve organoid peleti koruyun.
- Kalan ECM'yi ayırmak için organoid pelet ve pipete 1 mL soğuk bazal ortam ekleyin. Tüpe 6 mL soğuk bazal ortam ekleyin ve yavaşça karıştırın.
- 4 °C'de 5 dakika boyunca 300 × g'da santrifüj. Süper natantı atın.
- ECM fazlalığı hala görülebiliyorsa, başka bir yıkama işlemi gerçekleştirmek için 6.3.5- 6.3.6 arasındaki adımları tekrarlayın.
- Organoid peleti% 90 ECM'lik uygun bir hacimle (AOSM yerine AODM kullanın) kubbenin 50 μL'si başına ~ 30 organoid plakalamak için yeniden askıya alın.
- İlk kubbeyi kapladıktan sonra hücre kültürü mikroskobu (4x objektif lens) altındaki organoidlerin yoğunluğunu kontrol edin. Çok yoğunsa, istenen ~ 30 organoid yoğunluğunu elde etmek için% 90 ECM daha ekleyin.
- ECM'yi katılaştırmak ve hücreleri her iki günde bir 500 μL ısıtılmış AODM ile beslemek için 6.2.3- 6.2.4 adımlarını izleyin ve bazal hücreler, siliyer hücreler ve kadeh hücreleri içeren içe dönük psödostratifiye epitel ile çevrili lümen oluşumu ile olgunluğa ulaşana kadar (21 günlük farklılaşmadan sonra) 14 gün daha her bir kuyucuğa besleyin.
NOT: Burada tarif edilen hava yolu epitel organoidleri terminal olarak farklılaşmıştır ve pasajlı veya kriyoprezerve edilemez.
7. Görüntüleme kirpikleri frekansını yendi
NOT: Protokolün bu bölümü, ısıtma ve nem çevre odasına sahip bir canlı hücre görüntüleme mikroskobu, hızlı kare hızı (>100 Hz) bilimsel kamera, 20x uzun çalışma mesafesi hedefi ve görüntüleme yazılımı gerektirir (bu protokolde kullanılan önerilen ekipman için Malzeme Tablosuna bakınız).
- Mikroskop kurulumu
- Mikroskop ısıtma sisteminin açık olduğundan ve 37 ° C'ye dengelendiğinden emin olun. Mikroskobu açın. CO2 /hava gazı karıştırıcısı ile gazı %5 CO2'ye ayarlayın.
- CO2'nin içinden geçtiği nem modülü şişesini arıtılmış suyla doldurun. Suyun ısıtılması ve hücrelere nemlendirilmiş hava sağlanması için sahne üst kontrolörü aracılığıyla bağıl nemi %85'e ayarlayın. Odayı 30 dakika boyunca dengeleyin.
- Mikroskop plakası ekini mikroskop tutucuya yerleştirin.
- Hava yolu epitel hücresi modellerini, numuneyi fizyolojik bir sıcaklıkta tutmak için inkübatörden mikroskopa, bir ısı bloğu veya 37 ° C'ye eşit termal boncuklar üzerinde aktarın.
- Hava yolu epitel hücresi modellerini içeren kültür plakasını mikroskop plakası ekine yerleştirin. Mikroskop çevre odasını kapatın.
- Numunenin önceden ısıtılmış 37 °C,% 5 CO2 dolu mikroskop odasında 30 dakika boyunca dengelenmesine izin verin.
NOT: Daha kısa bir denge süresi yeterli olabilir. Bu, CBF'nin stabilizasyonu için gereken süreyi tanımlamak için bir deney yapılarak belirlenebilir ( Şekil 3'e bakınız).
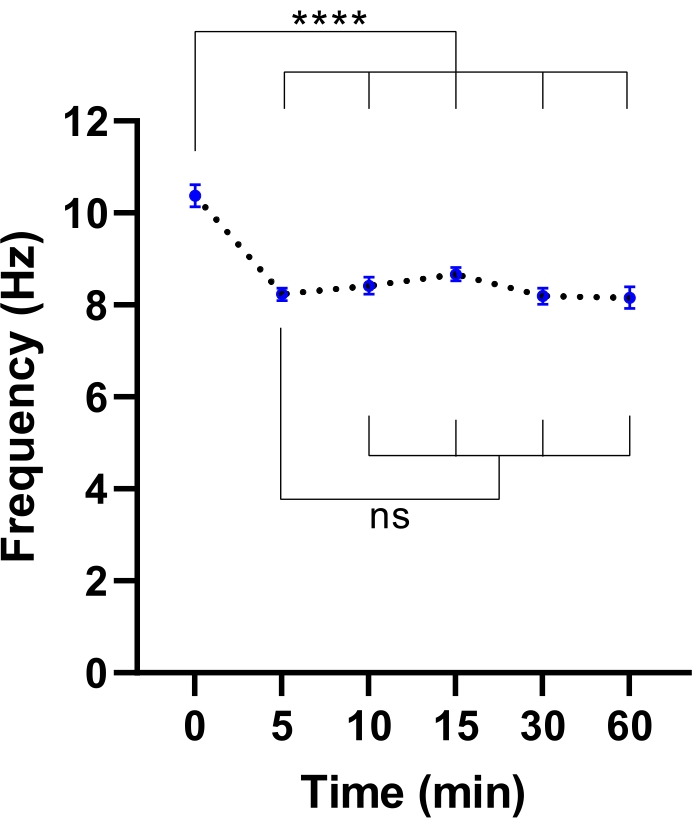
Şekil 3: Canlı hücre görüntüleme mikroskobunda siliyer atım frekansının stabilizasyonu. Çevresel odacıklı canlı hücre görüntüleme mikroskobuna aktarıldıktan sonra hava-sıvı arayüzündeki (ALI modelleri) hava yolu epitel hücrelerinde ortalama kirpik vuruş frekansının (CBF) nokta grafikleri. Oda, hazne kapısını açmadan ve kültür plakasını mikroskop plakası ekine yerleştirmeden önce 30 dakika boyunca 37 °C, %5 CO2 ve %85 bağıl nemde dengelendi ve muhafaza edildi. Hücre modelleri belirtilen aralıklarla 60 dakika boyunca görüntülendi. ALI modelleri CF'li iki katılımcıdan türetilmiştir. ALI modeli başına altı görüş alanı (FOV) görüntüsü elde edilmiştir. Her nokta (mavi), 12-36 FOV görüntüsünde ortalama CBF'yi temsil eder. Veriler, ortalama ± SEM olarak temsil edilir ve ortalama noktalı bir çizgiyle bağlanır. İstatistiksel farklılıkları belirlemek için tek yönlü varyans analizi (ANOVA) kullanıldı. P < 0.0001, ns: anlamsız. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Denge döneminde, bilgisayarda, satın alma yazılımını açın. 20x uzun çalışma mesafesi objektif lensini seçin.
- Mikroskop göz merceğinde, hücre modeline odaklanın (~Z = 8000 μm).
- Mikroskopun Kohler aydınlatması için kurulduğundan emin olun, böylece iletim ışık kaynağı ampul filamentleri örnek düzleme odaklanmaz ve görüntülemedeki eserlerden kaçınır. Bunun için 7.1.10-7.1.13 adımlarını izleyin
- Kondenserin üzerindeki alan iris diyaframını tamamen kapatın. Alan iris diyaframını yavaşça açın ve bir sekizgen şekli görünene kadar kondenseri yukarı/aşağı hareket ettirin.
- Alan iris diyaframı hizalanmazsa (yani, sekizgen görüş alanının merkezinde değilse (FOV)), Allen tuşlarını kullanarak merkeze hizalayın.
- Alan iris diyaframı hizalandıktan sonra, sekizgeni keskin netliğe getirmek için kondenser odağını ayarlayın.
- FOV içinde artık görülemeyecek hale gelene kadar alan iris diyaframını açın.
- Edinme yazılımını kullanarak, ışık yolunu kameranın monte edildiği bağlantı noktasına geçirmek için L100'e tıklayın. Mikroskop FOV'u yazılım aracılığıyla görselleştirmek için yeşil oynat (Çalıştır) düğmesine tıklayın. Kirpiklerin odakta olup olmadığını kontrol edin ve gerekirse ayarlayın.
- Edinme yazılımını kullanarak, mikroskopu aşağıdaki ayarlarla ayarlayın: Filtreler: boş; Kondenser: boş; Biçim: ciltleme yok; Pozlama süresi: 0.003 s; Okuma modu: panjur; ROI: 512 × 512 piksel.
NOT: Maruz kalma süresi, ölçülmesi gereken en yüksek frekansa dayanır, çünkü 1/maruz kalma süresi bu frekansın en az iki katı olmalıdır. Örneğin, kirpiklerin maksimum fizyolojik aralığı = 30 Hz ise, 1/pozlama süresi = 60 ve pozlama süresi 0,016 s≤ olmalıdır. Kare hızlarını >100 Hz yakalayan bir yatırım getirisi seçin.
- Görüntü alma
- Menüden hızlandırılmış görüntüler elde etmek için, Edin'e ve ardından Hızlı Zaman Atlaması'na tıklayın. Açılır pencerede, bir kaydetme konumu ve dosya adı seçin. 1000 kare edinin.
- Uygula'ya tıklayın. Kirpikleri mikroskop FOV'da önizlemek ve gerekirse Z odağını ayarlamak için yeşil oynat (Çalıştır) düğmesine tıklayın. Hızlı hızlandırılmış çekimi yakalamak için Şimdi Çalıştır'ı tıklatın.
- Hızlı hızlandırılmış çekim yakalandıktan sonra, mikroskop FOV'unu görselleştirmek için yeşil oynat (Çalıştır) düğmesine tıklayın. Mikroskop joystickini kullanarak, X / Y ekseni boyunca başka bir FOV'a geçin.
- Kirpikleri netlemek için Z odağını ayarlayın. Başka bir hızlı hızlandırılmış çekim yakalamak için Şimdi Çalıştır'a tıklayın.
- 7.2.3-7.2.4 arasındaki adımları yineleyin. ALI modelleri ve hava yolu organoidleri için, 3x numunelerin her birinde 6x FOV görüntüsü çoğaltır. Hava yolu epitel tabakaları için, görüntü katılımcı başına en az 4x kopya görüntüler.
8. CBF'nin veri analizi ve nicelleştirilmesi
- Veri analizi için hazırlıklar
NOT: Protokolün bu bölümü, özel analiz komut dosyaları (Ek Dosya 3), ham görüntü dosyaları (bölüm 7.2'de edinilmiştir), bir bilgi işlem yazılımı ve analiz yazılımı gerektirir.- Bilgi işlem yazılımını, tercihen en son sürümü analiz bilgisayarına yükleyin. Standart bilgi işlem yazılımı araç kutularının (elmat, ops, datafun, uitools, veri türleri, iofun, iotools, audiovideo) ve Görüntü ve Sinyal İşleme araç kutularının yüklü olduğundan emin olun.
- Özel analiz komut dosyaları 'BeatingCiliaBatchOMEfiles_JOVE.m' ve 'LoadRawDataExportFilteredMovies_JOVE.m' ve 'destek komut dosyaları' klasörünü bilgisayarın yerel sürücüsüne kopyalayın.
- Bilgisayar yazılımında, Giriş sekmesine tıklayın. Ardından Yolu Ayarla'ya tıklayın (Şekil 4A-B).
- Açılır pencerede, Alt Klasörlerle Ekle'ye tıklayın (Şekil 4C). 'MATLAB arama yolu' altında, Şekil 4B'de gösterilen klasörleri seçin, ardından Kaydet ve Kapat'ı tıklayın (Şekil 4E-F).
- Sol panelde görünüp görünmediklerini kontrol ederek analiz komut dosyalarının bilgi işlem yazılımına bağlı olduğunu onaylayın (Şekil 4G).
- Bölüm 7.2'de edinilen ham görüntü dosyalarını (açık mikroskopi ortamı (OME) biçimi) bilgisayarın yerel sürücüsüne aktarın.
NOT: Örnek ham görüntü dosyalarına şu adresten erişilebilir: https://doi.org/10.6084/m9.figshare.16649878.v1.
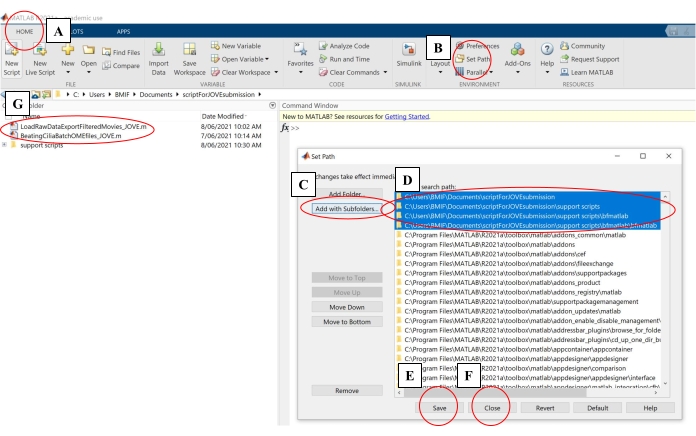
Şekil 4: Veri analizi için bilgi işlem yazılımı kurma. (A) Giriş sekmesini açın. (B) Yolu Ayarla'yı seçin. (C) Alt klasörlerle ekle'yi seçin. (D) Analiz komut dosyalarını içeren klasörleri seçin. (E) Kaydet'i seçin. (F) Kapat'ı seçin. (G) Analiz komut dosyaları sol panelde görünecektir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Tek piksellerin yoğunluk spektrumunun tepe noktası tespiti ile CBF'nin nicelleştirilmesi
- Bilgi işlem yazılımını açın. 'BeatingCiliaBatchOMEfiles_JOVE.m' analiz komut dosyasına tıklayın (Şekil 5A).
- Düzenleyici sekmesine tıklayın ve ardından komut dosyasını çalıştırmak için yeşil oynat (Çalıştır) düğmesine tıklayın (Şekil 5B-C). İstem penceresinde, analiz edilecek ham görüntü dosyalarını seçin (Şekil 5D).
- 7.1.15 adımındaki pozlama süresini, kare başına alma süresi için istem penceresine girin, ardından Tamam'a tıklayın (Şekil 5E).
- Komut dosyası CBF'yi hesaplarken ve ham görüntü dosyalarıyla aynı klasöre otomatik olarak kaydedilen 'AveSpectrum' dosyasında (Ek Dosya 4) çıktısını alırken dosya başına ~ 15 dakika bekleyin. İlerleme çubuğu aracılığıyla ilerlemeyi görselleştirin (Şekil 5F).
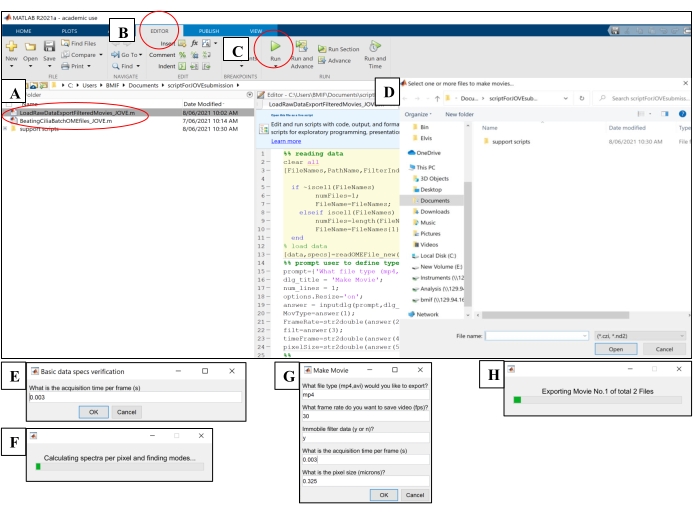
Şekil 5: Bilgi işlem yazılımı kullanarak analiz komut dosyalarını çalıştırma . (A) CBF'nin analizi ('BeatingCiliaBatchOMEfiles_JOVE.m') veya kirpik döven filmin oluşturulması ('LoadRawDataExportFilteredMovies_JOVE.m') için komut dosyasını açın. (B) Düzenleyici sekmesini açın. (C) Analiz komut dosyasını çalıştırmak için yeşil oynat (Çalıştır) düğmesini seçin. (D) Bir istem penceresi, analiz veya film oluşturma için dosya seçimini gerektirecektir. (E) 'BeatingCiliaBatchOMEfiles_JOVE.m' komut dosyasını çalıştırırken, dosya okuma komut dosyasının meta verileri düzgün okumaması durumunda kare başına edinme süresini manuel olarak girmek için bir istem görünecektir. (F) Hesaplanan kirpik vuruş frekansını gösteren ilerleme çubuğu. (G) 'LoadRawDataExportFilteredMovies_JOVE.m' komut dosyasını çalıştırırken, çıktısı alınacak filmin türünü (mp4 veya avi), film kare hızını (fps), hareketsiz bileşenin film verilerinden kaldırılıp kaldırılmadığını ('y' veya 'n'), kare sürelerini ve filme dışa aktarılan verilerin piksel boyutunu (mikron) manuel olarak girmek için bir istem görünecektir. Hareketsiz filtreleme için 'y' kullanılması önerilir, çünkü mukus veya verilerdeki diğer engelleyici hareketsiz katmanları kaldıracaktır. (H) Dışa aktarılan filmi gösteren ilerleme çubuğu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- 8.2.1-8.2.2 adımlarındaki işlemi kullanarak 'AveSpectrum' dosyalarını içeren klasörde 'GetFirstAmplitude.m' komut dosyasını çalıştırın. Komut dosyasının, en yüksek genliğe sahip olan ve hava yolu epitel kirpiklerinin fizyolojik aralığında, .xlsx 3 ve ≥30 Hz olan frekansı içeren 'FirstAmplitudeStacked<' dosyasının çıktısını almasını bekleyin.
- 'FirstAmplitudeStacked.xlsx' dosyasından frekans değerlerini kopyalayın ve bilimsel bir analiz yazılımı kullanarak çizin.
NOT: Özel analiz komut dosyasının CBF'yi nasıl ölçtüğüne ilişkin bir açıklama Ek Dosya 5'te verilmiştir. Örnek analiz edilen veri kümelerine şu adresten erişilebilir: https://doi.org/10.6084/m9.figshare.16649815.
- Kirpik dövülmesinin bir videosunu dışa aktarma
- Bilgi işlem yazılımını açın. Komut dosyasını yüklemek için 'LoadRawDataExportFilteredMovies_JOVE.m' komut dosyasına tıklayın (Şekil 5A).
- Düzenleyici sekmesine tıklayın ve ardından komut dosyasını çalıştırmak için yeşil oynat (Çalıştır) düğmesine tıklayın (Şekil 5C). İstem penceresinde, film dosyalarına dışa aktarılacak ham görüntü dosyalarını seçin (Şekil 5D).
- Tablo 4'te ayrıntılı olarak açıklanan ayarları 'Film Yap' açılır penceresine girin (Şekil 5G).
- Komut dosyası film dosyalarını oluştururken ve bunları ham görüntü dosyalarının konumuna çıkarırken dosya başına ~8 dakika bekleyin. İlerleme çubuğu aracılığıyla ilerlemeyi görselleştirin (Şekil 5H).
| Film girişleri | Tarif |
| Dosya türü | Dışa aktarmak istediğiniz dosya türünü girin (mp4 veya avi). |
| Kare hızı | Filmin dışa aktarılması gereken kare hızını girin. Elde edilen zaman serisi başına ~1000 kareniz varsa, kare hızını ~30 fps olarak ayarlamanız önerilir. |
| Hareketsiz filtreleme | Seçenekler 'y' veya 'n'dir. Varsayılan değer 'y'dir ve zaman filtreleme komut dosyası, Fourier alanını kullanarak film verilerindeki hareketsiz bileşenleri kaldırır. Tipik olarak, kirpikler veya hareketsiz mukus altındaki herhangi bir hücre katmanı, filtrelenebilen sinyalde sıfır frekanslı bir ofset bileşenine veya zaman değişmez bileşenine katkıda bulunacaktır. |
| Kare başına edinme süresi | Alınan verilerin kare başına edinme süresi. Filmde saniye cinsinden bir zaman damgası görüntülemek için kullanılır. |
| Piksel boyutu | Mikrometre cinsinden piksel boyutu, filmdeki bir ölçek çubuğunu mikrometre cinsinden görüntülemek için kullanılır. |
Tablo 4: Film oluşturma için giriş ayarları
Sonuçlar
Bu protokolün CBF'yi ölçmedeki etkinliğini göstermek için, KF'li üç katılımcıdan ve üç sağlıklı kontrol katılımcısından türetilen hava yolu epitel hücresi ALI modellerinde ölçülen CBF'nin sonuçları sunulmuştur. Kültür farklılaşmasının 14. gününde, dövülen kirpikler mevcuttu (Şekil 6). Kültür farklılaşmasının 14. gününden 21. gününe kadar, her iki kohortta da CBF'de istatistiksel olarak anlamlı (P < 0.0345) bir artış gözlenmiştir. Kültür...
Tartışmalar
Nazal epitel tabakalarında CBF'nin miktarını gizleyebilecek birçok faktör vardır. Epitel tabakaları numune toplandıktan sonraki 3-9 saat içinde görüntülenmelidir, çünkü siliyer fonksiyon bu süre zarfında en stabildir37. Daha az kırmızı kan hücresi ve döküntü, görüntüleme için en uygun olanıdır, çünkü bunlar veri toplamaya müdahale eder. Görüntüleme için bir ROI seçerken, numunenin toplanması sırasında kenarın hasar görmediği veya bozulmadığı ve tek b...
Açıklamalar
Yazarlar açıklayacak hiçbir şeyleri olmadığını beyan ederler.
Teşekkürler
Araştırmaya katılanlara ve ailelerine katkılarından dolayı teşekkür ederiz. Sydney Çocuk Hastaneleri (SCH) Randwick solunum departmanının hasta biyoörneklerinin organizasyonu ve toplanmasındaki yardımını takdir ediyoruz - Dr. John Widger, Dr. Yvonne Belessis, Leanne Plush, Amanda Thompson ve Rhonda Bell'e özel teşekkürler. UNSW Sidney'deki Mark Wainwright Analitik Merkezi'ndeki Katharina Gaus Işık Mikroskobu Tesisi'nden Iveta Slapetova ve Renee Whan'ın yardımlarını kabul ediyoruz. Bu çalışma Ulusal Sağlık ve Tıbbi Araştırma Konseyi (NHMRC) Avustralya (GNT1188987), CF Vakfı Avustralya ve Sidney Çocuk Hastanesi Vakfı tarafından desteklenmektedir. Yazarlar, Luminesce Alliance - Çocuk Sağlığı için İnovasyon'a katkısı ve desteği için teşekkür eder. Luminesce Alliance - Innovation for Children's Health, Sydney Çocuk Hastaneleri Ağı, Çocuk Tıbbi Araştırma Enstitüsü ve Çocuk Kanseri Enstitüsü arasında kar amacı gütmeyen bir işbirliği ortak girişimidir. Pediatrik araştırmaları koordine etmek ve entegre etmek için NSW Hükümeti'nin desteğiyle kurulmuştur. Luminesce Alliance ayrıca Sydney Üniversitesi ve New South Wales Sydney Üniversitesi'ne de bağlıdır. KMA, Avustralya Hükümeti Araştırma Eğitim Programı Bursu ile desteklenmektedir. LKF, Sydney Cove Rotary Kulübü/Sydney Çocuk Hastanesi Vakfı ve UNSW Üniversitesi lisansüstü ödül bursları tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
Referanslar
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O'Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O'Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır