Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Сбор, расширение и дифференциация первичных моделей эпителиальных клеток носа человека для количественной оценки частоты биения ресничек
В этой статье
Резюме
Этот протокол описывает сбор, расширение и дифференцировку эпителиальных клеток носа в органотипические модели эпителиальных клеток дыхательных путей и количественную оценку частоты биения ресничек с помощью визуализации живых клеток и специально разработанных сценариев.
Аннотация
Измерения функции ресничек (частота ударов, рисунок) были установлены в качестве диагностических инструментов для респираторных заболеваний, таких как первичная цилиарная дискинезия. Однако более широкое применение этих методов ограничено крайней восприимчивостью цилиарной функции к изменениям факторов окружающей среды, таких как температура, влажность и рН. В дыхательных путях пациентов с муковисцидозом (МВ) накопление слизи препятствует биению ресничек. Функция ресничек была исследована в моделях первичных клеток дыхательных путей в качестве индикатора активности канала трансмембранного регулятора проводимости CF (CFTR). Тем не менее, значительная вариабельность частоты биения ресничек была обнаружена в ответ на препараты, модулирующие CFTR, даже для пациентов с теми же мутациями CFTR . Кроме того, влияние дисфункциональной секреции хлоридов, регулируемой CFTR, на цилиарную функцию плохо изучено. В настоящее время не существует всеобъемлющего протокола, демонстрирующего пробоподготовку моделей дыхательных путей in vitro , получение изображений и анализ частоты биения ресничек (CBF). Стандартизированные условия культивирования и получение изображений, выполняемые в экологически контролируемых условиях, позволят обеспечить последовательную, воспроизводимую количественную оценку CBF между отдельными лицами и в ответ на препараты, модулирующие CFTR. Этот протокол описывает количественную оценку CBF в трех различных системах моделей эпителиальных клеток дыхательных путей: 1) нативные эпителиальные листы, 2) модели интерфейса воздух-жидкость, изображенные на проницаемых опорных вставках, и 3) внеклеточные матрикс-встроенные трехмерные органоиды. Последние два воспроизводят физиологию легких in vivo , с биением ресничек и выработкой слизи. Цилиарная функция захватывается с помощью высокоскоростной видеокамеры в камере, контролируемой окружающей средой. Для анализа CBF используются пользовательские скрипты. Предполагается, что перевод измерений CBF в клинику станет важным клиническим инструментом для прогнозирования ответа на CFTR-модулирующие препараты на основе каждого пациента.
Введение
Измерения частоты биения ресничек (CBF) и паттерна были установлены в качестве диагностических инструментов для респираторных заболеваний, таких как первичная цилиарная дискинезия (PCD)1. При муковисцидозе (МВ) дисфункция хлоридного канала регулятора трансмембранной проводимости CF (CFTR) вызывает обезвоживание жидкости поверхности дыхательных путей и нарушение мукоцилиарного клиренса2. Цилиарная функция была исследована in vitro в моделях первичных клеток дыхательных путей в качестве индикатора активности канала CFTR3. Тем не менее, значительная вариабельность между пациентами существует в CBF в ответ на ПРЕПАРАТЫ, модулирующие CFTR, даже для пациентов с теми же мутациями CFTR 3. Кроме того, влияние дисфункциональной секреции хлоридов, регулируемой CFTR, на цилиарную функцию плохо изучено. В настоящее время не существует всеобъемлющего протокола, демонстрирующего выборочную подготовку моделей дыхательных путей in vitro , получение изображений и анализ CBF.
Эпителиальные листы носа, выделенные из расчесок слизистой оболочки носа, непосредственно используются для измерения цилиарной функции для диагностики ПХД4. Тем не менее, хотя нет никакого контроля над размером или качеством полученных листов эпителия носа, CBF варьируется в зависимости от того, измеряется ли он на отдельных клетках или листах клеток и на реснитчатых краях эпителиального листа, которые нарушены или не повреждены5. Таким образом, вторичные дискинезии, вызванные повреждением клеток во время сбора расчесывания слизистой оболочки носа, могут влиять на CBF. Первичная клеточная культура эпителиальных клеток носа и их дифференцировка на воздушно-жидкой границе (ALI) или в трехмерном базальном мембранном матриксе в реснитчатые эпителиальные органоиды дыхательных путей дают начало ресничкам, свободным от вторичных дискинезий 4,6,7,8. Эпителиальные клетки дыхательных путей, дифференцированные в ALI (далее называемые моделями ALI), считаются важным вторичным диагностическим средством, которое воспроизводит паттерны цилиарного биения и частоту расчесывания слизистой оболочки ex vivo носа 6 и позволяет анализировать цилиарную ультраструктуру, паттерн биения и частоту ударов при сохранении специфических для пациента дефектов9 . Тем не менее, существуют расхождения в методологиях, используемых для создания этих псевдостратифицированных, мукоцилиарных дифференцированных моделей клеток. Различные протоколы расширения культуры или дифференцировки могут индуцировать различные эпителиальные фенотипы (реснитчатые или секреторные)10 и приводить к значительным различиям в CBF11. CBF был количественно определен в эпителиальных щеткахноса 4,6,12,13,14,15,16, эпителиальных органоидах дыхательных путей 14,17,18 и моделях ALI 3,4,6,13,19,20, 21. Тем не менее, среди этих протоколов есть большие вариации, и часто многие параметры не контролируются. Например, в некоторых исследованиях CBF визуализируется in situ, в то время как ячейки модели ALI остаются на проницаемой опорной вставке 3,19,20,21, в то время как другие соскребают ячейки с проницаемой опорной вставки и изображают их суспендированными в среде 4,6,13.
Кроме того, более широкое применение методов, измеряющих цилиарную функцию, ограничено крайней восприимчивостью цилиарной функции к изменениям факторов окружающей среды. Факторы окружающей среды, такие как температура22, влажность23,24 и pH25,26, влияют на цилиарную функцию и должны регулироваться для точной количественной оценки CBF. Различные физиологические параметры, используемые в разных лабораториях, и то, как они влияют на CBF, были рассмотрены ранее27.
В литературе сообщается о различных технологиях визуализации и подходах к измерениям CBF. Для диагностики ПХД используется видеомикроскопия для измерения цилиарной функции28,29. Недавно алгоритм видеоанализа, основанный на дифференциальной динамической микроскопии, был использован для количественной оценки как CBF, так и координации ресничек в моделях ALI эпителиальных клеток дыхательных путей 3,30. Этот метод позволяет охарактеризовать цилиарное биение в эпителиальных клетках дыхательных путей быстрым и полностью автоматизированным способом, без необходимости сегментирования или выделения областей. Различные методы визуализации и количественной оценки CBF могут добавить к различиям, о которых сообщается в CBF в литературе (Дополнительный файл 1).
Протокол от культуры к количественной оценке для оптимизации существующих методов, стандартизации условий культивирования и получения изображений, выполняемый в строгих экологически контролируемых условиях, позволил бы обеспечить последовательную, воспроизводимую количественную оценку НБВ внутри и между людьми.
Этот протокол предоставляет полное описание коллекции эпителиальных клеток, условий культуры расширения и дифференцировки, а также количественной оценки CBF в трех различных системах моделей эпителиальных клеток дыхательных путей носового происхождения: 1) нативные эпителиальные листы, 2) модели ALI, изображенные на проницаемых опорных вставках и 3) внеклеточные матрицы (ECM) - встроенные трехмерные органоиды (рисунок 1) ). Эпителиальные клетки носа, полученные из носовых нижних носовых расчесок, используются в качестве представителей эпителия дыхательных путей, поскольку они являются эффективным суррогатом эпителиальных клетокбронхов 31 при преодолении инвазивной процедуры, связанной со сбором бронхиальных расчесок. Метод условного перепрограммирования клеток (CRC) используется для расширения эпителиальных клеток первичных дыхательных путей для создания моделей ALI и трехмерных органоидов. Условное перепрограммирование эпителиальных клеток дыхательных путей в состояние, подобное стволовым клеткам, индуцируется кокультурой с остановленной ростом фидерной клеточной системой фибробластов и ингибитором Rho-ассоциированной киназы (ROCK)32. Важно отметить, что метод CRC увеличивает удвоение популяции в эпителиальных клетках дыхательных путей, сохраняя при этом их тканеспецифический потенциал дифференцировки33,34. Во всех моделях эпителиальных клеток дыхательных путей цилиарная функция захватывается в камере с контролируемой температурой с помощью высокоскоростной видеокамеры со стандартизированными настройками получения изображения. Для количественной оценки CBF используются пользовательские скрипты.

Рисунок 1: Схема рабочего процесса. После расчесывания нижней части носа участников, эпителиальные клетки дыхательных путей используются одним из двух способов. Либо эпителиальные листы дыхательных путей изолированы, и частота биения ресничек визуализируется немедленно, либо эпителиальные клетки дыхательных путей расширяются с помощью метода условного перепрограммирования клеток. CRC-расширенные эпителиальные клетки дыхательных путей дифференцируются для создания эпителиальных клеток дыхательных путей на воздушно-жидком интерфейсе или эпителиальных органоидных культурах дыхательных путей. Визуализация частоты цилиарного биения получена с помощью микроскопа визуализации живых клеток с камерой нагрева и влажности окружающей среды и научной камерой с высокой частотой кадров (>100 Гц). Анализ данных выполняется с помощью пользовательских скриптов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Одобрение исследования было получено от Совета по обзору этики сети детских больниц Сиднея (HREC/16/SCHN/120). Письменное согласие было получено от всех участников (или опекуна участников) до сбора биообразцов.
1. Подготовка к созданию моделей эпителиальных клеток дыхательных путей
- Подготовьте носовые клетки, объединив 80% модифицированной орлиной среды Dulbecco и 20% фетальной бычьей сыворотки. Добавка с 1 мкл / мл пенициллина / стрептомицина. Хранить при температуре 4 °C до 3 месяцев.
- Покройте колбы или проницаемые опорные вставки раствором коллагена по мере необходимости, следуя шагам 1.2.1-1.2.4. Не храните сосуды, покрытые коллагеном, длительно.
- Сделайте разбавление 1:100 раствора коллагена типа I (3 мг/мл) фосфатно-буферным физиологическим раствором (PBS) до конечной концентрации 0,03 мг/мл. Хорошо перемешать.
- Покрыть колбы для культивирования клеток (секция 4) 160 мкл/см2 (т.е. 4 мл на колбу T25) и проницаемые опорные вставки (секция 5) 455 мкл/см2 (т.е. 150 мкл на вставку 6,5 мм) подготовленного раствора коллагена.
- Инкубировать при 37 °C в течение 2-24 ч.
- Удалите раствор коллагена пипеткой или вакуумным аспиратором перед посевом клеток. Не промывайте сосуд перед посевом клеток.
- Подготовьте носитель ячейки условного перепрограммирования (CRC), объединив компоненты32 , перечисленные в таблице 1. Фильтр стерилизуют с помощью системы вакуумных фильтров с бутылочной крышкой. Хранить при температуре 4 °C до 2 месяцев.
- В день применения добавляют эпидермальный фактор роста человека, ингибитор ROCK и антибиотики, как указано в таблице 1.
| Компонент | Том |
| DMEM, высокий уровень глюкозы | 156.7 мл |
| ДМЭМ/Ф-12, ХЕПЕС | 313.3 мл |
| Гидрокортизон | 55.6 мкл |
| Инсулин | 1.25 мл |
| Холерический токсин | 21 мкл |
| Аденин | 1,2 мл |
| HI-FBS | 25 мл |
| Пенициллин-Стрептомицин | 5 мл |
| Фактор роста эпидермиса человека | 1 мкл/мл |
| Ингибитор ROCK | 1 мкл/мл |
| Фунгизон | 2 мкл/мл |
| Тобрамицин | 2 мкл/мл |
| Цефтазидим гидрат | 4 мкл/мл |
| Гентамицин раствор | 1 мкл/мл |
Таблица 1: Компоненты для 500 мл условных клеточных сред перепрограммирования
2. Коллекция носовых нижних носовых расчесок
ПРИМЕЧАНИЕ: Для этого раздела протокола требуется сборная трубка (50 мл) со средой для сбора носовых клеток, цитологическими щетками, тканями и соответствующими средствами индивидуальной защиты. Избегайте чистки зубов во время инфекции верхних дыхательных путей. Существует небольшой риск кровотечения, который увеличивается, если присутствует воспаление. Если целью чистки зубов является получение эпителиальных листов дыхательных путей для измерений EX VIVO CBF, чистка щеткой должна происходить как минимум через 6 недель после любой инфекции верхних дыхательных путей; в идеале, более 10 недель после заражения35.
- Подготовьте носовые ячейки для сбора (раздел 1) и держите трубку на льду.
- Опишите процедуру участнику как неудобную. Объясните, что во время расчесывания ощущается полное ощущение в ноздре, похожее на прыжок в океан/бассейн и воду, устремляющуюся в носовой проход. Сообщите участникам, что процедура вызовет выработку слез в качестве рефлекса.
- Оцените, какое позиционирование подходит для участника. Уложите участника в лежачее положение, если доступна кушетка для осмотра, так как лежачее положение предотвращает движение головы участника от кисти во время процедуры. Кроме того, сядьте участника рядом со стеной, к которой он может прижать голову спиной.
- Осмотрите носовой ход. Обратите внимание на смещение перегородки, полипы и любые другие анатомические аномалии, которые могут повлиять на прохождение кисти в носовом проходе и увеличить риск кровотечения.
- Очистите нос от избытка слизи, попросив участников сморкаться в ткань.
- Попросите участника дышать ртом. Возьмите цитологическую кисть в доминирующую руку. Положив пятую цифру на подбородок участника, чтобы закрепить руку, вставьте цитологическую кисть в носовой проход участника (рисунок 2). Вставьте кисть под ~45° к лицу участника, чтобы пройти через носовой меатус.
- Поверните кисть вертикально так, чтобы она была перпендикулярна лицу участника. Осторожно, но твердо прижмите кисти боковую стенку носа под нижней носовой раковиной, пока она не окажется в средней и задней части нижней носовой раковины.
ПРИМЕЧАНИЕ: Избегайте чрезмерного включения; если ощущается внезапное падение сопротивления, носовая глотка введена, и щетку следует втянуть до тех пор, пока процедурист снова не почувствует сопротивление. - Поверните кисть на 360° до трех раз. Аккуратно снимите кисть в обратном порядке, чтобы клетки не смещались с кисти.
- Поместите кисть в подготовленную коллекционную трубку со средой для сбора носовых клеток. Поместите сборную трубку на лед.
- Повторите расчесывание во второй ноздре, если участник симпатичен/требуется большое количество клеток (например, для инициирования культивирования клеток).
ПРИМЕЧАНИЕ: Ту же ноздрю можно снова расчесать, если на щетке не было видимых клеток крови, отмечая, однако, что риск кровотечения немного увеличивается при повторном расчесывании в той же ноздре.
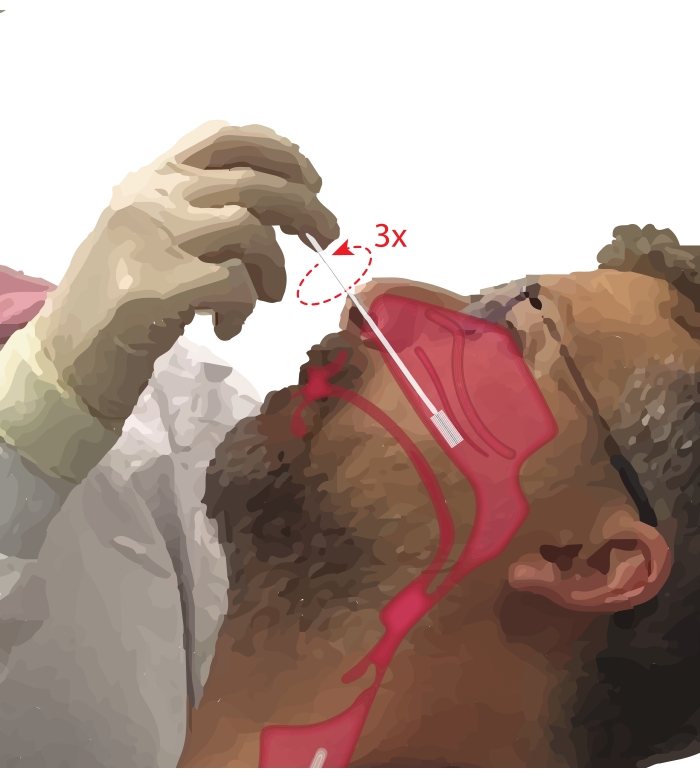
Рисунок 2: Коллекция эпителиальных клеток носа. Иллюстрация расположения цитологической кисти в средней и задней части нижней носовой раковины. Это положение достигается путем введения щетки через нары, поворота щетки под углом 90° к лицу и направления кисти вдоль носового прохода ниже нижней носовой раковины. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Подготовка эпителиальных листов дыхательных путей
ПРИМЕЧАНИЕ: Для этого раздела протокола требуется сборная трубка (цитологическая кисть (щетки) + 1 мл среды для сбора носовых клеток) (секция 2) и 96-луночная плоскодонная пластина. При сборе носовых носовых носовых щеток с целью визуализации эпителиальных листов дыхательных путей используйте только 1 мл среды для сбора носовых клеток без антибиотиков; в противном случае эпителиальные листы будут слишком рассредоточены для визуализации.
- Аккуратно закрутите трубку для сбора, содержащую цитологическую кисть (кисти), чтобы выбить эпителиальные листы дыхательных путей из кисти (кистей).
- Соберите все носители и ячейки с помощью пипетки P1000. Дозируйте 5-6 капель в лунку из 96-луночной плоскодонной пластины. Повторите примерно для семи скважин.
- Перенесите пластину на микроскоп в соответствии с шагом 7.1.4 и следуйте оставшейся части раздела 7, чтобы получить изображение частоты биения ресничек.
- Изображение эпителиальных листов (фиг.1), а не отдельных неприкрепленных клеток, поскольку было продемонстрировано, что цилиарная функция отличается между эпителиальными листами и одиночными неприкрепленными клетками5.
4. Расширение и поддержание эпителиальных клеток дыхательных путей
- Условное перепрограммирование эпителиальных дыхательных путей культуры расширения клеток
ПРИМЕЧАНИЕ: Коллагеновый раствор, покрытый сосудом (секция 1), облученные эмбриональные питательные клетки мыши (NIH-3T3), среда условного перепрограммирования клеток (CRC) (секция 1), цитологическая кисть (щетки) в средах сбора носовых клеток (секция 2).- Пластинчатое облучение питательных клеток в приготовленный коллагеновый раствор, покрытый культуральным сосудом (сосудами), при плотности посева 8000 клеток/см2 по меньшей мере за 2 ч и не более чем за 72 ч до совместной культивирования с эпителиальными клетками дыхательных путей (см.36 для культуры питательных клеток и облучения).
- Перенесите матовые клетки в коллекционной трубке (цитологические кисти (кисти) + среда сбора носовых клеток) в вихрь на льду. На низкой скорости вихревая трубка 10 с включена, выключена в 10 с (держитесь на льду между ними), чтобы выбить клетки из кисти (кистей). Энергичное вихрь может снизить жизнеспособность клеток. Осмотрите щетку (щетки), чтобы проверить, прилипает ли слизь. Если это так, повторите вихрь.
- Переложите трубку (трубки) на льду обратно в шкаф биобезопасности. Используйте серологическую пипетку для переноса среды из коллекционной трубки в новую трубку (трубку B), оставляя после себя цитологические щетки. Центрифужная трубка B при 300 × г в течение 7 мин при 4 °C.
- Снимите трубку В с центрифуги, выбросьте супернатант. Если слизь видна, промыть гранулу еще 5 мл среды сбора носовых клеток и снова центрифугировать.
- Добавьте 1 мл среды CRC для повторного суспендирования клеточной гранулы в трубке B. Используя серологическую пипетку 5 мл, пропустите клетки через клеточное сито, помещенное поверх трубки 50 мл (трубка C) круговыми движениями.
- Повторите несколько раз, чтобы сформировать одноклеточную суспензию. Соберите остаточную среду со дна сита и соедините ее со средой. Выкиньте клеточное сито.
- Используя серологическую пипетку объемом 5 мл, возьмите 1 мл среды из трубки С и перенесите ее в микроцентрифужную трубку.
- Возьмите 10 мкл этой клеточной суспензии и добавьте ее в микроцентрифужную трубку, предварительно аликвотированную с 10 мкл трипан-синего цвета. Хорошо перемешайте и немедленно используйте автоматический счетчик клеток для записи количества и жизнеспособности клеток.
- Засейте эпителиальные клетки дыхательных путей в колбу T25, предварительно засеянную облученными фидерными клетками.
- Поддержание и диссоциация эпителиальных клеток дыхательных путей
ПРИМЕЧАНИЕ: CRC-среда должна быть нагрета до 37 °C путем помещения ее на лабораторную водяную баню с контролируемой температурой или устройство для бисерной ванны перед добавлением в ячейки.- Регулярно проверяйте клетки под микроскопом клеточной культуры (4× объективе) на предмет прикрепления, загрязнения, морфологии и слияния.
- Меняйте СМИ CRC каждый второй день. Когда наблюдаются перепрограммированные клетки (рисунок 1) и отсутствует загрязнение, уменьшают или отменяют антибиотики.
- Когда клетки достигают 90% конфюлюзии, используйте метод32 двойного трипсина для диссоциации клеток и выполнения подсчета клеток, как описано в шаге 4.1.8 (см. Дополнительный файл 2 для диссоциации и замораживания клеток).
5. Посев и дифференцировка эпителиальных клеток дыхательных путей и поддержание дифференцированных моделей ALI
- Посев эпителиальных клеток дыхательных путей в проницаемые опорные вставки
- Перенесите проницаемые опорные вставки с коллагеновым раствором (секция 1) из инкубатора CO2 в шкаф биобезопасности. Аспирировать раствор коллагена и выбросить. Добавьте 750 мкл расширительной среды (без антибиотиков) в базальный отсек проницаемых опорных вставок.
- Перенесите диссоциированные клетки или размороженные клетки на льду в кабинет биобезопасности. Добавьте объем расширительной среды, необходимый для засева 200 000-250 000 клеток в 150 мкл в апикальный отсек каждой проницаемой опорной вставки.
- Быть осторожным, чтобы не создавать пузырьки; хорошо перемешать, чтобы убедиться, что клетки однородны и находятся во взвешенном состоянии. Добавьте 150 мкл клеточной суспензии к верхушечной стороне каждой проницаемой опорной вставки.
- Повторное суспендирование клеток после посева каждых трех проницаемых опорных вставок для поддержания однородной клеточной суспензии.
- Каждый второй день до образования монослоя сливающейся ячейки (обычно к 4-му дню после посева) выбрасывают среду и добавляют свежую расширительную среду, нагретую до комнатной температуры (RT, 15-25 °C).
- Дифференцировка эпителиальных клеток дыхательных путей на границе раздела воздух-жидкость
- Теплые среды ALI (без антибиотиков) до RT (15-25 °C).
- Удалите расширительную среду и перейдите на дифференцировочную среду (ALI) как на апикальном, так и на базальном отсеках.
- После 2 дней культивирования в затопленных носителях ALI, аспирируйте и выбрасывайте носители.
- Добавьте 750 мкл среды ALI в базальный отсек только для создания воздушно-жидкостного интерфейса.
ПРИМЕЧАНИЕ: Если после 1 недели культивирования монослой не сливается и отверстия все еще наблюдаются, клетки могут больше не иметь способности расширяться в области пустоты, рассмотрите возможность удаления эпителиальных клеток дыхательных путей.
- Поддержание дифференцированной модели ALI и удаление слизи
- Изменять апикальные и базальные среды каждые два дня до полной дифференциации (день 21-25 после установления воздушно-жидкостной границы).
- Один раз в неделю смывайте слизь с апикальной стороны, следуя шагам 5.3.3-5.3.4.
- Теплый PBS до RT (15-25 °C).
- Добавьте 200 мкл PBS в апикальный отсек. Инкубировать в инкубаторе CO2 в течение 10 мин. Используйте аспирационное устройство или пипетку для удаления PBS.
6. Трехмерные органоиды эпителия дыхательных путей
- Препараты для эпителиальной органоидной культуры дыхательных путей
- Поместите 24-луночную пластину (плиты) в инкубатор CO2 для нагрева до 37 °C в течение ночи.
- Разморозьте флакон ECM (Таблица материалов) объемом 10 мл на льду в соответствии с инструкциями производителя. Подготовьте 500 мкл аликвот (одноразовое использование), чтобы свести к минимуму количество циклов замораживания-оттаивания.
ПРИМЕЧАНИЕ: Рекомендуется использовать ECM с концентрацией белка >10,5 мг/мл для достижения наилучших результатов культивирования. Более низкая концентрация ускорит распад купола ECM и увеличит появление апикально-направленных наружу органоидов. - Используйте набор органоидов дыхательных путей (таблица материалов) для приготовления органоидных семенных сред для дыхательных путей (AOSM) и дифференциационных сред (AODM) в соответствии с инструкциями производителя.
- Подготовьте органоидные базальные среды дыхательных путей согласно таблице 2.
| Компонент | Том |
| Усовершенствованный DMEM/F-12 | 500 мл |
| ХЕПЕС | 5 мл |
| Аланил-глутамин | 5 мл |
| Пенициллин-Стрептомицин | 5 мл |
Таблица 2: Компоненты органоидных базальных сред дыхательных путей
- Используйте количество эпителиальных клеток живых дыхательных путей, диссоциированных в разделе 4.2, чтобы рассчитать, сколько лунок может быть засеяно при плотности посева 10 000 клеток (см. Таблицу 3).
- Рассчитайте общий объем ECM и AOSM, необходимый для создания 1 x 50 мкл 90% купола ECM (45 мкл ECM и 5 мкл AOSM) на скважину.
ПРИМЕЧАНИЕ: Рекомендуемая плотность посева 10 000 клеток на лунку предназначена для CRC-расширенных носовых эпителиальных клеток в проходе 1. Более поздние проходные клетки могут потребовать более высокой плотности посева для достижения образования такого же количества органоидов.
| Количество скважин | Количество ячеек | Количество куполов | Том Матригеля ECM | Том АОСМ |
| 1 | 10 000 ячеек | 1 | 45 мкл x 1.1 | 5 мкл x 1,1 |
| 2 | 20 000 ячеек | 2 | 90 мкл x 1.1 | 10 мкл x 1.1 |
| 5 | 50 000 ячеек | 5 | 225 мкл x 1.1 | 25 мкл x 1.1 |
| ......... | ......... Клетки | ......... | .........мкл x 1,1 | .........мкл x 1,1 |
Таблица 3: Расчеты по посеву эпителиальных клеток дыхательных путей в купола ECM
- Посев эпителиальных клеток дыхательных путей в купола ECM
ПРИМЕЧАНИЕ: Держите ECM на льду в любое время и выполняйте все шаги, связанные с ECM на льду, так как ECM начнет затвердевать при температуре >10 ° C.- Повторное суспендирование эпителиальных клеток дыхательных путей диссоциирует в разделе 4.2 с расчетным объемом 90% ECM согласно таблице 3.
- Удерживая пипетку под углом 90° (по вертикали) как можно ближе к дну колодца, дозируйте 50 мкл (до первой остановки, чтобы избежать образования пузырьков) суспензии ячейки ECM к центру лунки. Избегайте прикосновения к стенке колодца.
- Инкубировать пластину при 37 °C в течение 20 мин до затвердевания ECM. В то время как ECM затвердевает, нагревайте AOSM до RT (15-25 ° C), чтобы предотвратить его повторное сжижение и распад купола ECM при добавлении.
- Добавьте 500 мкл подогретого AOSM в каждый колодец, раздав его вниз по стенке. Не наносите пипетку непосредственно на купол ECM.
- Меняйте носитель каждые 2 дня в течение 4-7 дней. Чтобы аспирировать среду, наклоните пластину под углом 45° и аспирируйте от нижнего края колодца подальше от купола ECM.
- Через 4-7 дней инициируют дифференцировку органоидов, добавляя 500 мкл AODM (15-25 °C) в каждую лунку и меняя среду каждые 2 дня в течение 7 дней.
- Покрытие эпителиальных органоидов дыхательных путей на 7-й день дифференцировки
ПРИМЕЧАНИЕ: Повторное покрытие эпителиальных органоидов дыхательных путей необходимо, потому что край куполов ECM постепенно распадается в течение 2-недельного периода культивирования. Эпителиальные органоиды дыхательных путей на краю купола могут быть потеряны (вытеснены в среду) или иметь ориентацию на апикальную сторону, когда они не полностью встроены в ECM. Этап покрытия также «очищает» купол ECM путем удаления клеток / мусора, которые не успешно образуют органоиды.- Аспирируйте СМИ из каждой скважины. Добавьте 500 мкл органоидной базальной среды холодных дыхательных путей (далее называемой базальной средой) в каждую лунку.
- Используйте пипетку P1000, так как этот наконечник пипетки имеет самое большое отверстие и уменьшит вероятность разрыва органоидов во время пипетки. Отрегулируйте пипетку до 350 мкл, чтобы избежать образования пузырьков, затем пипетку вверх и вниз осторожно, чтобы разрушить купол ECM в каждой скважине. Соберите все ECM/базальные среды в центрифужную трубку объемом 15 мл.
- Промыть каждую лунку 500 мкл холодной базальной среды. Соберите базальные среды, содержащие все оставшиеся ECM и органоиды, в ту же 15-литровую центрифужную трубку, что и выше.
- Центрифуга при 300 х г в течение 5 мин при 4 °C. Из трех слоев, видимых после центрифугирования - (1) супернатант, (2) ECM, содержащий клеточный мусор (пушистый) и (3) гранулы, содержащие органоиды, - отбросьте слой супернатанта и ECM и сохраните органоидную гранулу.
- Добавьте 1 мл холодной базальной среды к органоидной грануле и пипетке вверх и вниз осторожно, чтобы отделить оставшуюся ECM. Добавьте в пробирку 6 мл холодной базальной среды и аккуратно перемешайте.
- Центрифуга при 300 × г в течение 5 мин при 4 °С. Выбросьте супернатант.
- Если избыток ECM все еще виден, повторите шаги 6.3.5- 6.3.6, чтобы выполнить еще одну промывку.
- Повторно суспендировать органоидную гранулу с соответствующим объемом 90% ECM (используйте AODM вместо AOSM) до пластины ~ 30 органоидов на 50 мкл купола.
- Проверьте плотность органоидов под микроскопом клеточной культуры (объектив 4x) после покрытия первого купола. Если он слишком плотный, добавьте дополнительно 90% ECM для достижения желаемой плотности ~ 30 органоидов.
- Следуйте шагам 6.2.3- 6.2.4 для затвердевания ECM и подачи клеток каждый второй день с 500 мкл подогретого AODM в каждую лунку в течение еще 14 дней, пока они не достигнут зрелости (после 21 дня дифференцировки) с образованием просвета, окруженного обращенным внутрь псевдостратифицированным эпителием, содержащим базальные клетки, реснитчатые клетки и бокаловидные клетки.
ПРИМЕЧАНИЕ: Эпителиальные органоиды дыхательных путей, описанные здесь, терминально дифференцированы и не могут быть пройдены или криоконсервированы.
7. Визуализация частоты биения ресничек
ПРИМЕЧАНИЕ: Для этого раздела протокола требуется микроскоп визуализации живых клеток с камерой нагрева и влажности окружающей среды, научная камера с высокой частотой кадров (>100 Гц), объектив на большом рабочем расстоянии 20x и программное обеспечение для визуализации (см. Таблицу материалов для рекомендуемого оборудования, используемого в этом протоколе).
- Настройка микроскопа
- Убедитесь, что система нагрева микроскопа включена и уравновешена до 37 °C. Включите микроскоп. Отрегулируйте газ до 5% CO2 с помощью газового смесителя CO2/air.
- Доливайте бутылку модуля влажности, через которую проходит CO2 , очищенной водой. Установите относительную влажность на 85% с помощью верхнего контроллера сцены, чтобы вода нагревалась, а ячейки подавались увлажненным воздухом. Уравновешивайте камеру в течение 30 мин.
- Вставьте пластинку микроскопа в держатель микроскопа.
- Перенос моделей эпителиальных клеток дыхательных путей из инкубатора в микроскоп на тепловом блоке или тепловых шариках, уравновешенных до 37 °C, для поддержания образца при физиологической температуре.
- Поместите культуральную пластину, содержащую модели эпителиальных клеток дыхательных путей, во вставку пластинки микроскопа. Закройте камеру окружающей среды микроскопа.
- Дайте образцу уравновеситься в предварительно нагретой 37 °C, 5% ЗАПОЛНЕННОЙCO2 камере микроскопа в течение 30 минут.
ПРИМЕЧАНИЕ: Может быть достаточно более короткого времени уравновешивания. Это можно определить, выполнив эксперимент по определению времени, необходимого для стабилизации CBF (см. рисунок 3).
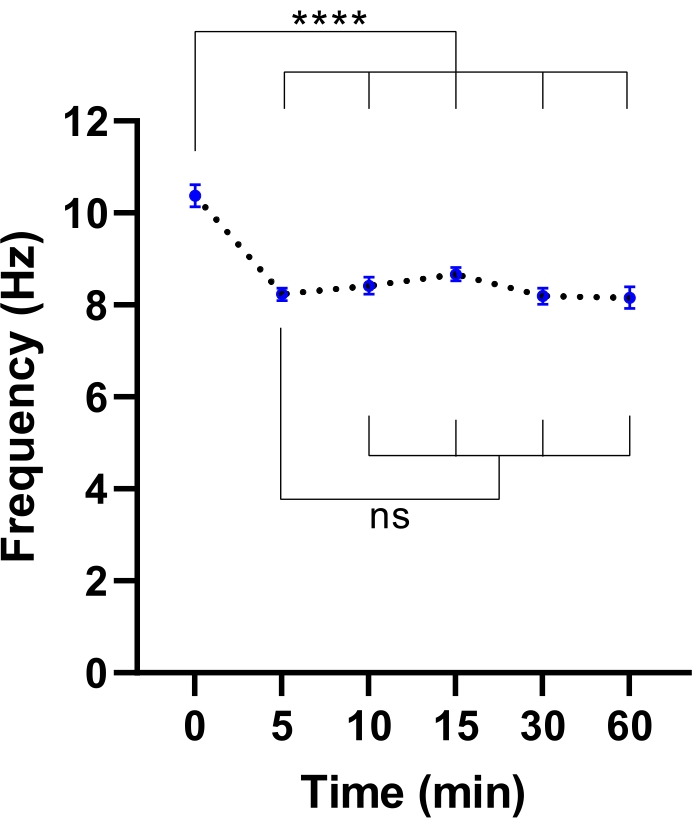
Рисунок 3: Стабилизация частоты цилиарного биения в микроскопе визуализации живых клеток. Точечные графики средней частоты биения ресничек (CBF) в эпителиальных клетках дыхательных путей на границе раздела воздух-жидкость (модели ALI) после переноса в микроскоп визуализации живых клеток с камерой окружающей среды. Камеру уравновешивали и поддерживали при 37 °C, 5% CO2 и относительной влажности 85% в течение 30 мин до открытия дверцы камеры и помещения культуральной пластины во вставку пластины микроскопа. Модели клеток визуализировали в течение 60 мин с указанными интервалами. Модели ALI были получены от двух участников с CF. Шесть изображений поля зрения (FOV) были получены на модель ALI. Каждая точка (синяя) представляет собой средний CBF в 12-36 изображениях FOV. Данные представлены в виде среднего значения ± SEM, при этом среднее значение связано пунктирной линией. Для определения статистических различий использовался односторонний анализ дисперсии (ANOVA). P < 0.0001, ns: не имеет значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Во время периода равновесия за компьютером откройте программное обеспечение для сбора. Выберите объектив с 20-кратным рабочим расстоянием.
- На окуляре микроскопа сосредоточьтесь на модели клетки (~Z = 8000 мкм).
- Убедитесь, что микроскоп настроен на освещение Колером таким образом, чтобы нити лампы пропускающего источника света не фокусировались на плоскости образца, избегая артефактов в визуализации. Для этого выполните шаги 7.1.10-7.1.13
- Полностью закройте поле диафрагмы радужной оболочки над конденсатором. Медленно откройте поле диафрагмы радужной оболочки и перемещайте конденсатор вверх/вниз, пока не появится восьмиугольная форма.
- Если поле диафрагмы радужной оболочки не выровнено (т.е. восьмиугольник не находится в центре поля зрения (FOV)), выровняйте его по центру с помощью клавиш Аллена.
- Как только диафрагма диафрагмы поля выровнена, отрегулируйте фокус конденсатора, чтобы привести восьмиугольник в резкий фокус.
- Откройте поле диафрагмы радужной оболочки до тех пор, пока его больше нельзя будет увидеть в пределах FOV.
- Используя программное обеспечение для сбора данных, нажмите на L100 , чтобы переключить световой путь к порту, в котором установлена камера. Нажмите на зеленую кнопку воспроизведения (Run), чтобы визуализировать FOV микроскопа с помощью программного обеспечения. Убедитесь, что реснички находятся в фокусе и при необходимости отрегулируйте.
- Используя программное обеспечение для сбора, настройте микроскоп со следующими настройками: Фильтры: пустые; Конденсатор: пустой; Формат: без биннинга; Время экспозиции: 0.003 s; Режим считывания: скользящий затвор; ROI: 512 × 512 пикселей.
ПРИМЕЧАНИЕ: Время экспозиции основано на самой высокой частоте, которую необходимо измерить, поскольку 1/время экспозиции должно быть не менее чем в два раза больше этой частоты. Например, если максимальный физиологический диапазон биения ресничек = 30 Гц, то 1/время экспозиции = 60, а время экспозиции должно быть ≤ 0,016 с. ROI зависит от характеристик кадра камеры. Выберите окупаемость инвестиций, которая фиксирует частоту кадров >100 Гц.
- Получение изображений
- Чтобы получить покадровые изображения из меню, нажмите « Получить», а затем нажмите «Быстрый таймлапс». Во всплывающем окне выберите место сохранения и имя файла. Приобретите 1000 кадров.
- Нажмите кнопку Применить. Нажмите на зеленую кнопку воспроизведения (Выполнить), чтобы просмотреть реснички в микроскопе FOV и при необходимости настроить фокус Z. Нажмите кнопку Выполнить сейчас, чтобы запечатлеть быструю покадровую съемку.
- После того, как быстрая покадровая съемка была захвачена, нажмите на зеленую кнопку воспроизведения (Run), чтобы визуализировать FOV микроскопа. С помощью джойстика микроскопа переместитесь вдоль оси X/Y к другому FOV.
- Отрегулируйте фокус Z, чтобы сфокусировать реснички. Нажмите «Выполнить сейчас», чтобы запечатлеть еще одну быструю покадровую съемку.
- Повторите шаги 7.2.3-7.2.4. Для моделей ALI и органоидов дыхательных путей изображение 6x FOV в каждом из 3x реплицированных образцов. Для эпителиальных листов дыхательных путей изображение не менее 4 раз повторяет изображения на участника.
8. Анализ данных и количественная оценка CBF
- Подготовка к анализу данных
ПРИМЕЧАНИЕ: Для этого раздела протокола требуются пользовательские сценарии анализа (дополнительный файл 3), необработанные файлы изображений (полученные в разделе 7.2), вычислительное программное обеспечение и программное обеспечение для анализа.- Установите вычислительное программное обеспечение, предпочтительно последнюю версию, на компьютере анализа. Убедитесь, что установлены стандартные наборы инструментов вычислительного программного обеспечения (elmat, ops, datafun, uitools, datatypes, iofun, iotools, audiovideo) и наборы инструментов обработки изображений и сигналов.
- Скопируйте папку пользовательских сценариев анализа 'BeatingCiliaBatchOMEfiles_JOVE.m' и 'LoadRawDataExportFilteredMovies_JOVE.m' и 'support scripts' на локальный диск компьютера.
- В компьютерном программном обеспечении нажмите на вкладку Главная. Затем нажмите «Задать путь» (рисунок 4A-B).
- Во всплывающем окне нажмите добавить с вложенными папками (рисунок 4C). В разделе 'Путь поиска MATLAB' выберите папки, показанные на рисунке 4D, затем нажмите Save and Close (Figure 4E-F).
- Убедитесь, что скрипты анализа связаны с вычислительным программным обеспечением, проверив, что они отображаются на левой панели (рисунок 4G).
- Перенесите необработанные файлы изображений (формат открытой среды микроскопии (OME)), полученные в разделе 7.2, на локальный диск компьютера.
ПРИМЕЧАНИЕ: Доступ к примерам необработанных файлов изображений можно получить по адресу: https://doi.org/10.6084/m9.figshare.16649878.v1.
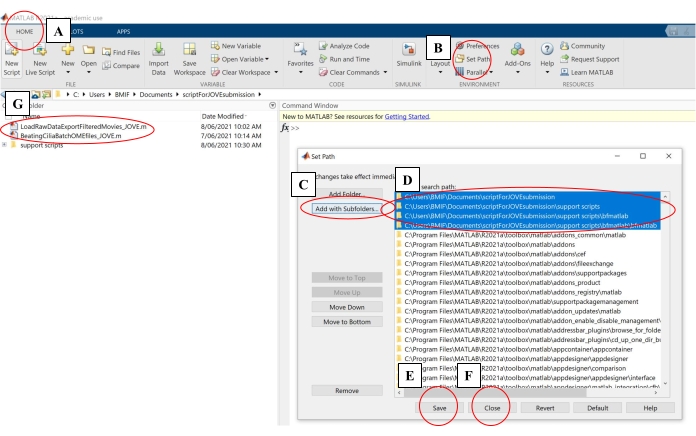
Рисунок 4: Настройка вычислительного программного обеспечения для анализа данных. (A) Откройте вкладку Главная . (B) Выберите Задать путь. (C) Выберите Добавить с вложенными папками. (D) Выберите папки, содержащие сценарии анализа. (E) Выберите Сохранить. (F) Выберите Закрыть. (G) Сценарии анализа появятся на левой панели. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Количественная оценка CBF по пиковому детектированию спектра интенсивности одиночных пикселей
- Откройте вычислительное программное обеспечение. Нажмите на файл скрипта анализа 'BeatingCiliaBatchOMEfiles_JOVE.m' (рисунок 5A).
- Перейдите на вкладку Редактор, а затем нажмите на зеленую кнопку воспроизведения (Run), чтобы запустить скрипт (рисунок 5B-C). В окне приглашения выберите файлы необработанных изображений для анализа (рисунок 5D).
- Введите время экспозиции из шага 7.1.15 в окно подсказки для времени получения за кадр, затем нажмите OK (рисунок 5E).
- Подождите ~ 15 минут на файл, пока скрипт вычисляет и выводит CBF в файл 'AveSpectrum' (Дополнительный файл 4), который автоматически сохраняется в той же папке, что и файлы необработанных изображений. Визуализируйте ход выполнения с помощью индикатора выполнения (рисунок 5F).
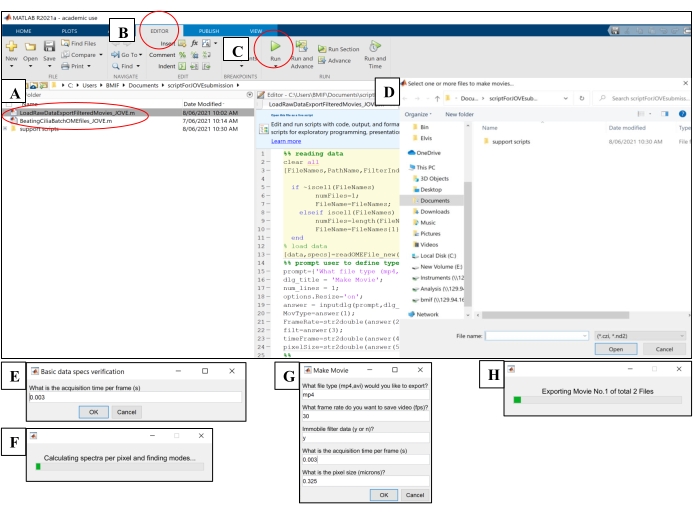
Рисунок 5: Запуск скриптов анализа с использованием вычислительного программного обеспечения. (A) Откройте скрипт для анализа CBF ('BeatingCiliaBatchOMEfiles_JOVE.m') или создания фильма о ресничках ('LoadRawDataExportFilteredMovies_JOVE.m'). (B) Откройте вкладку Редактор . (C) Нажмите зеленую кнопку воспроизведения (Выполнить), чтобы запустить сценарий анализа. (D) Окно подсказки потребует выбора файлов для анализа или создания фильма. (E) При выполнении сценария 'BeatingCiliaBatchOMEfiles_JOVE.m' появится запрос на ручной ввод времени получения на кадр (кадры) в случае, если сценарий чтения файла не считывает метаданные должным образом. (F) Индикатор выполнения, указывающий на вычисляемую частоту биения ресничек. (G) При запуске сценария «LoadRawDataExportFilteredMovies_JOVE.m» появится запрос на ручной ввод типа выводимого фильма (mp4 или avi), частоты кадров фильма (fps), удаления неподвижного компонента из данных фильма («y» или «n»), времени кадра (ов) и размера пикселя (микрон) данных, экспортируемых в фильм. Рекомендуется использовать «y» для неподвижной фильтрации, так как это удалит слизь или любые другие препятствующие неподвижные слои в данных. (H) Индикатор выполнения для индикации экспортируемого фильма. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Запустите сценарий 'GetFirstAmplitude.m' в папке, содержащей файлы 'AveSpectrum', используя процесс, описанный в шагах 8.2.1-8.2.2. Подождите, пока сценарий выведет файл «FirstAmplitudeStacked.xlsx», который содержит частоту, имеющую наибольшую амплитуду и находящуюся в физиологическом диапазоне биения ресничек эпителия дыхательных путей, ≥3 и <30 Гц.
- Скопируйте значения частоты из файла 'FirstAmplitudeStacked.xlsx' и постройте график с помощью программного обеспечения для научного анализа.
ПРИМЕЧАНИЕ: Объяснение того, как пользовательский скрипт анализа количественно оценивает CBF, приведено в дополнительном файле 5. Доступ к примерам проанализированных наборов данных можно получить по адресу: https://doi.org/10.6084/m9.figshare.16649815.
- Экспорт видео избиения ресничек
- Откройте вычислительное программное обеспечение. Нажмите на файл сценария 'LoadRawDataExportFilteredMovies_JOVE.m' (рисунок 5A), чтобы загрузить скрипт.
- Перейдите на вкладку Редактор , а затем нажмите на зеленую кнопку воспроизведения (Run), чтобы запустить скрипт (рисунок 5C). В окне приглашения выберите необработанные файлы изображений для экспорта в файлы фильмов (рисунок 5D).
- Введите настройки, описанные в таблице 4 , во всплывающее окно 'Make Movie' (рисунок 5G).
- Подождите ~ 8 минут на файл, пока сценарий создает файлы фильма и выводит их в расположение необработанных файлов изображений. Визуализируйте ход выполнения с помощью индикатора выполнения (рисунок 5H).
| Входы для фильмов | Приметы:__________ |
| Тип файла | Введите тип файла, который вы хотите экспортировать (mp4 или avi). |
| Частота кадров | Введите частоту кадров, с которой должен быть экспортирован фильм. Если у вас есть ~1000 кадров на полученный временной ряд, рекомендуется установить частоту кадров ~30 кадров в секунду. |
| Неподвижная фильтрация | Вариантами являются 'y' или 'n'. По умолчанию используется значение 'y', и сценарий фильтрации времени удаляет, используя пространство Фурье, любые неподвижные компоненты из данных фильма. Как правило, любые слои клеток под ресничками или неподвижной слизью будут вносить компонент смещения нулевой частоты или инвариантный компонент времени в сигнал, который может быть отфильтрован. |
| Время получения на кадр | Время сбора на кадр полученных данных. Он используется для отображения отметки времени в фильме в секундах. |
| Размер пикселя | Размер пикселя в микрометрах используется для отображения шкалы в фильме в микрометрах. |
Таблица 4: Настройки ввода для создания фильмов
Результаты
Чтобы продемонстрировать эффективность этого протокола в количественной оценке CBF, представлены результаты CBF, измеренные в моделях ALI эпителиальных клеток дыхательных путей, полученных от трех участников с муковисцидозом и трех здоровых контрольных участников. На 14-й день дифференци...
Обсуждение
Существует множество факторов, которые могут скрыть количественную оценку CBF в листах эпителия носа. Эпителиальные листы должны быть изображены в течение 3-9 часов после сбора проб, так как цилиарная функция наиболее стабильна в течение этого времени37. Меньшее количество к?...
Раскрытие информации
Авторы заявляют, что им нечего раскрывать.
Благодарности
Мы благодарим участников исследования и их семьи за их вклад. Мы ценим помощь сиднейской детской больницы (SCH) Randwick в организации и сборе биообразцов пациентов - особая благодарность доктору Джону Видгеру, доктору Ивонн Белессис, Линн Плюш, Аманде Томпсон и Ронде Белл. Мы признаем помощь Иветы Слапетовой и Рене Ван из Центра световой микроскопии Катарины Гаус в Аналитическом центре Марка Уэйнрайта в UNSW Sydney. Эта работа поддерживается Национальным советом по здравоохранению и медицинским исследованиям (NHMRC) Австралии (GNT1188987), Cf Foundation Australia и Sydney Children's Hospital Foundation. Авторы хотели бы поблагодарить Luminesce Alliance - Innovation for Children's Health за его вклад и поддержку. Luminesce Alliance - Innovation for Children's Health является некоммерческим совместным предприятием между Сетью детских больниц Сиднея, Детским медицинским научно-исследовательским институтом и Детским институтом рака. Он был создан при поддержке правительства Нового Южного Уэльса для координации и интеграции педиатрических исследований. Luminesce Alliance также связан с Сиднейским университетом и Университетом Нового Южного Уэльса в Сиднее. KMA поддерживается стипендией Австралийской правительственной исследовательской учебной программы. LKF поддерживается Ротари клубом Сиднейской бухты / Фондом детской больницы Сиднея и стипендиями для аспирантов Университета UNSW.
Материалы
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
Ссылки
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O'Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O'Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены